Том 70, № 1 (2025)
- Год: 2025
- Выпуск опубликован: 12.03.2025
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/138
Весь выпуск
ОБЗОРЫ
Острые респираторные вирусные инфекции у обезьян
Аннотация
Острые респираторные вирусные инфекции (ОРВИ) являются одной из наиболее серьезных проблем, влияющих на разведение обезьян, особенно среди импортированных и содержащихся в неволе приматов. Респираторные заболевания также являются значимой причиной заболеваемости и смертности в диких популяциях, большинство этих инфекций также могут поражать и людей. Многие виды обезьян, включая антропоидов, восприимчивы к ОРВИ. Вспышки спонтанных респираторных инфекций описаны во многих зоопарках и приматологических центрах мира. Вместе с тем изучение спонтанной и экспериментальной инфекции у лабораторных приматов представляет собой бесценный источник информации о биологии и патогенезе ОРВИ и по-прежнему является незаменимым инструментом для тестирования вакцин и лекарственных препаратов. Целью данного обзора литературы являлось обобщение и анализ опубликованных данных о циркуляции ОРВИ (вирусы парагриппа, аденовирусы, респираторно-синцитиальный вирус, вирусы гриппа, риновирусы, коронавирусы, метапневмовирусы, бокавирусы) среди диких и содержащихся в неволе приматов, а также результатов экспериментов по моделированию этих инфекций на обезьянах.
 7-24
7-24


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
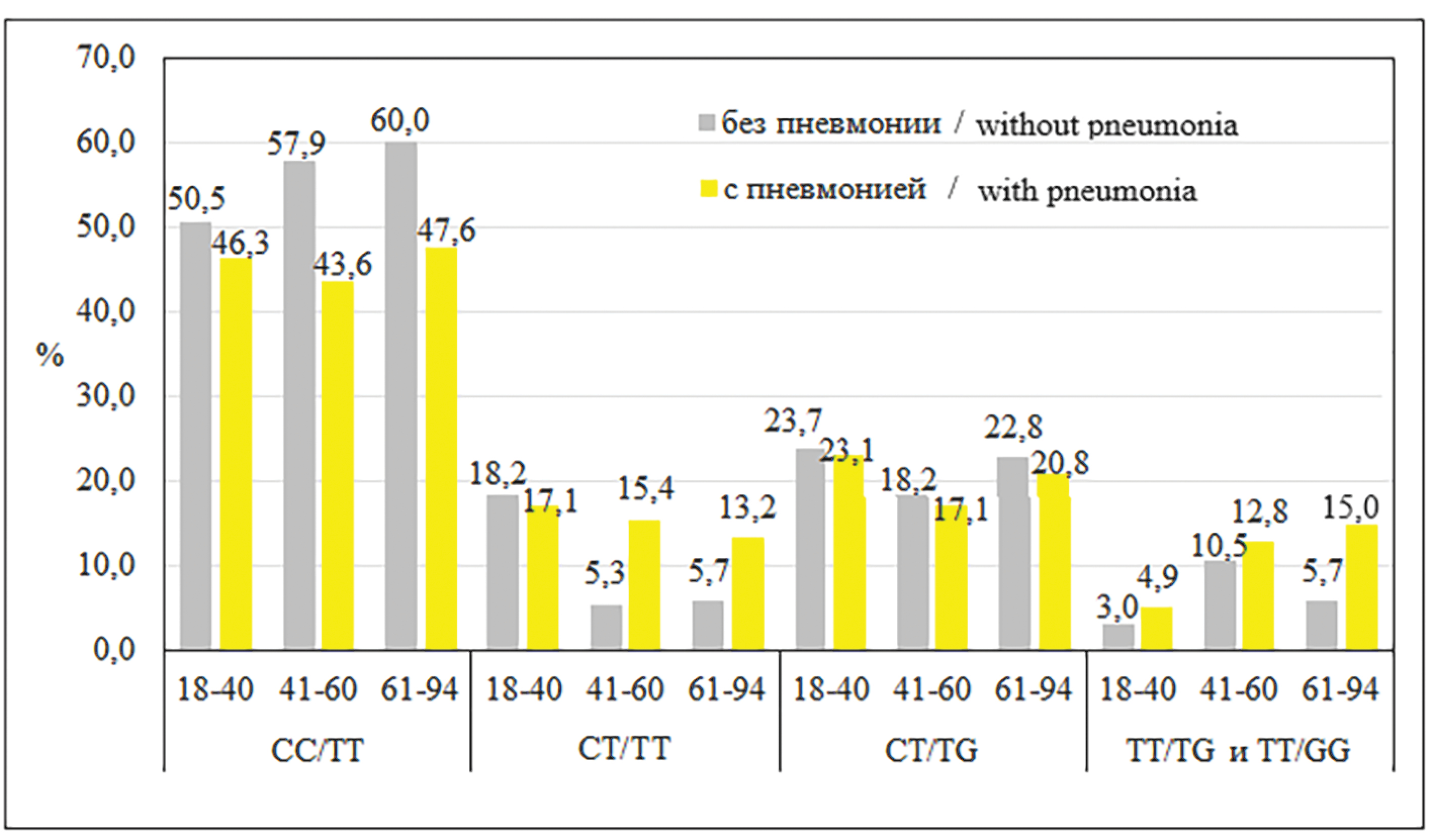
Анализ ассоциации клинического течения гриппа с однонуклеотидным полиморфизмом генов, влияющих на продукцию интерферона-λ3
Аннотация
Введение. Предрасположенность к разному течению инфекционного процесса во многом связана с полиморфизмом генома человека, особенно генов, кодирующих белки иммунной системы. На ранних этапах гриппозной инфекции существенную роль в ограничении репликации вируса выполняют компоненты врожденного иммунитета – интерфероны I (α/β) и III (λ) типа.
Цель работы – изучить ассоциации однонуклеотидных полиморфизмов (ОНП) генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) с разным течением гриппозной инфекции и выявить генетические маркеры осложненного внебольничной пневмонией гриппа. Отмеченные выше гены влияют на продукцию интерферона-λ3.
Материалы и методы. Исследованы образцы от 456 пациентов с легким (n = 150), среднетяжелым (n = 173) и тяжелым (n = 133) течением гриппа. Вирусную РНК выявляли методами обратной транскрипции и полимеразной цепной реакции (ПЦР). ОНП генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) устанавливали с помощью ПЦР. При анализе ассоциаций ОНП генов использовали программу SNPStats.
Результаты. У пациентов с генотипом С/Т или T/T по гену IFNL4 (rs12979860 C/T) чаще выявляли пневмонию, чем при генотипе С/С (ОШ 2,47 (1,31–4,63); р = 0,0044; q = 0,0059). Наличие одного аллеля Т увеличивало риск развития пневмонии (ОШ 2,02 (1,05–4,02); р = 0,006; q = 0,008). При генотипе Т/Т риск повышался более чем в 2 раза: ОШ 2,14 (1,31–3,48). Анализ ОНП гена IFNL3 (rs8099917 T/G) выявил более слабо выраженную ассоциацию G-аллеля с пневмонией (ОШ 1,86 (1,04–3,31); р = 0,03; q = 0,045).
Заключение. Генетическими маркерами повышенного риска внебольничной пневмонии при гриппе является наличие T-аллеля в гене IFNL4 (rs12979860 C/T) и в меньшей значимости G-аллеля в гене IFNL3 (rs8099917 T/G). Носители этих аллелей имеют повышенный риск развития пневмонии при гриппе, особенно в пожилом возрасте.
 25-34
25-34


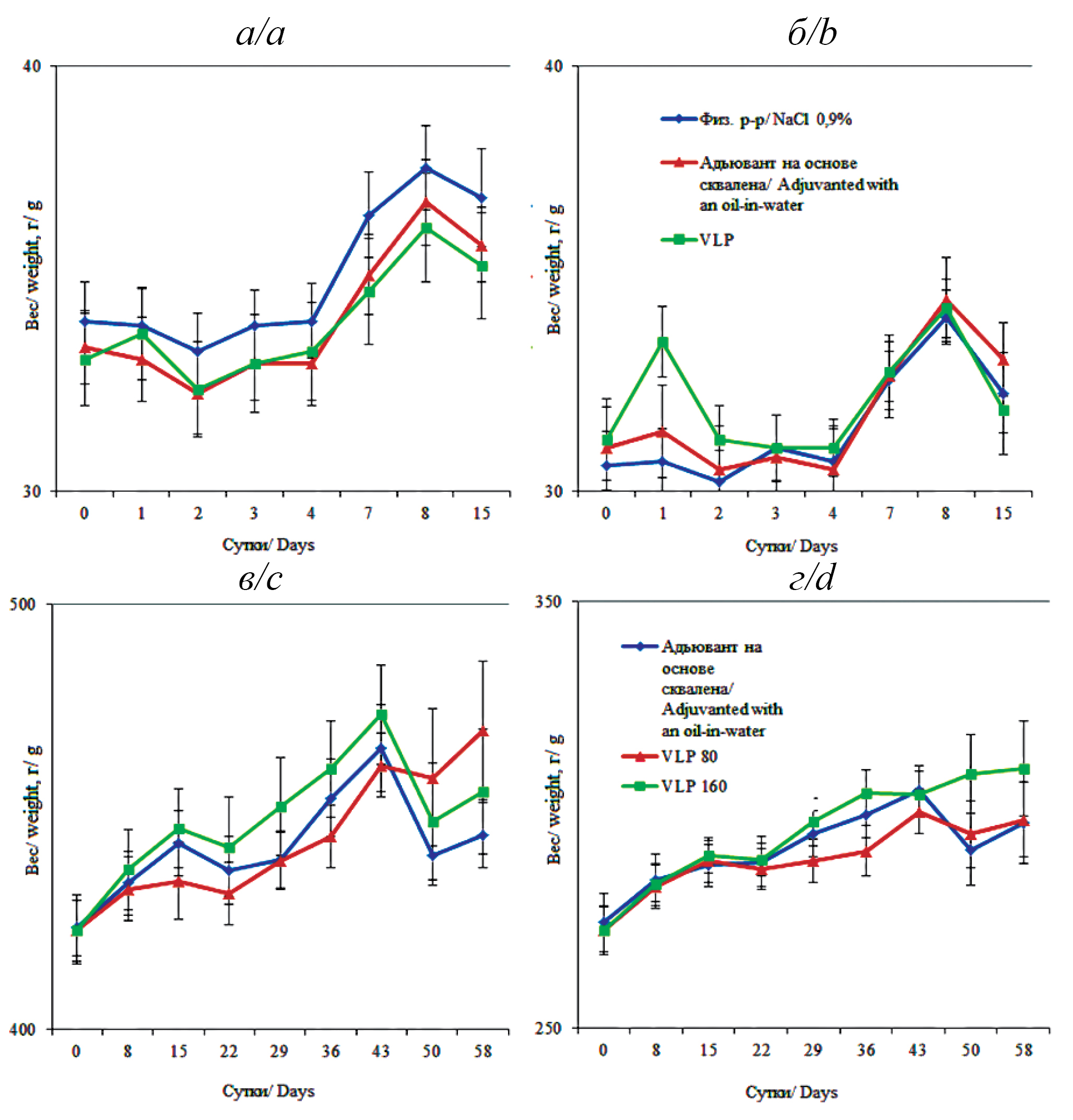
Доклинические исследования безопасности интраназальной вакцины на основе вирусоподобных частиц для профилактики COVID-19
Аннотация
Введение. Масштабная и продолжительная пандемия новой коронавирусной инфекции (COVID-19) показала необходимость эффективной вакцинации. Наряду с иммуногенностью, безопасность является критически важным вопросом для вакцин, поскольку общественное доверие может способствовать успеху или провалу программ иммунизации. В рамках доклинических исследований мы оценили безопасность вакцины на основе вирусоподобных частиц (Virus-like particles, VLP) на мышах и крысах.
Цель ‒ оценить токсичность (острую и субхроническую) и местную переносимость четырехвалентной вакцины против COVID-19 на основе VLP для интраназального введения в соответствии с правилами надлежащей лабораторной практики.
Материалы и методы. Материалом для исследования являлись половозрелые аутбредные мыши (30 самцов и 30 самок), половозрелые аутбредные крысы (45 самцов и 45 самок). Проводили оценку следующих показателей: физиологических, морфометрических и гистологических; общий и биохимический анализ крови и клинический анализ мочи.
Результаты. Не было зарегистрировано ни гибели, ни клинической картины интоксикации при исследовании на мышах острой токсичности, все показатели были в пределах физиологической нормы. При исследовании на крысах субхронической токсичности не отмечалось изменений в общем состоянии, поведении, не было гибели животных. Структура внутренних органов, показатели клинических и биохимических анализов крови, гемостаза и анализа мочи достоверно не различались между группами и не выходили за пределы нормы. При визуальной оценке, цитологическом и гистологическом анализе места введения вакцины не было выявлено местно-раздражающего действия.
Заключение. Четырехвалентная VLP-вакцина для профилактики COVID-19 безопасна, о чем свидетельствуют полученные результаты доклинических исследований, интраназальное введение не оказывает негативного влияния на функцию различных органов, уровень клеточных и биохимических биомаркеров в крови и моче мышей и крыс. В месте введения не было выявлено местно-раздражающего действия при визуальной оценке, цитологическом и гистологическом анализе.
 35-46
35-46


Выявление и характеризация вируса Dezidougou (род Negevirus) в комарах (Ochlerotatus caspius), собранных на территории Республики Саха (Якутия)
Аннотация
Введение. Мониторинг и исследование микроорганизмов, переносимых членистоногими, имеют важное значение. В последнее время с развитием методов секвенирования нового поколения (NGS) у насекомых идентифицировано множество ранее неизвестных вирусов.
Цель исследования. Изоляция вирусов из комаров отобранных в Республике Саха (Якутия), с последующим исследованием нового для России негевируса, выделенного из комаров вида Ochlerotatus caspius, включая определение его полной нуклеотидной последовательности, филогенетическую и вирусологические характеристики.
Материалы и методы. Изоляцию вируса Dezidougou проводили на культуре клеток C6/36 (Aedes albopictus). Электронную микроскопию осуществляли с использованием электронного микроскопа JEM 1400. Скрининговое определение нуклеотидных последовательностей выполняли с применением метода NGS на высокопроизводительном секвенаторе MiSeq, Illumina (США). Определение полногеномной нуклеотидной последовательности проводили секвенированием по методу Сэнгера. Филогенетический анализ выполняли с использованием базы данных GenBank и программ Vector NTI Advance 11, MEGA 11.
Результаты. Выделенный из комаров вирус эффективно реплицировался в клетках C6/36, вызывая их гибель. При этом он не размножался в использованных клеточных культурах млекопитающих. Выделенный вирус при интрацеребральном инфицировании мышей-сосунков не вызывал у них патологических проявлений. При электронно-микроскопическом исследовании очищенной вируссодержащей суспензии было показано наличие сферических вирусных частиц диаметром 45‒55 нм. Результаты полногеномного секвенирования идентифицировали его принадлежность к вирусу Dezidougou, впервые выделенному в Кот д’Ивуаре. Нуклеотидная последовательность генома штамма Yakutsk 2023 вируса Dezidougou была депонирована в базе данных GenBank (PP975071.1).
Заключение. Впервые в Российской Федерации был выделен и охарактеризован вирус Dezidougou рода Negevirus. Проведение дальнейших исследований распространенности негевирусов, их вирусологических особенностей, потенциального значения для здравоохранения и влияния на векторную компетентность переносчиков является важным и перспективным.
 47-56
47-56


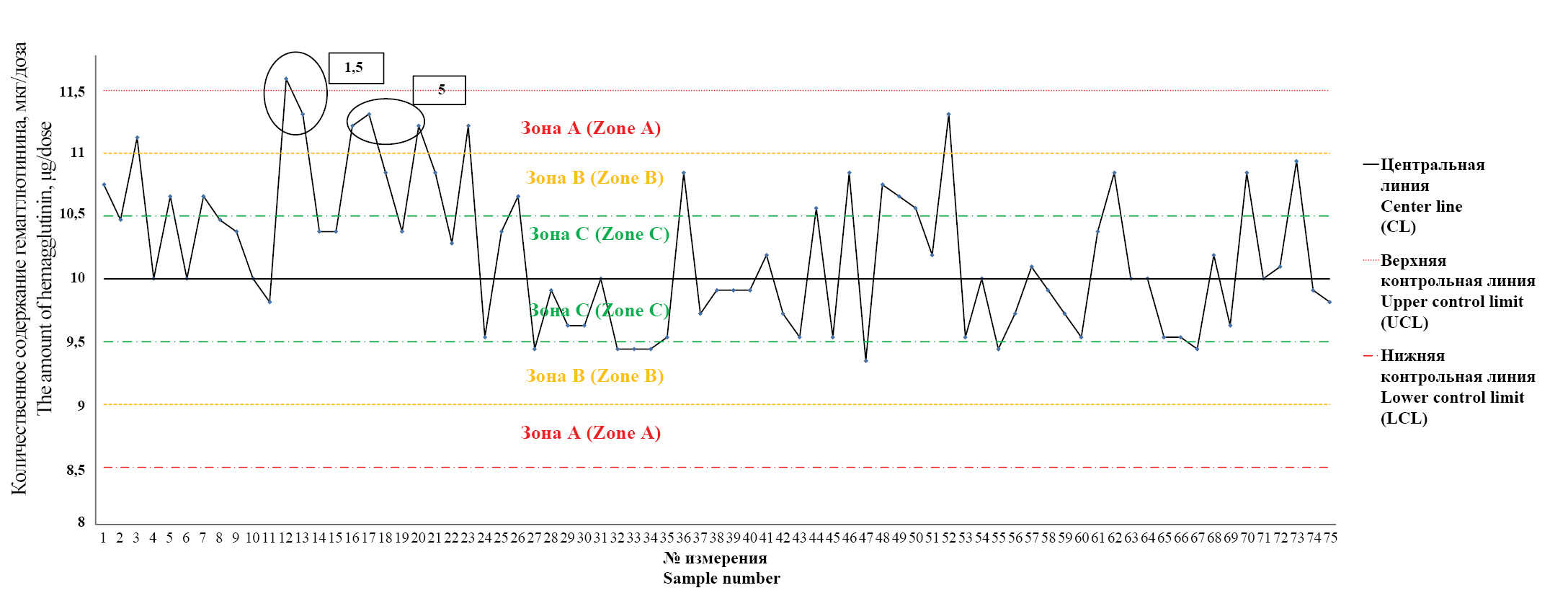
Оценка возможности определения количественного содержания гемагглютинина в готовой лекарственной форме инактивированных вакцин для профилактики гриппа, содержащих адъювант
Аннотация
Введение. Основным показателем качества, обеспечивающим эффективность вакцин для профилактики гриппа, является специфическая активность. Определение показателя в гриппозной вакцине, содержащей адъювант Совидон, проводят в полуфабрикате – тривакцине до добавления адъюванта. Настоящий подход имеет ряд недостатков. Важное значение для выпуска в гражданский оборот лекарственного препарата, соответствующего требованиям нормативной документации, имеет оценка статистической управляемости производственного процесса по результатам контроля показателя «специфическая активность».
Цель работы – оценка сопоставимости результатов количественного определения гемагглютинина в полуфабрикате вакцины для профилактики гриппа и в готовой лекарственной форме; анализ результатов контроля показателя качества «специфическая активность» для оценки статистической управляемости производственного процесса.
Материалы и методы. Для исследования методом одиночной радиальной иммунодиффузии использовали полуфабрикат вакцины для профилактики гриппа (тривакцина до добавления адъюванта Совидон) и соответствующие серии готовой лекарственной формы. Расчет содержания гемагглютинина проводили при помощи программного обеспечения SIAMS Photolab. Для построения контрольных карт Шухарта (Х-карты) в программе Microsoft Excel применяли паспортные данные предприятия – производителя лекарственного препарата.
Результаты. Статистический анализ показал, что результаты количественного определения гемагглютинина в полуфабрикате вакцины и готовой форме лекарственного препарата достоверно не отличаются (при уровне значимости р < 0,05). Анализ контрольных карт Шухарта показал наличие критериев, свидетельствующих о тенденциях к выходу производственного процесса из состояния статистической управляемости.
Заключение. Показана принципиальная возможность и обоснована целесообразность определения количественного содержания гемагглютинина в готовой лекарственной форме вакцины, содержащей адъювант Совидон. Выявленные тренды при анализе контрольных карт Шухарта являются основанием для установления причины выхода производственного процесса из состояния статистической управляемости и анализа рисков выпуска в гражданский оборот серий вакцины, не соответствующих установленным требованиям.
 57-65
57-65


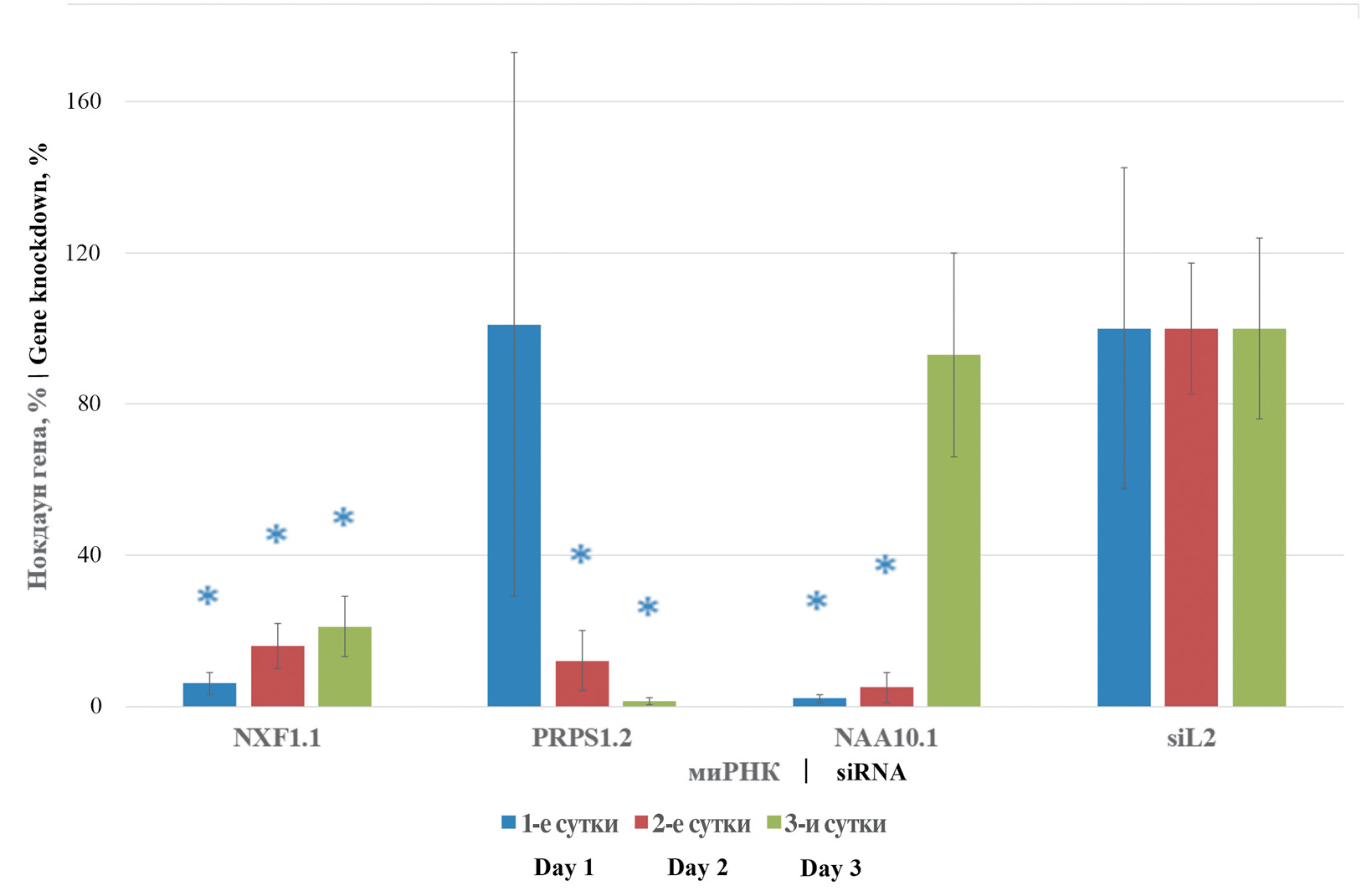
Оценка профилактического эффекта нокдауна клеточных генов NXF1, PRPS1 и NAA10 при гриппозной инфекции на модели in vitro
Аннотация
Введение. Грипп – острое респираторное вирусное инфекционное заболевание, индуцируемое одноименными вирусами. Существующие на сегодняшний день профилактические и терапевтические подходы имеют важное противоэпидемическое значение, однако имеется ряд проблем, таких как быстрое возникновение резистентных штаммов, отсутствие формирования перекрестного иммунитета и эффективность вакцин. Одним из подходов в создании противогриппозных средств является использование механизма РНК-интерференции и малых интерферирующих РНК (миРНК), комплементарных к матричной РНК мишени вирусных и клеточных генов.
Цель – оценка профилактического противогриппозного эффекта миРНК, направленных к клеточным генам NXF1, PRPS1 и NAA10, на модели in vitro.
Материалы и методы. Исследовали антигенные варианты вируса гриппа типа А: A/California/7/09 (H1N1), А/WSN/33 (H1N1) и A/Brisbane/59/07 (H1N1); клеточные культуры A549 и MDCK. Исследование выполняли посредством молекулярно-генетических (трансфекции, выделение нуклеиновых кислот, полимеразная цепная реакция с обратной транскрипцией в реальном времени) и вирусологических методов (заражение клеточных культур, титрование по визуальному цитопатическому действию, оценка вирусного титра посредством метода Рамакришнана).
Результаты. Показано, что миРНК, таргетированные к клеточным генам NXF1, PRPS1 и NAA10 при профилактическом применении в клеточной культуре в концентрации 0,25 мкг на лунку, при инфицировании штаммами вируса гриппа A/California/7/09 (H1N1), А/WSN/33 (H1N1) и A/Brisbane/59/07 (H1N1) при множественности инфекции 0,01, снижают вирусную репликацию до уровня 220 ТЦД50 на 1 мл клеточной среды, тогда как в контрольных необработанных клетках вирусный урожай составил ~106 ТЦД50 на 1 мл среды.
Выводы. Снижение экспрессии указанных генов NXF1, PRPS1 и NAA10 приводит к нарушению жизненного цикла и активности вирусов гриппа. Подобный подход может быть потенциально исследован и использован для близко- и дальнородственных представителей иных семейств вирусов.
 66-77
66-77


Суммарные антитела и нейтрализующая способность сывороток реконвалесцентов по отношению к трем разным штаммам SARS-CoV-2
Аннотация
Цель исследования. Оценить уровень гуморального иммунитета реконвалесцентов против SARS-CoV-2.
Материалы и методы. В исследовании участвовали 259 человек в возрасте от 18 лет до 81 года, отобранных случайным образом в ФГБНУ «ФИЦ ФТМ» и в ФГБУН «Институт неорганической химии им. А.В. Николаева» СО РАН. У участников определяли количество антител методом иммуноферментного анализа. Титры нейтрализующих антител выявляли с помощью реакции микронейтрализации с использованием 3 штаммов SARS-CoV-2. NGS-секвенирование проводили с использованием платформы Illumina MiSeq, филогенетический анализ ‒ с помощью ресурса NextClade.
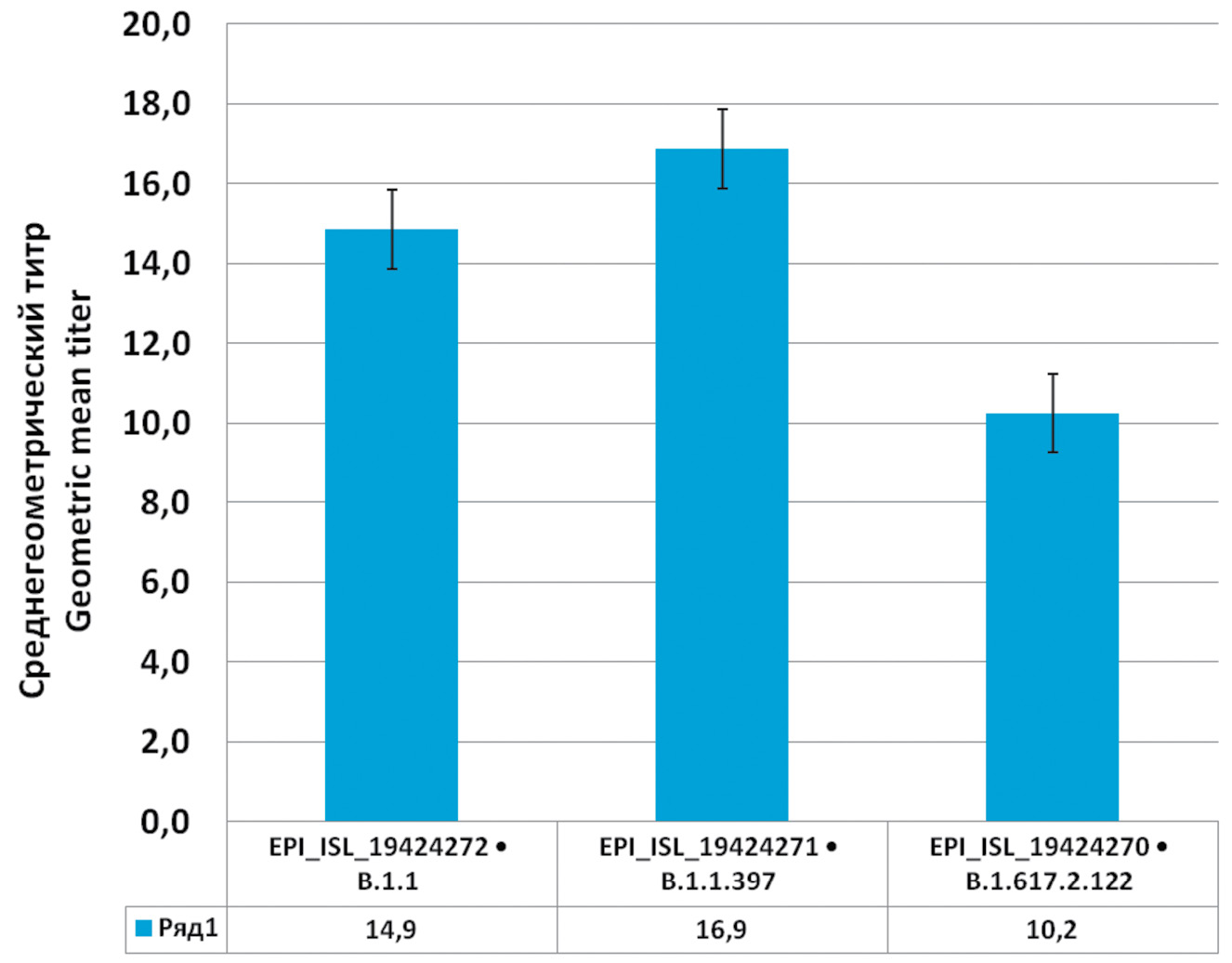
Результаты. Среднее количество антител у реконвалесцентов составило 133,42 ± 7,20 BAU/мл. Количество антител не зависело от пола и возраста пациентов, а также от времени, прошедшего после перенесенного COVID-19. Изучаемые штаммы SARS-CoV-2 были отсеквенированы и задепонированы в международную базу данных GISAID, проведен генетический анализ: EPI_ISL_19424272 филогенетически относится к кладе В1.1, EPI_ISL_19424271 относится к кладе B.1.1.397, EPI_ISL_19424270 относится к варианту Дельта B.1.617.2.122. Не было выявлено достоверных различий в нейтрализующей способности сывороток реконвалесцентов (переболевших за 2‒3 мес до исследования) для первых двух вариантов SARS-CoV-2 (циркулировавших на момент болезни участников исследования) и она была значительно снижена для варианта, относящегося к кладе Дельта, появившегося в новосибирском регионе позже (1/2 сывороток не показала нейтрализацию).
Выводы. Нейтрализующая способность сывороток реконвалесцентов имеет наибольшую активность в отношении тех вариантов вируса, которым переболел пациент, в то время как против нового варианта она оказывается сниженной или отсутствует. Циркуляция SARS-CoV-2 продолжается, и иммунитет, выработанный к первоначальным вариантам вируса, может оказаться недостаточно эффективным против вновь возникающих штаммов вследствие появления у вируса мутаций, позволяющих избегать выработанных ранее антител.
 78-86
78-86


Идентификация ортохантавирусов, впервые выявленных на территории Республики Беларусь
Аннотация
Актуальность. Мониторинг возбудителей геморрагической лихорадки с почечным синдромом (ГЛПС) на территории Республики Беларусь является необходимым и актуальным, поскольку количество случаев ГЛПС у населения за последние годы увеличилось, а генетические характеристики возбудителей отсутствуют.
Цель исследования. Выявление ортохантавирусов, циркулирующих на территории Республики Беларусь, и определение их генетических характеристик.
Материалы и методы. Проведен скрининг зооматериала в объеме 613 образцов от мелких млекопитающих, отловленных на территории Республики Беларусь. Использовали метод полимеразной цепной реакции (ПЦР) в реальном времени с тест-системой «Белар-ГЛПС-ПЦР/РВ». Положительные образцы секвенировали методом Сэнгера. Сравнительный и филогенетический анализ проводили с использованием программ MegAlign из пакета Lasergene (DNASTAR, США) и Mega 11.
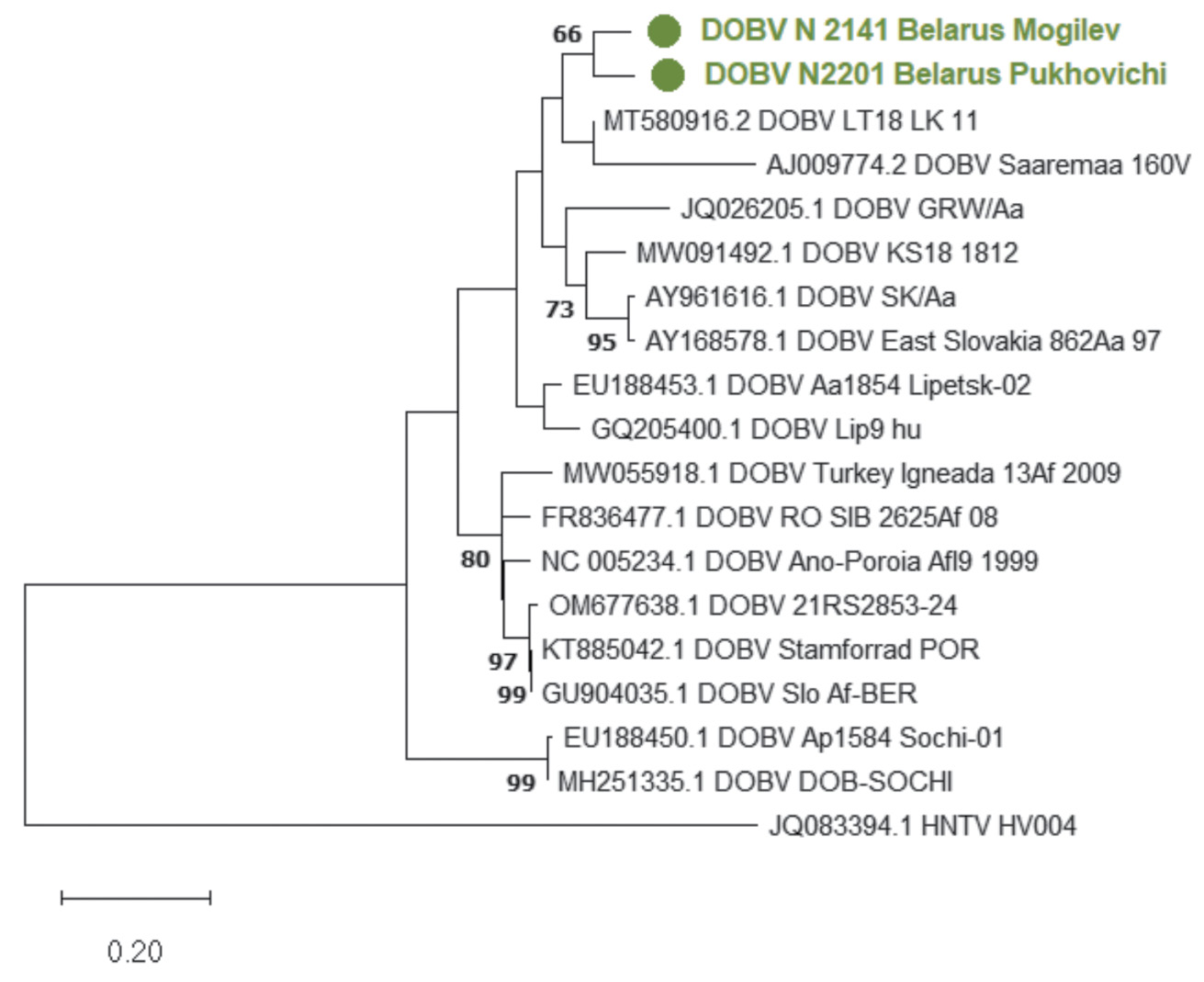
Результаты. При первичном скрининге было обнаружено 32 ПЦР-положительных образца (5,2%), из которых 24 образца относились к вирусу Пуумала (PUUV) и 8 образцов ‒ к вирусу Добрава-Белград (DOBV). Были секвенированы 3 нуклеотидные последовательности участка М-сегмента PUUV, 2 последовательности участка М-сегмента длиной 291 пара нуклеотидов (п.н.) и одна последовательность участка S-сегмента длиной 348 п.н. DOBV. Сравнительный анализ и филогения показали, что выявленные геноизоляты PUUV принадлежат к русской генетической линии, к той же сублинии, что и штаммы, распространенные в Московской и Курской областях. Выявленные геноизоляты DOBV продемонстрировали наиболее близкое родство к штаммам из центрального региона европейской части России.
Заключение. Результаты молекулярно-биологического анализа показали, что PUUV циркулирует на территории Республики Беларусь и распространен повсеместно. В то же время DOBV выявлен на территории четырех областей республики, что свидетельствует о расширении ареала данного возбудителя ГЛПС. В Республике Беларусь впервые получены нуклеотидные последовательности ортохантавирусов и проведен их молекулярно-генетический анализ.
 87-98
87-98