Том 69, № 2 (2024)
- Год: 2024
- Выпуск опубликован: 06.05.2024
- Статей: 9
- URL: https://virusjour.crie.ru/jour/issue/view/133
Весь выпуск
РЕДАКЦИОННАЯ КОНЦЕПЦИЯ
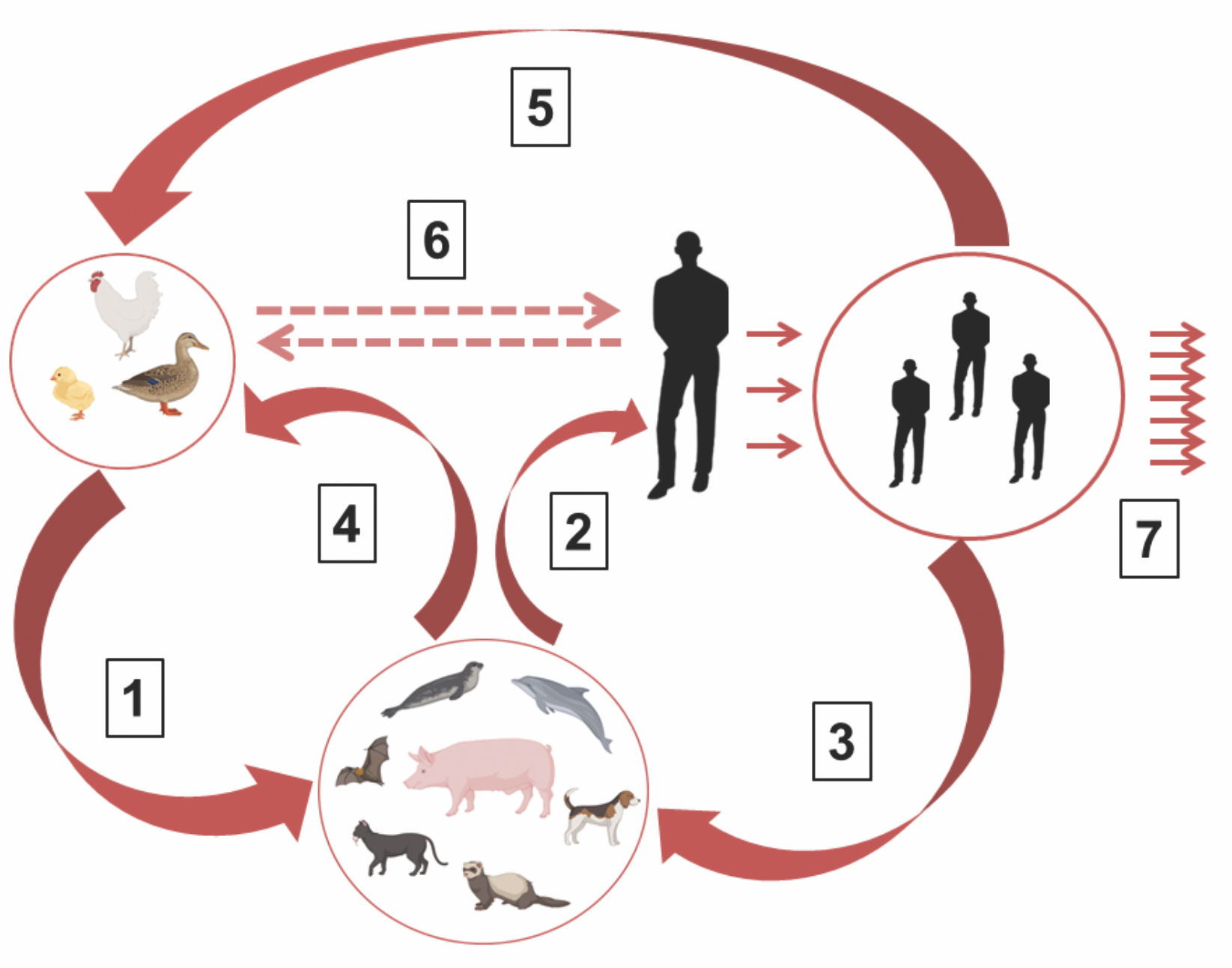
Птичий грипп: «по ком звонит колокол»?
Аннотация
Семейство Orthomyxoviridae состоит из 9 родов, включая Alphainfluenza viruses, куда входят вирусы гриппа птиц. У двух субтипов ‒ Н5 и Н7 ‒ помимо обычных низковирулентных штаммов описана особая разновидность высоковирулентного вируса птиц, способного вызывать заболеваемость у птиц с летальностью выше 60%. Эти и ряд других разновидностей вируса гриппа, тесно связанных с птицами, принято обозначать термином «птичий вирус гриппа». Различие высоко- (HPAI) и низковирулентных (LPAI) вирусов гриппа обусловлено структурой аргининсодержащего сайта протеолитической активации в белке НА. Вирус высоковирулентного птичьего гриппа Н5 выявлен около 100 лет назад и на протяжении этого времени вызывает эпизоотии среди диких и домашних птиц, и лишь несколько локальных эпизодов болезни зарегистрированы среди людей с начала XXI в. В последние годы зафиксирован резкий подъем заболеваемости птиц высоковирулентным вирусом Н5N1 (клайд h2.3.4.4b) на всех континентах планеты, сопровождающийся переходом вируса на разные виды млекопитающих. Регистрируемая глобальная смертность среди домашних и сельскохозяйственных птиц от данного субтипа приближается к уровню 1 млрд особей. Опасным эпидемическим фактором становятся участившиеся вспышки птичьего гриппа с высокой летальностью среди млекопитающих, в частности морских львов и тюленей в Северной и Южной Америке, норок и пушных зверей в Испании и Финляндии, домашних и уличных кошек в Польше. Изолированные от млекопитающих штаммы птичьего гриппа H5N1 клайда h2.3.4.4b имеют признаки частичной адаптации к организму человека в генах РВ2, NP, HA, NA, играющих главную роль в регуляции аэрозольной трансмиссии и круга хозяев вируса. Создавшаяся ситуация представляет реальную угрозу предадаптации вируса в организме млекопитающих как промежуточных хозяев с последующим переходом предадаптированного вируса в популяцию людей и формированием пандемии с катастрофическими последствиями.
 101-118
101-118


ОБЗОРЫ
Применение иммуноглобулинов и моноклональных антител в отношении COVID-19
Аннотация
Введение. При возникновении нового заболевания одним из наиболее доступных средств с установленной и доказанной терапевтической эффективностью в первую очередь являются препараты, содержащие специфические антитела к данному инфекционному агенту. Введение таких препаратов направлено на снижение количества возбудителя в макроорганизме и, как следствие, уменьшение тяжести симптомов заболевания либо выздоровление.
Целью настоящего обзора является анализ опыта использования иммуноглобулинов и моноклональных антител при лечении больных COVID-19 в ходе пандемии.
Результаты и заключение. Двумя основными группами медицинских средств защиты, блокирующих проникновение вируса SARS-CoV-2 в пермиссивные клетки, являются препараты, получаемые из плазмы крови реконвалесцентов (иммуноглобулин), и человеческие моноклональные антитела. В первой группе препаратов при лечении больных COVID-19 ведущее место занимает плазма крови реконвалесцентов. Данный препарат с успехом может быть использован для проведения экстренной профилактики на ранних стадиях заболевания. Основным недостатком терапии при использовании плазмы крови реконвалесцентов является трудность стандартизации ввиду значительного варьирования содержания специфических антител у доноров. Другим недостатком терапии при использовании препаратов первой группы являются нежелательные побочные реакции у реципиентов, возникающие при их введении. Альтернативным подходом при проведении терапии COVID-19 является использование гуманизированных и генно-инженерных человеческих моноклональных антител против определенных эпитопов вируса SARS-CoV-2, в частности, рецептор-связывающего домена S-белка, способных предотвратить проникновение вируса в пермиссивные клетки и прервать развитие манифестной инфекции. Преимуществами данных препаратов является их безопасность, высокая специфическая активность, возможность стандартизации, однако сложность их производства и высокая стоимость делают их малодоступными для массового использования в практической медицине.
 119-126
119-126


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Профилирование экспрессии генов p53 и c-myc у HTLV-1-инфицированных доноров крови в Конго
Аннотация
Введение. Инфекция HTLV-1 сохраняется в течение всей жизни человека, обусловливая бессимптомное вирусное носительство у большинства пациентов и обеспечивая цепь передачи. Однако примерно у 4% инфицированных развивается Т-клеточная лейкемия/лимфома взрослых (ATLL). HTLV-1 – это онкоретровирус, который трансформирует CD4+-Т-лимфоциты и дерегулирует лимфопролиферативные пути, что способствует развитию ATLL. Для достижения трансформации клеток большинство онкогенных ретровирусов используют трансдукцию с захватом протоонкогенов, при этом провирусная интеграция нарушает экспрессию опухолевых супрессоров или протоонкогенов.
Цель исследования. Мы провели исследование по определению распространенности HTLV-1-инфекции среди доноров крови с целью расширения базы данных HTLV-1, оценки риска передачи вируса через компоненты крови, а также оценки риска персистенции инфекции или развития неопластических заболеваний у носителей HTLV-1.
Материалы и методы. Настоящая научная работа – перекрестное исследование доноров крови всех категорий. В исследовании участвовали 265 доноров крови из Национального центра переливания крови в Браззавиле. После тестирования на антитела к HTLV-1 методом ИФА во всех положительных в ИФА-образцах проводили определение провирусной ДНК методом «вложенной» ПЦР, а затем методом количественной ОТ-ПЦР с использованием специфических праймеров p53 и c-myc оценивали экспрессию генов.
Результаты. Из 265 доноров 20 человек были положительны по анти-HTLV-1-антителам, у 5 доноров была выявлена провирусная ДНК. Распространенность HTLV-1 составила 1,8%. Все HTLV-1-инфицированные доноры были мужчинами (1,8%), с положительной корреляцией между наличием инфекции и мужским полом (p = 0,05); 1,1% положительных доноров были регулярными, большинство в возрасте от 31 до 45 лет (1,5%), и наиболее часто встречались доноры-совместители (1,1%). Во всех образцах наблюдалась нормальная экспрессия генов p53 и c-myc.
Заключение. Распространенность HTLV-1, хотя и низкая, остается значительной проблемой. У HTLV-1-инфицированных доноров не было обнаружено аномальной экспрессии генов p53 или c-myc, что может означать, что ни один из Т-лимфоцитов доноров не был трансформирован HTLV-1.
 127-133
127-133


Обнаружение и высокое содержание ДНК герпесвирусов (Orthoherpesviridae) в аутопсийных материалах пациентов с летальным исходом COVID-19
Аннотация
Введение. Вирус SARS-CoV-2 вызывает нарушения иммунитета, создающие условия для реактивации герпесвирусов человека (ГВЧ). Однако влияние ГВЧ на течение и исход COVID-19 оценивается неоднозначно.
Цель исследования – изучение возможной связи между реактивацией ГВЧ у пациентов, инфицированных SARS-CoV-2, и неблагоприятным исходом COVID-19.
Материалы и методы. Посмертные клинические материалы из головного мозга, печени, селезенки, лимфоузлов и легких были получены от 59 пациентов, находившихся на лечении в ГБУЗ ИКБ № 1 ДЗ г. Москвы в 2021–2023 гг. В 1-ю группу включили материалы от 39 пациентов с летальным исходом COVID-19; во 2-ю группу – от 20 пациентов, не инфицированных SARS-CoV-2 и умерших от разных соматических заболеваний. ДНК ГВЧ и РНК SARS-CoV-2 определяли методом ПЦР.
Результаты. В аутопсийных образцах ДНК ГВЧ была обнаружена у всех пациентов в обеих группах. В 1-й группе вирус Эпштейна‒Барр (ВЭБ) чаще обнаруживали в лимфоузлах (94%), вирус герпеса человека 6-го типа (ВГЧ-6) – в печени (68%), цитомегаловирус (ЦМВ) – в лимфоузлах (18%), вирус простого герпеса (ВПГ) – в головном мозге (16%), вирус варицелла-зостер (ВЗВ)– в легких и селезенке (по 3%). Различия в частоте встречаемости ГВЧ между группами были статистически незначимыми. Важные различия установлены при анализе вирусной нагрузки. У 1-й группы количество проб, содержавших более 1000 копий ДНК ГВЧ на 100 тыс. клеток, составляло 52,4%, во 2-й группе – 16,6% (p < 0,002). Установлена ассоциация между реактивацией ВПГ и ВГЧ-6 и тяжестью поражения легких. Активация ВЭБ коррелировала с повышением уровней ферментов печени.
Заключение. Полученные результаты свидетельствует о реактивации ГВЧ у пациентов с летальным исходом COVID-19. Обнаружение ГВЧ ассоциировалось с тяжелыми повреждениями легких и печени, что указывает на связь реактивации ГВЧ со смертельными исходами COVID-19.
 134-150
134-150


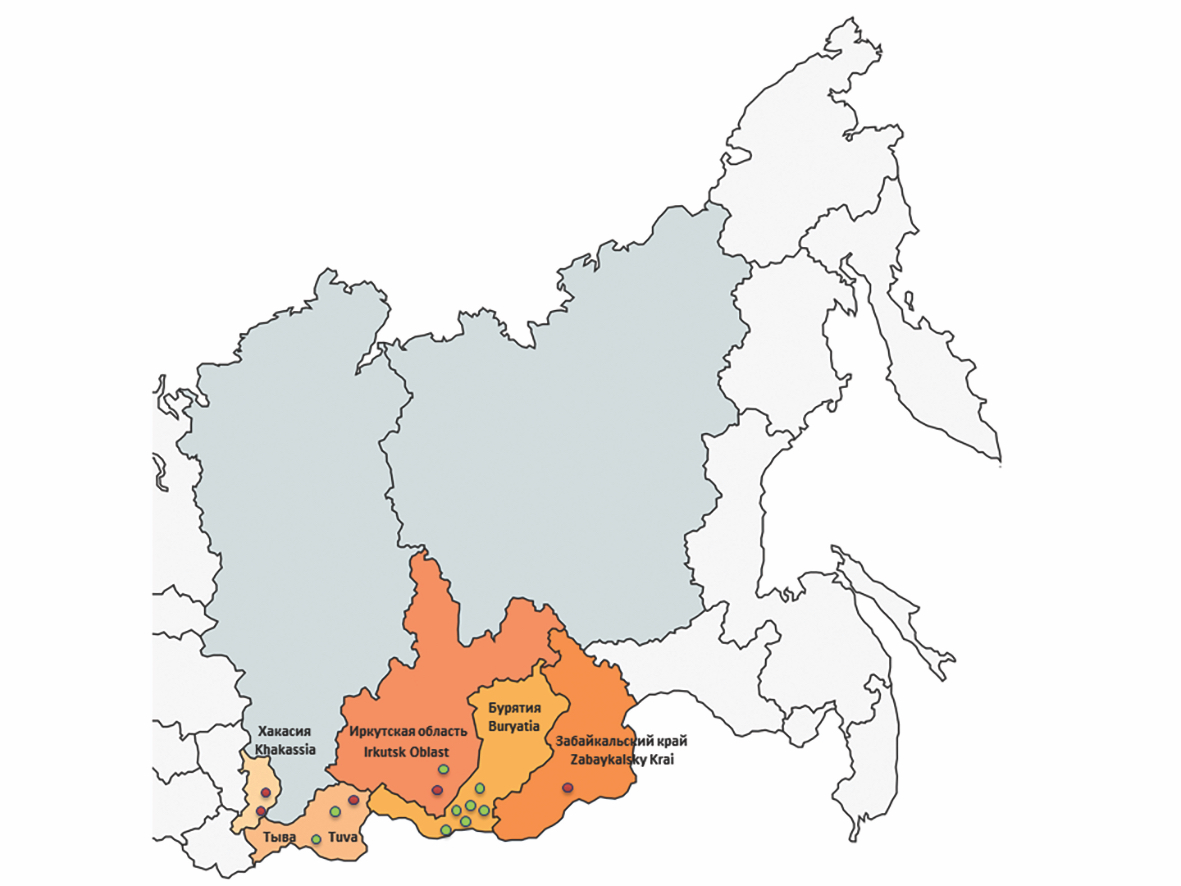
Встречаемость и генетическое разнообразие вируса Алонгшан (Flaviviridae), выявленного в клещах на юге Восточной Сибири
Аннотация
Введение. Инфекции, переносимые иксодовыми клещами, являются значимой проблемой для многих регионов России, в том числе и для Восточной Сибири. Неблагополучная эпидемиологическая ситуация может характеризоваться не только ростом встречаемости уже известных «клещевых» инфекций, но и выявлением новых нозологических форм и возбудителей, роль которых остается малоизученной или вообще неизученной. Сегментированные флавиподобные вирусы могут быть причиной инфекционных заболеваний человека и создавать угрозу для здоровья населения.
Цель работы ‒ поиск и молекулярно-генетическая характеристика изолятов вируса Алонгшан (Flaviviridae: Alongshan virus, ALSV), переносимого клещами на юге Восточной Сибири.
Материалы и методы. Было собрано и исследовано 1060 клещей, отловленных на территории Республик Хакасия, Тыва, Бурятия, Иркутской области и Забайкальского краяв весенне-летний период 2023 г. Детекцию РНК ALSV выполняли с помощью метода полимеразной цепной реакции с обратной транскрипцией с последующим определением нуклеотидной последовательности и проведением филогенетического анализа для каждого из 4 сегментов генома.
Результаты. Инфицированность ALSV клещей Ixodes persulcatus, собранных в Республике Хакасия, составила 3,3% (95% ДИ 1,4–7,5), в Иркутской области – 1% (95% ДИ 0,3–3,7), в Республике Тыва – 0,9% (95% ДИ 0,3–3,4), в Забайкальском крае – 0,7% (95% ДИ 0,2–3,6). Генетические варианты ALSV, циркулирующие в клещах I. persulcatus на территории юга Восточной Сибири, по всем 4 сегментам группируются с последовательностями, обнаруженными в Китае, и кластеризуются в азиатскую подгруппу, переносимую таежным клещом. Уровень различия нуклеотидных последовательностей фрагментов генома среди выявленных генетических вариантов ALSV составил от 2 до 3%.
Заключение. Показано широкое распространение ALSV в клещах I. persulcatus на территории республик Хакасия и Тыва, Иркутской области и Забайкальского края. Эти данные актуализируют мониторинг за изменением ареала распространения флавиподобных вирусов, потенциально опасных для человека, и их переносчиков.
 151-161
151-161


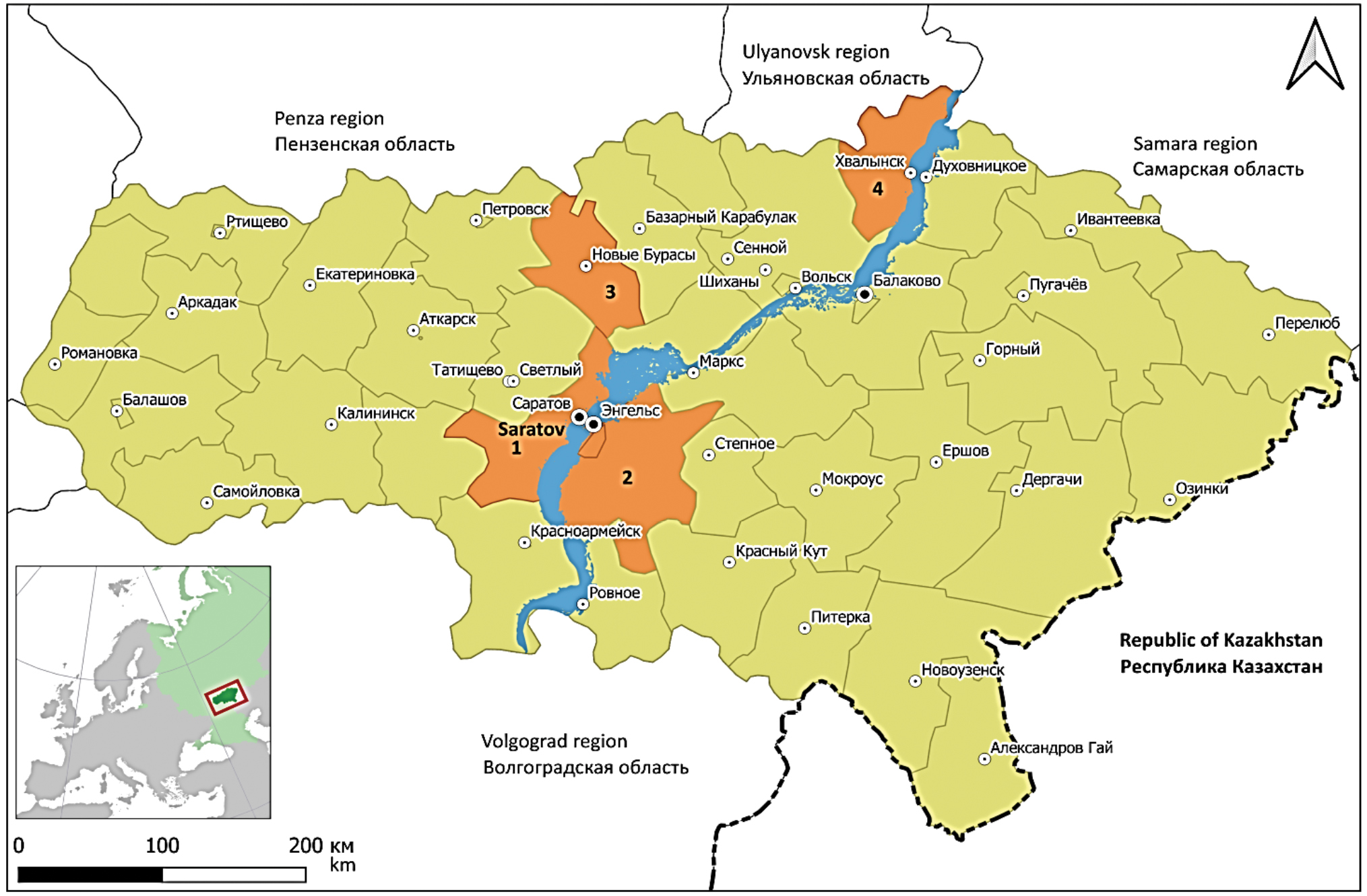
Филогенетический анализ вариантов вируса Пуумала (Hantaviridae: Orthohantavirus), циркулирующих на территории Саратовской области
Аннотация
Цель работы – определение полной нуклеотидной последовательности и проведение филогенетического анализа вариантов геномов вируса Пуумала, выделенных на территории Саратовской области.
Материалы и методы. Образцами для исследования послужил полевой материал, собранный в Гагаринском (бывшем Саратовском), Энгельсском, Новобурасском и Хвалынском районах Саратовской области в период с 2019 по 2022 г. Для специфического обогащения генома вируса Пуумала в образцах использовали ПЦР и панель праймеров, подготовленную для данного исследования. Далее проводили секвенирование полученных продуктов реакции и сборку фрагментов в одну последовательность для каждого из сегментов генома вируса. При построении филогенетических деревьев применяли алгоритм maximum parsimony.
Результаты. Показано, что генетические варианты вируса Пуумала, выделенные в Саратовской области, имеют высокую степень подобия генома, что говорит о единстве их происхождения. По данным филогенетического анализа, все выделенные варианты вируса (за исключением изолятов вируса из Хвалынского района) образуют обособленную ветвь в кластере, сформированном хантавирусами из других субъектов Приволжского федерального округа. Самыми близкими к образцам из Саратовской области являются варианты вируса из республик Удмуртия и Татарстан, а также из Самарской и Ульяновской областей.
Заключение. Полученные данные указывают на наличие выраженной территориальной приуроченности штаммов к определенным регионам или областям, являющимся природными биотопами их носителей. Этот факт позволяет довольно точно определять территорию возможного инфицирования заболевших и/или циркуляцию переносчиков данных вариантов вируса по последовательности отдельных сегментов их генома.
 162-174
162-174


Разработка, получение и характеристика вирусоподобных частиц SARS-CoV-2 (Coronaviridae: Orthocoronavirinae: Betacoronavirus: Sarbecovirus)
Аннотация
Введение. Пандемия COVID-19, вызванная коронавирусом SARS-CoV-2, породила серьезные проблемы в здравоохранении по всему миру. Ученым в кратчайшие сроки пришлось решать задачи по разработке методов лечения и профилактики этого заболевания. Наиболее эффективным способом прерывания развивающихся новых эпидемических вспышек является вакцинация. Одним из современных и эффективных подходов при разработке вакцин является использование вирусоподобных частиц (Virus like particles, VLP).
Цель исследования – разработать технологию получения VLP на основе рекомбинантных белков SARS-CoV-2 (E, M, N и S), продуцируемых в клетках насекомых, и дать их комплексную характеристику.
Материалы и методы. Источником вирусных белков послужили синтетические гены, кодирующие белки коронавируса E, M, N и S. Были разработаны VLP с разными поверхностными S-белками 4 штаммов коронавируса: подобный вирусу Ухань, Delta, Alpha и Omicron, клонированные в плазмиду pFastBac. Белки были синтезированы в бакуловирусной системе экспрессии и собраны в VLP в перевиваемой линии клеток Trichoplusia ni (T.ni). Синтез генов, клонирование в трансферные плазмиды и получение рекомбинантных бакуловирусов проводили стандартными методами. Наличие вставки в геноме бакуловируса определяли методом полимеразной цепной реакции. Для исследования антигенной активности VLP применяли иммуноферментный анализ, иммуноблоттинг. Очистку VLP проводили ультрацентрифугированием через 20% сахарозу. Оценку морфологии выполняли с помощью электронной микроскопии и методом динамического светорассеяния.
Результаты. Получены и охарактеризованы VLP, состоящие из рекомбинантных белков S, M, E и N, на основе консенсусных последовательностей, циркулирующих в мире геновариантов SARS-CoV-2. Показана специфичность антигенных детерминант синтезированных VLP антителам, формирующимся к белкам SARS-CoV-2, изучены иммуногенные свойства VLP.
Заключение. Разработаны способы получения и очистки VLP с универсальным набором поверхностных антигенов, способных к самосборке и индуцирующих специфический иммунитет против SARS-CoV-2.
 175-186
175-186


КРАТКИЕ СООБЩЕНИЯ
Серопревалентность вируса простого герпеса 1-го типа (Herpesviridae: Simplexvirus: Human alphaherpesvirus 1) у курильщиков
Аннотация
Введение. Вирус простого герпеса 1-го типа (ВПГ-1) – один из самых распространенных вирусных агентов, инфицирующих человека, имеет геном с двухцепочечной ДНК и относится к семейству Herpesviridae. Курение – одна из основных причин заболеваний и преждевременной смерти во всем мире, от которой ежегодно умирает до 6 млн человек.
Цель настоящего исследования – определение серопревалентности ВПГ-1 среди курильщиков.
Методы. Исследование проводили в период с декабря 2022 г. по январь 2023 г. В исследование была включена случайная выборка из 94 (88 мужчин и 6 женщин) здоровых лиц в возрасте от 20 до 60 лет, 50 участников составили контрольную группу. Серологическое тестирование на ВПГ заключалось в выявлении антител к ВПГ-1 класса IgG с помощью ИФА.
Результаты. Большинство участников были студентами университета – 45,7% мужчин и 5,3% женщин, за ними следовали работающие курильщики – 0,2% мужчин и 1,1% женщин. Число женщин было значительно меньше, чем мужчин, и составило 6,4 и 93,6% соответственно, что объясняется обычаями и традициями. Серопревалентность составила 24,47, 22,3 и 2,1% среди мужчин и женщин соответственно. Уровень серопревалентности составил 13,8% среди курильщиков кальяна и сигарет, 9% исключительно среди курильщиков сигарет и 1,1% исключительно среди курильщиков кальяна. Наибольший уровень выявляемости антител наблюдался в возрастных группах 21–30 и 31–40 лет – 12,80 и 7,40% соответственно.
Заключение. Исследование показало, что серопревалентность ВПГ-1 IgG составила 24,47% и была выше среди курильщиков кальяна и сигарет по сравнению с теми, кто курил исключительно сигареты или кальян.
 187-192
187-192


ЮБИЛЕЙНЫЕ ДАТЫ
 193-194
193-194