Том 65, № 1 (2020)
- Год: 2020
- Выпуск опубликован: 20.02.2020
- Статей: 7
- URL: https://virusjour.crie.ru/jour/issue/view/32
- DOI: https://doi.org/10.36233/0507-4088-2020-65-1
Весь выпуск
ОБЗОРЫ
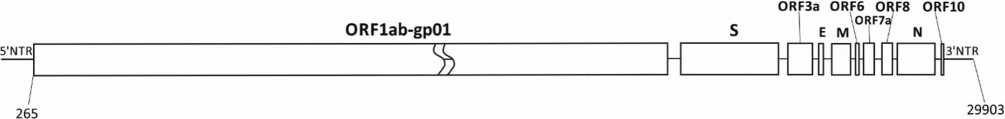
Этиология эпидемической вспышки COVID-19 в г. Ухань (провинция Хубэй, Китайская Народная Республика), ассоциированной с вирусом 2019-nCoV (Nidovirales, Coronaviridae, Coronavirinae, Betacoronavirus, подрод Sarbecovirus): уроки эпидемии SARS-CoV
Аннотация
Результаты сравнительного филогенетического, вирусологического, эпидемиологического, экологического и клинического изучения тяжёлого острого респираторного синдрома (ТОРС) (SARS-2002), ближневосточного респираторного синдрома (БВРС) (MERS-2012) и эпидемической вспышки острого респираторного заболевания (COVID-19) в 2019–2020 гг. в г. Ухань (Хубэй, Китайская Народная Республика, КНР) позволили сделать следующие выводы:
– этиологическим агентом COVID-19 является коронавирус (вирус 2019-CoV), филогенетически близкий к возбудителю ТОРС (вирус SARS-related human CoV) и родственным ему коронавирусам, изолированным от летучих мышей (вирусы SARS-related bat CoV). Эти вирусы относятся к подроду Sarbecovirus рода Betacoronavirus, подсемейства Orthocoronavirinae, семейства Coronaviridae (Cornidovirinea: Nidovirales). Следовательно, эпидемическая вспышка острого респираторного заболевания COVID-19 является вариантом ТОРС (КНР, 2002) и отличается от БВРС (Саудовская Аравия, 2012), вызванного другим коронавирусом, относящимся к подроду Merbecovirus того же рода;
– cогласно результатам филогенетического анализа 35 различных бетакоронавирусов (Betacoronavirus), изолированных в 2002–2019 гг. от людей и из природных источников, природным резервуаром коронавируса 2019-nCoV, также как и вируса SARS-related human CoV, являются летучие мыши рода Rhinolophus (Rhinolophidae), но, возможно, и представители других родов. Дополнительным резервуаром вируса могут служить употребляемые в пищу промежуточные виды животных (змеи, циветты, ежи, барсуки и т.д.), заражение которых происходит при поедании инфицированных летучих мышей. SARS-подобные вирусы циркулировали среди летучих мышей в межэпидемическом периоде (2003–2019 гг.);
– сезонные коронавирусы (подрод Duvinacovirus, род Alphacoronavirus) циркулируют в настоящее время (ноябрь 2019 г. – январь 2020 г.) в Европейской части, на Урале, в Сибири и на Дальнем Востоке России, наряду с вирусами гриппа А (H1N1)pdm09, A (H3N2) и В, а также другими шестью вирусами, вызывающими острые респираторные вирусные инфекции (вирус парагриппа, респираторно-синцитиальный вирус, адено-, рино-, бока-, и метапневмовирусы).
 6-15
6-15


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
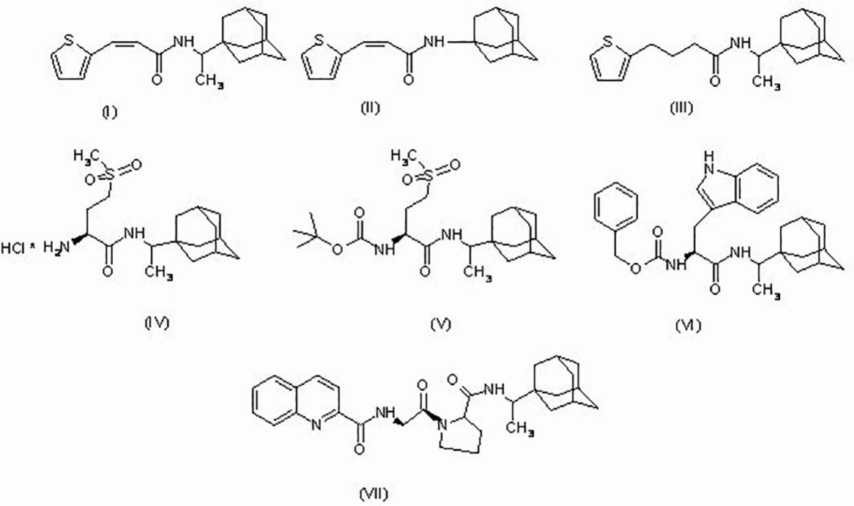
Производные адамантана, способные ингибировать репродукцию резистентного к римантадину штамма вируса гриппа А(H1N1)pdm09 (Influenza A virus, Alphainfluenzavirus, Orthomyxoviridae)
Аннотация
Введение. Соединения адамантанового ряда, такие как римантадин и амантадин, долгое время применяли для лечения заболеваний, вызванных вирусом гриппа А. Однако в результате возникших мутаций вирусы гриппа приобрели резистентность к аминоадамантанам. Мишенью для этих препаратов служил белковый канал М2. Виропорин М2 в белковой оболочке вируса гриппа А образует достаточно специфичные ионные каналы диаметром около 11 Å, специализирующиеся на транспорте ионов водорода внутрь вирусной частицы (вириона). Восстановление противовирусных свойств препаратов адамантанового ряда заключается в подборе дополнительных функциональных групп, связанных карбоциклом, для поиска новых сайтов связывания с белком мишенью М2.
Цель исследования – выявление противовирусных свойств адамантановых производных в отношении пандемического штамма вируса гриппа А in vitro.
Материал и методы. Соединения аминоадамантанов с аминокислотами и другими органическими молекулами были получены методами классического пептидного синтеза. Структура соединения подтверждена современными физико-химическими методами. Противовирусные свойства синтетических соединений были изучены in vitro на монослое клеток MDCK, инфицированных пандемическим штаммом вируса гриппа А/California/07/2009 в двух схемах введения исследуемых соединений и вируса.
Результаты. Эталонный штамм вируса гриппа A/California/07/2009(H1N1) был в разной мере чувствителен к тестируемым соединениям. Противовирусную активность соединений выражали в виде 50% ингибирующей дозы (ИД50), которая составила от 0,5 до 2,5 мкМ, что в целом неплохой показатель в отношении штамма, резистентного к римантадину/амантадину.
Обсуждение. ИД50 для соединений, вносимых за 2 ч до контакта с вирусом, была несколько выше, чем при одномоментном внесении вещества и вируса. Эффект увеличения ингибирующей концентрации в профилактической схеме внесения соединений был справедлив для всех соединений эксперимента.
Заключение. Представленные синтетические соединения активны в отношении варианта вируса гриппа А, резистентного к римантадину и амантадину. Полученные соединения могут быть использованы в качестве модельных структур для создания нового препарата прямого действия против современных штаммов вируса гриппа А.
 16-20
16-20


Опыт применения IgY-технологии для лабораторной диагностики вирусных инфекций
Аннотация
Введение. Известные преимущества антител класса Y (IgY) из яичных желтков иммунизированных кур в сравнении с антителами класса G (IgG) лабораторных животных, традиционно используемых в лабораторной диагностике инфекционных заболеваний, определяют стабильный интерес исследователей к использованию для этих целей IgY (IgY-технологии). За последние 20 лет очевидные преимущества IgY-технологии были продемонстрированы для целого ряда вирусных и бактериальных инфекций.
Цели и задачи. Конструирование систем иммуноферментного анализа (ИФА) на основе специфических IgY для лабораторной диагностики инфекций, вызываемых вирусами клещевого энцефалита, жёлтой лихорадки и полиовирусом.
Материал и методы. Получение препаратов желтков иммунизированных кур, приготовление высокоочищенных препаратов IgY (высаливание, аффинная хроматография), конструирование систем ИФА для определения вирусспецифических антигенов, отработка параметров систем ИФА.
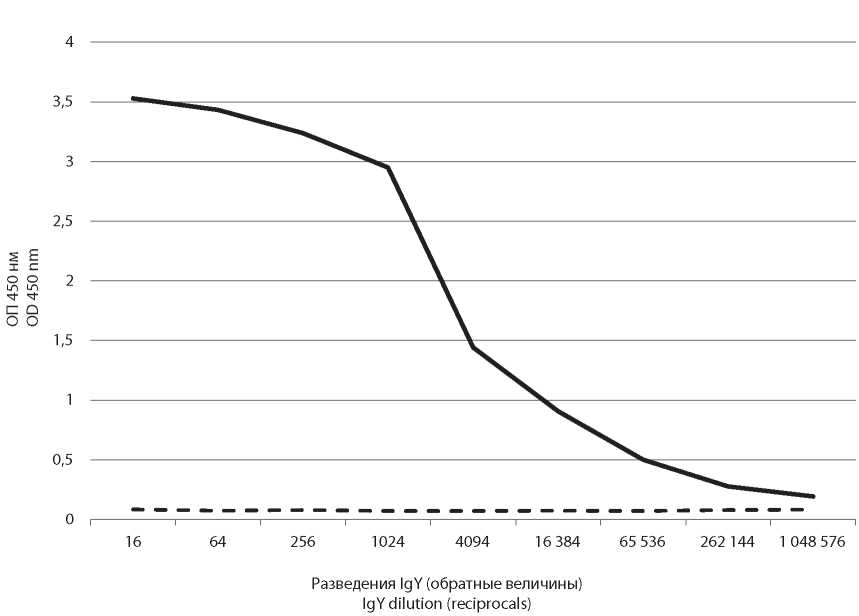
Результаты и обсуждение. Впервые в лабораторной практике были сконструированы системы ИФА, основанные на использовании поликлональных специфических IgY, для лабораторной диагностики актуальных вирусных инфекций человека, вызываемых флавивирусами и энтеровирусами: определены антигены вирусов клещевого энцефалита, жёлтой лихорадки, трёх типов полиовируса. Экспериментально показано, что данные системы ИФА обладают высокой чувствительностью и специфичностью, что позволяет использовать их для полуколичественного и количественного определения антигенов указанных вирусов в различных материалах (инфицированных клеточных культурах, вакцинных препаратах и т.д.).
Заключение. Разработанные на основе специфических IgY системы ИФА для определения вирусных антигенов могут эффективно использоваться для лабораторной диагностики ряда вирусных инфекций, для валидации и контроля вакцинных препаратов.
 21-26
21-26


Вирусные гепатиты В, С и инфекционный мононуклеоз: эпидемиологическое сходство и различия
Аннотация
Введение. Наличие в структуре вирусных гепатитов этиологически нерасшифрованных диагнозов определяет актуальность поиска иных возбудителей, участвующих в формировании патологии печени. Роль вируса Эпштейна–Барр в развитии гепатита описана в научной литературе, однако данные официальной статистики не позволяют оценить его вклад в поражение печени наряду с вирусами гепатита В и С.
Цель исследования – выявить общие и отличительные эпидемиологические признаки вирусных гепатитов В, С и инфекционного мононуклеоза (ИМ).
Материал и методы. Проведён ретроспективный эпидемиологический анализ заболеваемости указанными нозологиями по данным официальной статистики в 2009–2018 гг. в Российской Федерации.
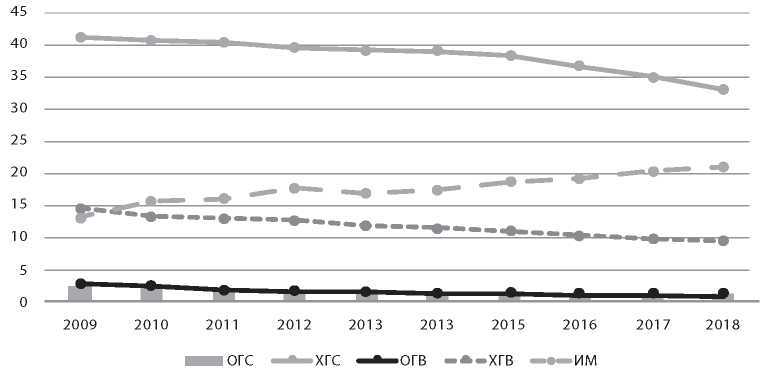
Результаты и обсуждение. Установлены разнонаправленность тенденций в многолетней динамике заболеваемости ИМ и острыми и хроническими гепатитами В и С, а также наличие сильной прямой корреляционной связи между заболеваемостью острыми и хроническими гепатитами В и С. К отличительным признакам относятся различия в интенсивности эпидемического процесса в разных возрастных группах (преобладание заболеваемости детей в возрасте 1–2 и 3–6 лет при ИМ и лиц старше 18 лет – при вирусных гепатитах). Общим для ИМ и вирусных гепатитов В и С является вовлечение в эпидемический процесс преимущественно городского населения, а также детей в возрасте до 1 года. Описанные различия обусловлены действием механизмов передачи, характерных для каждой инфекции.
Заключение. Полученные в ходе настоящего исследования результаты могут стать основой для дальнейшего изучения взаимодействия вируса Эпштейна–Барр с вирусами гепатита В и С.
 27-34
27-34


Характеристика В1-клеток в процессе экспериментального лейкомогенеза
Аннотация
Введение. Вирус лейкоза крупного рогатого скота (КРС) вызывает значительную поликлональную экспансию CD5+ , IgM+ B-лимфоцитов, известных как персистирующий лимфоцитоз приблизительно у 30% заражённого КРС. Однако пока не ясно, что происходит с данной субпопуляцией В-клеток в ранний период инфицирования животных.
Цель исследования – количественная характеристика IgM+ и CD5+ В-клеток в процессе иммунного ответа на заражение вирусом лейкоза крупного рогатого скота (BLV), которая может дать важную информацию о механизмах прайминга лимфоцитов при инфицировании BLV.
Материал и методы. В эксперименте использовали BLV-отрицательных телят чёрно-пёстрой породы в возрасте 8 мес (n = 11). Животным опытной группы (n = 8) внутривенно вводили кровь BLV-положительной коровы. Телятам контрольной группы (n = 3) вводили физиологический раствор. Исследования проводили до и после заражения на 5, 7, 14, 21, 28 и 65-е сутки иммунного ответа. Количество В-лимфоцитов в крови определяли методом иммунопероксидазного окрашивания на основе моноклональных антител к IgM и CD5.
Результаты. В результате проведённых исследований установлено, что уровень CD5+ В-клеток повышается на 14-е сутки первичного иммунного ответа, характеризующегося поликлональной пролиферацией CD5+ В-клеток, которые являются первичной мишенью для BLV. Данные исследований подтверждают, что в лимфоцитах экспериментально заражённого КРС поверхностная агрегация молекул IgM и CD5 на В-лимфоцитах отсутствует.
Обсуждение. Известно, что именно от субпопуляции В1-клеток зависит волнообразный характер синтеза IgM, который был показан в предыдущих исследованиях. После 7-х суток иммунного ответа показатели IgM+ и CD5+-клеток не коррелируют, что показывает их функциональное различие. Возможно, увеличение числа CD5+-клеток связано не с В-клетками, а с дифференцирующимися под влиянием вируса Т-лимфоцитами.
Выводы. Субпопуляция В1-клеток является первичной мишенью вируса лейкоза КРС. 65-е сутки иммунного ответа характеризуются экспансией IgM+ В-клеток, снижением числа CD5+-клеток и равномерным распределением рецепторов по периметру клеток.
 35-40
35-40


Сравнительная молекулярно-генетическая характеристика изолятов вируса бешенства (Rabies lyssavirus, Lyssavirus, Rhabdoviridae), циркулировавших на территории Российской Федерации в период с 1985 по 2016 год
Аннотация
Бешенство – древнейшая инфекция, вызываемая нейротропным вирусом рода Lyssavirus, семейства Rhabdoviridae, который поражает всех теплокровных позвоночных. Гомология последовательностей аминокислот нуклеопротеина среди лиссавирусов 78–93%.
Целью данного исследования было изучение генетического разнообразия и молекулярной эпидемиологии лиссавирусов, циркулировавших на территории РФ с 1985 по 2016 г.
Материал и методы. Исследовано 54 изолята вируса бешенства, выделенных от животных, 2 изолята, выделенных от людей, и 4 вакцинных штамма вируса бешенства: RV-97, ERA, Shchelkovo 51, ERAG333. Филогенетический анализ проводили с использованием данных GenBank о фрагментах геномов 73 изолятов вируса бешенства и 9 изолятов EBLV-1. Для исследования использовали программы DNASTAR V.3.12, Bio Edit 7.0.4.1 и MEGA v. 10.0.5, Primer Premier 5.
Результаты. Сравнительный молекулярно-генетический анализ фрагментов геномов 130 лиссавирусов, выделенных на территории РФ и Украины, а также вакцинных штаммов вируса бешенства показал их распределение по географическому признаку. Сравнение фрагментов нуклеопротеина изолятов вируса бешенства, циркулирующих на территории РФ и Украины, с вакцинными штаммами выявило 4 маркёрных мутации: V56I (для Евразийской группы), L/V95W (для Центральной группы), D101N/S/T, N/G106D. Филогенетический анализ изолята «Juli», выделенного в 1985 г. от человека, укушенного летучей мышью, и описанного М.А. Селимовым и С.В. Грибенча, доказал его принадлежность к европейскому лиссавирусу летучих мышей (подгруппе 1a).
Обсуждение. Изучение молекулярной эпидемиологии бешенства в пределах РФ позволяет проводить генотипирование вируса (распределение по группам, выявление маркёрных мутаций, генотипирование изолята «Juli»). Это помогает изучать скрытые механизмы рабической инфекции в популяции животных и человека, а также характеризовать вакцинные штаммы, в том числе при оральной вакцинации. Заключение. Необходимо дальнейшее изучение молекулярной эпидемиологии бешенства в пределах РФ и граничащих с ней стран.
 41-48
41-48


Разработка препарата для онколитической иммунотерапии на основе вируса осповакцины (Vaccinia virus, Orthopoxvirus, Chordopoxvirinae, Poxviridae) против рака молочной железы
Аннотация
Введение. В настоящее время активно развиваются новые направления в лечении рака, одним из которых является онколитическая иммунотерапия. Этот подход заключается в использовании вирусов в качестве онкоселективных цитолитических агентов, способных стимулировать опухолеспецифический и неспецифический иммунный ответ организма.
Цель работы – получение рекомбинантного вируса осповакцины, содержащего в геноме гены, кодирующие иммуностимулирующие молекулы, и изучение его онколитических и иммуностимулирующих свойств в экспериментах in vitro и in vivo.
Материал и методы. Рекомбинантный вирус осповакцины получен с использованием метода временной доминантной селекции. Цитолитическую эффективность вируса оценивали колориметрическим методом (МТТ-тест). Иммуногенность полиэпитопной конструкции в составе вирусного генома оценивали ex vivo стимуляцией клеток цельной крови иммунизированных мышей линии BALB/c в ответ на антигены с последующим определением уровня цитокинов методом иммуноферментного анализа.
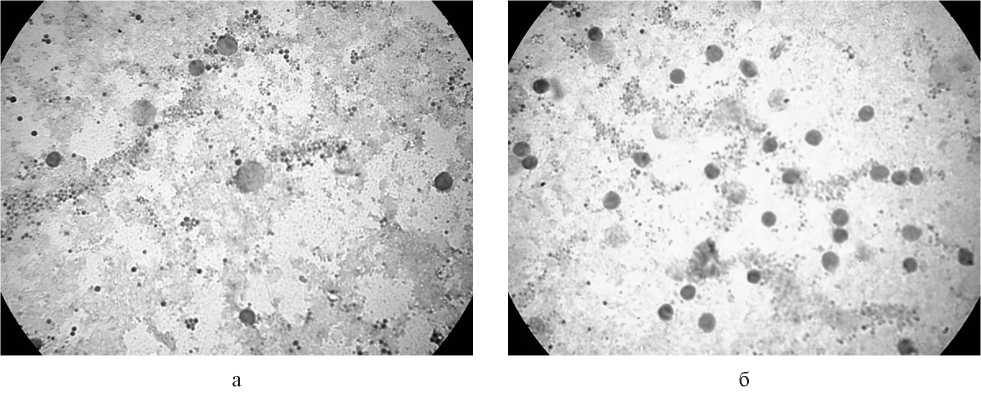
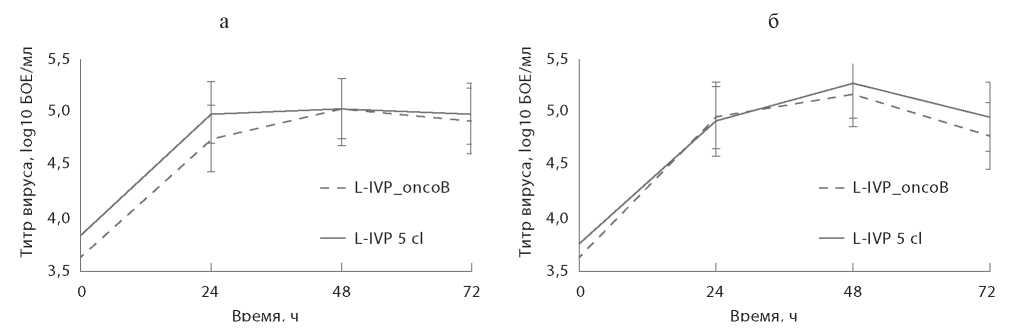
Результаты. Получен рекомбинантный вирус осповакцины L-IVP_oncoB, содержащий ген, кодирующий гранулоцитарно-макрофагальный колониестимулирующий фактор в области гена J2R, который кодирует тимидинкиназу. Кроме того, данный вирус содержит искусственно синтезированную генетическую конструкцию, кодирующую иммуноген, состоящий из эпитопов антигенов, гиперэкспрессируемых в злокачественных клетках при раке молочной железы, встроенную в область гена C11L (кодирует вирусный фактор роста). Показано, что проведённые модификации вирусного генома не оказывают влияния на ростовые характеристики вируса при культивировании на культурах клеток CV-1 и 4647, а также определена цитолитическая эффективность вируса в отношении раковых культур клеток различного генеза. В эксперименте in vivo выявлено, что полиэпитопная конструкция в составе генома L-IVP_oncoB способна инициировать изменение профиля цитокинов. Обсуждение. Полученные данные охарактеризовали L-IVP_oncoB как перспективный цитолитический и иммуностимулирующий агент и показали необходимость дальнейшего изучения его свойств в качестве средства онколитической иммунотерапии.
Заключение. Проведены основные эксперименты по оценке биологических свойств полученного L-IVP_oncoB, которые необходимы для характеризации онколитического вируса.
 49-56
49-56