Том 70, № 3 (2025)
- Год: 2025
- Выпуск опубликован: 21.07.2025
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/140
Весь выпуск
ОБЗОРЫ
Комбинированная лекарственная терапия как стратегия повышения эффективности и безопасности лечения инфекций вируса простого герпеса: возможные риски и перспективы
Аннотация
Вирусы простого герпеса (ВПГ) – чрезвычайно широко распространенные патогены, вызывающие у человека заболевания разной степени тяжести: от легких орофациальных изъязвлений кожи и слизистых оболочек до потенциально опасных для жизни энцефалита и тяжелых генерализованных форм инфекции или рецидивирующих герпетических поражений роговицы, приводящих к слепоте. Обычно для купирования рецидива инфекций ВПГ достаточно стандартного лечения, включающего ацикловир, пенцикловир или соответствующие пролекарства – валацикловир и фамцикловир. Однако пациенты со сниженным иммунным статусом вызывают особую озабоченность. Им часто требуется проведение длительной противовирусной терапии. В таких условиях значительно увеличивается риск развития у вируса лекарственной устойчивости, часто носящей перекрестный характер, т.к. все базовые противогерпетические препараты имеют схожий механизм действия и поражают одну лекарственную мишень – вирусную ДНК-полимеразу (ДНК-pol). При развитии лекарственной резистентности снижается эффективность лечения и возникает необходимость перехода к препаратам второго ряда с тяжелыми побочными эффектами. Таким образом, существует необходимость разработки новых альтернативных путей лечения. Создание препаратов, нацеленных на отличную от ДНК-pol биомишень, исключает риск перекрестной резистентности к ацикловиру и родственным препаратам, а их использование в комбинации с традиционными противогерпетическими препаратами может предотвратить или замедлить развитие лекарственной резистентности у вируса. Важно, что при комбинировании препаратов, воздействующих на инфекционный агент различными путями, терапевтический эффект может сохраняться при использовании более низких доз лекарственных средств благодаря синергическому характеру взаимодействия, что снижает вероятность развития нежелательных побочных эффектов лекарств. В обзоре представлены актуальные данные о состоянии и возможных перспективах развития комбинированной терапии инфекций, вызываемых ВПГ, полученные в результате проведения поиска литературы, связанной с антигерпесвирусной терапией, с использованием баз данных PubMed, Medline, РИНЦ, международного реестра клинических исследований Национального института здоровья США.
 205-216
205-216


Вирус Бомбали (Filoviridae: Orthoebolavirus: Orthoebolavirus bombaliense)
Аннотация
Актуальность. Представители рода Orthoebolavirus семейства Filoviridae вызывают у человека геморрагическую лихорадку с летальностью до 90%. Первые эпидемические вспышки заболевания, вызываемого представителями этого рода, были зарегистрированы в 1976 г. в Заире и Судане. Подобные вспышки регулярно возникают в Африке. Крупнейшая за всю историю наблюдений вспышка геморрагической лихорадки произошла в 2013–2016 гг. в Гвинее, Сьерра-Леоне и Либерии, в ходе которой были зарегистрированы случаи завоза заболевания в неэндемичные регионы. Очаги циркуляции представителей рода Orthoebolavirus (за исключением вируса Рестон) располагаются в зоне влажных тропических лесов Центральной и Западной Африки. Природным резервуаром филовирусов являются представители отряда рукокрылых (летучие мыши и крыланы). Последовательности геномной РНК вируса Эбола выделены у различных видов рукокрылых (Hypsignathus monstrosus, Epomops franqueti, Myonycteris tarquata), причем в последнее время обнаружены новые представители семейства Filoviridae.
Цель обзора. Провести анализ свойств нового представителя рода Orthoebolavirus семейства Filoviridae – вируса Бомбали (Orthoebolavirus bombaliense).
Материалы и методы. Материалом служили англоязычные научные издания, размещенные в базах цитирования RSCI, PubMed. Метод исследования – аналитический. Проведен анализ литературы за период с 2005 по 2023 г.
Результаты. Вирус Бомбали впервые был выделен в Гвинее в августе 2018 г. от летучих мышей Mops condylurus. При сравнении концентрации вируса Бомбали в органах инфицированных летучих мышей наибольший уровень накопления выявлен в легких, что косвенно свидетельствует о возможности аэрозольного инфицирования Mops condylurus. В дальнейшем РНК вируса Бомбали была выявлена с помощью полимеразной цепной реакции с обратной транскрипцией у летучих мышей Chaerephon pumilus в Сьерра-Леоне, но не в других видах насекомоядных и фруктоядных летучих мышей. Нуклеотидная последовательность геномной РНК вируса Бомбали в образцах, собранных в Гвинее, на 99,3% идентична таковой в образцах, собранных в Сьерра-Леоне, и на 98,3% в образцах, собранных в Кении. С учетом того, что летучие мыши Mops condylurus, как и большинство других видов насекомоядных летучих мышей, не могут перемещаться на значительные расстояния, это является косвенным свидетельством широкого распространения вируса Бомбали на Африканском континенте. Несмотря на то что случаи заболевания человека, вызванные вирусом Бомбали, до настоящего времени не выявлены, гликопротеин этого вируса (как и гликопротеины патогенных для человека филовирусов) имеет сродство с рецептором С1 белка Ниманна–Пика клеток человека.
Заключение. Изучение молекулярно-биологических характеристик вируса Бомбали, так же как и других недавно открытых новых представителей семейства Filoviridae, может дать ценную информацию для определения молекулярных маркеров патогенности для человека.
 217-223
217-223


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
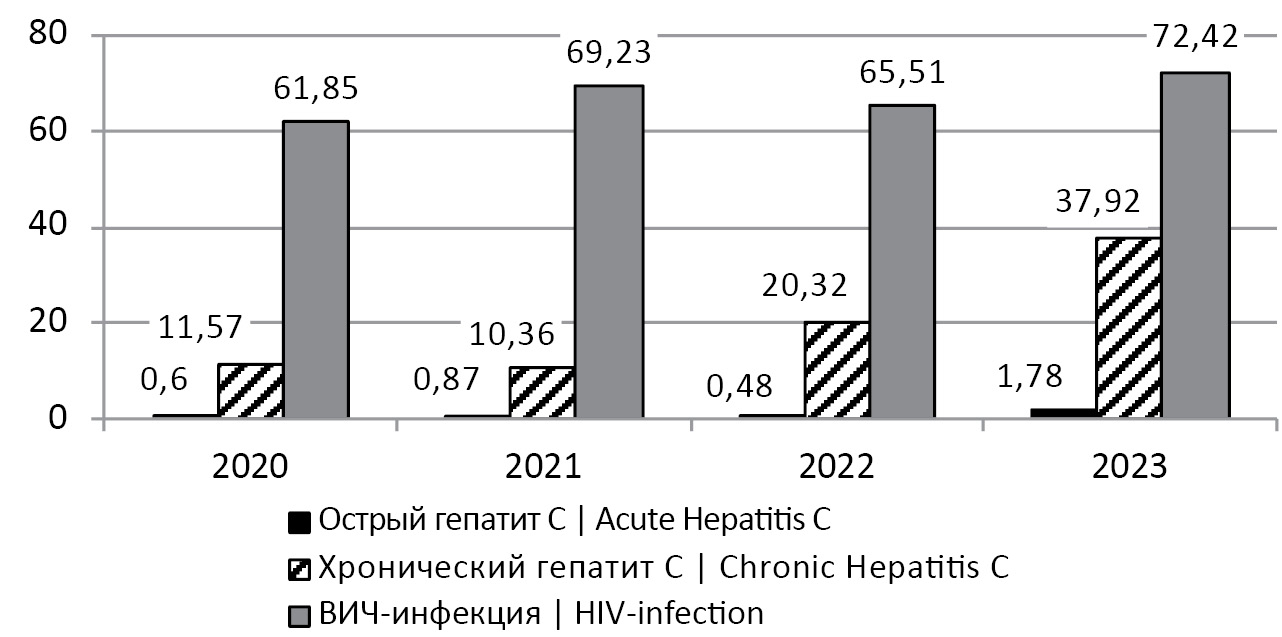
Анализ генетических полиморфизмов и мутаций лекарственной устойчивости в области NS5 генома ВГС (Flasuviricetes: Amarillovirales: Flaviviridae: Hepacivirus C) в образцах, полученных от ВИЧ-инфицированных лиц без опыта терапии в Алтайском крае в 2022–2023 гг.
Аннотация
Введение. Алтайский край в течение последних лет относится к региону, неблагополучному по инфекциям, вызванным вирусами иммунодефицита человека (ВИЧ) и гепатита С (ВГС). Наибольшую опасность представляет коинфекция ВИЧ-1 и ВГС. Существует необходимость оценки генетических вариантов ВГС и их лекарственной устойчивости (ЛУ) к препаратам прямого противовирусного действия (ПППД) у пациентов с коинфекцией ВИЧ-1 и ВГС.
Цель исследования. Определение генетического варианта ВГС и генетических особенностей вируса, связанных с его чувствительностью к ингибиторам NS5A и NS5B, в образцах, полученных от жителей Алтайского края без опыта терапии, с недавно выявленными ВИЧ-инфекцией и коинфекцией ВГС.
Материалы и методы. Коллекцию образцов плазмы крови, собранную в 2022–2023 гг. (n = 286) от ВИЧ-инфицированных лиц, подвергали анализу на наличие маркеров ВГС. Определяли концентрацию РНК ВГС в образцах, получали нуклеотидные последовательности (сиквенсы) фрагментов NS5A и NS5B и Core (для образцов ВГС 2k/1b), определяли субтип и проводили анализ ЛУ и полиморфных позиций.
Результаты. Антитела к ВГС были выявлены в 94/286 (32,86%) образцах, для 52 образцов были получены сиквенсы. К субтипам 3a, 1b, рекомбинантной форме 2k/1b и субтипу 1a относились 28 (53,85%), 17 (32,69%), 5 (9,62%) и один (1,92%) образец. Еще один образец содержал микс-инфекцию ВГС 1b + 3a. Чаще всего сниженная чувствительность и полная устойчивость выявлялись к ингибитору NS5A даклатасвиру: у 5,66 и 9,43% ВГС соответственно. Кроме того, в сиквенсах был выявлен ряд полиморфизмов.
Заключение. Полученные результаты могут косвенно свидетельствовать об увеличении доли ВГС субтипа 3a в эпидемии гепатита C в Алтайском крае, т.к. касаются лишь пациентов с недавно выявленной ВИЧ-инфекцией и коинфекцией ВГС. Данные о выявленных мутациях и генетических полиморфизмах должны быть учтены при назначении специфической терапии пациентам.
 224-233
224-233


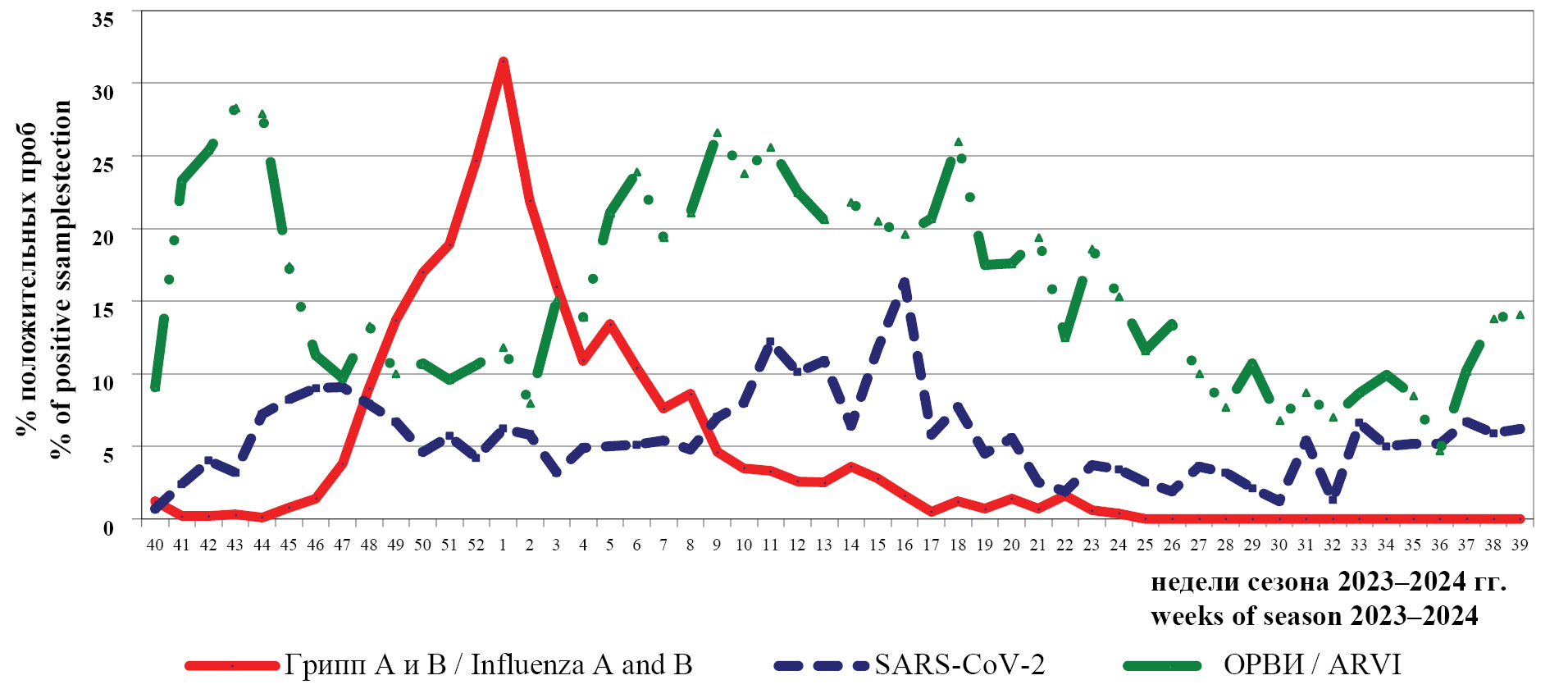
Эпидемический сезон 2023–2024 гг.: палитра возбудителей ОРВИ на некоторых территориях РФ и в регионах ВОЗ
Аннотация
Цель настоящей работы заключалась в определении особенностей циркуляции возбудителей острых респираторных вирусных инфекций (ОРВИ), в том числе вирусов гриппа и SARS-CoV-2, в период эпидемического сезона 2023–2024 гг. в регионах Всемирной организации здравоохранения (ВОЗ) и ряде регионов РФ.
Материалы и методы. В статье использованы вирусологические, иммунологические и статистические методы, а также аналитический материал сайта ВОЗ для оценки особенностей циркуляции возбудителей ОРВИ в регионах ВОЗ и на отдельных территориях РФ.
Результаты и обсуждение. Частота выявления положительных проб в клинических материалах составила: вирусов гриппа 7,7%, ОРВИ – 17,1% и SARS-CoV-2 – 6,5%. По антигенным и молекулярно-генетическим свойствам популяция доминирующего подтипа вируса гриппа A(H3N2) была гетерогенной и отличалась от вакцинного штамма. Сохранен благоприятный профиль чувствительности эпидемических штаммов к препаратам с антинейраминидазной активностью (осельтамивиру и к занамивиру) и ингибитору кэп-зависимой эндонуклеазы (балоксавиру марбоксилу). Отмечена тенденция к росту активности таких респираторных патогенов, как: HPIV, HAdV, HRsV, HRV, HCoV и HMPV. Экспертами ВОЗ выработаны рекомендации по составу гриппозных вакцин для стран Северного и Южного полушарий с заменой компонента вируса гриппа A(H3N2): А/Дарвин/9/2021 на A/Таиланд/8/2022 и А/Хорватия/10136RV/2023 соответственно. Продолжают регистрировать случаи инфицирования людей вирусами гриппа птиц и свиней.
Заключение. На фоне относительно низкой циркуляции новых вариантов SARS-CoV-2 в сезоне 2023-2024гг., в странах Северного полушария регистрировали эпидемическую активность вирусов гриппа в традиционные сроки. В глобальном масштабе его начало было связано с вирусом гриппа A(H3N2), затем регистрировали рост активности вируса гриппа A(H1N1) pdm09 и гриппа В. Прослежены, как и в предыдущие сезоны, различия по долевому участию вирусов гриппа в регионах ВОЗ, в том числе, и по городам РФ.
 234-245
234-245


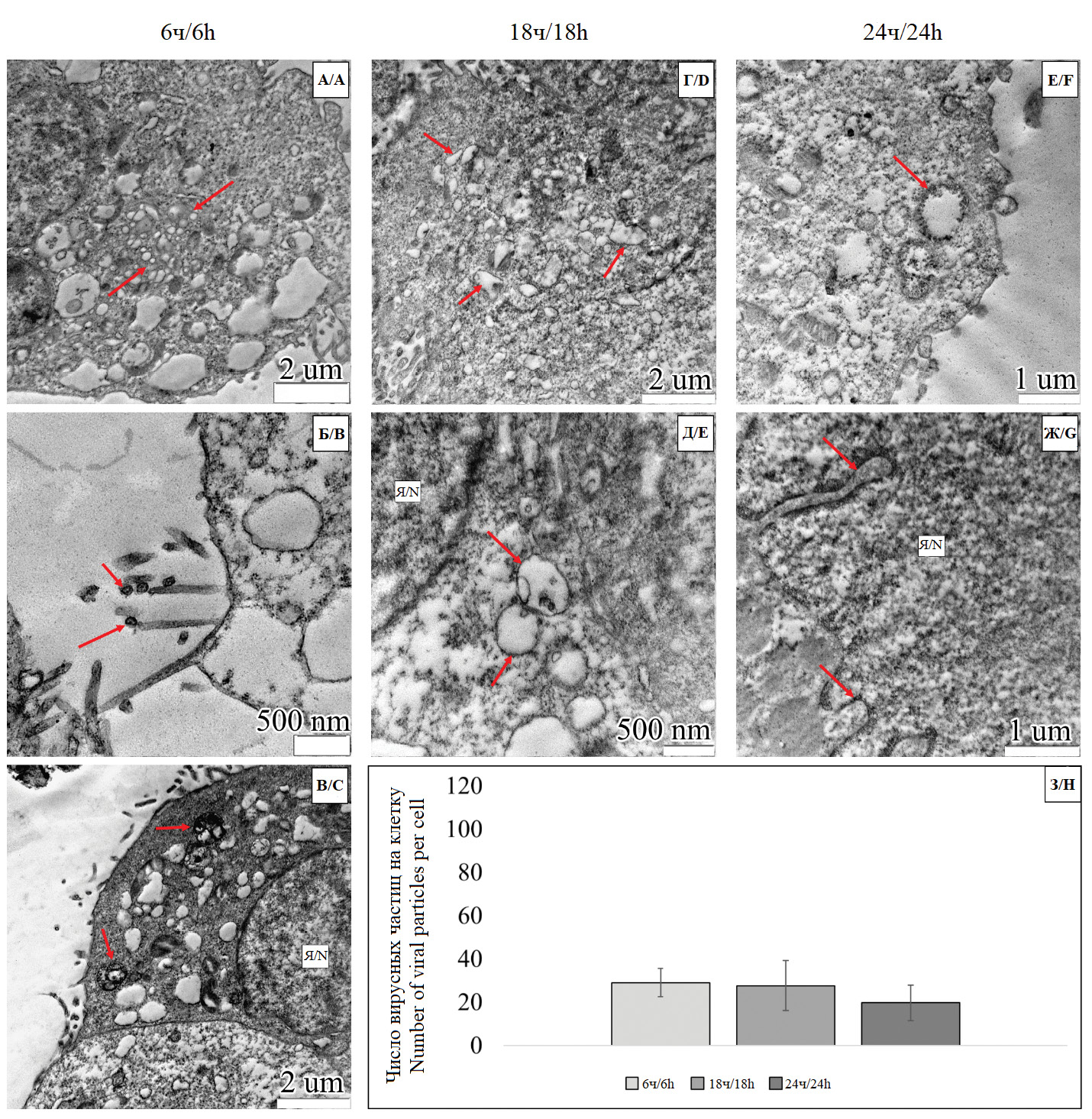
Ультраструктурная организация и репродукция вирионов в клетках линии Vero (E6) в условиях моноинфицирования вирусом гриппа A/H1N1 pmd09 и коинфицирования в сочетании с SARS-CoV-2 (штаммы Delta и Omicron)
Аннотация
Введение. РНК-содержащие вирусы, в особенности вирусы гриппа, представляют высокую эпидемиологическую значимость. Манифестация COVID-19 привела к регистрации случаев коинфекции, патогенез которой в значительной степени неясен. Линия Vero (E6) широко применяется для исследования морфогенеза различных вирусов, включая грипп и коронавирус.
Цель работы – исследование ультраструктуры клеток линии Vero (E6) и репродукции вирусных частиц при моноинфицировании вирусом гриппа А и коинфицирования этого вируса с двумя геновариантами SARS-CoV-2 в динамике через 6, 18 и 24 ч после инокуляции.
Материалы и методы. Для проведения in vitro исследования воздействия вирусной инфекции и анализа динамики изменения количества внутриклеточных вирусных частиц использовали модель клеточной линии Vero (E6). В исследовании задействовали 4 экспериментальные группы: клетки линии Vero (E6), моноинфицированные вирусом гриппа штамма A/H1N1 pmd09 в дозовой нагрузке 0,1 MOI; клетки линии Vero (E6), коинфицированные вирусом гриппа штамма A/H1N1 pmd09 в сочетании со штаммом Delta SARS-CoV-2 в суммарной дозовой нагрузке 0,1 MOI; клетки линии Vero (E6), коинфицированные вирусом гриппа штамма A/H1N1 pmd09 в сочетании со штаммом Omicron SARS-CoV-2 в суммарной дозовой нагрузке 0,1 MOI. В каждой исследуемой группе осуществляли отбор клеток на временны́х точках 6, 18 и 24 ч.
Результаты. Во всех группах спустя 6 ч патологических структур, помимо вируссодержащих транспортных везикул, не выявлено. Через 18 ч была отмечена вакуолизация эндоплазматического ретикулума, в разной степени характерная для всех исследуемых групп. Спустя 24 ч во всех группах ультраструктурные изменения встречались сравнительно чаще относительно этапов 6 и 18 ч и выражались в вакуолизации органелл и/или уплотнении цитоплазмы. Статистический анализ динамики количества вирусных частиц внутри групп показал тенденцию на возрастание этого параметра до стадии 24 ч в группе моноинфицирования. Однако ни одна из групп коинфекции не демонстрировала тенденции на изменение количества вирусных частиц, поскольку статистически значимых различий между стадиями 6, 18 и 24 ч выявлено не было.
Заключение. Полученные результаты позволили выдвинуть предположение о том, что взаимодействие вирусов гриппа A/H1N1 pmd09 и SARS-CoV-2 способствовало общему снижению образования новых вирионов в клетках линии Vero (E6) в обоих случаях коинфицирования.
 246-253
246-253


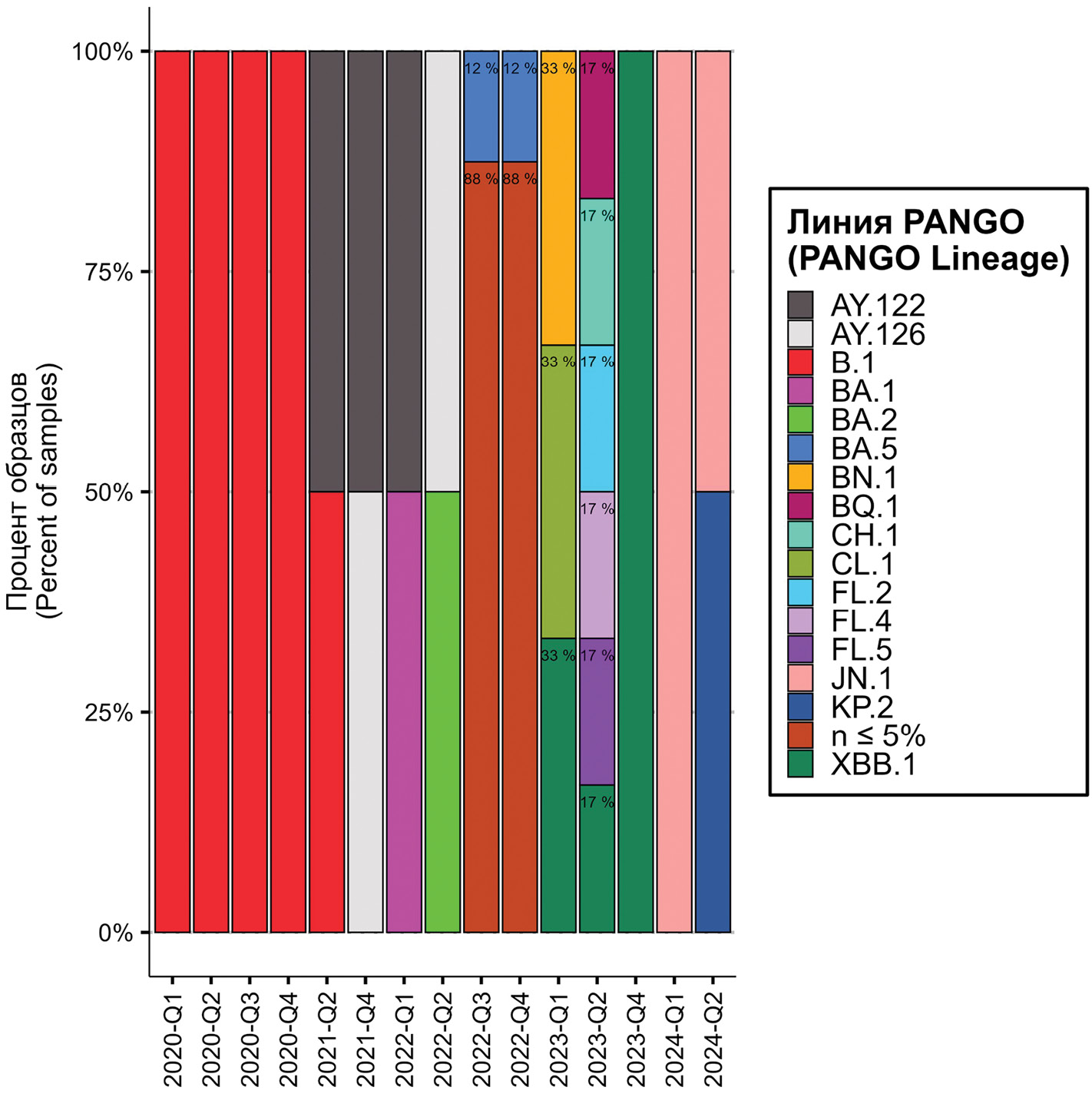
Влияние пандемии COVID-19 на этиологию и тяжесть респираторных вирусных инфекций у детей
Аннотация
Цель. Проанализировать вклад вирусов гриппа, респираторно-синцитиального вируса (РСВ), вируса SARS-CoV-2 и других возбудителей в развитие тяжелых острых респираторных инфекций (ТОРИ) у детей разных возрастных групп в зависимости от их этиологии и эпидемического периода.
Материалы и методы. Мониторинг ТОРИ проведен на протяжении 6 последовательных эпидемических сезонов, начиная с сезона 2018–2019 гг., в 9 стационарах трех городов России с определением тяжести болезни в зависимости от ее этиологии.
Результаты. В общей выборке доля детей, госпитализированных с лабораторно подтвержденным гриппом, в период 2018–2020 г. составляла 25,7–44,7%, с РСВ-инфекцией – 25,7–26,8%, но опустилась до 0,3 и 1,7% соответственно в разгар пандемии. В последующие 3 сезона 2021–2024 гг. лабораторно подтвержденный грипп среди детей регистрировали в 4,5–20,2% случаев, РСВ-инфекцию – в 13,4–24,1% со сменой подгрупп вируса. РСВ-инфекция была наиболее тяжелой в сезон 2022–2023 гг., протекая в ряде случаев с явлениями гипертермии, гипоксии, одышки и нарушением сознания. Среди госпитализированных детей доля больных COVID-19 в 2020–2021 гг. составила 0,8–2,4%, но увеличилась до 10,6–13,6% с появлением варианта Omicron в 2022 г. при снижении в последующие годы. Представлены основные генетические линии SARS-CoV-2, циркулировавшие в Российской Федерации.
Заключение. Вирусы гриппа и РСВ преобладали в структуре вирусных патогенов, выявленных у госпитализированных детей в возрасте до 2 лет включительно. Случаи COVID-19 у детей регистрировались редко, уступая по тяжести РСВ и риновирусной инфекции.
 254-266
254-266


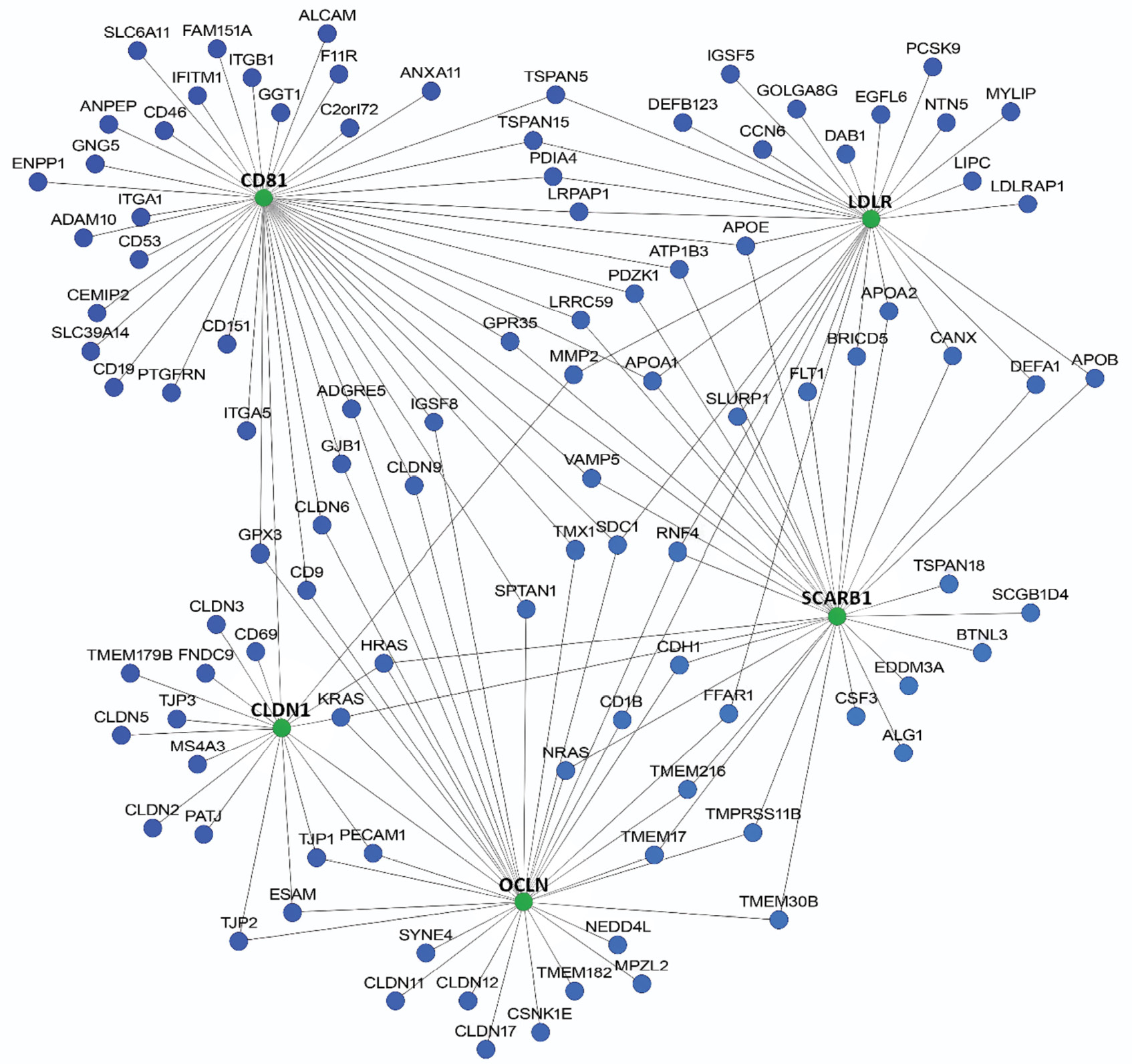
Выявление генов человека, потенциально участвующих в патогенезе вирусного гепатита С, на основе мультисетевого биоинформатического анализа
Аннотация
Цель. Поиск генов человека, потенциально участвующих в патогенезе гепатита С (ГС), методом мультисетевого биоинформатического анализа связей белков, задействованных на стадиях прикрепления и проникновения вируса гепатита С (ВГС) в клетку.
Материалы и методы. Для анализа генетических и белок-белковых сетей использовали ряд веб-приложений, алгоритмы и базы данных которых дополняют друг друга. В качестве базовых генов использовали гены CD81, CLDN1, LDLR, OCLN, SCARB1, продукты которых участвуют во взаимодействии с вирусными гликопротеинами Е1 и Е2 на стадии прикрепления и проникновения ВГС в клетку. Проведен анализ данных, включающий двухэтапное балльное ранжирование выявленных генов-кандидатов по их взаимодействию с базовыми генами и присутствию в результатах сетевого анализа разных веб-ресурсов.
Результаты. При использовании трех веб-ресурсов были первично выявлены гены-кандидаты: HumanNet – 100 генов-кандидатов, GeneMania – 20, STRING – 98. По результатам пересечения трех веб-ресурсов, общее число генов-кандидатов, связанных с базовыми генами, составило 170. Общее число генов с рангом выше 4 баллов составило 35. Гены-кандидаты были сгруппированы в функциональные наборы: клеточные барьеры и межклеточные контакты (17 генов, 48,6%); липидный обмен и липопротеины (9 генов, 25,7%); иммунный ответ и взаимодействие с вирусом (5 генов, 14,3%); сигнальные пути, протеолиз и цитоскелет (4 гена, 11,4%). Выявлены следующие гены-кандидаты, потенциально участвующие в патогенезе ГС: APOA1, CLDN3, APOE, LIPC, LRPAP1, CSNK1E, APOB, CD19, CLDN6, CLDN9, ESAM, F11R, IFITM1, LDLRAP1, PCSK9, TJP1, CD9, CLDN11, CLDN17, CLDN2, CLDN5, IGSF8, MMP2, PDZK1, ADAM10, APOA2, C3, CLDN12, DAB1, GJB1, ITGB1, MYLIP, NEDD4L, PTGFRN.
Заключение. В дальнейшем детальное изучение функциональных особенностей и полиморфных вариантов выявленных генов с применением биоинформатических и лабораторных методов может существенно расширить современные представления о вовлеченности генов человека в развитие ГС и открыть новые мишени для разработки лекарственных препаратов и терапевтических стратегий.
 267-281
267-281


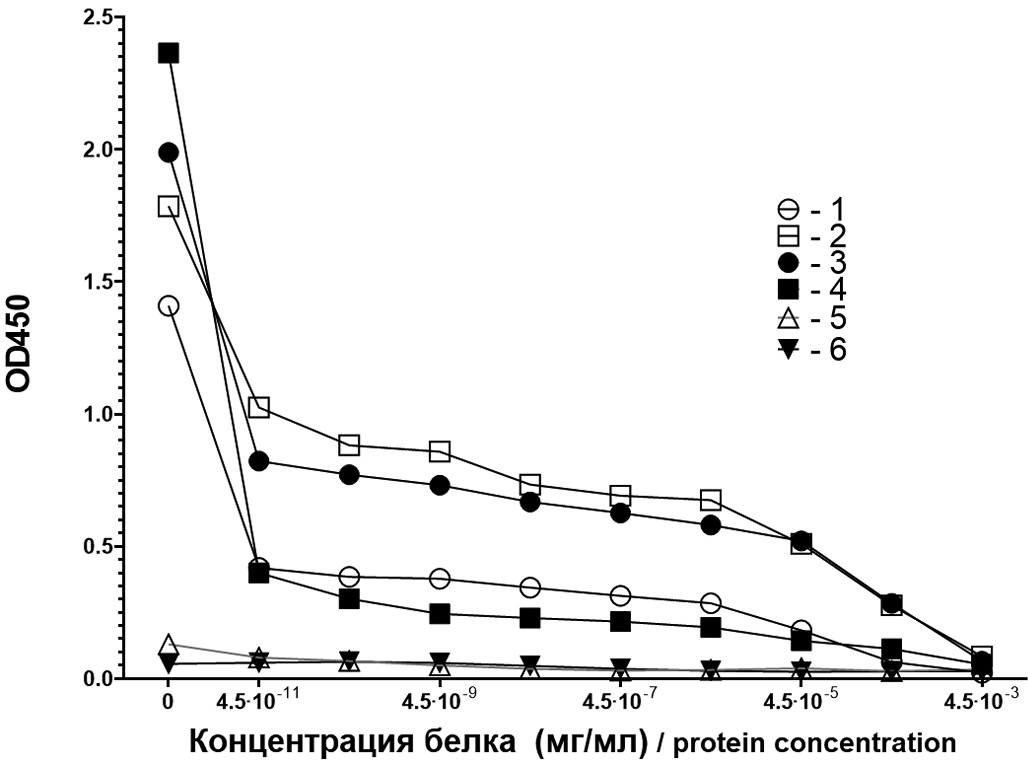
Рекомбинантный VP1 норовируса генотипа GII.4 (Caliciviridae: Norovirus) способен индуцировать выработку перекрестно-реагирующих антител
Аннотация
Введение. Норовирусы (НВ) являются одной из основных причин острого гастроэнтерита. В настоящее время отсутствует лицензированная вакцина против норовирусной инфекции. Разрабатываемые вакцины основаны на капсидном белке VP1, способном к формированию вирусоподобных частиц.
Целью настоящей работы стала характеристика иммуногенных свойств рекомбинантного VP1 НВ и оценка перекрестной реактивности антител против него с различными геновариантами НВ.
Материалы и методы. В сыворотке крови животных, иммунизированных полученным авторами рекомбинантным белком VP1, c помощью иммуноферментного анализа определяли титры и авидность суммарных антител и антител класса М (IgM) против VP1 HB. Способность полученных антител взаимодействовать с НВ разных генотипов оценивали с помощью иммуноэлектронной микроскопии.
Результаты. Рекомбинантный белок VP1 индуцировал образование у животных антител в высоких титрах. Суммарные антитела против VP1 имели высокую авидность, достигающую 100%, что предполагает наличие у них вируснейтрализующей активности. Антитела класса IgM обладали низкой авидностью. Методом иммуноэлектронной микроскопиии показано, что IgG-антитела против VP1 генотипа GII.4 взаимодействуют с НВ генотипа GII.7 и GII.17.
Заключение. Полученный рекомбинантный белок индуцирует выраженный иммунный ответ с формированием высокоавидных поликлональных перекрестно-реагирующих антител, что позволяет рассматривать его как антигенный компонент прототипа кандидатной вакцины против НВ человека.
 282-290
282-290