Impact of COVID-19 pandemic on the etiology and severity of respiratory viral infections in children
- Authors: Sominina A.А.1, Danilenko D.M.1, Komissarov A.B.1, Fadeev A.V.1, Komissarova K.S.1, Pisareva M.M.1, Musayeva T.D.1, Eder V.A.1, Levanyuk T.P.1, Stolyarov K.A.1, Krivitskaya V.Z.1, Petrova E.R.1, Afanasyeva O.I.1, Timonina V.S.2, Obraztsova E.V.1, Golovacheva E.G.1, Dondurey E.A.1,2, Lelenkova E.V.3, Kurskaya O.G.4, Shestopalov A.M.4, Lioznov D.A.1,5
-
Affiliations:
- Smorodintsev Research Institute of Influenza, Ministry of Health
- SPB GUBZ St. Olga Children’s City Hospital
- Federal Scientific Research Institute of Viral Infections “Virom”, Rospotrebnadzor
- Federal Research Center for Fundamental and Translational Medicine, Research Institute of Virology
- First St. Petersburg State Medical University named after Academician I. P. Pavlov
- Issue: Vol 70, No 3 (2025)
- Pages: 254-266
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/16745
- DOI: https://doi.org/10.36233/0507-4088-313
- EDN: https://elibrary.ru/HOFTVE
- ID: 16745
Cite item
Full Text
Abstract
Objective. To analyze the age-related characteristics of the contribution of influenza viruses, RSV, SARS-CoV-2, other pathogens to the development of severe acute respiratory infections (SARI) in children with an assessment of the disease severity depending on its etiology and epidemic period.
Materials and methods. SARI monitoring was carried out over six consecutive epidemic seasons, starting from 2018–2019 in 9 infectious hospitals of three cities of Russia with an assessment of the disease severity depending on its etiology.
Results. Among all hospitalized children, the proportion of children hospitalized with laboratory-confirmed influenza from 2018 to 2020 ranged from 25.7% to 44.7%, and for RSV infection from 25.7% to 26.8%. However, during the peak of the pandemic, these rates dropped significantly to 0.3% and 1.7%, respectively. In the subsequent three seasons (2021–2024), laboratory-confirmed influenza among hospitalized children was registered in 4.5–20.2% of cases, while RSV infection was identified in 13.4–24.1% of cases, accompanied by a shift in viral subgroups. RSV infections were most severe during the 2022–2023 season, presenting in some cases with hyperthermia, hypoxia, dyspnea, and altered consciousness. Among hospitalized children, the proportion with COVID-19 was relatively low in 2020–2021 (0.8–2.4%) but increased significantly to 10.6%–13.6% following the emergence of the Omicron variant in 2022, before decreasing again in subsequent years. The main genetic lineages of SARS-CoV-2 circulating in the Russian Federation are presented.
Conclusion. Influenza and RSV viruses were predominant among viral pathogens identified in hospitalized children aged ≤ 2 years. COVID-19 cases among children were relatively rare and generally less severe compared to RSV and rhinovirus infections.
Keywords
Full Text
Введение
В последние годы все явственнее осознается необходимость включения в существующие системы надзора за возбудителями респираторных вирусных инфекций дополнительного раздела, предназначенного для анализа тяжелых форм респираторных инфекций (ТОРИ), требующих госпитализации. В начале последнего столетия возникла идея создания Глобальной системы госпитального надзора за гриппом (GIHSN) [1], в которой применялись бы стандартизованные системы сбора и представления клинической информации по особенностям течения гриппа с использованием определенных критериев оценки тяжести заболевания, а также оценки эффективности гриппозных вакцин для их предупреждении [2, 3]. В настоящее время в систему GIHSN, в которой принимали также активное участие ученые ФГБУ «НИИ гриппа им. А.А. Смородинцева» и ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» [4, 5], включилось более 20 разных стран мира. При этом изучение полногеномной структуры вирусов, вызывающих ТОРИ, открыло дополнительные возможности определения детерминант патогенности у определенных вариантов возбудителя [6], а оперативное представление данных по генетической структуре гемагглютинина и нейраминидазы вирусов гриппа в Всемирную организацию здравоохранения (ВОЗ), в том числе через базу данных GISAID, обеспечило возможности оптимизации штаммового состава гриппозных вакцин [7]. Оценка клинической тяжести заболеваний представит особую важность в случае возникновения новых возбудителей пандемии [8]. Все больший интерес проявляется к вопросу о факторах риска развития ТОРИ, в особенности среди детей и лиц пожилого возраста.
Цель исследования – проанализировать вклад вирусов гриппа, респираторно-синцитиального вируса (РСВ), SARS-CoV-2 и других возбудителей в развитие ТОРИ у детей разных возрастных групп с оценкой тяжести заболеваний в зависимости от их этиологии и эпидемического периода.
Материалы и методы
Мониторинг гриппа, COVID-19 и других ОРВИ среди госпитализированных детей проводили на протяжении 6-летнего периода в 9 инфекционных стационарах Санкт-Петербурга, Новосибирска и Екатеринбурга в соответствии с единым для всех исполнителей Протоколом обследования больных и стандартным определением случая заболевания. В соответствии с международными правилами, принятыми в системе сигнального и госпитального надзора за гриппом, всех пациентов, нуждающихся в госпитализации, относили к категории ТОРИ. На каждого пациента заполняли Индивидуальную карту больного (ИКБ), в которой отражали пол, возраст, рост и вес больного, даты заболевания, госпитализации и выписки, диагноз (по МКБ-10) при поступлении и выписке, исход заболевания, результаты диагностики с применением метода полимеразной цепной реакции (ПЦР), прием антивирусных препаратов и вакцинацию в анамнезе, сопутствующие заболевания, а также определенные критерии оценки тяжести каждого заболевания. Исследование проводили в соответствии с принципами надлежащей врачебной практики (GCP) после его одобрения локальными этическими комитетами. Госпитальный мониторинг (ГМ) начинали после выявления первых трех лабораторно подтвержденных случаев гриппа (ЛПГ), в период пандемии SARS-CoV-2 – на протяжении всего сезона. Критерии включения и исключения пациентов из исследования, а также сбор данных и проведение ПЦР-анализа для выявления РНК вирусов гриппа и других ОРВИ выполняли, как ранее описано [9].
Для выявления РНК коронавируса SARS-CoV-2 использовали набор реагентов «АмплиПрайм SARS-CoV-2/Flu (A/B/H1pdm09)», предназначенный для выявления РНК коронавируса SARS-CoV-2 тяжелого острого респираторного синдрома (COVID-19) и вирусов гриппа А, B (ООО «НекстБио», Москва), или тест-систему «Интифика SARS-CoV-2» («Алкор Био», Санкт-Петербург). ПЦР в реальном времени проводили на Rotor-Gene 6000 (Corbett Research, Австралия) или в системе CFX96 Touch (BIO-RAD, США).
Определение показателей тяжести течения заболевания проводили в последние три сезона (с 2021–2022 по 2023–2024 гг.) по ряду введенных в ИКБ критериев тяжести, таких как гипертермия (температура выше 39 °С), гипоксия, снижение концентрации О2 в крови ниже возрастной нормы, одышка, геморрагический синдром, нарушение сознания. Частоту регистрации каждого из признаков при изучаемых инфекциях выражали в процентах. Степень тяжести заболевания определяли по совокупности включенных критериев раздельно для каждого из сезонов. Для этого рассчитывали среднее значение регистрируемых частот обнаружения исследованных критериев тяжести (Мт) в процентах и доверительные интервалы (ДИ). Дополнительно с этой целью определяли возрастные отличия в этиологии ТОРИ у детей, госпитализированных на общие отделения для ОРВИ (ОТД) и в Отделения интенсивной терапии и реанимации (ОРИТ) за 6-летний период наблюдений.
Этическое утверждение. Исследование проводилось при добровольном информированном согласии пациентов или законных представителей несовершеннолетних пациентов. Протоколы исследования одобрены Этическим комитетом ФГБУ «НИИ гриппа им. А.А. Смородинцева» (Протоколы № 215 от 31.01.2024, № 194 от 12.12.2022, № 178 от 10.01.2022, № 161 от 14.12.2020, № 149 от 18.12.2019, № 136 от 21.12.2018, № 120 от 18.12.2017).
Статистическую обработку результатов проводили с использованием программы Statistica 10: описательная статистика, непараметрические критерии. При оценке количественных показателей в качестве центра распределения была рассчитана медиана (Ме), а в качестве показателей вариации – первый (Q1) и третий квартили (Q3). Результаты качественных признаков выражали в абсолютных числах (абс.) с указанием долей (%). Сравнение номинальных данных в группах проводили при помощи критерия χ2 Пирсона. В тех случаях, когда число ожидаемых наблюдений в любой из ячеек четырехпольной таблицы было менее 10, для оценки уровня значимости различий использовали точный критерий Фишера. Статистически значимыми считались различия при p ≤ 0,05.
Секвенирование вирусов SARS-CoV-2. Полногеномную амплификацию (WGA) генома вируса SARS-CoV-2 проводили с использованием набора Midnight 1200bp amplicon primer set и набора BioMaster RT-PCR-Premium («Биолабмикс», Россия). Подготовку библиотек для платформы секвенирования MGI осуществляли с использованием набора Fast PCR-FREE FS DNA Library Prep Set (MGI, Китай). Секвенирование проводили на приборе MGI DNBSEQ-G400 с использованием набора высокопродуктивного секвенирования FCL SE100. Подготовку библиотек для платформы секвенирования Illumina осуществляли с помощью набора Illumina DNA Prep kit (Illumina, США). Секвенирование проводили на приборе Illumina Miseq с использованием набора реагентов V3 600-cycle MiSeq Reagent kit, а на приборе Illumina NextSeq – P2 100-cycle Reagent kit. Консенсусные последовательности вирусов для дальнейшего филогенетического анализа получали с помощью пакетов программ BWA, Samtools, Bcftools, Ivar и Lofreq.
Результаты
Выбор периода исследования ТОРИ у детей
Период наблюдений охватывал предпандемический сезон 2018–2019 гг., когда в России была зарегистрирована достаточно интенсивная эпидемия, вызванная вирусами гриппа A(H1N1)pdm09 и A(H3N2). Затем следовал исторически значимый период 2019–2020 гг., когда по окончании эпидемии гриппа, вызванной вирусами гриппа A(H1N1)pdm09 и В, в России появился в циркуляции новый коронавирус – SARS-CoV-2 и в марте 2020 г. ВОЗ объявила начало пандемии COVID-19. Следующие сезоны 2020–2021 и 2021–2022 гг. характеризовались активной циркуляцией SARS-CoV-2, которая заметно снизилась в сезон 2022–2023 гг. с завершением пандемии, объявленным ВОЗ в мае 2023 г., и постпандемический сезон 2023–2024 гг.
Возрастное распределение детей, госпитализированных с ТОРИ
За указанный период в клиническое исследование с ПЦР-расшифровкой этиологии и оценкой тяжести заболевания было включено 17 712 детей. В среднем за год обследовали 2952 ребенка (95% ДИ 2271–3633) с увеличением объемов исследований в последние 2 года. Медиана возраста для младшей возрастной группы составила 11 мес (95% ДИ 5–23), для группы 3–6 лет – 4,25 года (95% ДИ 3,5–5,3), для группы 7–17 лет – 10,3 года (95% ДИ 8,4–12,5). Бо́льшая часть поступивших больных находилась в состоянии средней тяжести, доля пациентов с тяжелыми формами заболевания, направленных в ОРИТ, составила в среднем за весь период наблюдения 6,5%. Частота госпитализации в ОРИТ была наиболее высокой в сезон развившейся пандемии SARS-CoV-2 (2020–2021 гг.), когда, в отличие от других периодов, чаще других госпитализировали детей школьного возраста (7–17 лет) (р < 0,1). В целом за весь период наблюдений наиболее уязвимой, судя по частоте госпитализации в ОРИТ (7,1%), была младшая возрастная группа детей – 0–2 лет (р < 0,001) (табл. 1).
Таблица 1. Возрастное распределение детей, госпитализированных с тяжелыми острыми респираторными инфекциями, в том числе в отделения реанимации и интенсивной терапии
Table 1. Age distribution among children hospitalized with severe acute respiratory infections, including in intensive care units
Сезон Season | Количество детей с ТОРИ Number of children with SARI | Распределение по возрастам (лет) Distribution by age (years) | Из них госпитализировано в ОРИТ (%)* Proportion of those admitted in ICU (%)* | |||||
0–2 | 3–6 | 7–17 | всего total | 0–2 | 3–6 | 7–17 | ||
2018–2019 | 2131 | 1218 | 577 | 336 | 3,8 | 3,9 | 3,3 | 4,5 |
2019–2020 | 2395 | 1186 | 723 | 486 | 6,1 | 7,4 | 5,5 | 3,9 |
2020–2021 | 2217 | 1199 | 649 | 369 | 10,6 | 10,5 | 9,7 | 12,7 |
2021–2022 | 3033 | 1788 | 678 | 567 | 7,3 | 6,7 | 8,3 | 8,1 |
2022–2023 | 3843 | 1930 | 791 | 1122 | 7,6 | 8,7 | 8,3 | 5,4 |
2023–2024 | 4093 | 1959 | 794 | 1340 | 4,4 | 5,8 | 3,0 | 3,1 |
Всего Total | 17712 | 9280 | 4212 | 4220 | 6,5 | 7,1 | 6,4 | 5,5 |
Примечание. * – приведены проценты от числа госпитализированных детей по возрастным группам. Здесь и в табл. 2, 3 наиболее значимые показатели выделены цветом.
Note. * – proportions of hospitalized children are given by age groups. Here and in Tables 2, 3 the most significant values are highlighted in color.
Влияние пандемии SARS-CoV-2 на этиологию ТОРИ у госпитализированных детей
Вирусы гриппа. Среди всех госпитализированных доля детей с ЛПГ зависела от эпидемического сезона и была наиболее высокой в предпандемический период (сезоны 2018–2019 и 2019–2020 гг.), когда она варьировала в среднем в пределах от 25,7 до 44,7% и была достоверно выше (р < 0,001) в группе детей 7–17 лет по сравнению с младшей возрастной группой 0–2 лет. В разгар пандемии (октябрь 2020 г. – сентябрь 2021 г.) частота диагностирования (ЧД) гриппа среди госпитализированных детей была крайне низкой и не превышала 0,3%. В сезон 2021–2022 гг. в циркуляцию вернулись вирусы гриппа A(H3N2), однако их ЧД в стационарах была достоверно ниже (р < 0,001), чем в предпандемический период (от 4,5 до 15,3% в зависимости от возраста). В следующую эпидемию (2022–2023 гг.) была зарегистрирована социркуляция вирусов гриппа A(H1N1)pdm09 и В; ЧД гриппа повысилась по сравнению с предыдущим сезоном в 1,3–2,5 раза, но, как и при эпидемии сезона 2023–2024 гг., вызванной вирусом гриппа A(H3N2), оставалась достоверно ниже в сравнении с предпандемическим периодом (р < 0,05) (табл. 2).
Таблица 2. Частота ПЦР-детекции основных возбудителей ТОРИ среди госпитализированных детей в зависимости от возраста и эпидемического сезона
Table 2. Frequency of PCR detection of main SARI pathogens in hospitalized children, depending on age and epidemic season
Вирус Virus | Эпидемический сезон Epidemic season | Доминирующий подтип Dominating subtype | Частота детекции вирусов в возрастных группах (лет) Percent of virus detection in age groups (years) | ||
0–2 | 3–6 | 7–17 | |||
Грипп Influenza | 2018–2019 | A(H1N1)pdm09 + A(H3N2) | 28,0 | 40,7 | 39,6 |
2019–2020 | A(H3N2) + B | 25,7 | 44,1 | 44,7 | |
2020–2021 | Нет | 0,0 | 0,3 | 0,0 | |
2021–2022 | A(H3N2) | 4,5 | 12,5 | 15,3 | |
2022–2023 | A(H1N1)pdm09 + B | 11,5 | 19,3 | 20,2 | |
2023–2024 | A(H3N2) | 8,2 | 14,1 | 12,5 | |
SARS-CoV-2 | 2018–2019 | Нет / NO | 0,0 | 0,0 | 0,0 |
2019–2020 | B.1 | 0,0 | 0,0 | 0,0 | |
2020–2021 | Delta AY.122, AY.126 | 1,2 | 0,8 | 2,4 | |
2021–2022 | Delta AY.122, AY.126 (2021), затем Omicron BA.1, BA.2–BA.5 (2022) Delta AY.122, AY.126 (2021), then Omicron BA.1–BA.5 (2022) | 10,6 | 6,8 | 13,6 | |
2022–2023 | Omicron (разные сублинии) Omicron (different sublineages) | 4,7 | 1,5 | 4,0 | |
2023–2024 | Новые сублинии Omicron New Omicron sublineages | 7,6 | 1,8 | 2,8 | |
РСВ RSV | 2018–2019 | РСВ-В (74,1%) | 26,8 | 16,5 | 4,8 |
2019–2020 | РСВ-А (43,8%) + РСВ-В (56,2%) | 25,7 | 13,6 | 3,3 | |
2020–2021 | РСВ-А (85,7%) | 1,7 | 1,2 | 0,3 | |
2021–2022 | РСВ-А (67,6%) | 13,4 | 6,9 | 2,1 | |
2022–2023 | РСВ-В (96,2%) | 24,1 | 12,1 | 3,8 | |
2023–2024 | РСВ-А (52,4%) + РСВ-В (47,6%) | 22,4 | 10,7 | 2,7 | |
Метапневмовирус Metapneumovirus | 2018–2019 | – | 7.4 | 8.5 | 3.0 |
2019–2020 | – | 2,4 | 4,0 | 1,4 | |
2020–2021 | – | 19,5 | 29,3 | 11,7 | |
2021–2022 | – | 0,1 | 0,6 | 0 | |
2022–2023 | – | 4,2 | 4,9 | 2,9 | |
2023–2024 | – | 6,4 | 7,7 | 2,2 | |
Риновирусы Rhinoviruses | 2018–2019 | – | 10,1 | 11,3 | 7,4 |
2019–2020 | – | 10,2 | 8,3 | 5,1 | |
2020–2021 | – | 16,6 | 14,6 | 14,6 | |
2021–2022 | – | 13,8 | 13,0 | 6,5 | |
2022–2023 | – | 14,2 | 13,7 | 12,2 | |
2023–2024 | – | 11,9 | 11,1 | 7,5 | |
Примечание. «–» – нет данных. Общее число РСВ с определенными генетически подгруппами в сезон 2018–2019 гг. составило 359 штаммов, в сезон 2019–2020 гг. – 267, в 2020–2021 гг. – 28, в 2021–2022 гг. – 71, в 2022–2023 гг. – 239, в 2023–2024 гг. – 391 штамм.
Note. «–» – no data. The total number of RSV with genetically defined subgroups in the 2018–2019 season was 359 strains, in the 2019–2020 season – 267, in 2020–2021 – 28, in 2021–2022 – 71, in 2022–2023 – 239, in 2023–2024 – 391 strains.
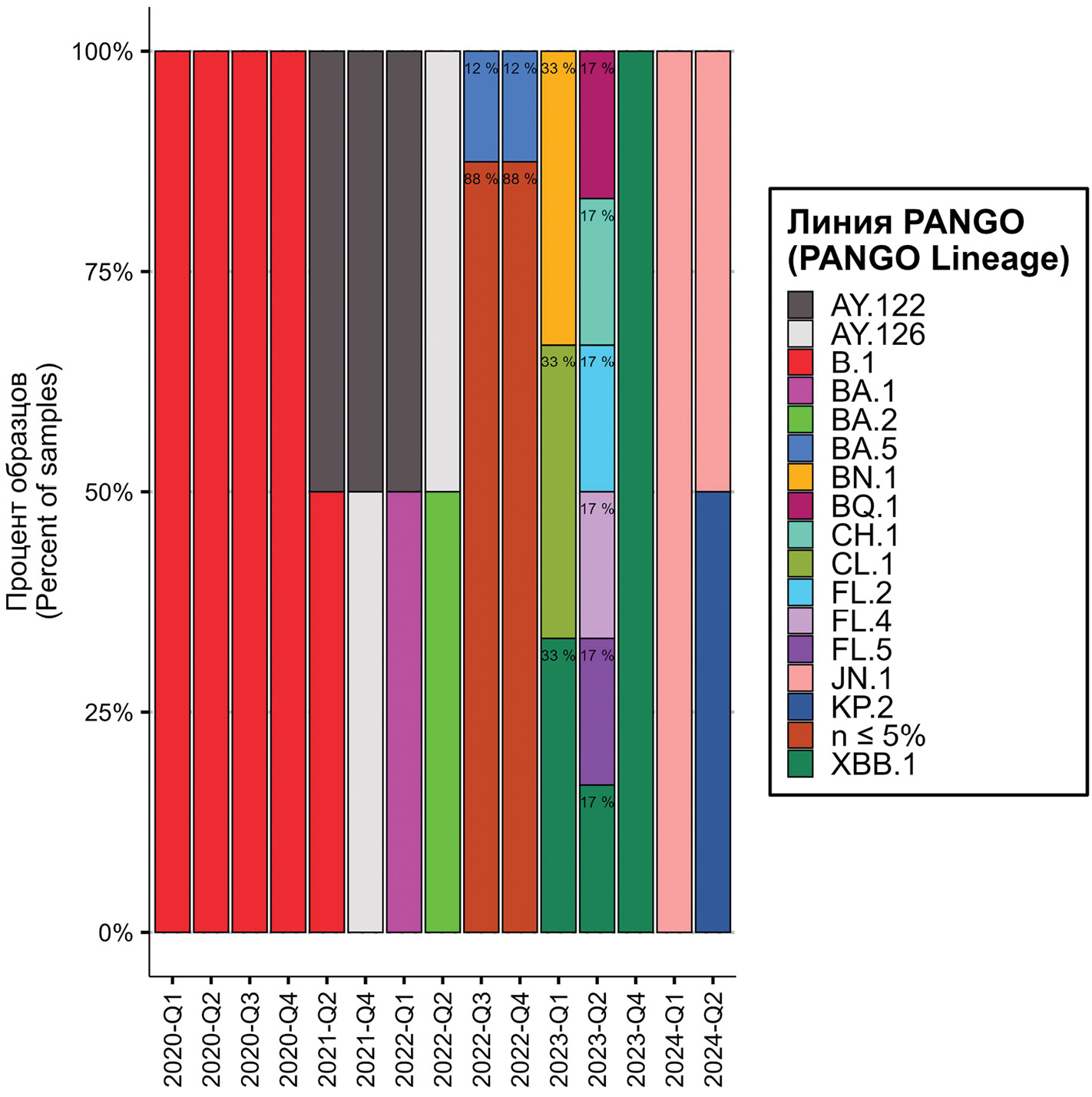
SARS-CoV-2. В сезон 2019–2020 гг., когда в России по окончании эпидемии гриппа впервые был зарегистрирован вирус SARS-CoV-2 (вариант B.1), случаев COVID-19 среди 2395 госпитализированных с ТОРИ детей зарегистрировано не было. Такие случаи впервые были выявлены в сезон 2020–2021 гг., когда в циркуляции появился вариант SARS-CoV-2, известный под названием Delta (AY.122, AY.126). В отличие от взрослых, у которых ЧД этой инфекции среди госпитализированных превышала 50% уровень, у детей случаи госпитализации с COVID-19 регистрировали редко (0,8–2,4%; р < 0,0001). В следующем сезоне, когда на смену варианту Delta в начале 2022 г. пришел высокотрансмиссивный вариант Omicron (BA.1, BA.2), ЧД COVID-19 достоверно увеличилась (до 6,8–13,6%; р < 0,0001), но в два последующих сезона, характеризовавшимися распространением множества линий и сменой доминирующих вариантов Omicron (BA.5, BN.1, CL.1, XBB.1, JN.1 и др.) (рис. 1), наблюдали достоверное (р < 0,0001) снижение частоты госпитализации детей с COVID-19 вне зависимости от возраста (табл. 2).
Рис. 1. Основные генетические линии SARS-CoV-2 (по классификации Pangolin), циркулировавшие в Российской Федерации в 2020–2024 гг. у детей в возрасте 0–17 лет.
По оси ординат – процент данной линии от общего числа секвенированных в этом квартале последовательностей SARS-CoV-2; по оси абсцисс – год и квартал исследований. n ≤ 5 – совокупность разных линий варианта Omicron, частота каждой из которых не превышала 5% в общей структуре выделенных вариантов.
Fig. 1. The main genetic lineages of SARS-CoV-2 (according to Pangolin classification) that circulated in the Russian Federation in 2020–2024 among children aged 0–17 years.
The Y-axis shows the percentage of this line from the total number of SARS-CoV-2 sequences sequenced in this quarter; the X-axis shows the year and quarter of the study. n ≤ 5 – a combination of different lineages of the Omicron variant, each with a frequency not exceeding 5% in the overall structure of identified variants.
Респираторно-синцитиальный вирус (РСВ). К числу наиболее значимых возбудителей ТОРИ для госпитализированных детей младшего возраста (0–2 года) относилась инфекция, вызванная РСВ, которая по частоте регистрации в предпандемический период в младшей возрастной группе (25,7–28,0%) не уступала гриппу (р = 0,6). С увеличением возраста пациентов частота ее регистрации достоверно снижалась (р < 0,05). В период развития пандемии (сезон 2020–2021 гг.) РСВ-инфекцию, как и грипп, регистрировали в стационарах редко (≤ 1,7%), вне зависимости от возраста, хотя другие инфекции, по нашим данным, такие как риновирусная, метапневмовирусная и парагриппозная, диагностировали чаще обычного. В последующие два сезона РСВ вновь вернулся в циркуляцию с наиболее высокой ЧД (22,4–24,1%) у детей младшего возраста в последние два сезона. При этом возрастная тенденция к преимущественному поражению детей младшего возраста сохранилась в полной мере (р < 0,05). Интересно, что в постпандемические сезоны частота детекции РСВ у детей младшего возраста (0–2 года) стала достоверно выше (р < 0,05), чем гриппа, однако среди детей школьного возраста ситуация менялась в обратную сторону за счет снижения роли РСВ и повышения ЧД гриппа (р < 0,05) (табл. 2). Выполненные молекулярно-генетические исследования показали чередование подгрупп РСВ с доминированием в Санкт-Петербурге подгруппы РСВ-В в сезоны 2018–2019 и 2022–2023 гг., РСВ-А в сезоны 2020–2021 и 2021–2022 гг. при социркуляции обеих подгрупп в сезоны 2019–2020 и 2023–2024 гг.
Метапневмовирус (МпВ). Вклад МпВ в развитие ТОРИ был меньшим по сравнению с РСВ и другими возбудителями во все сезоны, за исключением периода развитой пандемии (2020–2021 гг.), когда внезапно он заполнил нишу, сформировавшуюся в результате снижения циркуляции вирусов гриппа и РСВ, достигнув не свойственной ему ранее ЧД (до 19,5 и 29,3% ТОРИ в группах детей 0–2 и 3–6-летнего возраста соответственно). В следующем сезоне МпВ выявляли крайне редко, но в последующие 2 года наблюдался рост его активности (практически до предпандемического уровня в последнем сезоне).
Риновирусы. В рассматриваемый период риновирусы из года в год играли устойчиво важную роль в этиологии ТОРИ у детей с вовлечением всех возрастных групп. Интересно, что в период пандемии, когда SARS-CoV-2 вытеснил из циркуляции вирусы гриппа и РСВ, активность риновирусов, как и МпВ, достигла максимальных значений (14,6–16,6% случаев ТОРИ), но, в отличие от последнего, она сохранилась на высоком уровне и в последующие сезоны. Как и при других инфекциях, наиболее поражаемыми группами были дети младшего возраста.
В целом данные, представленные в табл. 2, позволяют сделать заключение о возрастной зависимости этиологии заболеваний у госпитализированных пациентов. У детей в возрасте до 2 лет наиболее часто диагностировали РСВ-инфекцию, и, наоборот, грипп в данной возрастной группе встречался реже, чем у старших пациентов. МпВ-инфекцию, как правило, чаще наблюдали у детей 3–6 лет. Риновирус выявляли с сопоставимой частотой в двух младших возрастных группах, превышающих таковую у пациентов 7–17 лет. В сезон 2021–2022 гг. (период циркуляции вариантов SARS-CoV-2 Delta и Omicron) частота регистрации COVID-19 среди детей была достаточно высокой вне зависимости от возраста, но в последующий период, на фоне появления все новых вариантов Omicron, наблюдали смещение ЧД COVID-19 в сторону детей младшего возраста, свойственную и другим респираторным инфекциям (за исключением гриппа). Частота детекции вирусов парагриппа, аденовирусов и бокавирусов была относительно невысока, за исключением сезона 2020–2021, когда она возросла до 7,8% для вирусов парагриппа и 3,4% для бокавирусов.
Особенности этиологии ТОРИ у детей, госпитализированных в ОРИТ
Представляло интерес определить, какие из респираторных вирусных инфекций чаще приобретают наиболее тяжелые формы, требующие направления в ОРИТ. С этой целью было проведено сравнение частоты детекции разных вирусных агентов у детей, госпитализированных в ОТД и в ОРИТ. Как показали результаты исследований, этиологическая структура заболеваемости у детей в ОРИТ менялась в зависимости от возраста и эпидемического сезона с преобладанием РСВ-инфекции у детей младших возрастных групп, причем ЧД этой инфекции у детей в возрасте до 2 лет во все сезоны была существенно выше (в 1,3–1,9 раза) при тяжелых формах заболевания, требующих направления в ОРИТ. Столь четкой закономерности не наблюдали ни при одной из других инфекций, что позволяет отнести РСВ-инфекцию к числу этиологически значимых факторов риска для детей младшего возраста. У детей дошкольного возраста частота детекции РСВ в ОРИТ, как правило, также превышала этот показатель для ОТД, но не была характерной для старшей возрастной группы. Основными факторами риска для школьников 7–17 лет оказались вирусы гриппа А(H1N1)pdm09, частота детекции которых в ОРИТ в сравнении с ОТД достоверно повышалась в сезоны их активной циркуляции (2018–2019 и 2022–2023 гг.). Частота детекции вирусов парагриппа, аденовирусов и бокавирусов в целом была относительно невысока, за исключением сезона 2020–2021, когда она возросла для вирусов парагриппа на общих отделениях до 7,8–14,0%. Роль бокавирусов для детей 0–2 лет повысилась в сезон 2023–2024 гг., достигнув 15,0% в ОРИТ (рис. 2).
Рис. 2. Возрастные отличия в этиологии ТОРИ у детей, госпитализированных в общие отделения для ОРВИ (ОТД) и в Отделения интенсивной терапии и реанимации (ОРИТ) за 6-летний период наблюдений.
По оси ординат – частота обнаружения данного возбудителя в процентах от общего числа обследованных детей указанной возрастной группы, по оси абсцисс – сезоны.
Fig. 2. Age-related differences in the etiology of SARI in children admitted in hospital departments for ARI (HD) and in intensive care units (ICU) over a 6-year observation period.
On the Y-axis – the frequency of detection of a given pathogen as a percentage of the total number of examined children of the specified age group. On X-axis – seasons.
Оценка тяжести заболеваний у детей
Оценку тяжести заболевания проводили в последние сезоны при использовании введенных в ИКБ перечисленных выше критериев тяжести (КТ) с определением усредненного Мт.
Грипп. Анализ частоты встречаемости КТ у детей показал, что грипп, вызванный вирусом A(H3N2), в целом протекал у детей тяжелее, чем грипп A(H1N1)pdm09 и грипп В, судя по Мт, который составлял в разные сезоны 7,9–9,2% против 5,4% и 4,6% соответственно. Так, нарушение сознания регистрировали при гриппе A(H3N2) в 11,1–12,9% случаев, чего не наблюдали при гриппе A(H1N1)pdm09. При гриппе В, в сезон его циркуляции (2022–2023 гг.) гипертермия и гипоксия были выражены в меньшей степени, хотя геморрагический синдром регистрировали достоверно чаще (в 35% случаев), чем при гриппе А и других инфекциях (р < 0,001).
SARS-CoV-2. Частота регистрации большинства КТ при COVID-19 была наиболее высокой в сезон 2021–2022 гг. (Мт 14,1; 95% ДИ 2,7–25,4): нарушение сознания регистрировали в 22,2% случаев, – чаще, чем при других инфекциях (за исключением риновирусной инфекции в сезон 2023–2024 гг.). Интересно, что в сезон 2022–2023гг. с распространением новых высоко трансмиссивных вариантов Omicron, тяжесть заболеваний резко снизилась (Мт в сезоны 2022–2023 и 2023–2024 гг. опустилась до 2,9 и 3,7 соответственно; 95% ДИ – до 0–10,7 и 1,5–5,6 соответственно) и стала достоверно ниже по сравнению с РСВ и риновирусной инфекцией (р < 0,05).
РСВ-инфекция часто протекала у детей тяжелее других, с наиболее выраженными и часто встречающимися явлениями гипоксии, одышки, снижения концентрации кислорода в крови ниже нормы, и в сезон 2022–2023 гг. Мт достигла 19,1 с присоединением геморрагического синдрома и нарушением сознания (в 10,0 и 16,7% случаев соответственно), чего не регистрировали ранее. В сезон 2023–2024 гг. тяжесть РСВ-инфекции несколько снизилась (Мт 14,9), но оставалась более высокой по сравнению с другими инфекциями.
Риновирусная инфекция протекала у детей из года в год также достаточно тяжело (Мт 9,9–13,9), по симптоматике была наиболее близкой к РСВ-инфекции, при этом частоту регистрации гипоксии и одышки встречали даже чаще, чем при гриппе.
МпВ-инфекция, подъем которой наблюдали в пандемический сезон 2021–2022 гг., развивалась без каких-либо отличительных признаков и по тяжести течения (Мт 0,0–6,4) во все сезоны уступала другим респираторным инфекциям, включая COVID-19 в последние 2 сезона (табл. 3).
Таблица 3. Частота регистрации основных признаков тяжести заболеваний у детей в зависимости от их этиологии и эпидемического сезона
Table 3. The percent of registration of the main criteria of disease severity in children, depending on their etiology and epidemic season
Сезон Season | Критерии тяжести Severity criteria | Частота регистрации признака при инфекции Percent of registration of a severity criteria during infection | ||||||
Грипп / Influenza A(H1N1) pdm09 | Грипп / Influenza A(H3N2) | Грипп B / Influenza В | РСВ RSV | Метапневмовирус Meta-pneumovirus | COVID-19 | Риновирус Rhinovirus | ||
2021–2022 | Гипертермия (≥ 39 °С) Hyperthermia (≥ 39 °C) | 0,0 | 12,2 | 0,2 | 6,8 | 0,2 | 12,8 | 9,5 |
Гипоксия / Hypoxia | 0,0 | 4,1 | 0,0 | 21,2 | 0,0 | 15,3 | 17,1 | |
Концентрация О2 в крови ниже нормы / Concentra tion of O2 in the blood below the norm | 0,0 | 4,2 | 0,0 | 15,2 | 0,0 | 9,4 | 20,4 | |
Одышка / Shortness of breath | 0,0 | 7,3 | 0,4 | 16,8 | 0,2 | 8,8 | 17,0 | |
Геморрагический синдром / Hemorrhagic syndrome | 0,0 | 14,3 | 0,0 | 0,0 | 0,0 | 21,4 | 7,1 | |
Нарушение сознания / Impaired consciousness | 0,0 | 11,1 | 0,0 | 0,0 | 0,0 | 22,2 | 0,0 | |
Степень тяжести (Mт) / Severity (Ms) | 0 | 9,2 | 0 | 11,0 | 0 | 14,1 | 13,3 | |
ДИ / confidence interval | 0,8–17,6 | 0–0,3 | 0–28,7 | 0–0,2 | 2,7–25,4 | 0–28,3 | ||
2022–2023 | Гипертермия (≥ 39 °С) Hyperthermia (≥ 39 °C) | 11,7 | 0,1 | 7,3 | 10,4 | 4,3 | 4,3 | 10,4 |
Гипоксия / Hypoxia | 4,6 | 0,0 | 2,8 | 21,5 | 7,4 | 1,4 | 14,8 | |
Концентрация О2 в крови ниже нормы / Concentra tion of O2 in the blood below the norm | 4,4 | 0,0 | 4,9 | 30,6 | 6,0 | 1,0 | 17,6 | |
Одышка / Shortness of breath | 6,2 | 0,0 | 4,2 | 24,0 | 6,1 | 7,5 | 13,0 | |
Геморрагический синдром / Hemorrhagic syndrome | 10,0 | 0,0 | 35,0 | 10,0 | 0,0 | 10,0 | 5,0 | |
Нарушение сознания / Impaired consciousness | 0,0 | 0,0 | 0,0 | 16,7 | 0,0 | 0,0 | 16,7 | |
Степень тяжести (Mт) / Severity (Ms) | 5,4 | 0 | 4,6 | 19,1 | 5,2 | 2,9 | 13,9 | |
ДИ / confidence interval | 0–13,7 | 0–0,1 | 0–29,9 | 3,3–34,9 | 0–11,5 | 0–10,7 | 4,8–23,0 | |
2023–2024 | Гипертермия (≥ 39 °С) / Hyperthermia (≥ 39 °C) | 0,0 | 12,0 | 0,4 | 10,2 | 5,1 | 5,8 | 5,5 |
Гипоксия / Hypoxia | 0,0 | 7,4 | 0,5 | 19,6 | 6,6 | 4,8 | 7,7 | |
Концентрация О2 в крови ниже нормы / Concentration of O2 in the blood below the norm | 0,0 | 3,4 | 0,0 | 29,6 | 6,4 | 3,4 | 16,8 | |
Одышка / Shortness of breath | 0,1 | 7,1 | 0,1 | 22,4 | 6,4 | 4,0 | 11,5 | |
Геморрагический синдром / Hemorrhagic syndrome | 0,0 | 8,3 | 0,0 | 8,3 | 8,3 | 0,0 | 8,3 | |
Нарушение сознания / Impaired consciousness | 0,0 | 12,9 | 0,0 | 8,1 | 1,6 | 3,2 | 22,6 | |
Степень тяжести (Mт) / Severity (Ms) | 0,0 | 7,9 | 0,1 | 14,9 | 6,4 | 3,7 | 9,9 | |
ДИ / confidence interval | 0–0,1 | 4,9–12,2 | 0–0,4 | 7,1–25,7 | 3,4–8,1 | 1,5–5,6 | 5,3–18,9 | |
Обсуждение
Проведенные исследования выявили существенные возрастные отличия в частоте регистрации и тяжести течения острых респираторных инфекций в зависимости от этиологии заболеваний у детей. Так, РСВ, МпВ и риновирусы служили наиболее частой причиной госпитализации детей в возрасте до 2 лет, тогда как грипп и COVID-19 значительно чаще регистрировали у взрослых [9]. Шестилетний мониторинг ТОРИ, включая допандемический и постпандемический периоды, показал также постоянно меняющуюся этиологическую структуру заболеваемости, как это показано и в других отечественных исследованиях [10, 11]. В частности, роль вирусов гриппа в развитии ТОРИ была наиболее высока в предпандемические сезоны 2018–2019 и 2019–2020 гг. В разгар пандемии SARS-CoV-2 (2020–2021 гг.) вирусы гриппа и РСВ практически были вытеснены из циркуляции в России [12], как и в других странах мира [13–15], что отразилось и на этиологии ТОРИ у детей, но в последующие сезоны вирусы гриппа A(H3N2) и A(H1N1)pdm09 вернулись на эпидемическую орбиту, попеременно сменяя друг друга, при ограниченном долевом участии вирусов гриппа В [16]. Подтверждено ранее выявленное нами явление интерференции между вирусами гриппа типа А, РСВ и SARS-CoV-2 в период пандемии, которое по окончании ее активной фазы проявлялось в чередовании эпидемических подъемов заболеваемости. Частота выявления у детей с ТОРИ гриппа и РСВ в последние сезоны сравнительно с предпандемическим периодом стала существенно ниже. Анализ данных, полученных из 22 стран мира в период с 2012 по 2019 г., включавших обследование 73 121 пациента с ТОРИ, показал, что риск госпитализации в ОРИТ был достоверно выше в слаборазвитых странах по сравнению с высокоразвитыми, при этом грипп A(H1N1)pdm09 протекал более тяжело, чем A(H3N2) [17], что согласуется с данными по смертности от гриппа в России в период с 2009 по 2017 г. [18]. В отличие от этого, по нашим данным, в постпандемический период грипп A(H3N2) у детей протекал более тяжело, с нарушением сознания, по сравнению с гриппом A(H1N1)pdm09. Частота детекции вирусов гриппа, вне зависимости от субтипа, была выше у детей школьного возраста, тогда как при РСВ-инфекции наиболее поражаемой группой всегда были дети в возрасте до 2 лет включительно.
Частота детекции SARS-CoV-2 при ТОРИ у детей младшего и школьного возраста в начале пандемии была невысокой, но повысилась до 10,6–13,6% в эпидемический сезон 2021–2022 гг., с появлением в 2022 г. наиболее трансмиссивного варианта Omicron. Однако уже в следующем сезоне с распространением множественных вариантов Omicron, произошло 2–3-кратное снижение частоты регистрации SARS-CoV-2, по-видимому, как следствие формирования популяционного иммунитета к SARS-CoV-2 [19]. На фоне возникновения множества новых генетических вариантов SARS-CoV-2 регистрировали рост частоты случаев гриппа, а также РСВ-инфекции у детей, в особенности в возрасте до 2 лет. Интересно, что, по данным генетического анализа, в сезон 2022–2023 гг. у детей с ТОРИ неожиданно стала доминировать подгруппа РСВ-В, в отличие от других сезонов и более раннего периода (2013–2016 гг.), когда преобладала подгруппа РСВ-А [20]. Известно, что РСВ-В способен вызывать более тяжелые формы инфекции с летальными исходами [21].
Тяжесть заболевания зависела как от этиологии, так и возраста пациентов. Так, при гриппе A(H3N2) у детей чаще регистрировали гипертермию, геморрагический синдром и потерю сознания, тогда как при РСВ-инфекции – гипоксию, одышку, а в последние сезоны и потерю сознания (в 8,1–16,7% случаев), чего не наблюдали ранее. Возможность возникновения отдаленных последствий РСВ-инфекции, в том числе развития бронхиальной астмы [22], определяет настоятельную необходимость создания средств профилактики этой инфекции, включая разработку вакцин [23], а также препаратов моноклональных антител с профилактической активностью [24]. МпВ-инфекция в последние 3 сезона протекала у детей относительно благоприятно, в отличие от риновирусной инфекции, которая протекала у детей достаточно тяжело, нередко с нарушением сознания, и по частоте регистрации гипоксии и одышки превосходила грипп.
Выводы
- Госпитальный мониторинг позволил установить вклад вирусов гриппа, SARS-CoV-2, РСВ, МпВ и риновирусов в развитие тяжелых респираторных вирусных инфекций у детей в ходе развития пандемии, а также проследить возрастные особенности этиологии и характерные клинические признаки наиболее значимых инфекций.
- Установлено, что вирусы гриппа и РСВ служили наиболее частой причиной госпитализации детей в возрасте 0–2 и 3–6 лет, в отличие от SARS-CoV-2, который регистрировался у них реже, и по тяжести течения COVID-19-инфекция уступала респираторно-синцитиальной и риновирусной инфекции.
- Подтверждено ранее выявленное нами явление интерференции между вирусами гриппа типа А, РСВ и SARS-CoV-2 в период пандемии, которое стало, однако, менее выраженным по окончании ее активной фазы.
- Расширение системы госпитального мониторинга способно обеспечить оперативность получения всей необходимой клинико-эпидемиологической информации в стране, что было бы важно для анализа текущих эпидемий и, особенно, при возникновении очередной пандемии.
About the authors
Anna А. Sominina
Smorodintsev Research Institute of Influenza, Ministry of Health
Author for correspondence.
Email: anna.sominina@influenza.spb.ru
ORCID iD: 0000-0001-9671-0629
Doctor of Medical Sciences, Professor, Head of the Laboratory of the of Risk Factors Assessment in Influenza and ARVI
Russian Federation, 197022, St. PetersburgDarya M. Danilenko
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: daria.baibus@gmail.com
ORCID iD: 0000-0001-6174-0836
Candidate of Biological Sciences, Deputy Director for Scientific Work, Head of the Department of Etiology and Epidemiology
Russian Federation, 197022, St. PetersburgAndrey B. Komissarov
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: a.b.komissarov@gmail.com
ORCID iD: 0000-0003-1733-1255
Head of the lab. of molecular virology
Russian Federation, 197022, St. PetersburgArtem V. Fadeev
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: artem.fadeev@influenza.spb.ru
ORCID iD: 0000-0003-3558-3261
senior researcher, lab. of molecular virology
Russian Federation, 197022, St. PetersburgKsenia S. Komissarova
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: kseniya.sintsova@influenza.spb.ru
ORCID iD: 0000-0002-1465-5548
researcher, lab. of molecular virology
Russian Federation, 197022, St. PetersburgMaria M. Pisareva
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: maria.pisareva@influenza.spb.ru
ORCID iD: 0000-0002-1499-9957
Candidate of Biological Sciences, leading researcher, lab. of molecular virology
Russian Federation, 197022, St. PetersburgTamila D. Musayeva
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: tamila.musaeva@influenza.spb.ru
ORCID iD: 0000-0002-3050-1936
junior researcher, lab. of molecular virology
Russian Federation, 197022, St. PetersburgVeronika A. Eder
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: veronika.eder@influenza.spb.ru
ORCID iD: 0000-0002-9970-3325
PhD, senior researcher, lab. of molecular virology
Russian Federation, 197022, St. PetersburgTatiana P. Levanyuk
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: tatyana.levanyuk@influenza.spb.ru
ORCID iD: 0009-0003-6888-6848
leading programmer, Laboratory of Risk Factors Assessment in Influenza and ARVI
Russian Federation, 197022, St. PetersburgKirill A. Stolyarov
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: kirill@influenza.spb.ru
ORCID iD: 0000-0002-1765-2799
leading programmer, lab. of epidemiology of influenza and ARVI
Russian Federation, 197022, St. PetersburgVera Z. Krivitskaya
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: vera.kriv@influenza.spb.ru
ORCID iD: 0000-0002-9146-0816
Doctor of Biological Sciences, leading researcher, Laboratory of Risk Factors Assessment for Influenza and ARVI
Russian Federation, 197022, St. PetersburgEkaterina R. Petrova
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: ekaterina.petrova@influenza.spb.ru
ORCID iD: 0000-0003-2258-4679
researcher, Laboratory of Risk Factors Assessment for Influenza and ARVI
Russian Federation, 197022, St. PetersburgOlga I. Afanasyeva
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: olga-afanaseva57@mail.ru
ORCID iD: 0000-0002-1229-171X
Doctor of Medical Sciences, Head of the Department of RVI in children
Russian Federation, 197022, St. PetersburgVeronika S. Timonina
SPB GUBZ St. Olga Children’s City Hospital
Email: karina88888888@list.ru
ORCID iD: 0000-0002-2887-0126
Doctor
Russian Federation, 194156, St. PetersburgElena V. Obraztsova
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: alorz@mail.ru
ORCID iD: 0000-0001-8762-6724
Candidate of Medical Sciences, senior researcher of the Department of RVI in children
Russian Federation, 197022, St. PetersburgEkaterina G. Golovacheva
Smorodintsev Research Institute of Influenza, Ministry of Health
Email: ekaterina.golovacheva@influenza.spb.ru
ORCID iD: 0000-0002-1934-7288
Doctor of Medical Sciences, senior researcher of the Department of RVI in children
Russian Federation, 197022, St. PetersburgElena A. Dondurey
Smorodintsev Research Institute of Influenza, Ministry of Health; SPB GUBZ St. Olga Children’s City Hospital
Email: dondureyelena@yandex.ru
ORCID iD: 0000-0003-2382-9172
Candidate of Medical Sciences, senior researcher of the Department of RVI in Children
Russian Federation, 197022, St. Petersburg; 194156, St. PetersburgEvgenya V. Lelenkova
Federal Scientific Research Institute of Viral Infections “Virom”, Rospotrebnadzor
Email: lelenkova_ev@eniivi.ru
ORCID iD: 0000-0003-2004-0977
epidemiologist
Russian Federation, 620030, EkaterinburgOlga G. Kurskaya
Federal Research Center for Fundamental and Translational Medicine, Research Institute of Virology
Email: kurskaya09_@mail.ru
ORCID iD: 0000-0002-1931-2026
Candidate of Medical Sciences, senior researcher, lab. of virology
Russian Federation, 630117, NovosibirskAlexander M. Shestopalov
Federal Research Center for Fundamental and Translational Medicine, Research Institute of Virology
Email: shestopalov2@ngs.ru
ORCID iD: 0000-0002-1880-8708
Doctor of Biological Sciences, Professor, Director
Russian Federation, 630117, NovosibirskDmitry A. Lioznov
Smorodintsev Research Institute of Influenza, Ministry of Health; First St. Petersburg State Medical University named after Academician I. P. Pavlov
Email: dlioznov@yandex.ru
ORCID iD: 0000-0003-3643-7354
Doctor of Medical Sciences, Professor, Director
Russian Federation, 197022, St. Petersburg; 197022, St. PetersburgReferences
- Puig-Barberà J., Tormos A., Trushakova S., Sominina A., Pisareva M., Ciblak M.A., et al. The Global Influenza Hospital Surveillance Network (GIHSN): a new platform to describe the epidemiology of severe influenza. Influenza Other Respir. Viruses. 2015; 9(6): 277–86. https://doi.org/10.1111/irv.12335
- Puig-Barberà J., Mira-Iglesias A., Burtseva E., Cowling B.J., Serhat U., Ruiz-Palacios G.M., et al. Influenza epidemiology and influenza vaccine effectiveness during the 2015-2016 season: results from the Global Influenza Hospital Surveillance Network. BMC Infect. Dis. 2019; 19(1): 415. https://doi.org/10.1186/s12879-019-4017-0
- Baselga-Moreno V., Trushakova S., McNeil S., Sominina A., Nunes M.C., Draganescu A., et al. Influenza epidemiology and influenza vaccine effectiveness during the 2016–2017 season in the Global Influenza Hospital Surveillance Network (GIHSN). BMC Public Health. 2019; 19(1): 487. https://doi.org/10.1186/s12889-019-6713-5
- Puig-Barberà J., Tormos A., Sominina A., Burtseva E., Launay O., Ciblak M.A., et al. First-year results of the Global Influenza Hospital Surveillance Network: 2012-2013 Northern hemisphere influenza season. BMC Public Health. 2014; 14: 564. https://doi.org/10.1186/1471-2458-14-564
- Puig-Barberà J., Burtseva E., Yu H., Cowling B.J., Badur S., Kyncl J., et al. Influenza epidemiology and influenza vaccine effectiveness during the 2014–2015 season: annual report from the Global Influenza Hospital Surveillance Network. BMC Public Health. 2016; 16(Suppl. 1): 757. https://doi.org/10.1186/s12889-016-3378-1
- Simon B., Pichon M., Valette M., Burfin G., Richard M., Lina B., et al. Whole genome sequencing of A(H3N2) influenza viruses reveals variants associated with severity during the 2016–2017 season. Viruses. 2019; 11(2): 108. https://doi.org/10.3390/v11020108
- WHO. Recommended composition of influenza virus vaccines for use in the 2024–2025 northern hemisphere influenza season; 2024. Available at: https://who.int/news/item/23-02-2024-recommendations-announced-for-influenza-vaccine-composition-for-the-2024-2025-northern-hemisphere-influenza-season
- WHO. Global influenza strategy 2019–2030; 2019. Available at: https://who.int/publications/i/item/9789241515320
- Sominina A.A., Danilenko D.M., Komissarov A.B., Pisareva M.M., Musaeva T.D., Stolyarov K.A., et al. Changes in the etiological structure of severe acute respiratory viral infections in children and adults under the influence of the COVID-19 pandemic. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2024; 101(3): 327–41. https://doi.org/10.36233/0372-9311-532 (in Russian)
- Burtseva E.I., Kolobukhina L.V., Voronina O.L., Ignatjeva A.V., Mukasheva E.A., Panova A.D., et al. Features of the circulation of ARVI pathogens during of emergence and widespread of SARS-CoV-2 in the 2018–2021. Epidemiologiya i vaktsinoprofilaktika. 2022; 21(4): 16–25. https://doi.org/10.31631/2073-3046-2022-21-4-16-26 https://elibrary.ru/rnyfoi (in Russian)
- Burtseva E.I., Kolobukhina L.V., Panova A.D., Mukasheva E.A., Krasnoslobodtsev K.G., Kirillova E.S., et al. Properties of influenza viruses that caused epidemic increases in morbidity in Russia and countries of the world during 2022-2023. The effectiveness of vaccine prophylaxis. Voprosy virusologii. 2024; 69(1): 42–55. https://doi.org/10.36233/0507-4088-211 (in Russian)
- Sominina A.A., Danilenko D.M., Stolyarov K.A., Karpova L.S., Bakaev M.I., Levanyuk T.P., et al. Interference of SARS-CoV-2 with other respiratory viral infections agents during pandemic. Epidemiologiya i vaktsinoprofilaktika. 2021; 20(4): 28–139. https://doi.org/10.31631/2073-3046-2021-20-4-28-39 https://elibrary.ru/cdrnsj (in Russian)
- Olsen S.J., Azziz-Baumgartner E., Budd A.P., Brammer L., Sullivan S., Pineda R.F., et al. Decreased influenza activity during the COVID-19 pandemic – United States, Australia, Chile, and South Africa, 2020. MMWR Morb. Mortal. Wkly Rep. 2020; 69(37): 1305–9. https://doi.org/10.15585/mmwr.mm6937a6
- Adlhoch C., Mook P., Lamb F., Ferland L., Melidou A., Amato-Gauci A.J., et al. Very little influenza in the WHO European Region during the 2020/21 season, weeks 40 2020 to 8 2021. Euro Surveill. 2021; 26(11): 2100221. https://doi.org/10.2807/1560-7917.ES.2021.26.11.2100221
- Meslé M.M.I., Sinnathamby M., Mook P., Pebody R., Lakhani A., Zambon M., et al. Seasonal and inter-seasonal RSV activity in the European Region during the COVID-19 pandemic from autumn 2020 to summer 2022. Influenza Other Respir. Viruses. 2023; 17(11): e13219. https://doi.org/10.1111/irv.13219
- Sominina A., Danilenko D., Komissarov A.B., Pisareva M., Fadeev A., Konovalova N., et al. Assessing the intense influenza A(H1N1)pdm09 epidemic and vaccine effectiveness in the post-COVID season in the Russian Federation. Viruses. 2023; 15(8): 1780. https://doi.org/10.3390/v15081780
- Cohen L.E., Hansen C.L., Andrew M.K., McNeil S.A., Vanhems P., Kyncl J., et al. Predictors of severity of influenza-related hospitalizations: results from the Global Influenza Hospital Surveillance Network (GIHSN). J. Infect. Dis. 2024; 229(4): 999–1009. https://doi.org/10.1093/infdis/jiad303
- Karpova L.S., Volik K.M., Stolyarov K.A., Popovtseva N.M., Stolyarova T.P., Sominina A.A., et al. Features of epidemic process of influenza a(h1n1)pdm09 and a(h3n2) in Russia from 2009 to 2017. Voprosy virusologii. 2018; 63(4): 177–84. https://doi.org/10.18821/0507-4088-2018-63-4-177-184 https://elibrary.ru/ymvmwl (in Russian)
- Popova A.Yu., Smirnov V.S., Egorova S.A., Drozd I.V., Milichkina A.M., Dashkevich A.M., et al. Patterns in the development of collective immunity to SARS-CoV-2 during the COVID-19 pandemic. Meditsinskaya immunologiya. 2023; 25(4): 759–66. https://doi.org/10.15789/1563-0625-PIT-2867 (in Russian)
- Krivitskaya V.Z., Sintsova K.S., Petrova E.R., Sverlova M.V., Sorokin E.V., Tsareva T.R., et al. Genetic and antigenic characteristics of respiratory syncytial virus strains isolated in St. Petersburg in 2013–2016. Voprosy virusologii. 2017; 62(6): 273–82. https://doi.org/10.18821/0507-4088-2017-62-6-273-282 https://elibrary.ru/zuqevd (in Russian)
- Schobel S.A., Stucker K.M., Moore M.L., Anderson L.J., Larkin E.K., Shankar J., et al. Respiratory Syncytial Virus whole-genome sequencing identifies convergent evolution of sequence duplication in the C-terminus of the G gene. Sci. Rep. 2016; 6: 26311. https://doi.org/10.1038/srep26311
- Rosas-Salazar C., Chirkova T., Gebretsadik T., Chappell J.D., Peebles R.S. Jr., Dupont W.D., et al. Respiratory syncytial virus infection during infancy and asthma during childhood in the USA (INSPIRE): a population-based, prospective birth cohort study. Lancet. 2023; 401(10389): 1669–80. https://doi.org/10.1016/S0140-6736(23)00811-5
- Gilbert B.E., Patel N., Lu H., Liu Y., Guebre-Xabier M., Piedra P.A., et al. Respiratory syncytial virus fusion nanoparticle vaccine immune responses target multiple neutralizing epitopes that contribute to protection against wild-type and palivizumab-resistant mutant virus challenge. Vaccine. 2018; 36(52): 8069–78. https://doi.org/10.1016/j.vaccine.2018.10.073
- Sun M., Lai H., Na F., Li S., Qiu X., Tian J., et al. Monoclonal antibody for the prevention of respiratory syncytial virus in infants and children: a systematic review and network meta-analysis. JAMA Netw. Open. 2023; 6(2): e230023. https://doi.org/10.1001/jamanetworkopen.2023.0023
Supplementary files