Том 70, № 2 (2025)
- Год: 2025
- Дата публикации: 30.04.2025
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/139
Весь выпуск
ОБЗОРЫ
Реассортантные штаммы Rotavirus A (Sedoreoviridae: Rotavirus: Rotavirus A): роль ротавирусов животных в возникновении новых вариантов ротавируса человека
Аннотация
Ротавирусы (РВ) животных играют важную роль в формировании новых вариантов эпидемически значимых штаммов Rotavirus А (РВА) человека. В настоящее время на территории Российской Федерации преобладает реассортантный вариант генотипа G3P[8], происхождение которого связано с РВ лошадей и крупного рогатого скота. Помимо этого, в мире долгое время спорадически выявляются реассортантные варианты РВА генотипов G3P[3], G3P[9], G6P[9], подобные РВ кошек и собак. Учитывая актуальность данной темы, подробное изучение AU-1-подобной геногруппы РВА, представители которой тесно связаны с РВ кошек и собак, представляет научно-практический интерес.
Цель настоящего обзора – анализ опубликованных научных данных о РВ человека, кошек и собак, входящих в состав AU-1-подобной геногруппы и изученных на основе полного генотипа.
 105-116
105-116


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
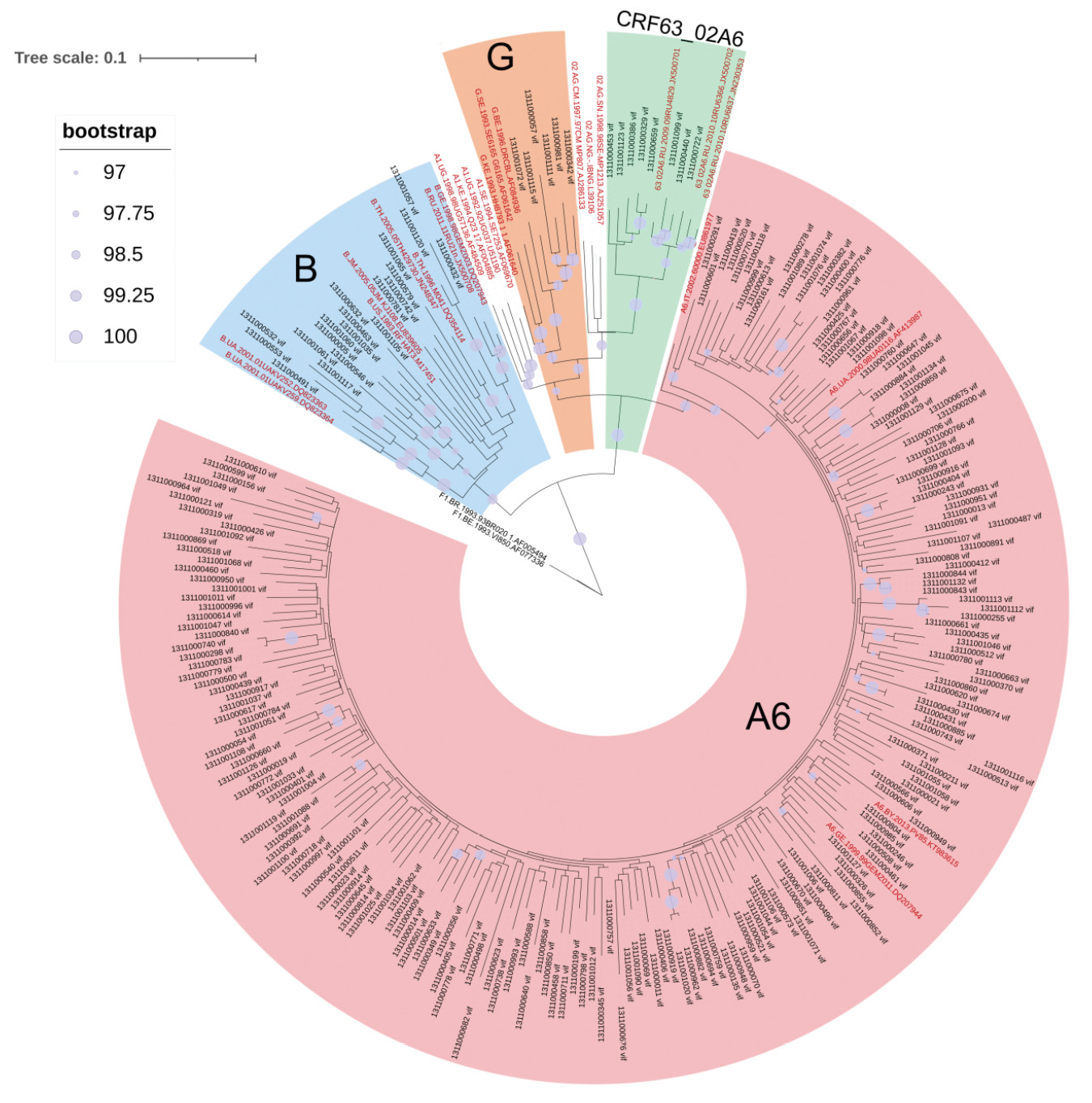
Генетическое разнообразие белка Vif у вариантов вируса иммунодефицита человека 1-го типа (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodeficiency virus-1), циркулировавших в Московской области в 2019‒2020 гг.
Аннотация
Введение. Белок Vif вируса иммунодефицита человека 1-го типа (ВИЧ-1) является фактором вирусной инфекционности и противодействует клеточным дезаминазам семейства APOBEC3, препятствующим репликации вируса. На основе белка Vif ведутся разработки для создания терапевтических средств. Природные замены в белке Vif могут влиять на его функциональность и ассоциироваться с ускоренным переходом ВИЧ-инфекции в стадию СПИДа. Изучение особенностей белка Vif у вариантов ВИЧ-1, циркулирующих в России, ранее не проводилось.
Цель работы: изучить генетическое разнообразие белка Vif вариантов ВИЧ-1, циркулировавших в Московской области в 2019‒2020 гг.
Материалы и методы. Проанализировано 234 образца цельной крови ВИЧ-инфицированных пациентов без опыта приема антиретровирусной терапии. Дизайн исследования включал следующие стадии: экстракция провирусной ДНК, амплификация гена vif, секвенирование продуктов амплификации, определение генетических вариантов полученных нуклеотидных последовательностей; затем проводили исследование консенсусных последовательностей белка Vif наиболее распространенных генетических вариантов ВИЧ-1, анализ консервативности и генетического разнообразия белка Vif-А6 (белок Vif вариантов ВИЧ-1 суб-субтипа А6) у пациентов с разными стадиями заболевания, оценку генетического разнобразия белка Vif-А6 в Московской области.
Результаты. Проведена оценка генетического разнообразия ВИЧ-1 в области генома, кодирующего белок Vif, – выявлено большое генетическое разнообразие, включающее в себя ВИЧ-1 чистых субтипов (A6, B и G), а также его рекомбинантных форм (CRF63_02A6). Впервые получены консенсусные последовательности белка Vif генетических вариантов ВИЧ-1 – B и CRF63_02A6, циркулирующих на территории Российской Федерации. Для наиболее распространенных в России вариантов ВИЧ-1 определены характерные замены в консенсусных последовательностях.
Заключение. Ограничением исследования является небольшая выборка последовательностей, принадлежащих генетическим вариантам B и CRF63_02A6 ВИЧ-1. Полученные результаты могут быть интересны и учтены при разработке терапевтических средств на основе белка Vif, а также при изучении вопросов патогенности ВИЧ-1 суб-субтипа А6.
 117-132
117-132


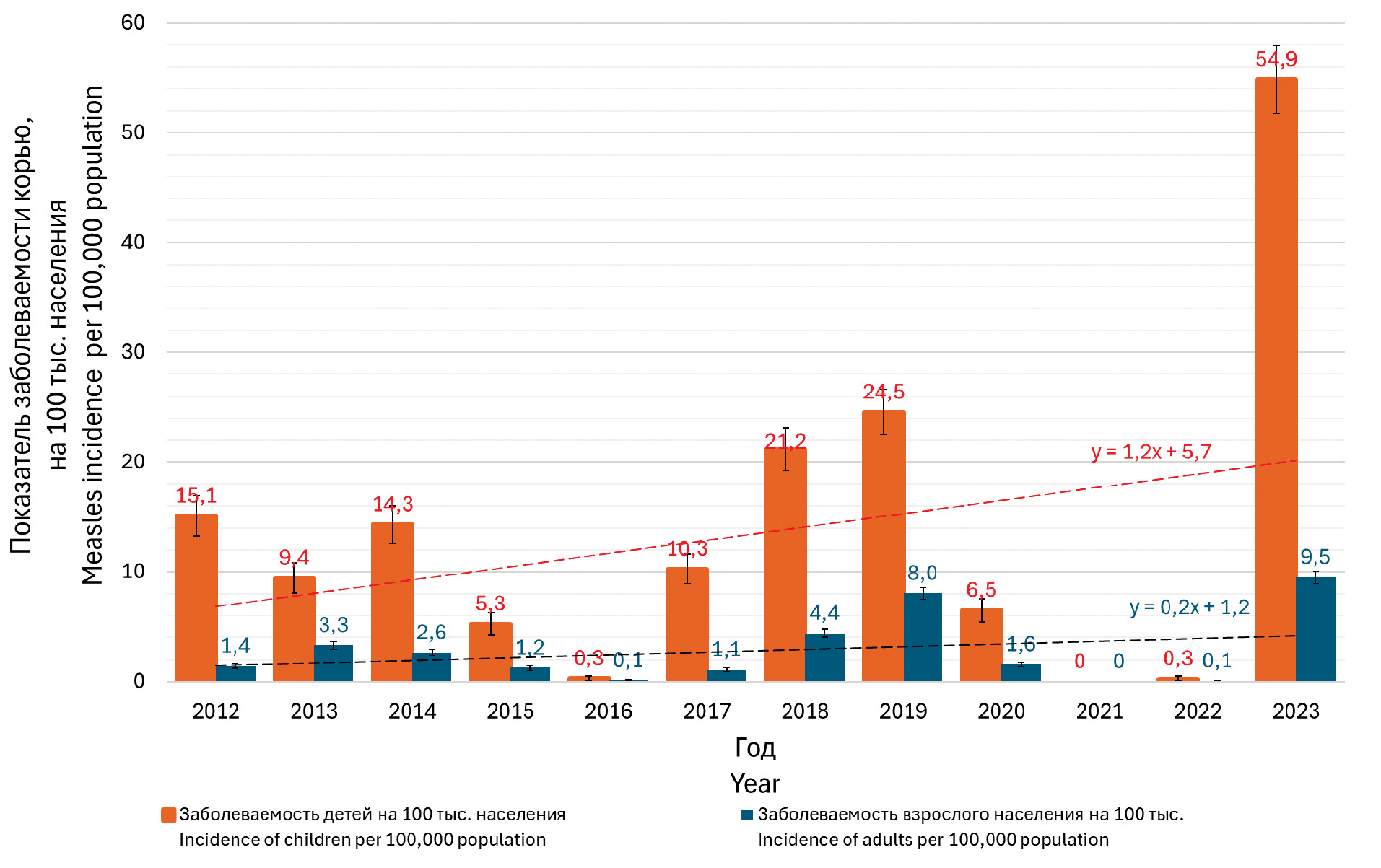
Оценка популяционного иммунитета к кори, краснухе и эпидемическому паротиту в Москве на современном этапе
Аннотация
Введение. Проблема заболеваемости вакциноуправляемыми инфекциями на этапе их элиминации требует слежения за состоянием популяционного специфического иммунитета с помощью серологического мониторинга, являющегося компонентом системы эпидемиологического надзора.
Цель исследования. Изучить эпидемиологические особенности кори, краснухи и эпидемического паротита (ЭП) и оценить уровень их серопревалентности в последнее десятилетие в Москве.
Материалы и методы. Для проведения ретроспективного анализа заболеваемости использовали формы федерального статистического наблюдения № 2, № 5 и № 6; данные государственных докладов «О состоянии санитарно-эпидемиологического благополучия населения в городе Москве»; официальные сведения ЕМИСС за 2012–2023 гг. Образцы сывороток крови (n = 7458) от условно здоровых лиц, стратифицированных по возрасту, изучены на наличие антител класса G (IgG) к вирусам кори, краснухи и ЭП методом иммуноферментного анализа. Статистическую обработку данных осуществляли с помощью программ Microsoft Excel и SPSS Statistics v. 27 (IBM).
Результаты. При анализе эпидемиологической ситуации в Москве с 2012 по 2023 г. установлено наличие разнонаправленных тенденций: волнообразного роста заболеваемости корью, стабилизации регистрации случаев краснухи на спорадическом уровне и неустойчивой заболеваемости ЭП с небольшим трендом в сторону увеличения. Определен высокий уровень антител IgG к вирусу краснухи, препятствующий распространению инфекции среди населения. Сформированный уровень популяционного иммунитета к ЭП не позволяет снизить заболеваемость до спорадических случаев. Наблюдаемый тренд роста заболеваемости корью в последнее десятилетие может быть объяснен накоплением неиммунных лиц среди населения.
Заключение. Возникшие сложности с достижением целевых уровней охвата вакцинацией во время пандемии COVID-19, а также значительная доля серонегативных лиц свидетельствуют о необходимости коррекции тактики вакцинопрофилактики и проведения мер по подчищающей и догоняющей иммунизации населения в отношении кори и эпидемического паротита, особенно в возрастных группах риска.
 133-146
133-146


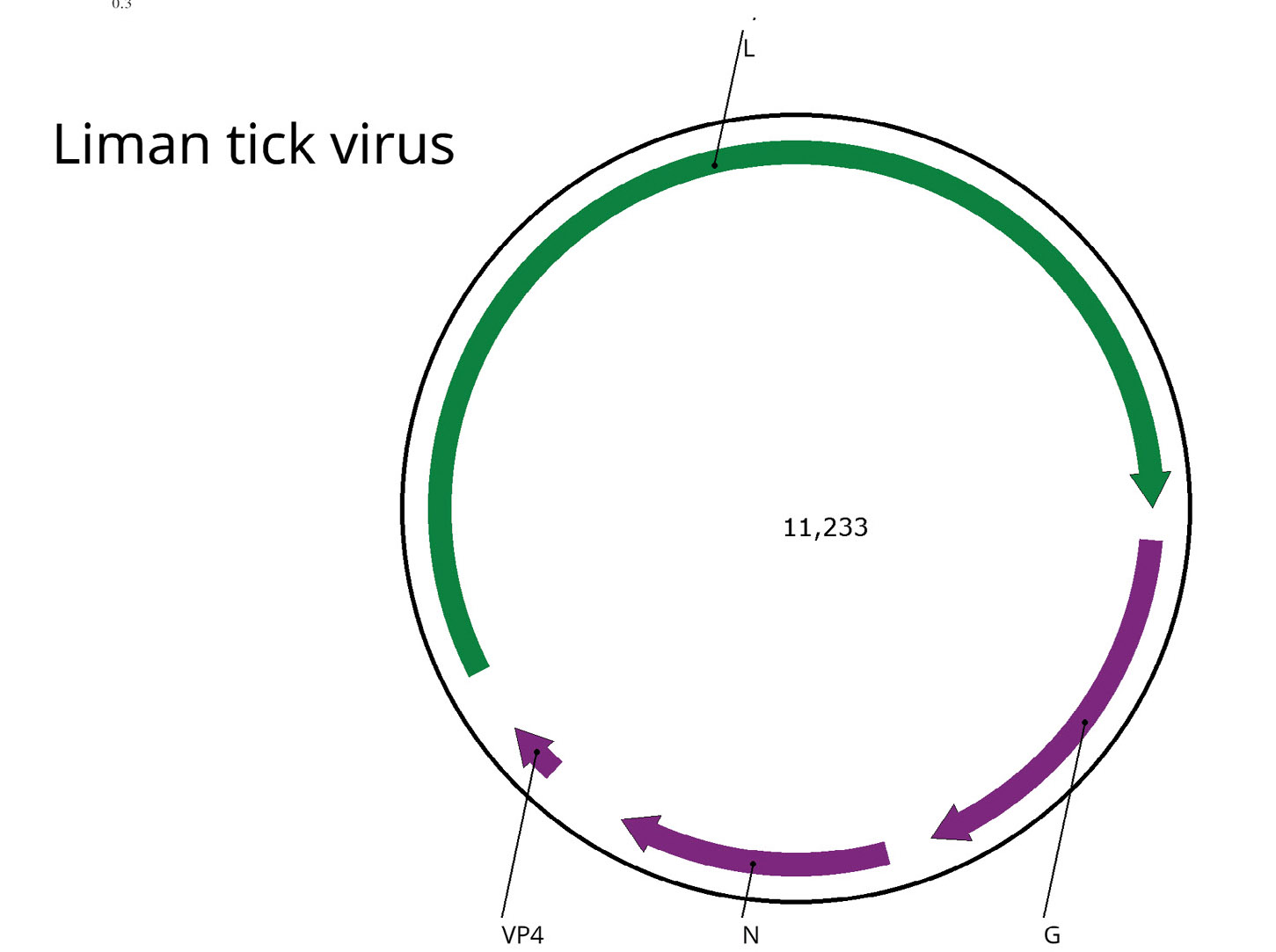
Детекция Liman tick virus (неклассифицированный представитель Chuviridae) в культуре клеток клещей HAE/CTVM8
Аннотация
Введение. Культуры клеток клещей широко используются для изучения биологии этих членистоногих и переносимых ими патогенов, в особенности вирусов. Большинство имеющихся в настоящее время культур клеток были получены из эмбриональных клеток клещей и могут быть инфицированы вирусами. Клеточная линия HAE/CTVM8, полученная из клещей Hyalomma anatolicum, часто используется для выделения переносимых клещами внутриклеточных инфекционных агентов.
Цель работы – изучение клеточной линии HAE/CTVM8 с помощью высокопроизводительного секвенирования с целью поиска вирусов в ней.
Материалы и методы. Культуральную жидкость клеток HAE/CTVM8 ультрацентрифугировали. Полученный осадок использовали для высокопроизводительного секвенирования после выделения РНК, реакции обратной транскрипции и синтеза второй цепи. Полученные прочтения фильтровали по длине и качеству в программе Trimmomatic, после чего собирали контиги с помощью программы SPAdes и анализировали их на присутствие вирусных последовательностей. Финальная сборка генома вируса осуществлялась в программе Ugene. Выравнивание последовательностей производили с использованием программы MAFFT. Построение филогенетических деревьев производилось с применением программы IQ-TREE.
Результаты. Выявлена персистенция одного вируса – Liman tick virus (LMTV) – в культуре клеток HAE/CTVM8. Филогенетически LMTV принадлежит новому семейству Chuviridae, состоящему из вирусов, обнаруженных с помощью высокопроизводительного секвенирования, вирусологическая характеристика которых отсутствует.
Заключение. Полученная в настоящем исследовании информация крайне важна для использования культуры клеток HAE/CTVM8 в научных исследованиях и изоляции новых вирусов. Наше исследование показывает, что клеточная линия HAE/CTVM8 с персистирующим в ней LMTV представляет собой готовую систему для изучения репродукции представителей семейства Chuviridae.
 147-153
147-153


Результаты выявления специфических антител класса IgG к возбудителю болезни, вызванной вирусом Эбола (Filoviridae: Orthoebolavirus), у жителей Гвинейской Республики после завершения эпидемии
Аннотация
Введение. В 2014–2016 гг. на территории Гвинеи была зарегистрирована эпидемия болезни, вызванной вирусом Эбола (БВВЭ). В 2021 г. случаи БВВЭ в регионе повторились. Важность изучения длительности постинфекционного иммунитета к вирусу Эбола в организме реконвалесцентов обусловлена тем, что после завершения эпидемии эти лица могут являться основными источниками заражения. Один из показателей циркуляции возбудителя на определенной территории – обнаружение специфических иммуноглобулинов класса G (IgG) в сыворотках крови населения.
Цель работы – выявление антител класса IgG к вирусу Эбола в сыворотках крови переболевших и практически здоровых жителей Гвинейской Республики после завершения эпидемии.
Материалы и методы. Методом иммуноферментного анализа протестированы сыворотки крови 9 пациентов, проходивших лечение в госпитале НКДЦЭМ (г. Киндиа, Гвинея), взятые после окончания болезни и до 72 мес после выздоровления, и 3939 проб крови практически здоровых жителей Гвинеи.
Результаты. Антитела класса IgG в сыворотках крови переболевших через месяц после выздоровления выявляли в титре до 1 : 800. К 12 мес уровень антител снизился до 1 : 100 и держался на таком уровне до 48 мес. После 72 мес наблюдений антитела не регистрировались. Из 3939 образцов крови здоровых жителей антитела класса IgG к вирусу Эбола выявлены в 5,6%. Бо́льшая часть положительных образцов собрана в Лесной Гвинее (7,7%), а меньшая – в Верхней (4,5%). Максимальное количество позитивных проб выявлено у лиц старше 70 лет (12,3%).
Заключение. В настоящем исследовании высокий уровень постинфекционного иммунитета в сыворотках крови переболевших БВВЭ сохранялся первые 6 мес, что соответствует данным, полученным другими авторами, и не исключает возможность повторного заражения. Самый высокий уровень иммунной прослойки населения зарегистрирован в Лесной Гвинее. Это может свидетельствовать об активной циркуляции возбудителя и постоянном контакте с ним жителей региона, что приводит к эпидемиологическим осложнениям.
 154-163
154-163


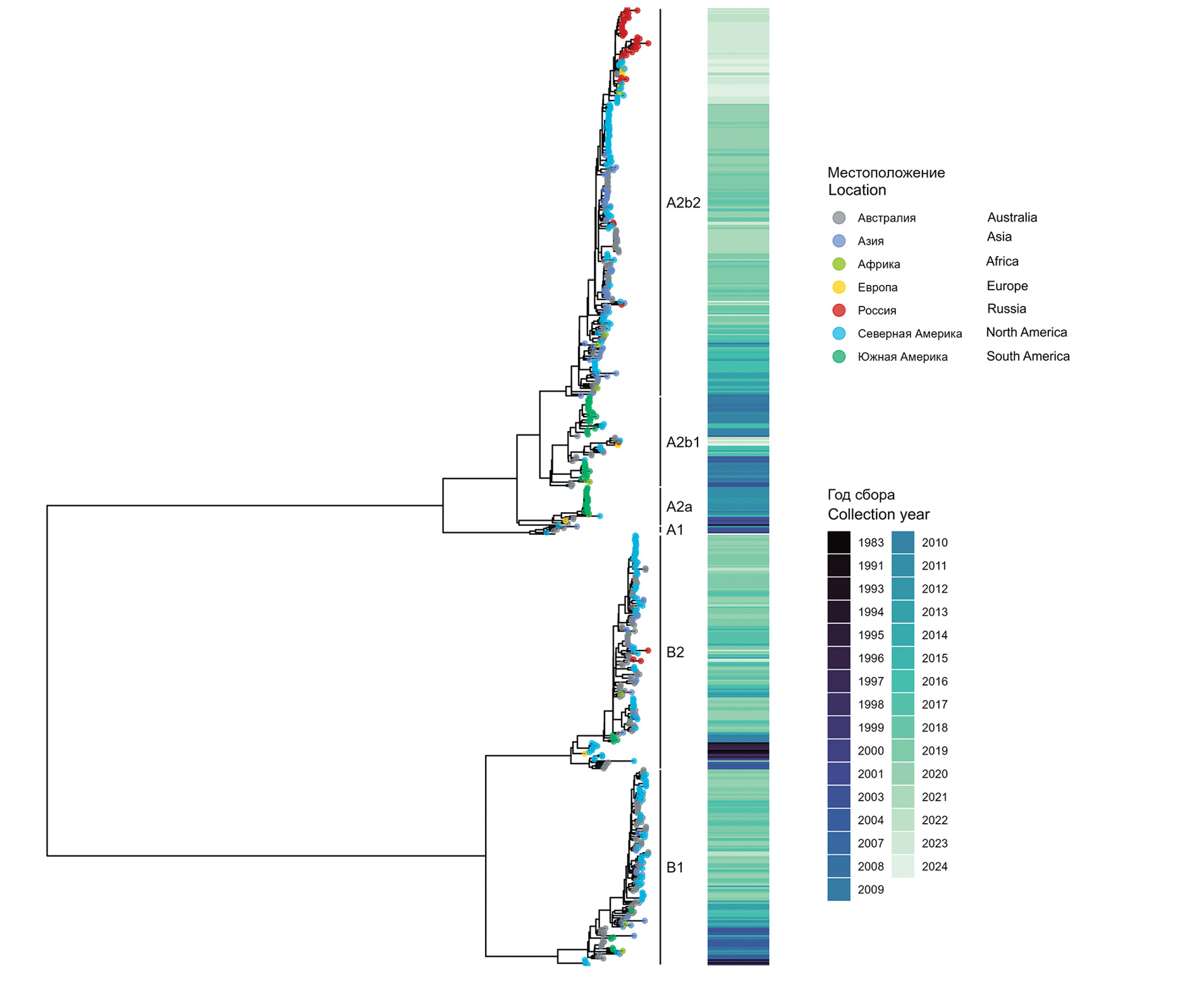
Генетическое разнообразие метапневмовируса человека (Pneumoviridae: Metapneumovirus) в России: результаты молекулярного анализа
Аннотация
Актуальность. Метапневмовирус человека (Human metapneumovirus, hMPV) имеет большое эпидемиологическое значение, являясь доминирующей причиной инфекций нижних дыхательных путей у детей младше 2 лет и лиц старше 65 лет. Возможно многократное инфицирование hMPV в течение жизни человека ввиду антигенной и генетической изменчивости возбудителя. При этом генетическая изменчивость hMPV, циркулирующих в России, остается неизученной.
Цель работы. Апробация протокола полногеномного секвенирования hMPV для оценки генетического разнообразия метапневмовирусов, циркулирующих в отдельных субъектах России.
Материалы и методы. Исследовали назофарингеальные мазки от пациентов разного возраста с острыми респираторными вирусными инфекциями, положительные в полимеразной цепной реакции на hMPV. Из части образцов вирус выделяли на клеточной культуре. На платформе Illumina MiSeq проведено полногеномное секвенирование вирусов hMPV из мазков и изолятов с последующим филогенетическим анализом.
Результаты. Впервые в России проведено полногеномное секвенирование 44 hMPV, циркулировавших в период с 2017 по 2024 г., описана их принадлежность к генетическим группам, показано доминирование клайда A2b2. Подтверждено, что наибольшее разнообразие в генах, кодирующих поверхностные белки вируса, отмечено для гена G, в то время как в гене F в изучаемый период изменения были минимальны.
Заключение. Проведенное исследование дает представление о генетическом разнообразии вирусов hMPV, циркулирующих в отдельных субъектах Российской Федерации. Изучение генетической изменчивости hMPV имеет решающее значение для понимания вирусной эволюции, динамики передачи и механизмов иммунного ускользания, которые влияют на разработку вакцин и противовирусных препаратов.
 164-176
164-176


Влияние инактивированной цельновирионной концентрированной очищенной вакцины для профилактики COVID-19 на клинические и биохимические параметры крови неполовозрелых крыс
Аннотация
Введение. С 2021 по 2022 г. распространение новой коронавирусной инфекции (COVID-19) в детской популяции составляло 9,5%, регистрировались летальные исходы. В 2022–2023 гг. доля детей, заразившихся COVID-19, выросла до 18%. Таким образом, разработка вакцины для педиатрической популяции является актуальной задачей. Необходимо отметить общую недостаточность публикаций результатов исследований безопасности, выполненных на доклиническом этапе.
Цель исследования – изучение влияния вакцины против COVID-19 на параметры общего и биохимического анализа крови у неполовозрелых крыс.
Материалы и методы. Исследование выполнено на 112 неполовозрелых крысах (60 самок, 52 самца) линии Wistar. Животных рандомизировали на группы, получившие вакцину «КовиВак» в дозах 0,125, 0,25 и 0,5 мл/животное или плацебо в объеме 0,5 мл/животное, 4-кратно внутримышечно в 1, 15, 29 и 43-й дни эксперимента, начиная с 3-го дня от рождения животного. В ходе исследования дважды (на 57-й и 71-й дни) проводили общий и биохимический анализы крови.
Результаты. У самцов зарегистрировали олигоцитемию (0,25 и 0,5 мл/животное, р < 0,05), лейкоцитоз и тромбоцитопению (0,5 мл/животное, р < 0,05). У самок установили моноцитопению (0,5 мл/животное, р < 0,05) и лейкоцитопению (0,25 мл/животное, р < 0,05). У самцов выявили увеличение количества глобулинов и общего белка (0,5 мл/животное), снижение соотношения А/G (0,25 и 0,5 мл/животное), снижение уровня холестерина (0,125 мл/животное). У самок зафиксировали увеличение количества альбумина и общего белка (0,5 мл/животное, р < 0,05), снижение уровня триглицеридов (0,125, 0,25, 0,5 мл/животное, плацебо, р < 0,05), снижение уровня триглицеридов и мочевины (0,25 мл/животное, р < 0,05).
Заключение. Все зарегистрированные значения находились в пределах внутрилабораторных норм. Таким образом, показана безопасность вакцины «КовиВак» в отношении клинических и биохимических параметров крови.
 177-188
177-188


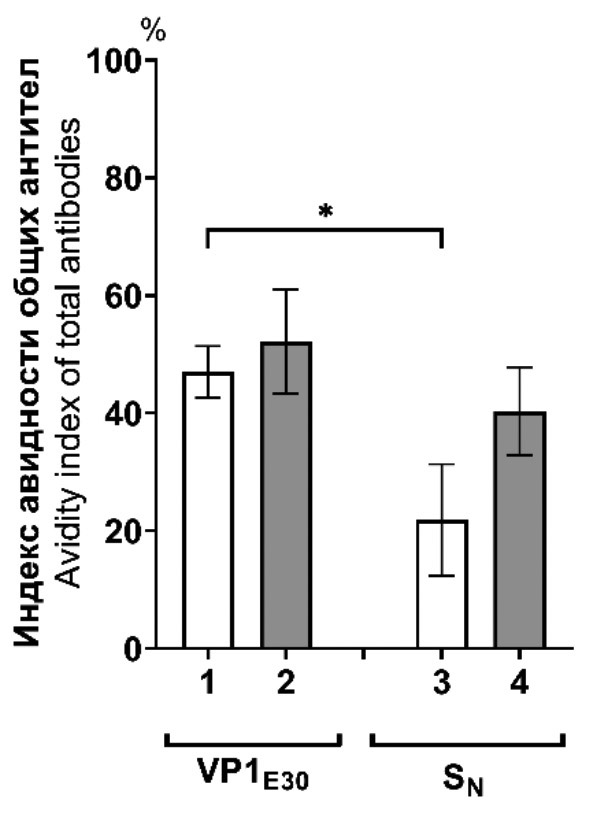
Иммунологические свойства химерного белка, содержащего основной капсидный белок echovirus 30 (Picornaviridae: Enterovirus: Enterovirus betacoxsackie)
Аннотация
Введение. Энтеровирусная инфекция, широко распространенная в мире и в России, характеризуется разнообразием клинических форм, одной из которых является серозный менингит. Наиболее частой причиной энтеровирусного менингита у детей является вирус echovirus 30 (E30). Ранее нами получен химерный белок, состоящий из S-домена белка VP1 норовируса (SN), слитого в одну молекулу с VP1 Е30 (SN-VP1E30), который в перспективе может быть использован для разработки вакцины для профилактики энтеровирусного менингита, вызванного вирусом Е30.
Целью настоящей работы явилось изучение иммунологических свойств белка SN-VP1E30.
Материалы и методы. Мышей линии Balb/c и морскую свинку иммунизировали белком SN-VP1E30. Продукцию антител класса G (IgG) и M (IgM) исследовали методом иммуноферментного анализа. Взаимодействие антител против SN-VP1E30 с вирионами энтеровирусов Е30 разных генотипов изучали методом электронной микроскопии. Реакцию нейтрализации Е30 антителами проводили в культуре клеток RD.
Результаты. У мышей, иммунизированных SN-VP1E30 без адъюванта, средние титры суммарных антител против VP1 E30 составили 1 : 19 000. Использование адъюванта повышало средний титр антител в 3 раза. Уровень IgM был значительно ниже и составил в среднем 1 : 1500. С помощью иммуноэлектронной микроскопии показано, что антитела морской свинки против химерного SN-VP1E30 способны связывать вирионы E30 генотипов h и еС2. Антитела мышей и морской свинки способны нейтрализовать Е30 в культуре клеток RD. У мышей титры нейтрализующих антител варьировали от 20 до 40, у морской свинки составили 40.
Заключение. Иммуногенность SN-VP1E30 у двух видов животных и способность антител связывать и нейтрализовать энтеровирус Е30 позволяет предложить его в качестве антигена в составе вакцины для профилактики заболеваний, вызванных E30.
 189-198
189-198