Immunological properties of a chimeric protein containing the major capsid protein of echovirus 30 (Picornaviridae: Enterovirus: Enterovirus betacoxsackie)
- Authors: Melentev D.A.1, Novikov D.V.1, Mokhonova E.V.1, Novikova N.A.1, Kashnikov A.Y.1, Selivanova S.G.1, Golitsyna L.N.1, Lapin V.A.1, Tsyganova M.I.1, Zaitsev D.E.1, Novikov V.V.1
-
Affiliations:
- Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
- Issue: Vol 70, No 2 (2025)
- Pages: 189-198
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/16739
- DOI: https://doi.org/10.36233/0507-4088-311
- EDN: https://elibrary.ru/peagdt
- ID: 16739
Cite item
Full Text
Abstract
Introduction. Enterovirus infection, widespread in the world and in Russia, is characterized by a variety of clinical forms, one of which is serous meningitis. The most common cause of enterovirus meningitis in children is echovirus 30 (E30). Previously, we obtained a chimeric protein consisting of the S domain of norovirus VP1 protein(SN), fused into one molecule with VP1 protein of E30 (SN-VP1E30), which in the future can be used to develop a vaccine for the prevention of enterovirus meningitis caused by the E30 virus.
The aim of this work was to study the immunological properties of the SN-VP1E30 protein.
Materials and methods. Balb/c mice and a guinea pig were immunized with the SN-VP1E30 protein. The production of IgG and IgM antibodies was studied by ELISA. The interaction of antibodies against SN-VP1E30 with virions of enteroviruses E30 of different genotypes was studied by electron microscopy. The reaction of neutralization of E30 by antibodies was carried out in vitro in RD cells.
Results. In mice immunized with SN-VP1E30 without adjuvant, the average titers of total antibodies against E30 VP1 protein were 1 : 19,000. The use of adjuvant increased the average titer of antibodies by 3 times. The level of IgM antibodies was significantly lower and amounted to, on average, 1 : 1500. Using immunoelectron microscopy, it was shown that guinea pig antibodies against chimeric SN-VP1E30 are able to bind virions of E30 genotypes h and eC2. Mouse and guinea pig antibodies were able to neutralize E30 in RD cell line. Neutralizing antibody titers in mice varied from 20 to 40, and were 40 in guinea pigs.
Conclusion. The immunogenicity of SN-VP1E30 in two animal species and the ability of antibodies to bind and neutralize enterovirus E30 allows us to propose it as an antigen in a vaccine for the prevention of diseases caused by E30.
Full Text
Введение
Echovirus 30 (Е30, ECHO30; сем. Picornaviridae, род Enterovirus, вид Enterovirus betacoxsackie) и другие представители вида E. betacoxsackie являются доминирующими возбудителями энтеровирусного менингита (ЭВМ) во многих странах. В РФ ежегодно регистрируется от одного до нескольких тысяч случаев заболевания ЭВМ. В периоды с высокой заболеваемостью ЭВМ вирус Е30 чаще других энтеровирусов обнаруживается у больных. В возрастной структуре заболевших ЭВМ более 90% приходится на долю детского населения. В последние годы в РФ зафиксирован рост заболеваемости энтеровирусной инфекцией. В возрастной структуре заболевших ЭВМ на территории РФ в 2023 г. доля детского населения составила 91,2%. Чаще других энтеровирусов у больных ЭВМ обнаруживался вирус Е30 (32,39%) [1]. Для успешного выздоровления больного от энтеровирусной инфекции требуется эффективный иммунный ответ. Подобный иммунный ответ включает в себя активацию клеток врожденной иммунной системы и продукцию высоких титров антител плазматическими клетками. При энтеровирусной инфекции особенно важен именно антительный ответ, который развивается при инфицировании и способен предотвратить повторное заражение [2, 3]. Наиболее эффективным способом сформировать гуморальный ответ является профилактическая вакцинация, однако вакцины против большинства энтеровирусов, включая вирус Е30, отсутствуют.
Поверхность капсида энтеровирусов сформирована белками VP1, VP2 и VP3. Среди них VP1 является основным структурным белком капсида Е30. У многих энтеровирусов в составе VP1 обнаружены линейные и конформационные эпитопы, связывание антител с которыми приводит к нейтрализации вируса [4]. На данный момент существует множество исследований, направленных на создание вакцин против энтеровирусов с использованием белка VP1 или пептидов, входящих в его состав. Однако рекомбинантные белки VP1 обычно проявляли меньшую иммуногенность у мышей по сравнению с иммунизацией инактивированными энтеровирусами. Среди подходов, используемых для повышения иммуногенности рекомбинантных белков, применяется конструирование химерных вирусоподобных частиц (англ. virus-like particles, VLP, ВпЧ). ВпЧ в своем строении имитируют размеры и структуру вирусных патогенов, а их поверхность может быть декорирована различными гетерологичными антигенами. Показано, что вакцины, использующие в качестве антигена ВпЧ, обладают высокой иммуногенностью [5–7].
В предыдущем исследовании нами был получен химерный белок, состоящий из S-домена белка VP1 норовируса (SN), слитого в одну молекулу с белком VP1 Е30 (SN-VP1E30). Химерный белок был способен образовывать ВпЧ [8]. В настоящей работе проведено изучение иммуногенных свойств белка SN-VP1E30.
Материалы и методы
Получение рекомбинантных белков
Рекомбинантные белки SN (S-домен капсидного белка VP1 норовируса), VP1E30 (полноразмерный капсидный белок VP1 энтеровируса Е30) и SN-VP1E30 (рекомбинантный химерный белок) в составе плазмид pET22b экспрессировали в Escherichia сoli Rosetta 2 (DE3), очищали методом аффинной хроматографии в денатурирующих условиях и ренатурировали, как описано ранее [8–10].
Получение антисывороток
Для исследования иммуногенности SN-VP1E30 использовали самок мышей (n = 30) линии Balb/c (возраст 8 нед, масса 18–20 г). Мышей иммунизировали внутрибрюшинно дважды с интервалом в 2 нед. Для одной инъекции использовали 10 мкг SN-VP1E30 в 500 мкл растворителя (50 мМ трис-HСl, 150 мМ NaCl и 20% глюкозы, рН 7,4). Для иммунизации с адъювантом 10 мкг рекомбинантного белка смешивали с 100 мкг Al(OH)3 («ИмБио», Россия), инкубировали в течение 12 ч при 4 °С, доводили объем до 500 мкл растворителем. В качестве отрицательного контроля мышей иммунизировали только растворителем. Через 19 сут после второй иммунизации производили забор крови, из которой готовили сыворотку крови стандартным методом.
Для исследования взаимодействия антител против SN-VP1E30 с вирусом Е30 самку морской свинки (Cavia porcellus) иммунизировали подкожно в двух повторах с интервалом в 2 нед. Для одной инъекции использовали 500 мкг SN-VP1E30 в смеси с 5 мг Al(OH)3 в 5 мл растворителя (50 мМ трис-HСl, 150 мМ NaCl и 20% глюкозы, рН 7,4). Через 21 сут после бустерной иммунизации проводили забор крови и получали сыворотку. Для приготовления суммарной фракции IgG-антител к сыворотке крови добавляли сульфат аммония до 33%, инкубировали в течение ночи при 4 °С и центрифугировали при 14 000 об/мин в микроцентрифуге Minispin (Eppendorf). Осадок растворяли в буфере (50 мМ трис-HСl, 150 мМ NaCl и 10% глицерина, рН 7,4) и проводили диализ против того же буфера.
Иммуноферментный анализ (ИФА)
Очищенные рекомбинантные белки VP1E30 или SN разводили физиологическим раствором до концентрации 1 мкг/мл и сорбировали в лунках 96-луночных планшетов в течение 24 ч при 4 °С. Для определения титра антител готовили серийные разведения сыворотки крови в ФСБ-Т (0,01 M натрий-фосфатный буферный раствор, 0,9% NaCl и 0,1% Твин-20, pH 7,4, 5% осветленного лизата клеток E. сoli Rosetta 2) в диапазоне от 100 до 164 025 раз. В качестве вторых антител применяли антитела козы к суммарным иммуноглобулинам (Ig) мыши, конъюгированные с пероксидазой хрена (ИМТЕК, Россия), антитела против мышиных иммуноглобулинов класса M (IgМ) (Elabscience, Китай) или белок А, меченный пероксидазой хрена, для обнаружения антител морской свинки. Для визуализации реакции в лунки планшетов вносили по 100 мкл 0,04% тетраметилбензидина и 0,02% перекиси водорода в натрий-цитратном буферном растворе, pH 5,0. Реакцию останавливали 1N серной кислотой и измеряли величину оптической плотности (ОП) на спектрофотометре Infinite M200 Pro (Tecan, Австрия) в двухволновом режиме: при основной длине волны 450 нм и длине волны сравнения 680 нм.
Для определения авидности антител образцы анализировали в дублях иммуноферментным методом с описанными ниже модификациями. Перед добавлением конъюгата в одну из двух лунок каждого из образцов вносили 100 мкл раствора 8М мочевины в ФСБ-Т, инкубировали в течение 3 мин, отмывали 5 раз и проводили ИФА, как описано выше. Индекс авидности рассчитывали как отношение величины ОП в лунках с 8М мочевиной к величине ОП в лунках без мочевины, полученной для одного образца сыворотки крови, выраженной в процентах.
Реакция нейтрализации
Вируснейтрализующие свойства антител исследовали с помощью реакции нейтрализации вируса Е30 в культуре клеток эмбриональной рабдомиосаркомы – RD («Биолот», Россия). Клетки выращивали в среде DМЕМ, содержащей 2% витаминов для среды RPMI-1640, 2% аминокислот, заменимых для MEM, 2% L-глутамина 200 мМ, пеницилина-стрептомицина («ПанЭко», Россия), 10% эмбриональной телячьей сыворотки («Biosera», Франция). Для заражения использовали вирусы Е30 с генотипом eC2 (изолят 2045/23) и генотипом h (изолят 2700/16), ранее выделенные с использованием клеток RD от больных с подтвержденным методом полимеразной цепной реакции диагнозом «энтеровирусный менингит» [11]. Сыворотку крови иммунизированных лабораторных животных прогревали в течение 30 мин при 56 °С. Далее в 4 повторах проводили последовательные 10-кратные разведения сыворотки полной питательной средой, содержащей 100 50% тканевых цитопатических доз (ТЦД50) Е30, и инкубировали в течение 1 ч при 37 °С. Из лунок 96-луночного планшета, содержащих 100% монослой клеток RD, удаляли ростовую среду и вносили разведения сыворотки крови иммунизированных животных. В качестве контролей использовали сыворотку крови неиммунизированных мышей, питательную среду, не содержащую вирус, и питательную среду, содержащую 100 ТЦД50 Е30. Клетки инкубировали в течение 4 сут при 37 °С и 5% СО2. Результаты оценивали с использованием колориметрического теста для оценки метаболической активности клеток (МТТ-тест). Для этого в каждую лунку добавляли 10 мкл 0,0005% метилтиазолилтетразолия бромида, растворенного в DMEM, инкубировали в течение 2 ч при 37 °С и 5% СО2, вносили 100 мкл растворителя (40% ДМСО, 16% SDS и 2% уксусной кислоты, рН 4,7) и перемешивали до полного растворения кристаллов формазана. Учет результатов проводили спектрофотометрически при ОП 570 нм с учетом фоновых значений при 620 нм. Нейтрализующий титр определяли по последнему разведению сыворотки, в которой средний показатель ОП был равен или превышал пороговое значение, рассчитанное как половина разницы между ОП в лунках с незараженными клетками и ОП в лунках с клетками, зараженными вирусом Е30.
Электронная микроскопия
Способность антител против SN-VP1E30, полученных из сыворотки морской свинки, взаимодействовать с вирионами энтеровируса Е30 разных генотипов изучали методом электронной микроскопии (ЭМ). Использовали фекалии двух пациентов, в которых были обнаружены Е30 с генотипом еС2 (Е30-еС2 1194/24) и h (Е30-h 2671/17). В качестве контрольного образца использовали фекалии, в которых был обнаружен Norovirus GII.4 130/24. Готовили 10% суспензию вируссодержащих фекалий в физиологическом растворе, центрифугировали при 5000 об/мин в течение 10 мин, супернатант последовательно фильтровали через мембранные фильтры PES Female Luer Lok/Male Luer slip с размером пор 0,45 мкм, а затем 0,22 мкм (Membrane Solutions LLC (MS), Китай) и использовали в работе.
Для проведения иммуноэлектронной микроскопии на медную сетку для ЭМ, покрытую парлодиевой пленкой-подложкой, сорбировали фракцию иммуноглобулинов морской свинки, содержащую антитела класса G (IgG) против SN-VP1E30, в течение 60 мин при комнатной температуре. Избыток иммуноглобулинов отмывали водой, сетку помещали на каплю вирусной суспензии и инкубировали в течение 60 мин при 37 °С. Препараты окрашивали водным раствором 2% уранилацетата (рН 4,5). В качестве контроля использовали сетку без сорбированных антител.
Для исследования возможности формирования иммунных комплексов к 20 мкл вирусной суспензии добавляли 20 мкл антител морской свинки и инкубировали в течение 30 мин при 37 °С, затем в течение 12 ч при 4 °С. После инкубации препараты центрифугировали в течение 30 мин при 10 000 об/мин. Полученные осадки разводили в 20 мкл воды и наносили на электронно-микроскопическую сетку, покрытую парлодиевой пленкой, контрастировали в водном растворе 2% фосфорно-вольфрамовой кислоты. Результаты визуализировали с помощью электронного микроскопа просвечивающего типа НТ7700 (Hitachi, Япония).
Результаты
Иммуногенность SN-VP1E30
На первом этапе работы сравнивали титры антител к белку VP1E30 у мышей, иммунизированных слитым белком SN-VP1E30 с адъювантом и без. Поскольку VP1E30 растворялся только в 4М мочевине, он использовался только в качестве антигена для выявления антител методом ИФА. В контрольных образцах сыворотки крови мышей, иммунизированных только буфером для растворения белков, антитела к рекомбинантным белкам VP1E30 и SN норовируса не выявлены. Титры суммарных антител против VP1E30, иммунизированных SN-VP1E30, в среднем достигали 1 : 19 000 (рис. 1 а). Использование адъюванта повышало средний титр антител в 3 раза (p = 0,0471). Для того чтобы определить, какая из частей химерного белка обладала большей иммуногенностью, проводили исследование титров антител против норовирусной части (SN) химерного белка. Установлено, что титры антител против VP1E30 были значительно выше, чем титры против SN (рис. 1 а) как при использовании адъюванта (p = 0,0078), так и без него (p = 0,0078). Уровни IgM-антител не отличались между группами мышей, иммунизированных с адъювантом и без него (рис. 1 б).
Рис. 1. Сравнение титров антител к белкам VP1E30 и SN после иммунизации мышей химерным белком SN-VP1E30. а – титры суммарных антител (n = 10); б – титры IgM-антител (n = 10). 1 – титр антител против VP1E30 при иммунизации без адъюванта, 2 – титр антител против VP1E30 при иммунизации с адъювантом, 3 – титр антител против SN при иммунизации без адъюванта, 4 – титр антител против SN в смеси с адъювантом. * – p ≤ 0,05.
Fig. 1. Comparison of antibody titers to VP1E30 and SN proteins after immunization of mice with the chimeric SN-VP1E30 protein. a – total antibody titers (n = 10); b – IgM antibody titers (n = 10). 1 – titer of antibodies against VP1E30 upon immunization without adjuvant, 2 – titer of antibodies against VP1E30 upon immunization with adjuvant, 3 – titer of antibodies against SN upon immunization without adjuvant, 4 – titer of antibodies against SN in a mixture with adjuvant. * – p ≤ 0.05.
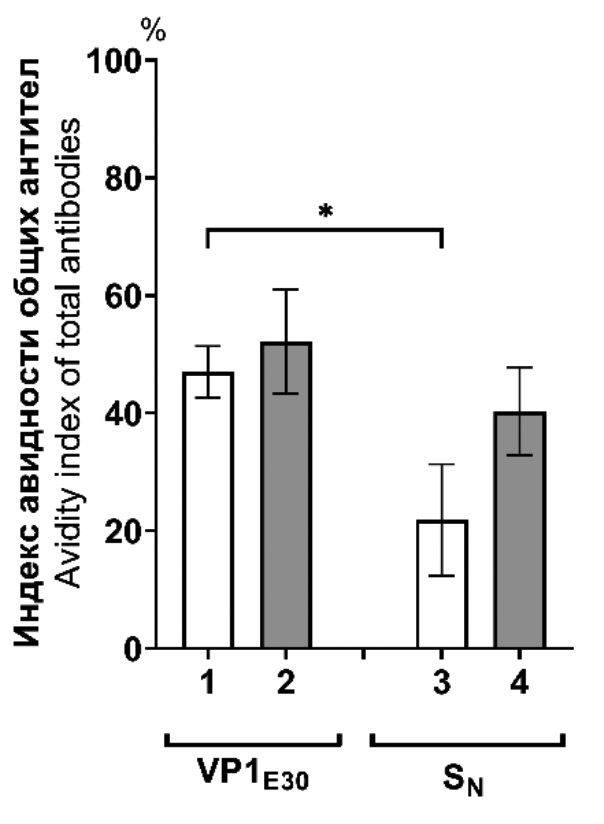
Установлено, что в среднем индекс авидности суммарных антител против VP1E30 составил 47% и использование адъюванта не влияло на этот показатель (рис. 2 а). В то же время авидность антител против VP1E30 была выше, чем авидность антител против SN (p = 0,044), использование адъюванта сглаживало данный эффект. Индекс авидности IgM-антител к белку VP1E30 не отличался от показателя у суммарных антител и был выше, чем аналогичный показатель у IgM против SN вне зависимости от того, использовали адъювант (p = 0,033) или нет (p = 0,015) (рис. 2 б).
Рис. 2. Сравнение индексов авидности антител против VP1E30 и SN после иммунизации мышей химерным белком SN-VP1E30. а – индекс авидности суммарных иммуноглобулинов (n = 10); б – индекс авидности IgM-антител (n = 10). 1 – индекс авидности антител против VP1E30 после иммунизации мышей SN-VP1E30 без адъюванта, 2 – индекс авидности антител против VP1E30 после иммунизации мышей SN-VP1E30 в смеси с адъювантом, 3 – индекс авидности антител против SN после иммунизации мышей SN-VP1E30 без адъюванта, 4 – индекс авидности антител против SN после иммунизации мышей в смеси с адъювантом. * – p ≤ 0,05.
Fig. 2. Comparison of the avidity indices of antibodies against VP1E30 and SN after immunization of mice with the chimeric protein SN-VP1E30. a – avidity index of total immunoglobulins (n = 10); b – avidity index of IgM antibodies (n = 10). 1 – avidity index of antibodies against VP1E30 after immunization of mice with SN-VP1E30 without adjuvant, 2 – avidity index of antibodies against VP1E30 after immunization of mice with SN-VP1E30 mixed with adjuvant, 3 – avidity index of antibodies against SN after immunization of mice with SN-VP1E30 without adjuvant, 4 – avidity index of antibodies against SN after immunization of mice mixed with adjuvant. * – p ≤ 0.05.
Взаимодействие антител против SN-VP1E30 с Е30
Способность антител к SN-VP1E30 взаимодействовать с вирионами Е30 исследовали с помощью ЭМ. На первом этапе подтверждали присутствие в исследуемом препарате вирусных частиц Е30 и норовируса (рис. 3 а, г, ж). Далее с использованием сеток, на поверхности которых сорбированы иммуноглобулины против SN-VP1E30, было показано, что исследуемые антитела способны связывать вирусные частицы Е30 генотипов h и eC2 (рис. 3 б, д), что проявилось в увеличении количества наблюдаемых вирионов. Норовирус не выявлялся с использованием сеток, покрытых антителами против SN-VP1E30 (рис. 3 з). Исследование образования иммунокомплексов антител против SN-VP1E30 с вирусными частицами показало сходные результаты. Добавление к препаратам вирусов Е30-еС2 и Е30-h антител против SN-VP1E30 приводило к появлению агрегатов вирусных частиц (рис. 3 в, е), которых не наблюдалось с вирионами норовируса (рис. 3 и).
Рис. 3. Электронные микрофотографии иммунокомплексов. Цена деления – 100 нм. a – исходный препарат Е30-еС2 1194/24; б – взаимодействие антител против SN-VP1E30 и энтеровируса E30-еС2; в – образования иммунных комплексов с E30-еС2; г – исходный препарат Е30-h 2671/17; д – взаимодействия антител против SN-VP1E30 и энтеровируса Е30-h; е – образования иммунных комплексов с Е30-h; ж – исходный препарат Norovirus GII.4 130/24; з – взаимодействия антител против SN-VP1E30 и Norovirus GII.4; и – образования иммунных комплексов с Norovirus GII.4.
Fig. 3. Electron micrographs of immune complexes. The bar represents 100 nm. a – original preparation E30-еС2 1194/24; b – interactions of antibodies against SN-VP1E30 and enterovirus E30-еС2; c – formation of immune complexes with E30-еС2; d – original preparation E30-h 2671/17; e – interactions of antibodies against SN-VP1E30 and enterovirus E30-h; f – formation of immune complexes with E30-h; g – original preparation Norovirus GII.4 130/24; h – interactions of antibodies against SN-VP1E30 and Norovirus GII.4; i – formation of immune complexes with Norovirus GII.4.
В реакции нейтрализации вируса Е30 в культуре клеток были исследованы сыворотки крови 3 мышей, иммунизированных SN-VP1E30 без адъюванта, 3 мышей, иммунизированных SN-VP1E30 с адъювантом, и сыворотка морской свинки, иммунизированной SN-VP1E30 с адъювантом. Установлено, что антитела мыши и морской свинки были способны нейтрализовать Е30 генотипов h и еС2. У мышей титры нейтрализующих антител варьировали от 20 до 40, а у морской свинки составили 40.
Обсуждение
Многолетний опыт применения вакцин против полиомиелита показывает, что аттенуированные штаммы энтеровирусов способны к быстрому восстановлению вирулентности, а производство инактивированной вакцины сопряжено с биологическими рисками [12]. В связи с этим исследования направлены на разработку альтернативных вакцин, в которых присутствие генетического материала энтеровирусов сведено к минимуму. Субъединичные вакцины показали низкую иммуногенность. Например, при использовании гена VP1 EV-A71 в составе ДНК-вакцины была показана индукция специфичного, но низкого антительного ответа против VP1 EV-A71 у мышей [13]. В другом исследовании при иммунизации короткими пептидами SP55 и SP70 из области VP1 EV-A71 титры антител против них были ниже, чем против инактивированного вируса EV-A71 [14]. Для повышения иммуногенности энтеровирусных белков широкое распространение получили ВпЧ [15]. Полученный в нашем исследовании путем генетического слияния с S-доменом белка VP1 норовируса и VP1 Е30 химерный белок SN-VP1E30 образовывал полые сферические ВпЧ диаметром 30–50 нм [8]. Иммунизация мышей раствором SN-VP1E30 без адъюванта, приводила к продукции высоких титров антител против VP1E30 с авидностью, превышающей 50%. Титры антител против VP1E30 были сопоставимы с титрами антител против VP1 EV-A71, полученными другими авторами при иммунизации мышей инактивированным вирусом [16, 17].
Следует отметить, что титры антител против VP1E30 были намного выше, чем титры антител против SN. Индекс авидности к белку VP1E30 также был выше (p = 0,044), чем к норовирусному SN, при иммунизации без адъюванта, что свидетельствует о развитии гуморального иммунного ответа преимущественно на антиген, расположенный на поверхности химерных ВпЧ. В аналогичном исследовании иммуногенных свойств ВпЧ, состоящих из SN и белка VP8 ротавируса, были получены сходные результаты, титры антител к VP8 были выше, чем к SN [18].
Особый интерес представляет продукция антител IgM против химерного белка, которые сохранялись на 33-и сутки после иммунизации в титрах, в среднем составляющих 1 : 1500. Ранее W. Zhu и соавт. показали, что небольшие дозы моноклональных IgM М20 против VP1 энтеровируса EV-A71 нейтрализовали EV-A71 in vitro и in vivo более эффективно, чем IgG. Кроме того, IgM были способны нейтрализовать другие энтеровирусы (CVА6, CVА10 и CVА16), в отличие от IgG [19, 20].
Последние 10 лет в генотиповой структуре российских штаммов вируса Е30 преобладали 2 генотипа: h и eC2 [1, 21]. Для того чтобы понять, как антитела против химерного белка SN-VP1E30 взаимодействуют с разными генотипами E30, проводили иммунную ЭМ. Показано, что антитела способны связывать вирионы E30 генотипов h и еС2 как при сорбции антител на подложке микроскопической сетки, так и в свободном виде, с образованием агрегатов вирусных частиц. Данные результаты свидетельствуют о сохранении антигенных детерминант в составе химерного белка, антитела против которых способны связывать вирионы Е30 разных генотипов. Полученные нами результаты совпадали с описанными ранее для EV70. D. Chen и соавт. показали, что антитела против VP1 EV70 также вызывали иммунопреципитацию разных генотипов вируса [22]. Кроме того, после иммунизации двух видов животных антитела против SN-VP1E30 нейтрализовали разные генотипы Е30 in vitro, что свидетельствует о перспективности использования SN-VP1E30 в качестве антигена в составе вакцины.
Следует отметить, что в ответ на иммунизацию SN-VP1E30 образовывались антитела против S-части белка VP1 норовируса. Однако эти антитела не были способны связывать вирионы норовируса. Данное наблюдение объясняется структурной организацией вириона норовируса, VP1 которого состоит из P- и S-доменов. При этом Р-домен формирует поверхность капсида и стерически экранирует доступ антител к S-домену, который расположен внутри капсида [23].
Заключение
Таким образом, иммунизация двух видов лабораторных животных с использованием SN-VP1E30 показала сильный антительный ответ на VP1 E30. Антитела против VP1 E30 были способны связывать и нейтрализовать in vitro разные генотипы Е30. Представленные данные свидетельствуют о том, что химерный белок SN-VP1E30 может быть предложен в качестве антигена в составе вакцины для профилактики заболеваний, вызванных E30.
About the authors
Dmitry A. Melentev
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Author for correspondence.
Email: dim-melente@yandex.ru
ORCID iD: 0000-0002-2441-6874
Junior Researcher, laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodDmitry V. Novikov
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: novikov.dv75@mail.ru
ORCID iD: 0000-0001-7049-6935
PhD, Leading Researcher, laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodEkaterina V. Mokhonova
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: ekaterinamohonova@yandex.ru
ORCID iD: 0000-0002-9742-7646
researcher, laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodNadezhda A. Novikova
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: novikova_na@mail.ru
ORCID iD: 0000-0002-3710-6648
Dr. Sci., Professor, Leading Researcher, Head of the laboratory of molecular epidemiology of viral infections
Russian Federation, 603950, Nizhny NovgorodAlexander Yu. Kashnikov
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mevirfc@mail.ru
ORCID iD: 0000-0003-1033-7347
Researcher, laboratory of molecular epidemiology of viral infections
Russian Federation, 603950, Nizhny NovgorodSvetlana G. Selivanova
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: svetafor22@mail.ru
ORCID iD: 0000-0002-6610-1774
PhD, Senior researcher, laboratory of molecular epidemiology of viral infections
Russian Federation, 603950, Nizhny NovgorodLyudmila N. Golitsyna
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: lyudmila_galitzina@mail.ru
ORCID iD: 0000-0002-8064-4476
PhD, Leading Researcher, laboratory of molecular epidemiology of viral infections
Russian Federation, 603950, Nizhny NovgorodVladislav A. Lapin
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: fridens.95@yandex.ru
ORCID iD: 0000-0002-5905-5722
Junior Researcher, laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodMaria I. Tsyganova
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: maria_che@mail.ru
ORCID iD: 0000-0002-2811-6844
PhD, Leading Researcher, laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodDmitry E. Zaitsev
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mitya.zaitseff@yandex.ru
ORCID iD: 0000-0002-7663-6924
Senior Lab Assistant, laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodViktor V. Novikov
Academician I.N. Blokhina Nizhny Novgorod Scientific Research Institute of Epidemiology and Microbiology of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mbre@mail.ru
ORCID iD: 0000-0002-2449-7213
Dr. Sci., Professor, Leading Researcher, Head of the laboratory of immunochemistry
Russian Federation, 603950, Nizhny NovgorodReferences
- Golitsyna L.N., Kashnikova A.D., Polyanina A.V., Zaitseva N.N., Mikhailova Yu.M., Cherepanova E.A. Enterovirus (non-polio) infection in the Russian Federation in 2023. In: Incidence, Etiological Structure and Prevention Issues of Enterovirus (Non-Polio) Infection: Electronic Resource [Zabolevaemost’, etiologicheskaya struktura i voprosy profilaktiki enterovirusnoi (nepolio) infektsii: Informatsionnyi byulleten’]. Nizhnii Novgorod; 2024: 3–8. Available at: https://www.nniiem.ru/file/razrabotki/2024/nniiem-inf-byulleten-n-11-po-evi-za-2023-dlya-sayta-korr-oformlenie-novikova-na.pdf (in Russian)
- Wallace G.S., Curns A.T., Weldon W.C., Oberste M.S. Seroprevalence of poliovirus antibodies in the United States population, 2009–2010. BMC Public Health. 2016; 16: 721. https://doi.org/10.1186/s12889-016-3386-1
- Zhu R., Cheng T., Yin Z., Liu D., Xu L., Li Y., et al. Serological survey of neutralizing antibodies to eight major enteroviruses among healthy population. Emerg. Microbes Infect. 2018; 7(1): 2. https://doi.org/10.1038/s41426-017-0003-z
- Huang K.A. Structural basis for neutralization of enterovirus. Curr. Opin. Virol. 2021; 51: 199–206. https://doi.org/10.1016/j.coviro.2021.10.006
- Al-Barwani F., Donaldson B., Pelham S.J., Young S.L., Ward V.K. Antigen delivery by virus-like particles for immunotherapeutic vaccination. Ther. Deliv. 2014; 5(11): 1223–40. https://doi.org/10.4155/tde.14.74
- Chroboczek J., Szurgot I., Szolajska E. Virus-like particles as vaccine. Acta Biochim. Pol. 2014; 61(3): 531–9.
- Ye X., Ku Z., Liu Q., Wang X., Shi J., Zhang Y., et al. Chimeric virus-like particle vaccines displaying conserved enterovirus 71 epitopes elicit protective neutralizing antibodies in mice through divergent mechanisms. J. Virol. 2014; 88(1): 72–81. https://doi.org/10.1128/JVI.01848-13
- Novikov D.V., Melentev D.A., Mokhonov V.V., Kashnikov A.Yu., Novikova N.A., Lapin V.A., et al. Construction of Norovirus (Caliciviridae: Norovirus) virus-like particles containing VP1 of the Echovirus 30 (Picornaviridae: Enterovirus: Enterovirus B). Voprosy virusologii. 2021; 66(5): 383–9. https://doi.org/10.36233/0507-4088-79 https://elibrary.ru/mkbqet (in Russian)
- Lapin V.A., Novikov D.V., Mokhonova E.V., Melentyev D.A., Tsyganova M.I., Zaitsev D.E., et al. Production of recombinant norovirus VP1 protein and its antigenic and immunogenic properties. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2024; 101(5): 661–7. https://doi.org/10.36233/0372-9311-552 https://elibrary.ru/ubmktf (in Russian)
- Melentev D.A., Novikov D.V., Lapin V.A., Mokhonova E.V., Tsiganova M.I., Manakova E.A., et al. Blood anti-surface proteins Echovirus 30 (Enterovirus, Picornaviridae) antibodies in residents of the Nizhny Novgorod region. Infektsiya i immunitet. 2024; 14(6): 1179–86. https://doi.org/10.15789/2220-7619-BAC-16103 https://elibrary.ru/exbfif (in Russian)
- Nix W.A., Oberste M.S., Pallansch M.A. Sensitive, seminested PCR amplification of VP1 sequences for direct identification of all enterovirus serotypes from original clinical specimens. J. Clin. Microbiol. 2006; 44(8): 2698–704. https://doi.org/10.1128/JCM.00542-06
- Muslin C., Kain A.M., Bessaud M., Blondel B., Delpeyroux F. Recombination in enteroviruses, a multi-step modular evolutionary process. Viruses. 2019; 11(9): 859. https://doi.org/10.3390/v11090859
- Yuan J., Tang X., Yin K., Tian J., Rui K., Ma J., et al. GITRL as a genetic adjuvant enhances enterovirus 71 VP1 DNA vaccine immunogenicity. Immunol. Res. 2015; 62(1): 81–8. https://doi.org/10.1007/s12026-015-8637-1
- Foo D.G., Alonso S., Phoon M.C., Ramachandran N.P., Chow V.T., Poh C.L. Identification of neutralizing linear epitopes from the VP1 capsid protein of Enterovirus 71 using synthetic peptides. Virus Res. 2007; 125(1): 61–8. https://doi.org/10.1016/j.virusres.2006.12.005
- Collins K.A., Snaith R., Cottingham M.G., Gilbert S.C., Hill A.V.S. Enhancing protective immunity to malaria with a highly immunogenic virus-like particle vaccine. Sci. Rep. 2017; 7: 46621. https://doi.org/10.1038/srep46621
- Wu C.N., Lin Y.C., Fann C., Liao N.S., Shih S.R., Ho M.S. Protection against lethal enterovirus 71 infection in newborn mice by passive immunization with subunit VP1 vaccines and inactivated virus. Vaccine. 2001; 20(5-6): 895–904. https://doi.org/10.1016/s0264-410x(01)00385-1
- Zhou S.L., Ying X.L., Han X., Sun X.X., Jin Q., Yang F. Characterization of the enterovirus 71 VP1 protein as a vaccine candidate. J. Med. Virol. 2015; 87(2): 256–62. https://doi.org/10.1002/jmv.24018
- Xia M., Huang P., Sun C., Han L., Vago F.S., Li K., et al. Bioengineered Norovirus S60 nanoparticles as a multifunctional vaccine platform. ACS Nano. 2018; 12(11): 10665–82. https://doi.org/10.1021/acsnano.8b02776
- Zhu W., Liu Z., Zheng X., Li J., Lu K., Jiang X., et al. A broad and potent IgM antibody against tetra-EV-As induced by EVA71 and CVA16 co-immunization. Vaccine. 2021; 39(44): 6510–9. https://doi.org/10.1016/j.vaccine.2021.09.056
- Zhu W., Li J., Wu Z., Li H., Zhang Z., Zhu X., et al. Dual blockages of a broad and potent neutralizing IgM antibody targeting GH loop of EV-As. Immunology. 2023; 169(3): 292–308. https://doi.org/10.1111/imm.13629
- Golitsyna L.N., Zverev V.V., Epifanova N.V., Sashina T.A., Kashnikov A.Yu., Sozonov D.V., et al. Enterovirus (non-polio) infection in the Russian Federation in 2017. In: Incidence, Etiological Structure and Prevention Issues of Enterovirus (Non-Polio) Infection: Electronic Resource [Zabolevaemost’, etiologicheskaya struktura i voprosy profilaktiki enterovirusnoi (nepolio) infektsii: Informatsionnyi byulleten’]. Nizhnii Novgorod; 2024: 3–8. Available at: https://nniiem.ru/file/razrabotki/2018/byulleten-evi-2017-n5-may-18-1.pdf (in Russian)
- Chen D., Duggan C., Texada D.E., Reden T.B., Kooragayala L.M., Langford M.P. Immunogenicity of enterovirus 70 capsid protein VP1 and itsnon-overlapping N- and C-terminal fragments. Antiviral Research. 2005; 66: 111–117. https://doi.org/10.1016/j.antiviral.2005.02.004.
- Prasad B.V., Hardy M.E., Dokland T., Bella J., Rossmann M.G., Estes M.K. X-ray crystallographic structure of the Norwalk virus capsid. Science. 1999; 286(5438): 287–90. https://doi.org/10.1126/science.286.5438.287
Supplementary files