Вопросы вирусологии
Международный рецензируемый научно-практический журнал «Вопросы вирусологии» (транслитерированное основное название «Voprosy virusologii», параллельное название - Problems of Virology, ISSN (Print) 0507-4088, ISSN (Online) 2411-2097) знакомит читателей с достижениями российской и мировой вирусологии, размещает на своих страницах статьи, посвященные изучению вирусов и вирусных болезней человека, животных и растений.
Видное место в журнале отводится публикации результатов экспериментальных работ по различным вопросам общей и частной вирусологии.
Журнал публикует материалы, способствующие внедрению в практику достижений вирусологической науки по ликвидации и снижению распространенности инфекционных заболеваний, а также их диагностике, профилактике и лечению.
В обзорных статьях обобщаются последние достижения в области вирусологии. С целью привлечения внимания вирусологов к наиболее актуальным вопросам, требующим дальнейшего изучения, в журнале публикуются редакционные заметки и рецензии на книги. Читатель найдет в журнале описание новых методов исследований, методических приемов, новой аппаратуры, средств диагностики и лечения.
Журнал рассчитан на вирусологов (медиков и ветеринаров), эпидемиологов, паразитологов, фармакологов, биохимиков и других специалистов.
«Вопросы вирусологии» - журнал открытого доступа, не берущий плату за публикацию научных статей.
Журнал входит в SCOPUS (Q4).
В соответствии с рекомендациями ВАК (Письмо ВАК от 06.12.2022 № 02-1198), журнал относится к категории К1 как издание, входящее в базы данных SCOPUS и RSCI.
Журнал, входит в рекомендованный ВАК «Перечень рецензируемых научных изданий, в которых должны быть опубликованы основные научные результаты диссертаций на соискание ученой степени кандидата наук, на соискание ученой степени доктора наук» (в соответствии с п.5 Правил формирования Перечня (Приказ Минобрнауки России от 12.12.2016 N 1586), как входящий в международную реферативную базу данных и систем цитирования Scopus) по специальностям:
- 1.5.10. Вирусология (медицинские и биологические науки)
- 3.2.2. Эпидемиология (медицинские и биологические науки)
- 3.1.22. Инфекционные болезни (медицинские и биологические науки)
- 3.3.6 Фармакология, клиническая фармакология (медицинские и биологические науки)
Журнал представлен в следующих международных базах библиографических данных и информационно-справочных системах: РИНЦ, RSCI (на платформе WoS), Abstract Journals, AIDS & Cancer Research, Biocontrol News and Information, Biological Sciences, Chemical Abstracts, DOAJ, EBSCOhost Biological Abstracts, EBSCOhost Wildlife & Ecology Studies Worldwide, Elsevier BV Scopus, Elsevier BV EMBASE, Index Medicus, Excerpta Medica, Index Veterinarius, MEDLINE, National Library of Medicine PubMed, Parasitology Database, Poultry Abstracts, Review of Medical and Veterinary Entomology, SCOPUS, Thomson Reuters Biological Abstracts, Thomson Reuters BIOSIS Previews, Thomson Reuters Science Citation Index Expanded, Thomson Reuters Web of Science, Tropical Diseases Bulletin, Veterinary Science Database, Virology and AIDS Abstracts, ROAD.
В 2022 г журнал вошел в DOAJ и удостоен DOAJ SEAL.
Контент доступен под лицензией Creative Commons — Attribution 4.0 International, CC-BY.
Каждой статье журнала присваивается идентификатор цифрового объекта — DOI.
Все публикуемые в журнале статьи, обзоры и лекции проходят обязательное двойное слепое рецензирование членами редколлегии и приглашенными экспертами.
Статьи иностранных авторов, а также русскоязычные статьи, отдельно рекомендованные редколлегией, публикуются на русском и английском языке под единым DOI. Перевод носителем языка и научное редактирование перевода производится за счет Редакции.
Журнал выходит 1 раз в 2 месяца (6 выпусков в год).
Журнал является органом Общероссийской общественной организации «Всероссийское научно- практическое общество эпидемиологов, микробиологов и паразитологов».
Учредители:
- ФБУН ЦНИИ Эпидемиологии Роспотребнадзора,
- Общероссийская общественная организация «Всероссийское научно-практическое общество эпидемиологов, микробиологов и паразитологов».
Издатель:
- ФБУН ЦНИИ Эпидемиологии Роспотребнадзора.
При регистрации на сайте читатели и авторы получают автоматические уведомления о содержании новых выпусков Журнала на адрес своей электронной почты с возможностью отписаться от рассылки.
Текущий выпуск
Том 70, № 4 (2025)
- Год: 2025
- Выпуск опубликован: 16.09.2025
- Статей: 9
- URL: https://virusjour.crie.ru/jour/issue/view/141
Весь выпуск
ОБЗОРЫ
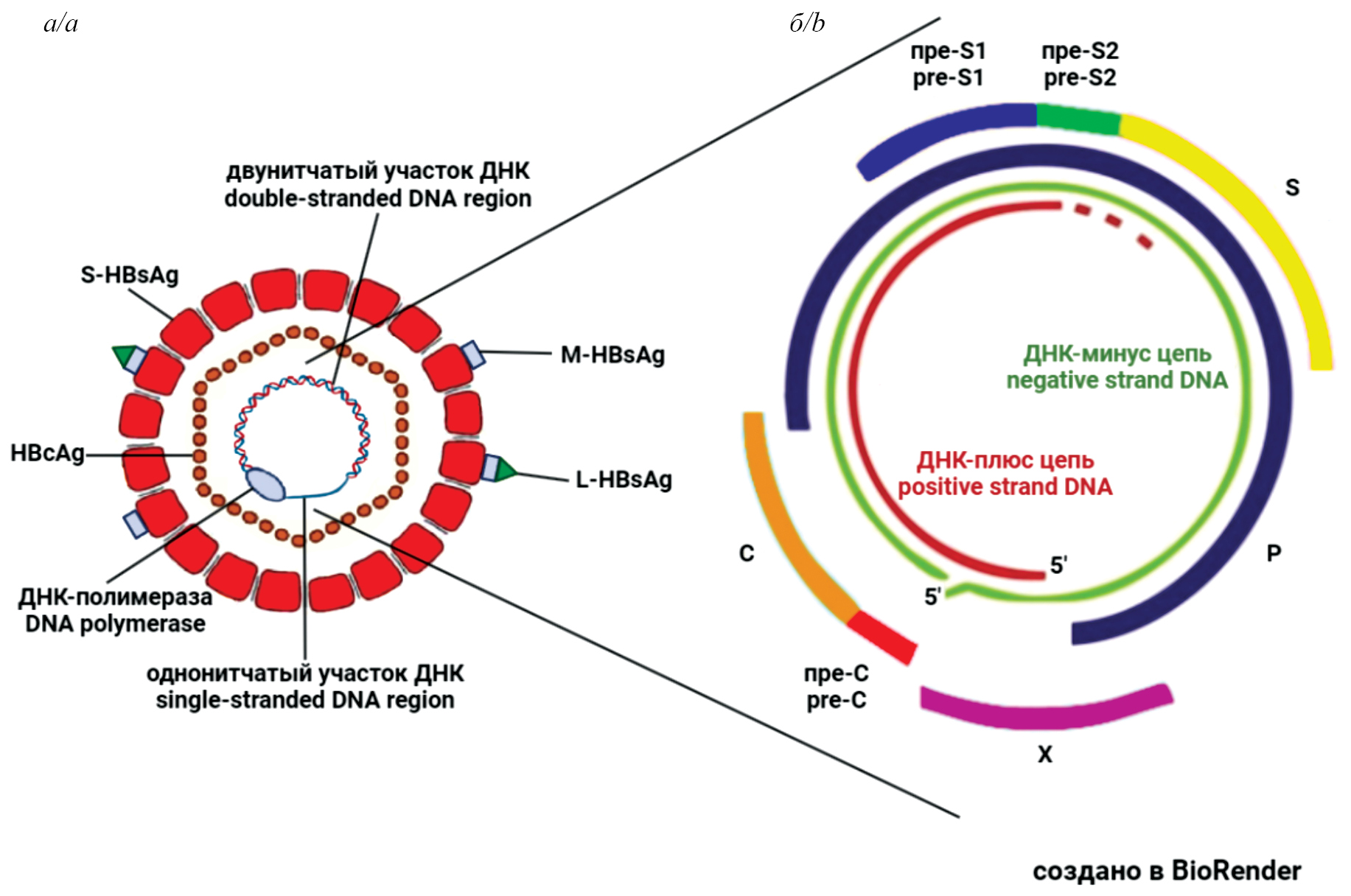
Скрытый гепатит B: распространенность и клиническая значимость. Роль в возникновении патологии печени и сочетанных вирусных инфекций
Аннотация
В обзоре рассмотрены вопросы, связанные со скрытым гепатитом В (СГВ), который возникает на поздней стадии хронического гепатита В (ХГВ) после клиренса HBsAg. В клинической практике СГВ обнаруживают по отсутствию HBsAg и по присутствию антител к HBcAg в сыворотке крови и часто называют «прошедшим» или «перенесенным» гепатитом В. Однако ДНК вируса гепатита В (ВГВ) остается в клетках печени, плохо выявляется рутинными методами диагностики и не может быть удалена с помощью имеющих методов терапии. Данные о распространенности СГВ различаются, в то же время СГВ регистрируют во всех регионах мира, значительно чаще – в регионах с высокой распространенностью ВГВ. Получены данные об ассоциации СГВ с фиброзом, циррозом печени и гепатоклеточной карциномой (ГКК), свидетельствующие о повышенном риске неблагоприятного исхода ХГВ у пациентов с СГВ. СГВ ассоциируется не только с ГКК, но также со злокачественными опухолями других органов. Установлено, что СГВ связан с повышенным риском реактивации ВГВ у пациентов с коинфекциями другими вирусами, а также у онкологических больных, лечение которых включает иммуносупрессивную терапию. Реактивация ВГВ приводит к тяжелым последствиям и в отсутствие лечения – к смерти пациентов. Можно заключить, что для достижения цели, поставленной ВОЗ, по искоренению вирусного гепатита к 2030 г. необходимо решить проблему СГВ. Для этого следует создать новые, более чувствительные и информативные диагностические тесты, эффективные методы элиминации ДНК ВГВ, а также более глубоко изучить механизмы развития СГВ.
 299-316
299-316


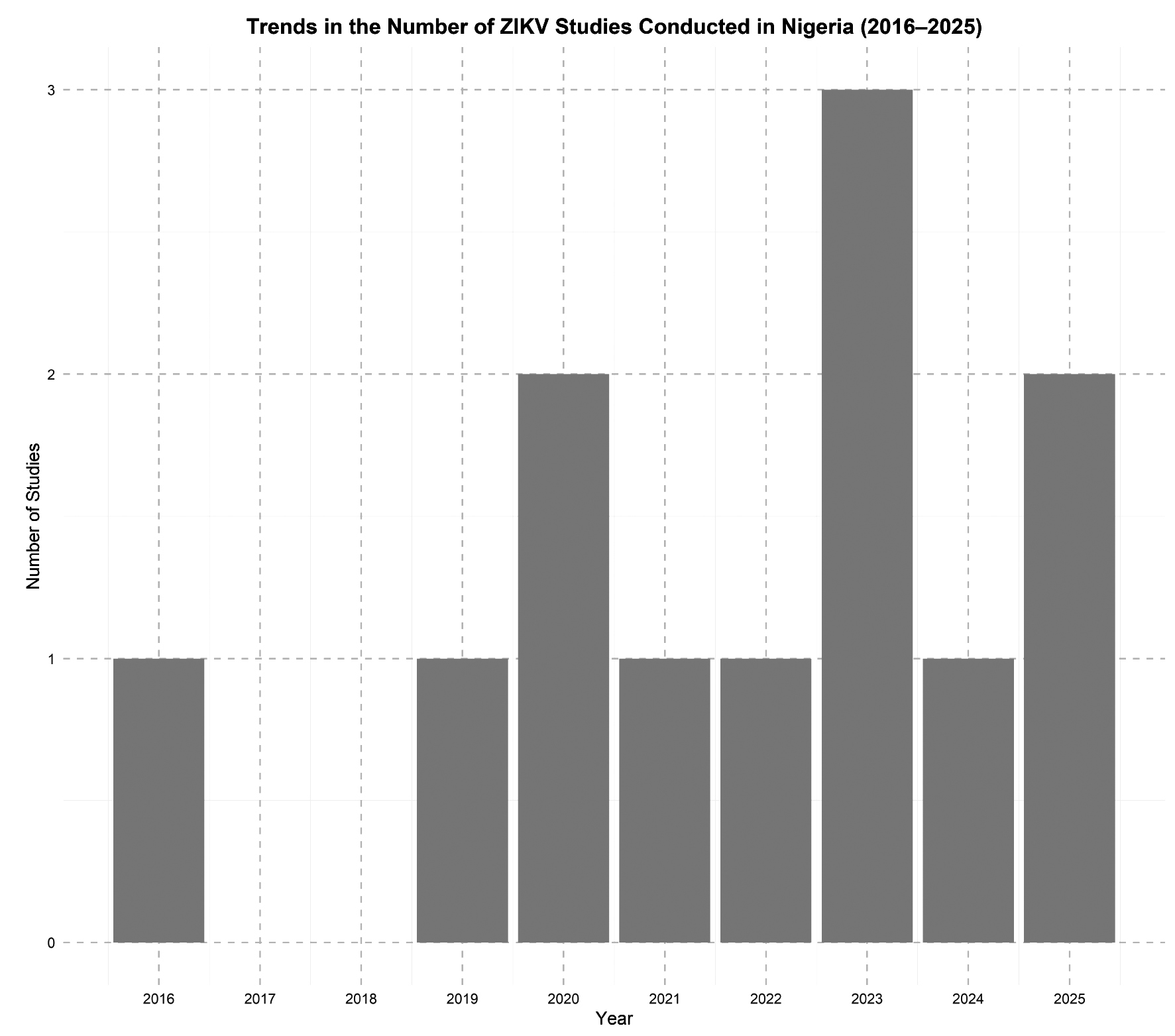
Вирус Зика в тени: недооцененный фактор в эпидемиологии лихорадочных заболеваний в Нигерии
Аннотация
Предпосылки. Передаваемый комарами вирус Зика (Orthoflavivirus zikaense), представитель семейства Flaviviridae рода Orthoflavivirus, привлекает международное внимание из-за своих неврологических и врожденных последствий. Хотя вирус является эндемичным для Африки, его распространенность в Нигерии остается малоизученной и часто маскируется другими лихорадочными заболеваниями, такими как малярия и лихорадка денге. В настоящем обзоре обобщены данные исследований, опубликованных в рецензируемых журналах в период с 2015 по 2025 г., с целью анализа эпидемиологических особенностей, диагностических трудностей и значения для общественного здравоохранения инфекции, вызываемой вирусом Зика, в Нигерии.
Материалы и методы. Был проведен нарративный синтез исследований, сообщающих о случаях заражения вирусом Зика в Нигерии, с использованием целенаправленного поиска в базах данных PubMed, Scopus, Web of Science и African Journals Online. Включали рецензируемые статьи на английском языке, содержащие серологические или молекулярные данные, полученные при исследованиях в популяциях людей или переносчиков вирусов.
Результаты. Данные 11 исследований в 10 штатах показывают, что серопревалентность вируса Зика варьирует от 1,4% до более чем 50%, особенно среди беременных женщин и пациентов с лихорадочными состояниями. Диагностические пробелы, связанные со схожестью симптомов и серологической перекрестной реактивностью, способствуют недооценке распространенности вируса. Коциркуляция с другими арбовирусами и ограниченный охват эпидемиологическим надзором дополнительно затрудняют оценку бремени вируса Зика на общественное здоровье.
Заключение. Вирус Зика, вероятно, циркулирует в Нигерии скрытно, чему способствуют экологические и инфраструктурные факторы. Несистематический контроль за переносчиками, ограниченные возможности диагностики и отсутствие интегрированного надзора за арбовирусами мешают своевременному выявлению инфекции. Опыт борьбы с другими вирусами, передающимися комарами рода Aedes, должен лечь в основу унифицированной и активной национальной стратегии борьбы с инфекцией, вызываемой вирусом Зика.
 317-323
317-323


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
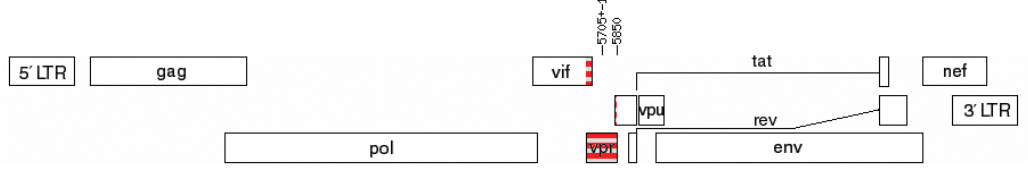
Вспомогательный белок Vpr вируса иммунодефицита человека 1-го типа (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodeficiency virus-1): особенности генетических вариантов вируса, циркулировавших на территории Московской области в 2019–2020 гг.
Аннотация
Введение. Vpr является многофункциональным вспомогательным белком ВИЧ-1, который проявляет свою активность на разных этапах жизненного цикла вируса. Олигомеризация белка является необходимым условием для проникновения Vpr в вирион и последующего его участия на ранних этапах ВИЧ-инфекции. К настоящему времени определены естественные аминокислотные замены в Vpr, ассоциированные с прогрессированием заболевания; рассматривается возможность создания средств терапии на основе Vpr.
Цель исследования – изучение особенностей Vpr у наиболее распространенных генетических вариантов ВИЧ-1, циркулировавших на территории Московской области в 2019–2020 гг.
Материалы и методы. Исследовали образцы ВИЧ-1, полученные от 231 пациента ГБУЗ МО «Центр профилактики и борьбы со СПИД» в период 2019–2020 гг. с разными стадиями заболевания, по схеме: экстракция провирусной ДНК, амплификация гена vpr, секвенирование, анализ полученных данных. Изучали консенсусные последовательности Vpr наиболее распространенных в России генетических вариантов и их пространственные структуры, вариабельность Vpr вариантов ВИЧ-1 суб-субтипа A6 (Vpr-A6) у пациентов с разными стадиями заболевания.
Результаты. Особенности Vpr различных генетических вариантов ВИЧ-1, циркулирующих в России, могут влиять на формирование его олигомерных форм. Не было выявлено ни одного сайта со статистически значимыми различиями в частоте встречаемости аминокислотных замен у пациентов с разными стадиями заболевания.
Заключение. Белки Vpr генетических вариантов ВИЧ-1, циркулирующих в России, могут иметь различия в функциональных свойствах. Варианты Vpr-A6 имели низкую вариабельность у пациентов с разными стадиями заболевания, в связи с чем Vpr-А6 может рассматриваться как объект для создания средств терапии.
 324-339
324-339


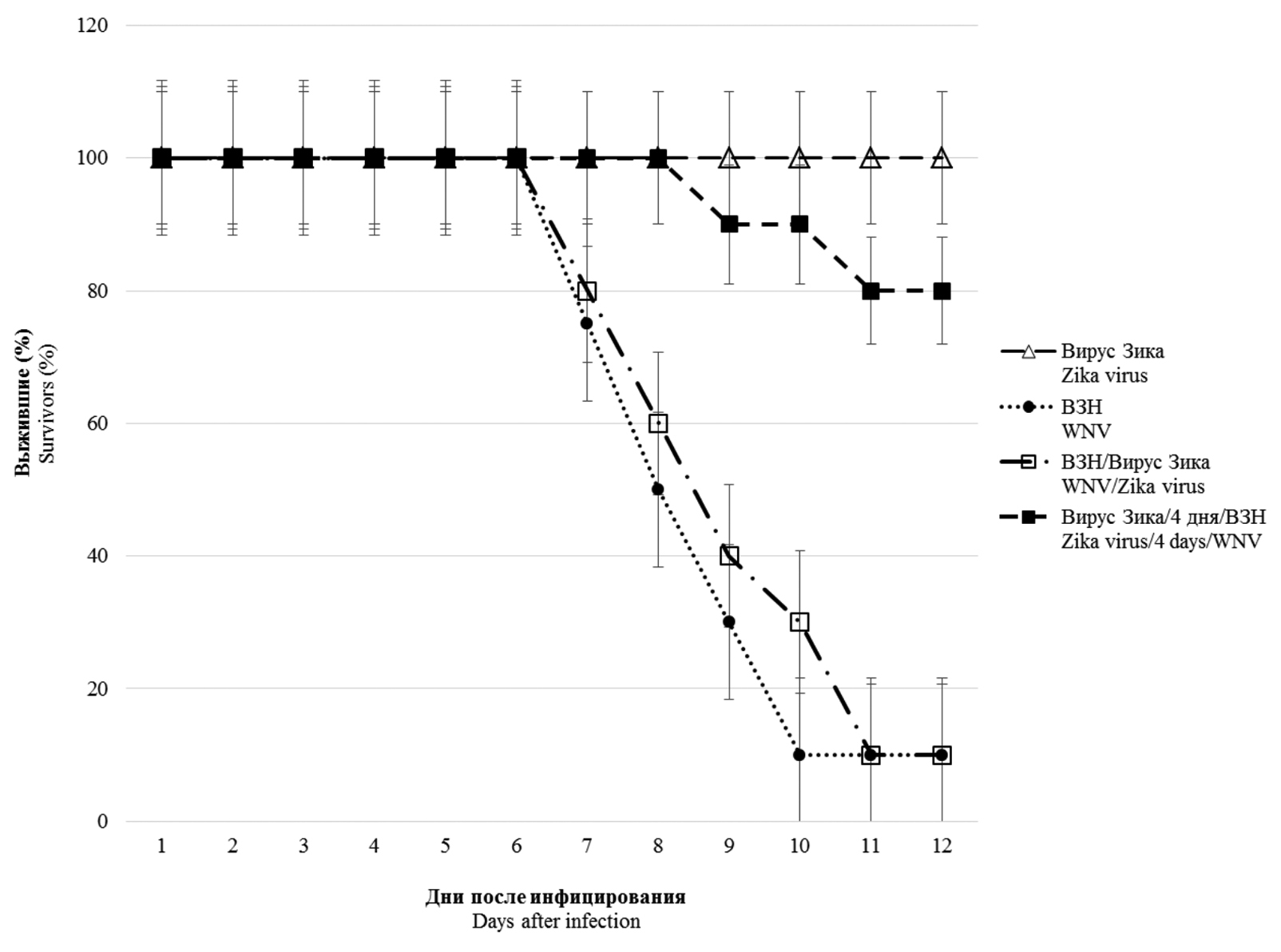
Моделирование смешанной инфекции вирусами Зика и Западного Нила (Flaviviridae: Orthoflavivirus: Orthoflavivirus zikaense, Orthoflavivirus nilense) in vitro и in vivo
Аннотация
Введение. Заболевания человека, вызываемые вирусами Западного Нила (ВЗН) и Зика и передающиеся через укус комара, широко распространены на разных континентах и обусловливают крупные вспышки. Ареалы этих вирусов перекрываются, что создает возможность возникновения микст-инфекций. Знания о подобных микст-инфекциях ограничены.
Цель исследования. Провести изучение особенностей протекания микст-инфекции ВЗН и вируса Зика in vitro и in vivo с целью оценки их возможной интерференции и/или усиления инфекции.
Материалы и методы. В работе использовали штаммы Влг27924 и MR766 ВЗН и вируса Зика соответственно. Инфекционную активность вирусов при моно- и коинфицировании определяли на культуре клеток Vero E6 с помощью полимеразной цепной реакции с обратной транскрипцией, а также на мышах линии BALB/c.
Результаты. При исследовании коинфицирования ВЗН и вирусом Зика in vitro показано, что совместное инфицирование приводит к интерференции, при этом степень конкурентного ингибирования репликации более выражена в отношении вируса Зика (в 1000 раз и более) при сравнении с моноинфекцией. При одновременном инфицировании мышей вирус Зика не влияет на развитие летальной инфекции, вызванной ВЗН. Однако предварительное (за 4 и 20 сут) инфицирование сублетальной дозой вируса Зика достоверно защищает животных от последующего введения 10 и 100 ЛД50 ВЗН. У предварительно инфицированных вирусом Зика коинфицированных животных зарегистрировано появление специфичных к ВЗН вируснейтрализующих антител в более высоком титре, чем у моноинфицированных ВЗН особей.
Заключение. Показано наличие интерференции in vitro между исследованными ортофлавивирусами, наиболее выраженной в отношении вируса Зика. При одновременном инфицировании мышей вирус Зика не влияет на течение и исход инфекционного процесса, вызванного ВЗН. Предварительное инфицирование мышей вирусом Зика обеспечивает защиту животных от летальной инфекции ВЗН, праймируя индукцию более высокого уровня вируснейтрализующих антител.
 340-348
340-348


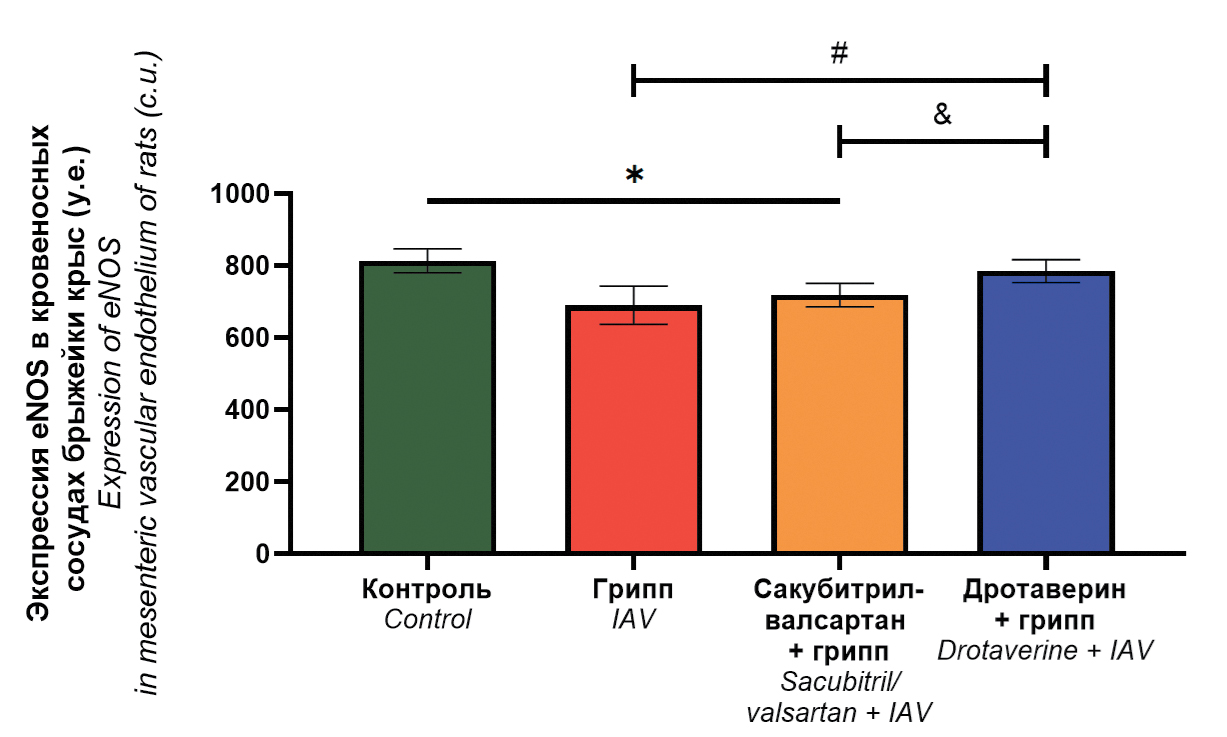
Эндотелиопротективные свойства сакубитрил-валсартана и дротаверина в экспериментальной инфекции, вызванной вирусом гриппа A(H1N1)pdm09 (Orthomyxoviridae: Alphainfluenzavirus: influenza A virus)
Аннотация
Введение. При тяжелом течении гриппа возникают поражение и изменения морфофункциональных свойств клеток эндотелия кровеносных сосудов, что обуславливает развитие геморрагического синдрома и может стать причиной эндотелиальной дисфункции. С целью оптимизации патогенетической терапии гриппа проведен скрининг препаратов с эндотелиопротективными свойствами.
Цель. Исследование эндотелиопротективных свойств сакубитрил-валсартана и дротаверина в экспериментальной инфекции, вызванной вирусом гриппа (ВГ) A(H1N1)pdm09.
Материалы и методы. Исследование проведено на крысах стока Wistar, получавших внутрижелудочно валсартан-сакубитрил и дротаверин (в лечебно-профилактической схеме), с последующим интраназальным инфицированием ВГ A/СПб/48/16 (H1N1)pdm09. В качестве интактного контроля использовали крыс без введения препаратов; в качестве контроля заражения – животных, не получавших препараты, с последующим инфицированием ВГ. У крыс определяли титр ВГ в легких и брыжейке, оценивали степень поражения сосудистого эндотелия легких по трем параметрам: десквамация, изменение морфологии и дистрофические изменения; определяли уровень экспрессии эндотелиальной синтазы оксида азота (eNOS) в эндотелии кровеносных сосудов брыжейки, а также исследовали вазомоторную активность кровеносных сосудов брыжейки.
Результаты. Применение дротаверина снижает выраженность гистопатологических изменений со стороны сосудистого эндотелия легких крыс; повышает максимальный ответ кровеносных сосудов брыжейки на ацетилхолин по сравнению с группой контроля заражения; нормализует уровень экспрессии eNOS. Сакубитрил-валсартан снижает выраженность десквамации со стороны сосудистого эндотелия легких; нормализует ответ кровеносных сосудов брыжейки на ацетилхолин, но не позволяет нормализовать экспрессию eNOS.
Выводы. Дротаверин обладает более выраженной эндотелиопротективной активностью, чем сакубитрил-валсартан при их применении в лечебно-профилактической схеме у крыс, инфицированных ВГ A(H1N1)pdm09.
 349-362
349-362


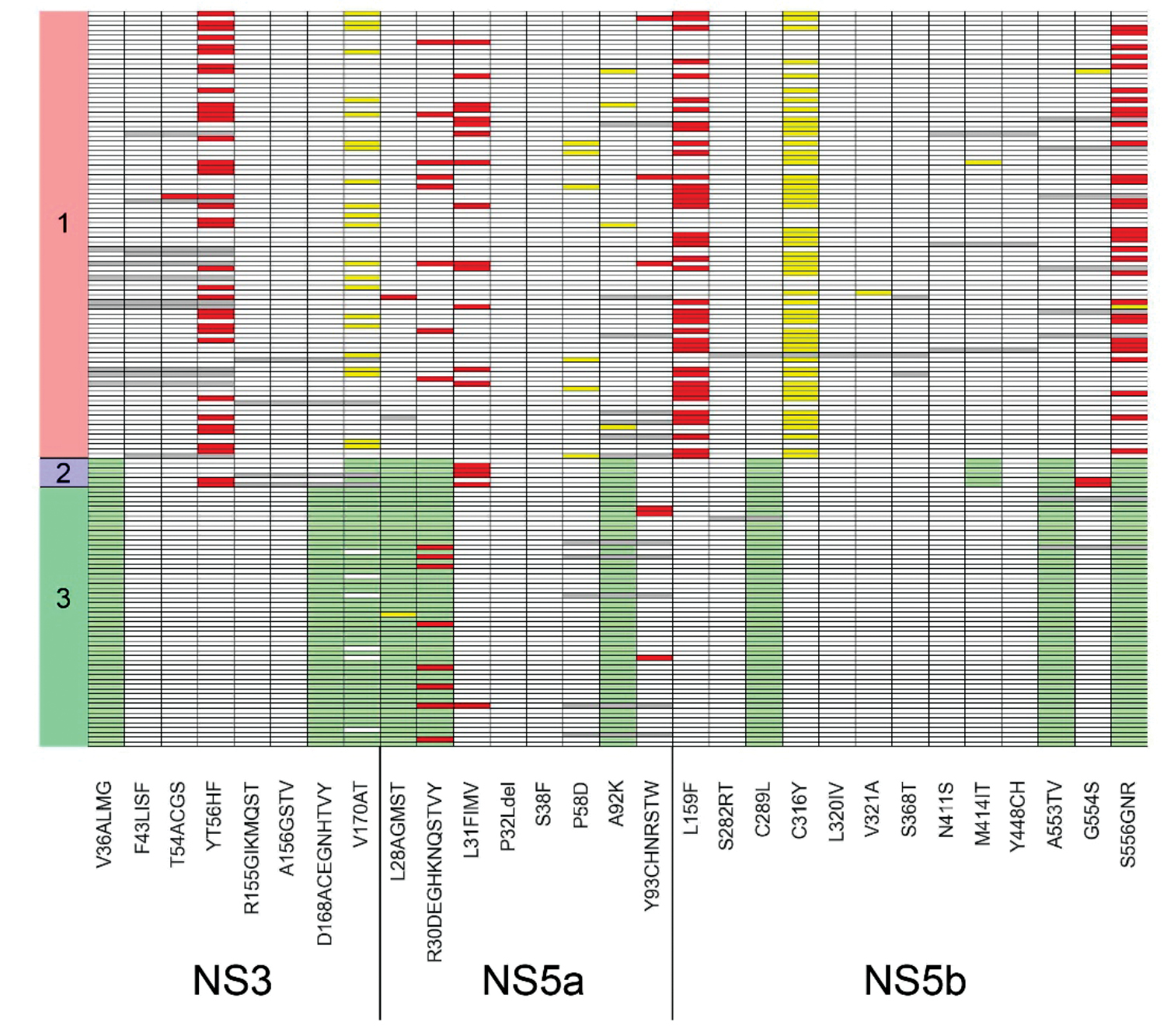
Амплификационная панель NGS HCV-seq для таргетного секвенирования РНК вируса гепатита С (Flaviviridae: Hepacivirus)
Аннотация
Введение. Гепатит С является актуальной проблемой здравоохранения во всем мире. Высокая вариабельность вируса гепатита С (ВГС) осложняет его полногеномное секвенирование, в большинстве исследований секвенированы только отдельные регионы генома. Существует необходимость в простом и надежном методе секвенирования полного генома ВГС.
Цель работы. Создание и апробация панели NGS для полногеномного секвенирования ВГС.
Материалы и методы. В работе представлена амплификационная панель NGS для секвенирования генома ВГС генотипов 1, 2 и 3. В зависимости от генотипа использован набор, состоящий из 79, 67 или 89 праймеров, при помощи которых осуществляется амплификация перекрывающихся участков генома ВГС.
Результаты. Панель была апробирована на 153 образцах РНК ВГC, выделенных из крови (93/6/54 образца генотипов 1/2/3 соответственно). Анализ энтропии Шеннона показал, что в пределах гена E2 генетическая неоднородность значительно выше, чем в остальной части генома. Была определена частота встречаемости мутаций, ассоциированных с лекарственной резистентностью. В частности, для генотипа 1 была отмечена следующая частота встречаемости мутаций в NS3: Y56F – 37,6%, V170I – 23,7%; в NS5a: R30Q – 8,6%, P58L/S/T – 6,5%, A92T – 4,3%; в NS5b: L159F – 45,2%, S556G/N – 33,3%.
Заключение. В работе изложен способ полногеномного секвенирования генома ВГС генотипов 1, 2 и 3. Панель для секвенирования ВГС обладает большим потенциалом для использования в научных исследованиях и эпидемиологическом мониторинге.
 363-373
363-373


В ПОМОЩЬ ВИРУСОЛОГУ
Результаты аттестации фармакопейного стандартного образца активности, специфичности и некротической активности оспенной вакцины
Аннотация
Введение. Фармакопейный стандартный образец активности, специфичности и некротической активности используется при испытаниях вакцин для профилактики оспы. В рамках аттестации фармакопейного стандартного образца была запланирована оценка возможности применения новой методики определения специфической активности, специфичности (подлинности) культуральным методом (in vitro) с целью испытаний вакцин для профилактики оспы, произведенных с использованием культуры клеток.
Цель работы – проведение аттестации фармакопейного стандартного образца активности, специфичности и некротической активности оспенной вакцины по основным аттестуемым характеристикам, а также оценка возможности использования новой методики определения специфической активности, специфичности (подлинности) с применением культурального метода.
Материалы и методы. Для исследования использовали фармакопейный стандартный образец Государственной фармакопеи Российской Федерации (далее – ГФ РФ) Стандартный образец активности, специфичности и некротической активности оспенной вакцины ФСО 3.2.00113, серия 130406 (далее – ФСО ГФ РФ 3.2.00113). С целью оценки аттестуемых характеристик применяли фармакопейные биологические методы, описанные в ГФ РФ, ФС.3.3.1.0033.15 Вакцина оспенная живая. Для определения специфической активности, специфичности (подлинности) культуральным методом применяли методику, предоставленную ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора (Новосибирск). Оценку статистических данных проводили в программе Microsoft Excel.
Результаты. Проведена аттестация ФСО ГФ РФ 3.2.00113. Положительным образом была оценена возможность использования новой методики определения специфической активности, специфичности (подлинности) с применением культурального метода.
Заключение. Наряду с подтверждением аттестованных характеристик была подтверждена возможность использования новой методики определения специфической активности, специфичности (подлинности) с применением культурального метода, определены основные критерии приемлемости.
 374-387
374-387


КРАТКИЕ СООБЩЕНИЯ
Выявление высокопатогенных ортопоксвирусов (Poxviridae: Chordopoxvirinae: Orthopoxvirus) методом дот-иммуноанализа в условиях лаборатории с высоким уровнем биологической защиты
Аннотация
Введение. Высокопатогенные для человека ортопоксвирусы (ОПВ) – вирусы натуральной оспы (VARV) и оспы обезьян (MPXV) – могут вызывать системные заболевания, характеризующиеся высокой контагиозностью и нередко приводящие к смерти. В предыдущих публикациях (https://doi.org/10.3390/v14112580) мы сообщали о разработке чувствительного, быстрого и простого в использовании иммунохимического теста, потенциально пригодного для применения в очаге инфекции и в условиях лаборатории с высоким уровнем биозащиты. Прототип диагностического набора был протестирован на непатогенных и малопатогенных для человека ОПВ и специфически выявлял их с чувствительностью в диапазоне от 103 до 104 БОЕ/мл.
Цель работы – оценка чувствительности разработанного иммунохимического теста при выявлении высокопатогенных для человека MPXV и VARV, а также применимости анализа в лаборатории с высоким уровнем биологической безопасности (BSL-4).
Материалы и методы. Методом одностадийного дот-иммуноанализа в условиях лаборатории с уровнем биобезопасности BSL4 оценивали эффективность выявления вирусов в криолизатах образцов культуры клеток CV-1, инфицированных VARV и MPXV.
Результаты. Показано, что одностадийный дот-анализ позволяет обнаруживать MPXV в концентрации 2,5 × 103 БОЕ/мл, а VARV в концентрации 1,0 × 104 БОЕ/мл. Отмечено, что пары дезинфектантов (перекись водорода или формальдегид), используемых для обработки изолирующего бокса, могут влиять на эффективность проявления результатов анализа.
Заключение. Одностадийный дот-иммуноанализ может быть выполнен в лаборатории BSL-4. При ограничении контакта проявляющей системы с парами формальдегида чувствительность теста при выявлении VARV и MPXV укладывается в ранее заявленный диапазон 103–104 БОЕ/мл.
 388-392
388-392


ЮБИЛЕЙНЫЕ ДАТЫ
К 80-летию со дня рождения Олега Ивановича Киселева
 393-394
393-394