Том 70, № 5 (2025)
- Год: 2025
- Выпуск опубликован: 15.11.2025
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/142
Весь выпуск
РЕДАКЦИОННАЯ КОНЦЕПЦИЯ
Таксономия и мегатаксономия вирусов (домен Vira) – текущий статус
Аннотация
Спустя 80 лет с момента открытия первого вируса нашим соотечественником Д.И. Ивановским установлено, что все организмы биосферы Земли являются природными хозяевами вирусов. Вирусы, объединенные в неформальный домен Vira, инфицируют все три домена биосферы: археи – Archaea, бактерии – Bacteria, эукариот – Eucarya (водоросли – Algae, грибы – Fungi, простейшие – Protozoa, растения – Plantae, беспозвоночные – Invertebrata, позвоночные – Vertebrata). Процесс формирования популяционных генофондов вирусов в результате взаимодействия с популяционными генофондами их хозяев происходил в условиях меняющейся среды обитания на протяжении 3,5 млрд лет и обеспечил огромное многообразие виросферы. Накопление данных о виросфере Земли, связанное с внедрением технологий массового параллельного секвенирования (NGS), привело к необходимости реконструкции подходов к классификации вирусов и реформированию, начиная с 2018 г., таксономии вирусов с введением новых высших рангов (мегатаксономия). На cентябрь 2025 г. для представителей виросферы Международным комитетом по таксономии вирусов (ICTV) приняты 15 таксономических рангов, основные из которых: надцарство (Realm) – 7, царство (Kingdom) – 11, тип (Phylum) – 22, класс (Class) – 49, отряд (Order) – 93, семейство (Family) – 368, род (Genus) – 3768, вид (Species) – 16 213. Дальнейший прогресс использования метагеномики, метатранскриптомики и глобальной экологии виросферы неминуемо приведет к дальнейшим изменениям в таксономии и мегатаксономии вирусов. Это будет иметь фундаментальное значение в понимании эволюции биосферы и прикладную значимость для разработки новых подходов обеспечения биологической безопасности и минимизации последствий чрезвычайных эпидемических событий, связанных с проблемой новых и возвращающихся (emerging and reemerging) инфекций.
 401-416
401-416


ОБЗОРЫ
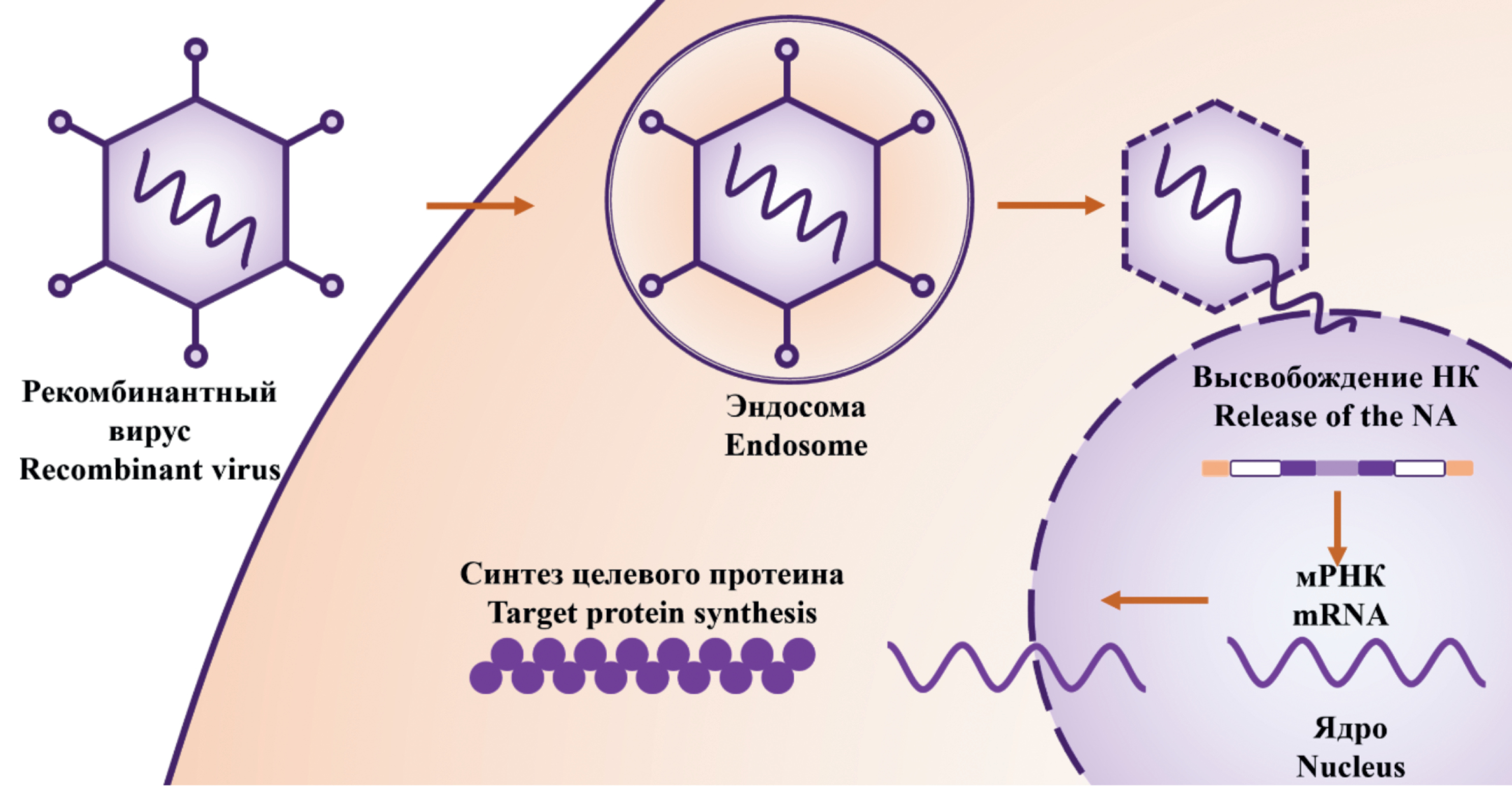
Современные подходы к конструированию и применению рекомбинантных вирусов
Аннотация
В обзоре описан ряд вирусных векторов и рассмотрены различные методы конструирования рекомбинантных вирусов, особое внимание уделено системе гомологичной рекомбинации и CRISPR/Cas9, описана возможность использования разных клонирующих векторов (виды плазмид, BAC). Также в обзоре представлен сравнительный анализ эффективности и безопасности применения вирусных векторов как для создания рекомбинантных вакцин, так и для получения онколитических вирусов, препаратов для генной терапии.
 417-430
417-430


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Генетическая характеристика изолята аденовируса человека 55-го генотипа (Adenoviridae: Mastadenovirus), выделенного в Москве в 2022 г.
Аннотация
Введение. Аденовирусная инфекция встречается повсеместно в виде спорадических случаев и отдельных вспышек. Аденовирус человека 55-го генотипа (HAdV-55), эндемичный для территорий Китая и Южной Кореи, вызывает острые респираторные вирусные инфекции (ОРВИ) разной степени тяжести как среди гражданского населения, так и в воинских коллективах в разных странах мира. Геномные исследования способствуют достоверной идентификации HAdV-55.
Цель данной работы состояла в идентификации HAdV, выделенного в Москве в 2022 г., проведении полногеномного секвенирования и сравнительного геномного исследования.
Материалы и методы. HAdV-55 выделили из образца пациента, госпитализированного с пневмонией, исследовали методами анализа полиморфизма длины рестрикционных фрагментов и полногеномного секвенирования. Биоинформационный сравнительный анализ выполняли для выборки геномов 83 изолятов.
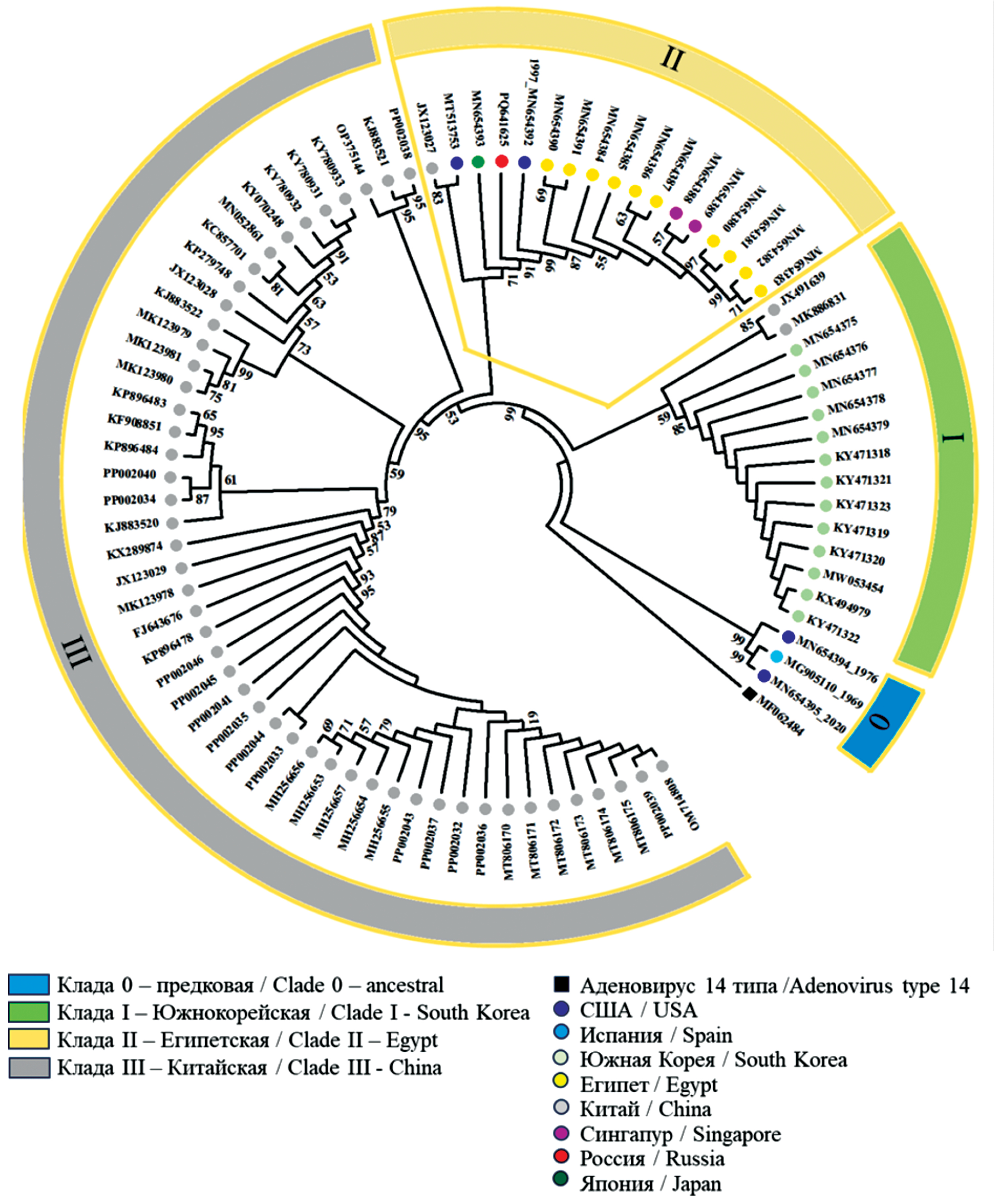
Результаты. Проведено полногеномное секвенирование изолята HAdV-55, впервые выделенного в РФ. Последовательность генома изолята SCV3008:Ad55 депонировали в GenBank (регистрационный номер PQ641625). Выявлены уникальные мутации в геноме SCV3008:Ad55, одна из которых приводила к консервативной замене T29A в пентоне, не влияющей на его функции. Филогенетический анализ показал кластеризацию SCV3008:Ad55 с изолятами клады II, включившей представителей 7 стран разных континентов, что свидетельствует о широком распространении HAdV-55. Изоляты эндемичных регионов Китая и Южной Кореи формировали отдельные клады. Исследование полиморфизма длин микросателлитов в нетранслируемых областях генома стало дополнительным инструментов различения близкородственных геномов.
Заключение. Сравнительное геномное исследование изолятов HAdV-55, появившегося в результате рекомбинации HAdV-14 и HAdV-11, показало медленное накопление мутаций с 1969 г. как в транслируемых, так и в нетранслируемых областях, позволило выявить уникальные замены нового изолята SVC3008:Ad55. Полученная геномная информация заложила основу для дальнейшего мониторинга HAdV-55 в России и продемонстрировала информативность и значимость полногеномных исследований для наблюдения за аденовирусами. Разработка и внедрение в практику методов генотипирования, нацеленных на выявление HAdV-55 и других клинически значимых генотипов, позволит значительно повысить эффективность диагностики аденовирусных инфекций с угрозой развития бронхопневмонии.
 431-443
431-443


Устойчивость и восстановление чувствительности опухолевых клеток, инфицированных цитомегаловирусом человека, к доксорубицину при сочетанном применении с дисперсным фуллереном dC60
Аннотация
Введение. Цитомегаловирусная инфекция способна индуцировать развитие резистентности опухолевых клеток к химиотерапевтическим препаратам посредством модуляции апоптотических путей. В поиске альтернативных препаратов, направленных на преодоление вирус-ассоциированной резистентности, перспективным направлением является применение наноматериалов (дисперсной формы фуллерена dC60). Возможность преодоления вирус-ассоциированной лекарственной устойчивости открывает новые возможности для разработки комбинированных терапевтических стратегий в лечении опухолей.
Цель ‒ оценить влияние цитомегаловирусной инфекции на резистентность клеток гепатокарциномы и промиелоцитарного лейкоза к доксорубицину, а также потенциал дисперсного фуллерена dC60 в восстановлении чувствительности к химиотерапии доксорубицином клеток моноцитарной лейкемии.
Материалы и методы. Исследовали клетки: гепатокарциномы (Huh 7.5), промиелоцитарного лейкоза (HL-60), моноцитарной лейкемии (THP-1); цитомегаловирус (штамм AD169). Экспериментальная часть включала общепринятые культуральные и вирусологические методы, иммуноцитохимию, иммуноблотинг, полимеразную цепную реакцию в режиме реального времени, полимеразную цепную реакцию с обратной транскрипцией, МТТ-тест.
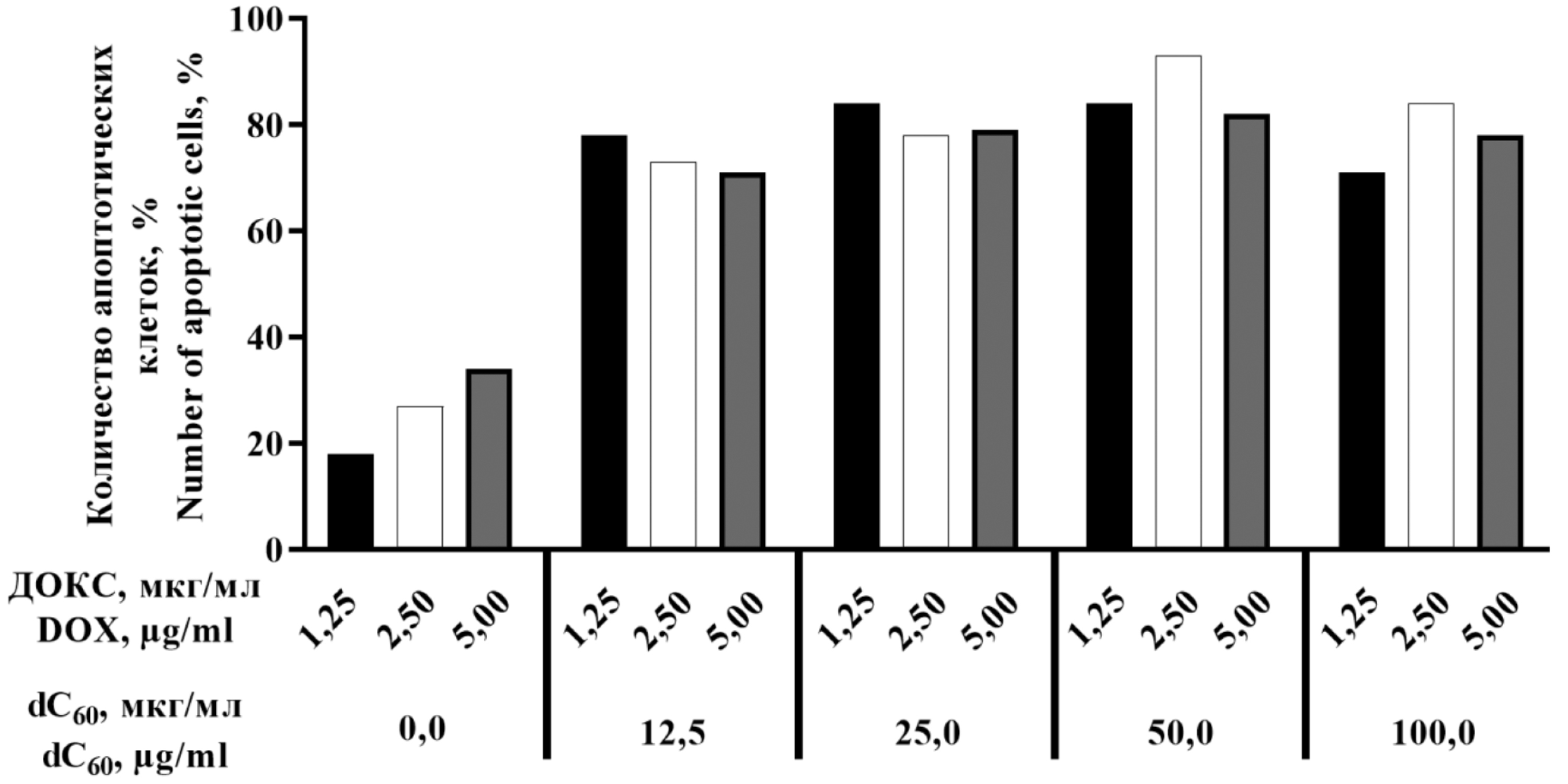
Результаты. Цитомегаловирусная инфекция в клетках гепатокарциномы и промиелоцитарного лейкоза снижала цитотоксическое действие доксорубицина на ٣٠٪. В клетках моноцитарной лейкемии сочетанное применение доксорубицина с дисперсным фуллереном dC60 приводило к восстановлению чувствительности инфицированных клеток к химиотерапии. При этом 93% гибель опухолевых клеток достигалась с применением доксорубицина в ٢ раза меньшей концентрации.
Заключение. Цитомегаловирусная инфекция формирует резистентность к доксорубицину на гемопоэтических (клетки промиелоцитарного лейкоза и моноцитарной лейкемии) и солидных (клетки гепатокарциномы) опухолевых моделях. Примечательно, что сочетанное действие доксорубицина с дисперсным фуллереном dC60 не только позволяет преодолевать вирус-опосредованную лекарственную устойчивость в клетках моноцитарной лейкемии, но и позволяет достичь выраженного цитотоксического эффекта при сниженных концентрациях доксорубицина, что открывает перспективы для разработки комбинированных терапевтических схем со сниженной токсичностью.
 444-454
444-454


Серопревалентность вирусов гепатитов B и C и факторы риска среди медицинских работников (МР) в специализированных больницах в Браззавиле, Республика Конго
Аннотация
Введение. Вирусы гепатитов B и C вызывают хронические инфекции, приводящие к циррозу печени и гепатоцеллюлярной карциноме.
Целью данного исследования было определить серопревалентность вирусов гепатитов B и C и потенциальные факторы риска, которые могут влиять на распространенность среди медицинских работников (МР) в Браззавиле, Республика Конго.
Материалы и методы. Мы провели поперечное исследование с июня по ноябрь 2022 г. среди МР в специализированных больницах Талангаи и Макелекеле в Браззавиле. В исследование было включено 107 МР. Серологический скрининг проводили с использованием экспресс-тестов, а затем с подтверждением реактивных результатов в иммуноферментном анализе после заполнения анкеты.
Результаты. Средний возраст пациентов составил 36,56 ± 11,62 года, в когорте преобладали женщины (соотношение женщин и мужчин составило 1 : 0,36). Наиболее представительной социально-профессиональной категорией были лаборанты. Серопревалентность вируса гепатита В составила 7,48%, а вируса гепатита С – 3,74%. За время работы 40% МР являлись жертвами несчастных случаев, связанных с контактом с кровью, и имели в 7 раз больший риск заражения вирусом гепатита В (коэффициент шансов [ОШ] = 7,01 (95% доверительный интервал [ДИ] 1,54–31,96); p = 0,01).
Заключение. Полученные данные свидетельствуют о том, что вирусы гепатитов B и C по-прежнему широко распространены среди МР в Республике Конго. Можно сделать вывод, что МР являются группой высокого риска инфицирования вирусами гепатитов B и C. В этой связи необходимо улучшить условия труда и безопасности МР, внедрить новые стратегии для снижения профессионального контакта с кровью и биологическими жидкостями, а также снизить уровень заражения вирусами гепатитов B и C.
 455-462
455-462


Частота выявления антител класса IgG к вирусу Mpox и осведомленность о заболевании Mpox в Ибадане, юго-западная Нигерия
Аннотация
Цель. Ранее случаи Mpox были распространены среди детей; недавние вспышки, вызванные вирусом клады II, в основном затронули лиц молодого возраста. Исследование направлено на изучение знаний о вирусе Mpox и отношения к нему, а также серопревалентности среди когорты лиц в Ибадане, давших согласие на участие в исследовании.
Материалы и методы. К участию в исследовании были допущены добровольцы, соответствовавшие установленным критериям включения. Было проведено поперечное исследование с участием 94 респондентов для изучения социально-демографических факторов, уровня осведомленности, отношения к профилактике и уровня инфицирования. Антитела класса IgG к вирусу Mpox количественно определяли с помощью метода твердофазного иммуноферментного анализа (ИФА). Затем данные анализировали с использованием критерия χ2, а количественное определение антител отображали с помощью диаграммы типа «ящик с усами»; статистическую значимость определяли при p < 0,05.
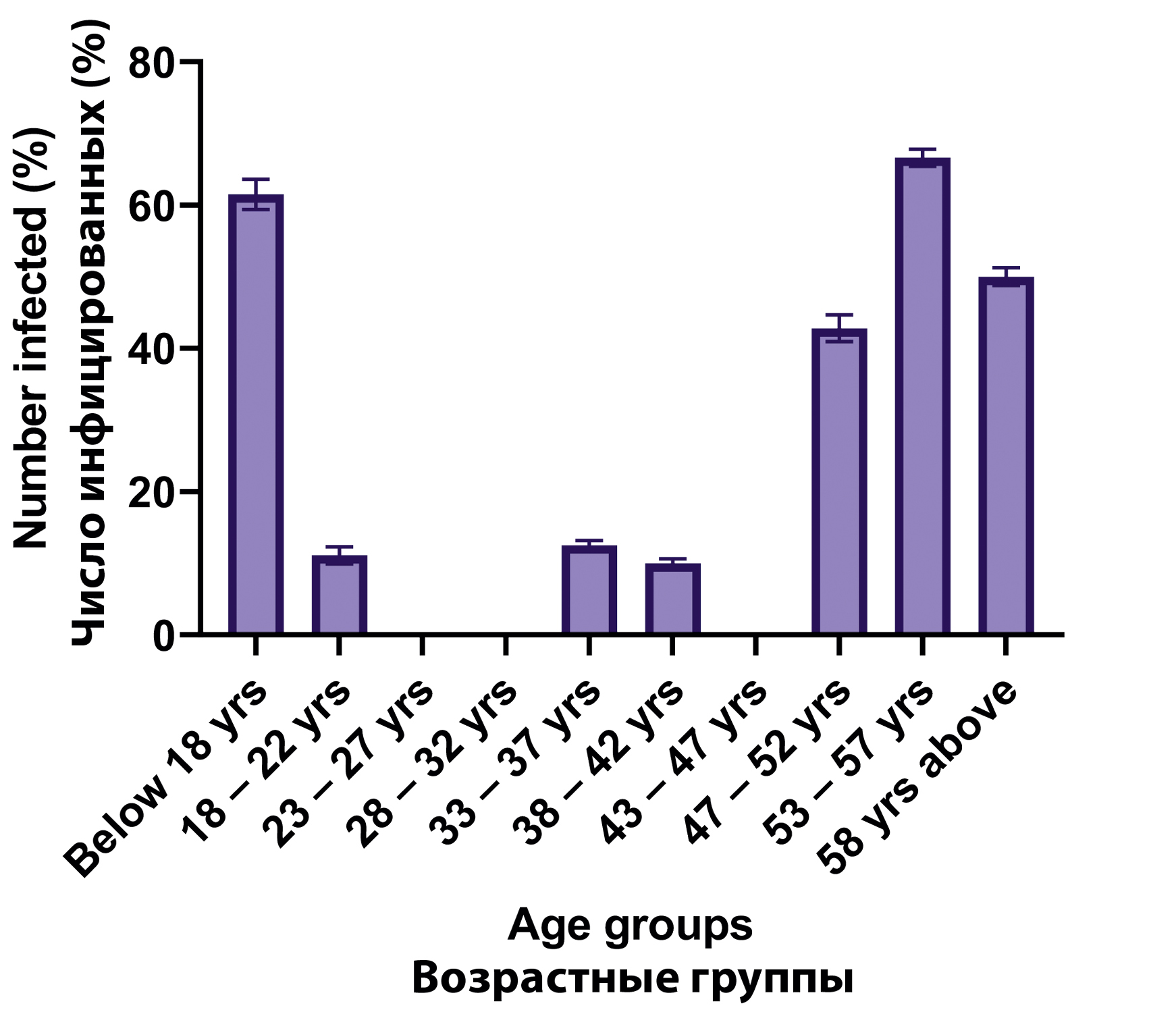
Результаты. Большинство респондентов были женщинами (66,7%) в возрасте 58 лет и старше (20,0%). Большинство имели высшее (40,0%) и среднее образование (34,4%). Осведомленность об Mpox была умеренной: 61,1% опрошенных слышали о вирусе в основном из новостей (20,0%) и от работников здравоохранения (18,9%). Тем не менее пробелы в знаниях были очевидны: только 38,9% знали о симптомах заболевания и 40,0% понимали пути передачи вируса. Отношение к профилактике было в целом положительным; 60,0% считали, что Mpox можно предотвратить, и 73,3% были готовы вакцинироваться. Тем не менее готовность участвовать в скрининге была низкой; 81,1% респондентов никогда не проходили тестирование, а 58,9% не знали о доступности теста в их регионе. Что касается серопревалентности, у женщин частота выявления анти-Mpox была значительно выше (27,4%), чем у мужчин (9,6%) (χ2 = 3,854, p = 0,050). В возрастном разрезе самые высокие показатели серопозитивности наблюдались у лиц младше 18 лет (61,5%) и в возрасте от 53 до 57 лет (66,6%) (χ2 = 30,817, p = 0,000), что указывает на значительные возрастные различия.
Заключение. Полученные данные подчеркивают необходимость целевого просвещения в области общественного здравоохранения, расширения доступа к тестированию и разработки стратегий целенаправленного вмешательства для улучшения профилактики и контроля Mpox, особенно среди уязвимых возрастных групп и малоинформированного населения.
 463-470
463-470


В ПОМОЩЬ ВИРУСОЛОГУ
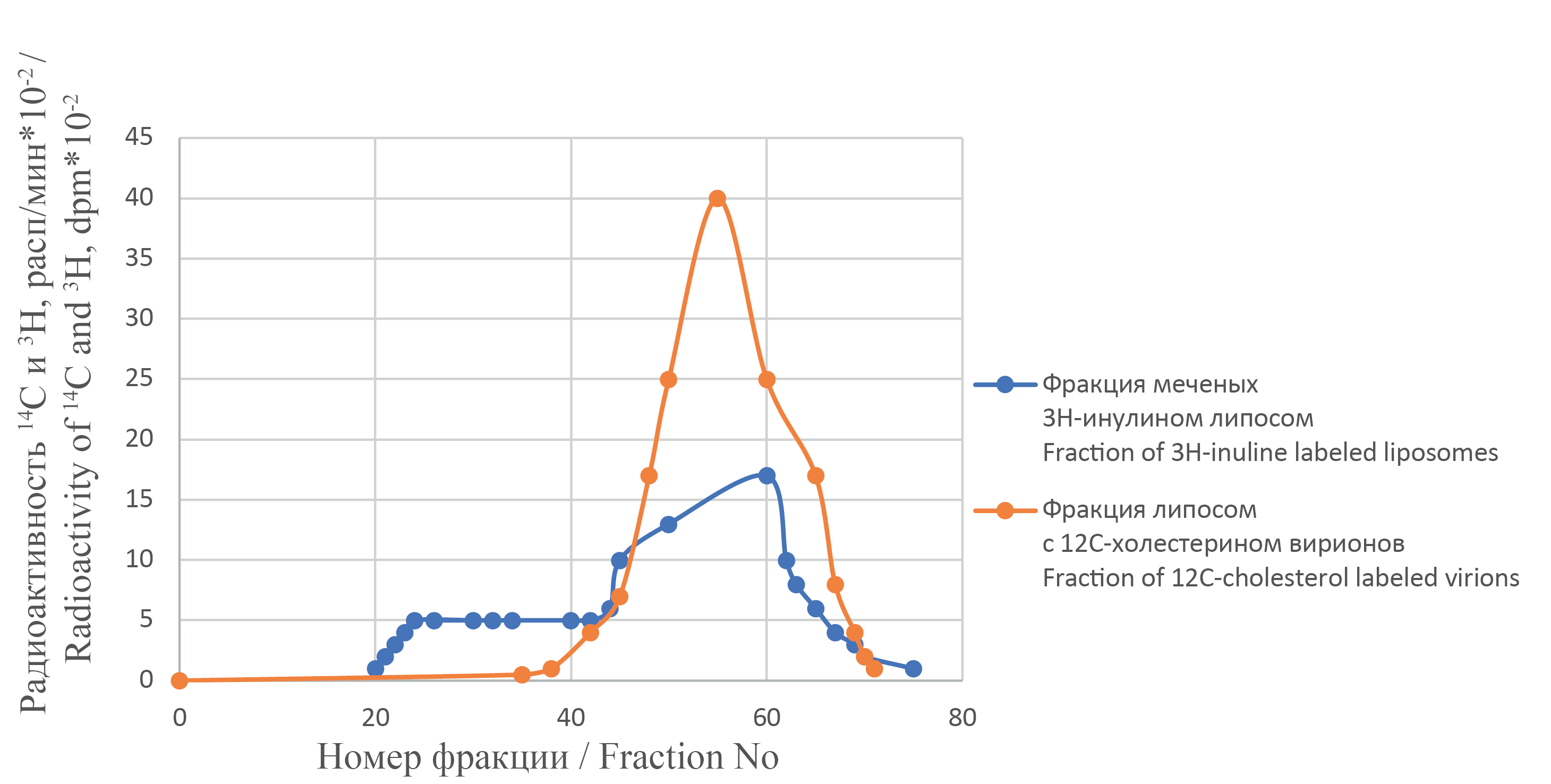
Диагностика инфекционного и гемагглютинирующего титра вируса гриппа А/Маллард Пенсильвания/10218/84 (H5N2) по изменению микровязкости вирусной мембраны после взаимодействия с фосфолипидными модификаторами на примере бесхолестериновых липосом
Аннотация
Введение. Противовирусное действие ряда препаратов связано с модификацией липидной мембраны вирусов вследствие их применения. Один из возможных механизмов такой модификации вирусной мембраны заключается в экстракции холестерина из мембран вирионов.
Цель работы. Изучить методику определения инфекционного и гемагглютинирующего титра вируса гриппа птиц по изменению микровязкости вирусной мембраны после инкубации с фосфолипидными модификаторами ‒ бесхолестериновыми липосомами, состоящими из фосфатидилхолина и фосфатидилэтаноламина в мольном отношении 1 : 2, в течение 48 ч.
Материалы и методы. Процесс экстракции подтверждали двумя методами: гель-фильтрацией с радиоактивно меченными липосомами и вирионами, а также по изменению величины поляризации флуоресцентного зонда 1-анилинонафталин-8-сульфонат-аниона (8-АНС) в вирусной мембране.
Результаты. Обнаружена корреляционная связь между изменением инфекционного и гемагглютинирующего титра и микровязкостью вирусной мембраны.
Заключение. Предложенная в работе методика позволяет проводить количественное определение инфекционной и гемагглютинирующей активности вируса гриппа в зависимости от изменений микровязкости мембран вирусов после взаимодействия фосфолипидных модификаторов. Представляется возможным использовать выявленную зависимость для определения инфекционной и гемагглютинирующей активности вируса гриппа в пределах одного серотипа в клинической лабораторной диагностике, применяя различные флуоресцентные зонды. В качестве липофильных модификаторов вирусной мембраны можно использовать не только липосомы определенного состава, но и такие соединения, как этиленгликоль, эритрит, глицерин.
 471-476
471-476


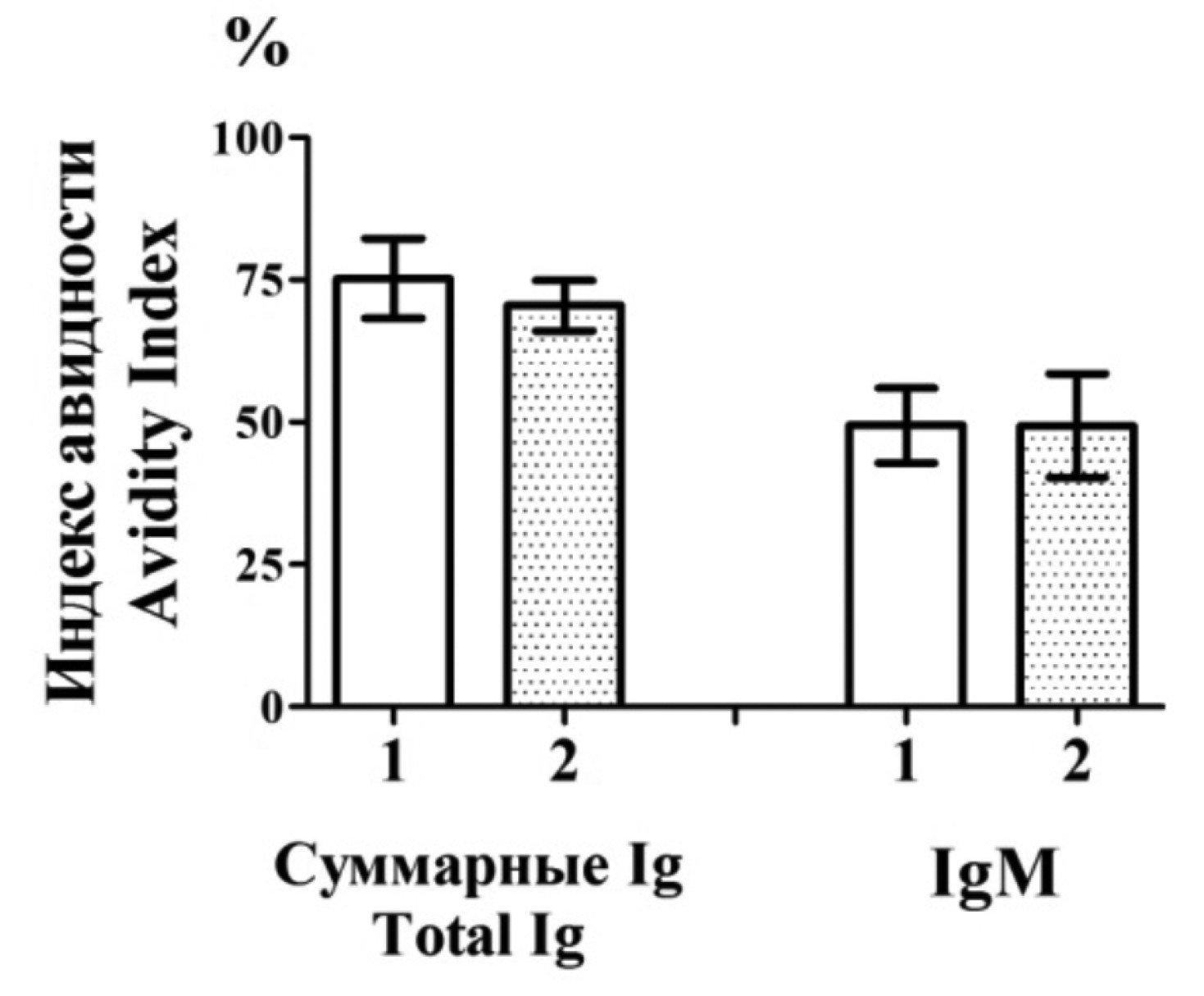
Антитела против VP3 echovirus 30 (Picornaviridae: Enterovirus: Enterovirus betacoxsackie) нейтрализуют вирус in vitro
Аннотация
Введение. Широкая распространенность энтеровируса echovirus 30 (E30) и случаи тяжелого течения инфекции указывают на необходимость разработки средств иммунопрофилактики. В структуре поверхностного белка VP3 ряда энтеровирусов найдены эпитопы для нейтрализующих антител и Т-клеточного ответа. Однако иммуногенные свойства VP3 E30 не изучены.
Целью настоящей работы явилась характеристика иммуногенности капсидного белка VP3 E30 и изучение вируснейтрализующих свойств антител против VP3 Е30.
Материалы и методы. Рекомбинантный VP3Е30 и химерный белок SN-VP3E30, состоящий из S-региона VP1 норовируса и полноразмерного VP3 Е30, экспрессировали в Escherichia coli. SN-VP3E30 использовали для формирования вирусоподобных частиц (ВпЧ). Действие SN-VP3E30 на дендритные клетки (ДК) человека оценивали методом проточной цитофлуометрии по изменению экспрессии HLA-DR, CCR7, CD80, CD83 и CD86. Для исследования иммуногенных свойств SN-VP3E30 иммунизировали мышей линии BALB/c и морскую свинку. Титры антител и их авидность определяли методом иммуноферментного анализа. Взаимодействие антител против VP3 с вирусом Е30 изучали с помощью иммуноэлектронной микроскопии. Способность нейтрализовать вирус исследовали в культуре клеток эмбриональной рабдомиосаркомы (RD).
Результаты. Рекомбинантный VP3Е30 вызывал неполное созревание ДК человека, характеризующееся отсутствием стимуляции экспрессии хемокинового рецептора CCR7. Включение VP3 в состав химерных ВпЧ приводило к полному созреванию ДК и сильному гуморальному иммунному ответу у лабораторных животных. Антитела против VP3 характеризовались высокой авидностью, способностью вызывать агломерацию вирусных частиц in vitro и нейтрализовать вирус Е30 в культуре клеток RD.
Заключение. Полученные результаты свидетельствуют о том, что VP3 может быть использован в качестве антигена в составе субъединичной вакцины против энтеровируса Е30.
 477-486
477-486