Prevalence and molecular genetic characteristics of parenteral hepatitis B, C and D viruses in HIV positive persons in the Novosibirsk region
- Authors: Kartashov M.Y.1,2, Svirin K.A.1, Krivosheina E.I.1, Chub E.V.1, Ternovoi V.A.1, Kochneva G.V.1
-
Affiliations:
- State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
- Novosibirsk National Research State University
- Issue: Vol 67, No 5 (2022)
- Pages: 423-438
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/626
- DOI: https://doi.org/10.36233/0507-4088-133
- ID: 626
Cite item
Full Text
Abstract
Introduction. Parenteral viral hepatitis (B, C, D) and HIV share modes of transmission and risk groups, in which the probability of infection with two or more of these viruses simultaneously is increased. Mutual worsening of the course of viral infections is important issue that occurs when HIV positive patients are coinfected with parenteral viral hepatitis.
The aim of the study was to determine the prevalence of HCV, HBV and HDV in HIV positive patients in the Novosibirsk region and to give molecular genetic characteristics of their isolates.
Materials and methods. Total 185 blood samples were tested for the presence of total antibodies to HCV, HCV RNA, HBV DNA and HDV RNA. The identified isolates were genotyped by amplification of the NS5B gene fragment for HCV, the polymerase gene for HBV and whole genome for HDV.
Results. The total antibodies to HCV were detected in 51.9% (95% CI: 44.7–58.9), HCV RNA was detected in 32.9% (95% CI: 26.6–39.5) of 185 studied samples. The distribution of HCV RNA positive cases completely repeated the distribution of HCV serological markers in different sex and age groups. The number of HCV infected among HIV positive patients increases with age. HCV subgenotypes distribution was as follows: 1b (52.5%), 3а (34.5%), 1а (11.5%), 2а (1.5%). 84.3% of detected HCV 1b isolates had C316N mutation associated with resistance to sofosbuvir and dasabuvir. The prevalence of HBV DNA in the studied samples was 15.2% (95% CI: 10.7–21.0). M204I mutation associated with resistance to lamivudine and telbivudine was identified in one HBV isolate. Two HDV isolates that belonged to genotype 1 were detected in HIV/HBV coinfected patients.
Conclusion. The data obtained confirm the higher prevalence of infection with parenteral viral hepatitis among people living with HIV in the Novosibirsk region compared to the general population of that region. The genetic diversity of these viruses among HIV infected individuals is similar to that observed in the general population.
Full Text
Введение
Эпидемиологическая ситуация по ВИЧ-инфекции (вирус иммунодефицита человека) в Российской Федерации продолжает оставаться напряжённой. Наиболее неблагоприятная обстановка наблюдается в ряде регионов Сибири, в том числе в Новосибирской области, где в 2021 г. показатель пораженности ВИЧ-инфекцией составил 1373,1 на 100 тыс. населения при среднем по России 782,0 на 100 тыс. населения (согласно государственному докладу «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 г.»). Вирусы гепатита В (ВГВ) и С (ВГС) характеризуются сходными с ВИЧ путями передачи: через кровь, при половом контакте и вертикально от матери к ребёнку. Данные инфекции имеют схожие группы риска, в которых повышена вероятность приобретения одновременно сразу нескольких вирусов (коинфицирование). Взаимное усугубление течения вирусных инфекций, возникающее при коинфицировании ВИЧ-положительных пациентов парентеральными вирусными гепатитами, достаточно широко описано в литературе и является важной проблемой здравоохранения. Среди ВИЧ-инфицированных лиц, проживающих на территории Российской Федерации, одной из наиболее распространённых форм вирусного гепатита является хронический гепатит С. Показан более высокий уровень Т-клеточной активации у пациентов с сочетанной ВГС-/ВИЧ-инфекцией по сравнению с моноинфицированными ВИЧ [1, 2]. Хроническая иммунная активация может стать причиной иммунной дисфункции и продукции цитокинов, вызывая усиление репликации ВИЧ, ВГС и снижение уровней Т-клеток [2]. Истощение CD4+ и CD8+ Т-клеток приводит к вирусной персистенции и переходу заболевания из острой стадии в хроническую [3]. Вероятность спонтанной элиминации ВГС при коинфицировании с ВИЧ снижается почти до нуля, скорость перехода заболевания из острой в хроническую стадию увеличивается, а тяжесть поражения печени, интенсивность фиброза, вероятность возникновения цирроза печени и развития гепатоцеллюлярной карциномы возрастают в 3–5 раз [4, 5]. При коинфекции ВГВ/ВИЧ также наблюдаются повышение интенсивности размножения ВГВ и ускоренные темпы прогрессирования заболевания печени (более высокие показатели фиброза), чем при моноинфицировании [6]. Имеются данные, что гликопротеины ВИЧ стимулируют гепатоциты к экспрессии TRAIL (Tumor necrosis factor-related apoptosis-inducing ligand), что индуцирует апоптоз гепатоцитов посредством активации каспазы 8 [7, 8]. Кроме того, gp120 ВИЧ стимулирует секрецию гепатоцитами интерлейкина-8 (IL-8), играющего ключевую роль в поддержании воспалительного процесса в печени и развитии гепатоцеллюлярной карциномы [9]. Повышать уровень IL-8 может и белок Х ВГВ путём активации экспрессии IL-8 через NF-κB (транскрипционный ядерный фактор каппа B) и C/EBP-подобные (CCAAT (Cytidine-Cytidine-Adenosine-Adenosine-Thymidine) / enhancer binding proteins – цитидин-цитидин-аденозин-аденозин-тимидин / энхансер-связывающие белки) цис-элементы. Белок Х ВГВ также способен стимулировать наработку циклооксигеназы-2, гиперэкспрессия которой наблюдается при циррозе печени [10, 11]. Ещё одной гипотезой утяжеления поражения печени при ВГВ-/ВИЧ-коинфицировании является истощение пула CD4+ Т-клеток в желудочно-кишечном тракте, что способствует увеличению микробной обсеменённости и повышению уровня циркулирующих липополисахаридов, которые способны связываться с Toll-подобным рецептором 4-го типа и индуцировать секрецию провоспалительных цитокинов через путь NF-κB [12, 13].
В мире насчитывается примерно 4–5 млн человек, одновременно инфицированных ВИЧ и ВГС, что является большой проблемой для здравоохранения [14]. Среди ВИЧ-положительных лиц ВГС обнаруживается у 20–30% в США и примерно у 34% в Европе, однако уровень коинфицирования в группе потребителей инъекционных наркотиков может достигать 50–70% и более. При этом вследствие низкой эффективности передачи ВГС половым путём коинфицирование ВГС среди ВИЧ-положительных гомосексуальных лиц составляет 4–8% [15, 16].
Среди 40 млн ВИЧ-инфицированных пациентов во всём мире 2–4 млн инфицированы ВГВ. Основной путь коинфицирования ВИЧ/ВГВ в Америке и Европе реализуется через половые контакты (как гомо-, так и гетеросексуальные), а также при употреблении наркотиков. В странах Азии и Африки к югу от Сахары основным путём передачи ВГВ является вертикальный от матери к новорождённому. Имеются данные о том, что в ряде стран региона около 90% ВИЧ-положительных лиц коинфицированы ВГВ, в то время как в среднем по миру хроническая инфекция ВГВ выявляется у 5–15% больных ВИЧ. Для ВГВ критичным является возраст инфицирования, поскольку заражение при рождении или в раннем детстве ведёт к персистенции ВГВ-инфекции в 50–90% случаях [15, 16].
Суперинфицирование вирусом гепатита D (ВГD) при хроническом гепатите В, как правило, ускоряет развитие более тяжёлого поражения печени вплоть до выраженного фиброза в любом возрасте у 70–90% людей. Наблюдения за пациентами, инфицированными ВГD, показали, что у пациентов с активным хроническим гепатитом В с дельта-инфекцией быстрее развивается цирроз печени и формируется гепатоцеллюлярная карцинома, несмотря на то что ВГD подавляет репликацию ВГB.
Актуализация данных по генотипическому разнообразию изолятов ВГВ, ВГС и ВГD позволяет отслеживать пути передачи, появление и распространение на территории Российской Федерации новых вариантов вирусов. Это, в свою очередь, позволяет своевременно планировать необходимые санитарно-эпидемиологические мероприятия. Изучение разнообразия и генетических характеристик изолятов ВГВ, ВГС и ВГD является основой диагностики и персонифицированной терапии вирусных гепатитов. Разные сочетания коинфекции ВИЧ с парентеральными гепатитами влияют на клинические проявления и течение болезни, снижают эффективность терапии и ухудшают прогноз заболевания, поэтому распространение и генетическое разнообразие парентеральных вирусных гепатитов среди ВИЧ-инфицированных пациентов являются актуальной задачей.
Цель данной работы состоит в определении встречаемости и молекулярно-эпидемиологической характеристики генетических вариантов ВГС, ВГВ и ВГD, выявленных среди ВИЧ-положительных пациентов Новосибирской области.
Материалы и методы
Исследование проведено на 185 образцах сывороток / плазмы крови от ВИЧ-инфицированных пациентов, проживающих на территории Новосибирской области, среди которых было 96 мужчин (51,9%; 95% доверительный интервал (ДИ) 44,7–58,4%) и 89 женщин (48,1%; 95% ДИ 41,8–56,2). Средний возраст обследованных равен 38,6 года (95% ДИ 36,4–39,6). Все пациенты были зарегистрированы в региональном Центре по профилактике и борьбе со СПИД с диагнозом «ВИЧ-инфекция» (диагноз ВИЧ-инфекции подтверждён в иммунном блоттинге при положительных результатах иммуноферментного анализа и определении уровня рибонуклеиновой кислоты (РНК) ВИЧ-1). Поскольку большинство исследований коинфицирования ВИЧ с вирусами парентеральных гепатитов проводится на группе потребителей инъекционных наркотиков, то в данной работе сформирована сплошная выборка ВИЧ-инфицированных пациентов путём использования генератора случайных чисел1 из общей лабораторной базы. Обследуемые лица разделены на 5 возрастных групп, размер которых прямо пропорционален их представленности в генеральной совокупности ВИЧ-инфицированных, зарегистрированых в региональном Центре по профилактике и борьбе со СПИД. Исследование проведено с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства Российской Федерации об охране здоровья граждан», у всех пациентов получено добровольное информированное согласие. Протокол исследования одобрен решением этического комитета ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора (протокол № 5 от 21.07.2022).
Определение наличия серологических маркеров ВГС (суммарных антител к ВГС) проводили иммуноферментным анализом с использованием набора «Бест анти-ВГС» («Вектор-Бест», Россия). Выделение нуклеиновых кислот проводили с использованием коммерческого набора «АмплиПрайм РИБО-преп» («НексБио», Россия), получение комплементарной дезоксирибонуклеиновой кислоты (кДНК) в реакции обратной транскрипции выполнялось с помощью коммерческого набора «РЕВЕРТА-L» («АмплиСенс», Россия) согласно инструкциям производителей. Образцы анализировали на наличие генетического материала ВГС, ВГВ и ВГD методом полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием наборов реагентов HCV-FL, HBV-FL и HDV-FL («АмплиСенс», Россия). Выявленные положительные образцы изолятов ВГС генотипировали путём амплификации фрагмента гена NS5b (около 380 пар нуклеотидов) в двухраундовой ПЦР с последующим определением нуклеотидной последовательности ампликонов методом Сенгера. Изоляты ВГВ, выявленные на скрининге, были генотипированы путём секвенирования гена рol (около 1200 пар нуклеотидов). Для выявленных изолятов ВГD проведено определение полногеномных последовательностей. Праймеры, используемые в данной работе, координаты амплифицируемых участков генома и температуры отжига представлены в табл. 1.
Таблица 1. Используемые в работе праймеры
Table 1. Primers used in the study
Агент (мишень) Agent (target) | Праймер Primer | Структура праймера (5´→3´) Primer sequence (5´→3´) | Позиция в референс-геноме* Position in the reference genome* | Tемпература отжига, ℃ Annealing temperature,℃ |
HCV (NS5B) | R52 | TGGGSTTCYCRTATGATACCCGCTGCTTTGA | 8056-8087 | 55 |
R54 | GGCAGAGTACCTRGTCATAGCCTCCGTGAA | 8662-8632 | ||
R53 | GCTGYTTTGACTCMACRGTCACTG | 8147-8171 | 55 | |
R55 | CTRGTCATAGCCTCCGTGAAGYCTC | 8527-8502 | ||
HBV (Pol/RT) | Pol_F | CTGCTGGTGGCTCCAGTT | 1354-1371 | 56 |
Pol_R | GCTAGGAGTTCCGCAGTATGG | 2583-2563 | ||
HDV | HDV-57F | GAGAAMYCACCTCCAGAGGA | 299-318 | 56 |
HDV-58R | CGTCCACTCGGATGGCTA | 842-825 | ||
HDV-63F | TCGGTAATGGCGAATGGGR | 752-770 | 56 | |
HDV-08R | GGAAGGCCCTCGAGAACAAG | 770-754 | ||
HDV-69F | AGTTCCTCTTCTTCCTCCYTGCT | 1212-1234 | 56 | |
HDV-46R | AAGGGGTCCTCTGGAGGTG | 324-306 | ||
HDV-74F | AGSTCCCTCTCGAGTTCCTC | 1500-1519 | 56 | |
HDV-54R | CCGGGATAAGCCTCACTCG | 485-467 |
Примечание. *Позиция генома для HСV указана для референса EU155342; позиция генома для HBV указана для референса MW999678; позиция генома для HDV указана для референса NC001653.
Note. *Genome positions for HCV are indicated for reference EU155342; the genome positions for HBV are indicated for reference
Секвенирование очищенных ампликонов проводили с использованием набора реагентов BigDye Terminator v3.1 на генетическом анализаторе Applied Biosystems 3500 Genetic Analyzer (Life Technologies, США). Анализ полученных хроматограмм проводили с помощью программы SeqMan (DNASTAR, США). Филогенетический анализ проводили с помощью пакета филогенетических программ MEGA Х [16] методом максимального правдоподобия с использованием трёхпараметрической модели эволюции Тамуры Т92. Показатели статистической надёжности узлов филогенетического дерева рассчитывались с помощью бутстреп-анализа с использованием 500 случайных реплик.
Анализ на наличие мутаций резистентности для изучаемого фрагмента NS5b региона изолятов ВГС проводили по следующим позициям: S282T (для 1a, 1b, 2a, 3a), C316H/N/Y (1a, 1b), V321I (2a). Резистентность изолятов ВГВ оценивали по наличию мутаций A181T, N236T (для адефовира и тенофовира), I169T, V173L, L180M, A181T, T184G, S202I, M204V/I, M250V (для ламивудина и энтекавира).
Для статистической обработки использовали стандартные методы описательной статистики с применением пакета программ Statistica 12.6 (StatSoft, США). Средние значения оценивали с учетом 95% ДИ по методу Клоппера–Пирсона.
Полученные нуклеотидные последовательности депонированы в международную базу GenBank под номерами ON814585 – ON814645 (фрагмент гена NS5b изолятов ВГС), ON814646 – ON814673 (фрагмент гена pol изолятов ВГB), MW556198 – MW556199 (полногеномные последовательности изолятов ВГD).
Результаты
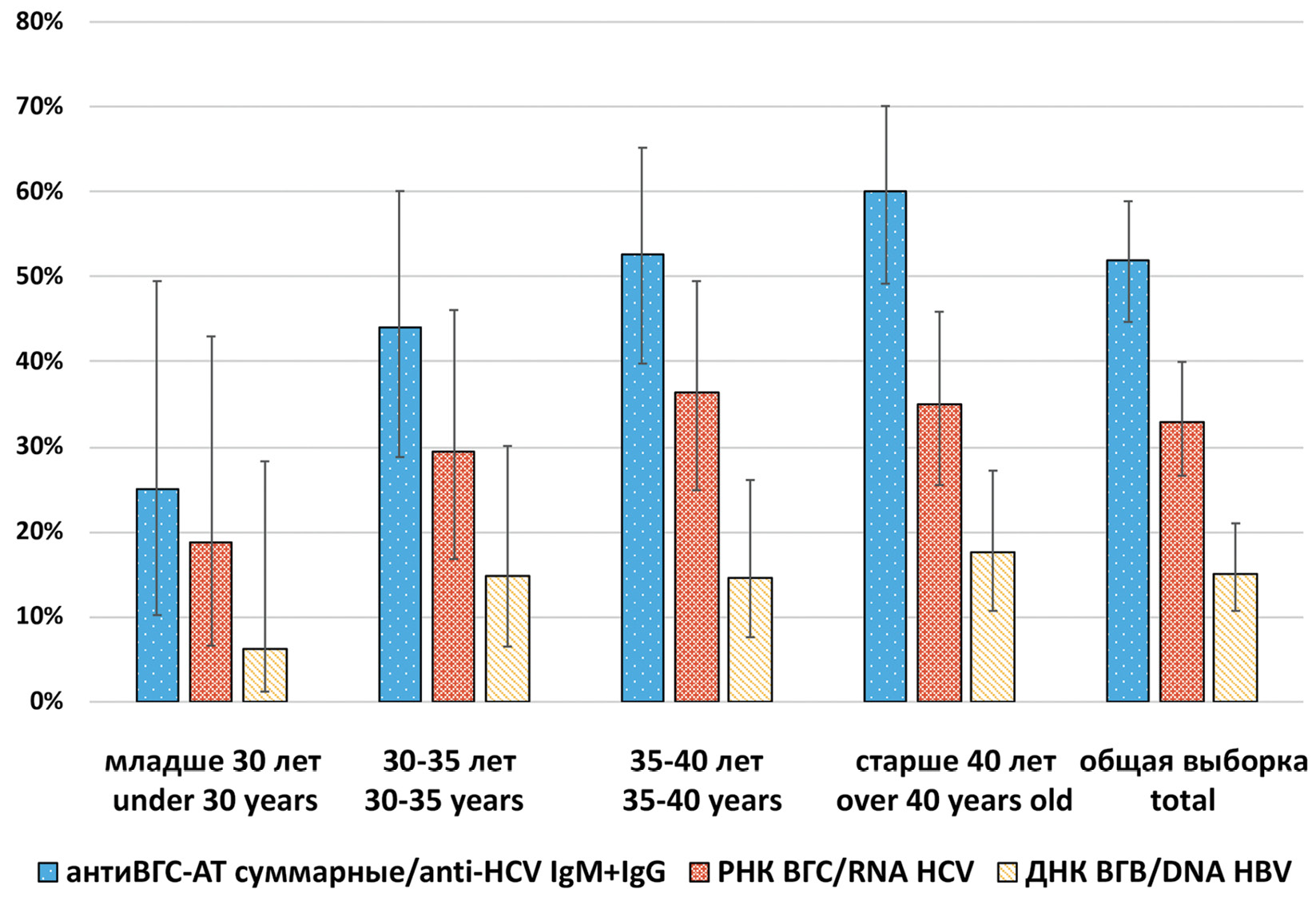
Среди 185 исследуемых образцов крови ВИЧ-инфицированных лиц суммарные антитела к ВГС были обнаружены в 51,9% (95% ДИ 44,7–58,9), Уровень обнаружения генетического материала ВГС составил 32,9% (95% ДИ 26,6–39,5), при этом РНК ВГС ожидаемо обнаруживалась только среди пациентов, положительных на присутствие серологических маркеров ВГС. Обнаружение, помимо антител к ВГС, и самой РНК свидетельствует о наличии активной репликации вируса и развитии хронического гепатита С. Распределение генетического материала ВГС в различных половозрастных группах полностью повторяет распределение серологических маркеров. Инфицирование ВГС (по наличию РНК ВГС) у ВИЧ-позитивных лиц имеет тенденцию к увеличению с возрастом: в группе до 30 лет встречаемость коинфицирования ВИЧ/ВГС составила 18,7% (95% ДИ 6,6–43,0); в группе 30–35 лет – 29,4% (95% ДИ 16,8–46,1); в группе 35–40 лет – 36,4% (95% ДИ 24,9–49,5); в группе старше 40 лет – 35,1% (95% ДИ 25,5–45,9) (рис. 1).
Рис. 1. Распределение маркеров вируса гепатита В и С среди различных возрастных групп ВИЧ-инфицированных лиц.
Филогенетический анализ показал, что доминирующими субгенотипами ВГС в изучаемой выборке ВИЧ-инфицированных в Новосибирской области являются 1b (52,5%) и 3а (34,5%), с меньшей частотой встречаются субгенотипы 1а (11,5%) и 2а (1,5%) (рис. 2 и 3). Проведённый нами статистический анализ не выявил различий в распределении генотипов между обследованными мужчинами и женщинами. Анализ мутаций резистентности к препаратам прямого противовирусного действия среди выявленных изолятов ВГС показал, что 27 вариантов субгенотипа 1b обладают мутацией C316N в NS5b, ассоциированной с развитием лекарственной устойчивости к лечению софосбувиром и дацабувиром. Таким образом, доля резистентных к лечению препаратами прямого противовирусного действия изолятов субгенотипа 1b в исследуемой популяции чрезвычайно высока и составляет 84,3%. Среди изолятов, относящихся к субгенотипам 1а, 2а и 3а, мутаций резистентности выявлено не было, но стоит отметить, что анализ проводился по фрагменту гена NS5b, в который часть известных мутационных позиций нуклеотидов не входит.
Рис. 2. Филогенетическое дерево, построенное методом максимального правдоподобия, для нуклеотидных последовательностей фрагментов гена NS5b вируса гепатита С (380 нуклеотидов) геновариантов вируса гепатита С, полученных от ВИЧ-инфицированных пациентов Новосибирской области (отмечены жирным шрифтом и шифром Nsk); буквой R обозначены варианты ВГС, имеющие мутацию C316N, ассоциированную с развитием резистентности к лечению ингибиторами NS5b (софосбувир, дацабувир).
Рис. 3. Филогенетический анализ изучаемых нуклеотидных последовательностей фрагментов гена NS5b вируса гепатита С (265 нуклеотидов) геновариантов вируса гепатита С, полученных от ВИЧ-инфицированных пациентов Новосибирской области (отмечены красным жирным шрифтом и шифром Nsk) с ранее циркулирующими вариантами вируса гепатита С на территории России и сопредельных стран: синим цветом обозначены варианты вируса гепатита С, циркулирующие на территории Западной Сибири; фиолетовым – варианты вируса гепатита С, циркулирующие на территории Восточной Сибири и Дальнего Востока; красным прямоугольником выделены варианты субгенотипа 1а, кластеризующиеся в отдельную кладу.
ДНК ВГВ была обнаружена в 15,2% (95% ДИ 10,7–21,0) исследуемых проб. Из 28 выявленных изолятов ВГВ 27 относятся к субгенотипу D2, один – к субгенотипу D3 (рис. 4). По аналогии с ВГС инфицирование ВГВ у ВИЧ-позитивных лиц имеет тенденцию к увеличению с возрастом: в группе до 30 лет встречаемость коинфицирования ВГВ/ВИЧ составила 6,3% (95% ДИ 1,2–28,3), 30–35 лет – 14,7% (95% ДИ 6,5–30,1), 35–40 лет – 14,5% (95% ДИ 7,6–26,1), старше 40 лет – 17,5% (95% ДИ 10,7–27,2) (рис. 1). Статистически значимых различий встречаемости коинфицирования ВГВ/ВИЧ у мужчин и женщин не выявлено. Анализ на наличие мутаций резистентности показал, что один изолят имеет мутацию M204I, ассоциированную с устойчивостью к лечению ламивудином и телбивудином.
Рис. 4. Филогенетическое дерево, построенное методом максимального правдоподобия, для нуклеотидных последовательностей фрагментов гена pol вируса гепатита B (1200 нуклеотидов) изолятов вируса гепатита B, полученных от ВИЧ-инфицированных пациентов Новосибирской области (отмечены жирным шрифтом и шифром Nsk).
Среди ВИЧ-/ВГВ-инфицированных пациентов обнаружено 2 изолята ВГD, которые при филогенетическом анализе были отнесены к генотипу 1 (рис. 5). Уровень инфицированности ВГD составил 1,1% (95% ДИ 0,3–3,8) среди общей выборки и 7,1% (95% ДИ 2,1–22,6) среди ВИЧ-/ВГВ-инфицированных. В обоих случаях изоляты ВГD были определены у мужчин старше 40 лет.
Рис. 5. Филогенетическое дерево, построенное методом максимального правдоподобия, для полногеномных нуклеотидных последовательностей изолятов ВГD (Nsk_D1 и Nsk_D2), полученных от ВИЧ-инфицированных пациентов Новосибирской области.
У трех из обследуемых пациентов (1,6%; 95% ДИ 0,6–4,6) было обнаружено коинфицирование ВГВ/ВГС/ВИЧ, у одного из них определялась и РНК ВГD. Эти три пациента относились к группе мужчин старше 40 лет, причём у всех был выявлен субгенотип ВГС 3а.
Обсуждение
Встречаемость как серологических маркеров ВГС-инфекции, так и генетического материала ВГС среди ВИЧ-инфицированных пациентов Новосибирской области значительно (в 25–30 раз) превышает аналогичные показатели среди условно здорового населения России и сопредельных стран (табл. 2) [17–25]. Наибольшее количество информации о распространённости маркеров ВГС, согласно литературным данным, приводится для группы потребителей инъекционных наркотиков, являющихся основной группой риска инфицирования ВГС. Полученные данные показывают, что в сплошной когорте ВИЧ-инфицированных Новосибирской области распространение ВГС-инфекции всё же ниже, чем у потребителей инъекционных наркотиков в других регионах России (данные наиболее близки к ситуации, сложившейся в Алтайском крае – соседнем с Новосибирской областью регионе). Полученные данные, возможно, связаны с наблюдаемой тенденцией к преобладанию полового пути передачи ВИЧ-инфекции и постепенной замене потребления инъекционных наркотиков на синтетические курительные смеси, спайсы [17].
Таблица 2. Встречаемость маркеров вируса гепатита С среди разных групп населения в различных регионах России и сопредельных странах
Table 2. Prevalence of HCV markers among different population groups in different regions of Russia and neighboring countries
Исследуемая выборка Study sample | Регион / страна Region / country | Встречаемость маркеров вируса гепатита С, % Prevalence of HCV markers, % | Год исследования Year of research | Источник Reference | |
Суммарные антитела к вирусу гепатита С Total anti-HCV | РНК вируса гепатита С RNA HCV | ||||
Сплошная выборка (условно здоровое население) Conditionally healthy population | Московская область Moscow region | 1,7 | 0,9 | 2017 | [18] |
Ростовская область Rostov region | 2,1 | 1,3 | |||
Свердловская область Sverdlovsk region | 3 | 0,6 | |||
Республика Саха (Якутия) The Republic of Sakha (Yakutia) | 3,3 | 1,2 | |||
Республика Тыва Tyva Republic | 3,3 | 1,3 | |||
Россия Russia | 2,2 | - | 2019 | [19] | |
Узбекистан Uzbekistan | 4,1 | – | |||
Молдова Moldova | 2,7 | – | |||
Беларусь Belarus | 1,26 | – | 2007 | [20] | |
Беларусь Belarus | 2 | – | 2021 | [21] | |
Украина Ukraine | 5 | – | |||
Потребители инъекционных наркотиков Injecting drug users | Московская область Moscow region | 68 | – | 2006 | [22] |
Волгоградская область Volgograd region | 70 | – | |||
Алтайский край Altai region | 54 | – | |||
Потребители инъекционных наркотиков с ВИЧ-инфекцией | Санкт-Петербург St. Petersburg | 98,9 | – | 2016 | [23] |
Тольятти Togliatti | 93 | – | 2005 | [24] | |
Россия Russia | 79,6 | 56,2 | 2002 | [25] | |
Восточная Европа и Центральная Азия Eastern Europe and Central Asia | 10–96 | – | 2007 | [26] | |
Западная Европа Western Europe | 2–93 | – | |||
Юго-Восточная Азия South-East Asia | 10–100 | – | |||
Северная Африка и Ближний Восток North Africa and the Middle-East | 5–60 | – | |||
Северная Америка North America | 8–90 | – | |||
ВИЧ-позитивные лица | Новосибирская область Novosibirsk region | 51,9 | 32,9 | 2021–2022 | Данное исследование |
Филогенетический анализ выявленных генетических вариантов ВГС у ВИЧ-позитивных лиц Новосибирской области показывает, что они хорошо кластеризуются с ранее обнаруженными вариантами, циркулирующими в различных регионах России (прежде всего Западной Сибири) среди населения без ВИЧ-инфекции. Уровень гомологии геновариантов генотипа 1 с прототипными изолятами составил 90–95%, генотипа 2 – 94–95%, генотипа 3 – 91–92%. Однако выделяются 7 вариантов субгенотипа 1а (ON814585 – ON814591), образующих на филодендрограмме отдельную кладу и имеющих гораздо меньшую степень гомологии с прототипными российскими изолятами.
Определение генотипа ВГС имеет немаловажное значение при проведении противовирусной терапии с использованием пролонгированных форм интерферона-α (α2a, α2b) в сочетании с рибавирином. Известно, что генотип является одним из важнейших прогностических факторов устойчивого вирусологического ответа [27]. При лечении пациентов, имеющих генотип 1 ВГС, устойчивый вирусологический ответ достигается в 55% случаев, тогда как у лиц с генотипом 2 или 3 – более чем в 80%. Вопросы, касающиеся влияния генотипа ВГС на тяжесть течения инфекции гепатита С, скорость развития заболевания и успех трансплантации печени, остаются не до конца выясненными. Представители всех генотипов и субтипов ВГС являются гепатотропными, могут вызывать развитие хронической инфекции, цирроза, гепатоцеллюлярной карциномы. Однако в ряде исследований было показано, что субгенотип 1b может быть связан с более тяжёлым течением гепатита, быстрым развитием декомпенсированной стадии заболевания, требующей трансплантации печени [28]. Генотип 3 ассоциируют с более быстрым прогрессированием фиброза [29], а также с развитием стеатоза (жирового гепатоза) вне зависимости от индекса массы тела пациента [30]. Распределение генотипов также связано с различными путями передачи инфекции. Традиционно субгенотипы 1a и 3a связывают с употреблением наркотиков, в то время как субгенотип 1b чаще передаётся с продуктами крови посредством медицинских процедур [31]. Интенсивное распространение субгенотипа 3а в нашей стране связывают с его проникновением в среду инъекционных наркоманов в 1980-е гг. из стран Центральной и Юго-Восточной Азии. Распределение генотипов среди ВИЧ-инфицированных лиц Новосибирской области сопоставимо с распределением генотипов ВГС в клинических образцах, собранных в 2005–2014 гг. в Новосибирске [32], однако доля субгенотипов 1а и 3а у ВИЧ-позитивных ожидаемо выше, чем в среднем в популяции.
В последние годы стали доступны высокоэффективные препараты прямого противовирусного действия (ПППД), мишенями которых являются белки ВГС, играющие ключевые роли в жизненном цикле вируса. ПППД демонстрируют высокую эффективность, хорошую переносимость пациентами, снижение взаимодействия с другими лекарственными препаратами, сокращение курса лечения, многие из них эффективны в отношении разных генотипов, т. е. являются пангенотипными [33–35]. Однако на сегодняшний день известно, что в генах ВГС, отвечающих за синтез белков, являющихся мишенями ПППД, встречаются мутации, повышающие устойчивость вируса к этиотропной терапии. В настоящее время описано множество мутаций, которые в той или иной степени влияют на устойчивость к конкретному ПППД [36, 37]. В нашем исследовании показано, что 84,3% изолятов мажорного субгенотипа 1b, имеющего наихудшую прогностическую значимость в клиническом течении инфекции, обладают также и мутацией C316N, ассоциированной с развитием резистентности к таким препаратам, как софосбувир [38, 39] и дацабувир [40, 41]. Важно отметить особую значимость софосбувира, который является препаратом выбора для лечения гепатита C у людей, живущих с ВИЧ. У него минимальное количество нежелательных взаимодействий с антиретровирусной терапией, которую принимают люди с ВИЧ, и схемы с использованием софосбувира для них входят в число предпочтительных [42]. В ранее проведённых исследованиях показано, что мутация C316N является наиболее часто встречаемой (56%; 95% ДИ 33,2–76,9) среди пациентов, инфицированных субгентипом 1b с неудачным опытом терапии софосбувиром [43]. Следует отметить, что определяемый в исследовании фрагмент NS5b региона не покрывает ряд других мутаций резистентности к ПППД, таких как V411S (для 1b), M414I/V (1a, 1b), R422K (1a, 1b), М423I/T/V (1a, 1b), что актуализирует продолжение исследования.
Распространённость РНК ВГВ среди ВИЧ-позитивных лиц Новосибирской области также оказалась более высокой по сравнению с условно здоровым населением России даже таких гиперэндемичных регионов, как республики Саха (Якутия) и Тыва. Полученные по Новосибирской области результаты соотносятся с литературными данными, согласно которым в группе ВИЧ-позитивных пациентов ДНК ВГВ выявлялась с частотой от 10–11,3 [44, 45] до 16,7–31,5% [46, 47]. В Российской Федерации распространены генотипы A, C и D ВГВ с доминированием генотипа D в большинстве регионов. Разные генотипы ВГВ отличаются резистентностью к противовирусным препаратам, подверженностью мутациям, риском хронизации и темпами прогрессирования поражения печени. Гепатит B, вызванный генотипом A, чаще принимает хроническое течение и имеет больший риск трансформации в цирроз печени и гепатоцеллюлярную карциному по сравнению с генотипом D. Доказано, что генотип С связан с более тяжёлым течением болезни и, вероятно, ведёт к развитию гепатокарциномы через стадию цирроза в более старшем возрасте, в то время как генотип В связан с развитием гепатокарциномы в раннем возрасте.
Для лечения хронического гепатита В широко используются аналоги нуклеозидов/нуклеотидов, такие как ламивудин, телбивудин, адефовир, энтекавир, однако обнаруживаются варианты ВГВ, проявляющие устойчивость к данным препаратам. Мутации устойчивости определяются прежде всего заменами в высоко консервативном мотиве «тирозин – метионин – аспарагиновая кислота – аспарагиновая кислота» (YMDD) С-домена полимеразы ВГВ (в положении 203–206). Наиболее часто встречаются замены метионина на валин в 204-м положении обратной транскриптазы (M204V) либо метионина на изолейцин (M204I) [48]. Сведения о вариантах ВГВ, несущих мутации в гене полимеразы среди ВГВ-/ВИЧ-коинфицированных пациентов, малочисленны, что обусловливает актуальность изучения циркуляции лекарственно-устойчивых вариантов ВГВ среди этой группы населения. Раннее определение изолятов ВГВ с мутациями в гене полимеразы, ассоциированных с развитием лекарственной устойчивости, имеет важное клиническое значение прежде всего для предупреждения обострения заболевания. Для пациентов с высоким риском прогрессирования гепатита В, к которым можно отнести ВИЧ-/ВГВ-инфицированных, раннее выявление таких вариантов ВГВ наиболее значимо как до начала применения нуклеозидных аналогов, так и в процессе лечения, когда вирусная нагрузка может быть очень низкой и (или) мутантные варианты ВГВ присутствуют в общей вирусной популяции в меньшей доле.
Среди исследуемых нами изолятов ВГВ от ВИЧ-инфицированных лиц, проживающих в Новосибирской области, в одном варианте обнаружена мутация M204I, связанная с развитием невосприимчивости к ламивудину, энтекавиру, телбивудину и тенофовиру. Следует сказать, что мутации в полимеразе, к которым относится и обнаруженная нами, влияют также и на поверхностный белок. Данные мутации снижают синтез HBsAg, затрудняя серологическую верификацию ВГВ и способствуя развитию ускользающих от вакцин штаммов вируса [49]. Результаты согласуются с проведённой ранее отечественной работой, в которой среди 30 ВИЧ-/ВГВ-инфицированных пациентов в одном случае (3,3%) установлено значимое аминокислотное замещение M204I, ещё в двух случаях определены потенциально значимые мутации L179S (ассоциирована с развитием лекарственной устойчивости при терапии хронического гепатита В ламивудином) и V214Y (связана с развитием лекарственной устойчивости к адефовиру) [50].
В России об эпидемической ситуации по гепатиту D можно судить только по результатам отдельных региональных исследований, основанных на частоте выявления анти-ВГD среди людей, положительных на наличие HBsAg. Показано, что ВГD относительно редко встречается на территории европейской части России и широко распространён на отдельных территориях азиатской части страны – в Тыве, Якутии, на Чукотке, достигая здесь 35% среди больных хроническим гепатитом В [51]. Среди 28 пациентов, в крови которых была обнаружена ДНК ВГВ, нам удалось обнаружить РНК ВГD у двух пациентов. Оба пациента являются мужчинами 42 и 45 лет. Один из изолятов ВГD кластеризуется с прототипными изолятами, циркулирующими на территории Средней Азии и Пакистана, однако имеет уровень гомологии нуклеотидной последовательности с прототипами не более 90%. Другой изолят кластеризуется с прототипными изолятами, циркулирующими на территории Румынии, Германии и Израиля, гомология нуклеотидной последовательности с которыми составляет около 95%.
Заключение
Полученные данные подтверждают факт более широкого распространения инфицирования парентеральными вирусными гепатитами среди ВИЧ-позитивных лиц Новосибирской области по сравнению с условно здоровым населением. Генетическое разнообразие вариантов этих вирусов среди ВИЧ-инфицированных аналогично разнообразию, наблюдаемому в общей популяции.
В работе определены уровни встречаемости у ВИЧ-инфицированных пациентов Новосибирской области серологических маркеров ВГС (суммарные антитела) – 51,9%, РНК ВГС – 32,9%, ДНК ВГВ – 15,2%, РНК ВГD – 1,1%. Показано генотипическое разнообразие выявленных изолятов ВГС: 1b (52,5%), 3а (34,5%), 1а (11,5%), 2а (1,5%); ВГВ: D2 (96,5%), D3 (3,5%); выявленные изоляты ВГD отнесены к первому генотипу. Встречаемость маркеров вирусов парентеральных гепатитов у ВИЧ-позитивных лиц имеет тенденцию увеличения с возрастом. Статистически достоверных различий в распределении маркеров парентеральных гепатитов среди ВИЧ-инфицированных мужчин и женщин на изучаемой выборке выявить не удалось. Среди вариантов ВГС, относящихся с 1b субгенотипу, определена значительная доля изолятов (84,3%), имеющих мутацию C316N, ассоциированную с развитием резистентности к лечению софосбувиром и дацабувиром. Мутация M204I, связанная с устойчивостью к лечению ламивудином и телбивудином, была выявлена у одного изолята ВГВ.
Результаты исследования свидетельствуют о целесообразности проведения тщательного обследования ВИЧ-позитивных лиц на наличие серологических и молекулярно-генетических маркеров инфицирования парентеральными вирусными гепатитами, что является крайне важным для выбора тактики лечения пациентов, своевременной профилактики возможных осложнений и предотвращения дальнейшего распространения данной группы вирусов в популяции.
Участие авторов: Карташов М.Ю. – проведение экспериментальных исследований, обработка данных, написание текста; Свирин К.А. – проведение экспериментальных исследований; Кривошеина Е.И. – проведение экспериментальных исследований; Чуб Е.В. – организация и контроль проведения исследований; Терновой В.А. – общее редактирование статьи; Кочнева Г.В. – общее руководство, написание текста статьи.
Финансирование. Исследование проведено в рамках государственного задания ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора ГЗ-2/22 (№ 122040600156-3 в ЕГИСУ НИОКТР).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Этическое утверждение. Исследование проводилось при добровольном информированном согласии пациентов. Протокол исследования одобрен решением этического комитета ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора (протокол № 5 от 21.07.2022).
1Рандомайзер для чисел и другие сервисы. Режим доступа: https://randomus.ru/.
About the authors
Mikhail Yu. Kartashov
State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor); Novosibirsk National Research State University
Author for correspondence.
Email: mikkartash@yandex.ru
ORCID iD: 0000-0002-7857-6822
PhD, MD (Biology), Senior Researcher, Department of Flavivirus Infections
Russian Federation, 630559, Novosibirsk Region, Koltsovo; 630090, NovosibirskKirill A. Svirin
State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: svirin_ka@vector.nsc.ru
ORCID iD: 0000-0001-9083-1649
Junior Researcher, Department of Flavivirus Infections
Russian Federation, 630559, Novosibirsk Region, KoltsovoEkaterina I. Krivosheina
State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: katr962@mail.ru
ORCID iD: 0000-0001-5181-0415
Junior Researcher, Department of Flavivirus Infections
Russian Federation, 630559, Novosibirsk Region, KoltsovoElena V. Chub
State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: chub_ev@vector.nsc.ru
ORCID iD: 0000-0003-1521-897X
PhD, MD (Biology), Biology, head of department
Russian Federation, 630559, Novosibirsk Region, KoltsovoVladimir A. Ternovoi
State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: tern@vector.nsc.ru
ORCID iD: 0000-0003-1275-171X
PhD, MD (Biology), head of the laboratory Department of Flavivirus Infections
Russian Federation, 630559, Novosibirsk Region, KoltsovoGalina V. Kochneva
State Scientific Center of Virology and Biotechnology “Vector” of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: kochneva@vector.nsc.ru
ORCID iD: 0000-0002-2420-0483
Doctor of Biology, head of the laboratory Department of Flavivirus Infections
Russian Federation, 630559, Novosibirsk Region, KoltsovoReferences
- Gonzalez V.D., Falconer K., Blom K.G., Reichard O., Mørn B., Laursen A.L., et al. High levels of chronic immune activation in the T-cell compartments of patients coinfected with hepatitis C virus and human immunodeficiency virus type 1 and on highly active antiretroviral therapy are reverted by alpha interferon and ribavirin treatment. J. Virol. 2009; 83(21): 11407–11. https://doi.org/10.1128/JVI.01211-09
- Kovacs A., Karim R., Mack W.J., Xu J., Chen Z., Operskalski E., et al. Activation of CD8 T cells predicts progression of HIV infection in women coinfected with hepatitis C virus. J. Infect. Dis. 2010; 201(6): 823–34. https://doi.org/10.1086/650997
- Rauch A., James I., Pfafferott K., Nolan D., Klenerman P., Cheng W., et al. Divergent adaptation of hepatitis C virus genotypes 1 and 3 to human leukocyte antigen-restricted immune pressure. Hepatology. 2009; 50(4): 1017–29. https://doi.org/10.1002/hep.23101
- Tengan F.M., Ibrahim K.Y., Dantas B.P., Manchiero C., Magri M.C, Bernando W.M. Seroprevalence of hepatitis C virus among people living with HIV/AIDS in Latin America and the Caribbean: a systematic review. BMC Infect. Dis. 2016; 16(1): 663. https://doi.org/10.1186/s12879-016-1988-y
- Zuckerman A.D., Douglas A., Whelchel K., Choi L., DeClercq J., Chastain C.A., et al. Pharmacologic management of HCV treatment in patients with HCV monoinfection vs. HIV/HCV coinfection: Does coinfection really matter? PLoS One. 2019; 14(11): e0225434. https://doi.org/10.1371/journal.pone.0225434
- Cheng Z., Lin P., Cheng N. HBV/HIV coinfection: impact on the development and clinical treatment of liver diseases. Front. Med. (Lausanne). 2021; 8: 713981. https://doi.org/10.3389/fmed.2021.713981
- Babu C.K., Suwansrinon K., Bren G.D., Badley A.D., Rizza S.A. HIV induces TRAIL sensitivity in hepatocytes. PLoS One. 2009; 4(2): e4623. https://doi.org/10.1371/journal.pone.0004623
- Herbeuval J.P., Boasso A., Grivel J.C., Hardy A.W., Anderson S.A., Dolan M.J., et al. TNF-related apoptosis-inducing ligand (TRAIL) in HIV-1-infected patients and its in vitro production by antigen-presenting cells. Blood. 2005; 105(6): 2458–64. https://doi.org/10.1182/blood-2004-08-3058
- Yu Y., Gong R., Mu Y., Chen Y., Zhu C., Sun Z., et al. Hepatitis B virus induces a novel inflammation network involving three inflammatory factors, IL-29, IL-8, and cyclooxygenase-2. J. Immunol. 2011; 187(9): 4844–60. https://doi.org/10.4049/jimmunol.1100998
- Lara-Pezzi E., Gómez-Gaviro M.V., Gálvez B.G., Mira E., Iñiguez M.A., Fresno M., et al. The hepatitis B virus X protein promotes tumor cell invasion by inducing membrane-type matrix metalloproteinase-1 and cyclooxygenase2 expression. J. Clin. Investig. 2002; 110(12): 1831–8. https://doi.org/10.1172/JCI15887
- Mohammed N.A., Abd El-Aleem S.A., El-Hafiz H.A., McMahon R.F. Distribution of constitutive (COX-1) and inducible (COX-2) cyclooxygenase in postviral human liver cirrhosis: a possible role for COX-2 in the pathogenesis of liver cirrhosis. J. Clin. Pathol. 2004; 57(4): 350–4. https://doi.org/10.1136/jcp.2003.012120
- Singh K.P., Crane M., Audsley J., Avihingsanon A., Sasadeusz J., Lewin S.R. HIV-hepatitis B virus coinfection: epidemiology, pathogenesis, and treatment. AIDS. 2017; 31(15): 2035–52. https://doi.org/10.1097/QAD.0000000000001574
- Brenchley J.M., Price D.A., Schacker T.W., Asher T.E., Silvestri G., Rao S., et al. Microbial translocation is a cause of systemic immune activation in chronic HIV infection. Nat. Med. 2006; 12(12): 1365–71. https://doi.org/10.1038/nm1511
- Qadir M.I. Hepatitis in AIDS patients. Rev. Med. Virol. 2018; 28(1). https://doi.org/10.1002/rmv.1956
- Sulkowski M.S. Viral hepatitis and HIV coinfection. J. Hepatol. 2008; 48(2): 353–67. https://doi.org/10.1016/j.jhep.2007.11.009
- Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms. Mol. Biol. Evol. 2018; 35(6): 1547–9. https://doi.org/10.1093/molbev/msy096
- Titarenko R.V. Features of the drug situation and the problems of drug abuse prevention among Russian teenagers. Gumanitarnye, sotsial’no-ekonomicheskie i obshchestvennye nauki. 2015; (11-1): 191–4. (in Russian)
- Soboleva N.V., Karlsen A.A., Kozhanova T.V., Kichatova V.S., Klushkina V.V., Isaeva O.V., et al. The prevalence of the hepatitis C virus among the conditionally healthy population of the Russian Federation. Zhurnal infektologii. 2017; 9(2): 56–64. https://doi.org/10.22625/2072-6732-2017-9-2-56-64 (in Russian)
- Guntipalli P., Pakala R., Kumari Gara S., Ahmed F., Bhatnagar A., Endaya Coronel M.K., et al. Worldwide prevalence, genotype distribution and management of hepatitis C. Acta Gastroenterol. Belg. 2021; 84(4): 637–56. https://doi.org/10.51821/84.4.015.
- Olinger C.M., Lazouskaya N.V., Eremin V.F., Muller C.P. Multiple genotypes and subtypes of hepatitis B and C viruses in Belarus: similarities with Russia and western European influences. Clin. Microbiol. Infect. 2008; 14(6): 575–81. https://doi.org/10.1111/j.1469-0691.2008.01988.x
- Isakov V., Tsyrkunov V., Nikityuk D. Is elimination of hepatitis C virus realistic by 2030: Eastern Europe. Liver Int. 2021; 41(Suppl. 1): 50–5. https://doi.org/10.1111/liv.14836
- Rhodes T., Platt L., Maximova S., Koshkina E., Latishevskaya N., Hickman M., et al. Prevalence of HIV, hepatitis C and syphilis among injecting drug users in Russia: a multi-city study. Addiction. 2006; 101(2): 252–66. https://doi.org/10.1111/j.1360-0443.2006.01317.x
- Tsui J.I., Ko S.C., Krupitsky E., Lioznov D., Chaisson C.E., Gnatienko N., et al. Insights on the Russian HCV care cascade: minimal HCV treatment for HIV/HCV co-infected PWID in St. Petersburg. Hepatol. Med. Policy. 2016; 1: 13. https://doi.org/10.1186/s41124-016-0020-x
- Rhodes T., Platt L., Judd A., Mikhailova L.A., Sarang A., Wallis N., et al. Hepatitis C virus infection, HIV co-infection, and associated risk among injecting drug users in Togliatti, Russia. Int. J. STD AIDS. 2005; 16(11): 749–54. https://doi.org/10.1258/095646205774763180
- Bobkova M.R., Samokhvalov E.I., Buravtsova E.V., Detkova N.V., Kravchenko A.V., Salamov G.G., et al. Hepatitis C among HIV-infected intravenous drug users in Russia. Mir virusnykh gepatitov. 2002; (6): 6–9. (in Russian)
- Aceijas C., Rhodes T. Global estimates of prevalence of HCV infection among injecting drug users. Int. J. Drug Policy. 2007; 18(5): 352–8. https://doi.org/10.1016/j.drugpo.2007.04.004
- Munir S., Saleem S., Idrees M., Tariq A., Butt S., Rauff B., et al. Hepatitis C treatment: current and future perspectives. Virol. J. 2010; 7: 296. https://doi.org/10.1186/1743-422X-7-296
- Zein N.N. Clinical significance of hepatitis C virus genotypes. Clin. Microbiol. Rev. 2000; 13(2): 223–35. https://doi.org/10.1128/CMR.13.2.223
- Probst A., Dang T., Bochud M., Egger M., Negro F., Bochud P.Y. Role of hepatitis C virus genotype 3 in liver fibrosis progression--a systematic review and meta-analysis. J. Viral. Hepat. 2011; 18(11): 745–59. https://doi.org/10.1111/j.1365-2893.2011.01481.x
- Ramalho F. Hepatitis C virus infection and liver steatosis. Antiviral Res. 2003; 60(2): 125–7. https://doi.org/10.1016/j.antiviral.2003.08.007
- Esteban J.I., Sauleda S., Quer J. The changing epidemiology of hepatitis C virus infection in Europe. J. Hepatol. 2008; 48(1): 148–62. https://doi.org/10.1016/j.jhep.2007.07.033
- Shustov A.V., Kochneva G.V., Sivolobova G.F., Grazhdantseva A.A., Gavrilova I.V., Akinfeeva L.A. The occurrence of markers, the distribution of genotypes and risk factors for viral hepatitis C among some groups of the population of the Novosibirsk region. Zhurnal mikrobiologii, epidemiologii i immunobiologii. 2004; 71(5): 20–5. (in Russian)
- Schinazi R., Halfon P., Marcellin P., Asselah T. HCV direct-acting antiviral agents: the best interferon-free combinations. Liver Int. 2014; 34(Suppl. 1): 69–78. https://doi.org/10.1111/liv.12423
- D’Ambrosio R., Degasperi E., Colombo M., Aghemo A. Direct-acting antivirals: the endgame for hepatitis C? Curr. Opin. Virol. 2017; 24: 31–7. https://doi.org/10.1016/j.coviro.2017.03.017
- Feld J.J. Direct-acting antivirals for Hepatitis C Virus (HCV): The progress continues. Curr. Drug Targets. 2017; 18(7): 851–62. https://doi.org/10.2174/1389450116666150825111314
- Zhang Y., Cao Y., Zhang R., Zhang X., Lu H., Wu C., et al. Pre-existing HCV variants resistant to DAAs and their sensitivity to PegIFN/RBV in Chinese HCV genotype 1b patients. PLoS One. 2016; 11(11): e0165658. https://doi.org/10.1371/journal.pone.0165658
- Palanisamy N., Kalaghatgi P., Akaberi D., Lundkvist Å., Chen Z.W., Hu P., et al. Worldwide prevalence of baseline resistance-associated polymorphisms and resistance mutations in HCV against current direct-acting antivirals. Antivir. Ther. 2018; 23(6): 485–93. https://doi.org/10.3851/IMP3237
- Ikeda H., Watanabe T., Shimizu H., Hiraishi T., Kaneko R., Baba T., et al. Efficacy of ledipasvir/sofosbuvir with or without ribavirin for 12 weeks in genotype 1b HCV patients previously treated with a nonstructural protein 5A inhibitor-containing regimen. Hepatol. Res. 2018; 48(10): 802–9. https://doi.org/10.1111/hepr.13074
- Wang G.P., Terrault N., Reeves J.D., Liu L., Li E., Zhao L., et al. Prevalence and impact of baseline resistance-associated substitutions on the efficacy of ledipasvir/sofosbuvir or simeprevir/sofosbuvir against GT1 HCV infection. Sci. Rep. 2018; 8(1): 3199. https://doi.org/10.1038/s41598-018-21303-2
- Kati W., Koev G., Irvin M., Beyer J., Liu Y., Krishnan P., et al. In vitro activity and resistance profile of dasabuvir, a nonnucleoside hepatitis C virus polymerase inhibitor. Antimicrob. Agents Chemother. 2015; 59(3): 1505–11. https://doi.org/10.1128/AAC.04619-14
- Di Maio V.C., Cento V., Lenci I., Aragri M., Rossi P., Barbaliscia S., et al. Multiclass HCV resistance to direct-acting antiviral failure in real-life patients advocates for tailored second-line therapies. Liver Int. 2017; 37(4): 514–28. https://doi.org/10.1111/liv.13327
- European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J. Hepatol. 2018; 69(2): 461–511. https://doi.org/10.1016/j.jhep.2018.03.026
- Popping S., Cento V., Seguin-Devaux C., Boucher C.A.B., de Salazar A., Heger E., et al. The European prevalence of resistance associated substitutions among direct acting antiviral failures. Viruses. 2022; 14(1): 16. https://doi.org/10.3390/v14010016
- Barth R.E., Huijgen Q., Tempelman H.A., Mudrikova T., Wensing A.M., Hoepelman A.I. Presence of occult HBV, but near absence of active HBV and HCV infections in people infected with HIV in rural South Africa. J. Med. Virol. 2011; 83(6): 929–34. https://doi.org/10.1002/jmv.22026
- Tramuto F., Maida C.M., Colomba G.M., Di Carlo P., Vitale F. Prevalence of occult hepatitis B virus infection in a cohort of HIV-positive patients resident in Sicily, Italy. Biomed. Res. Int. 2013; 2013: 859583. https://doi.org/10.1155/2013/859583
- Laguno M., Larrousse M., Blanco J.L., Leon A., Milinkovic A., Martínez-Rebozler M., et al. Prevalence and clinical relevance of occult hepatitis B in the fibrosis progression and antiviral response to INF therapy in HIV-HCV-coinfected patients. AIDS Res. Hum. Retroviruses. 2008; 24(4): 547–53. https://doi.org/10.1089/aid.2007.9994
- Panigrahi R., Majumder S., Gooptu M., Biswas A., Datta S., Chandra P.K., et al. Occult HBV infection among anti-HBc positive HIV-infected patients in apex referral centre, Eastern India. Ann. Hepatol. 2012; 11(6): 870–5.
- Hann HW., Gregory V.L., Dixon J.S., Barker R.F. A review of the one-year incidence of resistance to lamivudine in the treatment of chronic hepatitis B. Hepatol. Int. 2008; 2(4): 440–56. https://doi.org/10.1007/s12072-008-9105-y
- Elpaeva E.A., Pisareva M.M., Nikitina O.E., Kizhlo S.N., Grudinin M.P., Dudanova O.P. Role of hepatitis B virus mutant forms in progressive course of chronic hepatitis B. Uchenye zapiski Petrozavodskogo gosudarstvennogo universiteta. 2014; (6): 41–6. (in Russian)
- Kozhanova T.V., Il’chenko L.Yu., Isaeva O.V., Alekseeva M.N., Saryglar A.A., Mironova N.I., et al. Circulation of hepatitis B virus variants carrying mutations in the polymerase gene among HBV-infected and HBV/HIV-coinfected patients. Sovremennye tekhnologii v meditsine. 2013; 5(2): 60–4. (in Russian)
- Isaeva O.V., Kyuregyan K.K. Viral hepatitis delta: an underestimated threat. Infektsionnye bolezni: novosti, mneniya, obuchenie. 2019; 8(2): 72–9. https://doi.org/10.24411/2305-3496-2019-12010 (in Russian)
Supplementary files