Endothelial protective properties of sacubitril-valsartan and drotaverine in influenza A(H1N1)pdm09 virus infection (Orthomyxoviridae: Alphainfluenzavirus: influenza A virus)
- Authors: Marchenko V.A.1, Zelinskaya I.A.2, Mukhametdinova D.V.2, Toropova Y.G.2, Galagudza M.M.2, Zhilinskaya I.N.1
-
Affiliations:
- North-Western State Medical University Named after I.I. Mechnikov
- V.A. Almazov National Medical Research Centre, Russian Ministry of Health
- Issue: Vol 70, No 4 (2025)
- Pages: 349-362
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/16764
- DOI: https://doi.org/10.36233/0507-4088-235
- EDN: https://elibrary.ru/amzvmr
- ID: 16764
Cite item
Full Text
Abstract
Introduction. Severe influenza is characterized by damage and morphofunctional changes of the endothelium of blood vessels, which contributes to the development of hemorrhagic syndrome and can cause endothelial dysfunction. To optimize the pathogenetic therapy of influenza infection, a screening of medications with endothelial protective properties was carried out.
Aim. The aim of the study was to evaluate the endothelial protective properties of sacubitril/valsartan and drotaverine in influenza A(H1N1)pdm09 virus infection.
Materials and methods. The study was conducted on Wistar rats, which received sacubitril/valsartan and drotaverine (in treatment and prophylactic regimen) followed by intransal infection with influenza A/Saint-Petersburg/48/16 (H1N1)pdm09 virus. Rats without drug administration were included in the control group; rats received no medications followed by influenza virus infection – in challenge control group. The virus infectious activity was determined in pulmonary and mesenteric tissues. Vascular endothelium damage in lungs was assessed by three parameters (desquamation, morphological and dystrophic changes). Endothelial nitric oxide synthase (eNOS) expression level in endothelium of mesenteric blood vessels was determined as well as mesenteric arteries vasomotor activity.
Results. Drotaverine reduces the severity of histopathological changes in the pulmonary vascular endothelium; increases the maximal response of mesenteric blood vessels to acetylcholine compared to the infection control group; normalizes eNOS expression levels. Sacubitril/valsartan reduces the severity of desquamation in the pulmonary vascular endothelium; normalizes the response of mesenteric blood vessels to acetylcholine, while eNOS expression is decreased.
Conclusions. Drotaverine possesses more significant endothelial protective properties than sacubitril/valsartan when used in a treatment and prophylactic regimen in rats infected with influenza A(H1N1)pdm09 virus.
Full Text
Введение
Грипп – высококонтагиозная острая респираторная вирусная инфекция с аэрогенным механизмом передачи, неизменно занимающая одно из ведущих мест в структуре инфекционной заболеваемости во всем мире. Несмотря на наличие высокоэффективных этиотропных противовирусных препаратов и значительных успехов в специфической профилактике данной инфекционной болезни, ежегодно в результате инфицирования сезонными вирусами гриппа (ВГ) болеют около 1 млрд человек, из которых у 3–5 млн диагностируют тяжелые формы заболевания, тогда как летальные исходы регистрируют в среднем у 470 тыс. заболевших [1].
Своевременное применение этиотропных препаратов (в первые 48 ч) позволяет до определенной степени ингибировать репродукцию ВГ, а также снижать тяжесть течения заболевания и, как следствие, смертность от гриппозной инфекции [2]. Следовательно, этиотропная терапия не позволяет полностью ингибировать репродукцию вируса, а также не имеет значимого эффекта при назначении, начиная с 3 сут заболевания. Помимо этого, серьезной проблемой, ограничивающей эффективность этиотропной терапии, остается формирование у современных циркулирующих штаммов ВГ лекарственной устойчивости. Так, возникающие мутации в генах, кодирующих различные структурные и неструктурные белки (например, H275Y в нейраминидазе и I38T в белке полимеразы PA), обуславливают невосприимчивость сезонных ВГ человека к наиболее значимым противогриппозным препаратам – ингибиторам нейраминидазы (осельтамивир, занамивир) и эндонуклеазы (балоксавир марбоксил) [3, 4].
Поражение сердечно-сосудистой системы при гриппе впервые стали отмечать в конце 40-х гг. XX в. [5]. Так, на фоне гриппозной инфекции могут развиваться различные аритмии, инфаркт миокарда, миокардит, перикардит, кардиомиопатия, обострение застойной сердечной недостаточности [6, 7]. Кроме того, на вовлечение сердечно-сосудистой системы в патогенез гриппа указывают эпидемиологические данные, выявляющие более высокий уровень «дополнительной» смертности от гриппозной инфекции у больных с сопутствующими заболеваниями сердечно-сосудистой системы [8]. Так, во время эпидемии гриппа, а также на протяжении 2 мес после ее окончания у пациентов с сердечно-сосудистыми заболеваниями дополнительная смертность от гриппа составляет 481 на 100 тыс. населения, тогда как среди здоровых взрослых без соматических заболеваний данный показатель составляет 2 на 100 тыс.
Причина поражения сердечно-сосудистой системы связана с ВГ. Как было показано в многочисленных исследованиях (in vitro и in vivo), ВГ типа А способны инфицировать клетки эндотелия за счет наличия на их поверхности сиаловых кислот с α-2,3- и α-2,6-гликозидной связью [9]. В свою очередь, инфицирование эндотелиоцитов сопровождается транзиторным или длительным изменением морфологии и/или нарушением функциональной активности данных клеток, что отражают понятия «активация эндотелия» и «дисфункция эндотелия» соответственно. Так, со стороны инфицированных клеток эндотелия наблюдается дисрегуляция экспрессии генов, обеспечивающих регуляцию тонуса кровеносных сосудов, гемостаза и фибринолиза, ангиогенеза [10]. Кроме того, для гриппа (особенно при тяжелом течении) характерно возникновение оксидативного стресса, гипоксии и цитокинемии, что также может служить причиной поражения эндотелия, обуславливая развитие геморрагического синдрома и эндотелиальной дисфункции – типового патологического состояния, характеризующегося стойким нарушением морфологии и функциональной активности эндотелиоцитов [11].
Эндотелиальная дисфункция ассоциирована со снижением экспрессии и/или биодоступности оксида азота (NO), в том числе за счет ингибирования экспрессии гена, кодирующего эндотелиальную синтазу оксида азота (eNOS). Молекула NO, помимо мощного селективного вазодилатирующего эффекта, также обладает антиагрегантным, противовоспалительным, антиатерогенным и микробоцидным действием [12]. В исследованиях было показано, что ВГ A(H1N1)pdm09 вызывает выраженное снижение экспрессии eNOS in vitro, а также опосредует длительное (до 2 мес) снижение данного фактора in vivo [13, 14]. Таким образом, снижение eNOS при гриппе является одним из важных маркеров поражения эндотелия [11].
Таким образом, вовлечение эндотелия кровеносных сосудов является важным аспектом патогенеза гриппа. Более того, нарушения морфофункциональных свойств клеток эндотелия, возникающие при гриппе, могут сохраняться на протяжении 2 мес от начала заболевания, что соответствует эпидемиологическим данным о положительной корреляционной связи между заболеваемостью гриппом и «дополнительной» смертностью от заболеваний сердечно-сосудистой системы на протяжении 2 мес после окончания эпидемии [14–16]. Все это указывает на необходимость учитывать вклад поражения эндотелия в патогенез гриппа, а также создает предпосылки для проведения скрининга препаратов с эндотелиопротективной активностью, способных восстанавливать и поддерживать морфофункциональные свойства клеток сосудистого эндотелия, что, в свою очередь, необходимо для оптимизации схем патогенетической терапии данного заболевания.
Для коррекции дисфункции эндотелия при гриппе был предложен ряд препаратов с предполагаемой эндотелиопротективной активностью: статины, ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы ангиотензиновых рецепторов (БАР), β-блокаторы, вазодилататоры и пр.
Перспективные данные в отношении статинов как препаратов для патогенетического лечения гриппа были получены в начале XXI в. Помимо основного механизма действия, связанного со снижением внутриклеточного содержания холестерина, также выявили ряд плейотропных эффектов. К таким эффектам можно отнести не только противовоспалительное и иммуномодулирующее действие, но и улучшение функции эндотелия, снижение пролиферации гладкомышечных клеток медии сосудов, а также антитромботический эффект [17]. Однако за последние 10–15 лет появляется все больше данных, указывающих на отсутствие эффекта при использовании различных статинов в рамках патогенетической терапии тяжелых форм гриппа [18]. Более того, систематический прием препаратов из данной фармакологической группы до госпитализации может быть ассоциирован с ростом заболеваемости гриппом, особенно среди лиц женского пола и лиц старше 60 лет [19].
В отношении иАПФ и БАР также имеются противоречивые данные. Результаты одного из системных обзоров указывают на значимое снижение развития пневмонии и ассоциированной с ней смертностью от гриппа у пациентов, которым назначали в качестве патогенетической терапии препараты групп иАПФ, но не БАР [20]. Согласно данным другого исследования (метаанализа), при систематическом использовании препаратов этих групп у пациентов на фоне гриппа не наблюдалось статистически значимого снижения развития пневмонии и ассоциированной с ней смертности [21].
В отношении β-блокаторов было показано, что эти препараты не снижают вероятность развития сердечно-сосудистых осложнений на фоне гриппа при их систематическом приеме у пациентов с острым коронарным синдромом [22].
Таким образом, вопрос коррекции дисфункции эндотелия кровеносных сосудов в рамках патогенетической терапии гриппа остается нерешенным.
Исходя из полученных ранее результатов и данных литературы об изменениях морфофункциональных свойств клеток эндотелия при гриппе, включающих нарушение морфологии эндотелия сосудов легких, снижение уровня экспрессии eNOS в эндотелии кровеносных сосудов легких и брыжейки (локальный и системный уровень), а также снижение эндотелий-зависимой вазодилатации и повышение вазоконстрикции на системном уровне, в качестве двух препаратов-кандидатов с потенциальной эндотелиопротективной активностью в настоящем исследовании были использованы дротаверин и сакубитрил-валсартан [6, 14, 23, 24].
Дротаверин является селективным ингибитором фосфодиэстеразы 4-го типа, чей механизм действия связан с повышением концентрации в клетках вторичных мессенджеров – циклического аденозинмонофосфата и циклического гуанозинмонофосфата, что, в свою очередь, повышает активность фосфатазы регуляторной легкой цепи миозина, обуславливая расслабление гладкой мускулатуры. Обладая спазмолитическим и вазодилатирующим эффектом, дротаверин способен нивелировать системную вазоконстрикцию, что снижает выраженность активации и дисфункции клеток эндотелия. Также необходимо отметить, что данный препарат активно изучался в НИИ гриппа и в 2003 г. был предложен в составе комбинированного препарата – дротаверин в сочетании с ремантадином (патент № 2229877), показавшего эндотелиопротективный эффект как в исследованиях in vitro, так и в клинических исследованиях.
В свою очередь, сакубитрил-валсартан, комбинированный препарат нового поколения, относится к ингибиторам неприлизина и рецепторов ангиотензина II. Так, сакубитрил-валсартан применяется при лечении хронической сердечной недостаточности с целью снижения риска сердечно-сосудистой смерти, а также при эссенциальной гипертензии [25]. Данный препарат снижает выраженность оксидативного стресса и активации тромбоцитов (антитромботического действие), понижает концентрацию провоспалительных цитокинов (интерлейкина-6, фактора некроза опухоли-α) в крови, а также способствует снижению жесткости артериальной стенки, обуславливая вазодилатирующий эффект у пациентов с хронической сердечной недостаточностью [26]. Также имеются данные о способности сакубитрил-валсартана обуславливать коррекцию дисфункции эндотелия микроциркуляторного русла на фоне инфекции, вызванной вирусом SARS-CoV-2 [27].
Эндотелиопротективные свойства дротаверина и сакубитрил-валсартана оценивали по их способности влиять на: 1) выраженность гистопатологических изменений со стороны эндотелия кровеносных сосудов легких; 2) уровень экспрессии eNOS в эндотелии кровеносных сосудов брыжейки; 3) вазоконстрикцию и эндотелий-зависимую вазодилатацию кровеносных сосудов брыжейки; 4) инфекционную активность вируса в тканях легких (прямая противовирусная активность).
Цель работы – исследование эндотелиопротективных свойств сакубитрил-валсартана и дротаверина при экспериментальной инфекции, вызванной ВГ A(H1N1)pdm09.
Материалы и методы
Лабораторные животные. В исследовании были использованы 20 крыс-самцов стока Wistar (SPF-статус) массой 337 ± 65 г, полученных из питомника ФГБУ ПЛЖ «НМИЦ им. В.А. Алмазова». Животных содержали в отдельной комнате на базе вивария ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России в стандартных условиях в соответствии с директивой 2010/63EU Европейского парламента и Совета Европейского союза. Животные получали полный пищевой рацион и питьевую воду ad libitum. Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus author guidelines for animal use (IAVES, 23.07.2010). Протокол исследования был одобрен комиссией по биоэтике ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России (протокол № 05 от 27.03.2023).
Дизайн исследования. Животные были случайным образом распределены на 4 группы (по 5 особей в каждой): 1-я группа (контроль) – интактные крысы, получавшие на протяжении 4 сут питьевую воду без добавления препаратов, которым на 4-е сутки интраназально вводили стерильный физиологический раствор в объеме 0,2 мл; 2-я группа (грипп; контроль заражения) – крысы, получавшие на протяжении 4 сут воду без добавления препаратов, которых на 4-е сутки интраназально инфицировали ВГ A(H1N1)pdm09 (инфекционная активность 6,3 lg ЭИД50/мл, объем 0,2 мл); 3-я группа (сакубитрил-валсартан + грипп) – животные, получавшие внутрижелудочно на протяжении 4 сут сакубитрил-валсартан (60 мг/кг/сут), которых на 4-е сутки интраназально инфицировали ВГ A(H1N1)pdm09 (объем 0,2 мл); 4-я группа (дротаверин + грипп) – крысы, получавшие внутрижелудочно на протяжении 4 сут дротаверин (40 мг/кг/сут), с последующим интраназальным заражением (на 4-е сутки) исследуемым ВГ (объем 0,2 мл).
Препараты дротаверин и сакубитрил-валсартан были приобретены в аптечной сети «Неофарм» (г. Санкт-Петербург, Россия).
Интраназальное заражение (или введение физраствора) животных проводили после наркотизации 3% р-ром изофлюрана (Laboratorios Karizoo, Испания). Через 1 сут после введения физраствора или инфицирования крыс повторно наркотизировали, а затем подвергали эвтаназии с последующим выделением тканей легких и брыжейки.
Содержание, заражение и введение препаратов животным проводилось сотрудниками ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России (Марченко В.А. и Жилинской И.Н.) на базе вивария вышеупомянутого НИИ в 2023 г.
Определение инфекционного титра вируса в гомогенатах тканей легких и брыжейки. Из ткани правого легкого, а также брыжейки готовили 10% гомогенаты, добавляя среду DMEM («Биолот», Россия) с помощью лабораторного гомогенизатора SHM2 (Stuart, Великобритания). После центрифугирования (10–15 мин, 1000 × g) из супернатанта готовили серию 10-кратных разведений в фосфатно-солевом буфере (PBS) и вносили в аллантоисную полость развивающихся куриных эмбрионов (РКЭ) по 200 мкл каждого разведения. Так, для гомогенатов легких использовали разведения от 10−1 до 10−8, а для гомогенатов брыжейки – от 10−1 до 10−4. Инкубацию РКЭ проводили при температуре 36 °С в течение 2 суток, после чего из эмбрионов отбирали по 100 мкл аллантоисной жидкости, переносили в иммунологический планшет и добавляли 100 мкл 0,5% суспензии куриных эритроцитов. Реакцию гемагглютинации учитывали после оседания эритроцитов в контроле. Инфекционную активность рассчитывали по методу Рида–Менча [28].
Оценка гистопатологических изменений эндотелия кровеносных сосудов легких крыс. Сразу после некропсии ткани левого легкого животных переносили в 10% формалин и оставляли для фиксации на 24 ч. Гистологическую проводку осуществляли на автоматическом процессоре замкнутого типа Shandon Excelsior ES (Thermo Fisher Scientific, Великобритания). После этого из готовых парафиновых блоков изготавливали срезы легких толщиной 3–5 мкм с последующей депарафинизацией, дегидратацией в спиртах и окрашиванием гематоксилином и эозином.
Гистопатологические изменения со стороны эндотелия легких оценивали по трем параметрам, включая: 1) десквамацию, 2) изменения морфологии эндотелия и 3) дистрофические изменения. Для оценки выраженности данных изменений использовали полуколичественную шкалу от 0 до 3, где 0 – отсутствие изменений, 1 – слабо выраженные изменения, 2 – умеренно выраженные изменения, 3 – выраженные изменения. От каждого животного изучали 3–5 кровеносных сосудов.
Иммуногистохимическое исследование. С целью локализовать нуклеопротеин (NP) ВГ в легких и брыжейке животных срезы с аутопсийным материалом инкубировали с мышиными моноклональными антителами (клон 6D11; получены из лаборатории биотехнологии диагностических препаратов ФГБУ «НИИ гриппа им. А.А. Смородинцева») к соответствующему вирусному антигену (в разведении 1 : 1000). Для изучения уровня экспрессии eNOS в эндотелии кровеносных сосудов брыжейки использовали моноклональные мышиные антитела (Abcam, США, ab76198) в соотношении 1 : 500 к соответствующему белку.
Для детекции вирусного NP и eNOS в материале использовали согласно инструкции систему иммуногистохимической визуализации Envision Flex (Dako, Дания), которая включает вторичные антитела, конъюгированные с пероксидазой хрена, а также DAB-хромоген.
Морфометрическую обработку для определения экспрессии eNOS проводили с использованием программного обеспечения Nis-Elements BR 4.40 (Nikon, Япония) [29]. Для этого определяли отношение суммарной интенсивности сигнала – безразмерной величины, представленной суммой интенсивности всех пикселей изучаемого объекта (в диапазоне регистрации 0–105) к площади заполнения, которое выражалось в условных единицах (у.е.).
Изучение вазомоторной активности кровеносных сосудов брыжейки крыс. Из материала от каждого животного изолировали по три артерии брыжейки (3-го порядка), с последующим их монтированием в камерах проволочного миографа (DMT 620M, Дания).
Для исследования вазомоторной активности микрососудов использовали протокол кумулятивного ответа на вазоконстриктор фенилэфрин (ФЭ) и вазодилататор ацетилхолин (АХ) со ступенчато увеличивающейся концентрацией агонистов (от 10−7 до 10−5 М). Полученные данные регистрировали с помощью программного обеспечения LabChart 8.1.30. В качестве основных показателей оценки вазомоторной активности сосудов использовали: 1) концентрацию, обеспечивающую 50% максимального ответа сосудов на агонист (log ЕС50, М); 2) величину максимального ответа сосудов на агонист (Emax, %). Также определяли площадь под кривой «концентрация–ответ» (AUC).
Статистическую обработку полученных данных проводили с помощью пакета программ GraphPad Prism 8 с использованием метода ANOVA (однофакторного дисперсионного анализа). Нормальность полученных данных проверяли с помощью критерия Шапиро–Уилка. Данные представляли как среднее арифметическое (M), стандартное отклонение (SD) и стандартную ошибку среднего (SE). Статистическую значимость оценивалась с помощью U-критерия Манна–Уитни, критерия Краскела–Уоллиса и критерия Брауна–Форсайта. Различия считали статистически значимыми для значений p < 0,05.
Результаты
Определение инфекционной активности вируса гриппа в гомогенатах тканей легких и брыжейки крыс. Титры ВГ А(H1N1)pdm09 в гомогенатах легких крыс всех групп представлены в табл. 1.
Таблица 1. Титры вируса гриппа А/СПб/48/16 (H1N1)pdm09 в гомогенатах легких и брыжейки крыс (M ± SD)
Table 1. Titers of influenza А/Saint Petersburg/48/16 (H1N1)pdm09 virus in pulmonary and mesenteric homogenates of rats (M ± SD)
Тип гомогената Type of homogenate | Инфекционный титр вируса гриппа через 1 сут после инфицирования (lg ЭИД50/мл) Infectious titer of influenza virus at 1 day post infection (log10 EID50/mL) | |||
1-я группа (контроль) Group 1 (control) (n = 5) | 2-я группа (грипп) Group 2 (IAV) (n = 5) | 3-я группа (сакубитрил-валсартан + грипп) Group 3 (sacubitril/valsartan + IAV) (n = 5) | 4-я группа (дротаверин + грипп) Group 4 (drotaverine + IAV) (n = 5) | |
Легкие Lungs | 0,0 ± 0,0 | 6,27 ± 0,15* | 6,43 ± 0,31* | 6,29 ± 0,1* |
Брыжейка Mesentery | 0,0 ± 0,0 | 0,0 ± 0,0 | 0,0 ± 0,0 | 0,0 ± 0,0 |
Примечание. * – p < 0,05 по сравнению с 1-й группой (контроль), критерий Манна–Уитни (n = 5).
Note. * – p < 0.05 compared with group 1 (control), Mann–Whitney test (n = 5).
Так, в 1-й группе (контроль) инфекционно активный ВГ в легких не обнаруживался, тогда как во 2-й группе (грипп) титр вируса составлял 6,27 ± 0,15 lg ЭИД50/мл, в 3-й группе (дротаверин + грипп) – 6,43 ± 0,31 ЭИД50/мл, а в 4-й группе (сакубитрил-валсартан + грипп) – 6,29 ± 0,1 lg ЭИД50/мл. Титр вируса во 2–4-й группах статистически не отличался. В свою очередь, в гомогенатах брыжейки крыс ВГ не обнаруживался.
Детекция нуклеопротеина вируса гриппа в кровеносных сосудах легких и брыжейки крыс методом иммуногистохимического анализа. Для подтверждения репродукции вируса в тканях и кровеносных сосудах легких и брыжейки крыс проводили детекцию белка NP ВГ (рис. 1).
Рис. 1. Иммуногистохимический анализ экспрессии нуклеопротеина (NP) вируса гриппа А в тканях и кровеносных сосудах легких и брыжейки крыс (ув. 200).
Кровеносный сосуд легких крысы: a – 1-й группы (контроль); б – 2-й группы (грипп); в – 3-й группы (сакубитрил-валсартан + грипп); г – 4-й группы (дротаверин + грипп); кровеносный сосуд брыжейки крысы: д – 1-й группы (контроль); е – 2-й группы (грипп); ж – 3-й группы (сакубитрил-валсартан + грипп); з – 4-й группы (дротаверин + грипп). Черными стрелками обозначены NP-позитивные клетки эндотелия; белыми стрелками – NP-позитивные тучные клетки.
Fig. 1. Immunohistochemical assay of IAV NP expression in tissue and blood vessels of rat lungs and mesentery (magnification 200×).
Pulmonary blood vessel of rat: a – group 1 (control); b – group 2 (IAV); c – group 3 (sacubitril/valsartan + IAV); d – group 4 (drotaverine + IAV); mesenteric blood vessel of rat: e – group 1 (control); f – group 2 (IAV); g – group 3 (sacubitril/valsartan + IAV); h – group 4 (drotaverine + IAV). Black arrows indicate NP-positive endothelial cells; white arrows denote NP-positive mast cells.
Как видно из рис. 1, NP ВГ обнаруживался в кровеносных сосудах легких крыс 2–4-й групп. В свою очередь, иммуногистохимическое исследование не выявило присутствие NP-антигена в тканях и сосудах легких животных 1-й группы (контроль), а также в кровеносных сосудах и тканях брыжейки крыс всех групп.
Оценка гистопатологических изменений эндотелия кровеносных сосудов легких крыс. Наиболее выраженные изменения со стороны эндотелия легких регистрировали во 2-й группе (рис. 2 б).
Рис. 2. Гистологическое исследование кровеносных сосудов легких крыс и брыжейки (ув. 200 для а–г, ув. 400 для д–з, окрашивание гематоксилином и эозином).
Кровеносный сосуд легких крысы: a – 1-й группы (контроль); б – 2-й группы (грипп); в – 3-й группы (сакубитрил-валсартан + грипп); г – 4-й группы (дротаверин + грипп); кровеносный сосуд брыжейки крысы: д – 1-й группы (контроль); е – 2-й группы (грипп); ж – 3-й группы (сакубитрил-валсартан + грипп); з – 4-й группы (дротаверин + грипп).
Fig. 2. Histological examination of pulmonary and mesenteric blood vessels (magnification 200 × for a–d, magnification 400 × for e–h, hematoxylin & eosin staining).
Pulmonary blood vessel of rat: a – group 1 (control); b – group 2 (IAV); c – group 3 (sacubitril/valsartan + IAV); d – group 4 (drotaverine + IAV); mesenteric blood vessel of rat: e – group 1 (control); f – group 2 (IAV); g – group 3 (sacubitril/valsartan + IAV); h – group 4 (drotaverine + IAV).
На рис. 3 представлены результаты полуколичественной оценки гистопатологических изменений эндотелия кровеносных сосудов легких крыс. Так, наиболее выраженные изменения регистрировали во 2-й группе (грипп). В частности, выраженность гистопатологических изменений со стороны эндотелия легких в этой группе варьировала от слабой до умеренной и составляла для десквамации 1,5 ± 0,11 балла, для дистрофических изменений – 1,45 ± 0,11 балла, и для изменения морфологии эндотелия – 1,35 ± 0,13 балла. Кроме того, также выявили слабую или умеренную степень разволокнения адвентиции и медии кровеносных сосудов.
Рис. 3. Полуколичественная оценка поражения эндотелия кровеносных сосудов легких крыс (M ± SE, баллы).
* – p < 0,05 по сравнению с 1-й группой (контроль); # – p < 0,05 по сравнению со 2-й группой (грипп); & – p < 0,05 по сравнению с 3-й группой (сакубитрил-валсартан + грипп), критерий Краскела–Уоллиса, 4–5 сосудов от каждого животного (n = 5).
Fig. 3. Histological alteration semi-quantitative score for pulmonary vascular endothelium in rats (M ± SE, score).
* – p < 0.05 compared with group 1 (control); # – p < 0.05 compared with group 2 (IAV); & – p < 0.05 compared with group 3 (sacubitril/valsartan + IAV), Kruskal–Wallis test, 4–5 blood vessels from each animal (n = 5).
В 3-й группе (сакубитрил-валсартан + грипп) наблюдали статистически значимое снижение выраженности степени десквамации по сравнению со 2-й группой (грипп) – 0,86 ± 0,35 балла (p<0,05), тогда как для двух других параметров (дистрофические изменения и изменения морфологии) наблюдали лишь тенденцию к снижению (в сравнении со 2-й группой).
В 4-й группе (дротаверин + грипп) регистрировали минимальные гистопатологические изменения среди экспериментальных групп (2–4-я). Так, степень выраженности всех трех параметров: десквамации (0,62 ± 0,15 балла), изменений морфологии эндотелия (0,6 ± 0,11 балла) и дистрофических изменений (0,71 ± 0,12 балла) была значимо ниже, чем во 2-й группе (грипп) (p<0,05).
В 1-й группе (контроль) гистопатологических изменений со стороны эндотелия кровеносных сосудов легких не было обнаружено (0,05 ± 0,05 балла для всех трех параметров), так же как и со стороны эндотелия кровеносных сосудов брыжейки.
Определение уровня экспрессии eNOS в эндотелии кровеносных сосудов брыжейки крыс. На рис. 4 представлены результаты определения уровня eNOS в эндотелии кровеносных сосудов брыжейки крыс.
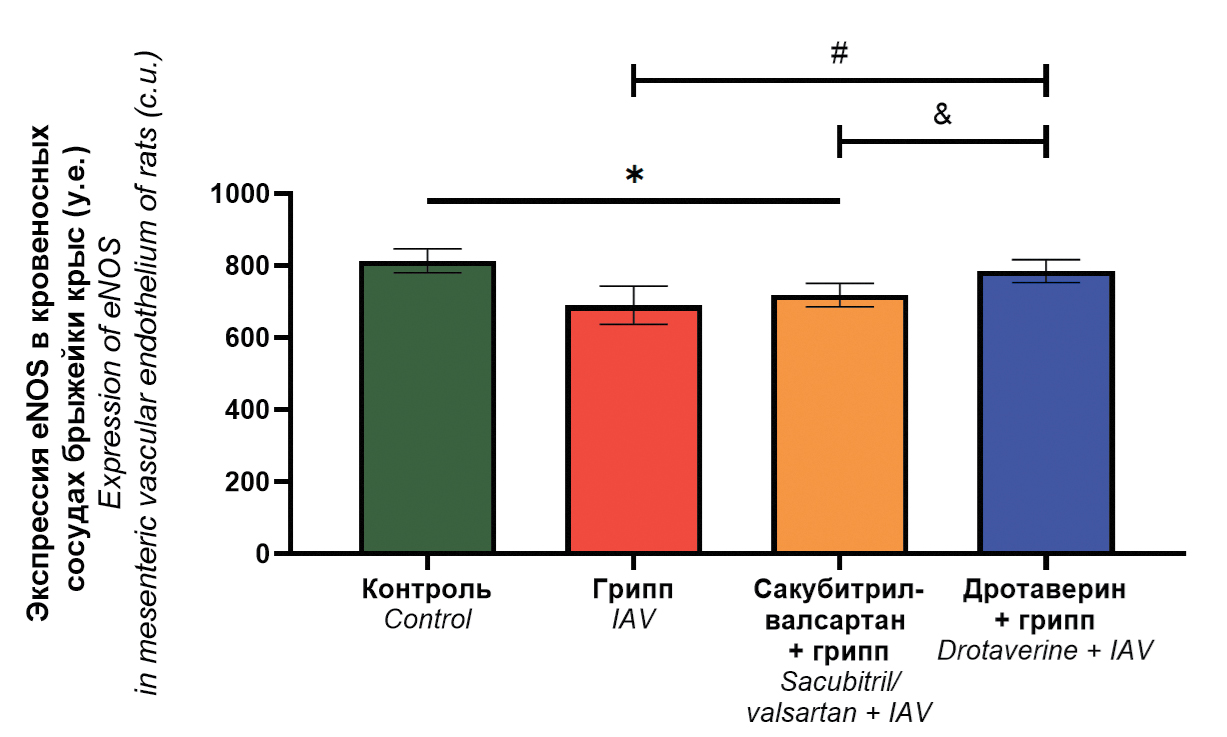
Рис. 4. Уровень экспрессия eNOS в эндотелии кровеносных сосудов брыжейки крыс, 3–4 сосуда от каждого животного (n = 5).
Кровеносный сосуд брыжейки крысы: a – 2-й группы (контроль); б – 2-й группы (грипп); в – 3-й группы (сакубитрил-валсартан + грипп); г – 4-й группы (дротаверин + грипп) (ув. 400).
Fig. 4. eNOS expression level in mesenteric endothelium of rats, 3–5 blood vessels from each animal (n = 5).
Mesenteric blood vessel of rat: a – group 1 (control); b – group 2 (IAV); c – group 3 (sacubitril/valsartan + IAV,); d – group 4 (drotaverine + IAV) (magnification 400×).
Проведенный морфометрический анализ уровня экспрессии eNOS в эндотелии кровеносных сосудов брыжейки у крыс из разных групп позволил выявить следующее (рис. 5): уровень экспрессии eNOS в эндотелии кровеносных сосудов брыжейки крыс через 1 сут после инфицирования во 2-й группе (грипп) и 3-й группе (сакубитрил-валсартан + грипп) составлял 690,8 и 718,6 у.е. соответственно и был значимо ниже – на 11,02% (p < 0,05) и 11,46% (p < 0,05) по сравнению с 1-й группой (контроль), где этот показатель составил 813,9 у.е. Экспрессия eNOS в эндотелии кровеносных сосудов брыжейки крыс в 4-й группе (дротаверин + грипп) составляла 785,5 у.е. и оставалась на уровне контрольных значений 1-й группы (p > 0,05), а также была статистически значимо выше – на 8,52% (p < 0,05) и 12,06% (p < 0,05) по сравнению с 3-й группой (сакубитрил-валсартан + грипп) и 2-й группой (грипп) соответственно.
Рис. 5. Уровень экспрессии eNOS в эндотелии кровеносных сосудов брыжейки крыс (M ± SD, у.е.).
* – p < 0,05 по сравнению с 1-й группой (контроль); # – p < 0,05 по сравнению со 2-й группой (грипп), & – p < 0,05 по сравнению с 3-й группой (сакубитрил-валсартан + грипп), критерий Краскела–Уоллиса, 3–4 сосуда от каждого животного (n = 5).
Fig. 5. eNOS expression level in mesenteric endothelium of rats (M ± SD, c.u.).
* – p < 0.05 compared with group 1 (control), # – p < 0.05 compared with group 2 (IAV), & – p < 0.05 compared with group 3 (sacubitril/valsartan + IAV), Kruskal–Wallis test, 3–4 blood vessels from each animal (n = 5).
Изучение вазомоторной активности кровеносных сосудов крыс. Показатели вазомоторной активности артерий брыжейки крыс представлены в табл. 2.
Таблица 2. Показатели вазомоторной активности артерий брыжейки крыс (M ± SE)
Table 2. Vasomotor activity of mesenteric arteries of rats (M ± SE)
Группа Group | Вазоконстриктор фенилэфрин (ФЭ) Vasoconstrictor phenylephrine (PE) | Вазодилататор ацетилхолин (АХ) Vasodilator acetylcholine (ACh) | ||
Log EC50, M | Emax, % | Log EC50, M | Emax, % | |
1-я группа (контроль) Group 1 (control) | −5,54 ± 0,03 | 134,66 ± 8,11 | −6,35 ± 0,16 | 47,62 ± 5,36 |
2-я группа (грипп) Group 2 (IAV) | −5,72 ± 0,04** | 119,70 ± 4,91 | −6,43 ± 0,17 | 26,81 ± 9,18 |
3-я группа (сакубитрил-валсартан + грипп) Group 3 (sacubitril/valsartan + IAV) | −5,71 ± 0,04** | 117,54 ± 6,26 | −6,07 ± 0,18 | 43,05 ± 7,29 |
4-я группа (дротаверин + грипп) Group 4 (drotaverine + IAV) | −5,10 ± 0,68 | 125,92 ± 6,29 | −5,34 ± 0,37# | 66,36 ± 12,24# |
Примечание. ** – p < 0,01 по сравнению с 1-й группой (контроль); # – p < 0,05 по сравнению со 2-й группой (грипп), критерий Брауна–Форсайта, 3 сосуда от каждого животного (n = 5).
Note. ** – p < 0.01 compared with group 1 (control); # – p < 0.05 compared with group 2 (IAV), Brown–Forsythe test, 3 blood vessels from each animal (n = 5).
Как видно из табл. 2, чувствительность артерий брыжейки (определяли по показателю log EC50, M) к вазоконстриктору ФЭ во 2-й группе (грипп) была выше на 0,18 М (p < 0,05) по сравнению с 1-й группой (контроль); чувствительность артерий брыжейки к вазоконстриктору в 3-й группе (сакубитрил-валсартан + грипп) была выше на 0,17 М (p < 0,05) по сравнению с 1-й группой (контроль) и на уровне 2-й группы (грипп). В 4-й группе (дротаверин + грипп) чувствительность артерий к вазоконстриктору статистически не отличалась от значений 1-й группы (контроль), но была отмечена тенденция к снижению данного параметра по сравнению с другими группами.
В свою очередь, максимальный ответ артерий брыжейки (определяли по показателю Emax, %) на вазоконстриктор во всех группах статистически не отличался.
Чувствительность артерий к вазодилататору АХ (log EC50, M) во 2-й группе (грипп) была на уровне отрицательного контроля. В 3-й группе (сакубитрил-валсартан + грипп) отмечали тенденцию к снижению чувствительности артерий к вазодилататору, тогда как в 4-й группе (дротаверин + грипп) этот показатель был статистически значимо ниже – на 1,01 lg М (p<0,05) по сравнению с 1-й группой (контроль).
Наиболее низкие значения максимального ответа сосудов (Emax) на вазодилататор регистрировали во 2-й группе (грипп). В 3-й группе (сакубитрил-валсартан + грипп) максимальный ответ артерий на АХ находился на уровне контрольных значений 1-й группы. У животных в 4-й группе (дротаверин + грипп) выявляли тенденцию к повышению максимального ответа сосудов на вазодилататор по сравнению с 1-й группой (контроль), а также регистрировали статистически значимое повышение ответа – на 59,6% (p < 0,05) по сравнению со 2-й группой (грипп).
Результаты кумулятивного дозозависимого ответа артерий брыжейки крыс при введении сакубитрил-валсартана и дротаверина на фоне инфицирования ВГ А(H1N1)pdm09 представлены на рис. 6.
Рис. 6. Дозозависимые кривые «концентрация-ответ» артерий брыжейки крыс (M ± SE).
a – фенилэфрин-зависимое сокращение кровеносных сосудов; б – ацетилхолин-зависимое расслабление кровеносных сосудов. * – p < 0,05 по сравнению с 1-й группой (контроль); # – p < 0,05 по сравнению со 2-й группой (грипп), критерий Брауна–Форсайта, 3 сосуда от каждого животного (n = 5).
Fig. 6. Dose-dependent response curves of mesenteric arteries of rats (M ± SE).
a – dose-dependent response to phenylephrine; b – dose-dependent response to acetylcholine. * – p < 0.05 compared with group 1 (control); # – p < 0.05 compared with group 2 (IAV), Brown-Forsythe test, 3 blood vessels from each animal (n = 5).
Дозозависимые кривые ответа артерий брыжейки крыс на вазоконстриктор ФЭ во всех группах статистически не различались. Однако следует отметить, что на средние концентрации ФЭ (−6 lg M) регистрировали тенденцию к увеличению ответа артерий брыжейки во всех экспериментальных группах по сравнению с 1-й группой (контроль) (рис. 6 а).
В свою очередь, со стороны артерий брыжейки крыс 2-й группы (грипп) на вазодилататор АХ регистрировали статистически значимое снижение ответа на предмаксимальную концентрацию вазодилататора (−5,3 lg М) по сравнению с 1-й группой (контроль) (рис. 6 б).
Таким образом, на основании данных из табл. 2 и рис. 6, можно сделать вывод о том, что дротаверин, но не сакубитрил-валсартан способен восстанавливать чувствительность артерий брыжейки к вазоконстриктору ФЭ и снижать чувствительность к вазодилататору АХ на фоне повышения эндотелий-зависимого максимального ответа кровеносных сосудов брыжейки на АХ.
Результаты изучения интегрального ответа артерий брыжейки крыс представлены на рис. 7.
Рис. 7. Интегральный ответ артерий брыжейки крыс (M ± SE).
p > 0,05 по сравнению с 1-й группой (контроль), критерий Брауна–Форсайта, 3 сосуда от каждого животного (n = 5).
Fig. 7. Integral response of mesenteric arteries of rats (M ± SE).
p > 0.05 compared with group 1 (control), Brown–Forsythe test, 3 blood vessels from each animal (n = 5).
Как видно из рис. 7, была выявлена тенденция к снижению интегрального ответа во 2-й группе (грипп) на вазодилататор, тогда как статистически значимых отличий в отношении сосудов брыжейки на вазоконстриктор не регистрировали.
Обсуждение
В качестве экспериментальной модели гриппозной инфекции использовали крыс стока Wistar. Эти животные являются чувствительными по отношению к ВГ A(H1N1)pdm09 после их предварительной адаптации [30]. Помимо этого, у крыс этого стока после инфицирования ВГ регистрируются выраженные морфофункциональные изменения со стороны эндотелия кровеносных сосудов легких и брыжейки на ранних сроках инфекции [23, 24].
В настоящем исследовании изучали эндотелиопротективную активность сакубитрил-валсартана и дротаверина через 24 ч после инфицирования крыс ВГ A(H1N1)pdm09, так как именно на этом временно́м интервале наблюдается наиболее выраженное поражение эндотелия кровеносных сосудов [23, 24]. В эксперименте изучали влияние в лечебно-профилактической схеме сакубитрил-валсартана и дротаверина на: 1) инфекционную активность вируса в гомогенатах легких и брыжейки крыс, 2) выраженность гистопатологических изменений эндотелия кровеносных сосудов легких, 3) уровень экспрессии eNOS в эндотелии кровеносных сосудов брыжейки, 4) вазомоторную активность кровеносных сосудов брыжейки при инфицировании ВГ A(H1N1)pdm09.
Необходимо отметить, что гистологические исследования проводили в кровеносных сосудах легких, а вазомоторную активность и уровень экспрессии eNOS изучали в эндотелии кровеносных сосудов брыжейки. Известно, что ВГ A(H1N1)pdm09 инфицирует эндотелий кровеносных сосудов легких крыс, что опосредует прямое цитопатическое действие и вызывает изменение морфологических и функциональных свойств данных клеток. Однако на фоне гриппозной инфекции у животных репродукция вируса в клетках эндотелия кровеносных сосудов брыжейки не происходит, что выражается в отсутствии каких-либо гистопатологических изменений [14]. Вместе с тем поражение ВГ эндотелиоцитов сосудов легких крыс вызывает системное поражение кровеносных сосудов, вероятно, за счет оксидативного стресса, гипоксии и/или цитокинемии [11, 31–33]. Кроме того, сосуды брыжейки являются общепризнанной моделью изучения функциональной активности кровеносных сосудов на системном уровне.
Так, титр исследуемого ВГ в гомогенатах легких крыс 3-й групп (сакубитрил-валсартан + грипп) и 4-й группы (дротаверин + грипп) статистически не отличался от 2-й группы (грипп), что указывает на отсутствие у препаратов противовирусной активности. Репродукция ВГ была подтверждена с помощью детекции NP ВГ в тканях и кровеносных сосудах легких. Необходимо отметить, что вирус не обнаруживался в тканях брыжейки, что подтверждается данными предыдущих исследований [14].
При изучении гистопатологических изменений со стороны кровеносных сосудов легких животных было установлено, что дротаверин значимо снижает степень выраженности десквамации, дистрофических изменений и изменений морфологии эндотелия по сравнению со 2-й группой (грипп). В свою очередь, применение сакубитрил-валсартана статистически значимо снижало степень выраженности десквамации эндотелия, но не дистрофических изменений и изменений морфологии эндотелия. Можно предположить, что изменения морфологии и дистрофические изменения эндотелия являются следствием миграции клеток иммунной системы в очаг воспаления, тогда как десквамация возникает в результате гибели эндотелиоцитов и отражает, как правило, крайнюю степень поражения эндотелия. Стоит отметить, что выраженность отека легочной ткани (отношение массы легких к массе тела) во всех группах статистически не различалась (данные не представлены).
При изучении уровня экспрессии eNOS в эндотелии кровеносных сосудов брыжейки было установлено, что дротаверин восстанавливает экспрессию этого эндотелиального фактора до значений 1-й группы (контроль). В свою очередь, экспрессия eNOS на фоне применения сакубитрил-валсартана остается на уровне значений 2-й группы (грипп).
Кроме того, полученные данные указывают на увеличение максимального ответа и снижение чувствительности кровеносных сосудов брыжейки на вазодилататор АХ, а также восстановления чувствительности к вазоконстриктору ФЭ на фоне применения дротаверина. В свою очередь, сакубитрил-валсартан восстанавливает максимальный ответ артерий брыжейки на вазодилататор и не влияет на чувствительность кровеносных сосудов брыжейки к нему, тогда как чувствительность к вазоконстриктору значимо выше контрольных значений. Необходимо отметить, что уровень экспрессии eNOS в эндотелии кровеносных сосудов брыжейки в целом соотносится с максимальным ответом кровеносных сосудов брыжейки на вазодилататор АХ.
Исходя из полученных результатов, можно сделать вывод о том, что дротаверин обладает более выраженными эндотелиопротективными свойствами по сравнению с сакубитрил-валсартаном. Это можно объяснить тем, что дротаверин в большей степени снижает выраженность гистопатологических изменений сосудистого эндотелия легких. Так, выраженное поражение клеток эндотелия кровеносных сосудов легких (локальный уровень), возникающее на фоне прямого цитопатического действия ВГ, опосредует активацию эндотелиоцитов, которые становятся основными продуцентами провоспалительных цитокинов (фактор некроза опухоли-α, интерлейкин-1β и интерлейкин-6), а также хемокинов (CXCL10, RANTES) [11]. В свою очередь, высокие концентрации провоспалительных цитокинов, циркулирующих в крови, обуславливают активацию клеток сосудистого эндотелия кровеносных сосудов на системном уровне (включая сосуды брыжейки).
Заключение
Дротаверин и сакубитрил-валсартан обладают эндотелиопротективными свойствами при их применении в лечебно-профилактической схеме у крыс при экспериментальной инфекции, вызванной ВГ A(H1N1)pdm09. При этом дротаверин обладает более выраженной эндотелиопротективной активностью, чем сакубитрил-валсартан, обуславливая: 1) снижение выраженности поражения эндотелия кровеносных сосудов легких, 2) повышение максимального ответа со стороны кровеносных сосудов брыжейки на АХ, 3) нормализацию экспрессии eNOS в эндотелии кровеносных сосудов брыжейки. Оба препарата не обладают противовирусной активностью in vivo.
Таким образом, эндотелиопротективный эффект дротаверина и сакубитрил-валсартана связан с их системным вазодилатирующим и гипотензивным действием.
Полученные данные могут лечь в основу дальнейших доклинических исследований по изучению эндотелиопротективных свойств данных препаратов в терапевтической схеме, а также последующих клинических исследований с целью оптимизации патогенетической терапии гриппа.
Настоящее исследование является продолжением работ по изучению дисфункции эндотелия кровеносных сосудов, индуцированной вирусом гриппа A(H1N1)pdm09, начатых в 2020 г. группой ученых ФГБУ «НИИ гриппа им. А.А. Смородинцева» Минздрава России.
About the authors
Vladimir A. Marchenko
North-Western State Medical University Named after I.I. Mechnikov
Author for correspondence.
Email: vmarcenco@mail.ru
ORCID iD: 0000-0001-6870-3157
Ph. D. in medicine, Associate Professor of Medical Microbiology Department
Russian Federation, 191015, St. PetersburgIrina A. Zelinskaya
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: irina.selinskaja@gmail.com
ORCID iD: 0000-0002-1971-3444
Researcher of Laboratory of Bioprosthetics and Cardiac Protection, Institute of Experimental Medicine
Russian Federation, 197341, St. PetersburgDarya V. Mukhametdinova
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: mukh.dv@yandex.ru
ORCID iD: 0000-0002-7109-1187
Research Assistant of Experimental Pathomorphology Group, Institute of Experimental Medicine
Russian Federation, 197341, St. PetersburgYana G. Toropova
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: yana.toropova@mail.ru
ORCID iD: 0000-0003-1629-7868
Sc. D., Head of Laboratory of Bioprosthetics and Cardiac Protection, Institute of Experimental Medicine
Russian Federation, 197341, St. PetersburgMichael M. Galagudza
V.A. Almazov National Medical Research Centre, Russian Ministry of Health
Email: galagoudza@mail.ru
ORCID iD: 0000-0001-5129-9944
MD, Sc. D., Professor and Corresponding member of the Russian Academy of Sciences, Director of the Institute of Experimental Medicine
Russian Federation, 197341, St. PetersburgIrina N. Zhilinskaya
North-Western State Medical University Named after I.I. Mechnikov
Email: s_zhilinskaya@mail.ru
ORCID iD: 0000-0002-0084-1323
Sc. D., Professor of Medical Microbiology Department
Russian Federation, 191015, St. PetersburgReferences
- WHO. Global Influenza Strategy 2019–2030; 2019. Available at: https://apo.org.au/node/224416
- Tenforde M.W., Noah K.P., O’Halloran A.C., Kirley P.D., Hoover C., Alden N.B., et al. Timing of influenza antiviral therapy and risk of death in adults hospitalized with influenza-associated pneumonia, influenza hospitalization surveillance network (FluSurv-NET), 2012–2019. Clin. Infect. Dis. 2025; 80(2): 461–8. https://doi.org/10.1093/cid/ciae427
- Lampejo T. Influenza and antiviral resistance: an overview. Eur. J. Clin. Microbiol. Infect. Dis. 2020; 39(7): 1201–8. doi: 10.1007/s10096-020-03840-9
- Fage C., Loison S., Zwygart A.C., Poli R., Rosset S., Medaglia C., et al. Influenza A(H1N1)pdm09 virus resistance to baloxavir, oseltamivir and sialic acid mimetics in single and dual therapies: Insights from human airway epithelia and murine models. Antiviral. Res. 2025; 239: 106174. https://doi.org/10.1016/j.antiviral.2025.106174
- Barber H. A case of influenzal myocarditis. Clin J. 1947; 76(5): 181–3.
- Skaarup K.G., Modin D., Nielsen L., Jensen J.U.S., Biering-Sørensen T. Influenza and cardiovascular disease pathophysiology: strings attached. Eur. Heart J. Suppl. 2023; 25(Suppl. A): A5–11. https://doi.org/10.1093/eurheartjsupp/suac117
- Jeyanathan T., Overgaard C., McGeer A. Cardiac complications of influenza infection in 3 adults. CMAJ. 2013; 185(7): 581–4. https://doi.org/10.1503/cmaj.110807
- Goldsteyn E.M. Influenza-associated mortality for circulatory and respiratory causes during the 2013-2014 through the 2018-2019 influenza seasons in Russia. Mezhdunarodnyi zhurnal prikladnykh i fundamental’nykh issledovanii. 2019; (12): 9–16. https://doi.org/10.17513/mjpfi.12945 https://elibrary.ru/dhthqt (in Russian)
- Cioffi D.L., Pandey S., Alvarez D.F., Cioffi E.A. Terminal sialic acids are an important determinant of pulmonary endothelial barrier integrity. Am. J. Physiol. Lung. Cell Mol. Physiol. 2012; 302(10): L1067–77. https://doi.org/10.1152/ajplung.00190.2011
- Vlasov T.D., Petrischev N.N., Lazovskaya O.A. Endothelial dysfunction. Do we understand this term properly? Vestnik anesteziologii i reanimatologii. 2020; 17(2): 76–84. https://doi.org/10.21292/2078-5658-2020-17-2-76-84 https://elibrary.ru/eqepoi (in Russian)
- Marchenko V.A., Zhilinskaya I.N. Endothelial activation and dysfunction caused by influenza A virus (Alphainfluenzavirus influenzae). Voprosy virusologii. 2024; 69(6): 465–78. https://doi.org/10.36233/0507-4088-264 https://elibrary.ru/zujoza (in Russian)
- Loscalzo J., Welch G. Nitric oxide and its role in the cardiovascular system. Prog. Cardiovasc. Dis. 1995; 38(2): 87–104. https://doi.org/10.1016/s0033-0620(05)80001-5
- Marchenko V.A., Barashkova S.V., Zelinskaya I.A., Toropova Ya.G., Ramsay E.S., Zhilinskaya I.N. Modulation of endothelial factors activity in human endothelial cells in influenza A(H1N1)pdm09 virus infection. Voprosy virusologii. 2021; 66(3): 198–210. https://doi.org/10.36233/0507-4088-48 https://elibrary.ru/wsxlvb (in Russian)
- Marchenko V.A., Zelinskaya I.A., Toropova Ya.G., Mukhametdinova D.V., Galagudza M.M., Lioznov D.A., et al. Duration of systemic alteration in vasomotor function of microvascular endothelium caused by the influenza A(H1N1)pdm09 virus. Regionarnoe krovoobrashchenie i mikrotsirkulyatsiya. 2023; 22(4): 74–86. https://doi.org/10.24884/1682-6655-2023-22-4-74-86 https://elibrary.ru/mmwnsf (in Russian)
- Roganova I.V. Comparative characteristics of cerebral circulation dysfunction in different age groups of patients with influenza virus infection. Izvestiya vysshikh uchebnykh zavedenii. Povolzhskii region. Meditsinskie nauki. 2011; (1): 108–15. https://elibrary.ru/oetuod (in Russian)
- Boytsov S.A. Influenza, novel Coronavirus infection and cardiovascular diseases. Kardiologicheskii vestnik. 2021; 16(1): 5–9. https://doi.org/10.17116/Cardiobulletin2021160115 https://elibrary.ru/zgvxkg (in Russian)
- Choudhary A., Rawat U., Kumar P., Mittal P. Pleotropic effects of statins: the dilemma of wider utilization of statin. Egypt. Heart J. 2023; 75(1): 1. https://doi.org/10.1186/s43044-023-00327-8
- Radigan K.A., Urich D., Misharin A.V., Chiarella S.E., Soberanes S., Gonzalez A., et al. The effect of rosuvastatin in a murine model of influenza A infection. PLoS One. 2012; 7(4): e35788. https://doi.org/10.1371/journal.pone.0035788
- Wu F., Wang C., Li S., Ye Y., Cui M., Liu Y., et al. Association between statins administration and influenza susceptibility: a systematic review and meta-analysis of longitudinal studies. Viruses. 2024; 16(2): 278. https://doi.org/10.3390/v16020278
- Caldeira D., Alarcão J., Vaz-Carneiro A., Costa J. Risk of pneumonia associated with use of angiotensin converting enzyme inhibitors and angiotensin receptor blockers: systematic review and meta-analysis. BMJ. 2012; 345: e4260. https://doi.org/10.1136/bmj.e4260
- Henry C., Zaizafoun M., Stock E., Ghamande S., Arroliga A.C., White H.D. Impact of angiotensin-converting enzyme inhibitors and statins on viral pneumonia. Proc. (Bayl. Univ. Med. Cent.). 2018; 31(4): 419–23. https://doi.org/10.1080/08998280.2018.1499293
- Sribhutorn A., Phrommintikul A., Wongcharoen W., Chaikledkaew U., Eakanunkul S., Sukonthasarn A. The modification effect of influenza vaccine on prognostic indicators for cardiovascular events after acute coronary syndrome: observations from an influenza vaccination trial. Cardiol. Res. Pract. 2016; 2016: 4097471. https://doi.org/10.1155/2016/4097471
- Marchenko V., Zelinskaya I., Toropova Y., Shmakova T., Podyacheva E., Lioznov D., et al. Influenza A virus causes histopathological changes and impairment in functional activity of blood vessels in different vascular beds. Viruses. 2022; 14(2): 396. https://doi.org/10.3390/v14020396
- Marchenko V., Mukhametdinova D., Amosova I., Lioznov D., Zhilinskaya I. Influenza A(H1N1)pdm09 virus alters expression of endothelial factors in pulmonary vascular endothelium in rats. Viruses. 2022; 14(11): 2518. https://doi.org/10.3390/v14112518
- Mazza A., Townsend D.M., Torin G., Schiavon L., Camerotto A., Rigatelli G., et al. The role of sacubitril/valsartan in the treatment of chronic heart failure with reduced ejection fraction in hypertensive patients with comorbidities: From clinical trials to real-world settings. Biomed. Pharmacother. 2020; 130: 110596. https://doi.org/10.1016/j.biopha.2020.110596
- Cassano V., Armentaro G., Magurno M., Aiello V., Borrello F., Miceli S., et al. Short-term effect of sacubitril/valsartan on endothelial dysfunction and arterial stiffness in patients with chronic heart failure. Front. Pharmacol. 2022; 13: 1069828. https://doi.org/10.3389/fphar.2022.1069828
- Hellmann M., Dąbrowska E., Żarczyńska-Buchowiecka M., Romanowska-Kocejko M., Narkiewicz K., Gruchała M., et al. Sacubitril/valsartan improved microvascular endothelial function in a young patient with COVID-19-related mild left ventricular dysfunction. Kardiol. Pol. 2022; 80(5): 614–5. https://doi.org/10.33963/kp.a2022.0063
- Ramakrishnan M.A. Determination of 50 % endpoint titer using a simple formula. World J. Virol. 2016; 5(2): 85–6. https://doi.org/10.5501/wjv.v5.i2.85
- Taylor C.R., Levenson R.M. Quantification of immunohistochemistry-issues concerning methods, utility and semiquantitative assessment II. Histopathology. 2006; 49(4): 411–24. https://doi.org/10.1111/j.1365-2559.2006.02513.x
- Marchenko V.A., Barashkova S.V., Zelinskaya I.A., Toropova Y.G., Sorokin E.V., Zhilinskaya I.N. Modeling influenza virus infection in mature Wistar rats. Voprosy virusologii. 2020; 65(3): 159–66. https://doi.org/10.36233/0507-4088-2020-65-3-159-166 https://elibrary.ru/ufdacp (in Russian)
- Janaszak-Jasiecka A., Siekierzycka A., Płoska A., Dobrucki I.T., Kalinowski L. Endothelial dysfunction driven by hypoxia – the influence of oxygen deficiency on no bioavailability. Biomolecules. 2021; 11(7): 982. https://doi.org/10.3390/biom11070982
- Zhang C. The role of inflammatory cytokines in endothelial dysfunction. Basic Res. Cardiol. 2008; 103(5): 398–406. https://doi.org/10.1007/s00395-008-0733-0
- Shaito A., Aramouni K., Assaf R., Parenti A., Orekhov A., Yazbi A.E., et al. Oxidative stress-induced endothelial dysfunction in cardiovascular diseases. Front. Biosci. (Landmark Ed). 2022; 27(3): 105. https://doi.org/10.31083/j.fbl2703105
Supplementary files