Evaluation of the effectiveness of chemical inactivation and immunogenicity of the Omicron variant of the SARS-CoV-2 virus
- Authors: Zhapparova G.A.1, Myrzakhmetova B.S.1, Tlenchiyeva T.M.1, Tussipova A.A.1, Bissenbayeva K.B.1, Toytanova A.S.1, Kutumbetov L.B.1
-
Affiliations:
- Research Institute for Biological Safety Problems
- Issue: Vol 69, No 5 (2024)
- Pages: 459-469
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/16662
- DOI: https://doi.org/10.36233/0507-4088-253
- EDN: https://elibrary.ru/vpecfj
- ID: 16662
Cite item
Full Text
Abstract
Introduction. The rapid spread of coronavirus infection COVID-19 among the population of many countries around the world has contributed to the emergence of many genetic variants of SARS-CoV-2. Compared to previous coronavirus variants, the new Omicron variants have shown a noticeable degree of mutation. Virus inactivation is one of the most important steps in the development of inactivated vaccines. The chemical inactivation agents currently used are β-propiolactone and formaldehyde, but there is no uniform standard for designing and specifying the inactivation process.
Objective. Evaluation and comparison of the effectiveness of chemical inactivation of two agents, formaldehyde and β-propiolactone against immunogenicity of the Omicron variant of the SARS-CoV-2 virus.
Materials and methods. Nasopharyngeal swabs were used to obtain the SARS-CoV-2 Omicron variant virus. Vero cell culture was used to isolate, reproduce, titrate the virus, and perform a neutralization reaction. The kinetics of studying the inactivation of the virus by chemical agents such as formaldehyde and β-propiolactone was carried out.
Results. Studies have been conducted to comparatively evaluate the effectiveness of chemical agents used to inactivate the SARS-CoV-2 virus of the Omicron variant, planned for use in the production of an inactivated whole-virion vaccine. Formaldehyde and β-propiolactone were used as inactivation agents in concentrations of 0.05, 0.1, 0.5% of the total volume of the virus suspension. It has been established that complete inactivation of the virus by formaldehyde in the concentrations used at a temperature of 37 °C occurs within up to 2 hours, and when using beta-propiolactone, within up to 12 hours.
Conclusion. Inactivated virus samples have different antigenic activity depending on the concentration of the inactivation agents used. The most pronounced antigenic activity is manifested in samples of the pathogen that were treated with an inactivation agent at a mild concentration of 0.05%. Increasing the concentration of inactivation agent by 5 or more times leads to a significant decrease in the antigenicity of the SARS-CoV-2 virus. With the inactivation modes used, the loss of biological activity of the virus occurs faster and antigenicity is retained largely when treated with formaldehyde.
Full Text
Введение
Новая коронавирусная инфекция (COVID-19) является третьим коронавирусным заболеванием человека на сегодняшний день. COVID-19 значительно превзошел SARS и MERS как по количеству инфицированных людей, так и по пространственному диапазону эпидемических зон. Быстрое распространение этого высококонтагиозного заболевания представляет собой самую серьезную угрозу для глобального общественного здравоохранения в этом столетии [1].
По состоянию на 13 апреля 2024 г. вспышки COVID-19 унесли 7 010 681 жизнь, а подтвержденное число случаев заболевания во всем мире превысило 704 753 890 в 229 странах1.
В результате мониторинга возбудителя болезни установлено, что вирус SARS-CoV-2 обладает повышенной генетической изменчивостью, в результате которой в процессе пандемии появились новые его варианты [2, 3].
Новый мутированный в значительной степени вариант SARS-CoV-2, отмеченный как B.1.1.529 (Омикрон), впервые обнаружен в Южной Африке, а затем быстро распространился по всему миру [4]. Через несколько дней после обнаружения в Южной Африке и Ботсване, 26 ноября 2021 г., на основании последующего и быстрого роста случаев заболевания, Омикрон был признан Всемирной организацией здравоохранения (ВОЗ) вариантом, имеющим высокую контагиозность с тяжелым течением заболевания и сниженной эффективностью лечения [5].
В настоящее время Омикрон разделен на 5 основных линий: ВА.1, ВА.2, ВА.3, ВА.4 и ВА.5. Первоначально Омикрон состоял из 3 сестринских линий: BA.1, BA.2 и BA.3. Вариант BA.1 стал причиной большинства инфекций 4-й эпидемической волны в Южной Африке. Однако, когда в середине января 2022 г. эта волна спала, BA.2 стал доминирующей южноафриканской линией [6‒9].
17 февраля 2023 г. стало известно еще об одном новом субварианте варианта Омикрон, который получил название Эрис (EG.5). По информации ВОЗ, подвид EG.5 относится к линейке XBB.1.9.2, как и другие подвиды варианта Омикрона. От своих предшественников штамм отличается наличием дополнительных мутаций аминокислот F456L и Q52H [10, 11]. Постепенно частота EG.5 среди других возбудителей COVID-19 увеличивалась и, по состоянию на июль 2023 г., достигла 17,4%. Наибольшее число случаев было зафиксировано в Китае, США, Корее, Японии, Канаде, Великобритании, Франции, Португалии2.
Главное отличие нового субварианта варианта Омикрон ‒ улучшенная способность ускользать от иммунного ответа, что обусловливает повышенную частоту заболеваемости. Также установлено крайне быстрое распространение вируса: всего за месяц доля субварианта Эрис среди всех типов коронавируса возросла на 10%. Он передается намного быстрее, чем предыдущие штаммы: Кракен, Арктур, Кентавр.
Таким образом, Омикрон является наиболее антигенно дивергентным вариантом. С момента появления Омикрона и его подвариантов (например, BA.2, BA.4, BA.5, BF.7, XBB), он стал ключевым фактором пандемии, приведшей к нескольким новым волнам инфекции [12, 13].
Приведенные выше данные свидетельствуют о том, что SARS-CoV-2 продолжает мутировать и появляются новые штаммы с другими свойствами. Из-за частой мутации вируса защитное действие имеющихся вакцин, изготовленных на основе исходного варианта возбудителя, снижается [14, 15]. В связи с этим для поддержания высокой эффективности специфической профилактики становится востребованной вакцина, стимулирующая эффективный иммунитет против варианта Омикрон вируса SARS-CoV-2.
Примерами зарегистрированных инактивированных вакцин являются CoronaVac (Sinovac, Китай), Covaxin (Bharat Biotech, Индия), Sinopharm (Sinopharm/институт биологических препаратов Уханя, Китай), «КовиВак» (Центр Чумакова, Россия), BBIB-CorV (Институт биологических препаратов Пекина, Китай).
Инактивированная вакцина широко используется для профилактики заболеваний [16], и ранее нами в НИИПББ была разработана инактивированная цельновирионная вакцина QazCovid-in против COVID-19 на основе SARS-CoV-2/human/KAZ/KZ_Almaty/2020 [17].
Подбор подходящего инактиватора, правильное проведение процедуры инактивации и проверка инактивации являются наиболее важными факторами в производстве инактивированных вакцин. Обычно процедура инактивации должна быть адаптирована к штамму вируса, концентрации инактиватора и многим другим факторам, таким как время инкубации и концентрация вируса, для получения эффективного продукта [18‒21]. Инактивация вируса проводится физическими (тепло, ультрафиолетовое облучение) и химическими методами (детергенты, SDS, TRIzol, формальдегид и β-пропиолактон (БПЛ)) [22, 23]. Формальдегид и БПЛ являются наиболее доступными химическими инактиваторами для инактивации вирусов, и оба одобрены регулирующими органами в разных странах для производства биологических продуктов, инактивированных вирусами [24]. Формальдегид инактивирует вирусы посредством перекрестного связывания поверхностных белков вируса, тогда как БПЛ ‒ главным образом посредством ацилирования или алкилирования вирусной ДНК или РНК [25]. В процессе приготовления вакцин против COVID-19 формальдегид и БПЛ используют для инактивации частиц вируса SARS-CoV-2 [26‒29]. В связи с тем SARS-CoV-2 ‒ сравнительно новый вирус, в настоящее время не проводятся комплексные исследования инактивации БПЛ и формальдегида на физические и химические свойства SARS-CoV-2, а также не существует научного стандарта для количественной оценки эффектов инактивации [30].
Цель исследования ‒ оценка и сравнение эффективности двух агентов: формальдегида и БПЛ, в отношении варианта Омикрон вируса SARS-CoV-2.
Материалы и методы
Клинические образцы. Для выделения варианта Омикрон вируса SARS-CoV-2 были использованы назофарингеальные смывы (мазки), собранные медицинскими сотрудниками и доставленные в НИИПББ с соблюдением международных и отечественных требований по транспортировке клинических образцов345, по разрешению Комитета санитарно-эпидемиологического контроля (КСЭК) МЗ РК. Наличие искомого варианта вируса в клиническом образце подтверждали с помощью полимеразной цепной реакции (ПЦР) и секвенирования спайк-белка возбудителя. Индикацию вируса и его принадлежности варианту Омикрон проводили сотрудники лаборатории «Коллективное пользование».
Культуры клеток и питательная среда. Для выделения, репродукции, титрования, вируса, а также постановки реакции нейтрализации использовали перевиваемую культуру клеток Vero, которые выращивали в питательной среде ДМЕМ, содержащей 10% фетальной сыворотки крови крупного рогатого скота, 200 мкг/мл стрептомицина, 200 Ед/мл пенициллина и 400 мкг/мл гентамицина.
Выделение вируса. Для выделения вируса использовали односуточную монослойную культуру клеток Vero, выращенных в матрасах 0,25 см2. На клеточный монослой наносили суспензию смывов со слизистой оболочки носовой полости больных в объеме 0,5 мл и выдерживали в течение 60 мин при температуре 37 °С с содержанием в воздухе 5% CO2-инкубатора и 95% относительной влажности с ежедневной микроскопией. Наличие вируса устанавливали по цитопатогенному действию в культуре клеток. Выделенный вирус идентифицировали в реакции нейтрализации с использованием сыворотки крови, полученной для варианта Омикрон вируса SARS-CoV-2 путем иммунизации интактных белых мышей.
Для получения новой генерации вируса культуры клеток с выраженным цитопатическим действием (ЦПД) замораживали, затем размораживали и полученным культуральным вирусом заражали свежую культуру клеток.
Титрование вируса. Инфекционную активность вируса определяли по общепринятой методике, титр вируса рассчитывали. Для титрования вируса культуру клеток Vero выращивали в 96-луночном культуральном микропланшете при температуре 37 °С до формирования монослоя. Для выращивания использовали DMEM с добавлением 2% фетальной бычьей сыворотки крови. Готовили последовательные 10-кратные разведения титруемой вирусной суспензии от 10−1 до 10−8. Каждым разведением заражали культуру клеток не менее чем в 4 лунках. Клетки с вирусом инкубировали при 37 °С в атмосфере 5% СО2 в течение 7 сут. Наличие вируса устанавливали по ЦПД, определяемого микроскопированием с помощью инвертированного микроскопа, а титр вируса рассчитывали по методу Reed-Muench [31].
Инактивация вируса. Химическую инактивацию проводили 37% формальдегидом и БПЛ (Sigma-Aldrich, США), для этого использовали вирус SARS-CoV-2/Omicron/KZ-Almaty/04.2023 с титром 6,83 lg TЦД50/мл. После сбора вирусную суспензию осветляли путем осаждения грубых частиц центрифугированием при 2000 g в течение 30 мин.
Для инактивации в осветленную вирусную суспензию добавляли 3% рабочий раствор формальдегида до конечной концентрации 0,05, 0,1 и 0,5% с последующей выдержкой при температуре 37 °С в течение 48 ч при постоянном перемешивании со скоростью 60 ± 5 об/ч. Для установления срока инактивации каждый час из биомассы вируса с инактивантами отбирали пробы, в которые для прекращения действия инактиванта добавляли 25% раствор бисульфита натрия в концентрации, пропорциональной по молекулярной массе формальдегиду, добавленному в биомассу, и подвергали проверке на полноту инактивации вируса или помещали при температуре 4‒6 °С до указанной проверки.
Для инактивации вируса SARS-CoV-2 БПЛ культуру клеток Vero выращивали в культуральных матрасах до формирования монослоя, затем инфицировали вирусом SARS-CoV-2. Через 3 сут после инфицирования собирали вирусную суспензию, клеточные остатки удаляли центрифугированием и хранили до дальнейшего использования. После этого вирусную суспензию инактивировали БПЛ в разных концентрациях (00,5, 0,1 и 0,5%). Затем вирусную суспензию вместе с БПЛ инкубировали при 4 °C в течение 12 ч с последующей 4-часовой инкубацией при 37 °C для гидролиза оставшегося БПЛ.
Для изучения кинетики инактивации вируса проводили периодически отбор проб в течение 48 ч через каждый час. Полноту инактивации вируса подтверждали при отсутствии ЦПД в трех последовательных повторностях заражения.
Определение антигенной активности инактивированного вируса. Антигенную активность оценивали по динамике и титрам вируснейтрализующих антител (ВНА) на испытуемый вирус, сформированных в организме привитых лабораторных биологических моделей (беспородные белые мыши SPF (specific pathogen free, без специфических патогенов)). Белым мышам (по 5 голов в группе) вводили внутримышечно по 0,5 мл испытуемых образцов инактивированной вирусной суспензии, предварительно собрав образцы сыворотки крови. Затем через каждые 7 сут в течение 28 сут повторно собирали образцы сыворотки крови, которые в ретроспективе исследовали на наличие и титр специфических антител на вариант Омикрон вируса SARS-CoV-2. Антигенную активность оценивали по скорости формирования и титру ВНА.
Постановка реакции нейтрализации. Реакцию нейтрализации проводили на монослойной культуре клеток Vero, приготовленной в 96-луночных пластиковых планшетах. В качестве реакционной смеси использовали двукратные разведения (1 : 2, 1 : 4 и т.д.) исследуемой сыворотки крови у белых мышей на поддерживающей среде и культуральную суспензию варианта Омикрон вируса SARS-CoV-2 с титром 100 ТЦД50, взятых в равных объемных соотношениях. Полученную смесь выдерживали при температуре 37 °С в течение 60 мин и вносили в разных дозах в не менее чем 4 лунки 96-луночного планшета с тестовой культурой клеток. В качестве контроля дозы суспензию вируса титровали на той же культуре клеток используя ее 10-кратные (10−1, 10−2, 10−3, 10−4) разведения на поддерживающей среде. Для контроля качества культуры клеток оставляли не менее 4 лунок без внесения реакционной смеси и вируса, но с заменой на поддерживающую среду. Культуру клеток в планшетах с реакцией нейтрализации выдерживали при температуре 37 °С в течение 5 сут, после чего проводили учет результатов по ЦПД вируса. Отсутствие ЦПД в культуре клеток, при наличии его в контрольных лунках с дозой вируса и отсутствии в лунках с контролем качества культуры клеток, определяли как нейтрализацию вируса или наличие антител, а наличие ЦПД при указанных состояниях в перечисленных контролях ‒ как отсутствие нейтрализации и специфических антител. За титр антител принимали то наивысшее разведение сыворотки крови, которое в не менее 50% случаев нейтрализовало репродукцию вируса. Титр антител описывали в обратных цифровых величинах двукратных разведений сыворотки крови. Достоверность разности титров антител, формируемых у модельных животных, устанавливали по Стьюденту [32].
Статистический анализ. Статистический анализ проводили с помощью программы GraphPad Prism версии 8.0.1. Титр вируса выражали в lg ТЦД50/мл.
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus author guidelines for animal use (IAVES 23 July 2010). Протокол исследования одобрен Комитетом по Биоэтике Научно-исследовательского института проблем биологической безопасности Министерства здравоохранения Республики Казахстан (Протокол № 2 от 14.08.2023).
Результаты
Поступившие клинические образцы (мазки), полученные из КСЭК МЗ РК и НЦЭ, при исследовании в ПЦР в 9 из 30 случаев содержали РНК вируса SARS-CoV-2. После заражения культуры клеток Vero клиническими образцами, позитивными в ПЦР на целевой вирус, в 3 пробах был выявлен цитопатогенный агент на 1-м пассаже, который проявил свое патогенное действие на 3-и сутки. В других биологических образцах наличие цитопатогенного агента не отмечалось в течение 3 последовательных пассажей. Со временем количество округлых и деструктивных клеток увеличилось, на поверхности монослоя уменьшалось количество адгезивных и распластанных клеток, наблюдались формирование очагов пустоты вследствие открепившихся клеток и увеличение межклеточного пространства при сравнении с контрольной культурой (рис. 1). Полная деструкция монослоя пораженных клеток наступала в течение 48‒72 ч после появления признаков цитопатологии.
Рис. 1. Цитопатические изменения в монослое культуры клеток Vero, ув. 100.
а ‒ неинфицированная культура клеток; б ‒ цитопатическое изменение в культуре клеток.
Fig. 1. Cytopathic changes in a monolayer of Vero cell culture, 100× magnification.
a ‒ uninfected cell culture; b ‒ cytopathic change in cell culture.
Выделенный цитопатогенный агент с помощью ПЦР был идентифицирован как вирус SARS-CoV-2, а при секвенировании гена шипового белка определен как вариант Омикрон. На уровне 5-го пассажа в культуре клеток этот вирус накапливался в титре 6,83 ± 0,22 lg TЦД50/мл.
В опубликованной ранее статье [33] были изучены сроки и кинетика инактивации вируссодержащей суспензии Уханьского штамма вируса SARS-COV-2 формальдегидом при температурных режимах 4 °С, 22 °С и 37 °С, где по результатам исследования температура 37 °С была отмечена как наиболее эффективная для инактивации. В связи с этим в настоящем исследовании инкубацию проводили только при температуре 37 °С.
Скорость инактивации вируса под воздействием двух вышеназванных агентов при температуре 37 °С приведена на рис. 2, 3.
Рис. 2. Кинетика инактивации варианта Омикрон вируса SARS-COV-2 в конечной концентрации формальдегида 0,05, 0,1, 0,5% и сравнительного контроля при температурном режиме 37 °С.
Fig. 2. Kinetics of inactivation of the Omicron virus SARS-COV-2 at a final formaldehyde concentration of 0.05, 0.1, 0.5% and a comparative control at a temperature of 37 °C.
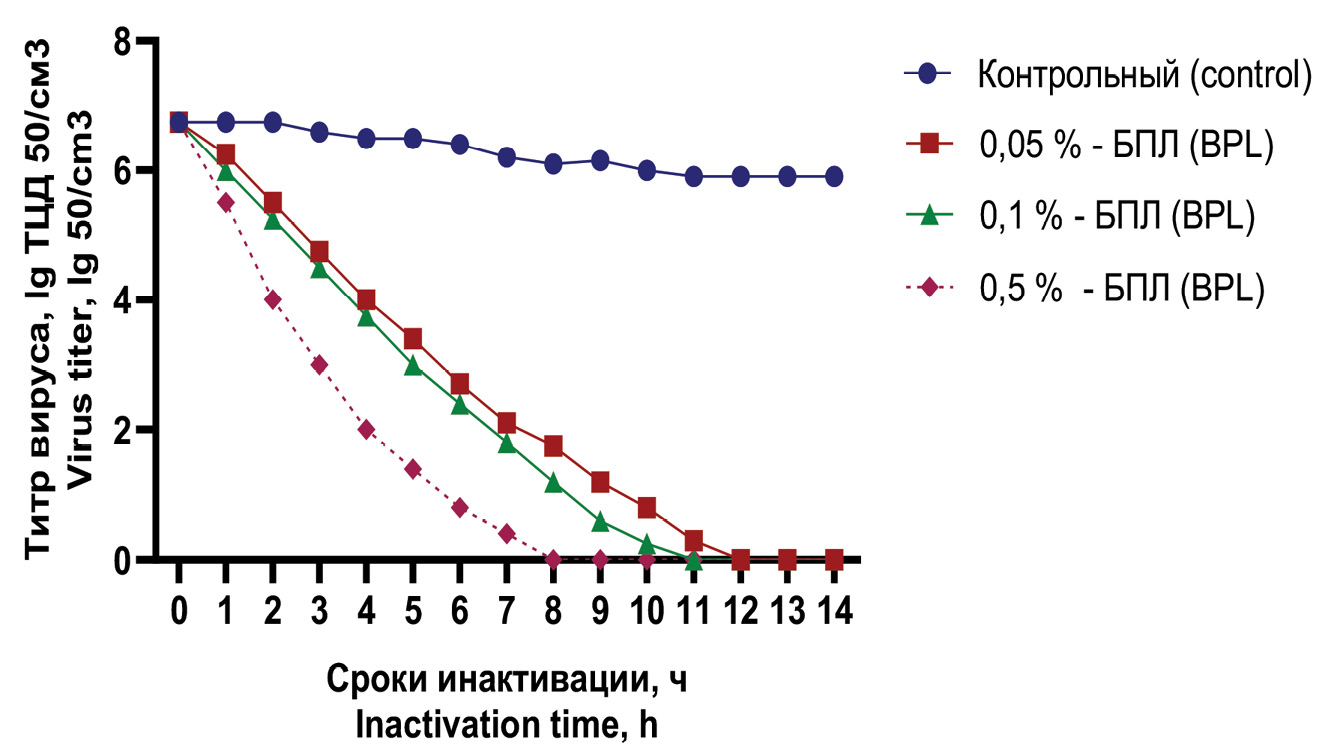
Рис. 3. Кинетика инактивации варианта Омикрон вируса SARS-COV-2 в конечной концентрации β-пропиолактона 0,05, 0,1, 0,5% и сравнительного контроля при температурном режиме 37 °С.
Fig. 3. Kinetics of inactivation of the Omicron virus SARS-COV-2 at a final concentration β-propiolactone 0.05, 0.1, 0.5% and comparative control at a temperature of 37 °C.
Как видно из рис. 2 и 3, при обработке 0,1 и 0,05% растворами формальдегида с выдерживанием при температуре 37 °С вирус теряет инфекционную активность через 2 ч. А инактивация этого возбудителя при обработке 0,5% формальдегидом наступала уже в течение 1 ч.
При использовании БПЛ в концентрации 0,1 и 0,05% полная потеря инфекционной активности вируса отмечалась через 11‒12 ч соответственно. Для концентрации инактиванта 0,1% этот показатель составлял 8 ч.
После каждого случая отбора образцов вируса, обработанного инактивантами, их подвергали тестированию на полноту инактивации возбудителя путем инокуляции культуры клеток и проведением последовательных 3 слепых пассажей в этой биологической модели. Инокуляцию в культуру клеток проводили титрованием. Результаты исследований приведены в табл. 1.
Таблица 1. Результаты оценки титра вируса, обработанного инактивантами, по срокам выдержки при температуре 37 °С
Table 1. Results of the titer measurement of the virus treated with inactivation agents with different exposure duration at a temperature of 37 °C
Деактивирующий агент Inactivating agent | Экспозиция, ч Exposure, h | Концентрация инактиванта, % Inactivation agent concentration, % | t, °С | Титр вируса, lgТЦД50/см3 Virus titer, lgTCD50/cm3 | |
исходный original | остаточный residual | ||||
Формальдегид Formaldehyde | 1 | 0,05 | 37 | 6,83 ± 0,22 | 1,2 ± 0,12 |
0,1 | 1,0 ± 0,15 | ||||
0,5 | 0,2 ± 0,11 | ||||
2 | 0,05 | 0,00 | |||
0,1 | 0,00 | ||||
0,5 | 0,00 | ||||
Контроль Control | 2 | 0 | 6,58 ± 0,38 | ||
β-пропиолактон β-propiolactone | 4 | 0,05 | 37 | 6,83 ± 0,22 | 5,11 ± 0,14 |
0,1 | 4,83 ± 0,23 | ||||
0,5 | 3,50 ± 0,17 | ||||
6 | 0,05 | 3,80 ± 0,1 | |||
0,1 | 3,50 ± 0,17 | ||||
0,5 | 2,00 ± 0,12 | ||||
8 | 0,05 | 2,50 ± 0,15 | |||
0,1 | 2,40 ± 0,17 | ||||
0,5 | 0,5 ± 0,2 | ||||
10 | 0,05 | 1,10 ± 0,2 | |||
0,1 | 1,00 ± 0,2 | ||||
0,5 | 0,00 | ||||
12 | 0,05 | 0,00 | |||
0,1 | 0,00 | ||||
0,5 | 0,00 | ||||
Контроль Control | 12 | 0 | 5,37 ± 0,17 | ||
Как видно из данных табл. 1, вариант Омикрон вируса SARS-CoV-2, обработанный формальдегидом в концентрациях 0,5, 0,1, 0,05%, независимо от концентрации инактиванта, терял свою биологическую активность в течение 2 ч. При исходном титре возбудителя 6,83 ± 0,22 lg ТЦД50/см3, через 1 ч после обработки формальдегидом с выдержкой при температуре 37 °С, его титр составил: 0,2 ± 0,11 lg ТЦД50/см3 при концентрации инактиванта 0,5%, 1,0 ± 0,15 lg ТЦД50/см3 при концентрации инактиванта 0,1% и 1,2 ± 0,12 lg ТЦД50/см3 при концентрации инактиванта 0,05%. А в образцах вирусной суспензии, отобранной через 2 ч после выдержки с раствором формальдегида при той же температуре, независимо от концентрации инактиванта, наличие цитопатогенного вируса не было обнаружено. Такой же отрицательный результат на наличие репродуктивного вируса был получен при дополнительном слепом двукратном пассировании испытуемых образцов в чувствительной культуре клеток.
В исследованиях с БПЛ полная потеря инфекционности вируса происходила в течение до 12 ч. При этом так же, как и с предыдущим инактивантом, прослеживалась зависимость скорости инактивации вируса от концентрации инактиванта. При концентрации БПЛ 0,5% инфекционная активность вируса полностью терялась в течение 10 ч, в то время как в образцах с концентрацией этого инактиванта 0,1 и 0,05% в указанный срок отмечался цитопатогенный титр в пределах 1,00 ± 0,2 и 1,10 ± 0,2 lg ТЦД50/см3 соответственно.
В исследованиях по оценке антигенной активности инактивированных образцов варианта Омикрон вируса SARS-CoV-2 по скорости формирования и титру ВНА в организме беспородных белых мышей категории SPF в зависимости от вида и концентрации использованного инактиванта были получены результаты, которые отражены в табл. 2.
Таблица 2. Динамика титров вируснейтрализующих антител (ВНА) в организме мышей, иммунизированных образцами варианта Омикрон вируса SARS-CoV-2, инактивированных двумя инактивантами в разных концентрациях при температуре 37 °С
Table 2. Dynamics of virus-neutralizing antibody (VNA) titers in mice inoculated with samples of the Omicron variant of the SARS-CoV-2 virus inactivated by two inactivation agents at different concentrations at 37°C
Инактивант Inactivation agent | Концентрация инактиванта, % Concentration of inactivation agent, % | Кол-во привитых мышей, гол. Number of vaccinated mice, head | Сроки исследования после иммунизации, сут Duration of the study after immunization, days | Прирост титра BHA, кратно Increase in VNA titer, multiple | |||
0 | 14 | 21 | 28 | ||||
Формальдегид Formaldehyde | 0,5 | 5 | 0 | 0 | 3,6 ± 0,8 | 4,4 ± 1,96 | 4 |
0,1 | 5 | 0 | 0 | 9,6 ± 3,2 | 12,8 ± 3,92 | 12 | |
0,05 | 5 | 0 | 2,4 ± 0,8 | 17,6 ± 7,84 | 25,6 ± 2,8 | 25 | |
β-пропиолактон β-propiolactone | 0,5 | 5 | 0 | 0 | 0 | 6,4 ± 1,96 | 6 |
0,1 | 5 | 0 | 0 | 7,2 ± 1,6 | 11,2 ± 3,92 | 11 | |
0,05 | 5 | 0 | 1,6 ± 0,8 | 14,4 ± 9,32 | 19,2 ± 2,65 | 19 | |
Примечание. Титры ВНА приведены в обратных числовых значениях разведения сыворотки крови.
Note. Virus-neutralizing antibody (VNA) titers are given in reciprocal numerical values of blood serum dilution.
Как видно из данных табл. 2, скорость формирования ВНА была зависима от концентрации инактивантов, независимо от их вида. При использованных наибольших концентрациях инактивантов, равных 0,5 и 0,1%, ВНА в образцах сыворотки крови привитых мышей выявлялись на 21-е сутки после инокуляции инактивированного возбудителя, в то время как при концентрации этих химических веществ 0,05% уже на 14-е сутки отмечали наличие следов ВНА в титре 2,4 ± 0,8 и 1,6 ± 0,8 (формальдегид и БПЛ соответственно). Уровень титров ВНА в динамике изменялся также в зависимости от концентрации использованных инактивантов. Образцы вируса, инактивированные инактивантами в концентрации 0,5%, стимулировали ВНА, титры которых за период наблюдения не превышали 4,4 ± 1,96 и 6,4 ± 1,968 (формальдегид и БПЛ соответственно), в то время как в организме мышей, привитых вирусом, инактивированным инактивантами в концентрации 0,1%, выявлялись специфические антитела в титрах 12,8 ± 3,92 и 11,2 ± 3,928 (формальдегид и БПЛ соответственно) на 28-е сутки после прививки. Выраженная антигенная стимуляция наблюдалась у вируса, инактивированного обоими инактивантами в концентрации 0,05%. У мышей, привитых вирусом, инактивированным инактивантами наименьшей концентрации, титры антител на 21-е сутки достигали 17,6 ± 7,84 и 14,4 ± 9,328 (формальдегид и БПЛ соответственно), а на 28-е сутки – 25,6 ± 2,8 и 19,2 ± 2,658 (формальдегид и БПЛ соответственно). Соответственно, кратность прироста титра ВНА за наблюдаемые 28 сут был наивысшим в образцах сыворотки крови мышей, привитых вирусом, инактивированным инактивантами в наименьшей концентрации, равной 0,05%, и составила 25 для вируса, инактивированного формальдегидом, а БПЛ ‒ 19.
Полученные данные свидетельствуют о том, что при концентрации инактивантов 0,05% целевой вариант вируса подвергается полной инактивации за выявленное время при температуре 37 °С и сохраняет свою антигенную активность значительно дольше, чем при его инактивации теми же инактивантами, взятыми в 2- и 4-кратно повышенных концентрациях.
Обсуждение
Инактивированные вирусные препараты традиционно используются при производстве вакцин. Они относятся к безопасным и эффективным препаратам для профилактики гриппа, полиомиелита, гепатита А, клещевого энцефалита и японского энцефалита [34‒37].
Инактивация вируса является одним из наиболее важных этапов вирусологических исследований и разработки инактивированных вакцин. В качестве химического инактиванта в настоящее время используют БПЛ и формальдегид, однако не существует единого стандарта для проектирования и определения процесса инактивации [38].
В настоящей статье рассматриваются доступные методы инактивации варианта Омикрон вируса SARS-CoV-2 для таких целей, как производство вакцин и антисывороток. Была оптимизирована концентрация инактивантов (формальдегида, БПЛ) и изучено их влияние на агрегацию вируса. Было выявлено, что обработка 0,05% и 0,1% формальдегидом и БПЛ культуральной суспензии при температуре +37 °С достаточна для полной инактивации вируса. При этом процесс разрушения в этих концентрациях с БПЛ значительно дольше, чем с формальдегидом. Также результаты исследовании показали, что более высокие концентрации 0,5% БПЛ и формальдегида отрицательно влияют на антигенный потенциал вируса, тем самым потенциально влияя на иммунный ответ при использовании в качестве антигенов. Однако более низкая концентрация (0,05 и 0,1%) оказывала минимальное влияние на антигенную целостность по сравнению с более высокой концентрацией, что позволяет предположить, что при этих концентрациях антигенный ответ должен быть устойчивым.
Имеются аналогичные работы использования БПЛ в разведении 1: 1000 при температуре +4‒8 °С, в которых в течение короткого времени (2 ч) отмечалась низкая активность вируса.
По данным литературы, для инактивации БПЛ обычно используют концентрации от 0,1 до 1%. Более ранние исследования показали, что обработка БПЛ вызывает агрегацию вирусных частиц, а увеличение его концентрации вызывает образование более крупных агрегатов [39].
Заключение
Результаты исследований показли, что выделенный генетический вариант Омикрон вируса SARS-CoV-2 из клинических образцов пациентов, больных COVID-19 (г. Астана), обладал цитопатогенной активностью в культуре клеток Vero, которая близко напоминает исходный вариант (Ухань) возбудителя. На уровне 5-го пассажа вирус накапливается в монослойной культуре клеток Vero, приготовленной в матрасах и клеточных фабриках, в титрах 6,83 ± 0,22 lg ТЦД50/мл3.
Выделенный вариант Омикрон вируса SARS-CoV-2 в культуральной жидкости при обработке формальдегидом в концентрацих 0,5, 0,1, 0,05% и выдержке при температуре 37 °С подвергается полной инактивации в течение до 2 ч. Обработка вируса БПЛ в тех же концентрациях, которые использованы для формальдегида, также инактивирует вирус, но за более продолжительное время, равное 11 ч. Образцы вируса, инактивированные использованными инактивантами, обладают разной антигенной активностью в зависимости от концентрации инактивантов. Наиболее выраженная антигенная активность проявляется у образцов возбудителя, которые подвергались обработке инактивантом в щадящей концентрации, равной 0,05%. Повышение концентрации инактивантов в 5 раз и более приводит к значимому снижению антигенности вируса SARS-CoV-2. При использованных режимах инактивации потеря биологической активности вируса происходит быстрее и антигенность сохраняется в большей степени при обработке формальдегидом.
Полученные результаты исследований можно использовать в технологии изготовления инактивированной вакцины против новой коронавирусной инфекции (COVID-19) с использованием варианта Омикрон вируса SARS-CoV-2.
1 https://www.worldometers.info/coronavirus/coronavirus-death-toll/
2 https://id-clinic.ru/news/covid-19/kovid-eg5-eris-samoe-vazhnoe-o-novom-shtamme-koronavirusa/
3 WHO/WHE/CPI/2019.20 Guidance on regulations for the transport of infectious substances 2019-2020.
4 WHO Laboratory biosafety guidance related to the novel coronavirus (2019-nCoV). https://www.who.int/docs/default source/coronaviruse/laboratory-biosafety-novel-coronavirus-version-1-1.pdf?sfvrsn=912a9847_2
5 Санитарно-эпидемиологические требования к лабораториям, использующим потенциально опасные химические и биологические вещества. Приказ Министра здравоохранения Республики Казахстан от 8 сентября 2017 г. № 684.
About the authors
Gulzhan A. Zhapparova
Research Institute for Biological Safety Problems
Author for correspondence.
Email: Gulzhan1003@mail.ru
ORCID iD: 0000-0001-5382-831X
master of biology, senior researcher of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, Gvardeyskiy
Balzhan S. Myrzakhmetova
Research Institute for Biological Safety Problems
Email: b.myrzakhmetova@biosafety.kz
ORCID iD: 0000-0002-4141-7174
candidate of biological sciences, head of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, GvardeyskiyTalshyngul M. Tlenchiyeva
Research Institute for Biological Safety Problems
Email: t.m.tlenchieva@mail.ru
ORCID iD: 0009-0006-7831-4212
master of chemistry, senior researcher of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, GvardeyskiyAiganym A. Tussipova
Research Institute for Biological Safety Problems
Email: aiganym.t24@gmail.com
ORCID iD: 0000-0002-7767-0542
master of Natural Sciences, senior laboratory assistant of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, GvardeyskiyKarina B. Bissenbayeva
Research Institute for Biological Safety Problems
Email: bisenbayeva.karina@bk.ru
ORCID iD: 0000-0001-5788-6074
master of biology, senior researcher of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, GvardeyskiyAizhan S. Toytanova
Research Institute for Biological Safety Problems
Email: aizhana-1308@mail.ru
ORCID iD: 0009-0004-9526-3539
master of biology, senior researcher of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, GvardeyskiyLespek B. Kutumbetov
Research Institute for Biological Safety Problems
Email: lespek.k@gmail.com
ORCID iD: 0000-0001-8481-0673
doctor of veterinary sciences, professor, chief researcher of the laboratory Especially Dangerous Infectious Diseases
Kazakhstan, 080409, GvardeyskiyReferences
- Han Q., Lin Q., Jin S., You L. Coronavirus 2019-nCoV: A brief perspective from the front line. J. Infect. 2020; 80(4): 373–7. https://doi.org/10.1016/j.jinf.2020.02.010
- Wrapp D., Wang N., Corbett K.S., Goldsmith J.A., Hsieh C.L., Abiona O., et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020; 367(6483): 1260–3. https://doi.org/10.1126/science.abb2507
- Xu D., Zhang Z., Chu F., Li Y., Jin L., Zhang L., et al. Genetic variation of SARS coronavirus in Beijing Hospital. Emerg. Infect. Dis. 2004; 10(5): 789–94. https://doi.org/10.3201/eid1005.030875
- Bai Y., Du Z., Xu M., Wang L., Wu P., Lau E.H.Y., et al. International risk of SARS-CoV-2 Omicron variant importations originating in South Africa. medRxiv. 2021; 2021.12.07.21267410. Preprint. https://doi.org/10.1101/2021.12.07.21267410
- Viana R., Moyo S., Amoako D.G., Tegally H., Scheepers C., Althaus C.L., et al. Rapid epidemic expansion of the SARS-CoV-2 Omicron variant in southern Africa. Nature. 2022; 603(7902): 679–86. https://doi.org/10.1038/s41586-022-04411-y
- Tegally H., Moir M., Everatt J., Giovanetti M., Scheepers C., Wilkinson E., et al. Emergence of SARS-CoV-2 Omicron lineages BA.4 and BA.5 in South Africa. Nat. Med. 2022; 28(9): 1785–90. https://doi.org/10.1038/s41591-022-01911-2
- Rahimi F., Bezmin Abadi A.T. The Omicron subvariant BA.2: Birth of a new challenge during the COVID-19 pandemic. Int. J. Surg. 2022; 99: 106261. https://doi.org/10.1016/j.ijsu.2022.106261
- Fonager J, Bennedbæk M, Bager P., Wohlfahrt J., Ellegaard K.M., Ingham A.C., et al. Molecular epidemiology of the SARS-CoV-2 variant Omicron BA.2 sub-lineage in Denmark, 29 November 2021 to 2 January 2022. Euro Surveill. 2022; 27(10): 2200181. https://doi.org/10.2807/1560-7917.ES.2022.27.10.2200181
- Chen L.L., Abdullah S.M.U., Chan W.M., Chan B.P., Ip J.D., Chu A.W., et al. Contribution of low population immunity to the severe Omicron BA.2 outbreak in Hong Kong. Nat. Commun. 2022; 13(1): 3618. https://doi.org/10.1038/s41467-022-31395-0
- O’Toole Á., Pybus O.G., Abram M.E., Kelly E.J., Rambaut A. Pango lineage designation and assignment using SARS-CoV-2 spike gene nucleotide sequences. BMC Genomics. 2022; 23(1): 121. https://doi.org/10.1186/s12864-022-08358-2
- Rambaut A., Holmes E.C., O’Toole Á., Hill V., McCrone J.T., Ruis C., et al. A dynamic nomenclature proposal for SARS-CoV-2 lineages to assist genomic epidemiology. Nat. Microbiol. 2020; 5(11): 1403–7. https://doi.org/10.1038/s41564-020-0770-5
- Jung C., Kmiec D., Koepke L., Zech F., Jacob T., Sparrer K.M.J., et al. Omicron: what makes the latest SARS-CoV-2 variant of concern so concerning? J. Virol. 2022; 96(6): e020772. https://doi.org/10.1128/jvi.02077-21
- Our world in data. Mathieu E., Ritchie H., Rodés-Guirao L., Appel C., Giattino C., Hasell J., et al. Coronavirus Pandemic (COVID-19); 2020. Available at: https://ourworldindata.org/coronavirus
- Malik J.A., Ahmed S., Mir A., Shinde M., Bender O., Alshammari F., et al. The SARS-CoV-2 mutations versus vaccine effectiveness: New opportunities to new challenges. J. Infect. Public Health. 2022; 15(2): 228–40. https://doi.org/10.1016/j.jiph.2021.12.014
- Wang Q., Ye S.B., Zhou Z.J., Song A.L., Zhu X., Peng J.M., et al. Key mutations in the spike protein of SARS-CoV-2 affecting neutralization resistance and viral internalization. J. Med. Virol. 2023; 95(1): e28407. https://doi.org/10.1002/jmv.28407
- Murdin A.D., Barreto L., Plotkin S. Inactivated poliovirus vaccine: past and present experience. Vaccine. 1996; 14(8): 735–46. https://doi.org/10.1016/0264-410x(95)00211-i
- Zakarya K., Kutumbetov L., Orynbayev M., Abduraimov Y., Sultankulova K., Kassenov M., et al. Safety and immunogenicity of a QazCovid-in® inactivated whole-virion vaccine against COVID-19 in healthy adults: A single-centre, randomised, single-blind, placebo-controlled phase 1 and an open-label phase 2 clinical trials with a 6 months follow-up in Kazakhstan. EClinicalMedicine. 2021; 39: 101078. https://doi.org/10.1016/j.eclinm.2021.101078
- Gupta D., Parthasarathy H., Sah V., Tandel D., Vedagiri D., Reddy S., et al. Inactivation of SARS-CoV-2 by β-propiolactone causes aggregation of viral particles and loss of antigenic potential. Virus Res. 2021; 305: 198555. https://doi.org/10.1016/j.virusres.2021.198555
- Widera M., Westhaus S., Rabenau H.F., Hoehl S., Bojkova D., Cinatl J., et al. Evaluation of stability and inactivation methods of SARS-CoV-2 in context of laboratory settings. Med. Microbiol. Immunol. 2021; 210(4): 235–44. https://doi.org/10.1007/s00430-021-00716-3
- Awadasseid A., Wu Y., Tanaka Y., Zhang W. Current advances in the development of SARS-CoV-2 vaccines. Int. J. Biol. Sci. 2021; 17(1): 8–19. https://doi.org/10.7150/ijbs.52569
- Herrera-Rodriguez J., Signorazzi A., Holtrop M., de Vries-Idema J., Huckriede A. Inactivated or damaged? Comparing the effect of inactivation methods on influenza virions to optimize vaccine production. Vaccine. 2019; 37(12): 1630–7. https://doi.org/10.1016/j.vaccine.2019.01.086
- Patterson E.I., Prince T., Anderson E.R., Casas-Sanchez A., Smith S.L., Cansado-Utrilla C., et al. Methods of inactivation of SARS-CoV-2 for downstream biological assays. J. Infect. Dis. 2020; 222(9): 1462–7. https://doi.org/10.1093/infdis/jiaa507
- Auerswald H., Yann S., Dul S., In S., Dussart P., Martin N.J., et al. Assessment of inactivation procedures for SARS-CoV-2. J. Gen. Virol. 2021; 102(3): 001539. https://doi.org/10.1099/jgv.0.001539
- Goldstein M.A., Tauraso N.M. Effect of formalin, beta-propiolactone, merthiolate, and ultraviolet light upon influenza virus infectivity chicken cell agglutination, hemagglutination, and antigenicity. Appl. Microbiol. 1970; 19(2): 290–4. https://doi.org/10.1128/am.19.2.290-294.1970
- Fan C., Ye X., Ku Z., Kong L., Liu Q., Xu C., et al. Beta-propiolactone inactivation of coxsackievirus A16 induces structural alteration and surface modification of viral capsids. J. Virol. 2017; 91(8): e00038-17. https://doi.org/10.1128/JVI.00038-17
- Wang H., Zhang Y., Huang B., Deng W., Quan Y., Wang W., et al. Development of an inactivated vaccine candidate, BBIBP-CorV, with potent protection against SARS-CoV-2. Cell. 2020; 182(3): 713–21.e9. https://doi.org/10.1016/j.cell.2020.06.008
- Gao Q., Bao L., Mao H., Wang L., Xu K., Yang M., et al. Development of an inactivated vaccine candidate for SARS-CoV-2. Science. 2020; 369(6499): 77–81. https://doi.org/10.1126/science.abc1932
- Zhang X.Y., Guo J., Wan X., Zhou J.G., Jin W.P., Lu J., et al. Biochemical and antigenic characterization of the structural proteins and their post-translational modifications in purified SARS-CoV-2 virions of an inactivated vaccine candidate. Emerg. Microbes Infect. 2020; 9(1): 2653–62. https://doi.org/10.1080/22221751.2020.1855945
- Chen H., Xie Z., Long R., Fan S., Li H., He Z., et al. A valid protective immune response elicited in rhesus macaques by an inactivated vaccine is capable of defending against SARS-CoV-2 infection. bioRxiv. 2020; 2020.08.04.235747. Preprint. https://doi.org/10.1101/2020.08.04.235747
- Basso C.R., Malossi C.D., Haisi A., de Albuquerque Pedrosa V., Barbosa A.N., Grotto R.T., et al. Fast and reliable detection of SARS-CoV-2 antibodies based on surface plasmon resonance. Anal. Methods. 2021; 13(29): 3297–306. https://doi.org/10.1039/d1ay00737h
- Reed L., Muench H. A simple method of estimation fifty percent and pints. J. Amer. Hyg. 1938; 27(3): 493–7. https://doi.org/10.1093/oxfordjournals.aje.a118408
- Myrzakhmetova B.Sh., Zhapparova G.A., Bisenbaeva K.B., Toytanova A.S., Tuyskanova M.S., Zhugunisov K.D., et al. Immune reactivity of two biological models to vaccination with the inactivated vaccine QazVac against coronavirus infection COVID-19. Voprosy virusologii. 2024; 69(3): 219–30. https://doi.org/10.36233/0507-4088-222 https://elibrary.ru/mcackf (in Russian)
- Zhugunisov K.D., Kerimbayev A.A., Kopeev S.K., Myrzakhmetova B.Sh., Tuyskanova M.S., Nakhanov A.K., et al. SARS-CoV-2 virus: isolation, growth, thermostability, inactivation and passages. Vestnik KazNU. Seriya biologicheskaya. 2022; 90(1): 73–89. https://doi.org/10.26577/eb.2022.v90.i1.07 (in Russian)
- Chan J.F., Yip C.C., To K.K., Tang T.H., Wong S.C., Leung K.H., et al. Improved molecular diagnosis of COVID-19 by the novel, highly sensitive and specific COVID-19-RdRp/Hel real-time reverse transcription-PCR assay validated in vitro and with clinical specimens. J. Clin. Microbiol. 2020; 58(5): e00310-20. https://doi.org/10.1128/jcm.00310-20
- Yuan Y., Wang R.T., Xia J., Cao H.J. Interventions for preventing influenza: an overview of Cochrane systematic reviews and a Bayesian network meta-analysis. J. Integr. Med. 2021; 19(6): 503–14. https://doi.org/10.1016/j.joim.2021.09.001
- Stuurman A.L., Marano C., Bunge E.M., De Moerlooze L., Shouval D. Impact of universal mass vaccination with monovalent inactivated hepatitis A vaccines – а systematic review. Hum. Vaccin. Immunother. 2017; 13(3): 724–36. https://doi.org/10.1080/21645515.2016.1242539
- Hegde N.R., Gore M.M. Japanese encephalitis vaccines: immunogenicity, protective efficacy, effectiveness, and impact on the burden of disease. Hum. Vaccin. Immunother. 2017; 13(6): 1–18. https://doi.org/10.1080/21645515.2017.1285472
- Yu S., Wei Y., Liang H., Ji W., Chang Z., Xie S., et al. Comparison of physical and biochemical characterizations of SARS-CoV-2 inactivated by different treatments. Viruses. 2022, 14(9): 1938. https://doi.org/10.3390/v14091938
- Kordyukova L.V., Moiseenko A.V., Serebryakova M.V., Shuklina M.A., Sergeeva M.V., Lioznov D.A., et al. Structural and immunoreactivity properties of the SARS-CoV-2 spike protein upon the development of an inactivated vaccine. Viruses. 2023; 15(2): 480. https://doi.org/10.3390/v15020480
Supplementary files