Study of the safety and immunogenicity of VLP-based vaccine for the prevention of rotavirus infection in neonatal minipig model
- Authors: Kostina L.V.1, Filatov I.E.1, Eliseeva O.V.1, Latyshev O.E.1, Chernoryzh Y.Y.1, Yurlov K.I.1, Lesnova E.I.1, Khametova K.M.1, Cherepushkin S.A.1, Savochkina T.E.1, Tsibezov V.V.1, Kryshen K.L.2, Alekseeva L.I.2, Zaykova O.N.1, Grebennikova T.V.1
-
Affiliations:
- National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
- RMC «HOME OF PHARMACY» JSC
- Issue: Vol 68, No 5 (2023)
- Pages: 415-427
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/16152
- DOI: https://doi.org/10.36233/0507-4088-194
- EDN: https://elibrary.ru/bnjqgp
- ID: 16152
Cite item
Full Text
Abstract
Introduction. In Russia, almost half of the cases of acute intestinal infections of established etiology in 2022 are due to rotavirus infection (RVI). There is no specific treatment for rotavirus gastroenteritis. There is a need to develop modern, effective and safe vaccines to combat rotavirus infection that are not capable of multiplying (replicating) in the body of the vaccinated person. A promising approach is to create vaccines based on virus-like particles (VLPs).
Objective. Study of the safety and immunogenicity of a vaccine against rotavirus infection based on virus-like particles of human rotavirus A in newborn minipigs with multiple intramuscular administration.
Materials and methods. Newborn minipigs were used as an animal model in this study. The safety of the tested vaccine was assessed based on thermometry data, clinical examination, body weight gain, clinical and biochemical blood parameters, as well as necropsy and histological examination. When studying the immunogenic properties of the Gam-VLP-rota vaccine in doses of 30 and 120 µg, the cellular, humoral and secretory immune response was studied.
Results. The results of assessing the general condition of animals during the immunization period, data from clinical, laboratory and pathomorphological studies indicate the safety of the vaccine against human rotavirus infection based on VLP (Gam-VLP-rota) when administered three times intramuscularly. Good local tolerance of the tested vaccine was demonstrated. The results of the assessment of humoral immunity indicate the formation of a stable immune response after three-time immunization with Gam-VLP-rota, stimulation of the production of antigen-specific IgG antibodies and their functional activity to neutralize human rotavirus A. It was shown that following the triple immunization with the minimum tested concentration of 30 µg/dose, animals developed a cell-mediated immune response. The results of the IgA titer in blood serum and intestinal lavages indicate the formation of both a systemic immunological response and the formation of specific secretory immunity to human rotavirus A.
Conclusion. Thus, three-time intramuscular immunization of minipigs with the Gam-VLP-rota vaccine forms stable protective humoral and cellular immunity in experimental animals. Evaluated vaccine is safe and has good local tolerability.
Full Text
Введение
Ротавирусная инфекция (РВИ) – основная причина острого гастроэнтерита у детей до 5 лет, которая приводит к госпитализации 1,76 млн [1] и смерти 128,5 тыс. детей этого возраста ежегодно [2]. Российская Федерация относится к регионам с высоким уровнем заболеваемости острыми кишечными инфекциями (ОКИ). Почти ½ случаев ОКИ установленной этиологии (49%) в 2022 г. приходилась на РВИ. Заболеваемость РВИ в России в 2022 г. составила 61,7 на 100 тыс. населения. Наиболее высокие показатели заболеваемости РВИ в Российской Федерации зарегистрированы среди детей в возрасте 1–2 лет (1063,08 на 100 тыс. населения) и до 1 года (699,21) [3].
Ротавирус (РВ) относится к семейству реовирусов и представляет собой вирус с двухцепочечной РНК (дцРНК). Геном вируса состоит из 11 сегментов дцРНК, кодирующих 6 структурных белков (VP1, VP2, VP3, VP4, VP6 и VP7) и 6 неструктурных белков (NSP1–6). РВ имеет трехслойную оболочку, внутренний слой которой образован белком VP2, средний – VP6, а внешний – белками VP4 и VP7, которые являются главными мишенями вируснейтрализующих антител (ВНА) [4]. VP6-специфические антитела вырабатываются в большом количестве после инфицирования и вакцинации и являются основными антителами, продуцируемыми В-клетками в ответ на РВИ [5].
По данным Референс-центра по мониторингу ОКИ, в 2022 г. на территории Российской Федерации произошло уменьшение удельного веса доминирующего в 2021 г. генотипа G9P[8] и превалирование генотипа G1P[8]. При этом наиболее часто выявляемыми типами РВ были G1P[8], G3P[8], G4P[8], G2P[4], G9P[8] [3, 6, 7].
Специфического лечения ротавирусного гастроэнтерита не существует. Одобренные Всемирной организацией здравоохранения ротавирусные вакцины – это живые пероральные аттенуированные штаммы РВ человеческого и/или животного происхождения: RotaTeq (Merck & Co. Inc., США), Rotarix (GlaxoSmithKline Biologicals, Бельгия), Rotavac (Bharat Biotech International Ltd, Индия) и ROTASIIL (Serum Institute India, Индия). Также существуют две вакцины, одобренные на национальном уровне: Rotavin-M1 (POLYVAC, Вьетнам) и Lanzhou lamb (Lanzhou Institute, Китай). Иммунизация против РВИ на территории Российской Федерации проводится в соответствии с календарем профилактических прививок по эпидемическим показаниям с 2014 г. (Приказ Минздрава России № 125н от 21.03.2014 «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям») двумя пентавалентными вакцинами RotaTeq и Рота-V-Эйд (Индия) [4, 8, 9, 10].
Результаты многолетнего глобального опыта массового применения ротавирусных вакцин доказали их высокую эффективность для профилактики РВИ [4, 8]. При этом частые повторные случаи РВИ были обусловлены тем, что приобретенный постинфекционный и поствакцинальный иммунитет является серотип-специфичным и не всегда способен обеспечить перекрестную защиту. Главной проблемой использования живых аттенуированных вакцин против РВИ является, прежде всего, риск возникновения инвагинации кишечника, возникающий в результате размножения ослабленных живых вакцин в кишечнике человека. Таким образом, актуальной проблемой отечественного здравоохранения является создание безопасной и эффективной вакцины против РВИ с учетом наиболее распространенных генотипов РВ, решение этой проблемы возможно с помощью применения перспективного подхода – получения вирусоподобных частиц (VLP). VLP имеют сходную с нативным вирусом пространственную структуру и антигенные свойства, однако лишены вирусного генетического материала, что обеспечивает их безопасность.
Ранее нами была разработана и оптимизирована технология синтеза 3-слойных VLP, состоящих из белков РВ А: VP2, VP4, VP6, VP7. Полученные частицы содержали белки VP4 и VP7 6 генотипов, наиболее представленных на территории России [14].
На основе полученных VLP РВ А человека была разработана кандидатная вакцина («Гам-VLP-рота») против РВИ. Представленное исследование направлено на изучение безопасности и иммуногенности этой вакцины на новорожденных карликовых свиньях.
Материалы и методы
Исследуемые объекты. Вакцина «Гам-VLP-рота» для внутримышечного введения с адъювантом SEPPIC SWE против РВИ на основе рекомбинантных VLP РВ А человека, состоящих из двух внутренних белков VP2 и VP6 и белков внешнего слоя VP4 и VP7 генотипов G1, G2, G4, G9, P4 P8, актуальных для эпидемических изолятов, которые наиболее распространены в Российской Федерации [11].
Животные. Исследованы новорожденные карликовые свиньи (21♂, 23♀). Животные были получены в АО «НПО «ДОМ ФАРМАЦИИ»; содержались в стандартных условиях в соответствии с Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях [12]. Целесообразность выбора новорожденных поросят карликовых свиней была обусловлена возрастной восприимчивостью (до 6 нед) животных к инфекции. Предполагали использование вакцины преимущественно в педиатрии [13].
Новорожденные поросята были получены от свиноматок, не имеющих антител к РВ А человека. Все животные имели паспорт здоровья и были свободны от патогенной микрофлоры, эндо- и эктопаразитов.
Дизайн исследования
Использовали вакцину с концентрациями антигена 30 и 120 мкг на 1 дозу (мкг/доза), которые планировалось применять в клинических исследованиях, а также с концентрацией антигена 600 мкг/доза для оценки возможного проявления токсических эффектов.
Были сформированы следующие экспериментальные группы: 1-я группа – 11 животных, которым вводили вакцину «Гам-VLP-рота» 30 мкг/доза; 2-я группа – 10 животных, вакцина «Гам-VLP-рота» 120 мкг/доза; 3-я группа – 6 животных, вакцина «Гам-VLP-рота» 600 мкг/доза; 4-я группа – 9 животных, буферный раствор для разведения VLP c адъювантом (носитель); 5-я группа – 8 животных, плацебо (физ. раствор). Животные 1–5-й групп были использованы для оценки безопасности, животные 1, 2 и 5-й групп – для оценки иммуногенности кандидатной вакцины.
Вакцину вводили в объеме 0,5 мл внутримышечно трехкратно, с интервалом 9–10 сут. Первую иммунизацию проводили на 4–5-й день после опороса. Носитель и плацебо вводили аналогично.
Оценка безопасности вакцины против ротавирусной инфекции
Безопасность тестируемой вакцины оценивали на основании данных термометрии, клинического осмотра, динамики массы тела, клинических и биохимических показателей крови, а также некропсии и гистологического исследования животных. Регистрацию массы тела, термометрию и клинический осмотр проводили ежедневно на протяжении всего эксперимента
При клиническом осмотре регистрировали поведение животного, реакцию на раздражители, дыхание, состояние шерстного и кожных покровов, упитанность, состояние слизистых оболочек, данные осмотра места введения, факт гибели и др.
Для оценки биохимических и гематологических показателей производили отбор крови из яремной вены перед каждой иммунизацией и перед каждой эвтаназией в соответствии с Директивой 2010/63/EU от 22.09.2010 Европейского парламента и Совета Европейского союза по охране животных, используемых в научных целях [12]. Определяли основные показатели гематологии и биохимии по стандартным методикам.
Эвтаназия и патоморфологическое исследование
Эвтаназию животных осуществляли на 9–10-е сутки после последней иммунизации в соответствии с Директивой 2010/63/EU от 22.09.2010 Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях [12].
Для исследования безопасности вакцины у эвтанизированных животных проводили патоморфологическое и гистологическое исследования внутренних органов и тканей. Также была проведена макроскопическая оценка кишечника на наличие инвагинаций.
Оценка иммуногенности вакцины против ротавирусной инфекции
При оценке иммуногенных свойств вакцины «Гам-VLP-рота» в дозах 30 и 120 мкг исследовали клеточный, гуморальный и секреторный иммунный ответ.
Оценка секреторного иммунитета
Для изучения секреторного иммунитета проводили определение уровня специфических IgA-антител к белку VP6 в смывах тонкого кишечника с помощью метода непрямого иммуноферментного анализа (ИФА), как описано ранее [14].
Оценка гуморального иммунитета
При оценке гуморального иммунного ответа исследовали уровень специфических IgG-антител к белку VP6 методом непрямого ИФА [14] и уровень ВНА в сыворотке крови поросят, иммунизированных вакциной в дозах 30, 120 мкг, и животных, которым вводили плацебо. Сыворотки отбирали перед каждой иммунизацией и перед плановой эвтаназией.
При оценке уровня ВНА был выбран вариант с множественностью заражения 100 ТЦИД50. Готовили разведения вирусного стока с максимальной инфекционной активностью 6,66 lg ТЦД50/мл. Исследуемые сыворотки разводили в 10, 20, 40, 80, 160, 320, 640 и 1280 раз, соединяли с вышеуказанными разведениями вирусного стока в лунках 96-луночной панели и инкубировали в течение 1 ч при температуре 37 °С. Затем смесь разведенных сывороток с вирусом вносили в 80–90% монослой клеточной линии MARC-145 и через 4–5 сут инкубации при 37 °С и 5% СО2 проводили учет результатов путем микроскопирования монослоя с целью определения цитопатических изменений в клетках. Нейтрализующим титром сыворотки считали то ее наибольшее разведение, при котором еще наблюдается нейтрализация вирусов, предупреждающая образование цитопатического действия в культуре клеток.
Оценка клеточного иммунитета
Оценку клеточно-опосредованного иммунного ответа проводили с помощью реакции бласттрансформации лимфоцитов (РБТЛ) и количественного определения клеток, секретирующих интерфероном (IFN)-γ в ELISpot.
У животных, иммунизированных вакциной в дозах 30, 120 мкг, и группы плацебо на 10-е сутки после 1-й и 2-й иммунизации отбирали периферическую кровь, после 3-й – периферическую кровь, селезенку и брыжеечные лимфатические узлы, выделяли фракцию мононуклеарных клеток [15]. Мононуклеары крови, селезенки и брыжеечных лимфатических узлов помещали в 96-луночные культуральные панели в концентрации 105 клеток в лунку. Антигены-стимуляторы добавляли по 100 мкл в лунку к клеткам до конечных концентраций. Клетки культивировали в полноростовой среде RPMI-1640, с 20% эмбриональной телячьей сывороткой (2 мМ глутамина, 4,5 г/л глюкозы, 50 мкг/мл гентамицина, 0,2 ед/мл инсулина) при 37 °С в атмосфере 5% СО2. Все манипуляции выполняли в стерильных условиях.
Для стимуляции in vitro использовали антигены: суспензию VLP (VP6-VP7 (генотип G2), VP6-VP7 (генотип G1), VP6-VP7 (генотип G9), VP6-VP7 (генотип G4), VP6-VP4 (генотип Р4), VP6-VP4 (генотип Р8)); неспецифический АГ – ККГЛ; адъювант – SEPPIC SWE; буфер TNC (10 мМ Tris–HCl, 140 мМ NaCl, 10 мМ CaCl2, рН 7,4), на котором разводилась суспензия VLP; полноростовую среду. Пролиферацию моноцитов оценивали с помощью РБТЛ через 4 сут с помощью инвертированного микроскопа (увеличение ×400). Результаты реакции выражали в виде индекса стимуляции пролиферации (ИСП) – отношения среднего количества бластов в присутствии стимуляторов к среднему количеству бластов в отсутствие стимуляторов. Положительным считали результат, если ИСП превышает 2.
Количественное определение клеток, секретирующих IFN-γ, проводили с помощью набора Porcine IFN-γ ELISpot (R&D Systems, США) в соответствии с инструкцией производителя.
Анализ данных
Данные были проверены на соответствие закону нормального распределения с помощью критерия Шапиро–Уилка. Для данных, подчиняющихся закону нормального распределения, были подсчитаны среднее значение (М) и ошибка среднего (SEM), которые представлены на диаграммах и в итоговых таблицах вместе со значением n (число наблюдений). Результаты титра антиген-специфических IgA представляли в виде индивидуальных значений, среднего геометрического (GM) и 95% доверительного интервала (95% ДИ).
Для сравнения двух независимых выборок, подчиняющихся нормальному распределению, использовали t-критерий Стьюдента, для данных, не подчиняющихся закону нормального распределения, применяли непараметрический критерий Манна–Уитни. При анализе данных более 2 групп с признаками нормального распределения использовали однофакторный и двухфакторный дисперсионный анализ (ANOVA) с последующим сравнением с помощью критерия Тьюки. Межполовые различия не определяли. Данные самцов и самок считали вместе.
Различия определяли при уровне значимости р < 0,05. Статистический анализ выполняли с помощью лицензионного программного обеспечения GraphPad Prism 9.1.1 (GraphPad Software, США) или Statistica 10.0 (StatSoft, США).
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus Author Guidelines for Animal Use (IAVES, 23 July 2010). Протокол исследования одобрен Этическим комитетом организации (Протокол № 1 от 01.04.2021).
Результаты
Оценка безопасности вакцины «Гам-VLP-рота» против ротавирусной инфекции
Общее состояние животных на протяжении всего периода иммунизации соответствовало норме. Динамика массы тела как интегральный показатель здоровья животных на протяжении всего периода иммунизации во всех группах была положительной (рис. 1).
Нормальная температура тела новорожденных поросят составляет 39–40 °С. По мере взросления в норме температура тела снижается и составляет 37–39 °С. Результаты измерения ректальной температуры тела (рис. 2) свидетельствовали об отсутствии пирогенных свойств исследуемой вакцины.
Рис. 1. Динамика массы тела поросят в период иммунизации.
Fig. 1. Body weight dynamics in newborn pigs during the immunization period.
Рис. 2. Динамика температуры тела поросят в период иммунизации.
Fig. 2. Body temperature dynamics in newborn pigs during the immunization period.
Клинический и биохимический анализ крови (количество эритроцитов, тромбоцитов, лейкоцитов, лимфоцитов, моноцитов, гранулоцитов, уровень гемоглобина, гематокрит, а так же аланинаминотрансфераза (АЛТ), аспартатаминотрансфераза (АСТ), мочевина, общий белок, креатинин, общий холестерин, альбумин (ALB), глобулины (GLOB), отношение ALB/GLOB, триглицериды, общий билирубин, щелочная фосфатаза, глюкоза) проводили перед каждой иммунизацией и перед плановой эвтаназией. При исследовании образцов крови, отобранных перед 1, 2 и 3-й иммунизациями и перед эвтаназией, результаты однофакторного дисперсионного анализа (one-way ANOVA) и анализа при помощи критерия Тьюки не выявили клинически значимых изменений показателей среди всех исследуемых групп, а также статистически значимых отличий показателей крови между опытными и контрольной группами. Таким образом, по результатам клинического и биохимического анализа крови не обнаружено негативного влияния тестируемой вакцины на гематологические и биохимические показатели при трехкратной иммунизации.
Результаты оценки патоморфологических исследований органов и тканей и данные макро- и микроскопического исследования места введения свидетельствовали о безопасности и хорошей местной переносимости вакцины «Гам-VLP-рота». Дополнительная оценка кишечника на предмет инвагинаций не выявила характерных патологических изменений.
Оценка иммуногенности вакцины «Гам-VLP-рота» против ротавирусной инфекции
Результаты определения секреторных IgA-антител в смывах кишечника животных методом ИФА представлены в табл. 1.
Таблица 1. Значения обратного титра антиген-специфических секреторных антител IgA в смывах кишечника. Индивидуальные значения, среднее геометрическое (GM) и 95% доверительный интервал (95% ДИ)
Table 1. Reciprocal values of the titer of antigen-specific secretory IgA antibodies in intestinal lavages. Individual values, geometric mean (GM) and 95% confidence interval (95% CI)
Группа Groupe | Номер животного Animal number | Значение титра IgA IgA titer value |
1-я группа 30 мкг/доза 1st group 30 mcg/dose | 1.6. | 3200 |
1.7. | 100 | |
1.8. | 400 | |
1.9. | 1600 | |
GM (95% ДИ) GM (95% CI) | 672,7 (58,31–7762) | |
2-я группа 120 мкг/доза 2nd group 120 mcg/dose | 2.1. | 1600 |
2.2. | 800 | |
2.3. | 3200 | |
2.4. | 400 | |
GM (95% ДИ) GM (95% CI) | 1131 (272,4–4699) | |
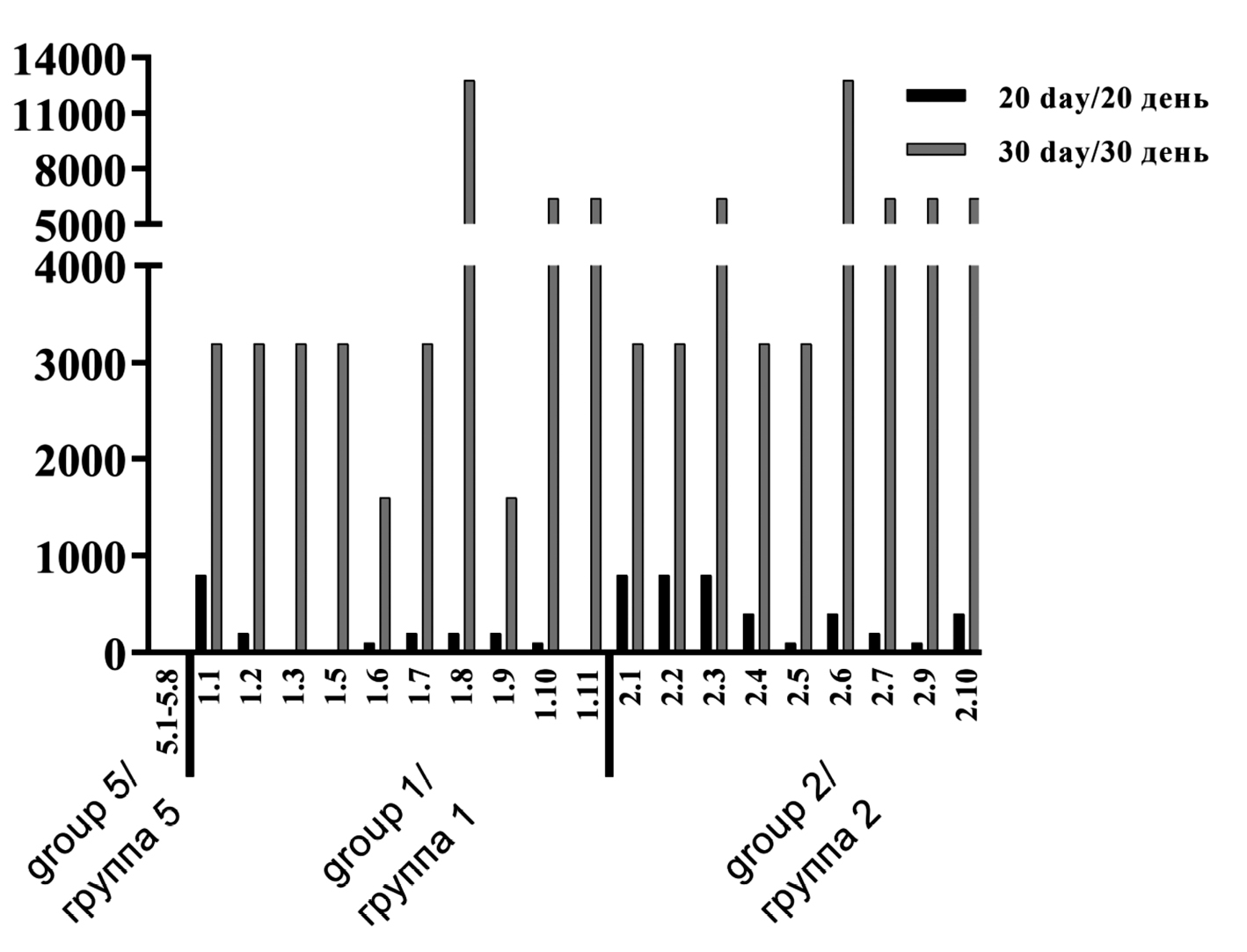
Рис. 3. Титр специфических IgG-антител в сыворотке крови поросят после трехкратной иммунизации.
Fig. 3. Specific IgG antibody titer in the blood serum of newborn pigs after three-time immunization. The X-axis indicates the groups. The Y-axis shows the reciprocal values of the IgG antibody titer. GM (95% CI) on day 20 of immunization – 200 (105.3–379.7) and 342.9 (180.7–650.5), on day 30 of immunization – 3675.8 (2330.5–5797.7) and 5079.7 (3485.3–7403.5) in 1st and 2nd groups, respectively.
Результаты оценки уровня IgA методом ИФА в смывах кишечника свидетельствовали о формировании секреторного иммунного ответа у животных в ответ на трехкратную иммунизацию. Было обнаружено дозозависимое увеличение титра антиген-специфических IgA.
Результаты определения титра специфических IgG-антител представлены на рис. 3. Максимальный титр антител наблюдали после 3-й иммунизации, после 1-й иммунизации титр антиген-специфических антител отсутствовал. Результаты свидетельствовали о формировании устойчивого гуморального иммунного ответа после трехкратной иммунизации вакциной «Гам-VLP-рота» как в дозе 30 мкг, так и в дозе 120 мкг.
Рис. 4. Результаты определения титра вируснейтрализующих антител к ротавирусу А в сыворотке крови поросят, вакцинированных трехкратно.
Fig. 4. Titers of neutralizing antibodies to rotavirus A in the blood serum of newborn pigs vaccinated three times. The X-axis indicates the groups. The Y-axis shows the reciprocal values of serum antibody titers. GM (95% CI) on the 20th day of immunization – 108.9 (59.6–198.8) and 186.6 (130.8–266.3), on the 30th day of immunization – 485.0 (375.5–626.6) and 746.6 (590.3–944.2) in 1st and 2nd groups, respectively.
Результаты определения уровня ВНА свидетельствовали о функциональной способности сформированных антител нейтрализовать РВ А человека (рис. 4). Наблюдали дозозависимое увеличение уровня нейтрализующих антител. Максимальный титр (GM=746) был зарегистрирован после 3-й иммунизации в группе животных, которым вводили вакцину с содержанием антигена 120 мкг/доза.
Реакцию РБТЛ проводили на 10-е сутки после 1, 2 и 3-й иммунизации, средние значения ИСП в крови по группам представлены на рис. 5. Значения ИСП крови, селезенки и брыжеечных лимфоузлов поросят после 3-й иммунизации представлены на рис. 6.
Рис. 5. Реакция бласттрансформации моноцитов периферической крови поросят после 1, 2 и 3-й иммунизации.
По оси абсцисс указаны исследуемые группы. По оси ординат приведены значения ИСП. * – статистически значимые различия p < 0,05.
Fig. 5. Peripheral blood monocytes proliferation response in newborn pigs after the first, second and third immunization. The X-axis indicates the groups. The Y-axis shows the stimulation index values. *– statistically significant differences p < 0.05.
Рис. 6. Реакция бласттрансформации мононуклеаров крови, селезенок и брыжеечных лимфоузлов поросят после 3-й иммунизации.
По оси абсцисс указан предмет исследования: кровь – периферическая кровь поросят; селезенка – селезенки поросят; лимфоузлы – брыжеечные лимфоузлы поросят. По оси ординат приведены значения ИСП. * – статистически значимые различия p < 0,05.
Fig. 6. Proliferation response of mononuclear cells in blood, spleen, and mesenteric lymph nodes in newborn pigs after the third immunization.
The X-axis indicates the types of samples: blood – peripheral blood of newborn pigs; spleen – spleens of newborn pigs; lymph nodes – mesenteric lymph nodes of newborn pigs. The Y-axis shows the stimulation index values. * – statistically significant differences p < 0.05.
Трехкратная иммунизация вакциной «Гам-VLP-рота» в концентрации 120 мкг/доза стимулировала пролиферацию лимфоцитов у поросят, среднее значение ИСП после 1-й иммунизации составило 2,1 ± 0,04, после 2-й – 2,1 ± 0,03, после 3-й – 1,7 ± 0,04. Однако, несмотря на превышение порогового значения после 1-й и 2-й иммунизации, различия у животных экспериментальных групп достоверно не отличались в зависимости от числа иммунизаций, а также по сравнению с группой плацебо, где ИСП составил 1,1 ± 0,1, 1,0 ± 0,1 и 1,3 ± 0,2 соответственно после 1, 2 и 3-й иммунизации (р > 0,05). После 1-й иммунизации исследуемой вакциной в минимальной концентрации (30 мкг/доза) ИСП увеличивался до 1,7 ± 0,3 по сравнению с группой плацебо (ИСП 1,1 ± 0,1), но не достигал порогового значения ИСП, равного 2. Наиболее интенсивная индукция пролиферации, статистически значимо отличающаяся от группы плацебо (р<0,05), была зарегистрирована после 2-й (2,5 ± 0,3) и 3-й (3,4 ± 0,5) иммунизации.
В 1-й группе (30 мкг/доза) после 3-й иммунизации вакциной «Гам-VLP-рота» было отмечено статистически значимое увеличение количества пролиферирующих лимфоцитов в крови (ИСП 4,6 ± 0,6), селезенках (ИСП 3,4 ± 0,6) и брыжеечных лимфоузлах (ИСП 3,6 ± 0,6) по сравнению с группой плацебо (ИСП 1,0 ± 0,1, 1,0 ± 0,1 и 1,3 ± 0,3 соответственно) (р < 0,05). Во 2-й группе (120 мкг/доза) достоверное увеличение ИСП после 3-й иммунизации (до 2,5 ± 0,4) было только в мононуклеарах селезенок по сравнению с группой плацебо (р < 0,05), в то время как увеличение ИСП (до 3,4 ± 0,8) в брыжеечных лимфоузлах не было статистически значимым по сравнению с группой плацебо (р > 0,05).
Результаты РБТЛ показали, что минимальная используемая концентрация (30 мкг/доза) вакцины «Гам-VLP-рота» при введении способна стимулировать пролиферацию моноцитов периферической крови поросят после 2-й и 3-й иммунизации, при этом значение ИСП достоверно увеличивалось в 2,6 раза по сравнению с группой плацебо (р < 0,05). Также только в этой группе отмечалось достоверное и значительное увеличение ИСП после 3-й иммунизации по сравнению с группой плацебо не только в крови, но и в мононуклеарах, выделенных из селезенок (в 3,4 раза) и брыжеечных лимфатических узлов (в 3 раза) (р < 0,05), в то время как во 2-й группе (120 мкг/доза) статистически значимое увеличение ИСП было зарегистрировано только в мононуклеарах, выделенных из селезенок (в 2,5 раза), по сравнению с группой плацебо.
Проводили количественное определение клеток, секретирующих IFN-γ, с помощью набора Porcine IFN-γ ELISpot («R&D Systems», США) в изолированных мононуклеарах селезенок и брыжеечных лимфатических узлов (5 × 105 в лунку). Результаты формирования IFN-γ-секретирующих лимфоцитов в культуре клеток, выделенных из селезенок и брыжеечных лимфатических узлов поросят, на 10-е сутки после 3-й иммунизации, представлены в табл. 2.
Таблица 2. Количество IFN-γ-секретирующих лимфоцитов в культуре клеток, выделенных из селезенок и брыжеечных лимфатических узлов поросят, иммунизированных вакциной «Гам-VLP-рота», на 10-е сутки после 3-й иммунизации
Table 2. The number of IFN-γ-secreting lymphocytes in a culture of cells isolated from the spleens and mesenteric lymph nodes of piglets immunized with the Gam-VLP-rota vaccine on the 10th day after the third immunization
Группа Group | Номер животного Animal ID | Селезенка / Spleen | Лимфоузлы / Lymph nodes | ||
среднее количество «спотов» по животному average number of «spots» per animal | среднее количество «спотов» по группе average number of «spots» per group | среднее количество «спотов» по животному average number of «spots» per animal | среднее количество «спотов» по группе average number of «spots» per group | ||
5-я группа плацебо 5th group placebo | 5.1 | 98 | 74 | 84 | 44 |
5.2 | 85 | 42 | |||
5.3 | 39 | 5 | |||
1-я группа 30 мкг/доза 1st group 30 mcg/dose | 1.6 | 173 | 138 | 156 | 543 |
1.7 | 129 | 1263 | |||
1.8 | 163 | 110 | |||
1.9 | 86 | 644 | |||
2-я группа 120 мкг/доза 2nd group 120 mcg/dose | 2.1 | 286 | 322 | 94 | 65 |
2.2 | 191 | 39 | |||
2.3 | 240 | 34 | |||
2.4 | 571 | 93 | |||
Примечание. Количество окрашенных пятен, соответствующих количеству IFN-γ-секретирующих клеток на 106.
Note. Number of spots corresponding to IFN-γ secreting cells to 106.
Активированные Т-клетки способны синтезировать провоспалительный цитокин IFN-γ, который необходим для элиминации вируса. С помощью метода ELISpot было показано, что IFN-γ-секретирующие клетки появляются в ответ на стимуляцию специфическим антигеном после 3-й иммунизации поросят вакциной «Гам-VLP-рота» в обеих опытных группах. После 3-й иммунизации количество таких клеток во 2-й группе (30 мкг/доза) оказалось в 12 раз больше в мононуклеарах, выделенных из брыжеечных лимфоузлов, и в 2 раза больше в мононуклеарах, выделенных из селезенок, по сравнению с группой плацебо. Наибольшее количество IFN-γ-секретирующих клеток было зарегистрировано у поросят, иммунизированных вакциной «Гам-VLP-рота» в концентрации 120 мкг/доза (2-я группа), в мононуклеарах, выделенных из брыжеечных лимфоузлов и селезенок, но увеличение по сравнению с аналогичной группой плацебо было меньше, чем в группе с введением 30 мкг/доза (в 1,5 и в 4,4 раза соответственно).
Известно, что 1-ю линию защиты от РВИ в кишечнике наряду с факторами гуморального иммунитета представляет клеточный иммунитет. Показано, что в отличие от взрослых дети с ротавирусной диареей имеют крайне низкий уровень ротавирусспецифических Т-клеток и низкий функциональный профиль. В этой связи важно, чтобы кандидатная вакцина против РВИ формировала не только гуморальный, но и клеточный иммунный ответ.
Полученные результаты показали, что поросята, получившие три дозы вакцины в минимальной исследуемой концентрации (30 мкг/доза), потенциально способны к количественному эффективному клеточно-опосредованному иммунному ответу. Клеточный ответ является защитным, что подтверждено достоверно высоким ИСП в реакции РБТЛ при трехкратном введении вакцины: ИСП 3,4 ± 0,5 (кровь); 3,4 ± 0,6 (селезенка) и 4,6 ± 0,6 (лимфоузлы), коррелирующим с интенсивным формированием IFN-γ-секретирующих клеток в селезенке и брыжеечных лимфоузлах.
С целью оценки местно-раздражающего действия проводили ежедневный макроскопический анализ и гистологический анализ места введения (мышца правой задней конечности) животных, не участвующих в заражении и подвергнутых плановой эвтаназии после иммунизации. Макроскопических и микроскопических изменений мышечной ткани после трехкратного введения исследуемых объектов в объеме 0,5 мл/животное не обнаружили, что свидетельствует о хорошей местной переносимости тестируемой вакцины
Обсуждение
Впервые VLP РВ были получены в клетках насекомых с использованием бакуловирусной системы экспрессии в 1987 г. [16]. В дальнейшем для создания VLP РВ были использованы разные системы экспрессии, включая дрожжи [17], бактерии [18], растения [19], клетки насекомых [20] и клетки млекопитающих [21]. VLP, продуцируемые в клетках насекомых, считаются более безопасными, поскольку бакуловирусы не способны реплицироваться в клетках млекопитающих. Кроме того, клетки Sf-9 обычно растут в бессывороточной, не содержащей животных продуктов среде, могут быть идентифицированы с помощью анализа кариотипа и изофермента, свободны от загрязняющих микроорганизмов, случайных агентов, ретровирусов и, как было показано, не являются онкогенными. Считается, что данная технология безопасна и может быть использована для широкомасштабного производства VLP [22].
Результаты многочисленных исследований продемонстрировали, что одновременная экспрессия структурных белков РВ в клетке приводит к образованию VLP путем самосборки. В отсутствие других белков VP2 формирует однослойные частицы. Одновременная коэкспрессия белков VP2 и VP6 приводит к образованию in vivo двухслойных VLP (2/6-VLP), сходных с DLP, тогда как совместная экспрессия VP2, VP6 и VP7 с VP4 или без него приводит к формированию трехслойных VLP (2/6/7-VLP или 2/4/6/7-VLP), напоминающих инфекционные вирусные частицы [23]. Большинство разработанных ротавирусных VLP-вакцин находится на стадии доклинических исследований на разных моделях животных (мыши, кролики, новорожденные поросята). Показана их иммуногенность и разные уровни защиты от последующего заражения вирусом. Эффективность защиты зависела от композиции белков в VLP, способа введения, типа адъюванта и вида животных [19, 24, 25, 26].
На сегодняшний день только одна кандидатная ротавирусная VLP-вакцина проходит I стадию клинических испытаний на людях. Моновалентная вакцина Ro-VLP состоит из белков VP7, VP6 и VP2 генотипа G1P[8] и получена в клетках растения Nicotiana benthamiana. Авторами показана безопасность, хорошая переносимость разработанной вакцины и формирование гомотипических IgG-антител у младенцев через 4 нед после трехкратного внутримышечного введения. Тем не менее вакцина Ro-VLP не вызывала образование вируснейтрализующих гетеротипических антител к генотипам G2P[4], G3P[8], G4P[8], G9P[8], G12P[8] [27].
В настоящей работе нами проведено исследование безопасности и иммуногенности вакцины «Гам-VLP-рота», разработанной на основе VLP, на новорожденных карликовых свиньях. Полученные данные общего состояния животных, клинико-лабораторных и патоморфологических исследований свидетельствуют о безопасности вакцины «Гам-VLP-рота» против РВИ человека при трехкратном внутримышечном введении карликовым свиньям. По данным макро- и микроскопического исследования места введения установлена хорошая местная переносимость тестируемой вакцины. Дополнительная оценка кишечника на предмет инвагинаций как побочного эффекта ряда существующих вакцин для профилактики РВИ не выявила характерных патологических изменений.
Оценка иммуногенных свойств вакцины «Гам-VLP-рота» при трехкратной внутримышечной иммунизации карликовых свиней показывает образование высоких уровней специфических IgG- (в сыворотке) и IgA-антител (в сыворотке и кишечнике), ВНА, а также формирование клеточно-опосредованного иммунного ответа с достоверно высоким ИСП в реакции РБТЛ, коррелирующим с интенсивным формированием IFN-γ-секретирующих клеток. Таким образом, трехкратная внутримышечная иммунизация вакциной «Гам-VLP-рота» формирует выраженный защитный гуморальный, секреторный и клеточный иммунный ответ у карликовых свиней.
About the authors
Ludmila V. Kostina
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Author for correspondence.
Email: lvkostina@mail.ru
ORCID iD: 0000-0002-9556-1454
PhD, Senior Researcher at the Laboratory of Molecular Diagnostics, National Research Center for Epidemiology and Microbiology
Russian Federation, 123098, MoscowIlya E. Filatov
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: filat69rus@yandex.ru
ORCID iD: 0000-0001-5274-224X
Junior Researcher, Laboratory of Molecular Diagnostics
Russian Federation, 123098, MoscowOlesya V. Eliseeva
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: olesenka80@mail.ru
ORCID iD: 0000-0002-0723-9749
PhD, Senior Researcher at the Laboratory of Molecular Diagnostics
Russian Federation, 123098, MoscowOleg E. Latyshev
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: oleglat80@mail.ru
ORCID iD: 0000-0002-5757-3809
PhD, Head Laboratory of Immunology
Russian Federation, 123098, MoscowYana Yu. Chernoryzh
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: revengeful_w@mail.ru
ORCID iD: 0000-0001-9848-8515
PhD, Researcher
Russian Federation, 123098, MoscowKirill I. Yurlov
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: kir34292@yandex.ru
ORCID iD: 0000-0002-4694-2445
Researcher
Russian Federation, 123098, MoscowEkaterina I. Lesnova
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: wolf252006@yandex.ru
ORCID iD: 0000-0002-2801-6843
Researcher
Russian Federation, 123098, MoscowKizkhalum M. Khametova
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: kizkhalum@yandex.ru
ORCID iD: 0000-0002-8461-600X
PhD, Researcher
Russian Federation, 123098, MoscowStanislav A. Cherepushkin
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: cherepushkin1@gmail.com
ORCID iD: 0000-0002-1734-5369
Researcher at the Laboratory of Molecular Diagnostics
Russian Federation, 123098, MoscowTatyana E. Savochkina
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: tasavochkina@yandex.ru
ORCID iD: 0000-0003-4366-8476
Researcher, Laboratory of Molecular Diagnostics
Russian Federation, 123098, MoscowValery V. Tsibezov
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: tsibezov@yandex.ru
ORCID iD: 0000-0003-2150-5764
PhD, Leading Researcher, Laboratory of Specific Prevention Products
Russian Federation, 123098, MoscowKirill L. Kryshen
RMC «HOME OF PHARMACY» JSC
Email: kryshen.kl@doclinika.ru
ORCID iD: 0000-0003-1451-7716
PhD, head of specific toxicity and microbiology department
Russian Federation, 188663, St. PetersburgLiubov I. Alekseeva
RMC «HOME OF PHARMACY» JSC
Email: alekseeva.li@doclinika.ru
ORCID iD: 0000-0002-6510-9897
Junior Researcher, Department of Specific Toxicology and Pharmacodynamics, study director
Russian Federation, 188663, St. PetersburgOlga N. Zaykova
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: zaykova_o_n@mail.ru
ORCID iD: 0000-0003-4708-2069
PhD, senior researcher, Laboratory of Molecular Diagnostics, researcher in Diagnostic and Prevention
Russian Federation, 123098, MoscowTatyana V. Grebennikova
National Research Center for Epidemiology and Microbiology named after Honorary Academician N.F. Gamaleya of the Ministry of Health of the Russian Federation
Email: t_grebennikova@mail.ru
ORCID iD: 0000-0002-6141-9361
Dr Sci. (Biol.), Professor, Corresponding Member RAS, Head Laboratory of Molecular Diagnostics Head of the Testing Center, Deputy Director for Science
Russian Federation, 123098, MoscowReferences
- Hallowell B.D., Chavers T., Parashar U., Tate J.E. Global estimates of rotavirus hospitalizations among children below 5 years in 2019 and current and projected impacts of rotavirus vaccination. J. Pediatric Infect. Dis. Soc. 2022; 11(4): 149–58. https://doi.org/10.1093/jpids/piab114
- Troeger C., Khalil I.A., Rao P.C., Cao S., Blacker B.F., Ahmed T., et. al. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatr. 2018; 172(10): 958–65. https://doi.org/10.1001/jamapediatrics.2018.1960
- State report «On the state of sanitary and epidemiological welfare of the population in the Russian Federation in 2022». Moscow; 2023. (in Russian)
- Omatola C.A., Olaniran A.O. Rotaviruses: from pathogenesis to disease control – a critical review. Viruses. 2022; 14(5): 875. https://doi.org/10.3390/v14050875
- Vetter V., Gardner R.C., Debrus S., Benninghoff B., Pereira P. Established and new rotavirus vaccines: a comprehensive review for healthcare professionals. Hum. Vaccin. Immunother. 2022; 18(1): 1870395. https://doi.org/10.1080/21645515.2020.1870395
- Ivashechkin A.A., Yuzhakov A.G., Grebennikova T.V., Yuzhakova K.A., Kulikova N.Y., Kisteneva L.B., et al. Genetic diversity of group A rotaviruses in Moscow in 2018-2019. Arch. Virol. 2020; 165(3): 691–702. https://doi.org/10.1007/s00705-020-04534-5
- Yuzhakov A., Yuzhakova K., Kulikova N., Kisteneva L., Cherepushkin S., Smetanina S., et al. Prevalence and genetic diversity of group a rotavirus genotypes in Moscow (2019-2020). Pathogens. 2021; 10(6): 674. https://doi.org/10.3390/pathogens10060674
- Namazova-Baranova L.S., Fedoseenko M.V., Kalyuzhnaya T.A., Shakhtakhtinskaya F.Ch., Tolstova S.V., Sel’vyan A.M. New possibilities of preventive immunization for rotavirus infection in Russian Federation. Overview of the innovative rotavirus vaccine profile. Pediatricheskaya farmakologiya. 2022; 19(6): 492–502. https://doi.org/10.15690/pf.v19i6.2489 https://elibrary.ru/zrbuqq (in Russian)
- Rotavirus vaccines: WHO position paper – July 2021. Wkly Epidemiol. Rec. 2021; 96(28): 301–20.
- Skansberg A., Sauer M., Tan M., Santosham M., Jennings M.C. Product review of the rotavirus vaccines ROTASIIL, ROTAVAC, and Rotavin-M1. Hum. Vaccin. Immunother. 2021; 17(4): 1223–34. https://doi.org/10.1080/21645515.2020.1804245
- Cherepushkin S.A., Tsibezov V.V., Yuzhakov A.G., Latyshev O.E., Alekseev K.P., Altaeva E.G., et al. Synthesis and characterization of human rotavirus A (Reoviridae: Sedoreovirinae: Rotavirus: Rotavirus A) virus-like particles. Voprosy virusologii. 2021; 66(1): 55–64. https://doi.org/10.36233/0507-4088-27 https://elibrary.ru/eersag (in Russian)
- Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes; 2010.
- Latyshev O.E., Eliseeva O.V., Kostina L.V., Alekseev K.P., Khametova K.M., Altaeva E.G., et al. Assessment of immunogenic activity of the cloned human rotavirus A WA strain. Voprosy virusologii. 2019; 64(4): 156–64. https://doi.org/10.36233/0507-4088-2019-64-4-156-164 https://elibrary.ru/sckbyy (in Russian)
- Filatov I.E., Tsibezov V.V., Balandina M.V., Norkina S.N., Latyshev O.E., Eliseeva O.V., et al. Virus-like particles based on rotavarus A recombinant VP2/VP6 proteins for assessment the antibody immune response by ELISA. Voprosy virusologii. 2023; 68(2): 161–71. https://doi.org/10.36233/0507-4088-169 https://elibrary.ru/aywqhn (in Russian)
- Stepanova O.I., Karkishchenko V.N., Klesov R.A., Stankova N.V., Agel’dinov R.A., Savina M.A. Method for separating lymphoid cells (mononuclear cells) from the blood of mini-pigs. Biomeditsina. 2020; 16(3): 54–9. https://doi.org/10.33647/2074-5982-16-3-54-59 https://elibrary.ru/ggmvjo (in Russian)
- Estes M.K., Crawford S.E., Penaranda M.E., Petrie B.L., Burns J.W., Chan W.K., et al. Synthesis and immunogenicity of the rotavirus major capsid antigen using a baculovirus expression system. J. Virol. 1987; 61(5): 1488–94. https://doi.org/10.1128/jvi.61.5.1488-1494.1987
- Li T., Lin H., Zhang Y., Li M., Wang D., Che Y., et al. Improved characteristics and protective efficacy in an animal model of E. coli-derived recombinant double-layered rotavirus virus-like particles. Vaccine. 2014; 32(17): 1921–31. https://doi.org/10.1016/j.vaccine.2014.01.093
- Rodríguez-Limas W.A., Tyo K.E., Nielsen J., Ramírez O.T., Palomares L.A. Molecular and process design for rotavirus-like particle production in Saccharomyces cerevisiae. Microb. Cell. Fact. 2011; 10: 33. https://doi.org/10.1186/1475-2859-10-33
- Kurokawa N., Lavoie P.O., D’Aoust M.A., Couture M.M., Dargis M., Trépanier S., et al. Development and characterization of a plant-derived rotavirus-like particle vaccine. Vaccine. 2021; 39(35): 4979–87. https://doi.org/10.1016/j.vaccine.2021.07.039
- Molinari P., Peralta A., Taboga O. Production of rotavirus-like particles in Spodoptera frugiperda larvae. J. Virol. Methods. 2008; 147(2): 364–7. https://doi.org/10.1016/j.jviromet.2007.09.002
- Lee J.M., Chung H.Y., Kim K.I., Yoo K.H., Hwang-Bo J., Chung I.S., et al. Synthesis of double-layered rotavirus-like particles using internal ribosome entry site vector system in stably-transformed Drosophila melanogaster. Biotechnol. Lett. 2011; 33(1): 41–6. https://doi.org/10.1007/s10529-010-0390-x
- Laura A., Palomares O.T.R. Challenges for the production of virus-like particles in insect cells: the case of rotavirus-like particles. Biochem. Eng. J. 2009; 45(3): 158–67. https://doi.org/10.1016/j.bej.2009.02.006
- Changotra H., Vij A. Rotavirus virus-like particles (RV-VLPs) vaccines: An update. Rev. Med. Virol. 2017; 27(6). https://doi.org/10.1002/rmv.1954
- Istrate C., Hinkula J., Charpilienne A., Poncet D., Cohen J., Svensson L., et al. Parenteral administration of RF 8-2/6/7 rotavirus-like particles in a one-dose regimen induce protective immunity in mice. Vaccine. 2008; 26(35): 4594–601. https://doi.org/10.1016/j.vaccine.2008.05.089
- Azevedo M., Vlasova A., Saif L. Human rotavirus virus-like particle vaccines evaluated in a neonatal gnotobiotic pig model of human rotavirus disease. Expert Rev. Vaccines. 2013; 12(2): 169–81. https://doi.org/10.1586/erv.13.3
- El-Attar L., Oliver S.L., Mackie A., Charpilienne A., Poncet D., Cohen J., et al. Comparison of the efficacy of rotavirus VLP vaccines to a live homologous rotavirus vaccine in a pig model of rotavirus disease. Vaccine. 2009; 27(24): 3201–8. https://doi.org/10.1016/j.vaccine.2009.03.043
- Kurokawa N., Robinson M.K., Bernard C., Kawaguchi Y., Koujin Y., Koen A., et al. Safety and immunogenicity of a plant-derived rotavirus-like particle vaccine in adults, toddlers and infants. Vaccine. 2021; 39(39): 5513–23. https://doi.org/10.1016/j.vaccine.2021.08.052
Supplementary files