Том 69, № 5 (2024)
- Год: 2024
- Выпуск опубликован: 09.11.2024
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/136
Весь выпуск
ОБЗОРЫ
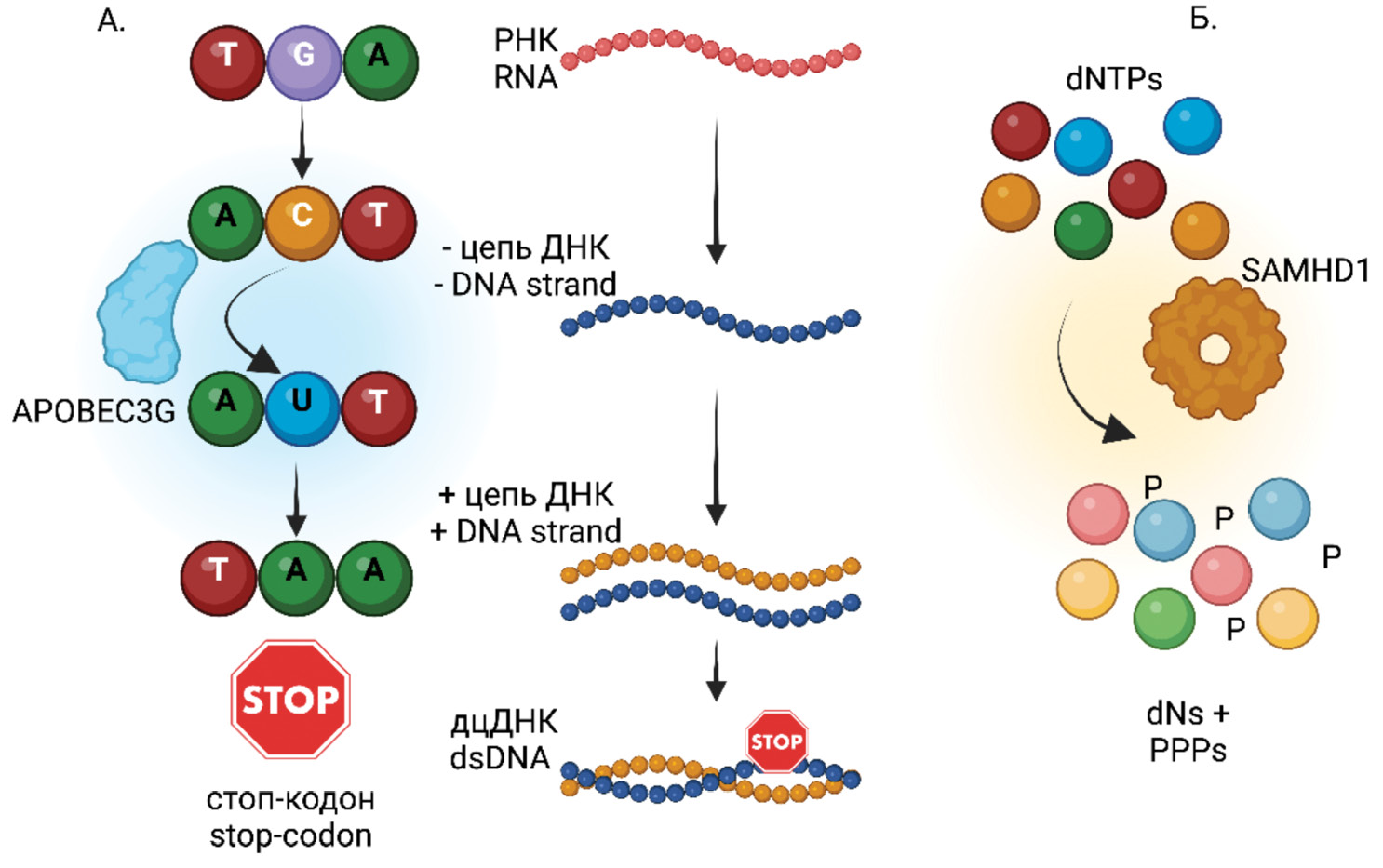
Дефектные провирусы ВИЧ: возможное участие в патогенезе ВИЧ-инфекции
Аннотация
Обзорная статья содержит анализ информации, полученной в результате поиска литературы по теме «дефектные геномы ВИЧ (ВИЧ, Human immunodeficiency virus-1, Lentivirus, Orthoretrovirinae, Retroviridae)». Рассматриваются вопросы происхождения дефектных геномов ВИЧ, возможность их транскрипции и трансляции, участие дефектных РНК и белков в стимуляции естественного и адаптивного иммунитета, вклад в патогенез ВИЧ-инфекции и гиперактивацию иммунной системы в условиях успешной антиретровирусной терапии (АРТ), эволюционные процессы в популяции провирусов ВИЧ под действием АРТ, возможные проблемы разработок элиминации резервуаров и эрадикации ВИЧ, связанные с существованием дефектных ВИЧ.
 399-414
399-414


Гладконосые летучие мыши (семейство Vespertilionidae) как возможный резервуар лисса- и коронавирусов в Западной Сибири и на юге европейской части России
Аннотация
В обзоре приведены современные данные относительно хироптерофауны, обитающей в Западной Сибири и на юге европейской части России. Дана общая характеристика рода лиссавирусов и семейства коронавирусов. Рассмотрен потенциал вирусоносительства в отношении лисса- и коронавирусов в популяциях рукокрылых двух географически отдаленных регионов.
 415-428
415-428


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Пререгистрированный мета-метаанализ глобального распространения гепатотропных вирусов
Аннотация
Введение. Гепатотропные вирусы (ВГА, ВГВ, ВГС, ВГD и ВГЕ) значительно влияют на мировое здравоохранение при их различной распространенности в разных регионах мира.
Цель исследования. Настоящее исследование направлено на систематическую консолидацию данных из разных метаанализов для оценки распределения и распространенности гепатотропных вирусов.
Материалы и методы. Следуя рекомендациям PRISMA, в исследовании использовали модель смешанных эффектов для интеграции данных. Оценку качества проводили с использованием инструментов QUOROM и AMSTAR, с оценкой гетерогенности по статистикам I2 Хиггинса, Q-статистике и значениям тау квадрат (τ2).
Результаты. В исследование проанализированы 86 метаанализов из 56 исследований (2017–2022 гг.) с минимальным перекрытием. Распространенность по регионам была следующей: MENA – 29,2%, Афганистан – 9,14%, Африка – 8,10%. Распространенность подгрупп вирусов: ВГА – 82,5%, ВГВ – 8,6%, ВГС – 15,1%, ВГD – 8,9%, ВГЕ – 13,9%, двойная коинфекция ВГВ/ВГС – 2,2%. Распространенность по группам риска: общее население – 8,3%, медицинские работники – 4,0%. Распространенность ВГВ/ВГС по континентам: Африка – 9,2%, Китай – 6,9% и др. Распространенность ВГС среди групп риска: медицинские работники – 5,58%, пациенты на гемодиализе – 34,8%. Региональные показатели распространенности ВГС: Африка – 7,42%, Ближний Восток – 25,30%.
Заключение. Различия паттернов распространенности гепатотропных вирусов в разных регионах мира обусловлены вляинием многих факторов. Для стран MENA более высокие показатели распространенности связаны с проблемами в здравоохранении, в то время как для Африки наибольшей проблемой являются ограниченные ресурсы. Необходимы индивидуализированные стратегии общественного здравоохранения, включая вакцинацию и информационно-просветительские кампании, для смягчения бремени и улучшения мирового здравоохранения. Полученные консолидированные данные о распространенности гепатотропных вирусов послужат ценным источником информации для принятия обоснованных решений.
 429-440
429-440


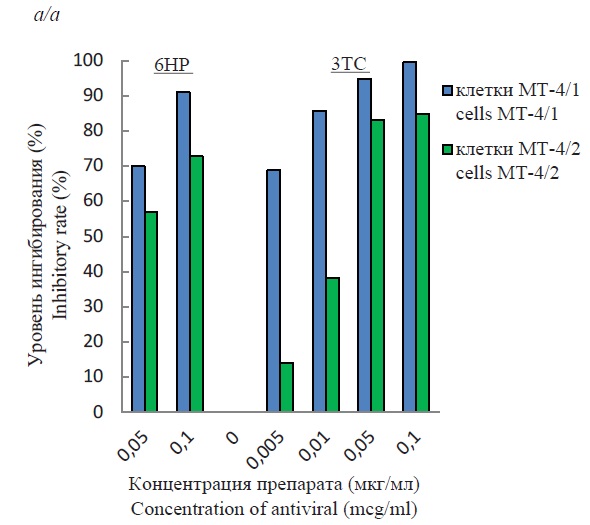
Оценка анти-ВИЧ-1 (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodeficiency virus type 1) активности 6НР и 3ТС in vitro с использованием вариантов клеточной линии МТ-4 с различной репликативной активностью
Аннотация
Введение. Химиотерапия ВИЧ-инфекции остается единственным средством лечения болезни. Процесс создания новых и усовершенствование созданных ранее препаратов являются по-прежнему приоритетным направлением. Одним из доклинических этапов испытания эффективности лекарственных средств является исследование in vitro в модельной системе «вирус‒клетка».
Цель исследования. Изучить противовирусную эффективность нуклеозидных ингибиторов обратной транскриптазы (НИОТ) 6НР и 3ТС при репликации ВИЧ-1 в неопластической линии клеток МТ-4.
Материалы и методы. Использовали два варианта клеточной линии CD4+ Т-лимфоцитов МТ-4 (МТ-4/1 и МТ-4/2), трансформированных Т-лимфотропным вирусом человека 1-го типа (Retroviridae: Orthoretrovirinae: Deltaretrovirus: HTLV-1), с разным уровнем репликации ВИЧ-1. Для подавления вируса использовали препараты аммоний-3’-азидо-3’-дезокситимидин-5’-карбомоилфосфонат (6НР) и 2´,3´-дидезокси-3´-тиацитидин (3ТС).
Результаты и обсуждение. Репликативная активность ВИЧ-1 для разных штаммов вируса была выше в линии МТ-4/2, чем в линии МТ-4/1. Использование каждого из противовирусных веществ по отдельности показало более существенное ингибирование вирусной активности в клетках МТ-4/1, чем в клетках МТ-4/2. При комбинированном использовании антивирусный эффект был во всех случаях практически одинаков и колебался в пределах 87‒96% для линии МТ-4/1 и 83‒89% для линии МТ-4/2. Высокая эффективность наблюдалась при совместном использовании меньших концентраций препаратов по сравнению с индивидуальным применением.
Заключение. Сочетанное использование НИОТ 6НР и 3ТС является перспективным для лечения ВИЧ-инфицированных пациентов на разных сроках инфекции и с различным уровнем вирусной нагрузки.
 441-448
441-448


Мутации в гене UL97 цитомегаловируса (Orthoherpesviridae: Herpesvirales: Cytomegalovirus: Cytomegalovirus humanbeta 5) увеличивают продолжительность виремии и снижают противовирусный ответ у реципиентов аллогенных гемопоэтических стволовых клеток
Аннотация
Введение. Цитомегаловирус (Orthoherpesviridae: Herpesvirales: Cytomegalovirus: Cytomegalovirus humanbeta 5) (ЦМВ) является одним из наиболее распространенных вирусов, детектируемых у реципиентов аллогенных гемопоэтических стволовых клеток (алло-ГСК). При этом возможность развития резистентности вируса к противовирусным препаратам, таким как ганцикловир (GCV), создает сложности при проведении противовирусной терапии (ПВТ). Настоящее исследование позволяет обосновать необходимость внедрения новых диагностических подходов для улучшения результатов лечения у реципиентов алло-ГСК.
Цель исследования – изучение распространенности и влияния мутаций в гене UL97 ЦМВ, ассоциированных с устойчивостью к действию GCV, на характер течения инфекции у реципиентов алло-ГСК.
Материалы и методы. В исследование вошли 14 реципиентов алло-ГСК с подозрением на устойчивую ЦМВ-инфекцию. Проводили амплификацию участка гена UL97 методом гнездовой полимеразной цепной реакции, осуществляли секвенирование по Сэнгеру, последовательности сравнивали со штаммом Merlin (дикий тип).
Результаты и обсуждение. Выявлено 6 мутаций (D490A, T502A, C592G, C592F, E596G и C603W), из которых 4 (C592G, C592F, E596G и C603W) ранее были описаны как ассоциированные с устойчивостью к действию противовирусных препаратов, а D490A и T502A обнаружены впервые. При сравнении параметров пациентов – носителей вируса дикого типа и носителей мутантного варианта, установлено, что основные показатели периферической крови у первых были достоверно ниже. Медиана срока наступления пика вирусной нагрузки после трансплантации алло-ГСК, продолжительность виремии и скорость вирусологический ответа на ПВТ также имели достоверные различия в исследуемых группах.
Заключение. Показано, что почти у 1/3 (4 из 14) реципиентов алло-ГСК выявлены мутации, ассоциированные с устойчивостью к действию GCV. У реципиентов – носителей мутантного варианта ЦМВ наблюдались более длительные виремия и срок получения отрицательного результата вирусологического исследования после начала ПВТ. Проведение генотипирования может способствовать принятию более обоснованного терапевтического решения.
 449-458
449-458


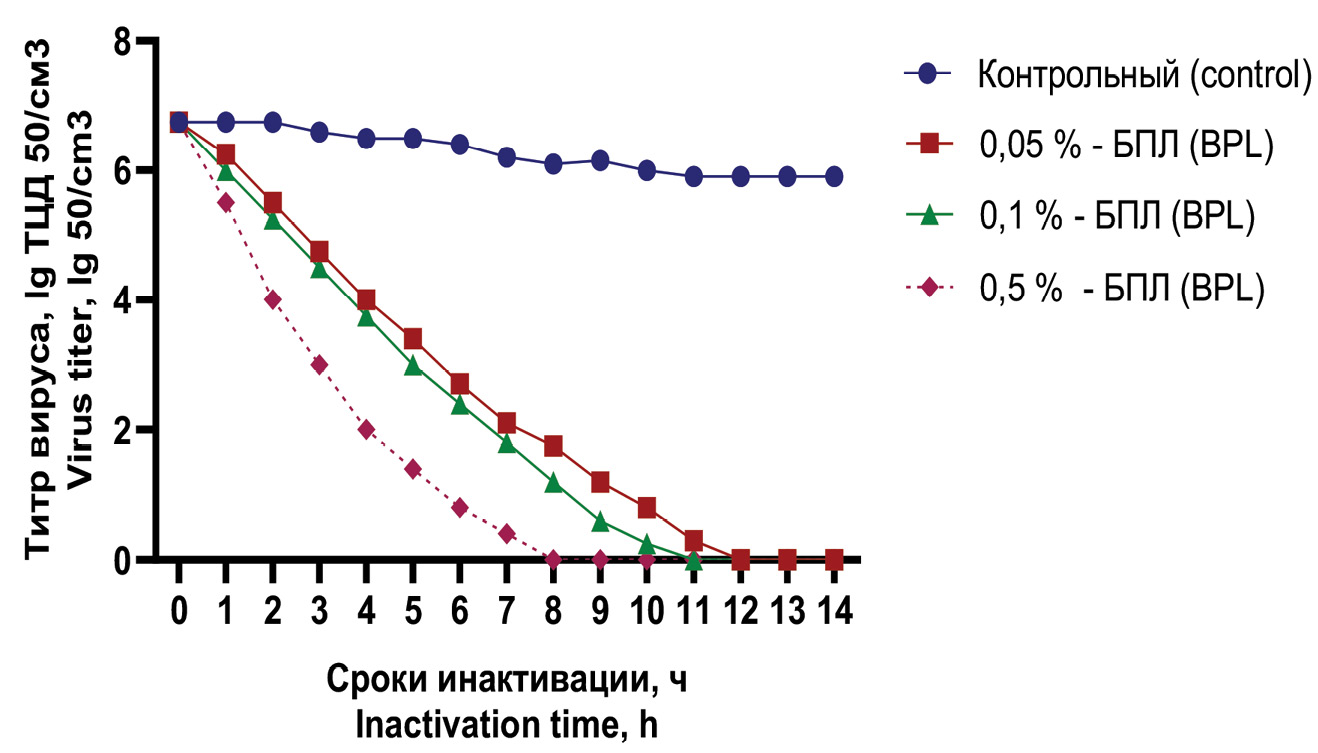
Оценка эффективности химической инактивации и иммуногенности варианта Омикрон вируса SARS-CoV-2
Аннотация
Введение. Быстрое распространение новой коронавирусной инфекции (COVID-19) среди населения многих стран мира способствовало появлению множества генетических вариантов вируса SARS-CoV-2. По сравнению с предыдущими вариантами коронавируса, новые субварианты варианта Омикрон продемонстрировали заметную степень мутации. Инактивация вируса является одним из наиболее важных этапов разработки инактивированных вакцин. В качестве химического инактиванта в настоящее время используют β-пропиолактон и формальдегид, однако не существует единого стандарта для проектирования и определения процесса инактивации.
Цель работы. Оценка и сравнение эффективности химической инактивации двух агентов: формальдегида и β-пропиолактона в отношении иммуногенности варианта Омикрон вируса SARS-CoV-2.
Материалы и методы. Для получения варианта Омикрон вируса SARS-CoV-2 использованы назофарингеальные мазки. Для выделения, репродукции, титрования вируса, а также постановки реакции нейтрализации использовали культуру клеток Vero. Проведена кинетика изучения инактивации вируса химическими агентами: формальдегидом и β-пропиолактоном.
Результаты. Проведены исследования по сравнительной оценке эффективности химических инактивантов, используемых для инактивации варианта Омикрон вируса SARS-CoV-2, планируемого для использования в изготовлении инактивированной цельновирионной вакцины. В качестве инактивантов использованы формальдегид и β-пропиолактон в концентрациях 0,05, 0,1, 0,5% от общего объема суспензии вируса. Установлено, что полная инактивация вируса формальдегидом в использованных концентрациях при температуре 37 °С происходит в течение 2 ч, а при использовании β-пропиолактона ‒ в течение 12 ч.
Заключение. Образцы вируса, инактивированные использованными инактивантами, обладают разной антигенной активностью в зависимости от концентрации инактивантов. Наиболее выраженная антигенная активность проявляется у образцов возбудителя, которые подвергались обработке инактивантом в щадящей концентрации, равной 0,05%. Повышение концентрации инактивантов в 5 раз и более кратно приводит к значимому снижению антигенности вируса SARS-CoV-2. При использованных режимах инактивации потеря биологической активности вируса происходит быстрее, антигенность сохраняется в большей степени при обработке формальдегидом.
 459-469
459-469


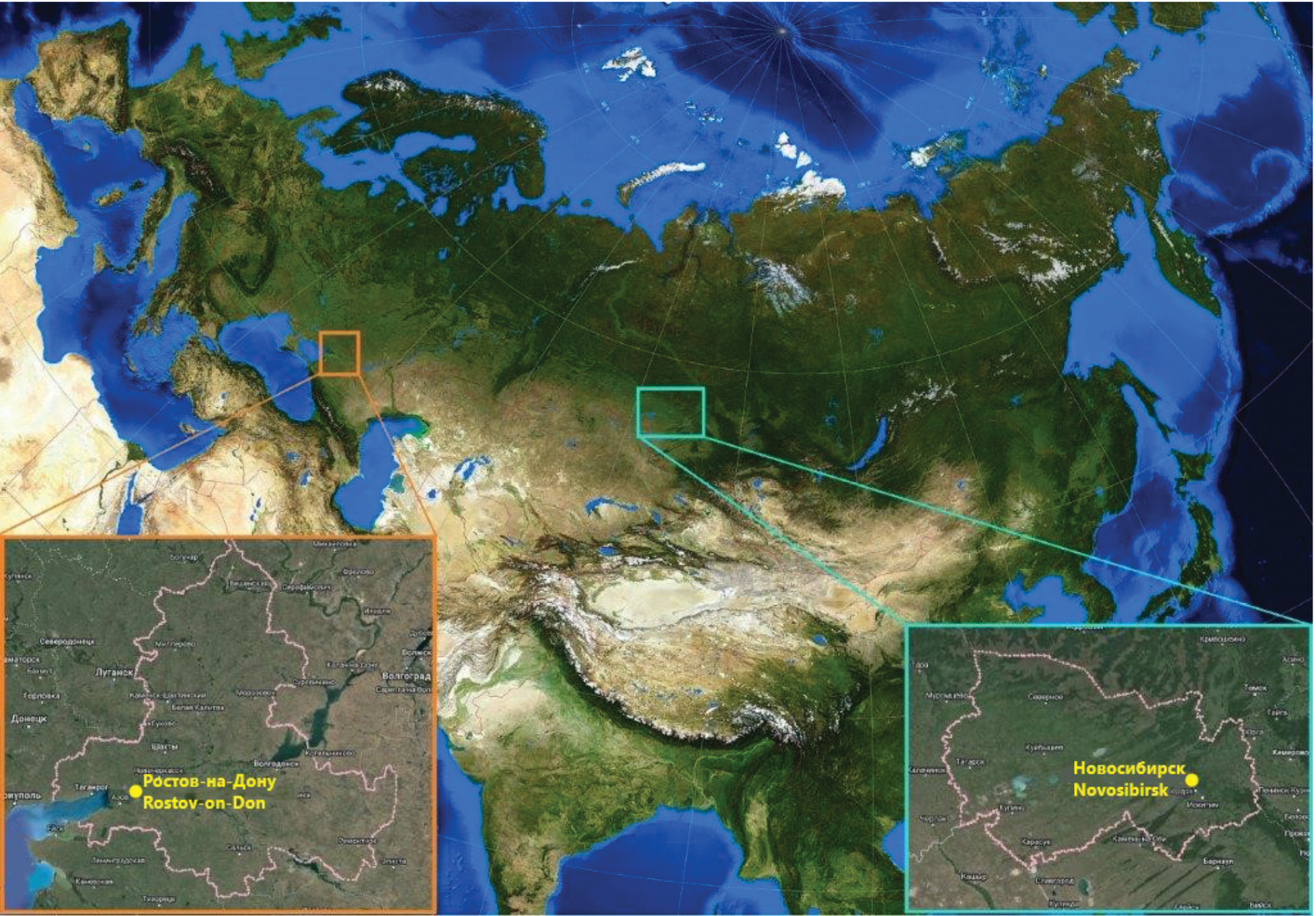
Вариабельность неструктурных белков у вариантов ВИЧ-1 суб-субтипа А6 (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodeficiency virus-1, sub-subtype A6), циркулирующих в разных регионах Российской Федерации
Аннотация
Введение. Неструктурные белки ВИЧ-1 являются перспективными мишенями для разработки вакцин и для создания подходов персонализированной медицины. На протяжении многих лет на территории Российской Федерации доминирует суб-субтип А6 ВИЧ-1. Однако имеющиеся географические, экономические и демографические особенности страны могут способствовать формированию различий между вариантами вируса, циркулирующими в разных регионах России.
Цель работы: провести сравнительный анализ консенсусных последовательностей неструктурных белков ВИЧ-1 вариантов А6, циркулирующих в Амурской области, в гг. Архангельске, Иркутске и Мурманске.
Материалы и методы. Исследовали 48 образцов цельной крови, которые были получены от ВИЧ-инфицированных пациентов без опыта приема терапии, наблюдавшихся в центрах по профилактике и борьбе со СПИДом в гг. Архангельске, Иркутске, Мурманске и в Амурской области. Получали полногеномные нуклеотидные последовательности ВИЧ-1, субтипировали. Формировали консенсусные последовательности каждого неструктурного белка ВИЧ-1 для каждого анализируемого региона. Дополнительно формировали референсные последовательности неструктурных белков ВИЧ-1 суб-субтипа А6 на основе полногеномных последовательностей, загруженных из международной базы данных Los Alamos. Сравнение консенсусных и референсных последовательностей осуществляли с помощью программ MEGA v.10.2.2 и PSIPRED.
Результаты. Впервые представлены референсные последовательности белков Vif, Vpr и Nef ВИЧ-1 суб-субтипа А6. Для белка Vpr различий в консенсусных последовательностях вариантов вируса, циркулирующих в разных регионах РФ, не обнаружено. Для консенсусных последовательностей белков Tat, Rev, Vpu, Vif и Nef вариантов ВИЧ-1 из разных регионов РФ определены характерные особенности.
Заключение. Ограничением проведенного исследования является небольшая выборка образцов. В целом полученные результаты указывают на существующее разнообразие неструктурных белков ВИЧ-1 суб-субтипа А6 в разных регионах страны и обозначают актуальность исследования полиморфизма неструктурных белков вариантов вируса в разных регионах в будущем.
 470-480
470-480


Сравнительный анализ полногеномных последовательностей изолятов вируса африканской чумы свиней (Asfarviridae: Asfivirus), выделенных на территории левобережья Днепра в 2023 году
Аннотация
Введение. Отсутствие данных о полногеномных последовательностях возбудителя африканской чумы свиней (АЧС), циркулирующего на территории левобережья Днепра, ограничивает понимание динамики молекулярной эволюции вируса и характера развития текущего эпизоотического процесса в центральной России и Украине. Определение степени генетической дивергентности и филогенетического родства вируса АЧС во многом может скорректировать стратегию общей и специфической профилактики болезни.
Цель работы – поиск и описание уникальных точечных мутаций (делеций/инсерций/замен) у изолятов, выделенных от домашних свиней на территории Донецкого, Луганского и Запорожского регионов в 2023 г.; установление родства и уровня гомологии с референтными штаммами вируса АЧС генотипа II; субгенотипирование на основе маркерных областей генома.
Материалы и методы. В качестве образцов использовали культуральную суспензию костного мозга свиньи, содержащую вирус АЧС. Подготовку геномной ДНК выполняли методом очистки и концентрирования вируса с последующей экстракцией тотальной нуклеиновой кислоты фенол-хлороформным методом. Процесс высокопроизводительного секвенирования осуществляли с помощью технологии MGI. Сборку консенсусных последовательностей проводили методом картирования прочтений на референс-геном штамма Georgia 2007/1.
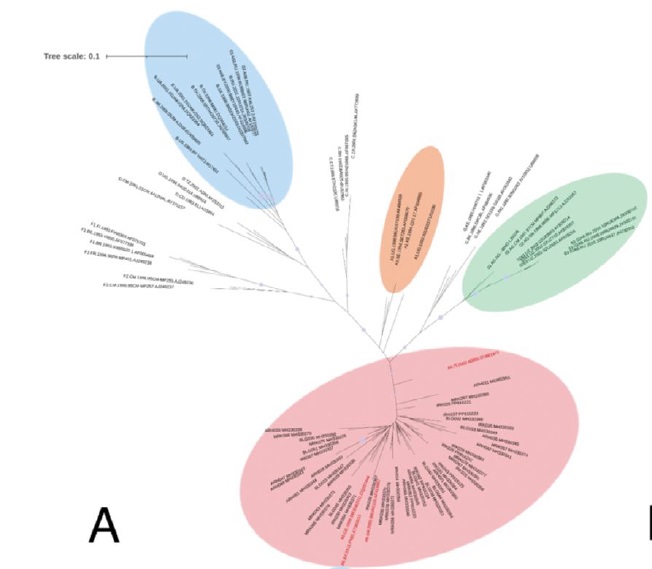
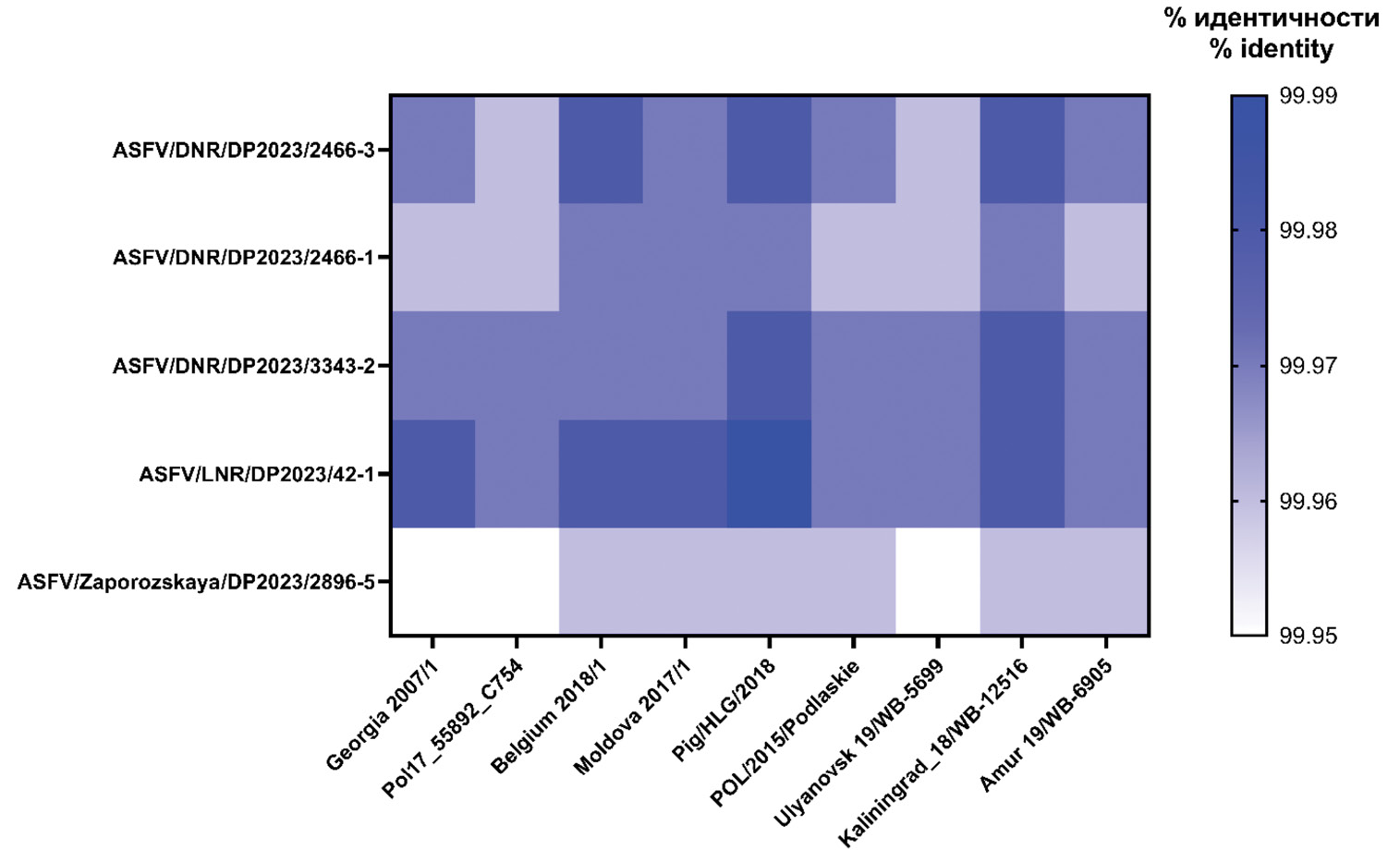
Результаты. Все изоляты отнесены к генотипу II, имеют монофилетическое происхождение, филогенетически относятся к кластерам «Европа» (4/5) и «Брянск 2021» (1/5), а также являются дивергентными от исходных родительских генетических вариантов, составляющих укрупненные клады. Кроме того, обнаружены многочисленные замены в локусах мультигенного семейства MGF 110, 505 и 360, кодирующих факторы вирулентности.
Заключение. На примере изучения филогении показана достоверная для дифференциации вариабельность вируса АЧС генотипа II, происходящего от референс-штамма Georgia 2007/1. Представленные данные обладают теоретической и практической значимостью при усовершенствовании национального и международного надзора за АЧС.
 481-494
481-494