Development of a method for detection of specific antibodies to E protein of yellow fever virus (Flaviviridae: Flavivirus) by enzyme immunoassay
- Authors: Krivosheina E.I.1, Kartashov M.Y.1,2, Naidenova E.V.3, Ushkalenko N.D.1, Pyankov S.A.1, Ternovoi V.A.1, Loktev V.B.1
-
Affiliations:
- FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
- Novosibirsk State University
- FSSI Russian Research Anti-Plague Institute «Microbe» of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
- Issue: Vol 67, No 4 (2022)
- Pages: 341-350
- Section: TO VIROLOGIST’S AID
- URL: https://virusjour.crie.ru/jour/article/view/635
- DOI: https://doi.org/10.36233/0507-4088-123
- ID: 635
Cite item
Full Text
Abstract
Introduction. Yellow fever (YF) remains one of the most common natural focal infectious diseases in the world. In connection with the increasing tourist flow to countries endemic for YF, the discovery of stable populations of Aedes aegypti and Ae. albopictus which are the main vectors of the yellow fever virus (YFV), in the southern regions of Russia, and the fact that in medical institutions in our country it is possible to obtain a live attenuated vaccine against YF, but there is no way to evaluate the effectiveness of vaccination, the question arises of the development and implementation of diagnostic kits for detecting antibodies (AB) to the pathogen by enzyme immunoassay (ELISA).
The aim of this study was to develop a method for detecting specific IgG antibodies to the E protein of YFV by ELISA and assessing its diagnostic characteristics.
Materials and methods. A specific cDNA was synthesized by reverse transcription on an RNA template of YFV isolated on a cell culture of Aedes albopictus clone C6/36, and a fragment of the genome coding the YFV E protein was amplified and subsequently cloned into the plasmid pET160 (Thermo Fisher Scientific, USA). The resulting gene fragment was used as a DNA template to obtain a recombinant analog of the third domain of the YFV E protein in Escherichia coli cells (BL-21(DE3)). Next, the immunogenicity of the obtained antigen was evaluated and the analysis conditions were optimized.
Results. The optimal conditions for the production of the obtained recombinant E protein of YFV were determined, its specificity was confirmed by immunological methods (Western blot and ELISA), sorption buffers and blocking solutions were selected, and sensitivity and specificity of detection of antibodies to YFV using the recombinant antigen were assessed.
Conclusion. A method for the detection of specific IgG antibodies to the YFV E protein by ELISA was developed. This diagnostic kit can be used both to study the protective properties of the YF vaccine and to detect imported cases of infection in non-endemic areas.
Full Text
Введение
Жёлтая лихорадка (ЖЛ) – острая природно-очаговая арбовирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя [1–4], которым является одноименный вирус, относящийся к семейству Flaviviridae. Территориями, где выявлена циркуляция вируса ЖЛ (ВЖЛ), являются регионы Африки, расположенные к югу от Сахары, а также Центральной и Южной Америки. Основные переносчики возбудителя – комары рода Aedes, в основном Ae. aegypti и Ae. albopictus, обитают как на эндемичных территориях (Африка и Южная Америка), так и в регионах Европы с тёплым климатом [5].
Специалистами Всемирной организации здравоохранения (ВОЗ) разработана стратегия по ликвидации эпидемий ЖЛ (The Eliminate Yellow fever Epidemics (EYE)), которая применяется и поддерживается в 40 странах Африки, Южной и Северной Америки. Целью создания такой программы являются эпидемиологический контроль за данной инфекцией и массовая вакцинация населения, проживающего в поражённых районах, в которой, по прогнозам, к 2026 г. примут участие более 1 млрд человек. Ежегодно ВОЗ публикует перечень стран, где существует риск возникновения вспышек ЖЛ, а также список государств, при въезде в которые требуется наличие международного свидетельства о вакцинации против ЖЛ для путешественников.
В настоящее время проблема распространения ВЖЛ является актуальной и для Российской Федерации. Так, в районе г. Сочи (Краснодарский край) были обнаружены местные популяции комаров Ae. aegypti и Ae. albopictus [6, 7]. После долгого отсутствия комары Ae. aegypti вновь зарегистрированы на территории Черноморского побережья Кавказа и в Крыму. В случае заноса возбудителя не исключена возможность возникновения вспышки ЖЛ и на этих территориях [8, 9]. Также всё большую популярность среди населения приобретают туристические направления в экзотические страны и регионы, где при въезде необходим международный сертификат о вакцинации против ЖЛ. По данным Роспотребнадзора Российской Федерации, в 2021 г. живой аттенуированной вакциной против ЖЛ производства Института полиомиелита и вирусных энцефалитов имени М.П. Чумакова (Москва) было вакцинировано более 11 тыс. россиян [10]. Но в то же время наборы реагентов для выявления специфических антител (IgM и IgG) к ВЖЛ и оценки эффективности иммунизации ни одной отечественной компанией не производятся.
По данным литературы, в настоящее время в мире зарегистрировано не более 10 диагностических препаратов, позволяющих выявлять специфические антитела классов IgM или IgG к ВЖЛ, но все они рекомендованы исключительно для научных исследований. Также есть ограничения по использованию данных тестов для выявления антител у вакцинированных людей [11]. На территории Российской Федерации разрешены к применению 6 коммерческих наборов для выявления антител IgM/IgG к возбудителю ЖЛ производства компании Euroimmun (Германия), которые основаны на использовании метода непрямой иммунофлуоресценции специфических антител. Ограничениями для широкого использования этих тестов являются сложность интерпретации результатов, небольшое количество одновременно анализируемых проб (до 10) и высокая стоимость, по сравнению с другими препаратами для диагностики ВЖЛ.
Одним из широко используемых методов для выявления как вирусных антигенов, так и специфических антител к возбудителю, является иммуноферментный анализ (ИФА), который обладает рядом преимуществ перед традиционными иммунологическими реакциями:
- высокая чувствительность;
- специфичность и воспроизводимость результатов;
- возможность получения количественных данных;
- автоматизация всех этапов постановки.
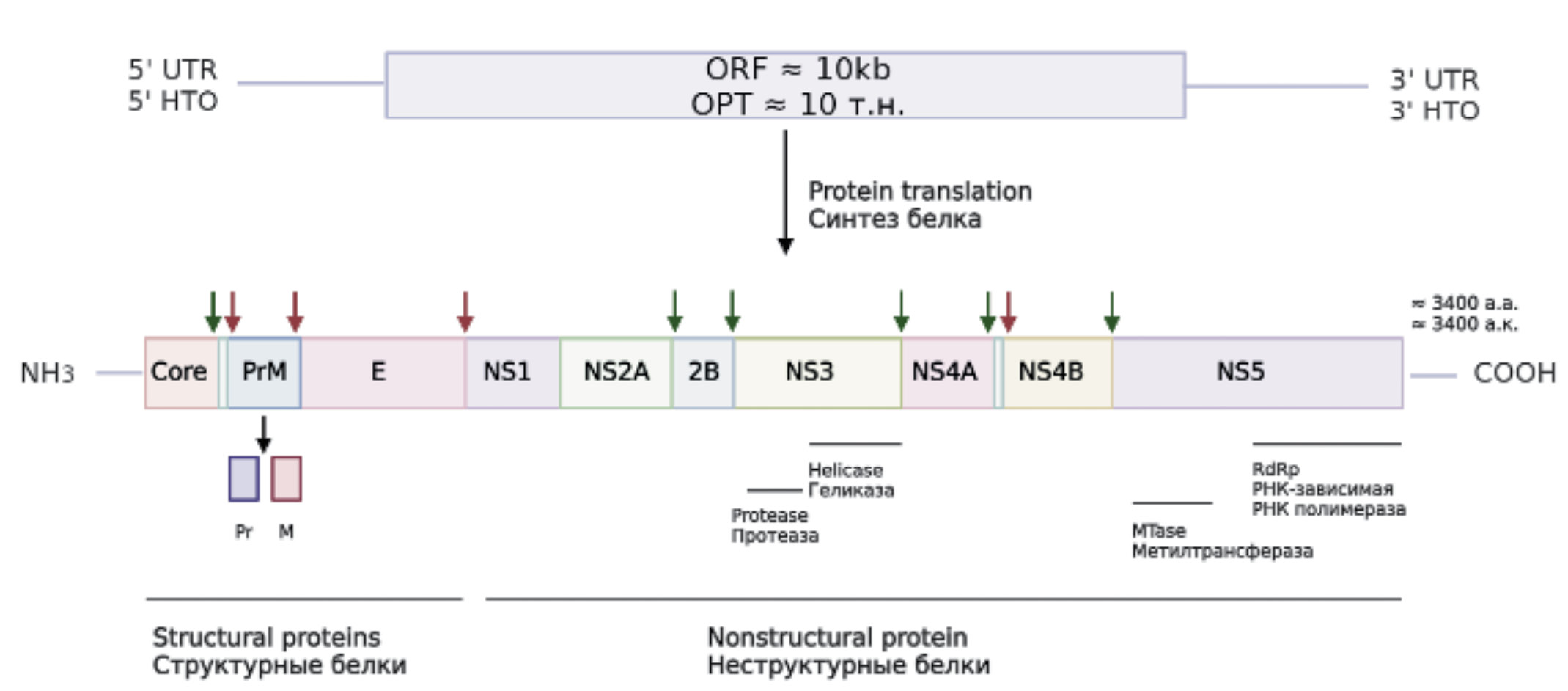
В связи с этим вопрос разработки и внедрения в практику препаратов для оценки качества иммунизации и диагностики ЖЛ, основанных на использовании метода ИФА, является очень актуальным. Для создания таких диагностических наборов необходимо использовать антигенные белки, способные высокоспецифично связываться с иммуноглобулинами классов IgM и IgG в организме инфицированного, переболевшего или вакцинированного человека. В составе вирусного генома ВЖЛ имеются 3 гена, кодирующие белки Е, NS1 и NS3, которые способны индуцировать иммунный ответ в организме (рис. 1). Белок Е отвечает за начальные фазы инфицирования клеток-хозяев, а также является основной мишенью для иммунного ответа хозяина. Белки NS1 и NS3 связаны с инфицированной клеткой и также являются мишенями для иммунной элиминации. Антитела к белку NS1 связывают компоненты системы комплемента и способствуют формированию защитного иммунитета, лизируя инфицированные клетки [5].
Рис. 1. Схематичное изображение вирусной РНК и полипротеинов вируса жёлтой лихорадки. Стрелки указывают сайты расщепления в полипротеине, которые процессируются протеазами клеточного (красные стрелки) или вирусного происхождения (зелёные стрелки).
Белок E флавивирусов состоит из трёх отдельных доменов, которые соединены короткими гибкими шарнирными областями. Первый является центральным и соединяет два других; второй представляет собой удлинённую структуру, которая обеспечивает димеризацию белков E в зрелом вирионе [12]; а третий принимает иммуноглобулин-подобную складку на С-конце и также представляет собой ту часть белка E, которая выступает дальше всего от поверхности зрелого вириона и, предположительно, содержит сайты связывания для клеточных факторов, участвующих в прикреплении и проникновении вируса в клетку [13].
Согласно литературным данным, все три домена белка E распознаются нейтрализующими антителами, хотя и с сильно варьирующей активностью [1]. Показано, что третий домен белка Е ВЖЛ имеет особенности аминокислотного состава, которые отличают его от аналогичных белковых структур других флавивирусов [14]. Эти различия являются уникальными для ВЖЛ и представляют собой типоспецифичные эпитопы нейтрализации для отдельных флавивирусов, и поэтому данный участок белка можно использовать для специфической серодиагностики ВЖЛ.
Целью нашего исследования была разработка способа выявления специфических антител класса IgG к белку Е ВЖЛ методом ИФА. В работе описаны этапы получения и очистки рекомбинантного аналога третьего домена белка E ВЖЛ, оптимизации его сорбирования на полистироловых планшетах и тестирование полученного набора реагентов.
Материалы и методы
Вирус. В работе использовали вакцинный штамм 17D ВЖЛ, который нарабатывали на клеточной культуре Aedes albopictus C6/36, полученной из коллекции культур клеток ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора [15].
Получение кДНК (комплементарная дезоксирибонуклеиновая кислота) ВЖЛ. Выделение суммарных нуклеиновых кислот и постановка реакции обратной транскрипции производились с использованием коммерческих наборов «РИБО-преп» и «Реверта-100-L» (ФГУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора), согласно инструкциям производителя.
ПЦР (полимеразная цепная реакция) и секвенирование. Дизайн олигонуклеотидных праймеров осуществляли при помощи программы PerlPrimer v. 1.1.21 [16], используя известные нуклеотидные последовательности геномов ВЖЛ, доступные в базе данных GenBank [17]. Анализ вставок проводили c праймерами, комплементарными плазмидной ДНК с обоих концов от вставки (табл. 1). Продукты амплификации секвенировали по обеим цепям модифицированным методом Сэнгера на основе капиллярного электрофореза на автоматическом секвенаторе 3130xl GeneticAnalyzer (Applied Biosystems, США). Полученные нуклеотидные последовательности анализировали с использованием пакета программ UniproUGENE v.1.30 [18] и MEGA7 [19].
Таблица 1. Перечень олигонуклеотидных праймеров, использованных в работе
Table 1. List of oligonucleotide primers used in the study
Праймер Primer | Структура Structure | Длина фрагмента (bp) Fragment length(bp) | Температура отжига (°С) Annealing temperature (°С) |
E3F | 5’CACCGCCGCCACTATCAGAGTACTGG 3’ | 480 | 57 |
E3R | 5’CTTTCCTATTGARCTTCCCTCTTTGTGC 3’ | ||
pET-F | 5’GACTCACTATAGGGGAATTGTGAGC 3’ | 338 | 54 |
pET-R | 5’CTAGTTATTGCTCAGCGGTGGC 3’ |
Получение гибридной плазмиды и клонов-продуцентов. Для клонирования использовали 2 мкл свеженаработанного ампликона и 0,5 мкл вектора pET160-TOPO по инструкции производителя (Thermo Fisher Scientific, США). Выделение плазмидной ДНК осуществляли, используя «Набор diaGene для выделения плазмидной ДНК из бактерий» («ДИАЭМ», Россия). Гибридной плазмидой трансформировали компетентные клетки Escherichia coli штамма BL21 (DE3) (Thermo Fisher Scientific, США) и засевали на чашки Петри с агаризованной средой LB (AppliChem, Германия) с ампициллином в концентрации 100 мкг/мл в качестве селективного маркера. Полученные клоны-продуценты анализировали по уровню экспрессии после индукции изопропил-β-D-1-тиогалактопиранозидом (ИПТГ) методом электрофореза в 15% полиакриламидном геле (ПААГ) с SDS по Лэммли [20].
Выделение рекомбинантного белка. Очистку белка осуществляли из клеточного осадка, полученного из 500 мл бактериальной культуры, индуцированной ИПТГ, коммерческим набором His-Spin Protein Miniprep (Zymo Research, США).
Подбор оптимальных условий сорбирования антигена. Полученный очищенный рекомбинантный белок сорбировали на полистироловых планшетах для ИФА (Thermo Fisher Scientific, США) в трёх сорбционных растворах: ацетатном (pH 4,5), карбонатном (pH 11,5) и карбонатно-бикарбонатном (pH 9,6). Блокировку осуществляли двумя разными растворами: сахарозой или пептоном с казеином. Подробный состав буферов представлен в табл. 2.
Таблица 2. Сорбционные и блокирующие растворы
Table 2. Sorption and blocking solutions
Наименование буфера Buffer name | Состав Composition | pH |
Ацетатный Acetate | 1М CH3COOH | 4,5 |
Карбонатный Carbonate | Na2CO3, NaN3 | 11,5 |
Карбонатно-бикарбонатный Carbonate-bicarbonate | Na2CO3, Na2HCO3 | 9,6 |
Раствор для блокировки 1 Blocking solution 1 | 0,1% казеин (casein), 1% сахароза (sucrose) | – |
Раствор для блокировки 2 Blocking solution 2 | 0,1% казеин (casein), 1% пептон (peptone) | – |
Отработка схемы ИФА. Твердофазный ИФА проводили в два этапа. Исследуемые образцы инкубировали с антигеном, сорбированным на полистироловые планшеты (в разведении 1 : 500) и после пятикратной отмывки от несвязавшегося с антигеном материала инкубировали с конъюгатом против IgG человека. Затем после второй пятикратной отмывки от необразовавшихся иммунных комплексов производили визуализацию результатов ИФА путём добавления раствора хромогена. После внесения стоп-реагента учитывали результаты реакции на планшетном ридере MultiscanGO (Thermo Fisher Scientific, США) при длине волны 450 нм с референс-волной при 630 нм.
Постановка вестерн-блоттинга. Предварительно выполняли электрофоретическое разделение белка в денатурирующих условиях в 12% ПААГ. Далее переносили белки из геля на нитроцеллюлозную мембрану с использованием спиртового Tris-HCl-буфера (pH 8,0) и камеру для полусухого переноса. Результат детектировали окраской мембраны пунцовым S. Блоттинг осуществляли в вакуум-системе SNAPID (Millipore, США). Блокировку мембраны проводили 1% раствором бычьего сывороточного альбумина (BSA) в фосфатно-солевом буфере с добавлением 0,1% твина 20 (ФСБ-Т). После выполняли последовательные инкубации с сыворотками и конъюгатом антител против иммуноглобулинов человека с щелочной фосфатазой (Sigma, США), затем мембрану отмывали раствором ФСБ-Т. Хромогенную реакцию выполняли готовым субстратом BCIP/NBT (Sigma, США). Реакцию останавливали отмывкой дистиллированной водой. Полученные после анализа мембраны высушивали и учитывали результаты блота в гель-документирующей системе iBright CL750 (Thermo Fisher Scientific, США). Обработку полученных изображений проводили с помощью программного обеспечения Invitrogeni Bright Analysis Software (Thermo Fisher Scientific, США).
Используемые сыворотки. Перечень сывороток крови людей, используемых в настоящем исследовании, указан в табл. 3. Присутствие или отсутствие антител в сыворотках было подтверждено следующими коммерческими диагностическими препаратами: набор реагентов для выявления антител класса IgG к ВЖЛ методом ИФА Human Yellow Fever Virus IgG (YFV-IgG) (Abbexa, Великобритания); набор реагентов для выявления антигена NS1 вирусов денге и специфических антител IgM/IgG методом иммунохроматографического анализа (ИХА) Dengue fever rapid diagnostic test (Dengue Duo) (SD BIOLINE, Южная Корея); набор реагентов для иммуноферментного выявления и количественного определения иммуноглобулинов класса G к вирусу клещевого энцефалита «ВектоВКЭ-IgG» (№ РЗН 2017/5605) и набор реагентов для иммуноферментного выявления иммуноглобулинов классов G и M к вирусу гепатита С «Бест анти-ВГС» (№ РЗН 2015/2352) («ВекторБЕСТ», Россия).
Таблица 3. Образцы использованных в исследовании сывороток крови людей
Table 3. Human serum samples used in the study
Исследуемый материал Tested samples | Количество образцов Number of samples |
Сыворотки крови людей, вакцинированных против ВЖЛ (Российская Федерация) Sera of people vaccinated against YFV (Russian Federation) | 30 |
Сыворотки крови больных и переболевших ЛД (Российская Федерация) Sera of patients and recovered from DENV (Russian Federation) | 10 |
Сыворотки крови людей, вакцинированных против ВКЭ (Российская Федерация) Sera of people vaccinated against TBEV (Russian Federation) | 10 |
Сыворотки крови больных ВГС (Российская Федерация) Sera of patients with HCV (Russian Federation) | 10 |
Сыворотки крови людей, у которых отсутствуют антитела к ВЖЛ, ЛД, ВКЭ и ВГС (Российская Федерация) Sera of people who do not have antibodies to YFV, DENV, TBEV and HCV (Russian Federation) | 30 |
Сыворотки крови людей с неизвестным иммунным статусом по ВЖЛ (Гвинейская Республика) Sera of people with unknown immune status for YFV (Republic of Guinea) | 250 |
Примечание. ВЖЛ – вирус жёлтой лихорадки; ЛД – лихорадка денге; ВКЭ – вирус клещевого энцефалита; ВГС – вирус гепатита С.
Note. YFV – yellow fever virus; DENV – dengue virus; TBEV – tick-borne encephalitis virus, HCV – hepatitis C virus.
Статистическую обработку данных проводили с использованием программного обеспечения Microsoft Excel.
Исследование проводилось при информированном согласии пациентов. Протокол исследования сывороток крови жителей Гвинейской Республики одобрен решением Этического комитета Гвинейской Республики (протокол № 129/CNERS/16 от 31 августа 2015 г.).
Результаты и обсуждение
В результате генно-инженерных манипуляций была получена гибридная плазмида pET160-E3, содержащая открытую рамку считывания, кодирующую фрагмент гена белка Е длиной 221 а.о. с шестью остатками гистидина, что обеспечивает последующее выделение белка на Ni-хелатном носителе и остатками полилинкера векторной плазмиды pET160 под контролем промотора фага T7.
Клонированный фрагмент гена белка Е ВЖЛ использовали в качестве ДНК-матрицы для получения рекомбинантного аналога третьего домена в клетках E. coli (штамм BL-21 (DE3)). Штамм, трансформированный плазмидной ДНК pET160-E3, культивировали в 100 мл жидкой питательной среды LB с добавлением ампициллина (100 мкг/мл), после чего добавляли индуктор Lac-оперона ИПТГ в различных концентрациях (0,1, 1 и 10 мМ) и культивировали при разных температурах (25, 30 и 37°С при покачивании на 180 об/мин) с отбором проб в трёх временных точках: до индукции, через 5 и 18 ч после добавления ИПТГ. Выбор клонов-продуцентов проводили по наличию экспрессируемого белка методом электрофореза в 15% ПААГ (рис. 2) с SDS. В серии экспериментов показано, что максимальная продукция рекомбинантного белка происходит на 18-й час инкубации при температуре 25°С после добавления индуктора в конечной концентрации 1 мМ/мл.
Рис. 2. Электрофореграмма лизатов клеток E. coli BL-21 (DE3) и очищенного рекомбинантного белка в 15% ПААГ-электрофорезе с SDS: 0 – до индукции ИПТГ; 1–7 – инкубация при 25°С при различных условиях: 1–3 инкубация в течение 5 ч после добавления ИПТГ в концентрациях 0,1, 1 и 10 мМ соответственно; 4–6 – инкубация в течение 18 ч после добавления ИПТГ в концентрациях 0,1, 1 и 10 мМ соответственно; 7 – спустя 18 ч после добавления ИПТГ 1 мМ/мл; 8 – очищенный рекомбинантный белок. Стрелкой обозначено положение рекомбинантного белка Е ВЖЛ. М – маркер; ИПТГ – изопропил-β-D-1-тиогалактопиранозид; ВЖЛ – вирус жёлтой лихорадки.
После подбора оптимальных условий получения рекомбинантного белка Е ВЖЛ в составе лизатов клеток E. coli была произведена его наработка в 500 мл культуральной среды LB (при температуре 25°C 180 об/мин в течение 18 ч после добавления ИПТГ (в конечной концентрации 1 мМ/мл)) и дальнейшая очистка на Ni-хелатном носителе. Гомогенность и степень очистки белка определяли также с помощью электрофореза в 15% ПААГ с SDS. Полученный рекомбинантный белок представлен единичной полосой с молекулярной массой ≈23,5 кДа (рис. 2).
Для определения специфичности взаимодействия полученного рекомбинантного антигена и антител к ВЖЛ, а также её отсутствия к антителам других флавивирусов нами был проведён ряд экспериментов с использованием вестерн-блот-анализа и ИФА.
Исследование в вестерн-блот-анализе показало специфичное взаимодействие образца сыворотки крови, содержащей антитела к ВЖЛ, с иммобилизованным на нитроцеллюлозной мембране рекомбинантным вирусным антигеном. Окрашивание происходило в зоне соответствия молекулярной массы и не наблюдалось в двух контрольных полосках на нитроцеллюлозных мембранах, обработанных сыворотками крови, в которых отсутствовали антитела к ВЖЛ (рис. 3).
Рис. 3. Результаты выявления очищенного антигена методом вестерн-блоттинга: дорожка 1 – обработанная сывороткой, содержащей антитела к вирусу денге; дорожка 2 – обработанная сывороткой, не содержащей антитела к ВЖЛ, ВКЭ, ВГС, вирусу денге; дорожка 3 – обработанная сывороткой крови с антителами к ВЖЛ. Стрелкой обозначено положение рекомбинантного белка Е ВЖЛ. ВЖЛ – вирус жёлтой лихорадки; ВКЭ – вирус клещевого энцефалита; ВГС – вирус гепатита С.
Следующим этапом работы были подбор оптимальных условий для сорбции очищенного рекомбинантного белка Е ВЖЛ на полистироловых планшетах и выбор подходящего блокирующего буфера. Для сорбирования полученный препарат разводили 1 : 500 в трёх сорбционных растворах – ацетатном, карбонатном и карбонатно-бикарбонатном. В качестве блокирующих буферов использовали два варианта растворов казеина – с сахарозой или пептоном. Далее был проведён ИФА с использованием сыворотки крови (в разведении 1 : 100), имеющей антитела к ВЖЛ.
Как показано на графике (рис. 4), при использовании ацетатного сорбционного буфера оптическая плотность при образовании иммунных комплексов рекомбинантного антигена и антител к ВЖЛ составляла 0,209 о.е. при использовании блокирующего раствора «казеин + сахароза», а с блокирующим раствором «казеин + пептон» – 0,230 о.е. При сорбировании рекомбинантного антигена с использованием карбонатного буфера и блокировки раствором «казеин + сахароза» чувствительность достигала 1,333 о.е., а при блокировании раствором «казеин + пептон» – 0,753 о.е. Аналогичные показатели для карбонатно-бикарбонатного буфера составляли 0,512 и 0,487 о.е. для блокирующих растворов «казеин + сахароза» и «казеин + пептон» соответственно. Таким образом, было показано, что оптимальными условиями для обеспечения высокого уровня специфичности рекомбинантного антигена и антител к ВЖЛ является использование карбонатного сорбционного буфера и блокирующего раствора, в состав которого входят казеин и сахароза.
Рис. 4. Результаты иммуноферментного анализа для определения оптимальных условий для сорбции рекомбинантного антигена вируса жёлтой лихорадки (разведение сыворотки крови 1 : 100).
Оценка антигенных свойств полученного рекомбинантного аналога третьего домена белка E ВЖЛ проведена с использованием сформированной панели образцов сывороток крови людей (табл. 3)
Диагностическую чувствительность определяли с использованием панели сывороток крови людей, вакцинированных против ВЖЛ, при проведении ИФА с применением анти-IgG-конъюгата. Положительный результат выявлен в 100% случаев. Таким образом, диагностическая чувствительность сконструированного нами экспериментального набора реагентов для выявления IgG к ВЖЛ составила не менее 98% с доверительной вероятностью 90%.
Для определения специфичности разработанной методики тестировали сыворотки крови людей, которые не были вакцинированы против ЖЛ. При исследовании всех образцов был получен отрицательный результат. Диагностическая специфичность составила не менее 99%.
В твердофазном ИФА все пробы от вакцинированных против ВЖЛ были положительными, и величина оптической плотности (ОП) колебалась от 0,599 до 2,820 (при ОПкрит. = 0,260). Положительных образцов среди групп сравнения не выявлено.
Проведено сравнение эффективности коммерческого набора реагентов Human Yellow FeverVirusIgG (YFV-IgG) (Abbexa, Великобритания) и экспериментальной ИФА тест-системы. Для этого использовали 30 сывороток крови, полученных от вакцинированных против ВЖЛ в разные годы, 1 – от пациента с диагнозом «лихорадка денге», 1 – от пациента с диагнозом «гепатит С» и 1 – от пациента с отсутствием антител к вышеперечисленным вирусам. Сыворотки тестировали в разведении 1 : 100. При анализе сывороток, содержащих антитела к ВЖЛ, как с использованием коммерческого набора, так и разработанного нами лабораторного варианта ИФА тест-системы иммуноглобулины класса IgG к ВЖЛ были обнаружены во всех исследуемых пробах. Сыворотки сравнения показали отрицательный результат при их исследовании двумя тест-системами.
Апробация экспериментальной тест-системы была проведена на 250 образцах сывороток крови жителей Гвинейской Республики, которая является эндемичной по ЖЛ и в которой ежегодно регистрируются случаи заболеваний. В связи с тем, что на данной территории широко распространены и возбудители малярии, полученный материал перед основными исследованиями был протестирован методом ИХА для выявления антигенов малярийных плазмодиев с наборами реагентов SD BIOLINE Malaria Ag P.f/Pan (Standart Diagnostics, Inc., Республика Южная Корея). Образцы, в которых присутствовали антигены возбудителей малярии, в последующую работу не были включены для исключения получения неспецифических результатов. При проведении исследований было выявлено 34,8% положительных проб, содержащих антитела класса IgG к ВЖЛ.
Заключение
В результате проведённых исследований была сконструирована плазмида, содержащая фрагмент гена иммуногенного белка E ВЖЛ в бактериальной системе E. coli, на основании которой создан штамм-продуцент белка, содержащего антигенные детерминанты ВЖЛ, и получен рекомбинантный антиген. Специфичность и чувствительность полученных препаратов подтверждена иммунологическими методами, в результате показано, что искусственно созданный аналог белка Е обладает антигенными свойствами и даёт возможность определять специфические антитела к ВЖЛ в сыворотках вакцинированных людей. Показано, что полученный рекомбинантный антиген не имеет перекрёстных реакций с другими флавивирусами (вирусами денге, клещевого энцефалита и гепатита С).
Таким образом, был разработан способ выявления специфических антител класса IgG к белку Е ВЖЛ методом ИФА, проведена оптимизация условий анализа, сконструированы экспериментальные серии препарата. Данный диагностический набор может быть использован для изучения протективных свойств вакцины от ЖЛ, а также для идентификации случаев инфекции.
About the authors
Ekaterina I. Krivosheina
FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mikkartash@yandex.ru
ORCID iD: 0000-0001-5181-0415
Russian Federation, Koltsovo, Novosibirsk region
Mikhail Y. Kartashov
FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor); Novosibirsk State University
Author for correspondence.
Email: mikkartash@yandex.ru
ORCID iD: 0000-0002-7857-6822
Ph.D. (Biol.), Senior Researcher, Department of Molecular Virology of Flaviviruses and Viral Hepatitis
Russian Federation, Koltsovo, Novosibirsk region; NovosibirskEkaterina V. Naidenova
FSSI Russian Research Anti-Plague Institute «Microbe» of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mikkartash@yandex.ru
ORCID iD: 0000-0001-6474-3696
Russian Federation, Saratov
Nikita D. Ushkalenko
FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mikkartash@yandex.ru
ORCID iD: 0000-0002-2171-7444
Russian Federation, Koltsovo, Novosibirsk region
Stepan A. Pyankov
FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mikkartash@yandex.ru
ORCID iD: 0000-0002-6593-6614
Russian Federation, Koltsovo, Novosibirsk region
Vladimir A. Ternovoi
FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mikkartash@yandex.ru
ORCID iD: 0000-0003-1275-171X
Russian Federation, Koltsovo, Novosibirsk region
Valery B. Loktev
FSSI State Scientific Center of Virology and Biotechnology “Vector”of the Federal Service for Surveillance of Consumer Rights Protection and Human Welfare (Rospotrebnadzor)
Email: mikkartash@yandex.ru
ORCID iD: 0000-0002-0229-321X
Russian Federation, Koltsovo, Novosibirsk region
References
- WHO. Health topic. Yellow fever. Available at: https://www.who.int/health-topics/yellow-fever
- L’vov D.K., ed. Medical Virology: Manual [Meditsinskaya virusologiya: rukovodstvo]. Moscow: MIA; 2008. (in Russian)
- Lindenbach B.D., Rice C.M. Molecular biology of flaviviruses. Adv. Virus Res. 2003; 59: 23–61. https://doi.org/10.1016/s0065-3527(03)59002-9
- Douam F., Ploss A. Yellow fever virus: Knowledge gaps impeding the fight against an old foe. Trends Microbiol. 2018; 26(11): 913–28. https://doi.org/10.1016/j.tim.2018.05.012
- Monath T.P. Yellow fever: an update. Lancet Infect. Dis. 2001; 1(1): 11–20. https://doi.org/10.1016/S1473-3099(01)00016-0
- Ganushkina L.A., Dremova V.P. Mosquitoes Aedes aegypti L. and Aedes albopictus skuse – a new biological threat to the south of Russia. Meditsinskaya parazitologiya i parazitarnye bolezni. 2012; (3): 49–55. (in Russian)
- Ganushkina L.A., Tanygina E.Yu., Bezzhonova O.V., Sergiev V.P. On the detection of Aedes (Stegomyia) albopictuss mosquitoes on the territory of the Russian Federation. Meditsinskaya parazitologiya i parazitarnye bolezni. 2012; (1): 3–4. (in Russian)
- Kovalenko I.S., Yakunin S.N., Abibulaev D.E., Vladychak V.V., Boroday N.V., Smelyanskiy V.P., et al. Obnaruzhenie Aedes (Stegomyia) albopictus (Skuse, 1895) v Krymu. Problemy osobo opasnykh infektsiy. 2020; (2): 135–7. https://doi.org/10.21055/0370-1069-2020-2-135-137 (in Russian)
- Yasyukevich V.V., Popov I.O., Titkina S.N., Yasyukevich N.V. Adventive species of Aedes in Russia – the risk assessment of a new biological threat to the health of the population of Russia. Problemy ekologicheskogo monitoringa i modelirovaniya ekosistem. 2017; 28(3): 51–71. https://doi.org/10.21513/0207-2564-2017-3-51-71 (in Russian)
- Department of the Federal Service for Supervision of Consumer Rights Protection and Human Welfare in the Udmurt Republic. On the prevention of yellow fever; 2022. Available at: https://18.rospotrebnadzor.ru/content/354/110271/ (in Russian)
- Krivosheina E.I., Kartashov M.Yu., Naydenova E.V. Advanced laboratory methods for detecting yellow fever pathogen. Problemy osobo opasnykh infektsiy. 2021; (2): 24–32. https://doi.org/10.21055/0370-1069-202-2-21-32 (in Russian)
- Heinz F.X., Stiasny K., Püschner-Auer G., Holzmann H., Allison S.L., Mandl C.W., et al. Structural changes and functional control of the tick-borne encephalitis virus glycoprotein E by the heterodimeric association with protein prM. Virology. 1994; 198(1): 109–17. https://doi.org/10.1006/viro.1994.1013
- Chávez J.H., Silva J.R., Amarilla A.A., Moraes Figueiredo L.T. Domain III peptides from flavivirus envelope protein are useful antigens for serologic diagnosis and targets for immunization. Biologicals. 2010; 38(6): 613–8. https://doi.org/10.1016/j.biologicals.2010.07.004
- Volk D.E., May F.J., Gandham S.H., Anderson A., Von Lindern J.J., Beasley D.W., et al. Structure of yellow fever virus envelope protein domain III. Virology. 2009; 394(1): 12–8. https://doi.org/10.1016/j.virol.2009.09.001
- Radaeva I.F., Nechaeva E.A., Drozdov I.G. Collection of Cell Cultures of the Federal State Budgetary Institution of the World Bank «Vector» of Rospotrebnadzor [Kollektsiya kul’tur kletok FBUN GNTs VB «Vektor» Rospotrebnadzora]. Novosibirsk: TsERIS; 2009. (in Russian)
- Marshall O.J. PerlPrimer: cross-platform, graphical primer design for standard, bisulphite and real-time PCR. Bioinformatics. 2004; 20(15): 2471–2. https://doi.org/10.1093/bioinformatics/bth254
- National Center for Biotechnology Information. GenBank Overview. Available at: https://www.ncbi.nlm.nih.gov/genbank/
- Okonechnikov K., Golosova O., Fursov M.; UGENE team. Unipro UGENE: a unified bioinformatics toolkit. Bioinformatics. 2012; 28(8): 1166–7. https://doi.org/10.1093/bioinformatics/bts091
- Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets. Mol. Biol. Evol. 2016; 33(7): 1870–4. https://doi.org/10.1093/molbev/msw054
- Laemmli U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 1970; 227(5259): 680–5. https://doi.org/10.1038/227680a0
Supplementary files