Competitive ELISA test system for the detection of antibodies to the rabies virus in animals (Rhabdoviridae: Lyssavirus)
- Authors: Lobanova V.A.1,2, Tsarkova K.N.1, Bogomolova O.A.1, Matveeva I.N.1, Klyukina V.I.1
-
Affiliations:
- All-Russian Research and Technological Institute of Biological Industry
- Russian State Agrarian University – Moscow Timiryazev Agricultural Academy
- Issue: Vol 67, No 4 (2022)
- Pages: 331-340
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/619
- DOI: https://doi.org/10.36233/0507-4088-127
- ID: 619
Cite item
Full Text
Abstract
Introduction. The main approach to the rabies prevention is the vaccination of domestic and wild carnivores. For the routine evaluation the anti-rabies vaccination effectiveness, World Organization for Animal Health (OIE) recommends various enzyme-linked immunosorbent assays (ELISA).
The aim of the study was to design and validate a competitive ELISA (cELISA) test system for the detection of antibodies to the rabies virus (RABV).
Materials and methods. The development of the cELISA was carried out following the OIE recommendations.
Results. The repeatability of the cELISA results within one laboratory was satisfactory (coefficient of variation 7.95–13.61%). The coefficient of determination (CD) between the results of the virus neutralization reaction (FAVN) and cELISA was 0.988, p < 0.001. The lower threshold for antibody detection was less than 0.02 IU/ml. The cELISA did not demonstrate cross-reactivity against antibodies to canine distemper virus, parainfluenza virus, parvovirus, coronavirus, and canine adenovirus (types I and II). During the study of 137 dog blood sera, diagnostic specificity (DSp) and diagnostic sensitivity (DSe) for the cELISA were 83.1% and 94.9%, respectively, and CD between the cELISA and FAVN results was 0.968, p < 0.001.
Discussion. Indirect ELISA test systems for determining the level of antibodies to RABV are not sensitive enough compared to reference tests, unlike cELISA. The developed test system is not inferior for its DSp and DSe to the commercial cELISA BioPro ELISA Rabies Ab (DSp 66.7%, DSe 94.4%).
Conclusion. The developed cELISA test system can be used to detect antibodies to RABV in the blood serum of dogs for evaluating the effectiveness of mass vaccination programs.
Full Text
Введение
Бешенство (греч. Rabies – безумие) – острое природно-очаговое заболевание теплокровных животных и человека, характеризующееся поражениями нервной системы и 100% летальным исходом [1]. Ежегодно от бешенства умирают почти 59 000 человек во всём мире. Рабическая инфекция по-прежнему представляет глобальную угрозу для людей и животных, а распространение бешенства собак напрямую увеличивает риск заражения людей при контактах с ними. Российская Федерация на протяжении многих лет является неблагополучной по бешенству животных. Подавляющее большинство случаев выявляют у домашних и диких плотоядных: собак, кошек, енотовидных собак, лис, куниц. Поэтому основным направлением профилактики заболевания на протяжении многих лет остаётся вакцинация домашних и диких животных [2].
Неотъемлемым компонентом контроля эффективности вакцинопрофилактики является определение титров антител к вирусу бешенства (ВБ) в сыворотках крови вакцинированных животных. Для контроля напряжённости поствакцинального иммунитета и определения уровня антител к ВБ Международным эпизоотическим бюро (МЭБ, OIE) рекомендованы тест-системы на основе реакций нейтрализации вируса в культуре клеток, а также иммуноферментного анализа (ИФА) [1]. Для рутинного исследования большого количества сывороток при оценке эффективности вакцинации обычно применяют непрямой (нИФА) или конкурентный (кИФА) варианты ИФА, при этом нИФА имеет ряд ограничений, в том числе обусловленных недостаточной чувствительностью теста [3]. Биотехнологическим решением проблемы низкой чувствительности тест-системы и универсальности диагностикума в отношении образцов от разных видов животных стала разработка методов кИФА [4, 5], в том числе и с применением стрептавидин-пероксидазных конъюгатов [6–8].
Цель работы – конструирование и валидация тест-системы на основе конкурентного варианта ИФА для выявления антител к ВБ животных.
Материалы и методы
Компоненты для конкурентного ИФА
При постановке кИФА использовали компоненты, полученные в результате предыдущих исследований: концентрированный очищенный препарат культурального ВБ, штамм «Щелково-51», с активностью 1 : 128 в реакции диффузионной преципитации (РДП), 1 : 320 в реакции связывания комплемента (РСК) и 1 : 4000 в нИФА; контрольная антирабическая сыворотка крови собак с концентрацией вируснейтрализующих антител (ВНА) 5,5 ± 0,26 МЕ/мл (определена в собственной модификации теста FAVN (fluorescent antibody virus neutralization test) с ВБ штамма «Щелково-51»); биотинилированные поликлональные кроличьи антитела к ВБ с активностью 1 : 128 в РДП, 1 : 160 в РСК, 1 : 12 800 в нИФА (степень биотинилирования антител – в среднем 5,2 ± 0,34 молекулы биотина на 1 молекулу антител) [9, 10].
Исследуемые сыворотки
Сыворотки крови домашних собак, вакцинированных против ВБ в разные периоды времени, были любезно предоставлены ветеринарной клиникой «Зоодоктор» (г. Щёлково) и использованы с согласия владельцев животных. Пул нормальных сывороток от клинически здоровых невакцинированных собак исследовали в собственной модификации теста FAVN с ВБ штамма «Щелково-51» [1], и отрицательно реагирующие сыворотки использовали в качестве отрицательного контроля для кИФА. Все образцы были доставлены в лабораторию при соблюдении температурного режима до 10°C. Для снижения вероятности проявления ложноположительных результатов в кИФА неспецифические термолабильные ингибиторы в образцах инактивировали на водяной бане при 56°C в течение 30 мин.
Конкурентный ИФА
На лунки 96-луночного планшета (Corning, кат. № 3591, США) сорбировали очищенный культуральный ВБ штамма «Щелково-51» в качестве антигена. Для этого в каждую лунку вносили по 100 мкл вируса в концентрации 10 мкг/мл в 50 мМ карбонатно-бикарбонатного буфера (рН 9,6) и оставляли при 4°C на 12 ч. Затем планшет пятикратно промывали фосфатно-солевым буфером (PBS) (рН 7,2–7,4) с 0,05% Твин 20 (Sigma-Aldrich, CAS № 9005-64-5, pH 7,2) для удаления несвязавшегося антигена и обрабатывали 200 мкл 2% обезжиренного сухого молока (ОСМ) при 37 ºC в течение 1 ч для блокирования неспецифических реакций. В лунки добавляли положительную контрольную сыворотку с концентрацией ВНА 5, 1 и 0,5 МЕ/мл (SS), отрицательную контрольную сыворотку (SN) или исследуемые сыворотки в разведении 1 : 2 в PBS в объёме 100 мкл, а затем инкубировали при 37°C в течение 1 ч и пятикратно промывали PBS, содержащим 0,05% Твин 20. В лунки добавляли по 100 мкл биотинилированных поликлональных антител к ВБ (разведение 1 : 2048), а затем инкубировали при 37°C в течение 1 ч и пятикратно промывали PBS с 0,05% Твин 20. В лунки добавляли по 100 мкл стрептавидин-пероксидазного конъюгата (Sigma-Aldrich, Prod. № 189733, разведение 1 : 5000), а затем инкубировали при 37°C в течение 1 ч и пятикратно промывали PBS с 0,05% Твин 20. Реакцию образования комплекса «антиген + антитело» визуализировали при добавлении в каждую лунку планшета по 100 мкл тетраметилбензидин-раствора (Sigma-Aldrich, CAS № 54827-17-7, pH 3,4–3,8); инкубировали 20 мин при 20°C, избегая попадания солнечного света на лунки планшета, и останавливали с помощью 50 мкл 1 Н раствора H2SO4. Разведения всех компонентов, кроме ВБ, готовили с использованием PBS с 0,05% Твин 20 и 0,2% ОСМ [11].
Оптическую плотность раствора в каждой лунке определяли на спектрофотометре (Sigma, США) при 450 нм (OD450), для каждой лунки вычисляли процент ингибиции окрашивания (PI) по формуле (1):
, (1)
где OD450 (иссл.) – OD450 лунки с исследуемой сывороткой, OD450 (SN) – OD450 лунки, содержащей отрицательную контрольную сыворотку (SN), OD450 (SS) – OD450 лунки, содержащей положительную контрольную сыворотку (SS).
Концентрацию антирабических антител определяли при построении калибровочной кривой на основе PI лунок, содержащих положительную контрольную сыворотку. Поствакцинальный антирабический иммунитет оценивали как протективный, если в сыворотке крови вакцинированных собак содержание ВНА составляло не менее 0,5 МЕ/мл. Результаты кИФА считали действительными при соблюдении следующих условий:
- OD450 отрицательной контрольной сыворотки не менее 1,0;
- разница между OD450 отрицательной и положительной контрольных сывороток не менее 0,8;
- при построении калибровочной кривой наблюдается линейная зависимость между OD450 и концентрацией антител в положительной контрольной сыворотке.
При несоблюдении одного или нескольких из этих условий результаты теста считались недействительными и исследование следовало повторить, предварительно убедившись в корректности осуществления методики, соблюдении мер, исключающих перекрёстную контаминацию лунок и другие типичные ошибки при постановке таких рутинных тестов, как ИФА. При наличии эффекта насыщения (выхода калибровочной кривой OD450 на плато при достижении определённых концентраций ВНА) действительными считали только результаты исследования тех лунок, чьи значения OD450 расположены на участке кривой, отражающей линейную зависимость OD450 от концентрации антител. Результаты лунок, значения которых находятся на горизонтальном участке калибровочной кривой (участок плато), не могут быть корректно интерпретированы, поэтому сыворотки из таких лунок должны быть повторно исследованы в кИФА в разведении 1 : 4.
Статистическая обработка результатов
Статистическую обработку полученных результатов проводили общепринятыми методами [12]. Графический анализ выполнен с использованием программного обеспечения R версии 3.5.1.
Результаты
Подбор оптимальных концентраций реагентов для постановки конкурентного ИФА
Разработку иммуноферментной тест-системы на основе кИФА проводили в соответствии с рекомендациями МЭБ – Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2021, части 2.2.1, 2.2.4, 2.2.5 [1]. В ходе оптимизации условий постановки кИФА определяли оптимальную дозу вируса для сенсибилизации планшетов, состав блокирующего буфера; оптимальные разведения биотинилированных антител, стрептавидин-пероксидазного конъюгата и исследуемых сывороток; порядок регистрации и интерпретации результатов ИФА.
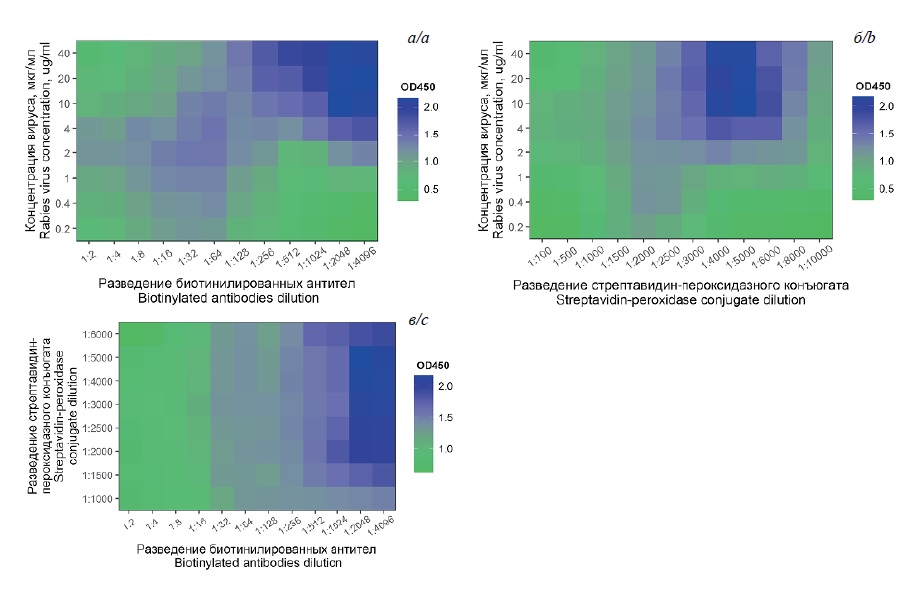
Оптимальную концентрацию очищенного цельновирионного культурального ВБ штамма «Щелково-51» для иммобилизации на поверхности лунок 96-луночного планшета, биотинилированных кроличьих поликлональных антител к ВБ, а также стрептавидин-пероксидазного конъюгата определяли методом шахматного титрования вируса в концентрациях от 0,2 до 40 мкг/мл, биотинилированных антител – в последовательных двукратных разведениях от 1 : 2 до 1 : 4096 и стрептавидин-пероксидазного конъюгата в разведениях от 1 : 100 до 1 : 10 000 (рис. 1). Концентрация очищенного цельновирионного культурального ВБ штамма «Щелково-51» 10 мкг/мл определена в качестве оптимальной для иммобилизации на поверхности 96-луночного планшета при времени экспозиции 12 ч при 4°С (рис. 1 а, б). В качестве оптимального определено разведение биотинилированных антител 1 : 2048 (рис. 1 а, в), а для стрептавидин-пероксидазного конъюгата это значение составило 1 : 5000 (рис. 1 б, в).
Рис. 1. Результаты шахматного титрования: а – вируса бешенства штамма «Щелково-51» и биотинилированных кроличьих антирабических антител; б – вируса бешенства штамма «Щелково-51» и стрептавидин-пероксидазного конъюгата; в – биотинилированных кроличьих антирабических антител и стрептавидин-пероксидазного конъюгата.
Для определения оптимального состава буфера для блокирования неспецифических реакций после сенсибилизации планшетов очищенным ВБ штамма «Щелково-51» сравнивали OD450 лунок при постановке кИФА с использованием следующих блокирующих буферов: 1%, 2% растворы ОСМ (Millipore, Prod. № 70166), 1%, 2%, 3% растворы бычьего сывороточного альбумина (Sigma-Aldrich, CAS № 9048-46-8) в PBS. Каждый раствор добавляли в лунки в количестве 200 мкл и инкубировали планшеты при 37ºC в течение 1 ч. В кИФА исследовали положительную и отрицательную контрольные сыворотки крови собак с активностью 0,5 и 0,05 МЕ/мл соответственно в 10 повторностях (n = 10). По результатам исследований в качестве блокирующего буфера был выбран 2% раствор ОСМ в PBS (табл. 1).
Таблица 1. Влияние блокирующих растворов на результаты конкурентного ИФА, M ± SD
Table 1. Effect of blocking solutions on cELISA results, M ± SD
Раствор, концентрация Solution, concentration | OD450 в кИФА контрольных сывороток с активностью OD450 in сELISA for control sera with activity | Отношение OD450 SN/SP OD450 SN/SP ratio | Пороговый PI* для 0,5 МЕ/мл, % Threshold PI* for 0.5 IU/ml, % | ||
0,05 МЕ/мл (SN) 0,05 IU/ml (SN) | 5 МЕ/мл (SP) 5 IU/ml (SP) | 0,5 МЕ/мл 0,5 IU/ml | |||
ОСМ, 1 % Skim milk powder, 1% | 1,98 ± 0,18 | 0,19 ± 0,05 | 0,79 ± 0,12 | 10,41 ± 0,45 | 67,38 ± 3,78 |
ОСМ, 2 % Skim milk powder, 2% | 2,12 ± 0,23 | 0,16 ± 0,03 | 0,76 ± 0,09 | 13,37 ± 0,42 | 69,29 ± 3,12 |
БСА, 1 % Bovine serum albumin, 1% | 1,87 ± 0,19 | 0,22 ± 0,03 | 0,92 ± 0,13 | 8,54 ± 0,36 | 57,78 ± 2,45 |
БСА, 2 % Bovine serum albumin, 2% | 1,84 ± 0,24 | 0,23 ± 0,05 | 0,87 ± 0,08 | 8,07 ± 0,22 | 60,84 ± 3,08 |
БСА, 3 % Bovine serum albumin, 3% | 2,07 ± 0,16 | 0,22 ± 0,05 | 0,82 ± 0,11 | 9,43 ± 0,34 | 66,95 ± 2,23 |
Примечание. кИФА – конкурентный иммуноферментный анализ; ОСМ – обезжиренное сухое молоко; БСА – бычий сывороточный альбумин; SN – отрицательная контрольная сыворотка; SP – положительная контрольная сыворотка; PI – процент ингибиции окрашивания. *По формуле 1.
Note. cELISA – competitive enzyme-linked immunosorbent assay; SN – negative control serum; SP – positive control serum; PI – percent of the staining inhibition. *See equation 1.
Для проведения кИФА в качестве оптимального было определено двукратное разведение исследуемых сывороток (1 : 2). В случаях, когда концентрация антител в сыворотке превышает 10 МЕ/мл, результаты определения PI находятся на горизонтальном участке калибровочной кривой (участок плато) и не могут быть интерпретированы c достаточной точностью. Такие сыворотки дополнительно исследовали в разведении 1 : 4.
Повторяемость результатов конкурентного ИФА в рамках одной лаборатории
Пять образцов сывороток крови собак были протестированы в отделе иммунологии Всероссийского научно-исследовательского и технологического института биологической промышленности в ходе проведения пяти анализов кИФА в течение 1 недели, при каждом анализе образец исследовали в четырех повторностях. Таким образом, для каждого из 5 образцов было получено 20 результатов исследования в конкурентном варианте ИФА. Параллельно при каждом анализе тестировали положительную контрольную сыворотку с концентрацией ВНА 5, 1, 0,5, 0,1 МЕ/мл, строили калибровочную кривую и вычисляли концентрацию антител для исследуемых сывороток. Далее для каждой сыворотки рассчитывали среднюю концентрацию антител, стандартное отклонение (SD) и коэффициент вариации (CV) [1]. Для каждой из пяти исследованных сывороток CV составил менее 15%, включая образец с низким уровнем ВНА (образец № 5), что говорит об удовлетворительной повторяемости результатов кИФА (табл. 2). Коэффициент детерминации (R2) между результатами FAVN и кИФА составил 0,988, p < 0,001 (рис. 2).
Таблица 2. Результаты исследования сывороток крови собак в конкурентном ИФА в 20 повторностях
Table 2. The results of dog blood sera study in a competitive ELISA in 20 replicates
Номер сыворотки Serum number | Концентрация ВНА в FAVN, МЕ/мл VNA concentration in FAVN, IU/ml | Концентрация антител в кИФА Antibody concentration in cELISA | ||
Среднее, МЕ/мл Mean, IU/ml | SD, МЕ/мл SD, IU/ml | CV, % | ||
1 | 0,68 | 0,64 | 0,051 | 7,95 |
5 | 0,10 | 0,08 | 0,011 | 13,61 |
23 | 0,50 | 0,52 | 0,051 | 9,80 |
45 | 12,14 | 10,72 | 0,931 | 8,68 |
54 | 4,47 | 4,82 | 0,391 | 8,10 |
Примечание. ВНА – вируснейтрализующие антитела; кИФА – конкурентный иммуноферментный анализ; FAVN – тест нейтрализации вируса флуоресцентными антителами; SD – стандартное отклонение; CV – коэффициент вариации.
Note. VNA – virus neutralizing antibodies; cELISA – competitive enzyme-linked immunosorbent assay; FAVN – fluorescent antibody virus neutralization test; SD – standard deviation; CV – coefficient of variation.
Рис. 2. Корреляция между результатами FAVN и кИФА: а – оси X и Y представлены на линейной шкале; б – оси X и Y представлены на log10-шкале. Сплошной обозначена линия регрессии. Пунктирные линии обозначают протективный уровень антител 0,5 МЕ/мл.
Аналитическая чувствительность конкурентного ИФА
Для определения аналитической чувствительности разработанной тест-системы на основе кИФА исследовали последовательные двукратные разведения сывороток, предварительно протестированные в FAVN. Каждое разведение исследовали в 20 повторностях. Установлено, что концентрации ВНА 0,5 МЕ/мл соответствует PI в кИФА, равный 69,29% (табл. 1). Нижний порог обнаружения ВНА в сыворотке крови для разработанной тест-системы составил менее 0,02 МЕ/мл (рис. 3).
Рис. 3. Определение предела обнаружения антител для конкурентного варианта ИФА. Процент ингибиции окрашивания в кИФА приведен с 95% доверительным интервалом. Пунктирной линией обозначен порог процента ингибиции окрашивания, соответствующий концентрации вируснейтрализующих антител 0,5 МЕ/мл.
Аналитическая специфичность
Аналитическую специфичность разработанной тест-системы определяли при исследовании гетерологичных сывороток, содержащих антитела к вирусу чумы плотоядных, парвовирусу, коронавирусу, аденовирусу собак I и (или) II серотипа, вирусу парагриппа собак и не содержащих антител к ВБ. Полученные результаты свидетельствуют, что разработанная тест-система является специфичной и не проявляет кросс-реактивности в отношении антител к указанным возбудителям (табл. 3).
Таблица 3. Результаты исследования сывороток крови собак, не содержащих антитела к вирусу бешенства, в конкурентном ИФА
Table 3. Results of the cELISA testing of dog blood sera that do not contain antibodies to the rabies virus
Сыворотка Serum | Количество образцов Number of samples | Концентрация антирабических антител в кИФА cELISA anti-rabies antibodies concentration | |
≥ 0,5 МЕ/мл ≥ 0.5 IU/ml | < 0,5 МЕ/мл < 0.5 IU/ml | ||
Сыворотка крови собак, вакцинированных препаратом «Вангард Плюс 5 L4 CV» (содержит антитела к CDV, CAV, CCV, CPiV, CPV, L) Blood serum from dogs vaccinated with “Vanguard Plus 5 L4 CV” (contains antibodies to CDV, CAV, CCV, CPiV, CPV, L) | 3 | 0 | 3 |
Сыворотка крови собак, вакцинированных препаратом «Вангард 7» или «Эурикан DHPPI + L» (содержит антитела к CDV, CAV, CPiV, CPV, L) Blood serum from dogs vaccinated with “Vanguard 7” or “Eurican DHPPI + L” (contains antibodies to CDV, CAV, CPiV, CPV, L) | 14 | 0 | 14 |
Сыворотка крови собак, вакцинированных препаратом «Нобивак DHPPi» (содержит антитела к CDV, CAV, CPiV, CPV) Blood serum from dogs vaccinated with “Nobivak DHPPi” (contains antibodies to CDV, CAV, CPiV, CPV) | 9 | 0 | 9 |
Сыворотка крови собак, вакцинированных препаратом «Мультикан-6» (содержит антитела к CDV, CAV, CCV, CPV, L) Blood serum from dogs vaccinated with “Multican-6” (contains antibodies to CDV, CAV, CCV, CPV, L) | 17 | 0 | 17 |
Сыворотка «Витакан-С» (содержит антитела к CDV, CPV, CAV) “Vitakan-S” serum (contains antibodies to CDV, CPV, CAV) | 10 | 0 | 10 |
Всего Total | 53 | 0 | 53 |
Примечание. кИФА – конкурентный иммуноферментный анализ; CAV – аденовирус собак; CCV – коронавирус собак; CDV – вирус чумы плотоядных; CPiV – вирус парагриппа собак; CPV – парвовирус собак; L – лептоспироз.
Note. cELISA – competitive enzyme-linked immunosorbent assay; CAV – Canine adenovirus; CCV – Canine coronavirus; CDV – Canine distemper virus; CPiV – Canine parainfluenza virus; CPV – Canine parvovirus; L – Leptospirosis.
Диагностическая специфичность и чувствительность конкурентного ИФА
В отличие от реакции нейтрализации, качество результатов ИФА не зависит от качества исследуемой сыворотки, однако чувствительность и специфичность обусловлены особенностями проведения теста. При исследовании 137 сывороток крови вакцинированных и невакцинированных против бешенства собак специфичность и чувствительность тест-системы на основе кИФА составили 83,1 и 94,9% соответственно (табл. 4). Также отмечена высокая степень корреляции между результатами кИФА и FAVN (R2 = 0,968, p < 0,001) (рис. 4).
Таблица 4. Результаты исследования 137 сывороток крови собак в конкурентном ИФА
Table 4. Results of 137 dog sera testing in a competitive ELISA
Конкурентный ИФА Competitive ELISA | FAVN | ||
≥ 0,5 МЕ/мл ≥ 0,5 IU/ml | < 0,5 МЕ/мл < 0,5 IU/ml | Всего Total | |
≥ 0,5 МЕ/мл ≥ 0,5 IU/ml | 74 | 10 | 84 |
< 0,5 МЕ/мл < 0,5 IU/ml | 4 | 49 | 53 |
Всего Total | 78 | 59 | 137 |
Примечание. кИФА – конкурентный иммуноферментный анализ; FAVN – тест нейтрализации вируса флуоресцентными антителами.
Note. cELISA – competitive enzyme-linked immunosorbent assay; FAVN – fluorescent antibody virus neutralization test.
Рис. 4. Корреляция между результатами FAVN и кИФА: а – оси X и Y представлены на линейной шкале; б – оси X и Y представлены на log10-шкале. Сплошной обозначена линия регрессии. Пунктирные линии обозначают протективный уровень антител 0,5 МЕ/мл.
При проведении ROC-анализа (receiver operating characteristic) AUC (area under curve – площадь под кривой) для кИФА составил 0,961 (95% доверительный интервал (ДИ) 0,929–0,992), что позволяет считать эту тест-систему пригодной для определения поствакцинального иммунного статуса животного (рис. 5).
Рис. 5. ROC-кривая для конкурентного варианта ИФА.
Обсуждение
При конструировании тест-систем на основе кИФА в качестве конкурирующего компонента могут быть использованы как моноклональные, так и поликлональные антитела [3]. При создании тест-систем для выявления антител к конкретному вирусному белку в качестве антигена используют этот белок, а в качестве конкурирующего компонента – моно- или поликлональные антитела к нему [4, 13–15]. В случае же, если диагностический набор направлен на определение общего пула антител к вирусу, как это представлено в нашей работе, в качестве антигена используют цельный вирус либо его фрагменты, а в качестве конкурирующего компонента – поликлональные антитела к вирусу [6, 16].
При определении оптимальной методики постановки кИФА возможны модификации с одновременным или последовательным добавлением в лунки исследуемой сыворотки и конкурирующих антител. Вариант кИФА, подразумевающий смешивание конкурирующего компонента с образцом перед добавлением их в лунку [17], не нашёл широкого применения. Ввиду непредсказуемости результата такого взаимодействия компонентов было невозможно определить, насколько активно конкурирующие антитела вытесняют антитела сыворотки из системы и не может ли это привести к искусственному занижению итогового показателя активности исследуемой сыворотки. Поэтому на данный момент большинство тест-систем подразумевают последовательное поэтапное внесение компонентов в лунки планшета [18].
Для выявления образовавшегося комплекса «антиген + антитело» в части тест-систем используют специфические антивидовые антитела, как это зачастую происходит в непрямом варианте ИФА [14, 15], однако такой вариант постановки теста накладывает видовые ограничения на исследуемый материал, а также снижает специфичность и чувствительность тест-системы (например, из-за низкой степени очистки вторичных антител). Со временем антивидовые антитела были заменены на стрептавидин-пероксидазные конъюгаты: высокая аффинность стрептавидина к биотинилированным антителам обеспечивает высокую специфичность и чувствительность теста [6–8, 16, 19].
Актуальной задачей на данный момент остаётся разработка новых модификаций ИФА, обладающих большей диагностической специфичностью и чувствительностью. Диагностикумы для определения уровня антител к ВБ на основе нИФА зачастую оказываются недостаточно чувствительны, по сравнению с референс-тестами FAVN и RFFIT [20, 21]. M. Wasniewski с соавт. сообщают, что при 100% специфичности чувствительность тест-системы Platelia TM Rabies II ad usum Veterinarium составляет только 78,2%, при этом лишь 5 из 23 аккредитованных международных лабораторий получили удовлетворительные результаты по показателям специфичности и чувствительности ИФА, по сравнению с FAVN [21]. Примечательно, что, по данным ряда исследований, аналогичный набор для выявления антител к гликопротеину ВБ в образцах сыворотки крови и цереброспинальной жидкости людей обладает высокой специфичностью и чувствительностью по сравнению со стандартными тестами вируснейтрализации [22, 23]. Также вызывает вопросы эффективность тест-системы Serelisa TM Rabies Ab mono Indirect [24]. 8 из 16 лабораторий, протестировавших собственные образцы сывороток крови собак и кошек с помощью тестов FAVN или RFFIT и Serelisa, заявили о неудовлетворительной чувствительности и специфичности Serelisa TM Rabies Ab mono Indirect (коэффициент соответствия методу вируснейтрализации составил менее 80%), при этом 4 лаборатории получили значительную долю ложноположительных результатов [20]. Коэффициент соответствия теста ИФА референс-методу (RFFIT или FAVN) составил для различных лабораторий от 67,5 до 92,0% [20].
Оптимальным решением на данный момент можно считать варианты кИФА с применением биотинилированных моно- и поликлональных антител. Наиболее специфичной и чувствительной на данный момент является тест-система BioPro ELISA Rabies Ab [6]: при исследовании 107 сывороток крови собак специфичность и чувствительность тест-cистемы составила 66,7 и 94,4% соответственно. Для разработанной нами тест-системы при исследовании 137 сывороток крови собак эти показатели составили 83,1 и 94,4% соответственно. AUC для BioPro ELISA Rabies Ab при исследовании 560 сывороток крови лисиц (в качестве референс-метода выступала тест-система на основе нИФА Platelia Rabies II Kit ad usum veterinarium, Bio-Rad) составил 0,977 (95% ДИ 0,961–0,988), а для нашей тест-системы при исследовании 137 сывороток крови собак (референс-метод – модификация FAVN) – 0,961 (95% ДИ 0,929–0,992).
Заключение
Таким образом, по приведенным выше параметрам разработанная нами тест-система не уступает современным коммерческим тест-системам для выявления антител к ВБ, а также превосходит по своей специфичности и чувствительности диагностикумы на основе нИФА. Полученные результаты позволяют рекомендовать разработанную тест-систему на основе кИФА для рутинных исследований по определению уровня антирабических антител в сыворотке крови собак при оценке эффективности программ массовой вакцинации.
About the authors
Varvara A. Lobanova
All-Russian Research and Technological Institute of Biological Industry; Russian State Agrarian University – Moscow Timiryazev Agricultural Academy
Author for correspondence.
Email: varvara.ustinova1995@gmail.com
ORCID iD: 0000-0001-9757-784X
SPIN-code: 4888-9180
Postgraduate Student of the Immunology Department, FSBI “All-Russian Research and Technological Institute of Biological Industry”; Assistant of Biotechnology Department, FSBEI HE “Russian State Agrarian University – Moscow Timiryazev Agricultural Academy”
Russian Federation, 141142, Moscow Region, Losino-Petrovsky urb. distr.; 127434, MoscowKristina N. Tsarkova
All-Russian Research and Technological Institute of Biological Industry
Email: car-cristina@rambler.ru
ORCID iD: 0000-0003-0694-9834
Junior Research Scientist of the Department of Immunology
Russian Federation, 141142, Moscow Region, Losino-Petrovsky urb. distr.Olesya A. Bogomolova
All-Russian Research and Technological Institute of Biological Industry
Email: noo_vnitibp@mail.ru
ORCID iD: 0000-0001-6442-226X
SPIN-code: 3155-3489
PhD of Biological Sciences, Senior Research Scientist of the Department of Immunology
Russian Federation, 141142, Moscow Region, Losino-Petrovsky urb. distr.Irina N. Matveeva
All-Russian Research and Technological Institute of Biological Industry
Email: biolog1967@mail.ru
ORCID iD: 0000-0003-0849-2524
SPIN-code: 6054-5026
Doctor of Biological Sciences, Professor, Head of the Department of Molecular Biology and Virology
Russian Federation, 141142, Moscow Region, Losino-Petrovsky urb. distr.Valentina I. Klyukina
All-Russian Research and Technological Institute of Biological Industry
Email: klyukinavi@yandex.ru
ORCID iD: 0000-0002-4295-1424
SPIN-code: 6675-9170
Doctor of Biological Sciences, Professor, Head of the Department of Immunology
Russian Federation, 141142, Moscow Region, Losino-Petrovsky urb. distr.References
- OIE Manual of Diagnostic Tests and Vaccines for Terrestrial Animals – 2018. Chapter 3.1.17. Rabies (infection with Rabies virus and other Lyssaviruses). Available at: https://www.woah.org/fileadmin/Home/eng/Health_standards/tahm/3.01.17_RABIES.pdf
- Karaulov A.K., Varkentin A.V., Petrova O.N., Tatsenko E.E., Semenova N.A., Shcherbin S.V., et al. Report of the information and analytical center of the Veterinary Supervision Department of the Federal Service for Veterinary and Phytosanitary Surveillance (Rosselkhoznadzor) (FSBI «Federal Centre for Animal Health» (FGBI «ARRIAH») on the epizootic situation in the Russian Federation for 2020. Available at: https://fsvps.gov.ru/sites/default/files/files/iac/2022/2021_31_12_godovoy_otchet.pdf (in Russian)
- Lobanova V.A., Klyukina V.I. Biotechnological aspects of improving detection methods antibodies to animal rabies virus. Vestnik biotekhnologii i fiziko-khimicheskoy biologii im. Yu. A. Ovchinnikova. 2021; 17(1): 62–75. (in Russian)
- Sugiyama M., Yoshiki R., Tatsuno Y., Hiraga S., Itoh O., Gamoh K., et al. A new competitive enzyme-linked immunosorbent assay demonstrates adequate immune levels to rabies virus in compulsorily vaccinated Japanese domestic dogs. Clin. Diagn. Lab. Immunol. 1997; 4(6): 727–30. https://doi.org/10.1128/cdli.4.6.727-730.1997
- Bedeković T., Šimić I., Krešić N., Lojkić I., Mihaljević Ž., Sučec I., et al. Evaluation of ELISA for the detection of rabies virus antibodies from the thoracic liquid and muscle extract samples in the monitoring of fox oral vaccination campaigns. BMC Vet. Res. 2016; 12: 76. https://doi.org/10.1186/s12917-016-0701-0
- Mojžiš M., Korytár P., Jerg S. Development and validation of ELISA test for detection of rabies anti-glycoprotein antibodies. In: Proceedings of the International Conference on Rabies in the Americas (RITA XIX). Atlanta; 2008: 48–9.
- Wasniewski M., Cliquet F. Evaluation of ELISA for detection of rabies antibodies in domestic carnivores. J. Virol. Methods. 2012; 179(1): 166–75. https://doi.org/10.1016/j.jviromet.2011.10.019
- Wasniewski M., Almeida I., Baur A., Bedekovic T., Boncea D., Chaves L.B., et al. First international collaborative study to evaluate rabies antibody detection method for use in monitoring the effectiveness of oral vaccination programmes in fox and raccoon dog in Europe. J. Virol. Methods. 2016; 238: 77–85. https://doi.org/10.1016/j.jviromet.2016.10.006
- Lobanova V.A., Klyukina V.I. Obtaining components of a test system based on a competitive ELISA for the detection of antibodies to the rabies virus. Veterinarnyy vrach. 2022; (2): 29–39. https://doi.org/10.33632/1998-698X.2022_29_39 (in Russian)
- Burns R., ed. Immunochemical Protocols. Totowa, NJ: Humana Press; 2005.
- Gibbs J., Vessels M., Rothenberg M. Effective blocking procedures in ELISA assays. Application note. Available at: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-456.pdf
- Novikov D.A., Novochadov V.V. Statistical Methods in Biomedical Experiment (Typical Cases) [Statisticheskie metody v mediko-biologicheskom eksperimente (tipovye sluchai)]. Volgograd; 2005. (in Russian)
- Esterhuysen J.J., Prehaud C., Thomson G.R. A liquid-phase blocking ELISA for the detection of antibodies to rabies virus. J. Virol. Methods. 1995; 51(1): 31–42. https://doi.org/10.1016/0166-0934(94)00098-2
- Hismatullina N.A., Guljukin A.M., Sabirova V.V., Gafarova A.Z., Elakov A.L. Development and application of a novel ELISA-block test-system to improve rabies vaccine prevention. Veterinarnaya meditsina. 2012; (96): 64–6. (in Russian)
- Aronthippaitoon Y., Samer W., Atuntee T., Thananchai H., Thongkorn K., Pongsopawijit P., et al. A cost effective easy competitive enzyme-linked immunosorbent assay suitable for monitoring protective immunity against the rabies virus in the serum of humans and dogs. Jpn J. Infect. Dis. 2019; 72(2): 99–105. https://doi.org/10.7883/yoken.JJID.2018.248
- Fontana D., Rodriguez M.C., Garay E., Russo S., Prieto C. Optimization and validation of a blocking ELISA for quantitation of anti-rabies immunoglobulins in multispecies sera. Appl. Microbiol. Biotechnol. 2020; 104(9): 4127–39. https://doi.org/10.1007/s00253-020-10490-6
- Zhang S., Liu Y., Zhang F., Hu R. Competitive ELISA using a rabies glycoprotein-transformed cell line to semi-quantify rabies neutralizing-related antibodies in dogs. Vaccine. 2009; 27(15): 2108–13. https://doi.org/10.1016/j.vaccine.2009.01.126
- Korimbocus J., Dehay N., Tordo N., Cano F., Morgeaux S. Development and validation of a quantitative competitive ELISA for potency testing of equine anti rabies sera with other potential use. Vaccine. 2016; 34(28): 3310–6. https://doi.org/10.1016/j.vaccine.2016.04.086
- Muhamuda K., Madhusudana S.N., Ravi V. Development and evaluation of a competitive ELISA for estimation of rabies neutralizing antibodies after post-exposure rabies vaccination in humans. Int. J. Infect. Dis. 2007; 11(5): 441–5. https://doi.org/10.1016/j.ijid.2006.09.013
- Servat A., Cliquet F. OIE Reference Laboratory for Rabies; WHO. Collaborative study to evaluate a new ELISA test to monitor the effectiveness of rabies vaccination in domestic carnivores. Virus. Res. 2006; 120(1-2): 17–27. https://doi.org/10.1016/j.virusres.2006.02.011
- Wasniewski M., Labbe A., Tribout L., Rieder J., Labadie A., Schereffer J.L., et al. Evaluation of a rabies ELISA as an alternative method to seroneutralisation tests in the context of international trade of domestic carnivores. J. Virol. Methods. 2014; 195: 211–20. https://doi.org/10.1016/j.jviromet.2013.10.021
- Feyssaguet M., Dacheux L., Audry L., Compoint A., Morize J.L., Blanchard I., et al. Multicenter comparative study of a new ELISA, PLATELIA RABIES II, for the detection and titration of anti-rabies glycoprotein antibodies and comparison with the rapid fluorescent focus inhibition test (RFFIT) on human samples from vaccinated and non-vaccinated people. Vaccine. 2007; 25(12): 2244–51. https://doi.org/10.1016/j.vaccine.2006.12.012
- Welch R.J., Anderson B.L., Litwin C.M. An evaluation of two commercially available ELISAs and one in-house reference laboratory ELISA for the determination of human anti-rabies virus antibodies. J. Med. Microbiol. 2009; 58(Pt. 6): 806–10. https://doi.org/10.1099/jmm.0.006064-0
- Cliquet F., McElhinney L.M., Servat A., Boucher J.M., Lowings J.P., Goddard T., et al. Development of a qualitative indirect ELISA for the measurement of rabies virus-specific antibodies from vaccinated dogs and cats. J. Virol. Methods. 2004; 117(1): 1–8. https://doi.org/10.1016/j.jviromet.2003.12.001
Supplementary files