The impact of innate immune response on the efficacy of oncolytic viruses
- Authors: Trachuk K.N.1, Pestov N.B.1, Biryukova Y.K.1, Kolyasnikova N.M.1
-
Affiliations:
- Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
- Issue: Vol 69, No 6 (2024)
- Pages: 479-488
- Section: REVIEWS
- URL: https://virusjour.crie.ru/jour/article/view/16692
- DOI: https://doi.org/10.36233/0507-4088-275
- EDN: https://elibrary.ru/yuzhvf
- ID: 16692
Cite item
Full Text
Abstract
Oncolytic viruses represent a promising class of immunotherapeutic agents for the treatment of malignant tumors. The proposed mechanism of action of various oncolytic viruses has initially been explained by the ability of such viruses to selectively lyse tumor cells without damaging healthy ones. Recently, there have emerged more studies determining the effect of the antiviral immunostimulating mechanisms on the effectiveness of treatment in cancer patients. Stimulation of innate immune cells by an oncolytic virus can initiate an adaptive antitumor immune response, yet at the same time, the antiviral mechanisms of the immune system can limit the spread of the virus, thereby reducing its effectiveness. Thus, the success of the clinical application of the oncolytic viruses directly depends on the three key components: tumor immunosuppression, antiviral responses, and antitumor immune responses.
The review presents current data on the influence of pattern recognition receptors on the effectiveness of oncolytic viruses.
Keywords
Full Text
Введение
Первые упоминания онколитических вирусов появились в ХХ в., и тогда исследования основывались на изучении вирусов дикого типа или аттенуированных вакцинных штаммов. В настоящее время наблюдается тенденция к разработке рекомбинантных онколитических вирусов с повышенной безопасностью, «вооруженных» трансгенами, которые усиливают противоопухолевое действие, в особенности в части иммуностимулирующего эффекта [1, 2]. Огромное значение имеет не только адаптивный иммунный ответ, но и работа врожденной иммунной системы как первой линии защиты организма от различных вирусных и бактериальных инфекций.
Рецепторы распознавания паттернов
Для врожденного иммунитета крайне важны рецепторы распознавания паттернов (Pattern Recognition Receptors, PRRs) – класс рецепторов, которые могут напрямую распознавать чужеродные молекулярные паттерны, ассоциированные с патогеном (Pathogen-Associated Molecular Patterns, PAMPs), например, вирусные белки, а также различные молекулярные паттерны, ассоциированные с повреждением собственных клеток (Damage-Associated Molecular Patterns, DAMPs) [3]. После взаимодействия рецепторов PRRs c чужеродным лигандом запускается каскад реакций, что приводит к выработке интерферонов (interferon, IFN) типа I и типа III, хемокинов и провоспалительных цитокинов, активирующих другие компоненты врожденного и адаптивного иммунитета [4]. Существует несколько классов рецепторов PRRs, чувствительных к вирусам (рис. 1).
Рис. 1. Рецепторы распознавания паттернов (PRRs), участвующие в противовирусном ответе.
Fig. 1. Pattern recognition receptors (PRRs) involved in the antiviral response.
Toll-подобные рецепторы
Toll-подобные рецепторы (Toll-Like Receptors, TLRs) являются первыми рецепторами PRRs, обнаруженными во врожденной иммунной системе, которые играют важную роль в воспалительных реакциях [5]. Всего у человека открыто 10 рецепторов TLRs, которые можно разделить по месту их локализации: 1-я группа – рецепторы, которые экспрессируются на поверхности клетки и в большей степени связаны с обнаружением бактериальных агентов; 2-я группа – рецепторы, которые экспрессируются в эндосомах и связаны с обнаружением нуклеиновых кислот [6]. Рецепторы TLRs представляют собой трансмембранные гликопротеины I типа, включающие внеклеточную область, которая содержит богатые лейцином повторы и отвечает за распознавание специфических лигандов, а также трансмембранную и внутриклеточную области, последняя содержит домен Toll/IL-1R (TIR), отвечающий за передачу сигнала [7]. После того как рецепторы TLRs распознают и связывают соответствующие молекулы PAMPs и DAMPs, домены TIR проводят сигналы путем связывания с различными белками-адаптерами рецепторов в цитоплазматической области [8]. Все рецепторы TLRs, кроме TLR3, используют TIR-домен для связи с адаптерным белком первичного ответа миелоидной дифференцировки 88 (Myeloid Differentiation primary response gene 88, MyD88). После активации белок MyD88 взаимодействует N-концевым доменом с семейством белков киназы, ассоциированной с рецептором интерлейкина (interleukin, IL) 1, что обусловливает их активацию и последующее фосфорилирование транскрипционного ядерного фактора каппа В (Nuclear Factor kappa B, NF-κB). Это приводит к экспрессии провоспалительных цитокинов, таких как IL-6 и фактор некроза опухоли-альфа (Tumor Necrosis Factor Alpha, TNF-α) [9–11].
Рецепторы TLR3 расположены внутри эндосом и распознают преимущественно двухцепочечную РНК (дцРНК), однако способны также связываться и с одноцепочечной РНК (оцРНК) и двухцепочечной ДНК (дцДНК) [12]. Рецепторы TLR3 широко экспрессируются в нейронах, иммунных клетках, фибробластах и различных эпителиальных клетках [13, 14]. Среди иммунных клеток TLR3 экспрессируют только миелоидные дендритные клетки (ДК), макрофаги и тучные клетки [15, 16]. После взаимодействия с нуклеиновой кислотой рецептор TLR3 активирует белок TRIF для запуска нижестоящего сигнального каскада TLR3-TRIF-IRF3/NF-κB. Белки IRF3 и IRF7 являются регуляторными факторами IFN, которые опосредуют активацию транскрипционного фактора NF-κB, при этом IRF3 активируется по пути TRIF, а IRF7 – по пути MyD88 [7].
Человеческие рецепторы TLR7 и TLR8, кодирующиеся одними и теми же генетическими локусами на Х-хромосоме, являются эндосомальными рецепторами для вирусной оцРНК и экспрессируются в моноцитах, макрофагах, нейтрофилах, миелоидных ДК и регуляторных Т-клетках [17–19]. Рецепторы TLR7/8 распознают такие вирусы, как вирус везикулярного стоматита (ВВС), вирус Сендай, вирус Коксаки типа В, а также ряд флавивирусов – вирус желтой лихорадки (ВЖЛ), вирус денге, вирус Зика и др.
Рецепторы TLR9 локализуются в поздних эндосомах или лизосомах, где распознают неметилированные мотивы цитидинфосфат-гуанозина CpG в дцДНК бактериальных и вирусных агентов [20]. При взаимодействии лиганда с рецептором TLR9 запускается MyD88-зависимый путь, опосредованный активацией разных факторов транскрипции, включая NF-κB и активаторный белок-1 (Activating Protein-1, AP-1). NF-κB и AP-1 индуцируют ДК секретировать высокие уровни провоспалительных цитокинов, включая TNF-α, IL-6 и IL-12, что приводит к быстрой активации цитотоксичности естественных киллеров и продукции IFN-γ для мощного иммунного ответа [21].
RIG-I-подобные рецепторы
RIG-I-подобные рецепторы (RIG-I-Like Receptors, RLRs) представляют собой семейство внутриклеточных РНК-рецепторов, которые в отличие от TLRs, находящихся на поверхности клеток или в эндосомальных компартментах, детектируют вирусные и бактериальные РНК в цитоплазме. В семейство рецепторов RLRs входят: рецептор RIG-I (Retinoic acid-Inducible Gene 1) – белок I, индуцируемый ретиноевой кислотой; рецептор MDA5 (Melanoma Differentiation-Associated protein 5) – белок 5, ассоциированный с дифференцировкой меланомы; и рецептор LGP2 (Laboratory of Genetics and Physiology 2) [22].
В структуру рецепторов RIG-I и MDA5 входят: два домена активации и рекрутирования каспазы (Caspase Activation and Recruitment Domains, CARD), которые опосредуют дальнейшую активацию сигнальных путей; геликазный домен RecA, отвечающий за внутреннее связывание дцРНК и функции гидролиза аденозинтрифосфата; C-концевой домен, ответственный за связывание с концами РНК [23, 24]. Рецепторы RIG-I и MDA5 состоят из одинаковых доменов и выполняют схожие функции, однако взаимодействуют с разными РНК-лигандами. При этом рецептор RIG-I преимущественно связывается с короткими оцРНК, рецептор MDA5 распознает длинные доступные дцРНК или агрегаты РНК [25, 26]. Связывание вирусной РНК с рецепторами RIG-I/MDA5 приводит к конформационным изменениям и мультимеризации домена CARD, что позволяет RIG-I взаимодействовать с митохондриальным противовирусным сигнальным белком (Mitochondrial AntiViral-Signaling protein, MAVS). Затем олигомеризованный белок MAVS запускает каскад белковых реакций TRAF3-TBK1/IKKϵ, что приводит к повышенному фосфорилированию, димеризации и ядерной транслокации IRF-3 и IRF-7, а также активации факторов транскрипции NF-κB и STAT [23, 27].
Рецептор LGP2 отличается от двух других RLRs отсутствием доменов CARD, которые необходимы для передачи сигналов. В связи с этим основной функцией LGP2 является регуляция RIG-I и MDA5 [28]. Рецептор LGP2 может ингибировать передачу сигналов RIG-I с помощью различных механизмов, таких как прерывание взаимодействия между рецептором RIG-I и белком MAVS [29, 30], предотвращение связывания вирусной дцРНК с рецептором RIG-I [31] и подавление опосредованного белком TRIM25 убиквитинирования рецептора RIG-I [32]. Рецепторы RLRs в большей степени распознают геномы РНК-вирусов, а также промежуточные продукты репликации вирусов, что играет важную роль в инициации противовирусного врожденного иммунного ответа против разных РНК-вирусов [22, 33].
cGAS и другие ДНК-рецепторы
На сегодняшний день в геноме человека найдено более 14 рецепторов, распознающих ДНК. Наиболее универсальный и важный – это рецептор циклической гуанозинмонофосфат-аденозинмонофосфат-синтазы (cyclic GMP-AMP synthase, cGAS), который распознает дцДНК независимо от последовательности [34]. После связывания с ДНК рецепторы задействуют адаптерные белки, такие как стимулятор генов интерферона (STimulator of INterferon Genes, STING), MyD88 или β-катенин, которые активируют факторы транскрипции IRF3, IRF7 [35]. Белок STING ‒ это трансмембранный белок, локализованный в неактивном состоянии в эндоплазматическом ретикулуме в виде димера, который активируется следующими рецепторами, распознающими ДНК: cGAS, IFI16, IFIX, ZBP1/DAI, DDX41 и MRE11-Rad 50 [36–42]. Активация факторов транскрипции белком STING индуцирует экспрессию генов IFN типа I и III, цитокинов и хемокинов, что приводит к противовирусному состоянию клетки и ее окружения.
Онколитические вирусы – тенденции
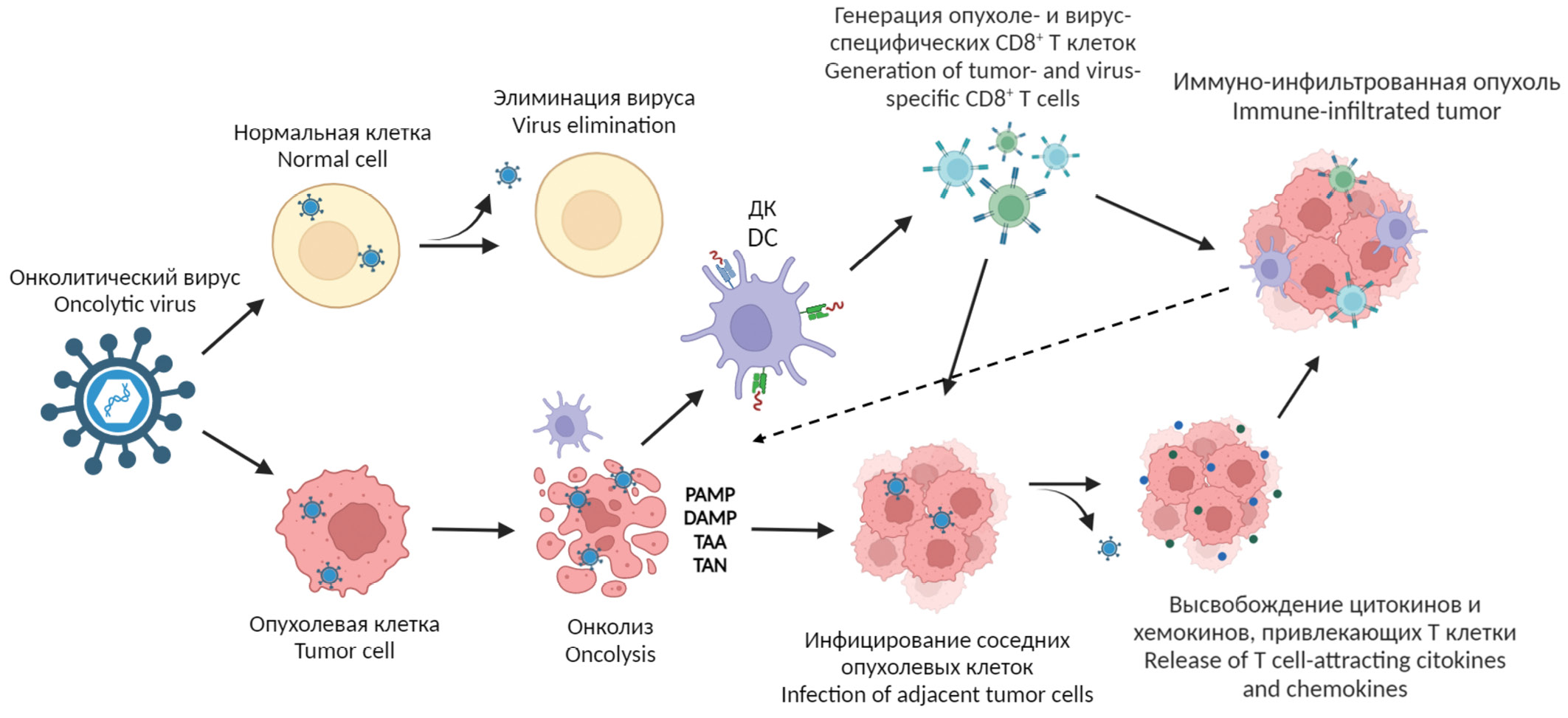
В зависимости от особенностей репликации различных онколитических вирусов и их взаимодействий с иммунной системой хозяина, механизм их действия может различаться (рис. 2). На данный момент выделяют два механизма действия онколитических вирусов – прямой лизис опухолевых клеток (онколиз) и иммуногенная клеточная гибель, индуцированная воздействием вируса [43, 44]. Часто для достижения терапевтического эффекта задействованы оба механизма, как, например, при использовании вируса простого герпеса 1-го типа (ВПГ-1) в качестве онколитического агента [45]. Первоначальным механизмом действия ВПГ-1 является прямой лизис опухолевых клеток. После связывания с рецепторами и проникновения в клетку ВПГ-1 реплицируется, лизирует ее, высвобождая вирусные частицы для дальнейшего заражения соседних опухолевых клеток [45, 46].
Рис. 2. Механизмы действия онколитических вирусов.
Fig. 2. Mechanisms of oncolytic virus action.
На этом этапе запускается следующий механизм действия онколитических вирусов – индукция противовирусного и противоопухолевого иммунного ответа. Иммуногенная клеточная гибель, индуцированная воздействием вируса, включая иммуногенный апоптоз, некроптоз и пироптоз, приводит к высвобождению множества молекул, в том числе PAMP, DAMP, а также опухоль-ассоциированных антигенов (Tumor-Associated Antigens, TAA) и опухоль-ассоциированных неоантигенов (Tumor-Associated Neoantigens, TAN) [47, 48]. Идентификация PAMP/DAMP через PRRs в опухолевых или иммунных клетках запускает экспрессию провоспалительных цитокинов, IFN типа I, IL-1β, IL-6, IL-12, TNF-α и хемокины, такие как CCL2, CCL3, CCL5 и CXCL10 [49]. Хемокины привлекают нейтрофилы и макрофаги к очагам инфекции, а цитокины стимулируют активность клеток врожденного иммунитета, таких как дендритные и NK-клетки, которые дополнительно стимулируют продукцию IFN, TNF-α, IL-12, IL-6 и новых хемокинов, что приводит к усилению врожденного иммунного ответа и превращению иммунологически «холодных» опухолей в «горячие» [50, 51]. Также иммуногенность онколитического вируса можно увеличить с помощью различных трансгенов, например, цитокинов (IL-15, IL-12, гранулоцитарно-макрофагальный колониестимулирующий фактор) или полноразмерных антител (анти-CD47, анти-PD-1) [52–54]. Таким образом, различные вирусы могут активировать разные классы PRRs (таблица), что способствует стимуляции врожденного и адаптивного иммунных ответов.
Таблица. Взаимодействие различных вирусов с рецепторами PRRs
Table. The interaction of various viruses with PRRs
Группы вирусов Virus groups | Семейство вирусов Virus family | Онколитический вирус Oncolytic virus | PRRs | Ссылки References |
оцРНК(–) ssRNA(–) | Rhabdoviridae | Вирус везикулярного стоматита Vesicular stomatitis virus | TLR7, RIG-1 | [55–57] |
Paramyxoviridae | Сендай вирус Sendai virus | TLR7, RIG-1 | ||
Paramyxoviridae | Вирус болезни Ньюкасла Newcastle disease virus | TLR7, RIG-1, MDA5 | ||
оцРНК(+) ssRNA(+) | Flaviviridae | Вирус желтой лихорадки Yellow fever virus | TLR7, RIG-1, MDA5 | |
Flaviviridae | Вирус денге Dengue virus | TLR3, TLR7/8, RIG-1, MDA5 | [64–66] | |
Flaviviridae | Вирус Зика Zika virus | TLR3, TLR7/8, RIG-1, MDA5 | [66–68] | |
Flaviviridae | Вирус японского энцефалита Japanese encephalitis virus | TLR3, TLR7/8, RIG-1 | [69–71] | |
Flaviviridae | Вирус Западного Нила West Nile virus | TLR3, TLR7/8, RIG-1 | ||
Picornaviridae | Полиовирус Poliovirus | TLR3, TLR7/8, MDA5 | ||
дцРНК dsRNA | Spinareoviridae | Реовирус Reovirus | TLR3, RIG-1 | |
Sedoreoviridae | Ротавирус Rotavirus | TLR3, RIG-1, MDA5 | ||
дцДНК dsDNA | Orthoherpesviridae | Вирус простого герпеса 1-го типа Herpes simplex virus 1 type | TLR9, RIG-1, cGAS/STING | [80–82] |
Adenoviridae | Аденовирус типа 5 Adenovirus 5 type | TLR9, cGAS/STING |
Хорошо известно, что дефекты в путях IFN способствуют прогрессированию рака – выживанию и ускоренной пролиферации злокачественных клеток [85]. Немалая часть подавляющих эпигенетических изменений, связанных с канцерогенезом, относится к генам, вовлеченным в IFN-пути [86]. Такая ситуация часто наблюдается при раке мочевого пузыря, глиомах и лейкемиях [87–89]. С другой стороны, такие дефекты иммунного ответа облегчают репликацию вирусов и, таким образом, повышают эффективность вирусного онколиза.
Стратегии нацеливания на PRRs при иммунотерапии рака
Результаты исследований онколитического действия реовируса на клеточной линии рака яичников OV-90 показали, что быстро реплицирующийся в опухолевых клетках реовирус приводит к высвобождению большого количества вирусных частиц и вирусной дцРНК. Высвободившиеся молекулы PAMPs через сигнальный путь рецептора TLR3 активируют транскрипционные факторы NF-κB и IRF-3 и индуцируют апоптическую гибель опухолевых клеток [76].
Живая аттенуированная вакцина на основе штамма 17D вируса ВЖЛ продемонстрировала высокий потенциал в качестве онколитического вируса [2]. Вакцинный штамм 17D ВЖЛ является классическим представителем семейства Flaviridae, геном которого представляет собой (+)оцРНК. При инфицировании клетки 17D ВЖЛ распознается эндосомальными рецепторами TLR7, расположенными на ДК, а также рецептором RIG-I, который относится к RLRs [62, 90]. В результате запускается сигнальный каскад реакций, который стимулирует выработку IFN типа I и активацию противовирусного ответа.
Изучение генетически модифицированного аденовируса Ad5D24, содержащего 18 иммуностимулирующих островков CpG (Ad5D24-CpG), на ксенотрансплантатной модели рака легкого продемонстрировало повышенную противоопухолевую активность Ad5D24-CpG по сравнению с онколитическим аденовирусом в отдельности, а также с комбинацией онколитического аденовируса и CpG-олигонуклеотидов [83]. Было показано, что повышенная противоопухолевая активность Ad5D24-CpG обусловлена активацией естественных киллеров.
ВВС относится к семейству Rhabdoviridae, и его геном представлен (−)оцРНК, которая кодирует 5 белков: белок нуклеокапсида, фосфопротеин, матричный белок, гликопротеин и полимеразу. Инфекция, вызванная ВВС, у человека обычно протекает бессимптомно, что делает его перспективным онколитическим терапевтическим агентом [91]. Репликация ВВС в клетках может генерировать дефектную интерферирующую РНК (диРНК), усеченную форму генома ВВС. Как диРНК, так и весь геном ВВС при попадании в клетку может активировать рецептор RIG-I, вызывая противовирусный иммунный ответ [55]. Однако матриксный белок ВВС, который нацелен на нуклеопорин Nup98, способен ингибировать нуклеоцитоплазматический транспорт мРНК клетки, тем самым подавляя экспрессию белков, включая IFN и провоспалительные цитокины, за счет чего в инфицированных клетках иммунные ответы на инфекцию, вызванную ВВС, могут быть подавлены [92]. Сообщалось, что рекомбинантный штамм ΔM51 ВВС является отличным кандидатом в онколитические вирусы, т.к. способен оказывать селективное действие при раке толстой кишки и раке поджелудочной железы [93, 94]. Z. Zhang и соавт. показали, что внутриопухолевая инъекция ΔM51 ВВС на мышиной модели рака легкого эффективно снижает рост опухоли [56].
Вирус болезни Ньюкасла, который относится к семейству Paramyxoviridae и имеет (−)оцРНК геном, является еще одним кандидатом в онколитические вирусы. После инфицирования линии клеток рака яичников человека OVCAR3 рекомбинантным низкопатогенным вирусом болезни Ньюкасла наблюдалась опосредованная рецепторами RIG-I и MDA5 экспрессия IFN типа I, что способствовало противоопухолевому эффекту [60].
Ротавирусы, вызывающие гастроэнтерит у людей и многих позвоночных, принадлежат к семейству Reoviridae и имеют геном, состоящий из дцРНК. Было показано, что штаммы ротавируса могут индуцировать MDA5-опосредованный иммунный ответ [78]. T. Shekarian и соавт. сообщили о том, что вакцинный штамм ротавируса при внутриопухолевом введении активирует рецепторы дцРНК RIG-I и MDA5, стимулирует передачу сигналов IFN типа I, что приводит к инфильтрирации в опухоль миелоидных и CD8+ клеток [79].
ВПГ-1 является членом семейства Orthoherpesviridae, а его геном представлен дцДНК длиной 152 т.п.о. Одним из первых препаратов на основе ВПГ-1 был Talimogene Laherparepvec (T-VEC), одобренный FDA (Food and Drug Administration) в 2015 г. для лечения неоперабельной меланомы [95]. T-VEC представляет собой рекомбинантный ВПГ-1 с делецией в гене ICP34.5, гене ICP47 и вставкой, кодирующей гранулоцитарно-макрофагальный колониестимулирующий фактор. Было показано, что при инфицировании ВПГ-1 цитозольная митохондриальная ДНК усиливает RIG-I-опосредованную индукцию IFN I типа [80]. Однако не стоит забывать, что ВПГ-1 способен уклоняться от врожденного иммунного ответа благодаря различным механизмам, в том числе при помощи вирусных белков US3 и US11, которые ингибируют передачу сигналов рецепторов RIG-1/MDA5 [96, 97].
Также установлено, что разные флавивирусы, включая вирус Зика и вирус денге, активируют рецепторы TLR3, RIG-1, MDA5, опосредуя дальнейшую сигнализацию путей IFN и формирование противовирусного иммунного ответа [64, 67].
Иммунная сигнализация, опосредованная STING, в значительной степени нарушена в клетках меланомы, рака толстой кишки человека, и, скорее всего, похожая картина будет наблюдаться при других типах рака [98, 99]. Потеря функции STING сделала клетки меланомы более восприимчивыми к ВПГ-1 из-за нарушенных путей IFN типа I и других цитокинов. Такой эффект наблюдался для различных онколитических вирусов на основе ВПГ в клетках меланомы, рака яичников, в мышиной модели аденокарциномы протоков поджелудочной железы и колоректальной карциномы [81, 98–100]. Таким образом, онколитические вирусы являются перспективными кандидатами в современной онкотерапии против раковых заболеваний с нарушенной сигнализацией STING. На основе этого механизма уже проводится тестирование рекомбинантных онколитических вирусов со встроенными агонистами STING, например, STINGPOX на основе вируса осповакцины, а также стратегий комбинированной терапии онколитических вирусов с агонистами STING, например реовирус с агонистом ADU-S100 (MIW815) и ВПГ-1 с агонистом C-REV [101–103].
Заключение
Рецепторы PRRs играют ключевую роль в защите организма хозяина от разных вирусных инфекций. Хотя основной задачей рецепторов PRRs является скорейшая элиминация вируса, внутриопухолевое введение онколитического вируса способно активировать сигнальные пути TLRs/RLRs/cGAS-STING, тем самым превратить иммунологически «холодные» опухоли в «горячие», т.е. инфильтрованные иммунными клетками. Приобретение статуса иммунологически «горячей» опухоли будет способствовать активации Т-клеточного ответа, подавлению опухолевой иммуносупрессии, повышая эффект иммунотерапии. Однако активация противовирусного иммунного ответа будет способствовать элиминации онколитического вируса из организма, что также может повлиять на терапевтический эффект.
Успешное применение онколитического вируса для иммунотерапии злокачественных новообразований требует тщательного изучения механизмов взаимодействия конкретного вируса с иммунной системой пациента, включая характерные для семейства вируса взаимодействия с разными PRRs, систему уклонения вируса от иммунного ответа. С другой стороны, не менее важным является определение фенотипических, морфологических и эпигенетических особенностей пула опухолевых клеток пациента, что также поможет предсказать эффект от иммуноопосредованного действия онколитического вируса.
About the authors
Kirill N. Trachuk
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Author for correspondence.
Email: trachuk_kn@chumakovs.su
ORCID iD: 0000-0002-2061-0274
P.G. student, Junior researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides
Russian Federation, 108819, MoscowNikolai B. Pestov
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: trachuk_kn@chumakovs.su
ORCID iD: 0000-0002-9973-0120
Ph. D., Senior Researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides
Russian Federation, 108819, MoscowYulia K. Biryukova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: trachuk_kn@chumakovs.su
ORCID iD: 0000-0002-5804-4001
Ph. D., Researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides
Russian Federation, 108819, MoscowNadezhda M. Kolyasnikova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: trachuk_kn@chumakovs.su
ORCID iD: 0000-0002-9934-2582
Dr. Sci. (Med.), Leading Researcher, Head of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides
Russian Federation, 108819, MoscowReferences
- Kolyasnikova N.M., Pestov N.B., Sanchez-Pimentel J.P., Barlev N.A., Ishmukhametov A.A. Anti-cancer virotherapy in Russia): lessons from the past, current challenges and prospects for the future. Curr. Pharm. Biotechnol. 2023; 24(2): 266–78. https://doi.org/10.2174/1389201023666220516121813
- Nazarenko A.S., Vorovitch M.F., Biryukova Y.K., Pestov N.B., Orlova E.A., Barlev N.A., et al. Flaviviruses in antitumor therapy. Viruses. 2023; 15(10): 1973. https://doi.org/10.3390/v15101973
- Li D., Wu M. Pattern recognition receptors in health and diseases. Sig. Transduct. Target. Ther. 2021; 6(1): 291. https://doi.org/10.1038/s41392-021-00687-0
- Medzhitov R., Preston-Hurlburt P., Janeway C.A. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature. 1997; 388(6640): 394–7. https://doi.org/10.1038/41131
- Fitzgerald K.A., Kagan J.C. Toll-like receptors and the control of immunity. Cell. 2020; 180(6): 1044–66. https://doi.org/10.1016/j.cell.2020.02.041
- Behzadi P., García-Perdomo H.A., Karpiński T.M. Toll-like receptors: general molecular and structural biology. J. Immunol. Res. 2021; 2021: 9914854. https://doi.org/10.1155/2021/9914854
- Kawai T., Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors. Nat. Immunol. 2010; 11(5): 373–84. https://doi.org/10.1038/ni.1863
- Xu Y., Tao X., Shen B., Horng T., Medzhitov R., Manley J.L., et al. Structural basis for signal transduction by the Toll/interleukin-1 receptor domains. Nature. 2000; 408(6808): 111–5. https://doi.org/10.1038/35040600
- Suzuki N., Suzuki S., Duncan G.S., Millar D.G., Wada T., Mirtsos C., et al. Severe impairment of interleukin-1 and Toll-like receptor signalling in mice lacking IRAK-4. Nature. 2002; 416(6882): 750–4. https://doi.org/10.1038/nature736
- Baccala R., Gonzalez-Quintial R., Lawson B.R., Stern M.E., Kono D.H., Beutler B., et al. Sensors of the innate immune system: their mode of action. Nat. Rev. Rheumatol. 2009; 5(8): 448–56. https://doi.org/10.1038/nrrheum.2009.136
- Brown J., Wang H., Hajishengallis G.N., Martin M. TLR-signaling networks: an integration of adaptor molecules, kinases, and cross-talk. J. Dent. Res. 2011; 90(4): 417–27. https://doi.org/10.1177/0022034510381264
- Kawai T., Akira S. Toll-like receptors and their crosstalk with other innate receptors in infection and immunity. Immunity. 2011; 34(5): 637–50. https://doi.org/10.1016/j.immuni.2011.05.006
- Bugge M., Bergstrom B., Eide O.K., Solli H., Kjønstad I.F., Stenvik J., et al. Surface Toll-like receptor 3 expression in metastatic intestinal epithelial cells induces inflammatory cytokine production and promotes invasiveness. J. Biol. Chem. 2017; 292(37): 15408–25. https://doi.org/10.1074/jbc.m117.784090
- Chen C.Y., Shih Y.C., Hung Y.F., Hsueh Y.P. Beyond defense: regulation of neuronal morphogenesis and brain functions via Toll-like receptors. J. Biomed. Sci. 2019; 26(1): 90. https://doi.org/10.1186/s12929-019-0584-z
- Matsumoto M., Oshiumi H., Seya T. Antiviral responses induced by the TLR3 pathway. Rev. Med. Virol. 2011; 21(2): 67–77. https://doi.org/10.1002/rmv.680
- Agier J., Żelechowska P., Kozłowska E., Brzezińska-Błaszczyk E. Expression of surface and intracellular Toll-like receptors by mature mast cells. Cent. Eur. J. Immunol. 2016; (4): 333–8. https://doi.org/10.5114/ceji.2016.65131
- Kolli D., Velayutham T., Casola A. Host-viral interactions: role of pattern recognition receptors (PRRs) in human pneumovirus infections. Pathogens. 2013; 2(2): 232–63. https://doi.org/10.3390/pathogens2020232
- Tomai M.A., Vasilakos J.P. Toll-like receptor 7 and 8 agonists for vaccine adjuvant use. In: Immunopotentiators in Modern Vaccines. Elsevier; 2017: 149–62.
- Peng G., Guo Z., Kiniwa Y., Voo K.S., Peng W., Fu T., et al. Toll-like receptor 8-mediated reversal of CD4+ regulatory T cell function. Science. 2005; 309(5739): 1380–4. https://doi.org/10.1126/science.1113401
- Cerullo V., Seiler M.P., Mane V., Brunetti-Pierri N., Clarke C., Bertin T.K., et al. Toll-like receptor 9 triggers an innate immune response to helper-dependent adenoviral vectors. Mol. Ther. 2007; 15(2): 378–85. https://doi.org/10.1038/sj.mt.6300031
- Kumagai Y., Takeuchi O., Akira S. TLR9 as a key receptor for the recognition of DNA. Adv. Drug Deliv. Rev. 2008; 60(7): 795–804. https://doi.org/10.1016/j.addr.2007.12.004
- Rehwinkel J., Gack M.U. RIG-I-like receptors: their regulation and roles in RNA sensing. Nat. Rev. Immunol. 2020; 20(9): 537–51. https://doi.org/10.1038/s41577-020-0288-3
- Ramos H.J., Gale M. RIG-I like receptors and their signaling crosstalk in the regulation of antiviral immunity. Curr. Opin. Virol. 2011; 1(3): 167–76. https://doi.org/10.1016/j.coviro.2011.04.004
- Kowalinski E., Lunardi T., McCarthy A.A., Louber J., Brunel J., Grigorov B., et al. Structural basis for the activation of innate immune pattern-recognition receptor RIG-I by viral RNA. Cell. 2011; 147(2): 423–35. https://doi.org/10.1016/j.cell.2011.09.039
- Luo D. Toward a crystal-clear view of the viral RNA sensing and response by RIG-I-like receptors. RNA Biol. 2014; 11(1): 25–32. https://doi.org/10.4161/rna.27717
- Feng Q., Hato S.V., Langereis M.A., Zoll J., Virgen-Slane R., Peisley A., et al. MDA5 detects the double-stranded RNA replicative form in picornavirus-infected cells. Cell Rep. 2012; 2(5): 1187–96. https://doi.org/10.1016/j.celrep.2012.10.005
- Onomoto K., Onoguchi K., Yoneyama M. Regulation of RIG-I-like receptor-mediated signaling): interaction between host and viral factors. Cell. Mol. Immunol. 2021; 18(3): 539–55. https://doi.org/10.1038/s41423-020-00602-7
- Gong X.Y., Zhang Q.M., Zhao X., Li Y.L., Qu Z.L., Li Z., et al. LGP2 is essential for zebrafish survival through dual regulation of IFN antiviral response. iScience. 2022; 25(8): 104821. https://doi.org/10.1016/j.isci.2022.104821
- Esser-Nobis K., Hatfield L.D., Gale M. Spatiotemporal dynamics of innate immune signaling via RIG-I–like receptors. Proc. Natl. Acad. Sci. USA. 2020; 117(27): 15778–88. https://doi.org/10.1073/pnas.1921861117
- Saito T., Hirai R., Loo Y.M., Owen D., Johnson C.L., Sinha S.C., et al. Regulation of innate antiviral defenses through a shared repressor domain in RIG-I and LGP2. Proc. Natl. Acad. Sci. USA. 2007; 104(2): 582–7. https://doi.org/10.1073/pnas.0606699104
- Rothenfusser S., Goutagny N., DiPerna G., Gong M., Monks B.G., Schoenemeyer A., et al. The RNA helicase Lgp2 inhibits TLR-independent sensing of viral replication by retinoic acid-inducible gene-I. J. Immunol. 2005; 175(8): 5260–8. https://doi.org/10.4049/jimmunol.175.8.5260
- Quicke K.M., Kim K.Y., Horvath C.M., Suthar M.S. RNA helicase LGP2 negatively regulates RIG-I signaling by preventing TRIM25-mediated caspase activation and recruitment domain ubiquitination. J. Interferon Cytokine Res. 2019; 39(11): 669–83. https://doi.org/10.1089/jir.2019.0059
- Yoneyama M., Kikuchi M., Natsukawa T., Shinobu N., Imaizumi T., Miyagishi M., et al. The RNA helicase RIG-I has an essential function in double-stranded RNA-induced innate antiviral responses. Nat. Immunol. 2004; 5(7): 730–7. https://doi.org/10.1038/ni1087
- Korneenko T.V., Pestov N.B., Nevzorov I.A., Daks A.A., Trachuk K.N., Solopova O.N., et al. At the crossroads of the cGAS-cGAMP-STING pathway and the DNA damage response: implications for cancer progression and treatment. Pharmaceuticals (Basel). 2023; 16(12): 1675. https://doi.org/10.3390/ph16121675
- De Oliveira Mann C.C., Hornung V. Molecular mechanisms of nonself nucleic acid recognition by the innate immune system. Eur. J. Immunol. 2021; 51(8): 1897–910. https://doi.org/10.1002/eji.202049116
- Diner B.A., Li T., Greco T.M., Crow M.S., Fuesler J.A., Wang J., et al. The functional interactome of PYHIN immune regulators reveals IFIX is a sensor of viral DNA. Mol. Syst. Biol. 2015; 11(1): 787. https://doi.org/10.15252/msb.20145808
- Unterholzner L., Keating S.E., Baran M., Horan K.A., Jensen S.B., Sharma S., et al. IFI16 is an innate immune sensor for intracellular DNA. Nat. Immunol. 2010; 11(11): 997–1004. https://doi.org/10.1038/ni.1932
- Takaoka A., Wang Z., Choi M.K., Yanai H., Negishi H., Ban T., et al. DAI (DLM-1/ZBP1) is a cytosolic DNA sensor and an activator of innate immune response. Nature. 2007; 448(7152): 501–5. https://doi.org/10.1038/nature06013
- Wu J., Sun L., Chen X., Du F., Shi H., Chen C., et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA. Science. 2013; 339(6121): 826–30. https://doi.org/10.1126/science.1229963
- Zhang Z., Yuan B., Bao M., Lu N., Kim T., Liu Y.J. The helicase DDX41 senses intracellular DNA mediated by the adaptor STING in dendritic cells. Nat. Immunol. 2011; 12(10): 959–65. https://doi.org/10.1038/ni.2091
- Kondo T., Kobayashi J., Saitoh T., Maruyama K., Ishii K.J., Barber G.N., et al. DNA damage sensor MRE11 recognizes cytosolic double-stranded DNA and induces type I interferon by regulating STING trafficking. Proc. Natl. Acad. Sci. USA. 2013; 110(8): 2969–74. https://doi.org/10.1073/pnas.1222694110
- Ablasser A., Goldeck M., Cavlar T., Deimling T., Witte G., Röhl I., et al. cGAS produces a 2′-5′-linked cyclic dinucleotide second messenger that activates STING. Nature. 2013; 498(7454): 380–4. https://doi.org/10.1038/nature12306
- Russell L., Peng K.W. The emerging role of oncolytic virus therapy against cancer. Chin. Clin. Oncol. 2018; 7(2): 16. https://doi.org/10.21037/cco.2018.04.04
- Kaufman H.L., Kohlhapp F.J., Zloza A. Oncolytic viruses: a new class of immunotherapy drugs. Nat. Rev. Drug Discov. 2015; 14(9): 642–62. https://doi.org/10.1038/nrd4663
- Lou E. Oncolytic herpes viruses as a potential mechanism for cancer therapy. Acta Oncol. 2003; 42(7): 660–71. https://doi.org/10.1080/0284186031000518
- Chiocca E.A. Oncolytic viruses: 12. Nat. Rev. Cancer. 2002; 2(12): 938–50. https://doi.org/10.1038/nrc948
- Ahmed A., Tait S.W.G. Targeting immunogenic cell death in cancer. Mol. Oncol. 2020; 14(12): 2994–3006. https://doi.org/10.1002/1878-0261.12851
- Ma J., Ramachandran M., Jin C., Quijano-Rubio C., Martikainen M., Yu D., et al. Characterization of virus-mediated immunogenic cancer cell death and the consequences for oncolytic virus-based immunotherapy of cancer. Cell. Death Dis. 2020; 11(1): 48. https://doi.org/10.1038/s41419-020-2236-3
- Gujar S., Pol J.G., Kim Y., Lee P.W., Kroemer G. Antitumor benefits of antiviral immunity: an underappreciated aspect of oncolytic virotherapies. Trends Immunol. 2018; 39(3): 209–21. https://doi.org/10.1016/j.it.2017.11.006
- Kleijn A., Kloezeman J., Treffers-Westerlaken E., Fulci G., Leenstra S., Dirven C., et al. The in vivo therapeutic efficacy of the oncolytic adenovirus Delta24-RGD is mediated by tumor-specific immunity. PLoS One. 2014; 9(5): e97495. https://doi.org/10.1371/journal.pone.0097495
- Guo Z.S., Liu Z., Bartlett D.L. Oncolytic immunotherapy: dying the right way is a key to eliciting potent antitumor immunity. Front. Oncol. 2014; 4: 74. https://doi.org/10.3389/fonc.2014.00074
- Hu Z., Li Y., Yang J., Liu J., Zhou H., Sun C., et al. Improved antitumor effectiveness of oncolytic HSV-1 viruses engineered with IL-15/IL-15Rα complex combined with oncolytic HSV-1-aPD1 targets colon cancer. Sci. Rep. 2024; 14(1): 23671. https://doi.org/10.1038/s41598-024-72888-w
- Xu B., Tian L., Chen J., Wang J., Ma R., Dong W., et al. An oncolytic virus expressing a full-length antibody enhances antitumor innate immune response to glioblastoma. Nat. Commun. 2021; 12(1): 5908. https://doi.org/10.1038/s41467-021-26003-6
- Aldrak N., Alsaab S., Algethami A., Bhere D., Wakimoto H., Shah K., et al. Oncolytic herpes simplex virus-based therapies for cancer. Cells. 2021; 10(6): 1541. https://doi.org/10.3390/cells10061541
- Linder A., Bothe V., Linder N., Schwarzlmueller P, Dahlström F., Bartenhagen C., et al. Defective interfering genomes and the full-length viral genome trigger RIG-I after infection with vesicular stomatitis virus in a replication dependent manner. Front. Immunol. 2021; 12: 595390. https://doi.org/10.3389/fimmu.2021.595390
- Zhang P., Han X., Tan W., Chen D., Sun Q. RIG-I-mediated innate immune signaling in tumors reduces the therapeutic effect of oncolytic vesicular stomatitis virus. Thorac. Cancer. 2023; 14(3): 246–53. https://doi.org/10.1111/1759-7714.14740
- Solmaz G., Puttur F., Francozo M., Lindenberg M., Guderian M., Swallow M., et al. TLR7 controls VSV replication in CD169+ SCS macrophages and associated viral neuroinvasion. Front. Immunol. 2019; 10: 466. https://doi.org/10.3389/fimmu.2019.00466
- Melchjorsen J., Jensen S.B., Malmgaard L., Rasmussen S.B., Weber F., Bowie A.G., et al. Activation of innate defense against a paramyxovirus is mediated by RIG-I and TLR7 and TLR8 in a cell-type-specific manner. J. Virol. 2005; 79(20): 12944–51. https://doi.org/10.1128/jvi.79.20.12944-12951.2005
- De Marcken M., Dhaliwal K., Danielsen A.C., Gautron A.S., Dominguez-Villar M. TLR7 and TLR8 activate distinct pathways in monocytes during RNA virus infection. Sci. Signal. 2019; 12(605): eaaw1347. https://doi.org/10.1126/scisignal.aaw1347
- Rangaswamy U.S., Wang W., Cheng X., McTamney P., Carroll D., Jin H. Newcastle disease virus establishes persistent infection in tumor cells in vitro: contribution of the cleavage site of fusion protein and second sialic acid binding site of hemagglutinin-neuraminidase. J. Virol. 2017; 91(16): e00770-17. https://doi.org/10.1128/jvi.00770-17
- Zhang P., Ding Z., Liu X., Chen Y., Li J., Tao Z., et al. Enhanced replication of virulent Newcastle disease virus in chicken macrophages is due to polarized activation of cells by inhibition of TLR7. Front. Immunol. 2018; 9: 366. https://doi.org/10.3389/fimmu.2018.00366
- Bruni D., Chazal M., Sinigaglia L., Chauveau L., Schwartz O., Desprès P., et al. Viral entry route determines how human plasmacytoid dendritic cells produce type I interferons. Sci. Signal. 2015; 8(366): ra25. https://doi.org/10.1126/scisignal.aaa1552
- Querec T.D., Akondy R.S., Lee E.K., Cao W., Nakaya H.I., Teuwen D., et al. Systems biology approach predicts immunogenicity of the yellow fever vaccine in humans. Nat. Immunol. 2009; 10(1): 116–25. https://doi.org/10.1038/ni.1688
- Nasirudeen A.M., Wong H.H., Thien P., Xu S., Lam K.P., Liu D.X. RIG-I, MDA5 and TLR3 synergistically play an important role in restriction of Dengue virus infection. PLoS Negl. Trop. Dis. 2011; 5(1): e926. https://doi.org/10.1371/journal.pntd.0000926
- Ye S., Liang Y., Chang Y., Lai B., Zhong J. Dengue virus replicative-form dsRNA is recognized by RIG-I and MDA5 cooperatively to activate innate immunity. bioRxiv. 2024. Preprint. https://doi.org/10.1101/2024.10.15.618382
- Sekaran S.D., Ismail A.A., Thergarajan G., Chandramathi S., Rahman S.K.H., Mani R.R., et al. Host immune response against DENV and ZIKV infections. Front. Cell. Infect. Microbiol. 2022; 12: 975222. https://doi.org/10.3389/fcimb.2022.975222
- Lu A.Y., Gustin A., Newhouse D., Gale M. Jr. Viral protein accumulation of Zika virus variants links with regulation of innate immunity for differential control of viral replication, spread, and response to interferon. J. Virol. 2023; 97(5): e01982-22. https://doi.org/10.1128/jvi.01982-22
- da Silva M.H.M., Moises R.N.C., Alves B.E.B., Pereira H.W.B., de Paiva A.A.P., Morais I.C., et al. Innate immune response in patients with acute Zika virus infection. Med. Microbiol. Immunol. 2019; 208(6): 703–14. https://doi.org/10.1007/s00430-019-00588-8
- Jiang R., Ye J., Zhu B., Song Y., Chen H., Cao S. Roles of TLR3 and RIG-I in mediating the inflammatory response in mouse microglia following Japanese encephalitis virus infection. J. Immunol. Res. 2014; 2014(1): 787023. https://doi.org/10.1155/2014/787023
- Nazmi A., Mukherjee S., Kundu K., Dutta K., Mahadevan A., Shankar S.K., et al. TLR7 is a key regulator of innate immunity against Japanese encephalitis virus infection. Neurobiol. Dis. 2014; 69: 235–47. https://doi.org/10.1016/j.nbd.2014.05.036
- Awais M., Wang K., Lin X., Qian W., Zhang N., Wang C., et al. TLR7 deficiency leads to TLR8 compensative regulation of immune response against JEV in mice. Front. Immunol. 2017; 8: 160. https://doi.org/10.3389/fimmu.2017.00160
- Welte T., Reagan K., Fang H., Machain-Williams C., Zheng X., Mendell N., et al. Toll-like receptor 7-induced immune response to cutaneous West Nile virus infection. J. Gen. Virol. 2009; 90(Pt. 11): 2660–8. https://doi.org/10.1099/vir.0.011783-0
- Lim S.M., Koraka P., Osterhaus A.D., Martina B.E. West Nile virus: immunity and pathogenesis. Viruses. 2011; 3(6): 811–28. https://doi.org/10.3390/v3060811
- Oshiumi H., Okamoto M., Fujii K., Kawanishi T., Matsumoto M., Koike S., et al. The TLR3/TICAM-1 pathway is mandatory for innate immune responses to poliovirus infection. J. Immunol. 2011; 187(10): 5320–7. https://doi.org/10.4049/jimmunol.1101503
- Mohanty M.C., Deshpande J.M. Differential induction of Toll-like receptors & type 1 interferons. Indian J. Med. Res. 2013; 138(2): 209–18.
- An Y., Wang X., Wu X., Chen L., Yang Y., Lin X., et al. Oncolytic reovirus induces ovarian cancer cell apoptosis in a TLR3-dependent manner. Virus Res. 2021; 301: 198440. https://doi.org/10.1016/j.virusres.2021.198440
- Rice M., Tili E., Loghmani H., Nuovo G.J. The differential expression of toll like receptors and RIG-1 correlates to the severity of infectious diseases. Ann. Diagn. Pathol. 2023; 63: 152102. https://doi.org/10.1016/j.anndiagpath.2022.152102
- Dou Y., Yim H.C., Kirkwood C.D., Williams B.R., Sadler A.J. The innate immune receptor MDA 5 limits rotavirus infection but promotes cell death and pancreatic inflammation. EMBO J. 2017; 36(18): 2742–57. https://doi.org/10.15252/embj.201696273
- Shekarian T., Sivado E., Jallas A.C., Depil S., Kielbassa J., Janoueix-Lerosey I., et al. Repurposing rotavirus vaccines for intratumoral immunotherapy can overcome resistance to immune checkpoint blockade. Sci. Transl. Med. 2019; 11(515): eaat5025. https://doi.org/10.1126/scitranslmed.aat5025
- Berry N., Suspène R., Caval V., Khalfi P., Beauclair G., Rigaud S., et al. Herpes simplex virus type 1 Infection disturbs the mitochondrial network, leading to type I interferon production through the RNA polymerase III/RIG-I pathway. mBio. 2021; 12(6): e0255721. https://doi.org/10.1128/mbio.02557-21
- Zhang N., Guan Y., Li J., Yu J., Yi T. Inactivation of the DNA-sensing pathway facilitates oncolytic herpes simplex virus inhibition of pancreatic ductal adenocarcinoma growth. Int. Immunopharmacol. 2023; 124(Pt. B): 110969. https://doi.org/10.1016/j.intimp.2023.110969
- Zyzak J., Mitkiewicz M., Leszczyńska E., Reniewicz P., Moynagh P.N., Siednienko J. HSV-1/TLR9-mediated IFNβ and TNFα induction is mal-dependent in macrophages. J. Innate Immun. 2020; 12(5): 387–98. https://doi.org/10.1159/000504542
- Cerullo V., Diaconu I., Romano V., Hirvinen M., Ugolini M., Escutenaire S., et al. An oncolytic adenovirus enhanced for toll-like receptor 9 stimulation increases antitumor immune responses and tumor clearance. Mol. Ther. 2012; 20(11): 2076–86. https://doi.org/10.1038/mt.2012.137
- He T., Hao Z., Lin M., Xin Z., Chen Y., Ouyang W., et al. Oncolytic adenovirus promotes vascular normalization and nonclassical tertiary lymphoid structure formation through STING-mediated DC activation. Oncoimmunology. 2022; 11(1): 2093054. https://doi.org/10.1080/2162402x.2022.2093054
- Matveeva O.V., Chumakov P.M. Defects in interferon pathways as potential biomarkers of sensitivity to oncolytic viruses. Rev. Med. Virol. 2018; 28(6): e2008. https://doi.org/10.1002/rmv.2008
- Kulaeva O.I., Draghici S., Tang L., Kraniak J.M., Land S.J., Tainsky M.A. Epigenetic silencing of multiple interferon pathway genes after cellular immortalization. Oncogene. 2003; 22(26): 4118–27. https://doi.org/10.1038/sj.onc.1206594
- Cairns P., Tokino K., Eby Y., Sidransky D. Homozygous deletions of 9p21 in primary human bladder Timors detected by comparative multiplex polymerase chain reaction. Cancer Res. 1994; 54(6): 1422–4.
- Diaz M.O., Ziemin S., Le Beau M.M., Pitha P., Smith S.D., Chilcote R.R., et al. Homozygous deletion of the alpha- and beta 1-interferon genes in human leukemia and derived cell lines. Proc. Natl. Acad. Sci. USA. 1988; 85(14): 5259–63. https://doi.org/10.1073/pnas.85.14.5259
- Olopade O.I., Jenkins R.B., Ransom D.T., Malik K., Pomykala H., Nobori T., et al. Molecular analysis of deletions of the short arm of chromosome 9 in human gliomas. Cancer Res. 1992; 52(9): 2523–9.
- Fernandez-Garcia M.D., Meertens L., Chazal M., Hafirassou M.L., Dejarnac O., Zamborlini A., et al. Vaccine and wild-type strains of yellow fever virus engage distinct entry mechanisms and differentially stimulate antiviral immune responses. mBio. 2016; 7(1): e01956-15. https://doi.org/10.1128/mbio.01956-15
- Felt S.A., Grdzelishvili V.Z. Recent advances in vesicular stomatitis virus-based oncolytic virotherapy): a 5-year update. J. Gen. Virol. 2017; 98(12): 2895–911. https://doi.org/10.1099/jgv.0.000980
- Petersen J.M., Her L.S., Varvel V., Lund E., Dahlberg J.E. The matrix protein of vesicular stomatitis virus inhibits nucleocytoplasmic transport when it is in the nucleus and associated with nuclear pore complexes. Mol. Cell. Biol. 2000; 20(22): 8590–601. https://doi.org/10.1128/mcb.20.22.8590-8601.2000
- Day G.L., Bryan M.L., Northrup S.A., Lyles D.S., Westcott M.M., Stewart J.H.4th. Immune effects of M51R vesicular stomatitis virus treatment of carcinomatosis from colon cancer. J. Surg. Res. 2020; 245: 127–35. https://doi.org/10.1016/j.jss.2019.07.032
- Seegers S.L., Frasier C., Greene S., Nesmelova I.V., Grdzelishvili V.Z. Experimental evolution generates novel oncolytic vesicular stomatitis viruses with improved replication in virus-resistant pancreatic cancer cells. J. Virol. 2020; 94(3): e01643-19. https://doi.org/10.1128/jvi.01643-19
- Andtbacka R.H.I., Kaufman H.L., Collichio F., Amatruda T., Senzer N., Chesney J., et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma. J. Clin. Oncol. 2015; 33(25): 2780–8. https://doi.org/10.1200/jco.2014.58.3377
- van Gent M., Chiang J.J., Muppala S., Chiang C., Azab W., Kattenhorn L., et al. The US3 kinase of herpes simplex virus phosphorylates the RNA sensor RIG-I to suppress innate immunity. J. Virol. 2022; 96(4): e01510-21. https://doi.org/10.1128/jvi.01510-21
- Xing J., Wang S., Lin R., Mossman K.L., Zheng C. Herpes simplex virus 1 tegument protein US11 downmodulates the RLR signaling pathway via direct interaction with RIG-I and MDA-5. J. Virol. 2012; 86(7): 3528–40. https://doi.org/10.1128/jvi.06713-11
- Xia T., Konno H., Ahn J., Barber G.N. Deregulation of STING signaling in colorectal carcinoma constrains DNA damage responses and correlates with tumorigenesis. Cell Rep. 2016; 14(2): 282–97. https://doi.org/10.1016/j.celrep.2015.12.029
- Xia T., Konno H., Barber G.N. Recurrent loss of STING signaling in melanoma correlates with susceptibility to viral oncolysis. Cancer Res. 2016; 76(22): 6747–59. https://doi.org/10.1158/0008-5472.can-16-1404
- de Queiroz N.M.G.P., Xia T., Konno H., Barber G.N. Ovarian cancer cells commonly exhibit defective STING signaling which affects sensitivity to viral oncolysis. Mol. Cancer Res. 2019; 17(4): 974–86. https://doi.org/10.1158/1541-7786.mcr-18-0504
- Whelan J.T., Singaravelu R., Wang F., Pelin A., Tamming L.A., Pugliese G., et al. CRISPR-mediated rapid arming of poxvirus vectors enables facile generation of the novel immunotherapeutic STINGPOX. Front. Immunol. 2023; 13: 1050250. https://doi.org/10.3389/fimmu.2022.1050250
- Sugimura N., Kubota E., Mori Y., Aoyama M., Tanaka M., Shimura T., et al. Reovirus combined with a STING agonist enhances anti-tumor immunity in a mouse model of colorectal cancer. Cancer Immunol. Immunother. 2023; 72(11): 3593–608. https://doi.org/10.1007/s00262-023-03509-0
- Sibal P.A., Matsumura S., Ichinose T., Bustos-Villalobos I., Morimoto D., Eissa I.R., et al. STING activator 2′3′-cGAMP enhanced HSV-1-based oncolytic viral therapy. Mol. Oncol. 2024; 18(5): 1259–77. https://doi.org/10.1002/1878-0261.13603