Detection rates and high concentration of herpesvirus (Orthoherpesviridae) DNA in autopsy materials from patients with COVID-19 fatal outcome
- Authors: Yurlov K.I.1, Yakushina S.A.1,2, Fedorova N.E.1, Kisteneva L.B.1,2, Kelly E.I.2, Kanibolotsky A.A.3,4, Ivkin Y.N.3,4, Antipiat N.A.2, Turin I.N.2, Larichev V.F.1, Demidova N.A.1, Lesnova E.I.1, Klimova R.R.1, Masalova O.V.1, Kushch A.A.1
-
Affiliations:
- National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
- Department of Health, Moscow Infectious Clinical Hospital No. 1
- Sklifosovsky Research Institute For Emergency Medicine, «Sklifosovsky Institute»
- Research Institute for Healthcare and Medical Management of Moscow Healthcare Department
- Issue: Vol 69, No 2 (2024)
- Pages: 134-150
- Section: ORIGINAL RESEARCH
- URL: https://virusjour.crie.ru/jour/article/view/16601
- DOI: https://doi.org/10.36233/0507-4088-215
- EDN: https://elibrary.ru/jxmqzh
- ID: 16601
Cite item
Full Text
Abstract
Introduction. SARS-CoV-2 infection causes immune disorders that create conditions for the reactivation of human herpesviruses (HHVs). However, the estimates of the HHVs effect on the course and outcome of COVID-19 are ambiguous.
Аim – to study the possible relationship between the HHV reactivation and the adverse outcome of COVID-19.
Materials and methods. Postmortem samples from the brain, liver, spleen, lymph nodes and lungs were obtained from 59 patients treated at the Moscow Infectious Diseases Hospital No.1 in 2021–2023. The group 1 comprised 39 patients with fatal COVID-19; group 2 (comparison group) included 20 patients not infected with SARS-CoV-2 who died from various somatic diseases. HHV DNA and SARS-CoV-2 RNA were determined by PCR.
Results. HHV DNA was found in autopsy samples from all patients. In group 1, EBV was most often detected in lymph nodes (94%), HHV-6 in liver (68%), CMV in lymph nodes (18%), HSV in brain (16%), VZV in lung and spleen (3% each). The detection rates of HHVs in both groups was similar. Important differences were found in viral load. In patients with COVID-19, the number of samples containing more than 1,000 copies of HHV DNA per 100,000 cells was 52.4%, in the comparison group – 16.6% (p < 0.002). An association has been established between the reactivation of HSV and HHV-6 and the severity of lung damage. Reactivation of EBV correlated with increased levels of liver enzymes.
Conclusion. Reactivation of HHVs in patients with fatal COVID-19 was associated with severe lung and liver damages, which indicates a link between HHV reactivation and COVID-19 deaths.
Full Text
Введение
Новая коронавирусная инфекция (COVID-19) – воспалительное респираторное заболевание, вызываемое коронавирусом SARS-CoV-2 (Coronaviridae: Betacoronavirus). По данным Всемирной организации здравоохранения, общее число летальных случаев, прямо или косвенно связанных с пандемией COVID-19, в период 2020 по 2021 г. составило приблизительно 14,9 млн1. Этому способствовали появление новых вариантов SARS-CoV-2 и высокая скорость передачи вируса. Формы COVID-19 различаются – от бессимптомной инфекции (около 50% случаев) до крайне тяжелых форм, при которых пациентам требуются госпитализация и проведение искусственной вентиляции легких. Показатели летальности, по разным данным, могут составлять от менее 1 до 20% (чаще – около 2%) и в значительной степени зависят от возраста пациента, сопутствующих заболеваний, а также географического региона. У пациентов в тяжелом и крайне тяжелом состоянии старше 75 лет летальность может достигать, по одним данным, 14,8%, по другим – 79,2% [1, 2].
В патогенезе COVID-19 ведущую роль играют многочисленные нарушения иммунитета, среди которых можно отметить следующие: 1) отсутствие координации между врожденными и адаптивными иммунными реакциями [3]; 2) значительно повышенные уровни провоспалительных цитокинов (интерлейкин (IL)-6, IL-1, фактор некроза опухоли альфа (TNF-α)) – «цитокиновый шторм» [4]; 3) нарушения продукции интерферона [5]; 4) дисбаланс между провоспалительными (М1) и противовоспалительными (М2) макрофагами в легких, приводящий к нарушениям функции макрофагов [6]; 5) лимфопения (уменьшение CD4+ и CD8+-T клеток, NK-клеток, B-клеток) с функциональным истощением цитотоксических лимфоцитов, которое коррелирует с прогрессированием заболевания [7]; 6) увеличение количества иммуносупрессорных регуляторных Т-клеток (Трег) [8]; 7) ослабление распознавания вирусной РНК через цитоплазматический сенсор RIG-I в инфицированных клетках [9].
Нарушение регуляции иммунной системы при COVID-19, а также иммунодепрессанты (кортикостероиды и антагонисты интерлейкинов), используемые для его лечения, создают условия для развития вторичных инфекций различной природы. В качестве возбудителей оппортунистических инфекций у пациентов с COVID-19 внимание исследователей привлекают герпесвирусы – представители семейства Orthoherpesviridae. Герпесвирусы человека (ГВЧ, HHV) широко распространены в человеческой популяции, способны переходить в латентную форму и пожизненно персистировать в организме. При изменениях факторов внешней и внутренней среды, в том числе при заражении патогенами вирусной этиологии и риске гибели клеток, ГВЧ могут реактивироваться [10].
В многочисленных работах сообщается о реактивации ГВЧ в организме пациентов с COVID-19. ДНК ГВЧ 5-го типа – цитомегаловируса (ЦМВ), обнаруживали в клинически значимой концентрации (> 500 копий/мл) в периферической крови (ПК) у 10/218 пациентов с COVID-19 в крайне тяжелом состоянии, 7 из этих 10 пациентов скончались [11]. Описан случай коинфекции SARS-CoV-2 и ЦМВ [12]. У тяжелобольного пациента с COVID-19 наблюдали симптомы нарушения функции желудочно-кишечного тракта (ЖКТ). В сыворотке крови концентрация ДНК ЦМВ достигала высоких значений – 308 000 МЕ/мл. Коинфекция SARS-CoV-2 и ЦМВ проявлялась изъязвлениями слизистой оболочки толстой и подвздошной кишки с воспалительными инфильтратами и цитопатическими эффектами. Специфическое лечение ЦМВ-инфекции ганцикловиром снижало признаки поражения ЖКТ и привело к выздоровлению пациента [12].
У пациентов, инфицированных SARS-CoV-2, исследовали реактивацию ГВЧ 4-го типа – вируса Эпштейна–Барр (ВЭБ). В образцах плазмы крови определяли ДНК ВЭБ и антитела к литическим генам ВЭБ. Реактивацию ВЭБ выявили у 27,1% пациентов с COVID-19 и только у 12,5% пациентов без COVID-19. По мнению авторов, у пациентов с COVID-19 наблюдается более частая реактивация ВЭБ по сравнению с пациентами с отрицательным результатом на COVID-19 [13, 14].
В публикациях сообщалось об обнаружении герпесвируса человека 6-го типа (ВГЧ-6) у пациентов с COVID-19 [15]. Описан случай заболевания 2-летнего ребенка с неврологическими нарушениями и лихорадкой, у которого в мазке из носоглотки обнаружили РНК SARS-CoV-2 и в спинномозговой жидкости (СМЖ) – высокую концентрацию лимфоцитов. Анализ СМЖ методом полимеразной цепной реакции (ПЦР) выявил ДНК ВГЧ-6 и антитела IgM к этому вирусу. Лечение ацикловиром в течение 2 нед значительно улучшило состояние ребенка, и он был выписан из больницы [16]. Результаты масштабного исследования, проведенного J. Katz и соавт. [17], показали, что среди 889 пациентов с подтвержденным диагнозом COVID-19 у 25 (2,81%) был установлен клинический диагноз «инфекция, вызванная вирусом простого герпеса 1-го типа» (ВПГ-1) и у 16 пациентов (1,8%) – «инфекция, вызванная вирусом варицелла-зостер» (ВЗВ). В группе сравнения (987,849 пациентов без COVID-19) ВПГ-1-инфекцию обнаружили у 0,77% и ВЗВ-инфекцию – у 0,43% пациентов, различия между группами были высокозначимыми. Авторы сделали вывод, что между реактивацией ВПГ-1, ВЗВ и SARS-CoV-2-инфекцией наблюдается сильная связь.
В 2023 г. была проведена кумулятивная оценка распространения ГВЧ среди пациентов с тяжелым течением COVID-19 на основании результатов 32 исследований [18]. Частота встречаемости ГВЧ составила: ВПГ – 38%, ЦМВ – 19%, ВЭБ – 45%, ВГЧ-6 – 18%, ВГЧ-7 – 44%, ВГЧ-8 – 19%. Авторы заключили, что установление реактивации ГВЧ у пациентов с тяжелым течением COVID-19 полезно при ведении пациентов, в том числе для профилактики осложнений.
Суммируя полученные данные, можно констатировать, что коинфекция SARS-CoV-2 и ГВЧ часто встречается у пациентов c COVID-19, особенно при тяжелом и крайне тяжелом течении заболевания. Однако ее влияние на пациентов с COVID-19 оценивается неоднозначно. Расхождения в оценках объясняются несколькими причинами. В большинстве работ обследованы небольшие группы или единичные пациенты. Используются разные показатели герпесвирусных инфекций: серологические, молекулярные, микроскопические, гистологические. Характеристики пациентов сильно различаются, лечение иммуномодуляторами и иммуносупрессорами также неодинаково. В то же время кортикостероиды и антагонисты интерлейкинов могут способствовать реактивации ГВЧ. Данные о связи между реактивацией ГВЧ и смертностью при COVID-19 противоречивы. Сведения о посмертных исследованиях ГВЧ в материалах от пациентов с COVID-19 единичны. Так, в 3 из 6 изученных аутопсийных материалов от пациентов, скончавшихся от COVID-19, выявили антигены ЦМВ методом иммуногистохимии в клетках легких и кишечника [19]. J.D. Haslbauer и соавт. [20] определяли ГВЧ методом гибридизации ДНК in situ в посмертных образцах лимфатических узлов от пациентов, умерших от COVID-19 и без COVID-19. В 4/21 (19%) образцах от пациентов, скончавшихся от COVID-19, был обнаружен ВЭБ, в 2/21 (9,5%) – ВПГ. В контрольных образцах ВЭБ был выявлен у 7% пациентов, а ВПГ не был обнаружен (p = 0,045).
Цель настоящего исследования – изучение возможной связи между реактивацией ГВЧ у пациентов и неблагоприятным исходом COVID-19.
Материалы и методы
Для достижения цели исследования определяли наличие ГВЧ в органах пациентов с летальным исходом COVID-19, проводили количественный анализ ДНК ГВЧ в аутопсийных образцах от пациентов с COVID-19 (1-я группа, основная) и от пациентов, скончавшихся без COVID-19 (2-я группа, сравнения), а также анализировали взаимосвязь выявления и вирусной нагрузки ГВЧ с тяжестью клинических проявлений заболевания.
Пациенты. В исследование были включены посмертные клинические материалы от 59 пациентов с летальным исходом, находившихся на лечении в ГБУЗ ИКБ № 1 ДЗ г. Москвы в 2021‒2023 гг. Из них у 39 скончавшихся пациентов был подтвержден диагноз COVID-19 (1-я группа, основная). У 2 из этих 39 пациентов не удалось получить лабораторные и анамнестические данные, поэтому они не были включены в характеристику пациентов, представленную ниже, однако их результаты по наличию и вирусной нагрузке ГВЧ включены в лабораторную часть. У 20 из 59 умерших пациентов не были обнаружены маркеры SARS-CoV-2 и признаки COVID-19 (2-я группа, сравнения).
Исследование проведено при добровольном информированном согласии законных представителей пациентов. Протокол исследования одобрен Этическим комитетом ГБУЗ «Инфекционная клиническая больница № 1 ДЗМ» (Протокол № 1 от 01 апреля 2021 г.). Процедуры исследования на выявление ДНК герпесвирусов были одобрены на заседании Этического комитета, протокол № 6 от 27 декабря 2018 г.
Характеристики пациентов с летальным исходом COVID-19 приведены в табл. 1.
Таблица 1. Демографические, клинические и серологические характеристики пациентов с COVID-19 (1-я группа)
Table 1. Demographic, clinical and serological characteristics of COVID-19 patients (group 1)
Демографические и клинические показатели Demographic and clinical indicators | ||
Показатель Indicator | Медиана (мин‒макc) Median (min‒max) | |
Возраст, лет Age, years | 77 (39‒91) | |
Пол Gender | Мужчин – 18, женщин – 21 Men – 18, woman – 21 | |
Продолжительность болезни, сут Duration of illness, days | 19 (6‒33) | |
ИВЛ более 1 сут UPV for more than 1 day | 9 (24%) пациентов 9 (24%) patients | |
Показатели крови Blood counts | ||
Показатель Index | Медиана (мин‒макс) Median (min‒max) | Референс‒значения Reference‒values |
Лейкоциты, 109/л Leukocytes, 109/l | 14,7 (1,4‒45,6) | 4‒9 |
Нейтрофилы, % Neutrophils, % | 87,35 (63,0‒95,4) | 47‒72 |
Лимфоциты, % Lymphocytes, % | 6 (1‒32) | 19‒45 |
Моноциты, % Monocytes, % | 3 (1‒5,9) | 3‒11 |
Гемоглобин, г/л Hemoglobin, gl | 127 (76‒164) | 117‒161 |
Тромбоциты, 109/л Platelets, 109/l | 159 (40‒462) | 150‒400 |
С-реактивный белок, мг/л C-reactive protein mg/l | 29 (1‒316) | 0‒5 |
D-димер, нг/мл D-dimer, ng/ml | 970 (350‒5250) | 0‒240 |
Прокальцитонин, нг/мл Procalcitonin, ng/ml | 0,267 (0‒2,224) | 0,00‒0,05 |
Жирным шрифтом выделены значения, отличающиеся от референс-значений Values that differ from the reference values are highlighted in bold | ||
Показатели повреждения легких Indicators of lung damage | ||
Показатель Index | Абсолютное значение, n = 37 Absolute value, n = 37 | |
КТ3, КТ3/4, КТ4 CT3, CT3/4, CT4 | 15/37 | |
КТ0, КТ1, КТ2 CT0, CT1, CT2 | 22/37 | |
Выпот в плевральной полости Effusion in the pleural cavity | 12/37 | |
Сопутствующие заболевания и осложнения Concomitant diseases and complications | ||
Диагноз Diagnosis | Абсолютное значение, n = 37 Absolute value, n = 37 | |
Ишемическая болезнь сердца Coronary heart disease | 32/37 | |
Гипертоническая болезнь Hypertension | 34/37 | |
Цереброваскулярная болезнь Cerebrovascular disease | 21/37 | |
Диабет Diabetes | 11/37 | |
Хроническая болезнь почек Chronic kidney disease | 11/37 | |
Ожирение Obesity | 11/37 | |
Хроническая обструктивная болезнь легких Chronic obstructive pulmonary disease | 9/37 | |
Бактериальные осложнения Bacterial complications | 33/37 | |
Терапия Therapy | ||
Показатель Index | Абсолютное значение, n = 37 Absolute value, n = 37 | |
Противовирусная терапия (риамиловир, фавипиравир, ремдесивир) Antiviral therapy (riamilovir, favipiravir, remdesivir) | 32/37 | |
Антибактериальная терапия Antibacterial therapy | 35/37 | |
Глюкокортикостероиды Glucocorticosteroids | 34/37 | |
Упреждающая противовоспалительная терапия (тоцилизумаб, барицитиниб, олокизумаб) Proactive anti-inflammatory therapy (tocilizumab, baricitinib, olokizumab) | 27/37 | |
Антикоагулянтная терапия (гепарин, эноксапарин натрия, апиксабан) Anticoagulant therapy (heparin, enoxaparin sodium, apixaban) | 37/37 | |
Жаропонижающая, муколитическая терапия Antipyretic, mucolytic therapy | 37/37 | |
В группу сравнения (2-я группа) вошли 20 пациентов (7 мужчин и 13 женщин, медиана возраста – 71 год; от 36 до 87 лет), скончавшихся от следующих неинфекционных заболеваний: гипертоническая болезнь – 3 пациента, гипертоническая болезнь и ишемическая болезнь – 1 пациент, аневризма передней соединительной артерии – 1 пациент, острое поражение миокарда – 1 пациент, цереброваскулярная болезнь – 4 пациента, инфаркт миокарда – 1 пациент, инфаркт головного мозга – 5 пациентов, энцефалопатия (алкогольная) – 1 пациент, онкологические заболевания – 3 пациента.
Клинические материалы. Вскрытие тел скончавшихся пациентов проводили в соответствии с руководством по вскрытию, сбору и представлению образцов, а также с соблюдением мер биобезопасности на базе ИКБ № 1 г. Москвы. Аутопсийные материалы были получены из легких, лимфатических узлов, селезенки, печени и головного мозга, всего от пациентов обеих групп ‒ 281 образец. Образцы сразу после вскрытия доставляли в лабораторию, замораживали и хранили при температуре −70 °С до исследования.
Определение ДНК ГВЧ методом ПЦР. Кусочки замороженных тканей размораживали и измельчали. Измельченные материалы делили на 2 равные части. Из одной части выделяли ДНК с использованием набора «АмплиСенс ДНК-сорб-В» («Интерлабсервис», Москва) в соответствии с инструкцией производителя. Реакцию ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени проводили, используя набор реагентов для качественного определения ДНК ВПГ («АмплиСенс HSV I, II-FL», «Интерлабсервис», Москва) и качественного определения ДНК ВЗВ («АмплиСенс VZV-FL», «Интерлабсервис», Москва). Поскольку набор для анализа ВПГ выявляет как ВПГ-1, так и ВПГ-2, в дальнейшем для этих 2 вирусов использовали общее обозначение – ВПГ. Для выявления и количественного определения ДНК ВЭБ, ЦМВ и ВГЧ-6 использовали набор («АмплиСенс EBV/CMV/HHV6-скрин-FL», «Интерлабсервис», Москва), который количественно определяет, помимо ВЭБ и ЦМВ, также ВГЧ-6А и ВГЧ-6В. В дальнейшем для ВГЧ-6А и ВГЧ-6В использовали обозначение ВГЧ-6. Ген β-глобина использовали в качестве эндогенного внутреннего контроля. Предел обнаружения составлял 1 копия/реакция. Для реакции использовали 10 мкл выделенной ДНК.
Определение РНК SARS-CoV-2 методом ПЦР. Диагноз COVID-19 был подтвержден прижизненно у пациентов в ИКБ № 1 установленными лабораторными методами, у скончавшихся пациентов РНК SARS-CoV-2 определяли в тех же аутопсийных образцах, в которых определяли ДНК ГВЧ. Использовали метод ПЦР с обратной транскрипцией. Из второй части размороженных и измельченных кусочков выделяли РНК SARS-CoV-2 и определяли вирусную РНК с использованием набора «АмплиТест SARS-CoV-2» (ФГБУ «ЦСП» ФМБА России, Москва) в соответствии с инструкцией производителя.
Статистическая обработка данных. Категориальные переменные, такие как пол и частота выявления различных характеристик, были проверены с использованием теста Манна‒Уитни, парного теста Вилкоксона, точных тестов χ2 и Фишера. Для проверки на нормальность распределения концентрации ДНК ГВЧ использовали тест нормальности Колмогорова. Подсчет средних и медианных значений, а также стандартных отклонений проводили с использованием пакета Statistiсa 12.6 (StatSoft Inc., Tulsa, США). Различия считали значимыми при р < 0,05.
Результаты
Частота обнаружения герпесвирусов человека у пациентов с летальным исходом COVID-19 и без COVID-19
Проведено сравнительное исследование посмертных образцов от 39 пациентов, умерших от СOVID-19 (1-я группа), и от 20 пациентов группы сравнения, у которых РНК SARS-CoV-2 и симптомы СOVID-19 обнаружены не были (2-я группа). ДНК ГВЧ (ВПГ-1, ВПГ-2, ВЗВ, ВЭБ, ЦМВ, ВГЧ-6А и ВГЧ-6В) определяли в образцах из легких, печени, лимфоузлов, селезенки и головного мозга. В 1-й группе суммарно во всех изученных органах по крайней мере по одному типу ГВЧ были обнаружены у всех 39 пациентов, 2 типа ГВЧ – у 22 пациентов, 3 типа ГВЧ – у 13 пациентов и 4 типа ГВЧ – у одного пациента (табл. 2). Во 2-й группе по одному типу ГВЧ также были обнаружены у всех пациентов, 2 типа ГВЧ – у 7 пациентов, 3 типа ГВЧ – у 8 пациентов и 4 типа ГВЧ – у двух пациентов. Различия по частоте встречаемости ДНК ГВЧ между группами оказались статистически незначимы (p > 0,05).
Таблица 2. Частота обнаружения ГВЧ у пациентов с летальным исходом СOVID-19 (1-я группа) и у пациентов без SARS-CoV-2 (2-я группа)
Table 2. HHV detection rates in patients with fatal outcome of COVID-19 (group 1) and in patients without SARS-CoV-2 (group 2)
Герпесвирусы человека Human herpesviruses | 1-я группа Group 1 (n = 39) | 2-я группа Group 2 (n = 20) | ||
n | % | n | % | |
ВГЧ-6 HHV-6 | 0 | 0,0 | 3 | 15 |
ВЭБ EBV | 2 | 5,1 | 0 | 0 |
ЦМВ CMV | 1 | 2,6 | 0 | 0 |
ВГЧ-6 + ВЭБ HHV-6 + EBV | 20 | 51,3 | 7 | 35 |
ВЭБ + ЦМВ EBV + CMV | 1 | 2,6 | 0 | 0 |
ВЭБ + ВПГ EBV + HSV | 1 | 2,6 | 0 | 0 |
ЦМВ + ВГЧ-6 + ВПГ CMV + HHV-6 + HSV | 1 | 2,6 | 0 | 0 |
ВГЧ-6 + ВЭБ + ЦМВ HHV-6 + EBV + CMV | 5 | 12,8 | 5 | 25 |
ВГЧ-6 + ВЭБ + ВЗВ HHV-6 + EBV + VZV | 2 | 5,1 | 0 | 0 |
ВГЧ-6 + ВЭБ + ВПГ HHV-6 + EBV + HSV | 5 | 12,8 | 3 | 15 |
ВГЧ-6 + ВЭБ + ЦМВ + ВПГ HHV-6 + EBV + CMV + HSV | 1 | 2,6 | 2 | 10 |
Оценивали распространение каждого изученного типа ГВЧ в органах суммарно как встречавшихся индивидуально, так и в сочетаниях с другими ГВЧ. Результаты показали (рис. 1), что в 1-й группе значительно чаще выявляли ДНК ВЭБ и ВГЧ-6 – у 95 и 85% пациентов, соответственно, по сравнению с ЦМВ, ВЗВ и ВПГ – у 28, 5 и 21% пациентов соответственно (p < 0,05). Частота определения ДНК ГВЧ в органах пациентов 2-й группы составляла: ВЭБ и ВГЧ-6 – 85 и 100% соответственно, ДНК ЦМВ, ВЗВ и ВПГ – 35, 0 и 25% соответственно. Различия между 1-й и 2-й группами по частоте обнаружения ГВЧ оказались незначимы (p > 0,05). В обеих группах значительно чаще встречались ВЭБ и ВГЧ-6 по сравнению с другими ГВЧ (р < 0,05) (рис. 1).
Рис. 1. Частота обнаружения герпесвирусов в аутопсийных материалах у пациентов c летальным исходом COVID-19 (1-я группа) и без COVID-19 (2-я группа). По горизонтали – обозначения герпесвирусов; по вертикали – частота выявления ДНК герпесвирусов (в %). COVID-19(+) – пациенты 1-й группы с летальным исходом COVID-19; COVID-19(−) – пациенты 2-й группы, скончавшиеся без COVID-19. * – р < 0,05.
Fig. 1. The frequency of herpesvirus detection in autopsy materials in patients with COVID-19 fatal outcome (group 1) and without COVID-19 (group 2). Horizontally – the designation of herpesviruses; vertically – the frequency of detection of herpesvirus DNA, in %. COVID-19(+) – 1st group patients with fatal COVID-19; COVID-19(−) – 2nd group patients who died without COVID-19. * – p < 0.05.
Распределение герпесвирусов человека в различных органах пациентов
Анализ ДНК ГВЧ показал (табл. 3), что в легких, лимфоузлах и в селезенке у пациентов с летальным исходом COVID-19 чаще других типов ГВЧ встречался ВЭБ (p < 0,05). В печени чаще всего определяли ВГЧ-6 (p < 0,05), в головном мозге – ВЭБ и ВГЧ-6. У пациентов без COVID-19 (2-я группа) в целом вирусы распределялись по органам сходным образом, однако было отмечено несколько отличий. Так, у пациентов 1-й группы достоверно чаще по сравнению со 2-й группой (p < 0,05) в легких выявляли геном ВЭБ, в лимфоузлах – ЦМВ, а в образцах головного мозга – ВГЧ-6. У пациентов из группы сравнения в селезенке чаще обнаруживался геном ВГЧ-6 (p < 0,05).
Таблица 3. Сравнительный анализ частоты обнаружения ГВЧ в органах у пациентов с летальным исходом COVID-19 (1-я группа) и у пациентов, скончавшихся без COVID-19 (2-я группа)
Table 3. Comparative analysis of HHV detection rates in different organs of patients with COVID-19 fatal outcome (group 1) and in patients who died not from COVID-19 (group 2)
Органы, количество образцов Organs, number of samples | Частота обнаружения ДНК ГВЧ, n (%)* HHV DNA detection rates, n (%)* | |||||
ВПГ-1/2 HSV1/2 | ВЗВ VZV | ВЭБ EBV | ЦМВ CMV | ВГЧ-6 HHV-6 | ||
Легкие Lung | 1-я группа group 1 (n = 39) | 6 (15) | 1 (3) | 30 (77)** | 6 (15) | 16 (41) |
2-я группа group 2 (n = 19) | 4 (22) | 0 | 5 (26)** | 6 (32) | 7 (37) | |
Печень Liver | 1-я группа group 1 (n = 37) | 3 (8) | 0 | 18 (49) | 6 (16) | 25 (68) |
2-я группа group 2 (n = 20) | 2 (10) | 0 | 9 (45) | 3 (15) | 17 (85) | |
Лимфоузлы Lymph nodes | 1-я группа group 1 (n = 35) | 4 (11) | 0 | 33 (94) | 7 (18)** | 13 (37) |
2-я группа group 2 (n = 17) | 2 (12) | 0 | 15 (88) | 0** | 7 (41) | |
Селезенка Spleen | 1-я группа group 1 (n = 36) | 2 (6) | 1 (3) | 24 (67) | 3 (8) | 10 (28)** |
2-я группа group 2 (n = 20) | 2 (10) | 0 | 16 (80) | 4 (20) | 14 (70)** | |
Головной мозг Brain | 1-я группа group 1 (n = 38) | 6 (16) | 0 | 9 (24) | 2 (5) | 7 (18)** |
2-я группа group 2 (n = 20) | 2 (10) | 0 | 2 (10) | 0 | 0** | |
Примечание. * – указано количество всех изученных ГВЧ в каждом органе, включая встречавшиеся в одном органе по 2, 3 или 4 типам ГВЧ; ** – значения, статистически значимо различающиеся между группами (p < 0,05).
Note. * – the number of all studied HHVs in each organ is indicated, including 2, 3 or 4 HHVs identified in one organ; ** – values that differ statistically between groups (p < 0.05).
Количественный анализ ДНК ГВЧ в органах пациентов
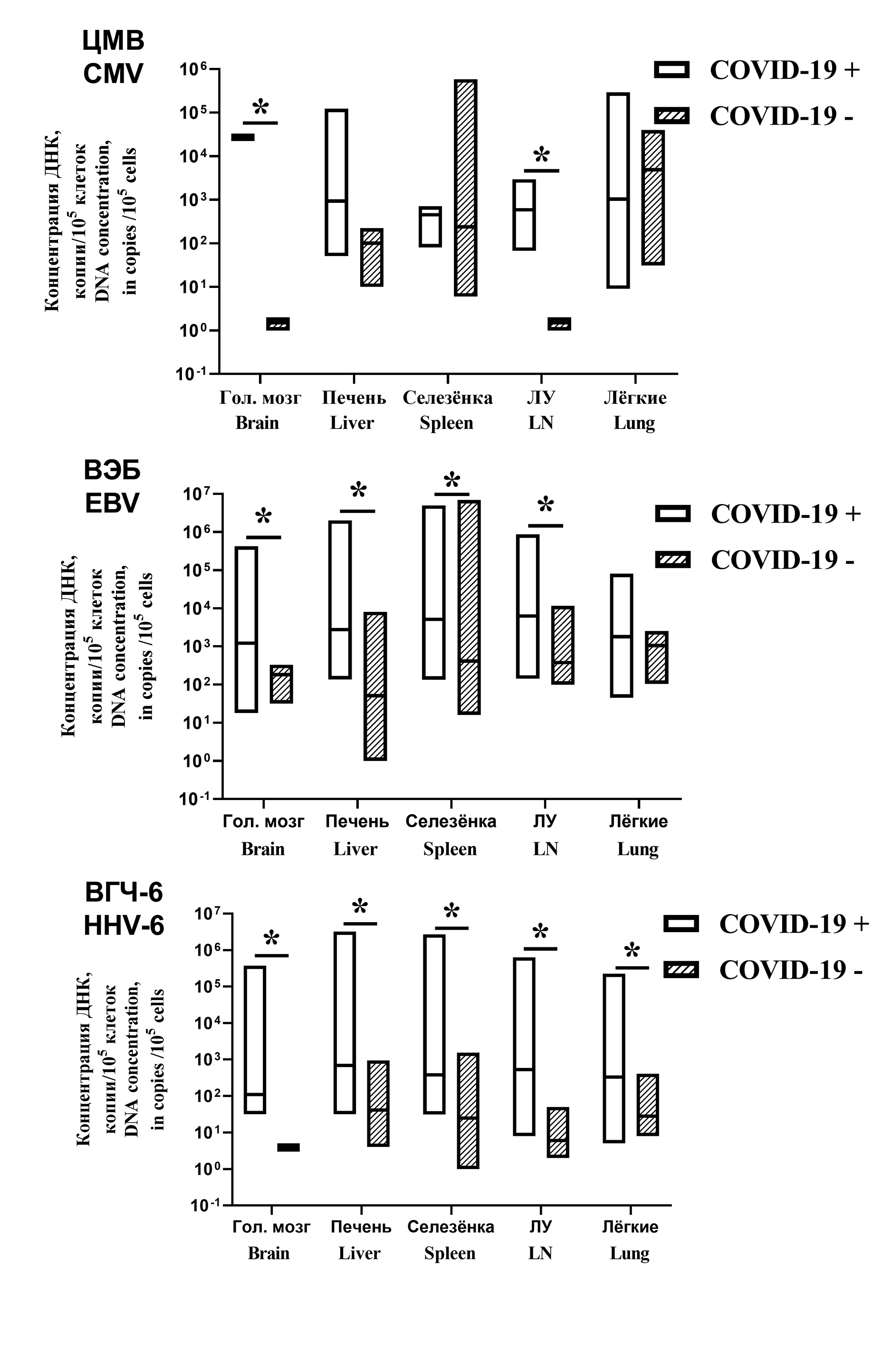
Для оценки вирусной нагрузки проведен количественный анализ ДНК ГВЧ ВЭБ, ЦМВ и ВГЧ-6, который показал, что в большинстве органов у пациентов с COVID-19 медианные концентрации ДНК ВЭБ и ВГЧ-6 были выше, чем у пациентов в группе сравнения (p < 0,05). Концентрации ДНК ЦМВ в печени, селезенке и в легких, а также ДНК ВЭБ в легких не различались (рис. 2).
Рис. 2. Концентрации ДНК герпесвирусов в органах пациентов, умерших с подтвержденным диагнозом COVID-19 (COVID+) или в результате соматических неинфекционных заболеваний (COVID−). По горизонтали – обозначения органов, из которых получены аутопсийные материалы; по вертикали – количество ДНК ГВЧ в копиях на 100 тыс. клеток. Представлены минимальные и максимальные значения концентрации ДНК, линии обозначают медианы. * – р < 0,05.
Fig. 2. Concentrations of herpesvirus DNA in the organs from patients who died with a confirmed diagnosis of COVID-19 (COVID +) or as a result of somatic non-infectious diseases (COVID−). On X-axis – the designations of the organs from which autopsy materials were obtained; on Y-axis – the amount of HHV DNA in copies per 100 thousand cells. The minimum and maximum values of DNA concentration are presented, the lines indicate the medians. * – p < 0.05..
Важные данные были получены при анализе вирусной нагрузки ГВЧ у пациентов в 1-й и 2-й группах. У пациентов с COVID-19 количество проб, содержавших более 1000 и более 10 000 копий ДНК ГВЧ на 100 тыс. клеток суммарно составляло 52,4%, тогда как в группе сравнения аналогичной показатель составил 16,6%. Различия между группами были высокозначимы (табл. 4).
Таблица 4. Сравнительный анализ вирусной нагрузки ГВЧ в органах пациентов с летальным исходом COVID-19 (1-я группа) и пациентов, скончавшихся без COVID-19 (2-я группа)
Table 4. Comparative analysis of the HНV viral load in the organs from patients with COVID-19 fatal outcome (group 1) and patients who died not from COVID-19 (group 2)
Концентрация ДНК ГВЧ, копии/100 тыс. клеток Concentration of HHV DNA, in copies/100 thousand cells | Количество образцов, содержащих ДНК ГВЧ The number of samples containing HНV DNA | |||
1-я группа group 1 (n = 185) | 2-я группа group 2 (n = 96) | |||
n | % | n | % | |
0 | 47 | 25,4 | 33 | 34,4 |
1‒1000 | 41 | 22,2** | 47 | 49,0** |
1001‒10 000 | 45 | 24,3* | 10 | 10,4* |
> 10 000 | 52 | 28,1** | 6 | 6,2** |
Примечание: * ‒ p = 0,002; ** ‒ p < 0,001.
Notes: * ‒ p = 0,002; ** ‒ p < 0,001
Полученные данные указывают на присутствие ГВЧ в клинически значимых количествах в органах пациентов, скончавшихся от COVID-19, а также о реактивации у них ГВЧ. В то же время в группе сравнения в 80 из 96 образцов (83%) содержание ДНК ГВЧ было менее 1000 на 100 тыс. клеток. Эти данные позволяют предположить, что у большинства пациентов без COVID-19 ГВЧ, по-видимому, находились в латентном состоянии.
Сравнительный анализ герпесвирусов человека у пациентов с повреждениями легких и печени
Для оценки ГВЧ как факторов риска тяжелого течения и неблагоприятного исхода COVID-19 сравнивали результаты выявления ГВЧ у пациентов с разной степенью повреждения легких, о которой судили по показателям компьютерной томографии (КТ). Анализ данных КТ легких показал, что у 15/37 (41%) пациентов картина КТ соответствовала среднетяжелым и тяжелым повреждениям – более 50% поражения объема легких (КТ3, КТ3/4, КТ4); у 22/37 (59%) – легким и умеренным повреждениям или их отсутствию (0‒50%; КТ0, КТ1, КТ2). В секционных образцах легких ГВЧ были обнаружены у 21/37 (56,7%) пациентов: у 10 пациентов с КТ3, КТ3/4, КТ4 и у 11 – с КТ0, КТ1, КТ2. Частота встречаемости ЦМВ, ВЭБ и ВГЧ-6 в группах пациентов с тяжелыми и умеренными повреждениями легких статистически значимо не различалась. Сравнение медианных значений ДНК ВЭБ и ЦМВ также не выявило статистически значимых различий между пациентами с тяжелыми и легкими повреждениями легких. В то же время выявлены различия при сравнении вирусной нагрузки ВГЧ-6 в образцах. Концентрация ДНК ВГЧ-6 у пациентов с КТ3, КТ3/4, КТ4 была в 3,1 раза больше по сравнению с пациентами с КТ0, КТ1, КТ2: медиана 705 (мин. 280 ‒ макс. 223 509) копий на 100 тыс. клеток против медианы 226 (мин. 5 ‒ макс. 537) копий на 100 тыс. клеток соответственно). Различия были статистически значимы (p = 0,02). Интересные данные получили также при изучении ВПГ. Так, ВПГ был выявлен у 5/15 (33%) пациентов с тяжелыми повреждениями легких (КТ3, КТ3/4, КТ4) и у 1/22 (4,5%) пациента при легких повреждениях (КТ0, КТ1, КТ2) (ОШ 10; 95% ДИ 1,02‒97,5; p < 0,05). Полученные результаты свидетельствует о том, что тяжелые повреждения легких ассоциированы с присутствием ВПГ и ВГЧ-6.
Одним из патологических проявлений при COVID-19 является плевральный выпот [21]. Плевральный выпот был диагностирован у 11/37 пациентов с COVID-19 (30%). Анализ частоты встречаемости всех изученных ГВЧ показал, что статистически значимые различия были выявлены при диагностике ВПГ-инфекции. У пациентов с плевральным выпотом ДНК ВПГ была обнаружена в 36% (4/11) случаев, без плеврального выпота – в 8% (2/26) случаев (ОШ 6,9; 95% ДИ 1,03‒45,6; p = 0,04), что свидетельствует об ассоциации ВПГ с нарушениями функции легких. Частота встречаемости других типов ГВЧ не коррелировала с плевральным выпотом.
Изучение вирусной нагрузки 3 типов ГВЧ (ВЭБ, ЦМВ и ВГЧ-6) у пациентов с плевральным выпотом и без такового показало, что вирусная нагрузка ВЭБ и ЦМВ была больше у пациентов с плевральным выпотом по сравнению с пациентами без него: медианные концентрации ВЭБ составили 2396 против 1114 копий ДНК на 100 тыс. клеток соответственно; ЦМВ – 146 629 против 931 копий ДНК на 100 тыс. клеток соответственно, однако статистической значимости различия не достигали. В то же время плевральный выпот ассоциировался с высокими концентрациями ВГЧ-6 в легких. Так, реактивация ВГЧ-6 наблюдалась у 2/11 (18%) пациентов с плевральным выпотом (вирусная нагрузка более 1000 копий на 100 тыс. клеток), но ни у одного из 26 пациентов без гидроторакса. Статистический анализ показал, что появление плеврального выпота ассоциируется с реактивацией ВГЧ-6 (p = 0,026).
Важными показателями повреждения печени являются уровни ферментов аланин- (АЛТ) и аспартатаминотрансферазы (АСТ). У 36 пациентов с летальным исходом COVID-19 был проведен количественный анализ концентраций АЛТ и АСТ в сыворотке крови. Повышенный уровень АЛТ и АСТ (> 50 ед/мл) был обнаружен у 19/36 пациентов (53%). Сравнивали концентрации ДНК ГВЧ в образцах печени у пациентов с нормальными и высокими показателями активности ферментов. Связь между медианными концентрациями ЦМВ и ВГЧ-6 и повышенными уровнями ферментов не обнаружили. Установили, что в образцах печени у 6/19 пациентов (32%) с показателями АСТ/АЛТ > 50 ед/мл выявлялся высокий уровень ДНК ВЭБ: медианные значения составили 19 793 (10 714‒2 020 609) копий на 100 тыс. клеток. Из 17 пациентов, у которых показатели печени были в норме, только у 1/17 (6%) было выявлено более 1000 копий ДНК ВЭБ. Повышение уровня изученных ферментов печени статистически значимо чаще ассоциировалось с активацией ВЭБ (p = 0,042).
Таким образом, у пациентов с летальным исходом COVID-19 присутствие ГВЧ ассоциировалось с тяжелыми повреждениями легких и печени.
Частота выявления РНК SARS-CoV-2
У 39 пациентов с летальным исходом COVID-19 в секционных материалах определяли наличие РНК SARS-CoV-2. Показано, что у 28 пациентов (72%) была обнаружена РНК хотя бы в одном из органов. У одного пациента SARS-CoV-2 выявили во всех аутопсийных материалах, у 11/39 (28%) пациентов не выявили РНК SARS-CoV-2 ни в одном органе.
Анализ частоты встречаемости РНК SARS-CoV-2 в разных органах показал, что в образцах из легких, головного мозга, печени и лимфоузлов частота была приблизительно одинаковой и составила 38% (15/39), 32% (12/38), 35% (13/37) и 31% (11/35) соответственно, в образцах из селезенки была ниже – 14% (5/36). Эти данные подтверждают политропную природу вируса и свидетельствуют о SARS-CoV-2-инфекции как о системном заболевании.
Анализ содержания РНК SARS-CoV-2 продемонстрировал, что вирусная РНК в тканях легкого выявлялась на относительно высоком уровне, соответствующем пороговому циклу (Ct) 22,9 ± 5,5, что статистически значимо не отличалось от уровня РНК в образцах головного мозга и лимфоузлов: Ct 26,3 ± 5,6 и Ct 25,2 ± 5,9 соответственно. В то же время в тканях печени (Ct 28,0 ± 5,9) и селезенки (Ct 31,6 ± 4,6) уровень РНК SARS-CoV-2 был значимо ниже (р < 0,05).
Представляло интерес сопоставить данные по выявлению ДНК ГВЧ и РНК SARS-CoV-2 в одних и тех же образцах. Оказалось, что из 56 образов, положительных на SARS-CoV-2, большинство – 48 (86%) – содержали ДНК ГВЧ. Наиболее часто обнаруживалась коинфекция ВЭБ и SARS-CoV-2 – в 19/48 (39,6%) образцов, ЦМВ и ВГЧ-6 – значительно реже – в 4 и в 2 образцах соответственно. Интересно, что в образцах, инфицированных SARS-CoV-2, нередко встречались по 2 типа ГВЧ ‒ в 17/48 (35%) образцах и даже по 3 типа ГВЧ – в 5/48 (10%) образцах. Коинфекция SARS-CoV-2 и ГВЧ, по-видимому, вызывает более серьезные осложнения у больных COVID-19 по сравнению с моноинфекцией SARS-CoV-2 и может приводить к летальному исходу заболевания.
Обсуждение
В настоящей работе у каждого из 39 пациентов с летальным исходом COVID-19 были обнаружены геномные ДНК ГВЧ. Наиболее часто и в высоких концентрациях встречались ВЭБ и ВГЧ-6: в аутопсийных образцах из всех органов индивидуально и в сочетаниях с другими ГВЧ ВЭБ и ВГЧ-6 были выявлены у 95 и 85% пациентов соответственно. Высокая частота обнаружения ДНК ВЭБ была показана также в других исследованиях. Так, ДНК ВЭБ была обнаружена у 40/42 (95%) пациентов, инфицированных SARS-CoV-2, в отделении интенсивной терапии [22], и у 28/34 (82,4%) пациентов с тяжелым течением COVID-19 [23]. Одним из объяснений высокой частоты распространения ВЭБ и ВГЧ-6 может быть их тропизм: ВЭБ поражает преимущественно В-лимфоциты, ВГЧ-6 – Т-лимфоциты. Лимфотропность обеспечивает быстрое распространение вирусов по организму, вхождение в органы и ткани и персистенцию в качестве резидентных клеток, где они могут сохраняться в латентном состоянии и реактивироваться.
Для определения влияния ВЭБ на тяжесть течения и исход COVID-19 обследовали пациентов с коинфекцией ВЭБ и SARS-CoV-2, результаты исследования показали, что у 37/67 (55,2%) пациентов риск появления симптомов лихорадки был в 3 раза выше, чем у пациентов с одной только инфекцией SARS-CoV-2, уровни С-реактивного белка и АСТ также были статистически значимо больше [24]. Авторы заключили, что реактивация ВЭБ может ассоциироваться с тяжелым течением COVID-19. M. Meng и соавт. обнаружили признаки активной ВЭБ-инфекции у 55/217 (25%) пациентов с COVID-19 и часть из них лечили ганцикловиром. Авторы отметили, что среди пациентов, получавших ганцикловир, уровень выживаемости был больше в сравнении с группой, где препарат не применяли (p = 0,01), и сделали вывод, что реактивация ВЭБ у пациентов с COVID-19 может быть связана с повышенным риском смерти [25]. Важные результаты получены при изучении связи реактивации ВЭБ со смертностью среди 345 пациентов с COVID-19. Метаанализ результатов 4 опубликованных работ по реактивации ВЭБ у больных COVID-19 показал [14], что у пациентов с ВЭБ(−)/SARS-CoV-2(+) смертность была статистически значимо меньше (9,9%), чем у пациентов с ВЭБ(+)/SARS-CoV-2(+) (23,6%). Было подтверждено, что реактивация ВЭБ увеличивает смертность у пациентов с COVID-19, и сделан вывод: в тех случаях, когда состояние здоровья пациентов с COVID-19 постепенно ухудшается, необходимо заподозрить реактивацию ВЭБ, поскольку она является возможным маркером тяжести течения COVID-19. Авторы считают доказанным, что реактивация ВЭБ увеличивает смертность у пациентов с COVID-19.
Реактивацию ЦМВ выявили у 19/156 (12,2%) пожилых пациентов с COVID-19 и наблюдали среди них значительное увеличение смертности [26]. Авторы заключили, что реактивация ЦМВ у пациентов с COVID-19 в возрасте, равном или меньше 86 лет, была независимым фактором риска госпитальной смертности. В другой работе у 16 из 140 (11,4%) пациентов с COVID-19 определяли ДНК ЦМВ в периферической крови. Смерть наступила у 8/16 ЦМВ-положительных пациентов (50%) по сравнению с 11/124 (8,87%) ЦМВ-отрицательными лицами (р < 0,001) [27].
Анализ ДНК ВПГ-1 в образцах бронхоальвеолярного лаважа (BAL) у пациентов с пневмонией, вызванной SARS-CoV-2, выявил высокую инфицированность – в 47/83 (56%) образцов. Уровень смертности у пациентов с ВПГ-положительными результатами оказался более высоким по сравнению с пациентами без ВПГ (57,4% против 33,5%; p = 0,015). Реактивация ВПГ-1 в нижних отделах дыхательных путей ассоциировалась с неблагоприятным прогнозом и значительным увеличением смертности [28].
Примерно у 16% пациентов с COVID-19 развиваются тяжелые и крайне тяжелые формы заболевания, и показатели смертности у этих пациентов составляют от 11 до 60% [29]. Результаты настоящей работы, а также данные прижизненных исследований, рассмотренные выше, показывают, что ГВЧ 1‒7-го типов могут вносить вклад в развитие тяжелого течения COVID-19 и вызывать летальный исход заболевания.
Патогенез COVID-19 характеризуется прежде всего поражением клеток респираторного тракта, легких и развитием тяжелой гипоксии. К настоящему времени накоплено достаточно данных, свидетельствующих о развитии у больных COVID-19 полиорганной недостаточности – дисфункции многих органов, включая сердце, почки, печень, ЖКТ, эндотелий сосудов [30]. В настоящем исследовании показано присутствие ГВЧ в образцах из всех изученных органов пациентов, умерших от COVID-19: в легких, лимфатических узлах, головном мозге, печени и в селезенке. Впервые показано, что в разных органах пациентов с летальным исходом встречаются по 2, 3 и даже по 4 ГВЧ из разных подсемейств. Количество проб с высокой концентрацией вирусной ДНК, содержащих более 1000 копий ДНК и даже более 10 000 копий на 100 тыс. клеток, суммарно составляло 52%. Интересно, что в печени и в селезенке пациентов, скончавшихся от COVID-19, были обнаружены ВГЧ-6 в концентрациях более 1 млн копий ДНК на 100 тыс. клеток. Согласно имеющимся данным, такие концентрации ВГЧ-6 наблюдаются у лиц, у которых вирусная ДНК интегрирована в геном – в теломерные районы хромосом. Для сохранения своего генома ВГЧ-6 использует эту уникальную форму латенции, т.к. геномы всех других ГВЧ в латентном состоянии находятся в виде кольцевой эписомы. Интегрированная ДНК ВГЧ-6 способна к реактивации и индукции разных заболеваний [31].
Обращает на себя внимание большое количество пациентов, в аутопсийных образцах которых обнаружены высокие концентрации ДНК ГВЧ. Работ, в которых проведено сравнение содержания ДНК ГВЧ в сыворотке/плазме крови и в тканях органов у пациентов с COVID-19, найти в доступной литературе не удалось. Возможно, объяснение содержится в работе [32], в которой изучали ВЭБ в плазме крови и в ткани опухоли у пациентов с раком желудка, ассоциированным с ВЭБ. ДНК ВЭБ определяли в плазме крови методом количественной ПЦР, в срезах опухолевой ткани – методом гибридизации in situ. Обнаружили, что среднее соотношение ДНК ВЭБ в плазме к ДНК в ткани составило всего 8,8%. Предположили, что лишь небольшой процент инфицированных ВЭБ раковых клеток желудка секретирует ДНК ВЭБ в периферическую кровь. В настоящей работе периферическая кровь пациентов с летальным исходом COVID-19 была недоступна. Однако можно предположить, что высокие концентрации ДНК ГВЧ, обнаруженные в образцах из органов пациентов, ‒ результат накопления ДНК в тканях при реактивации вирусов, и эта ДНК в значительной степени остается in situ.
Клинические и лабораторные исследования, проведенные в настоящей работе, показали, что присутствие ГВЧ в органах пациентов с летальным исходом COVID-19 ассоциировалось с тяжелыми поражениями легких и поражением печени. Это заключение подтверждается результатами прижизненного обследования пациентов. Так, у 76/95 (80%) пациентов, госпитализированных с COVID-19 с признаками пневмонии и повышенными значениями АЛТ, были обнаружены маркеры активной ВЭБ-инфекции, тогда как у доноров крови активная ВЭБ-инфекция наблюдались лишь у 10/92 (10,9%) [33]. Сходные данные в отношении ВПГ-инфекции получены при прижизненном обследовании пациентов, умерших от COVID-19 [34]. Пневмония, вызванная SARS-CoV-2 и осложненная острым респираторным дистресс-синдромом, а также очень высокие значения АЛТ и АСТ в сыворотке крови (3000‒4000 ед/л) – показатели активного гепатита, ассоциировались с высокой концентрацией ВПГ-1 в сыворотке крови (более 14 000 000 копий/мл) за 3‒7 сут до смерти пациентов.
Полученные нами результаты, а также данные опубликованных работ свидетельствуют о реактивации и высоком содержании ГВЧ в органах скончавшихся пациентов, подтверждают данные о полиорганной природе патологических процессов и указывают на вклад ГВЧ в летальный исход COVID-19.
Обследование больных COVID-19 показало, что у пациентов с тяжелым течением инфекции, особенно у пожилых пациентов, часто или почти всегда наблюдаются предшествующие сопутствующие заболевания, перечень которых весьма значителен: диабет, рак, ожирение, ВИЧ-инфекция, хронические воспалительные заболевания почек, печени, легких, цереброваскулярные заболевания [35]. В связи с этим в группу сравнения были включены 20 пациентов, скончавшихся от заболеваний неинфекционной природы (без COVID-19): инфаркта, инсульта, хронических заболеваний печени, онкологических заболеваний. Изучение ДНК ГВЧ в аутопсийных материалах от пациентов группы сравнения показало, что частота обнаружения ГВЧ была высокой и практически не отличалась от таковой среди пациентов с COVID-19. В то же время концентрация ДНК ГВЧ сильно различалась. Так, концентрация ДНК ГВЧ, превышающая 1000 копий на 100 тыс. клеток, включая образцы, содержащие 10 000 копий на 100 тыс. клеток, была обнаружена у 17% пациентов, что с высокой степенью значимости (p < 0,001) отличалось от группы с COVID-19 (52%). Присутствие ГВЧ у пациентов с тяжелыми патологиями различных органов наблюдали также другие авторы. Показано, что реактивация ЦМВ может способствовать прогрессированию атеросклероза [36]. Описан случай кардиомиопатии, ассоциированной с ВЭБ-инфекцией миокарда, в результате которой повышался риск электрической нестабильности, перфорации сердца и внезапной смерти [37]. К сходному выводу о связи повреждения сердечно-сосудистой системы с ВЭБ-инфекцией пришли также другие авторы [38].
Имеются данные о способности ВЭБ вызывать интерстициальную пневмонию, или пневмонит, иногда с плевральным выпотом. Описаны 16 случаев ВЭБ-ассоциированного пневмонита [39].
Обнаружение ГВЧ в образцах биопсии печени (преимущественно ВГЧ-6) и в сыворотке крови (преимущественно ВЭБ) у пациентов с хроническим гепатитом С и клинический анализ повреждений функции печени позволили установить, что ГВЧ увеличивают тяжесть течения хронических гепатитов [40].
Метаанализ, проведенный методами доказательной медицины, показал, что герпесвирусная инфекция ассоциируется с повышенным риском нарушения мозгового кровообращения, повреждением ткани мозга, нарушением его функций – ишемическим инсультом. Риск инсульта особенно сильно связан с ВЗВ-, ВЭБ- и ВПГ-инфекциями [41].
Полученные нами данные свидетельствуют о реактивации ГВЧ у большинства (52%) пациентов с летальным исходом COVID-19 и у части пациентов (17%) группы сравнения. Можно предположить, что у большинства пациентов из группы сравнения и у части пациентов, скончавшихся от COVID-19, ГВЧ находились в латентном состоянии.
В аутопсийных образцах от 39 пациентов с летальным исходом COVID-19 определяли наличие РНК SARS-CoV-2, у 28 пациентов (72%) была обнаружена РНК хотя бы в одном из органов. В 47/56 (84%) образцов наблюдали одновременно ДНК ГВЧ и РНК SARS-CoV-2. Результаты настоящей работы и данные других авторов, наблюдавших коинфекцию SARS-CoV-2 и ГВЧ, ставят вопрос, может ли инфекция SARS-CoV-2 быть фактором риска реактивации герпесвирусов, и с другой стороны, каковы механизмы усиления SARS-CoV-2 инфекции при реактивации ГВЧ.
Один из механизмов может быть связан со способностью ГВЧ воздействовать на рецептор SARS-CoV-2 АСЕ2. Показано, что ВЭБ повышает экспрессию ACE2 и таким образом усиливает инфицирование клеток SARS-CoV-2 [42]. Позже обнаружили, что ЦМВ способен повысить экспрессию рецептора ACE2 в эпителиальных и эндотелиальных клетках, облегчая проникновение вируса в клетки легких и других органов [43]. Отмечая, что репликация ВЭБ и ВГЧ-6 происходит в эпителии ротоглотки и носоглотки, которые являются местами инфицирования SARS-CoV-2, полагают, что реактивация ВЭБ и ВГЧ-6 может усилить тяжесть COVID-19 [23], в том числе путем прямого цитотоксического действия. Реактивация ГВЧ при инфицировании SARS-CoV-2 может происходить и непрямыми путями ‒ в результате нарушения регуляции иммунных механизмов. Наблюдается активация дендритных клеток, Th1, Th17 и NK-клеток, повышение продукции многих провоспалительных цитокинов, включая IL-6, IL-8, TNF-α и IL-10, которые увеличивают риск реактивации ГВЧ [44]. У пациентов, обследованных в настоящей работе, обнаружены прижизненные изменения показателей клеток и сыворотки крови, свидетельствующие о ярко выраженном воспалительном процессе (табл. 1).
К реактивации ГВЧ при COVID-19 может приводить прием системных кортикостероидов, назначаемых для подавления цитокинового шторма. По данным J. Naendrup и соавт. (2022), лечение кортикостероидами вызывало реактивацию ВЭБ у 58% и ЦМВ ‒ у 55% пациентов [45]. Показано, что одним из молекулярных механизмов реактивации ВЭБ под действием гидрокортизона и дексаметазона может быть индукция экспрессии мРНК сверхраннего вирусного гена BZLF1, кодирующего литический трансактиватор ‒ белок ZEBRA [46]. В терапии COVID-19 рекомендованы к применению препараты-ингибиторы (например, блокаторы янус-киназ, рецепторов IL-6, IL-1, блокаторы IL-6), которые обладают иммуносупрессивным действием и могут увеличивать риск реактивации ГВЧ.
Рассмотренные механизмы реактивации ГВЧ при заражении SARS-CoV-2 не исключают друг друга и, по-видимому, могут действовать совместно, увеличивая тяжесть течения COVID-19 и неблагоприятный исход заболевания. Совокупность представленных данных указывает на целесообразность включения герпесвирусных инфекций в протоколы обследования пациентов с COVID-19, находящихся как в крайне тяжелом состоянии, так и в состоянии средней тяжести, особенно из-за широкой доступности противогерпетических препаратов и имеющихся положительных результатах лечения COVID-19.
Выводы
- ДНК ряда ГВЧ (ВПГ-1, ВПГ-2, ВЗВ, ВЭБ, ЦМВ, ВГЧ-6А и ВГЧ-6В) обнаружены в аутопсийных материалах у всех 39 пациентов, скончавшихся от COVID-19, а также у всех 20 пациентов, умерших от других заболеваний без COVID-19.
- ДНК ГВЧ обнаружены в легких, в печени, в лимфоузлах, в головном мозге и в селезенке. У пациентов с летальным исходом COVID-19, по сравнению с пациентами, скончавшихся без COVID-19, статистически значимо чаще обнаруживалась в легких ДНК ВЭБ (76% против 26%), в лимфоузлах ДНК ЦМВ (18% против 0%) и в головном мозге ДНК ВГЧ-6 (18% против 0%). У пациентов, скончавшихся без COVID-19, в селезенке чаще обнаруживалась ДНК ВГЧ-6 (70% против 28%).
- Количество образцов с концентрацией ДНК ГВЧ, превышающей 1000 копий/100 тыс. клеток, в материалах от пациентов с летальным исходом COVID-19 было в 3 раза больше (52,4%), чем от пациентов без COVID-19 (16,6%), что указывает на реактивацию ГВЧ у пациентов с летальным исходом и на латентное состояние ВГЧ у большинства пациентов без COVID-19.
- Тяжелые повреждения легких (по данным КТ и плеврального выпота) у пациентов с летальным COVID-19 ассоциировались со значительным повышением концентрации ДНК ВГЧ-6 и существенным превышением частоты выявления ДНК ВПГ по сравнению со среднетяжелыми и легкими повреждениями в аутоптатах легких.
- Повышенные уровни ферментов АЛТ/АСТ, свидетельствующие о повреждениях печени, у 32% пациентов с летальным исходом COVID-19 ассоциировались с реактивацией ВЭБ, у пациентов с нормальными уровнями АЛТ/АСТ реактивация ВЭБ наблюдалась лишь у 6% пациентов.
- У 28/39 (72%) пациентов с летальным исходом COVID-19 в секционных материалах обнаружили РНК SARS-CoV-2 в легких, головном мозге и лимфоузлах – в высоких концентрациях. Коинфекция SARS-CoV-2 чаще всего наблюдалась с ВЭБ.
1 https://www.who.int/news/item/05-05-2022-14.9-million-excess-deaths-were-associated-with-the-covid-19-pandemic-in-2020-and-2021
About the authors
Kirill I. Yurlov
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: kir34292@yandex.ru
ORCID iD: 0000-0002-4694-2445
SPIN-code: 1767-5652
Researcher
Россия, 123098, MoscowSofia A. Yakushina
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation; Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: sofia.iakushina@gmail.com
ORCID iD: 0000-0003-0507-0174
SPIN-code: 9585-8019
junior researcher, infectious disease physician
Россия, 125367, Moscow; 123098, MoscowNatalya E. Fedorova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: ninani@mail.ru
ORCID iD: 0000-0001-8466-7993
SPIN-code: 1090-2763
Senior Researcher
Россия, 123098, MoscowLidiia B. Kisteneva
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation; Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: lidia.kisteneva@gmail.com
ORCID iD: 0000-0001-7336-409X
SPIN-code: 9205-3670
Dr. Sci. (Medicine), Leading Researcher
Россия, 125367, Moscow; 123098, MoscowElena I. Kelly
Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: ekelly@yandex.ru
ORCID iD: 0009-0000-2718-9462
specialist in pathological anatomy
Россия, 125367, MoscowAlexander A. Kanibolotsky
Sklifosovsky Research Institute For Emergency Medicine, «Sklifosovsky Institute»; Research Institute for Healthcare and Medical Management of Moscow Healthcare Department
Email: dr.kaa@mail.ru
ORCID iD: 0000-0001-6123-8387
SPIN-code: 3976-1662
Scopus Author ID: 57223849355
ResearcherId: HLG-3242-2023
Candidate of Medical Sciences, Associate Professor, Head of the Pathoanatomical Department, Head of the Department of Medical Education for Pathological Anatomy of the Research Institute of Healthcare Organization and Medical Management of the Moscow Department of Health
Россия, 129090, Moscow; 115184, MoscowYevgeniy N. Ivkin
Sklifosovsky Research Institute For Emergency Medicine, «Sklifosovsky Institute»; Research Institute for Healthcare and Medical Management of Moscow Healthcare Department
Email: evgenuivkin@rambler.ru
ORCID iD: 0009-0004-2609-1788
pathologist doctor Research Institute of Emergency Medicine, specialist in pathological anatomy Department of Medical Education for Pathological Anatomy
Россия, 129090, Moscow; 115184, MoscowNatalia A. Antipiat
Department of Health, Moscow Infectious Clinical Hospital No. 1
Author for correspondence.
Email: natadog70@bk.ru
ORCID iD: 0000-0001-8578-2838
deputy chief physician Infectious Diseases
Россия, 125367, MoscowIgor N. Turin
Department of Health, Moscow Infectious Clinical Hospital No. 1
Email: tyurin.dti@yandex.ru
ORCID iD: 0000-0002-5696-1586
SPIN-code: 6755-0576
chief physician Infectious Diseases
Россия, 125367, MoscowVictor F. Larichev
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: vlaritchev@mail.ru
ORCID iD: 0000-0001-8262-5650
SPIN-code: 5826-1430
Dr. Sci. (Medicine), Leading Researcher
Россия, 123098, MoscowNatalia A. Demidova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: ailande@yandex.ru
ORCID iD: 0000-0003-1961-9789
SPIN-code: 8759-0277
Researcher
Россия, 123098, MoscowEkaterina I. Lesnova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: wolf252006@yandex.ru
ORCID iD: 0000-0002-2801-6843
SPIN-code: 9901-8607
Senior Researcher
Россия, 123098, MoscowRegina R. Klimova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: rklimova@yandex.ru
ORCID iD: 0000-0002-4147-8444
SPIN-code: 8286-6108
Researcher, Gamaleya NRC of Epidemiology and Microbiology
Россия, 123098, MoscowOlga V. Masalova
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: ol.mas@mail.ru
ORCID iD: 0000-0001-5571-5669
SPIN-code: 7210-0870
Dr. Sci. (Biology), Leading Researcher, Head of the Laboratory
Россия, 123098, MoscowAlla A. Kushch
National Research Center for Epidemiology and Microbiology, Ministry of Health of the Russian Federation
Email: vitallku@mail.ru
ORCID iD: 0000-0002-3396-5533
SPIN-code: 6964-1715
Professor, Dr. Sci. (Biology), Leading Researcher
Россия, 123098, MoscowReferences
- Carvalho J.L., Silva-Carvalho A.E., Garcez E.M., Saldanha-Araujo F. Commentary: mesenchymal stem cells: a new piece in the puzzle of COVID-19 treatment. Front. Immunol. 2021; 12: 682195. https://doi.org/10.3389/fimmu.2021.682195
- Rabi F.A., Al Zoubi M.S., Kasasbeh G.A., Salameh D.M., Al-Nasser A.D. SARS-CoV-2 and coronavirus disease 2019: what we know so far. Pathogens. 2020; 9(3): 231. https://doi.org/10.3390/pathogens9030231
- Blanco-Melo D., Nilsson-Payant B.E., Liu W.C., Uhl S., Hoagland D., Møller R., et al. Imbalanced host response to SARS-CoV-2 drives development of COVID-19. Cell. 2020; 181(5): 1036–45.e9. https://doi.org/10.1016/j.cell.2020.04.026
- Montazersaheb S., Hosseiniyan Khatibi S.M., Hejazi M.S., Tarhriz V., Farjami A., Ghasemian Sorbeni F., et al. COVID-19 infection: an overview on cytokine storm and related interventions. Virol. J. 2022; 19(1): 92. https://doi.org/10.1186/s12985-022-01814-1
- Lowery S.A., Sariol A., Perlman S. Innate immune and inflammatory responses to SARS-CoV-2: Implications for COVID-19. Cell Host Microbe. 2021; 29(7): 1052–62. https://doi.org/10.1016/j.chom.2021.05.004
- Liu L., Wei Q., Lin Q., Fang J., Wang H., Kwok H., et al. Anti-spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection. JCI Insight. 2019; 4(4): e123158. https://doi.org/10.1172/jci.insight.123158
- Zheng M., Gao Y., Wang G., Song G., Liu S., Sun D., et al. Functional exhaustion of antiviral lymphocytes in COVID-19 patients. Cell Mol. Immunol. 2020; 17(5): 533–5. https://doi.org/10.1038/s41423-020-0402-2
- Wang Y., Zheng J., Islam M.S., Yang Y., Hu Y., Chen X. The role of CD4+FoxP3+ regulatory T cells in the immunopathogenesis of COVID-19: implications for treatment. Int. J. Biol. Sci. 2021; 17(6): 1507–20. https://doi.org/10.7150/ijbs.59534
- Thorne L.G., Reuschl A.K., Zuliani-Alvarez L., Whelan M.V.X., Turner J., Noursadeghi M., et al. SARS-CoV-2 sensing by RIG-I and MDA5 links epithelial infection to macrophage inflammation. EMBO J. 2021; 40(15): e107826. https://doi.org/10.15252/embj.2021107826
- Cantan B., Luyt C.E., Martin-Loeches I. Influenza infections and emergent viral infections in intensive care unit. Semin. Respir. Crit. Care Med. 2019; 40(4): 488–97. https://doi.org/10.1055/s-0039-1693497
- Talan L., Akdemir Kalkan İ., Altıntaş N.D., Yörük F. Cytomegalovirus reactivation in critically-ill COVID-19 patients. Balkan Med. J. 2022; 39(4): 301–2. https://doi.org/10.4274/balkanmedj.galenos.2022.2022-2-2
- Amaral P.H., Ferreira B.M., Roll S., Neves P.D., Pivetta L.G., Mohrbacher S., et al. COVID-19 and cytomegalovirus co-infection: a challenging case of a critically ill patient with gastrointestinal symptoms. Eur. J. Case Rep. Intern. Med. 2020; 7(10): 001911. https://doi.org/10.12890/2020_001911
- Bernal K.D.E., Whitehurst C.B. Incidence of Epstein-Barr virus reactivation is elevated in COVID-19 patients. Virus Res. 2023; 334: 199157. https://doi.org/10.1016/j.virusres.2023.199157
- Manoharan S., Ying L.Y. Epstein Barr virus reactivation during COVID-19 hospitalization significantly increased mortality/death in SARS-CoV-2(+)/EBV(+) than SARS-CoV-2(+)/EBV(-) patients: a comparative meta-analysis. Int. J. Clin. Pract. 2023; 2023: 1068000. https://doi.org/10.1155/2023/1068000
- Berzero G., Campanini G., Vegezzi E., Paoletti M., Pichiecchio A., Simoncelli A.M., et al. Human herpesvirus 6 encephalitis in immunocompetent and immunocompromised hosts. Neurol. Neuroimmunol. Neuroinflamm. 2021; 8(2): e942. https://doi.org/10.1212/NXI.0000000000000942
- Di Nora A., Pizzo F., Costanza G., Ruggieri M., Falsaperla R. Human herpes 6 encephalitis in co-infection with COVID-19. Acta Neurol. Belg. 2023; 123(2): 687–8. https://doi.org/10.1007/s13760-022-01961-w
- Katz J., Yue S., Xue W. Herpes simplex and herpes zoster viruses in COVID-19 patients. Ir. J. Med. Sci. 2022; 191(3): 1093–7. https://doi.org/10.1007/s11845-021-02714-z
- Shafiee A., Teymouri Athar M.M., Amini M.J., Hajishah H., Siahvoshi S., Jalali M., et al. Reactivation of herpesviruses during COVID-19: A systematic review and meta-analysis. Rev. Med. Virol. 2023; 33(3): e2437. https://doi.org/10.1002/rmv.2437
- Nakashima J., Kadomatsu Y., Itagaki S., Otani T., Kiriu T., Matsunaga A., et al. A case-series of six autopsy cases of COVID-19 including three cases of cytomegalovirus coinfection. Pathol. Int. 2022; 72(6): 358–60. https://doi.org/10.1111/pin.13230
- Haslbauer J.D., Zinner C., Stalder A.K., Schneeberger J., Menter T., Bassetti S., et al. Vascular damage, thromboinflammation, plasmablast activation, T-cell dysregulation and pathological histiocytic response in pulmonary draining lymph nodes of COVID-19. Front. Immunol. 2021; 12: 763098. https://doi.org/10.3389/fimmu.2021.763098
- Iqbal B., Rahman N.M., Hallifax R.J. COVID-19-related pleural diseases. Semin. Respir. Crit. Care Med. 2023; 44(4): 437–46. https://doi.org/10.1055/s-0043-1769616
- Paolucci S., Cassaniti I., Novazzi F., Fiorina L., Piralla A., Comolli G., et al. EBV DNA increase in COVID-19 patients with impaired lymphocyte subpopulation count. Int. J. Infect. Dis. 2021; 104: 315–9. https://doi.org/10.1016/j.ijid.2020.12.051
- Simonnet A., Engelmann I., Moreau A.S., Garcia B., Six S., El Kalioubie A., et al. High incidence of Epstein-Barr virus, cytomegalovirus, and human-herpes virus-6 reactivations in critically ill patients with COVID-19. Infect. Dis. Now. 2021; 51(3): 296–9. https://doi.org/10.1016/j.idnow.2021.01.005
- Chen T., Song J., Liu H., Zheng H., Chen C. Positive Epstein-Barr virus detection in coronavirus disease 2019 (COVID-19) patients. Sci. Rep. 2021; 11(1): 10902. https://doi.org/10.1038/s41598-021-90351-y
- Meng M., Zhang S., Dong X., Sun W., Deng Y., Li W., et al. COVID-19 associated EBV reactivation and effects of ganciclovir treatment. Immun. Inflamm. Dis. 2022; 10(4): e597. https://doi.org/10.1002/iid3.597
- Giacconi R., Cardelli M., Piacenza F., Pierpaoli E., Farnocchia E., Di Rosa M., et al. Effect of cytomegalovirus reactivation on inflammatory status and mortality of older COVID-19 patients. Int. J. Mol. Sci. 2023; 24(7): 6832. https://doi.org/10.3390/ijms24076832
- Pérez-Granda M.J., Catalán P., Muñoz P., Aldámiz T., Barrios J.C., Ramírez C., et al. Cytomegalovirus reactivation in patients diagnosed with severe COVID-19: A point prevalence study in a general hospital. Rev. Esp. Quimioter. 2023; 36(1): 45–51. https://doi.org/10.37201/req/068.2022
- Pérez-Pedrero Sánchez-Belmonte M.J., Sánchez-Casado M., Moran Gallego F.J., Piza Pinilla R., Gomez Hernando C., Paredes Borrachero I. Herpes simplex virus type 1 (HSV-1) over-infection in patients with acute respiratory distress syndrome secondary to COVID-19 pneumonia: Impact on mortality. Med. Clin. (Engl. Ed). 2023; 160(2): 66–70. https://doi.org/10.1016/j.medcle.2022.04.019
- Yang X., Yu Y., Xu J., Shu H., Xia J., Liu H., et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir. Med. 2020; 8(5): 475–81. https://doi.org/10.1016/S2213-2600(20)30079-5
- Li Q., Chen Z., Zhou X., Li G., Zhang C., Yang Y. Ferroptosis and multi-organ complications in COVID-19: mechanisms and potential therapies. Front. Genet. 2023; 14: 1187985. https://doi.org/10.3389/fgene.2023.1187985
- Gabrielli L., Balboni A., Borgatti E.C., Virgili G., Petrisli E., Cantiani A., et al. Inherited chromosomally integrated human herpesvirus 6: laboratory and clinical features. Microorganisms. 2023; 11(3): 548. https://doi.org/10.3390/microorganisms11030548
- Qiu M.Z., He C.Y., Lu S.X., Guan W.L., Wang F., Wang X.J., et al. Prospective observation: Clinical utility of plasma Epstein-Barr virus DNA load in EBV-associated gastric carcinoma patients. Int. J. Cancer. 2020; 146(1): 272–80. https://doi.org/10.1002/ijc.32490
- Solomay T.V., Semenenko T.A., Filatov N.N., Vedunova S.L., Lavrov V.F., Smirnova D.I., et al. Reactivation of Epstein-Barr virus (Herpesviridae: Lymphocryptovirus, HHV-4) infection during Covid-19: epidemiological features. Voprosy virusologii. 2021; 66(2): 152–61. https://doi.org/10.36233/0507-4088-40 https://elibrary.ru/nhbzyr (in Russian)
- Roncati L., Manenti A., Fabbiani L., Malagoli C., Nasillo V., Lusenti B., et al. HSV1 viremia with fulminant hepatitis as opportunistic sequela in severe COVID-19. Ann. Hematol. 2022; 101(1): 229–31. https://doi.org/10.1007/s00277-021-04417-y
- Silaghi-Dumitrescu R., Patrascu I., Lehene M., Bercea I. Comorbidities of COVID-19 patients. Medicina (Kaunas). 2023; 59(8): 1393. https://doi.org/10.3390/medicina59081393
- Nikitskaya E., Lebedeva A., Ivanova O., Maryukhnich E., Shpektor A., Grivel J.C., et al. Cytomegalovirus-productive infection is associated with acute coronary syndrome. J. Am. Heart Assoc. 2016; 5(8): e003759. https://doi.org/10.1161/JAHA.116.003759
- Chimenti C., Verardo R., Grande C., Francone M., Frustaci A. Infarct-like myocarditis with coronary vasculitis and aneurysm formation caused by Epstein-Barr virus infection. ESC Heart Fail. 2020; 7(3): 938–41. https://doi.org/10.1002/ehf2.12611
- Chen X., Li Y., Deng L., Wang L., Zhong W., Hong J., et al. Cardiovascular involvement in Epstein-Barr virus infection. Front. Immunol. 2023; 14: 1188330. https://doi.org/10.3389/fimmu.2023.1188330
- Prasoppokakorn T., Assanasen T., Chantranuwatana P., Suankratay C. EBV-associated lymphoid interstitial pneumonia in IBD patient: Case report and literature review. Respir. Med. Case Rep. 2020; 30: 101059. https://doi.org/10.1016/j.rmcr.2020.101059
- Yurlov K.I., Masalova O.V., Kisteneva L.B., Khlopova I.N., Samokhvalov E.I., Malinovskaya V.V., et al. Human herpesviruses increase the severity of hepatitis. Biology (Basel). 2021; 10(6): 483. https://doi.org/10.3390/biology10060483
- Lin J., Zheng Y., Zhao N., Cui F., Wu S. Herpesvirus latent infection promotes stroke via activating the OTUD1/NF-κB signaling pathway. Aging (Albany NY). 2023; 15(17): 8976–92. https://doi.org/10.18632/aging.205011.
- Verma D., Church T.M., Swaminathan S. Epstein-Barr virus lytic replication induces ACE2 expression and enhances SARS-CoV-2 pseudotyped virus entry in epithelial cells. J. Virol. 2021; 95(13): e0019221. https://doi.org/10.1128/JVI.00192-21
- Perera M.R., Greenwood E.J.D., Crozier T.W.M., Elder E.G., Schmitt J., Crump C.M., et al. Human cytomegalovirus infection of epithelial cells increases SARS-CoV-2 superinfection by upregulating the ACE2 receptor. J. Infect. Dis. 2023; 227(4): 543–53. https://doi.org/10.1093/infdis/jiac452
- Yu X., Li L., Chan M.T.V., Wu W.K.K. Bioinformatic analyses suggest augmented interleukin-17 signaling as the mechanism of COVID-19-associated herpes zoster. Environ. Sci. Pollut. Res. Int. 2021; 28(46): 65769–75. https://doi.org/10.1007/s11356-021-15567-x
- Naendrup J.H., Garcia Borrega J., Eichenauer D.A., Shimabukuro-Vornhagen A., Kochanek M., Böll B. Reactivation of EBV and CMV in severe COVID-19-epiphenomena or trigger of hyperinflammation in need of treatment? A large case series of critically ill patients. J. Intensive Care Med. 2022; 37(9): 1152–8. https://doi.org/10.1177/08850666211053990
- Yang E.V., Webster Marketon J.I., Chen M., Lo K.W., Kim S.J., Glaser R. Glucocorticoids activate Epstein Barr virus lytic replication through the upregulation of immediate early BZLF1 gene expression. Brain Behav. Immun. 2010; 24(7): 1089–96. https://doi.org/10.1016/j.bbi.2010.04.013
Supplementary files