Investigation of oncolytic potential of vaccine strains of yellow fever and tick-borne encephalitis viruses against glioblastoma and pancreatic carcinoma cell lines
- Authors: Nazarenko A.S.1, Biryukova Y.K.1, Orlova E.O.1, Trachuk K.N.1, Ivanova A.L.1, Belyakova A.V.1, Pestov N.B.1, Vorovitch M.F.1,2, Ishmukhametov A.A.1,2, Kolyasnikova N.M.1
-
Affiliations:
- Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
- I.M. Sechenov First Moscow State Medical University, Ministry of Health of Russia (Sechenov University), Institute of Translational Medicine and Biotechnology
- Issue: Vol 68, No 6 (2023)
- Pages: 536-548
- Section: ORIGINAL RESEARCHES
- URL: https://virusjour.crie.ru/jour/article/view/16100
- DOI: https://doi.org/10.36233/0507-4088-204
- EDN: https://elibrary.ru/laqurr
- ID: 16100
Cite item
Full Text
Abstract
Introduction. Flaviviruses, possessing natural neurotropicity could be used in glioblastoma therapy using attenuated strains or as a delivery system for antitumor agents in an inactivated form.
Objective. To investigate the sensitivity of glioblastoma and pancreatic carcinoma cell lines to vaccine strains of yellow fever and tick-borne encephalitis viruses.
Materials and methods. Cell lines: glioblastoma GL-6, T98G, LN-229, pancreatic carcinoma MIA RaCa-2 and human pancreatic ductal carcinoma PANC-1. Viral strains: 17D yellow fever virus (YF), Sofjin tick-borne encephalitis virus (TBEV). Virus concentration were determined by plaque assay and quantitative PCR. Determination of cell sensitivity to viruses by MTT assay.
Results. 17D YF was effective only against pancreatic carcinoma tumor cells MIA Paca-2 and had a limited effect against PANC-1. In glioblastoma cell lines (LN229, GL6, T98G), virus had no oncolytic effect and the viral RNA concentration fell in the culture medium. Sofjin TBEV showed CPE50 against MIA Paca-2 and a very limited cytotoxic effect against PANC-1. However, it had no oncolytic effect against glioblastoma cell lines (LN229, T98G and GL6), although virus reproduction continued in these cultures. For the GL6 glioblastoma cell line, the viral RNA concentration at the level with the infection dose was determined within 13 days, despite medium replacement, while in the case of the LN229 cell line, the virus concentration increased from 1 × 109 to 1 × 1010 copies/ml.
Conclusion. Tumor behavior in organism is more complex and is determined by different microenvironmental factors and immune status. In the future, it is advisable to continue studying the antitumor oncolytic and immunomodulatory effects of viral strains 17D YF and Sofjin TBEV using in vivo models.
Full Text
Введение
Проблема терапии злокачественных заболеваний по-прежнему остается нерешенной. Существующие терапевтические подходы способны вызывать ремиссии разной протяженности, но не обеспечивают полного выздоровления, поскольку в ответ на терапию происходит отбор устойчивых опухолевых клеток. Онколитическая виротерапия – активно развивающееся направление исследований в последние годы. На основе онколитических вирусов уже разработан ряд препаратов, зарегистрированных для терапии злокачественных заболеваний, и еще десятки находятся на разных стадиях клинических исследований [1–3]. Развитие онколитической виротерапии в нашей стране имеет давнюю историю [4]. Лидирующее положение на территории бывшего СССР занимала исследовательская группа под руководством М.К. Ворошиловой (лаборатория иммунологии энтеровирусов, Институт полиомиелита, Москва), которая активно изучала онколитический потенциал энтеровирусов [5]. Исследователи показали, что живые энтеровирусные вакцины стимулируют клеточный иммунитет у онкологических больных и потенциально могут быть эффективными для лечения пациентов с опухолями желудочно-кишечного тракта [6, 7]. Работа по созданию панелей препаратов на основе онколитических энтеровирусов и персонализированного подхода к пациентам с учетом молекулярно-биологических механизмов тропизма к конкретным опухолям продолжается в настоящее время группой под руководством проф. М.П. Чумакова [8–10]. Еще одним перспективным подходом для онковиротерапии является использование рекомбинантных аденовирусов, в частности, в качестве вероятно наиболее перспективных кандидатов для виротерапии злокачественных глиобластом [11–13]. В ГНЦ вирусологии и биотехнологии «Вектор» (Новосибирск) был создан противоопухолевый препарат «Канцеролизин» на основе мутантного варианта Ade12 аденовируса человека серотипа 5, который с эффективностью, близкой к вирусу дикого типа, инфицирует опухолевые клетки, дефектные по р53, а также создана клеточная линия на основе клеток 293, которая может быть использована для масштабируемого получения данного вируса [14]. В экспериментах на лабораторных животных (мыши, кролики, морские свинки) в доклинических исследованиях канцеролизина была показана его безвредность и безопасность [15, 16]. В ГНЦ «Вектор» на основе вируса осповакцины штамма L-IVP был также сконструирован онколитический вирус, обеспечивающий доставку противораковых терапевтических генов в клетки макроорганизма. В рекомбинантный вирус L-IVP_oncoM был встроен ген, кодирующий гранулоцитарно-макрофагальный колониестимулирующий фактор, и синтетический ген, кодирующий полиэпитопный иммуноген, состоящий из эпитопов антигенов, гиперэкспрессирующихся в клетках меланомы. Онколитическую эффективность полученного рекомбинантного вируса оценивали с помощью мышиной модели ксенографтов с использованием злокачественных клеток SK-Mel-28 [17].
В последние годы, помимо изучения патогенного потенциала представителей рода флавивирусов, активно изучается их онколитический потенциал [18]. Вирусам свойственно заражать и лизировать клетки, причем опухолевые клетки, как правило, приобретают повышенную чувствительность к вирусам, благодаря поломкам в механизмах контроля клеточного деления и внутриклеточной противовирусной защиты. Показано, что онколитические вирусы способны также стимулировать противоопухолевый иммунитет [19]. С точки зрения иммуногенности флавивирусы могут играть положительную роль в терапии опухоли и приводить к ее лизису иммуноопосредованным способом. Однако флавивирусы в качестве онколитических вирусов малоизучены, хотя они имеют природную нейротропность и могут использоваться для лечения, например, глиобластом, при использовании безопасных для человека штаммов или в качестве системы доставки противоопухолевых агентов в инактивированном виде.
Род Orthoflavivirus [20] включает более 70 арбовирусов, которые являются трансмиссивными и переносятся комарами и клещами. Геном флавивирусов представлен кэпированной одноцепочечной РНК положительной полярности длиной около 11 тыс. нуклеотидов с единственной открытой рамкой считывания. Больше всего исследований на предмет онколитической активности среди флавивирусов посвящено вирусу Зика. Вирус Зика является слабопатогенным для человека, у взрослых пациентов инфекция, вызванная вирусом Зика, обычно протекает бессимптомно, лишь небольшой процент пациентов (< 20%) сообщают о легкой лихорадке, сыпи и боли в суставах в течение примерно 7 сут. В ряде работ было продемонстрировано, что вирус Зика избирательно инфицирует нервные стволовые клетки плода [2], которые имеют некоторое сходство с клетками глиобластомы. Эффективность вируса Зика в отношении глиобластом была также показана на модели in vitro и in vivo [21]. Авторы отметили, что вирус Зика избирательно заражал клетки глиобластомы, полученные от пациентов после резекции, в сравнении с нейронами и глиальными клетками. Авторы также использовали вирус Зика для терапии глиобластом мыши GL261 и CT-2A. В результате наблюдалось увеличение продолжительности жизни мышей C57BL/6, получавших терапию, в сравнении с контрольной группой, уменьшение объема опухоли проходило без неврологических симптомов. Кроме того, избирательность репликативной активности вируса Зика в отношении клеток глиобластомы U87 MG человека была продемонстрирована в исследовании В.А. Святченко и соавт. на модели с использованием иммунодефицитных SCID мышей с привитыми подкожными ксенографтами глиобластомы U87 MG [22].
Еще один флавивирус, обладающий онколитическим потенциалом, – вирус желтой лихорадки (ВЖЛ). ВЖЛ вызывает серьезное инфекционное заболевание, возбудитель которого передается при укусе комаров Aedes aegypti [23]. Аттенуированный штамм 17D ВЖЛ полностью секвенирован, имеет хороший профиль безопасности у иммунокомпетентных детей и взрослых, вакцина на его основе используется в профилактических целях для предотвращения заболевания в эндемичных регионах [24]. Недавнее исследование на мышах при внутриопухолевой терапии подкожных опухолей меланомы и карциномы толстой кишки продемонстрировало эффективность штамма 17D ВЖЛ как иммуномодулирующего агента, приводящего к задержке роста опухолей [25]. Таким образом, штамм 17D ВЖЛ можно рассматривать в качестве потенциального онколитического агента.
Вирус клещевого энцефалита (ВКЭ) изучали на предмет онколитической активности только в 50-х годах прошлого столетия. Е.Н. Левкович и Л.Г. Карпович (лаборатория клещевого энцефалита, Институт полиомиелита, Москва, СССР) исследовали 25 штаммов ВКЭ и родственных ему вирусов, включая вирус шотландского энцефаломиелита овец, вирус омской геморрагической лихорадки, вирус Кьясанурской лесной болезни, вирус Лангат. Было показано, что вирусы, которые хорошо репродуцируются в организме человека, также активно размножаются в клетках HeLa, однако их цитопатогенное действие сильно варьирует [26]. В исследовании Е.Н. Левкович и Г.И. Сергеевой было выявлено ингибирующее действие всех изученных штаммов ВКЭ на рост асцитной карциномы Эрлиха и саркомы Крокера in vitro. ВКЭ, а также вирус Лангат оказались способными инфицировать опухолевые клетки с последующим снижением их пролиферативной способности и задержкой роста опухоли при трансплантации клеток экспериментальным животным [27, 28]. Однако из-за высокой патогенности ВКЭ и отсутствия на тот момент возможности генетически модифицировать вирус, исследования его онколитических свойств были прекращены. На сегодняшний день ВКЭ можно рассматривать в качестве онколитического вируса при условии должных генетических модификаций, приводящих к его полной аттенуации.
Цель работы – исследование чувствительности клеточных линий глиобластомы и карциномы поджелудочной железы к вакцинным штаммам 17D ВЖЛ и Софьин ВКЭ.
Материалы и методы
Клеточные линии и условия культивирования
Перевиваемая культура клеток почечного эпителия зеленой мартышки Vero (получены из Американской коллекции клеточных культур – АТСС) и культура эмбриональной почки свиньи (СПЭВ) (из коллекции ФГАНУ «ФНЦИРИП им. М.П. Чумакова РАН») были использованы для титрования вируса методом бляшек; клеточную линию глиобластомы GL-6 (ФГБУН ИМБ РАН), клеточные линии глиобластомы T98G, LN-229 (АТСС), клеточные линии карциномы поджелудочной железы MIA PaСa-2 и протоковой карциномы поджелудочной железы человека PANC-1 (ИБХ РАН) использовали для определения чувствительности к вирусам.
Клетки культивировали в питательной (ростовой) среде DMEM (ФГАНУ «ФНЦИРИП им. М.П. Чумакова РАН»), с добавлением 2 мМ L-глутамина («ПанЭко», кат. № Ф032), антибиотиков пенициллина (250 МЕ/мл) и стрептомицина (200 мкг/мл) («ПанЭко», кат. № А065п) и 5% эмбриональной телячьей сыворотки (ЭТС) (FBS Gibco #2412072) в атмосфере 5% СО2 при 37 °С. В качестве поддерживающей среды после заражения клеток вирусами использовали среду «Игла МЕМ» (ФГАНУ «ФНЦИРИП им. М.П. Чумакова РАН») с идентичными добавками, как и в случае с ДМЕМ, но с добавлением 2% ЭТС.
Вирусные штаммы
В работе использовали аттенуированный вакцинный штамм 17D ВЖЛ, вакцинный штамм Софьин ВКЭ из коллекции ФГАНУ «ФНЦИРИП им. М.П. Чумакова РАН». Титры вирусов оценивали методом бляшек, концентрацию вирусной РНК в культуральной среде – методом количественной полимеразной цепной реакции (ПЦР).
Титрование вирусов методом бляшек
Титры вируса определяли методом бляшек под покрытием 1,26% метилцеллюлозы в культуре клеток Vero (для ВЖЛ) и СПЭВ (для ВКЭ) на пластиковых 12-луночных планшетах. Клетки высевали на 12-луночные планшеты и инкубировали в течение 24 ч при 37 °C в CO2-инкубаторе. На среде 199 с солями Эрла готовили 10-кратные разведения вирусных образцов и добавляли их к клеткам в объеме 100 мкл на лунку. Планшеты инкубировали в CO2-инкубаторе в течение 1 ч при осторожном покачивании. Затем в каждую лунку вносили 1 мл 1,26% метилцеллюлозы.
Учет бляшек проводили на 8-е сутки после заражения. Титр вируса выражали в количестве бляшкообразующих единиц (БОЕ) в 1 мл вируссодержащего материала. Титр рассчитывали по формуле:
ΣN/(d × n × V) = БОЕ/мл,
где: N – количество бляшек в одной лунке для соответствующего разведения; n – количество лунок для одного разведения, шт.; V – объем пробы (дозы для заражения), мл; d – разведение (в виде 10-x).
Определение концентрации вирусной РНК в культуральной среде методом ПЦР в реальном времени
Пробу культуральной среды отбирали в объеме 1 мл, клеточный дебрис удаляли центрифугированием при 3000 об/мин в течение 5 мин. Выделение РНК вируса из полученного супернатанта проводили с помощью набора реагентов «Рибо-преп», обратную транскрипцию (получение кДНК) осуществляли с помощью набора «Реверта-L». При проведении ПЦР для ВКЭ использовали набор реагентов «АмплиСенс TBEV, B. burgdorferi sl, A. phagocytophillum, E. chaffeensis / E. muris-FL» с применением калибраторов с известной концентрацией кДНК: 1 × 109, 1 × 107, 1 × 105 ГЭ/мл. При проведении ПЦР для ВЖЛ применяли набор реагентов «АмплиСенс Yellow fever virus-FL», в качестве стандартов использовали штамм 17D ВЖЛ в титре 1 × 107, 1 × 105, 1 × 103 БОЕ/мл. Производителем всех использованных наборов реагентов является ЦНИИ Эпидемиологии Роспотребнадзора (Москва). Количественную ПЦР в реальном времени выполняли на термическом циклере Rotor-Gene Q 6plex (Qiagen) c помощью каналов детекции (FAM, HEX) и определением цикла детекции (Ct).
Определение чувствительности клеток к вирусам
- Цитопатическое действие (ЦПД). Клетки сажали на 25 см2 матрасы и культивировали до образования монослоя. Заражение проводили в минимальном объеме 250 мкл вируссодержащей жидкостью в титрах 107 БОЕ/мл в течение 1 ч при 37 °C с покачиванием. Затем монослой клеток отмывали и добавляли поддерживающую среду. ЦПД наблюдали в течение 14 сут. Начиная с 3-х суток с помощью световой микроскопии оценивали ЦПД. Учет ЦПД проводили визуально по системе крестов: если изменению (по сравнению с контролем) подвергся весь монослой в матрасе, ЦПД оценивали на 4 креста (++++), если ¾ – на 3 (+++), если ½ – на 2 (++), если на ¼ – на 1 крест (+).
- МТТ-тест. 96-луночные планшеты с клетками перевиваемых опухолевых линий инфицировали 10-кратными серийными разведениями вирусов в шести повторах. Адсорбцию вируса проводили в течение 1 ч при 37 °C в CO2 инкубаторе в объеме 30 мкл на лунку, далее удаляли вируссодержащую жидкость, промывали клетки средой без сыворотки и культивировали в поддерживающей среде с 2% ЭТС. Через 3, 4, 5 сут определяли жизнеспособность клеток с помощью MTT-теста, используя реагент МТТ в рабочей концентрации 5 мг/мл в фосфатном буфере рН 7,2 («ПанЭко», кат. № О104). С помощью планшетного ридера Bio-Rad iMark определяли оптическую плотность при длине волны 595/650 нм. Результат оценивали в сравнении со средней оптической плотностью в контроле (неинфицированные клетки), принимая ее за 100%.
Формирование тканевых сфероидов
Формирование тканевых сфероидов производили с помощью агарозных форм, изготовленных с применением силиконовых матриц (любезно предоставленных И.В. Зубаревым) согласно инструкции производителя (ЧУ Лаборатория биотехнологических исследований «3Д Биопринтинг Солюшенс», Россия) [29].
Микроскопия
Визуальный контроль, фотографии клеток и сфероидов производили с применением инвертированного биологического микроскопа OLYMPUS CKX53, оснащенного цифровой камерой и ПО ADFImageCapture.
Статистически анализ.
Статистическую оценку данных проводили в программе GraphPad Prism 8 с использованием дисперсионного анализа ANOVA для MTT-теста, критерия Краскела–Уоллиса для ПЦР.
Результаты
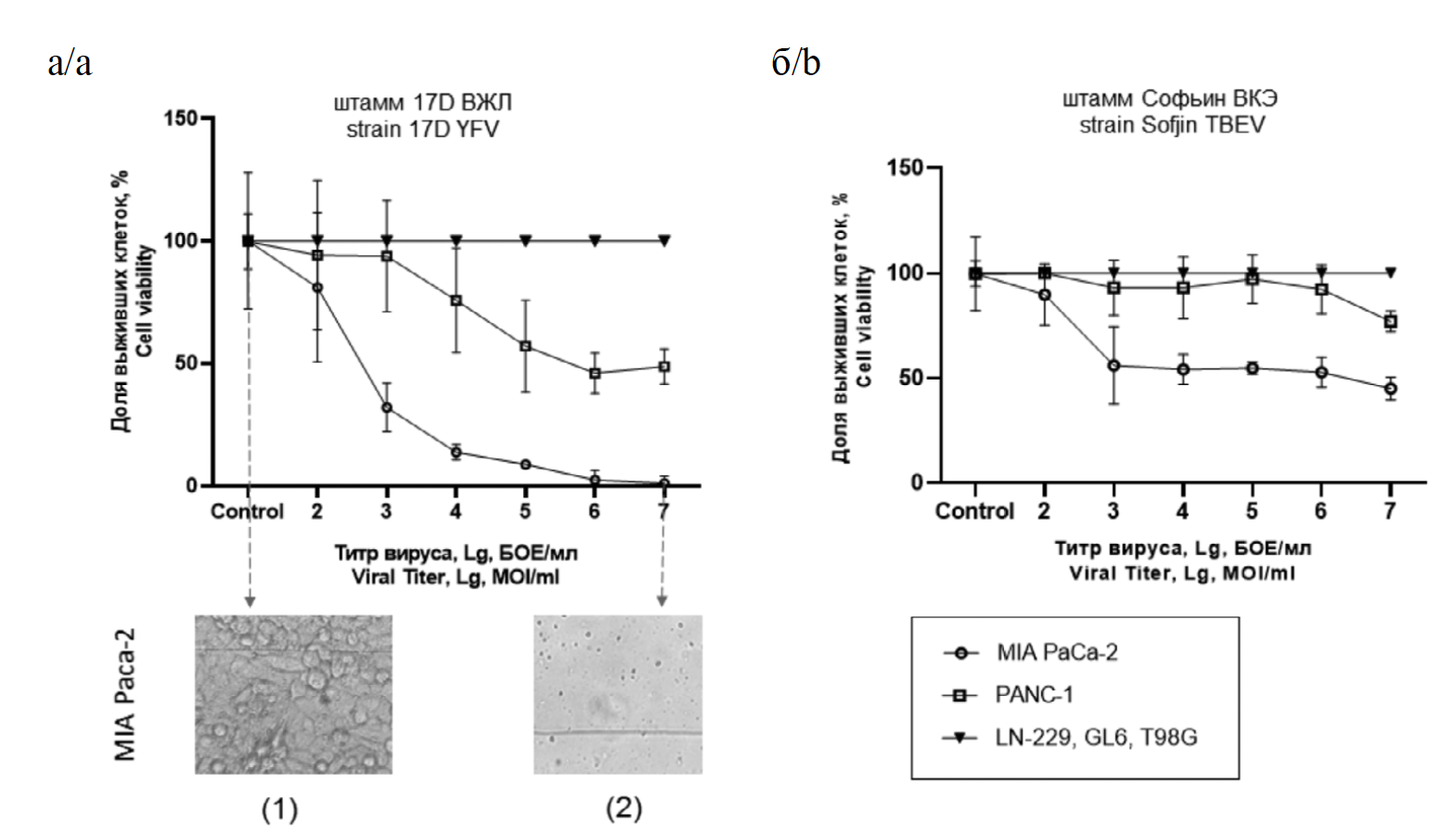
Исследовали чувствительность опухолевых клеточных линий глиобластом GL6, LN-229, T98G, карциномы поджелудочной железы MIA Paca-2 и протоковой карциномы поджелудочной железы PANC-1 к штаммам 17D ВЖЛ и Софьин ВКЭ. С целью определения минимального титра вируса, необходимого для достижения ЦПД, клеточные культуры инкубировали с серийными 10-кратными разведениями ВЖЛ и ВКЭ. Через 5 сут после заражения оценивали жизнеспособность клеток с помощью МТТ-теста. На рис. 1 (а, б) представлены результаты чувствительности исследуемых клеточных линий к штаммам 17D ВЖЛ и Софьин ВКЭ на 5-е сутки после заражения клеток. Полученные профили чувствительности указывают, что наибольший цитопатический эффект штаммы 17D ВЖЛ и Софьин ВКЭ проявляют в отношении клеточной линии MIA Paca-2, частичный – в отношении PANC-1, полное отсутствие ЦПД наблюдается в отношении трех исследуемых культур глиобластом.
Рис. 1. Чувствительность клеточных линий глиобластом GL6, LN-229, T98G, карциномы поджелудочной железы MIA Paca-2 и протоковой карциномы поджелудочной железы PANC-1 к штамму 17D ВЖЛ (панель а) и штамму Софьин ВКЭ (панель б) в зависимости от титра вируса при заражении по результатам оценки доли выживших клеток с помощью МТТ-теста на 5-е сутки после инфицирования.
Фотографии клеток MIA Paca-2. Ув. ×100. а(1) – контрольной лунки, монослой сохранен; а(2) – инфицированной, полный клеточный лизис.
Fig. 1. Sensitivity of glioblastoma cells GL6, LN-229, T98G, pancreatic carcinoma MIA Paca-2 and pancreatic ductal carcinoma PANC-1 cell to strain 17D YFV (panel а) and strain Sofjin TBEV (panel b) depending on the virus titer at the infection as assessed by the proportion of surviving cells using the MTT test at 5 days post-infection.
Photographs of MIA Paca-2 cells. Magnification ×100. а(1) – control well, monolayer preserved; а(2) – infected well, complete cell lysis.
Минимальный титр ВЖЛ при заражении для достижения полной клеточной гибели в отношении MIA Paca-2 составил 106 БОЕ/мл, а ЦПД50 достигалось при титре вируса 103 БОЕ/мл. При воздействии штамма Софьин ВКЭ полного клеточного лизиса в культуре MIA Paca-2 не происходило, ЦПД50 достигалось при минимальном титре вируса 104 БОЕ/мл. Оба исследуемых вирусных штамма даже при титре заражения 107 БОЕ/мл не вызывали полного клеточного лизиса клеток PANC-1, при этом ЦПД50 достигалось к 5-м суткам при воздействии штамма 17D ВЖЛ в титре 106 БОЕ/мл, а в случае штамма Софьин ВКЭ ЦПД50 на клетках PANC-1 наблюдали на 3-и сутки при титре заражения 107 БОЕ/мл, к 5-м суткам цитопатический эффект значительно снижался (табл. 1).
Таблица 1. Результаты определения минимального титра заражения вирусов (штаммы 17D ВЖЛ и Софьин ВКЭ) в отношении клеточных линий карцином (MIA Paca-2, PANC-1) и глиобластом (GL6, LN-229, T98G)
Table 1. Results of determining the minimum titer of virus infection (strain 17D YFV and strain Sofjin TBEV) in carcinoma (MIA Paca-2, PANC-1) and glioblastoma (GL6, LN-229, T98G) cell lines
Минимальный титр вируса при заражении, БОЕ/мл Minimum virus titer at infection, MOI/ml | Штамм 17D ВЖЛ Strain 17D YFV | Штамм Софьин ВКЭ Strain Sofjin TBEV | ||
5-е сутки эксперимента 5th day of the experiment | ЦПД50 CPE50 | Полный клеточный лизис Total cell lysis | ЦПД50 CPE50 | Полный клеточный лизис Total cell lysis |
MIA Paca-2 | 103 | 106 | 104 | – |
PANC-1 | 106 | – | 107* | – |
GL6, LN-229, T98G | – | – | – | – |
Примечание. «–» – нет эффекта; * – ЦПД50 – эффект наблюдается только на 3-и сутки.
Note. «–» – no effect; * – CPE50 – effect observed only on day 3 at titer of 107 MOI/ml.
Исследуемые культуры того же пассажа вели на 25 см2 матрасах с последующим заражением ВЖЛ и ВКЭ с целью оценки ЦПД и отбора проб культуральной среды для определения концентрации вируса методом количественной ПЦР в режиме реального времени. Результаты оценки ЦПД для штамма 17D ВЖЛ при культивировании клеточных линий на матрасах коррелировали с данными МТТ-теста: при титре заражения 107 БОЕ/мл к 5-м суткам ЦПД достигало результата «4 креста» в отношении клеточной линии MIA Paca-2 и «2 креста» в отношении клеточной линии PANC-1. По данным ПЦР, при заражении штаммом 17D ВЖЛ в титре 1 × 107 БОЕ/мл (ПЦР 1 × 106 ГЭ/мл) концентрация вирусной РНК в культуральной среде возрастала, что свидетельствует о репликации вируса в данных клеточных линиях и объясняет выраженный онколитический эффект ВЖЛ в их отношении (табл. 2). ЦПД штамма Софьин ВКЭ при заражении клеток в титре 4 × 107 БОЕ/мл к 5-м суткам в отношении клеточной линии MIA Paca-2 оценивали как «3 креста», в отношении клеточной линии PANC-1 – как «1 крест». По результатам ПЦР, концентрация вирусной РНК в культуральной среде MIA Paca-2 и PANC-1 к 5-м суткам была выше исходной (в момент заражения) – 2 × 109 ГЭ/мл, при этом в клетках MIA Paca-2 концентрация вирусной РНК ВКЭ была на порядок выше (табл. 2).
Таблица 2. Изменение концентрации вирусной РНК в культуральной среде при инфицировании (0-е сутки) карцином поджелудочной железы MIA Paca-2 и PANC-1 штаммами 17D ВЖЛ и Софьин ВКЭ на 3, 4, 5-е сутки эксперимента
Table 2. Changes in viral RNA concentration in the culture medium following infection (day 0) of pancreatic carcinomas MIA Paca-2 and PANC-1 strains 17D YFV and Sofjin TBEV on days 3, 4, 5 of the experiment
Вирус Virus | Штамм 17D ВЖЛ Strain 17D YFV | Штамм Софьин ВКЭ Strain Sofjin TBEV | |||||||
Сутки Days | |||||||||
Клеточные линии Cell Lines | 0 | 3 | 4 | 5 | 0 | 3 | 4 | 5 | |
MIA Paca-2 | ЦПД, БОЕ/мл CPE, MOI/ml | 1 × 107 | ++ | +++ | ++++ | 4 × 107 | + | ++ | +++ |
ПЦР, ГЭ/мл PCR, gE/ml | 1 × 106 | 2,3 × 108 | – | 1,6 × 108 | 2 × 109 | 1,3 × 1011 | – | 1,2 × 1011 | |
PANC-1 | ЦПД, БОЕ/мл CPE, MOI/ml | 1 × 107 | отсутствует | ++ | ++ | 4 × 107 | отсутствует | + | + |
ПЦР, ГЭ/мл PCR, gE/ml | 1 × 106 | 9,6 × 107 | – | 6,2 × 107 | 2 × 109 | 6,1 × 1010 | – | 8,8 × 1010 | |
Примечание. «–» – не исследовалось.
Note. «–» – not investigated.
Отсутствие ЦПД наблюдали в отношении клеточных линий глиобластом LN229 и T98G при заражении штаммом 17D ВЖЛ в титре 107 БОЕ/мл, и лишь в отношении клеточной линии GL6 было отмечено небольшое разрушение монослоя, оцениваемое в «1 крест» (на 3-и сутки эксперимента), однако в последующем усиления ЦПД в клеточной линии GL6 не было зафиксировано вплоть до 13-х суток. Результаты МТТ-теста коррелировали с данными ЦПД, была зарегистрирована полная выживаемость исследуемых клеточных линий глиобластом на 5-е сутки эксперимента (рис. 1). На 5, 7, 10, 13-е сутки и в случае GL6 также и на 3-и сутки отбирали пробы для оценки концентрации 17D ВЖЛ методом количественной ПЦР в режиме реального времени, при этом на 5-е и 10-е сутки производили замену среды (3-и, 10-е сутки в случае GL6). По результатам ПЦР было выявлено снижение концентрации РНК 17D ВЖЛ в культуральной жидкости для всех исследуемых линий глиобластом (рис. 2). Полученные результаты указывают на отсутствие онколитического эффекта в отношении глиобластом для штамма 17D ВЖЛ.
Рис. 2. Изменение концентрации вирусной РНК в культуральной среде при инфицировании (0-е сутки) глиобластом GL6, LN-229, T98G штаммом 17D ВЖЛ на 3, 5, 7, 10, 13-е сутки эксперимента.
Fig. 2. Changes in viral RNA concentration in the culture medium following infection (day 0) of GL6, LN-229, T98G glioblastomas with strain 17D YFV on days 3, 5, 7, 10, 13 of the experiment.
При инфицировании клеточных линий штаммом Софьин ВКЭ ЦПД отсутствовало, однако результаты ПЦР-исследования культуральной жидкости показали, что ВКЭ размножается в клеточных линиях LN229 и GL6. Было проведено 2 независимых эксперимента. Первый эксперимент был более коротким – продолжительностью 5 сут, во втором, более длительном эксперименте на 5-е и 10-е сутки (3-и, 10-е сутки в случае GL6) была произведена замена культуральной среды. В культуральной жидкости клеточной линии LN229 при заражении ВКЭ в титре 1 × 107 БОЕ/мл (ПЦР 1 × 109 ГЭ/мл) концентрация РНК вируса достигла максимальной отметки к 5-м и 10-м суткам и составила 1,3 × 1011 и 7 × 1010 ГЭ/мл соответственно. Для клеточной линии GL6 максимальная концентрация РНК ВКЭ в культуральной жидкости наблюдалась к 3-м суткам эксперимента и достигла 9,6 × 1010 и 4 × 1010 ГЭ/мл в первом и втором экспериментах соответственно, после чего наблюдалось снижение концентрации РНК. В культуральной жидкости клеточной линии T98G концентрация РНК ВКЭ составила 109 ГЭ/мл и практически не менялась в течении первых 5 сут после заражения в первом эксперименте, во втором опыте РНК ВКЭ в концентрации 107 ГЭ/мл определялась в культуральной жидкости вплоть до 13-х суток, однако концентрация РНК вируса была ниже в сравнении с концентрацией РНК ВКЭ в других линиях глиобластом (рис. 3).
Рис. 3. Изменение концентрации вирусной РНК в культуральной среде при инфицировании (0-е сутки) глиобластом GL6, LN-229, T98G штаммом Софьин ВКЭ на 3, 5, 7,10, 13-е сутки эксперимента.
Fig. 3. Changes in viral RNA concentration in the culture medium following infection (day 0) of GL6, LN-229, T98G glioblastomas strain Sofjin TBEV on days 3, 5, 7, 10, 13 of the experiment.
Высокий тропизм штамма 17D ВЖЛ к карциноме поджелудочной железы MIA Paca-2 был продемонстрирован в трехмерной культуре (сфероидах). Формирование тканевых сфероидов производили с помощью агарозных форм, приготовленных при помощи силиконовых матриц («3Д Биопринтинг Солюшенс»). На 3-и сутки культивирования клетки MIA Paca-2 формировались в сфероиды размером 650 мкм. После инфицирования ВЖЛ в титре 1 × 106 БОЕ/мл на после заражения 3-и сутки отмечали ЦПД и появление дефектных сфероидов в сравнении с контрольной группой (рис. 4).
Риc. 4. Оценка ЦПД штамма 17D ВЖЛ с помощью тканевых сфероидов на культуре клеток MIA Paca-2. На фотографии вид сфероидов на 3-и сутки. Контроль – не инфицированный сфероид панель (а) и после инфицирования титром 106 БОЕ/мл штаммом 17D ВЖЛ – панель (б). Ув. ×40.
Fig. 4. Assessment of the CPE of 17D YFV using tissue spheroids on MIA Paca-2 cell culture. The photo shows the view of spheroids at 3 days control – uninfected spheroid (panel а) and after infection with 106 MOI/ml strain 17D YFV – (panel b). Magnification × 40.
Таким образом, результаты настоящего исследования показали, что ВЖЛ, обладая природной тропностью к клеткам гепатобилиарной системы, эффективен только в отношении опухолевых клеток карциномы поджелудочной железы. При высоких титрах заражения ВЖЛ оказывал сильное цитотоксическое действие на клетки карциномы поджелудочной железы (MIA Paca-2) и имел ограниченный эффект в отношении карциномы протоков поджелудочной железы (PANC-1). В отношении исследованных клеточных линий глиобластом (LN229, GL6, T98G) вирус не оказывал онколитического действия, концентрация вирусной РНК в культуральной среде постепенно снижалась.
Штамм Софьин ВКЭ продемонстрировал ЦПД в отношении карциномы поджелудочной железы (MIA Paca-2) и крайне ограниченный цитотоксический эффект в отношении протоковой карциномы поджелудочной железы (PANC-1). При этом, несмотря на природную нейротропность, вирус не оказывал онколитического эффекта в отношении клеточных линий глиобластом (LN229, T98G и GL6), хотя наблюдалась репродукция вируса в этих культурах. Так, для глиобластомы линии GL6 концентрация вирусной РНК определялась в течение 13 сут и была на уровне исходной концентрации РНК при заражении, даже при периодическом удалении культуральной среды, а в случае клеточной линии LN229 концентрация вируса увеличилась с 1 × 109 до 1 × 1010 ГЭ/мл.
Обсуждение
Исследование вакцинных штаммов 17D ВЖЛ и Софьин ВКЭ в отношении клеточных линий глиобластом и карцином поджелудочной железы дает основание сделать вывод о наличии онколитического потенциала у исследуемых вирусов и возможности их применения в терапии злокачественных новообразований.
Безусловно, преимуществом штамма 17D ВЖЛ является его доказанная многолетними исследованиями безопасность и иммуногенность [30].
Сравнить полученные результаты in vitro с другими исследованиями достаточно сложно, так как в литературе представлены данные для опухолевых линий другого генеза. Например, в работе M. Aznat и соавт. [25] исследования выполнены на клеточных линиях рака толстой кишки, почечно-клеточного рака, рака молочной железы и меланомы. Штамм 17D ВЖЛ проявлял цитопатическое действие, в то время как на нетрансформированных фибробластах человека цитотоксические эффекты отсутствовали. При прививании карциномы толстой кишки MC38 и меланомы B16OVA мышам C57BL/6 с последующим внутриопухолевым введением вируса наблюдалась задержка роста опухоли. Таким образом, штамм 17D ВЖЛ можно рассматривать в качестве потенциального онколитического агента.
Тот факт, что вакцина на основе штамма 17D ВЖЛ является широко используемым профилактическим средством для подкожной или внутримышечной вакцинации, значительно упрощает возможную клиническую разработку стратегий иммунотерапии, включающих внутриопухолевые инъекции. Дополнительно повысить эффективность терапии можно путем введения в клетку опухоли последовательностей, кодирующих гены-супрессоры опухоли, гены «смерти» или гены цитокинов, усиливающих индукцию иммунного ответа на опухолевые антигены, например, путем создания рекомбинантных векторов на основе 17D, несущих монотела с убиквитин-лигазами VHL и MDM2 для таргетного разрушения онкогенов типа K-RAS.
Вакцинный штамм Софьин ВКЭ является нейротропным, свободно преодолевает гематоэнцефалический барьер и способен вызывать энцефалопатию [31], поэтому применение его in vivo как противоопухолевого агента возможно только после предварительной иммунизации реципиентов инактивированной вакциной или при генетической модификации ВКЭ для улучшения его профиля безопасности. Ранее уже были проведены исследования ВКЭ-штаммов дальневосточного подтипа, к которым относится и штамм Софьин в качестве возможных онколитических агентов. Результаты показали ингибирование роста подкожных опухолей мышей различной этиологии (фибросаркома MCI, нейробластома мыши C1300, аденокарцинома молочной железы EO 771, остеогенная саркома Ridgeway, саркомы T241 и 180), однако такие исследования проводились очень давно, в 1950-х гг. [27, 28, 32, 33]. Таким образом, штамм Софьин ВКЭ потенциально можно рассмотреть в качестве онколитического вируса при условии обеспечения безопасности его применения.
Полученные в настоящем исследовании результаты in vitro также подтверждают, что штаммы 17D ВЖЛ и Софьин ВКЭ имеют перспективы в онковиротерапии. Разумеется, клеточные культуры не в полной мере отражают патофизиологию опухолевых клеток в системе in vivo. Поведение опухоли в организме определяется как опухолевыми клетками, так и клетками стромального микроокружения, внеклеточным матриксом, влиянием гипоксии, а микроокружение опухоли характеризуется наличием большого количества воспалительных цитокинов, факторов роста и других факторов, поддерживающих рост и метастазирование опухоли [34, 35]. В связи с вышесказанным в дальнейшем планируется продолжить изучение противоопухолевых онколитических и иммуномодулирующих эффектов штаммов 17D ВЖЛ и Софьин ВКЭ на моделях in vivo. Поскольку акцент нами делается именно на иммунологические эффекты, планируются эксперименты на иммунокомпетентных животных с использованием сингенных моделей подкожного опухолевого роста клеток рака поджелудочной железы (PAN02) и глиомы (GL261). Исследование на иммунокомпетентных животных позволит также получить данные по усилению эффекта при предварительной иммунизации животных, а в случае ВКЭ Софьин исследование возможно только при условии предварительной иммунизации инактивированной вакциной ВКЭ.
Также в дальнейшем для понимания механизмов вирусного онкотропизма целесообразно проводить исследования с культурами клеточных опухолевых линий, полученных из опухолей (послеоперационный материал) от пациентов. Так в исследовании А.В. Липатовой и соавт. [36] был применен мультиомный анализ с целью изучения вклада интерферонзависимых противовирусных механизмов в опухолевых клетках мультиморфной глиобластомы, полученных от отдельных пациентов, на устойчивость к онколитическим вирусам, принадлежащим к разным вирусным семействам.
Заключение
Штаммы 17D ВЖЛ и Софьин ВКЭ оказывали цитопатическое действие на клеточные линии рака поджелудочной железы человека при увеличении репродукции вируса в культуральной среде. Резистентность к исследуемым вирусам клеточной линии протоковой карциномы поджелудочной железы PANC-1 была выше, чем карциномы поджелудочной железы MIA Paca-2, что, возможно, связано с повышенной экспрессией IRF2 и IRF7, которые регулируют гены интерферона-a и -γ, в данной клеточной линии [37, 38].
Также следует отметить способность штамма 17D ВЖЛ лизировать 3D-сфероиды клеточной линии MIA Paca-2, что, вероятно, определяет возможность вируса проникать между плотными контактами опухолевых клеток.
В настоящем исследовании штамм Софьин ВКЭ по литическому действию на опухолевые клеточные линии явно уступал штамму 17D ВЖЛ, однако способность его к репликации в клеточных линиях глиобластомы требует дальнейшего изучения in vivo на модели иммунокомпетентных животных с учетом проработки вопроса безопасности его применения путем дополнительной генно-инженерной модификации вируса или предварительной иммунизации животных инактивированной вакциной. Ввиду того, что флавивирусы являются высокоэффективными иммуногенами, мы предполагаем, что лизис или задержка роста опухоли могут быть достигнуты иммуно-опосредованным путем благодаря репликации вируса в опухолевых тканях.
В заключение следует отметить, что применение флавивирусов для онковиротерапии опухолей может оказаться перспективным. Флавивирусы могут быть использованы как непосредственно для лизиса опухолевых клеток, так и для иммуно-опосредованной индукции лизиса опухоли через активацию Т-клеточного звена иммунитета, способствуя преобразованию «холодных» опухолей в «горячие» для увеличения числа иммуночувствительных клеток опухоли и повышения эффективности терапии.
About the authors
Alina S. Nazarenko
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: nazarenko_as@chumakovs.su
ORCID iD: 0000-0002-7322-8730
Junior researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow. Russia
Russian Federation, 108819, MoscowYulia K. Biryukova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Author for correspondence.
Email: biryukova_jk@chumakovs.su
ORCID iD: 0000-0002-5804-4001
Ph. D., Researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), 108819, Russian Federation, Moscow. Russia
Russian Federation, 108819, MoscowEkaterina O. Orlova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: orlova_ea@chumakovs.su
ORCID iD: 0009-0009-4175-0493
Junior researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow. Russia
Russian Federation, 108819, MoscowKirill N. Trachuk
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: trachuk_kn@chumakovs.su
ORCID iD: 0000-0002-2061-0274
Junior researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow, Russia
Russian Federation, 108819, MoscowAlla L. Ivanova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: ivanova_al@chumakovs.su
ORCID iD: 0009-0002-3086-0581
Ph. D., Microbiologist, Encephalitis Vaccine department, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow. Russia
Russian Federation, 108819, MoscowAlla V. Belyakova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: belyakova_av@chumakovs.su
ORCID iD: 0000-0003-4363-6394
Ph. D., Scientific secretary, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow. Russia
Russian Federation, 108819, MoscowNikolai B. Pestov
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: nayeoff@yahoo.com
ORCID iD: 0000-0002-9973-0120
Ph. D., Senior Researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow, Russia
Russian Federation, 108819, MoscowMikhail F. Vorovitch
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis); I.M. Sechenov First Moscow State Medical University, Ministry of Health of Russia (Sechenov University), Institute of Translational Medicine and Biotechnology
Email: vorovich_mf@chumakovs.su
ORCID iD: 0000-0002-7367-6357
Ph. D., Head of Encephalitis Vaccine Department and Senior Researcher of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow. Russia
108819, Moscow; 119048, MoscowAydar A. Ishmukhametov
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis); I.M. Sechenov First Moscow State Medical University, Ministry of Health of Russia (Sechenov University), Institute of Translational Medicine and Biotechnology
Email: ishmukhametov@chumakovs.su
ORCID iD: 0000-0001-6130-4145
Academician of the Russian Academy of Sciences, CEO, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow. Russia
Russian Federation, 108819, Moscow; 119048, MoscowNadezhda M. Kolyasnikova
Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis)
Email: kolyasnikova_nm@chumakovs.su
ORCID iD: 0000-0002-9934-2582
D.M.S, Head of the Laboratory of Tick-Borne Encephalitis and Other Viral Encephalitides, Chumakov Federal Scientific Center for Research and Development of Immune-and-Biological Products of Russian Academy of Sciences (Institute of Poliomyelitis), Moscow, Russia
Russian Federation, 108819, MoscowReferences
- Klaan N.K., Akin’shina L.P., Pronina T.A. Oncolitical viruses in the therapy of malignant neoplastic diseases. Rossiyskiy bioterapevticheskiy zhurnal. 2018; 17(4): 6–19. https://doi.org/10.17650/1726-9784-2018-17-4-6-19 https://elibrary.ru/ysbnsh (in Russian)
- Li K., Zhao Y., Hu X., Jiao J., Wang W., Yao H. Advances in the clinical development of oncolytic viruses. Am. J. Transl. Res. 2022; 14(6): 4192–206.
- Macedo N., Miller D.M., Haq R., Kaufman H.L. Clinical landscape of oncolytic virus research in 2020. J. Immunother. Cancer. 2020; 8(2): e001486. https://doi.org/10.1136/jitc-2020-001486
- Kolyasnikova N.M., Pestov N.B., Sanchez-Pimentel J.P., Barlev N.A., Ishmukhametov A.A. Anti-cancer virotherapy in Russia: lessons from the past, current challenges and prospects for the future. Curr. Pharm. Biotechnol. 2023; 24(2): 266–78. https://doi.org/10.2174/1389201023666220516121813
- Tsypkin L.B., Voroshilova M.K., Goryunova A.G., Lavrova I.K., Koroleva G.A. The morphology of tumors of the human gastrointestinal tract in short-term organ culture and the reaction of these tumors to infection with poliovirus. Cancer. 1976; 38(4): 1796–806. https://doi.org/10.1002/1097-0142(197610)38:4%3C1796::aid-cncr2820380457%3E3.0.co;2-y
- Voroshilova M.K., Goryuniva A.G., Gorbachkov E.A., Chumakov P.M., Oganian T.G., Kodkind G.H. Studies on Cellular Immunity of Oncology Patients in the Process of Asymptomic Enteroviral Infection. Riga: Zinātne; 1977: 17–20.
- Voroshilova M.K., Vaganova N.T. Treatment of Patients with Gastro-Intestinal Tract Tumors with Live Enteroviral Vaccines. Riga: Zinātne; 1969.
- Soboleva A.V., Lipatova A.V., Kochetkov D.V., Chumakov P.M. Changes in the sensitivity of human glioblastoma cells to oncolytic enteroviruses induced by passaging. Vestnik Rossiyskogo gosudarstvennogo meditsinskogo universiteta. 2018; (2): 40–4. https://doi.org/10.24075/brsmu.2018.025 https://elibrary.ru/uutsjs
- Sosnovtseva A.O., Chekhonin V.P., Zheltukhin A.O., Lipatova A.V., Chumakov P.M. Oncolytic activity of the vaccine strain of type 3 poliovirus on the model of rat glioma C6 cells. Byulleten’ eksperimental’noy biologii i meditsiny. 2019; 167(1): 111–5. https://doi.org/10.1007/s10517-019-04472-6 https://elibrary.ru/rrdykv
- Zheltukhin A.O., Soboleva A.V., Sosnovtseva A.O., Le T.Kh., Il’inskaya G.V., Kochetkov D.V., et al. Human enteroviruses exhibit selective oncolytic activity in the model of human glioblastoma multiforme xenografts in immunodeficient mice. Vestnik Rossiyskogo gosudarstvennogo meditsinskogo universiteta. 2018; (2): 42–8. https://doi.org/10.24075/brsmu.2018.026 https://elibrary.ru/xuagdz
- Stepanenko A.A., Sosnovtseva A.O., Valikhov M.P., Chekhonin V.P. A new insight into aggregation of oncolytic adenovirus Ad5-delta-24-RGD during CsCl gradient ultracentrifugation. Sci. Rep. 2021; 11(1): 16088. https://doi.org/10.1038/s41598-021-94573-y
- Romanenko M.V., Dolgova E.V., Osipov I.D., Ritter G.S., Sizova M.S., Proskurina A.S., et al. Oncolytic effect of adenoviruses serotypes 5 and 6 against U87 glioblastoma cancer stem cells. Anticancer Res. 2019; 39(11): 6073–86. https://doi.org/10.21873/anticanres.13815
- Svyatchenko V.A., Netesov S.V., Tarasova M.V., Chumakov P.M. Oncolytic adenoviruses in anticancer therapy: current status and prospects. Molekulyarnaya biologiya. 2012; (4): 496–507. https://doi.org/10.1134/S0026893312040103 https://elibrary.ru/rgfvkf
- Vdovochenko G.V., Radaeva I.F., Sergeev A.A., Kolokol’tsova T.D., Nechaeva E.A., Il’ina T.V., et al. Development of banks of a 203-cell continuous culture for manufacturing the anti-tumor therapeutic preparation cancerolysin. Biotekhnologiya. 2006; (1): 83–9. https://elibrary.ru/iiqmwx
- Vdovichenko G.V., Petrishchenko V.A., Sergeyev A.A., Kim I.I., Fatyukhina O.Ye., Shishkina L.N., et al. Preclinical studies of the anticancer adenovirus cancerolysin. Voprosy virusologii. 2006; 51(6): 39–42. https://elibrary.ru/hylfpr (in Russian)
- Vdovichenko G.D., Petrishchenko V.A., Sergeev A.A., Kim I.I., Fatyukhina O.E., Shishkina L.N., et al. Study on reactogenicity, safety and specific activity of an anticancer medicinal preparation cancerolysin using test animals. Biotekhnologiya. 2006; (2): 88–96. https://elibrary.ru/ibjlpf
- Bauer T.V., Tregubchak T.V., Maksyutov A.Z., Taranov O.S., Maksyutov R.A., Gavrilova E.V., et al. Recombinant vaccinia virus promising for melanoma treatment. Molekulyarnaya genetika, mikrobiologiya i virusologiya. 2020; 35(2): 97–104. https://doi.org/10.3103/S0891416820020032 https://elibrary.ru/ujwwtp
- Nazarenko A.S., Vorovitch M.F., Biryukova Y.K., Pestov N.B., Orlova E.A., Barlev N.A., et al. Flaviviruses in antitumor therapy. Viruses. 2023; 15(10): 1973. https://doi.org/10.3390/v15101973
- Lemos de Matos A., Franco L.S., McFadden G. Oncolytic viruses and the immune system: the dynamic duo. Mol. Ther. Methods Clin. Dev. 2020; 17: 349–58. https://doi.org/10.1016/j.omtm.2020.01.001
- Postler T.S., Beer M., Blitvich B.J., Bukh J., de Lamballerie X., Drexler J.F., et al. Renaming of the genus flavivirus to orthoflavivirus and extension of binomial species names within the family flaviviridae. Arch. Virol. 2023; 168(9): 224. https://doi.org/10.1007/s00705-023-05835-1
- Zhu Z., Gorman M.J., McKenzie L.D., Chai J.N., Hubert C.G., Prager B.C., et al. Zika virus has oncolytic activity against glioblastoma stem cells. J. Exp. Med. 2017; 214(10): 2843–57. https://doi.org/10.1084/jem.20171093
- Svyatchenko V.A., Razumov I.A., Protopopova E.V., Demina A.M., Solovieva O.I., Zavjalov E.L., et al. Zika virus has an oncolytic activity against human glioblastoma U87 cells. Vavilovskiy zhurnal genetiki i selektsii. 2019; 22(8): 1040–5. https://doi.org/10.18699/VJ18.448 https://elibrary.ru/yqnnul (in Russian)
- Monath T.P., Vasconcelos P.F. Yellow fever. J. Clin. Virol. 2015; 64: 160–73. https://doi.org/10.1016/j.jcv.2014.08.030
- Zhu X., Fan C., Xiong Z., Chen M., Li Z., Tao T., et al. Development and application of oncolytic viruses as the nemesis of tumor cells. Front. Microbiol. 2023; 14: 1188526. https://doi.org/10.3389/fmicb.2023.1188526
- Aznar M.A., Molina C., Teijeira A., Rodriguez I., Azpilikueta A., Garasa S., et al. Repurposing the yellow fever vaccine for intratumoral immunotherapy. EMBO Mol. Med. 2020; 12(1): e10375. https://doi.org/10.15252/emmm.201910375
- Levkovich E.N., Karpovich L.G. Comparative study of the viruses of the tick encephalitis group in HeLa cell cultures. Voprosy virusologii. 1960; (5): 30–9. (in Russian)
- Levkovich E.N., Sergeeva G.I. The inhibiting effect of tick-borne encephalitis complex viruses possessing varying neurovirulence on mouse tumors in vivo. Byulleten’ eksperimental’noy biologii i meditsiny. 1967; 64(8): 88–91. (in Russian)
- Sergeeva G.I., Levkovich E.N. A study of the features of reproduction in tumor cells in vitro and in vivo of different viruses of the tick-borne encephalitis complex, possessing various degress of neurovirulence. Voprosy virusologii. 1966; 11(5): 539–45. (in Russian)
- Koudan E.V., Gryadunova A.A., Karalkin P.A., Korneva J.V., Meteleva N.Y., Babichenko I.I., et al. Multiparametric analysis of tissue spheroids fabricated from different types of cells. Biotechnol. J. 2020; 15(5): 1900217. https://doi.org/10.1002/biot.201900217
- Dutta S.K., Langenburg T. A perspective on current flavivirus vaccine development: a brief review. Viruses. 2023; 15(4): 860. https://doi.org/10.3390/v15040860
- Lindquist L., Vapalahti O. Tick-borne encephalitis. Lancet. 2008; 371(9627): 1861–71. https://doi.org/10.1016/s0140-6736(08)60800-4
- Moore A.E. The destructive effect of the virus of Russian Far East encephalitis on the transplantable mouse sarcoma 180. Cancer. 1949; 2(3): 525–34. https://doi.org/10.1002/1097-0142(194905)2:3%3C525::aid-cncr2820020317%3E3.0.co;2-o
- Moore A.E. Inhibition of growth of five transplantable mouse tumors by the virus of Russian Far East encephalitis. Cancer. 1951; 4(2): 375–82. https://doi.org/10.1002/1097-0142(195103)4:2%3C375::aid-cncr2820040227%3E3.0.co;2-a
- Chiantore M.V., Mangino G., Zangrillo M.S., Iuliano M., Affabris E., Fiorucci G., et al. Role of the Microenvironment in tumourigenesis: focus on virus-induced tumors. Curr. Med. Chem. 2015; 22(8): 958–74. https://doi.org/10.2174/0929867322666141212121751
- Gál P., Varinská L., Fáber L., Novák Š., Szabo P., Mitrengová P., et al. How signaling molecules regulate tumor microenvironment: parallels to wound repair. Molecules. 2017; 22(11): 1818. https://doi.org/10.3390/molecules22111818
- Lipatova A.V., Soboleva A.V., Gorshkov V.A., Bubis J.A., Solovyeva E.M., Krasnov G.S., et al. Multi-omics analysis of glioblastoma cells’ sensitivity to oncolytic viruses. Cancers (Basel). 2021; 13(21): 5268. https://doi.org/10.3390/cancers13215268
- Moerdyk-Schauwecker M., Shah N.R., Murphy A.M., Hastie E., Mukherjee P., Grdzelishvili V.Z. Resistance of pancreatic cancer cells to oncolytic vesicular stomatitis virus: role of type I interferon signaling. Virology. 2013; 436(1): 221–34. https://doi.org/10.1016/j.virol.2012.11.014
- Sakai T., Mashima H., Yamada Y., Goto T., Sato W., Dohmen T., et al. The roles of interferon regulatory factors 1 and 2 in the progression of human pancreatic cancer. Pancreas. 2014; 43(6): 909–16. https://doi.org/10.1097/mpa.0000000000000116
Supplementary files