Том 66, № 6 (2021)
- Год: 2021
- Выпуск опубликован: 09.12.2021
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/53
Весь выпуск
ОБЗОРЫ
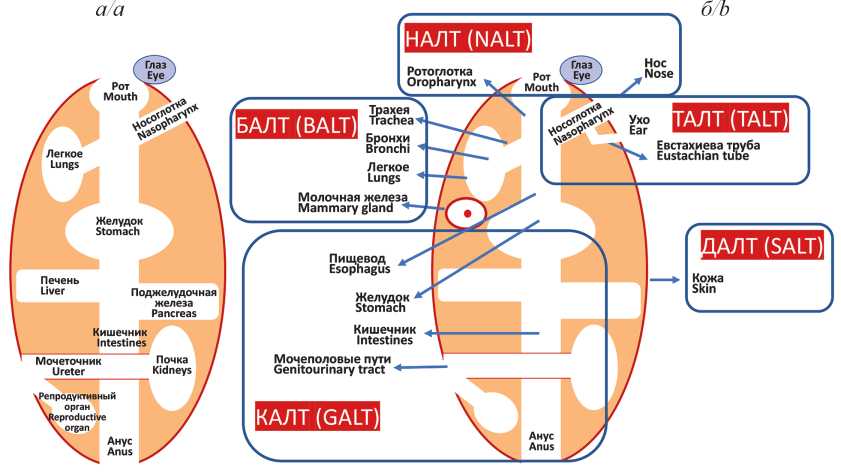
Мукозальный иммунитет и вакцины против вирусных инфекций
Аннотация
Иммунитет слизистых оболочек (СО) реализуется через структурно-функциональную систему, называемую мукозо-ассоциированной лимфоидной тканью (МАЛТ; mucosa-associated lymphoid tissue, MALT). МАЛТ подразделяется на части (кластеры) в зависимости от их анатомического расположения, однако все они имеют идентичное строение: слой слизи, эпителиальная ткань, собственная пластинка СО и лимфоидные фолликулы. Плазматические клетки МАЛТ вырабатывают уникальный тип иммуноглобулинов (Ig) – IgA, обладающий способностью к полимеризации. При мукозальной иммунизации преобладающей формой этих антител (АТ) является секреторный димер (sIgA), в больших количествах концентрирующийся в СО. Мукозальные IgA действуют как первая линия защиты и эффективно нейтрализуют вирусные агенты на уровне входных ворот инфекции, предотвращая поражение эпителиальных клеток и генерализацию инфекционного процесса. На сегодняшний день лицензированы несколько мукозальных противовирусных вакцин, в состав которых входят аттенуированные штаммы соответствующих вирусов: полиомиелита, гриппа, ротавируса. Несмотря на огромные успехи, достигнутые с применением этих вакцинных препаратов, в частности по ликвидации полиомиелита, существенными недостатками использования аттенуированных вирусных штаммов, входящих в их состав, являются риск реактогенности и возможность реверсии к вирулентному штамму в процессе вакцинации. Тем не менее именно мукозальная вакцинация, имитируя естественное инфицирование, способна индуцировать быстрый и эффективный иммунный ответ и таким образом способствовать предотвращению, а возможно, и остановке вспышек многих вирусных инфекций. В настоящее время клинические испытания успешно проходит целый ряд интраназальных вакцин, основанных на новом векторном подходе, при котором для доставки протективно значимых иммуногенов патогенных вирусов используются безопасные вирусные векторы. Самым тестируемым вектором для интраназальных вакцинных препаратов является аденовирус, а наиболее значимым иммуногеном – S-белок SARSCoV-2. Исследуются также мукозальные векторные вакцины против респираторно-синцитиального вируса человека и вируса иммунодефицита человека 1 типа на основе вируса Сендай, способного бессимптомно реплицироваться в клетках бронхиального эпителия.
 399-408
399-408


Молекулярная эволюция вируса Даби (Phenuiviridae: Bandavirus: Dabie bandavirus) – возбудителя острой лихорадки с тромбоцитопеническим синдромом
Аннотация
Со времени идентификации вируса Даби (ВД; прежнее название – вирус SFTS, SFTSV) (Phenuiviridae: Bandavirus: Dabie bandavirus) вызванные им эпидемии острой лихорадки с тромбоцитопеническим синдромом (severe fever with thrombocytopenia syndrome, SFTS) произошли в нескольких странах Восточной Азии. Быстрый рост заболеваемости указывает на то, что этот инфекционный агент имеет пандемический потенциал и представляет собой надвигающуюся глобальную угрозу для общественного здравоохранения.
В настоящем обзоре проведён анализ молекулярной эволюции возбудителя острой лихорадки с тромбоцитопеническим синдромом на материале его вариантов, выделенных в Китайской Народной Республике (КНР), Японии и Южной Корее (Республика Корея). Установлены скорость процесса эволюции и возможное время появления общего предка ВД, а также продемонстрирована возможность его реассортации.
Скорость эволюции генома ВД оценена как 2,28 × 10-4 нуклеотидных замен/сайт/год для S-сегмента, 2,42 × 10-4 для М-сегмента и 1,19 × 10-4 замен/сайт/год – для L-сегмента. В геноме вируса определены позиции положительной селекции.
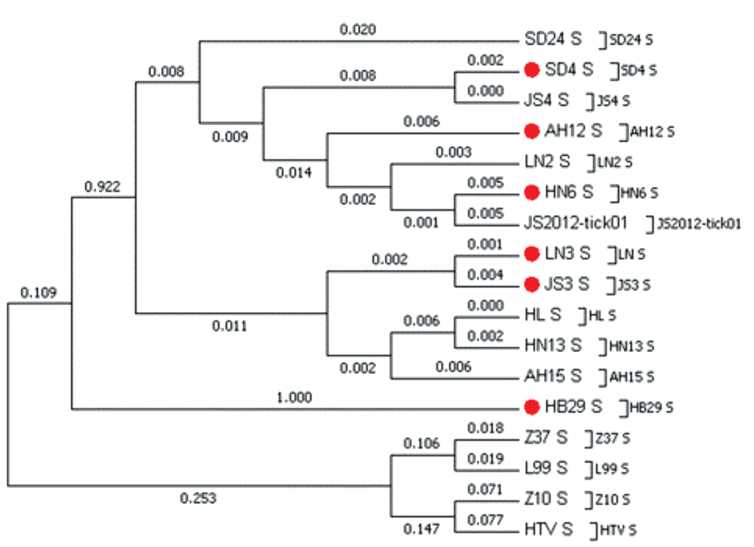
Филогенетический анализ установил, что ВД разделён на 2 клайда, содержащие 6 различных генотипов.
Структура филогенетических деревьев для L-, S- и M-сегментов указывает на происхождение всех генотипов от одного общего предка.
Результаты исследований свидетельствуют о том, что ВД использует множественные механизмы для повышения уровня изменчивости. Понимание филогенетических факторов, определяющих трансмиссию данного патогена, имеет важное значение для оценки эпидемиологических характеристик вызываемого им заболевания и прогноза возможных его вспышек.
 409-416
409-416


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Молекулярные методы диагностики новой коронавирусной инфекции: сравнение петлевой изотермической амплификации и полимеразной цепной реакции
Аннотация
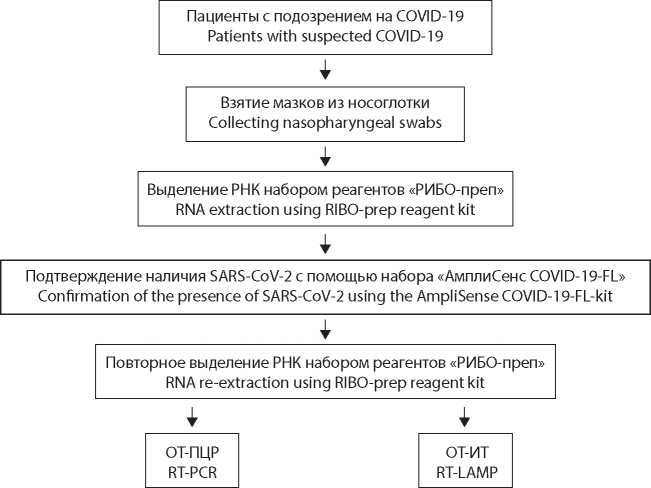
Введение. В настоящее время основой молекулярной диагностики большинства инфекционных заболеваний является использование полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР; reverse transcription polymerase chain reaction, RT-PCR). Альтернативой этому методу при решении диагностических задач могут выступать технологии, основанные на петлевой изотермической амплификации с обратной транскрипцией (ОТИТ; reverse transcription loop-mediated isothermal amplifcation, RT-LAMP). В данном исследовании нами выполнено сравнение ОТ-ИТ и ОТ-ПЦР с целью анализа как преимуществ, так и недостатков обоих подходов.
Материал и методы. При проведении экспериментов использованы наборы реагентов, предназначенные для анализа на основе ОТ-ПЦР и ОТ-ИТ. В работе использовался биологический материал, полученный из мазков со слизистой оболочки рото- и носоглотки у лиц с симптомами новой коронавирусной инфекции.
Результаты. В ходе исследования протестирован 381 образец РНК вируса SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus; Sarbecovirus) от различных пациентов. Полученные значения порогового числа циклов (cycle threshold, Ct) для ОТ-ПЦР составили в среднем 20,0 ± 3,7 (диапазон 1530 ± 300 с), для ОТ-ИТ – 12,8 ± 3,7 (диапазон 550 ± 160 с). Исходя из теоретических предпосылок, в качестве гипотетической была предложена линейная зависимость представленных величин; коэффициент корреляции составил ≈0,827. При этом для проб с низкой вирусной нагрузкой (ВН) более высокие значения Ct при ОТ-ИТ не всегда соответствовали таковым в случае ОТ-ПЦР.
Обсуждение. Мы отметили существенное преимущество во времени при выполнении анализа с помощью ОТ-ИТ по сравнению с ОТ-ПЦР, что может быть важно в условиях тестирования большого количества образцов. Разработанные на основе методики ОТ-ИТ тест-системы в силу простоты в использовании и относительной быстроты получения результата могут быть применены в процессе массового скрининга с целью выявления лиц со средней и высокой ВН, представляющих наибольшую угрозу распространения SARS-CoV-2. В свою очередь, диагностические методы на базе ОТ-ПЦР подходят в том числе для оценки ВН и её динамики у пациентов c COVID-19.
 417-424
417-424


Распространение маркёров респираторных вирусов человека среди обезьян Адлерского приматологического центра
Аннотация
Введение. Актуальность изучения циркуляции респираторных вирусов (РВ) человека среди лабораторных приматов связана с необходимостью испытания на этих моделях вакцин и антивирусных препаратов против вызываемых этими возбудителями инфекций, смертность от которых наиболее высока у детей и пожилых.
Целью данной работы являлось изучение распространённости серологических и молекулярно-генетических маркёров респираторных вирусных инфекций человека у лабораторных приматов, рождённых в Адлерском приматологическом центре (г. Сочи, Россия), а также у импортированных обезьян.
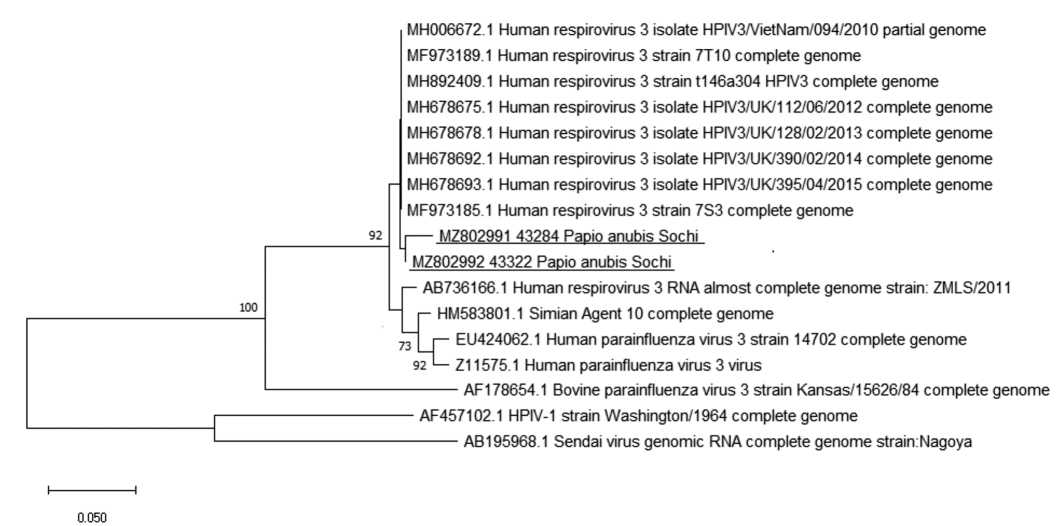
Материал и методы. От различных видов обезьян получены образцы сыворотки крови (n = 1971) и аутопсийного материала лёгких (n = 26). Образцы сывороток крови исследованы на наличие серологических маркёров возбудителей кори, парагриппа (ПГ) 1, 2, 3 типов, гриппа А и В, респираторно-синцитиальной (РС) и аденовирусной инфекций с помощью иммуноферментного анализа (ИФА). В аутопсийном материале осуществляли детекцию РНК РС-вируса, метапневмовируса, вируса ПГ типов 1–4, риновируса, коронавируса, а также ДНК аденовирусов групп B, C, E и бокавируса для исследования методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
Результаты и обсуждение. Частота выявления среди обезьян антител (АТ) к РВ в среднем была невысокой и составила: 11,3% (95% ДИ: 9,2–13,7%; n = 811) для вируса кори; 8,9% (95% ДИ: 6,2–12,2%; n = 381) для вируса ПГ 3 типа; 2,5% (95% ДИ: 0,8–5,6%; n = 204) для вируса ПГ 1 типа и 7,7% (95% ДИ: 3,8–3,7%, n = 130) – для аденовирусов. При тестировании всех 26 аутопсийных образцов лёгочной ткани от обезьян разных видов, погибших от пневмонии, в 2 образцах от павианов анубисов (Papio аnubis) была выявлена РНК вируса ПГ типа 3.
Заключение. Полученные данные подтверждают необходимость строгого соблюдения сроков карантина и обязательного тестирования обезьян на наличие АТ к вирусу кори класса IgM, свидетельствующих о недавнем инфицировании. Установлена роль вируса ПГ 3 типа в патологии респираторного тракта у павианов анубисов.
 425-433
425-433


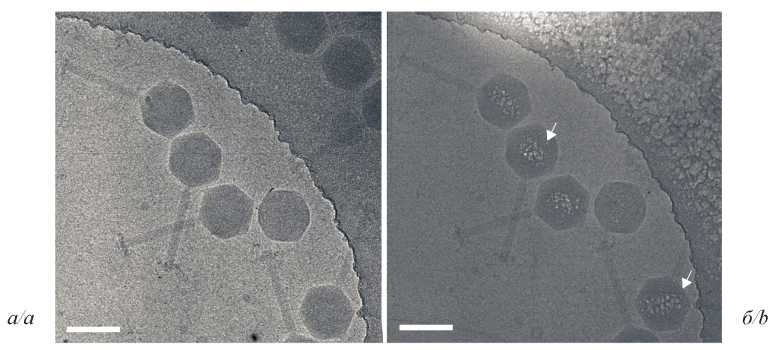
Картирование ДНК в капсиде гигантского бактериофага phiEL (Caudovirales: Myoviridae: Elvirus) с помощью аналитической электронной микроскопии
Аннотация
Введение. Гигантские phiKZ-подобные бактериофаги имеют внутри капсида уникальное белковое образование – внутреннее тело (ВТ), на которое навита суперскрученная ДНК. Стандартные подходы, используемые в криоэлектронной микроскопии (криоЭМ), не позволяют отличить эту структуру от окружающей её молекулы нуклеиновой кислоты фага. Ранее нами разработан аналитический подход для визуализации комплексов ДНК с белком на срезах бактериальных клеток Escherichia coli с использованием в качестве маркёра химического элемента фосфора. В настоящем исследовании мы адаптировали данную методику к значительно более мелким объектам – капсидам phiKZ-подобных бактериофагов.
Материал и методы. В исследовании применялись методы электронной микроскопии: аналитическая (АЭМ) (спектроскопия характеристических потерь энергии электронами, СХПЭЭ) и криоЭМ (сравнение изображений образцов с низкой и высокой дозой электронного облучения). Результаты. Мы изучили упаковку молекулы ДНК внутри капсидов гигантских бактериофагов phiEL из семейства Myoviridae, инфицирующих Pseudomonas aeruginosa. Построены карты распределения фосфора, показавшие несимметричное расположение ДНК внутри капсида.
Обсуждение. Мы разработали и применили методику визуализации ВТ с использованием высокоуглового темнопольного детектора (HAADF) и аналитического подхода СПЭМ-СХПЭЭ. Картирование распределения фосфора посредством СХПЭЭ и результаты криоЭМ выявили белковую структуру внутри капсида фагов phiEL в виде ВТ, размер которого был оценён с помощью теоретических расчётов.
Заключение. Разработанная методика может применяться для исследования распределения фосфора в других ДНК- или РНК-содержащих вирусах при сравнительно низких содержаниях искомого элемента.
 434-441
434-441


Особенности патологии дыхательной системы у сирийских хомяков (Mesocricetus auratus) при инфекции вирусом SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus: Sarbecovirus)
Аннотация
Введение. На сегодняшний день в связи с необходимостью проведения доклинических исследований препаратов, предназначенных для профилактики и лечения новой коронавирусной инфекции COVID-19, важной задачей представляется верификация гистологических изменений дыхательной системы на экспериментальных моделях у лабораторных животных, в частности у сирийских (золотистых) хомяков (Mesocricetus auratus).
Цель работы – исследование патологических изменений лёгких применительно к биологической модели инфекции, вызываемой вирусом SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus; Sarbecovirus), у сирийских хомяков.
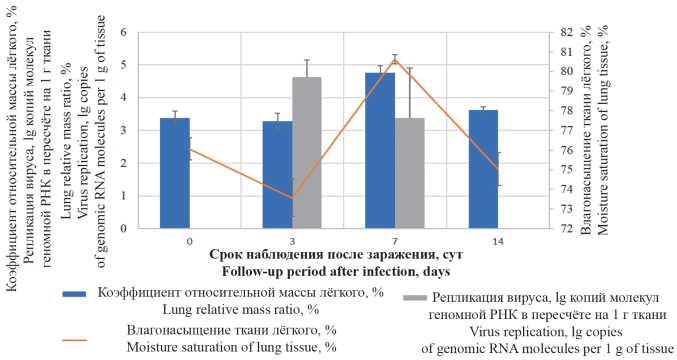
Материал и методы. Самцов сирийских хомяков массой 80–100 г заражали путём интраназального введения культуры с содержанием возбудителя 4 × 104 ТЦД50/мл (ТЦД – тканевая цитопатическая доза). Эвтаназию животных проводили на 3, 7 и 14 сут с регистрацией гравиметрических показателей. Содержание вируса в лёгких определяли методом полимеразной цепной реакции (ПЦР). Гистологические препараты ткани правого лёгкого и трахеи окрашивали гематоксилином и эозином, а также по Маллори.
Результаты и обсуждение. У инфицированных SARS-CoV-2 животных через 3 сут после заражения определяли максимальные значения репликативной активности вируса в лёгочной ткани. Спустя 7 сут на фоне снижения количественного содержания инфекционного агента в тканях лёгкого выявляли патологически значимое увеличение гравиметрических показателей органа. В период 3–14 сут после заражения в гистологической картине лёгких наблюдали развитие воспалительного процесса, характеризовавшегося последовательной сменой инфильтративно-пролиферативных, отёчно-макрофагальных и фибробластических изменений. Установлено, что начальные изменения эпителия дыхательных путей могут протекать без паранекротического интерстициального воспаления, тогда как при формировании множественного поражения лёгочной паренхимы повреждения эпителия бронхиол и ацинарных ходов могут иметь вторичный характер. В качестве патоморфологического признака, характерного для инфекции SARS-CoV-2 у данного вида, отмечено появление эпителиоидных крупноклеточных форм метаплазированного эпителия, формирующих псевдоацинарные структуры.
Заключение. В результате исследования описаны особенности патологии дыхательной системы у сирийских хомяков на экспериментальной модели инфекции SARS-CoV-2. Полученные данные имеют практическое значение как референтные и могут быть использованы при проведении доклинических исследований по оценке эффективности вакцинных препаратов и лекарственных средств.
 442-451
442-451


Анализ особенностей белка Tat вируса иммунодефицита человека 1 типа суб-субтипа А6 (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodefciency virus-1)
Аннотация
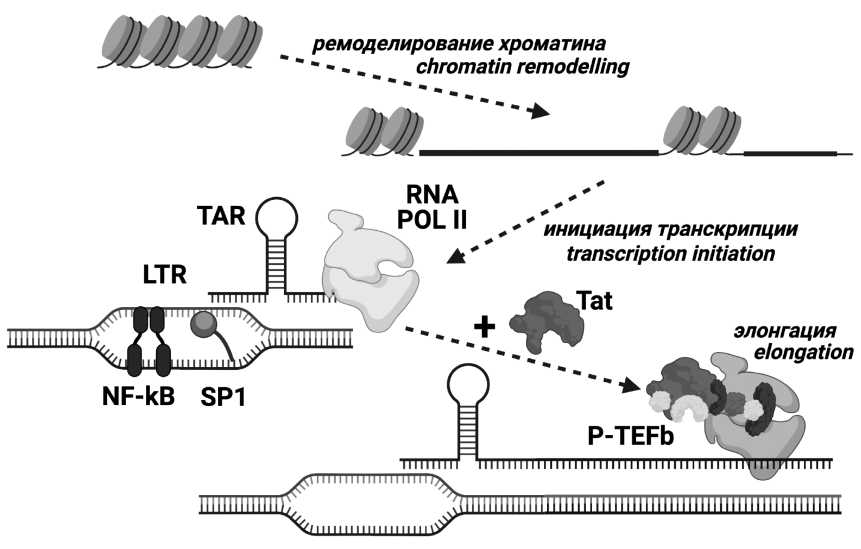
Введение. Белок Tat вируса иммунодефицита человека (ВИЧ) является главным фактором регуляции транскрипции генома ВИЧ и имеет ряд дополнительных внутриклеточных и внеклеточных активностей. Как и другим белкам ВИЧ, Tat свойственна изменчивость, при этом некоторые аминокислотные замены внутри белка Tat, включая субтип-специфичные, способны влиять на его функциональность. В РФ наиболее широко распространён ВИЧ 1 типа (ВИЧ-1) суб-субтипа А6. Исследования полиморфизма структурных областей генома А6 выявили многочисленные характерные особенности этого варианта, однако изучение области генома, кодирующей Tat, у ВИЧ-1 суб-субтипа А6 не проводилось.
Цели и задачи: Основной целью работы был анализ особенностей белка Tat у ВИЧ-1 суб-субтипа А6. Задачами исследования были выявление характеристических замен, сравнение полиморфизма белка Tat суб-субтипа А6 и наиболее близкого к нему суб-субтипа А1, а также определение статистически достоверных различий в функционально значимых доменах Tat суб-субтипа А6 и наиболее изученного субтипа В.
Материал и методы. Материалом для работы послужили нуклеотидные последовательности ВИЧ-1 суб-субтипов А6, А1, А2, А3, А4, субтипа В и референсная нуклеотидная последовательность, полученные из международной базы данных Los Alamos.
Результаты и обсуждение. Мутации Q54H и Q60H являются характеристическими заменами для А6. Продемонстрированы существенные достоверные различия в частоте естественных полиморфизмов белка Tat между суб-субтипами А6 и А1. В функционально значимом CPP-регионе выявлены мутации, достоверно различающиеся по частоте между суб-субтипом А6 и субтипом В ВИЧ-1 – R53K, Q54H, Q54P и R57G.
Заключение. Белок Tat варианта А6 ВИЧ-1 обладает особенностями, позволяющими достоверно отличить его от других генетических вариантов вируса. Выявленные в функционально значимом CPP-регионе мутации потенциально способны изменять активность данного белка. Полученные данные могут составить основу для разработки лекарственных и вакцинных препаратов.
 452-464
452-464


ИНФОРМАЦИЯ
 465-468
465-468