Том 66, № 2 (2021)
- Год: 2021
- Выпуск опубликован: 15.05.2021
- Статей: 8
- URL: https://virusjour.crie.ru/jour/issue/view/49
Весь выпуск
ОБЗОРЫ
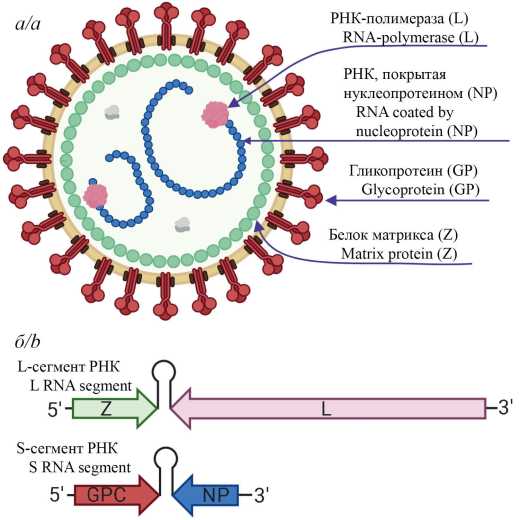
Обзор кандидатных вакцин для профилактики лихорадки Ласса
Аннотация
Вирус Ласса (ВЛ) является одним из основных этиологических факторов этиологическим фактором геморрагических лихорадок в мире: по оценкам ВОЗ им ежегодно поражаются от 100 до 300 тыс. человек, а связанная с ВЛ смертность составляет до 10 тыс. в год [1]. Несмотря на то что распространение вызываемого им заболевания – лихорадки Ласса (ЛЛ) – в основном ограничено западноафриканскими странами (Сьерра-Леоне, Либерия, Гвинея и Нигерия), исторически документированы завозные случаи в Европе, Соединённых Штатах Америки (США), Канаде, Японии и Израиле [2]. В 2017 г. ВОЗ включила ВЛ в список приоритетных патогенов, в отношении которых необходимы проведение ускоренных исследований, создание вакцинных препаратов, а также средств для терапии и диагностики инфекций, возбудителями которых они являются [3]. В данном обзоре рассмотрены основные технологические платформы, используемые при разработке вакцин против ЛЛ.
 91-102
91-102


Изучение чувствительности лабораторных животных к вирусу SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus; Sarbecovirus)
Аннотация
Вследствие пандемии новой коронавирусной инфекции (НКИ) мировое научное сообщество было вынуждено изменить направление большинства исследований, сосредоточив силы на создании вакцины, а также поиске новых противовирусных препаратов для лечения COVID-19. Выбор экспериментальных моделей, временного периода и подходов для оценки разрабатываемых лекарственных средств и вакцин имеет важнейшее значение для выработки эффективных мер по профилактике и борьбе с этим заболеванием. Цель настоящего обзора – обобщение актуальных данных относительно чувствительности лабораторных моделей к новому коронавирусу SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus; Sarbecovirus). Работа содержит описание наиболее восприимчивых к нему видов животных, которые могут быть использованы для воспроизведения НКИ, с изложением основных достоинств и недостатков каждого из них.
Для моделирования инфекционного процесса при COVID-19 обычно выбирают мелких грызунов (Rodentia) и нечеловекообразных приматов (Strepsirrhini). В качестве основных маркёров патологии рассматривают вирусную нагрузку в верхних и нижних отделах дыхательной системы, клинические симптомы (потеря массы тела, температура тела и общее состояние животных), патоморфологическую картину в органах-мишенях, а также выработку антител (АТ) после инфицирования. Несмотря на обширный объём данных, ни одна из описанных моделей заражения SARS-CoV-2 пока не может считаться эталонной, так как не воспроизводит весь спектр морфологических и патогенетических механизмов инфекции, а также не отражает в полной мере клиническую картину, наблюдаемую у пациентов в человеческой популяции.
На основании проведённого анализа литературных данных мы полагаем, что сирийский хомячок (Mesocricetus auratus) и мыши (Muridae), экспрессирующие рецептор ангиотензинпревращающего фермента 2 (АПФ2), являются наиболее чувствительными видами для использования в подобных экспериментах. Выработка нейтрализующих АТ позволяет оценить эффективность вакцинных препаратов, а течение и выраженность симптомов делает использование мышей и хомячков особенно востребованным для скрининга фармакологических веществ с противовирусным действием, введение которых может предотвратить либо замедлить прогрессирование болезни.
 103-111
103-111


Летучие мыши субтропической зоны Краснодарского края России как возможный резервуар зоонозных вирусных инфекций
Аннотация
Новые и возвращающиеся инфекции представляют серьёзную угрозу для мирового здравоохранения. Появление вируса SARS-CoV-2 и вызванная им пандемия COVID-19 продемонстрировали важность изучения и контроля зоонозных вирусных агентов непосредственно в природных очагах. Для SARS-подобных коронавирусов, а также множества других возбудителей зоонозов, включая геморрагические лихорадки и бешенство, основным резервуаром являются подковоносые летучие мыши (ЛМ) (Rhinolophus spp.), широко распространённые в Евразии и Африке. Ареал их захватывает также южные регионы России, включая Северный Кавказ и Крым. Большие колонии этих животных располагаются на территории Сочинского национального парка (СНП; субтропическая зона Краснодарского края, район Большого Сочи, Северный Кавказ). Всего по данным многолетних наблюдений здесь насчитывается до 23 видов ЛМ, включая большого (Rh. ferrumequinum), малого (Rh. hipposideros) и южного (Rh. euryale) подковоносов.
В настоящем обзоре приведены сведения о зоонозных вирусах, которые ассоциированы с видами ЛМ, обитающих на территории субтропической зоны Краснодарского края Российской Федерации, и проведён анализ возможной роли представителей семейства рукокрылых (Chiroptera) как природного резервуара новых и возвращающихся инфекций. Изучение циркуляции зоонозных вирусов в популяциях ЛМ служит важным элементом мониторинга вирусных популяций в естественных очагах.
 112-122
112-122


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Активность человеческого рекомбинантного интерферона альфа-2b in vitro в отношении вируса SARS-CoV-2
Аннотация
Введение. Пандемическое распространение новой коронавирусной инфекции COVID-19 вызвало чрезвычайную ситуацию мирового масштаба и привлекло к себе внимание специалистов здравоохранения и населения всех стран. Значительный рост числа новых случаев инфицирования её возбудителем – вирусом SARS-CoV-2 демонстрирует актуальность поиска лекарственных средств, эффективных в отношении данного патогена. Целью настоящей работы являлась оценка противовирусной активности человеческого рекомбинантного интерферона альфа-2b (ИФН-α2b) в отношении SARS-CoV-2 in vitro.
Материал и методы. Эксперименты выполняли на постоянной культуре клеток почки африканской зелёной мартышки (Chlorocebus sabaeus) Vero Cl008. Эффективность препаратов оценивали по подавлению репродукции вируса in vitro. Биологическую активность определяли по формированию негативных колоний титрованием вируссодержащей суспензии в культуре Vero Cl008.
Результаты. Изучена активность лекарственных препаратов на основе ИФН-α2b с высоким профилем безопасности и доказанной эффективностью при профилактике и лечении гриппа и острых респираторных вирусных инфекций (ОРВИ) относительно нового пандемического вируса SARS-CoV-2 в культуре Vero C1008. ИФН-α2b эффективно подавлял репродукцию инфекционного агента при внесении в культуру как за 24 ч до инфицирования, так и через 2 ч после него. В диапазоне концентраций 102–106 МЕ/мл отмечалось полное подавление репродукции SARS-CoV-2.
Обсуждение. ИФН-α2b продемонстрировал in vitro высокую противовирусную активность в отношении нового коронавируса. Кроме того, вещество обладает высоким химиотерапевтическим индексом (>1000).
Заключение. Лекарственные препараты на основе ИФН-α2b для интраназального применения обладают высокой противовирусной активностью и перспективны для изучения in vivo в плане профилактики и лечения COVID-19.
 123-128
123-128


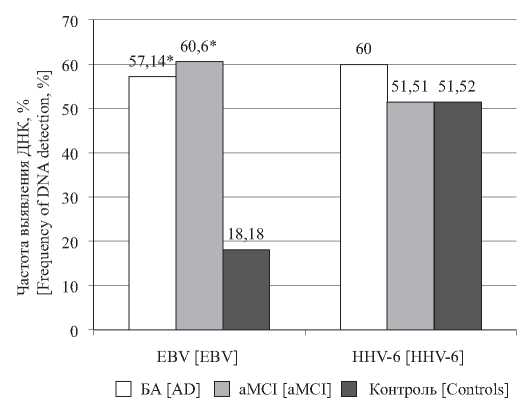
Герпесвирусные инфекции и иммунологические нарушения при различных стадиях когнитивных расстройств альцгеймеровского типа
Аннотация
Введение. Болезнь Альцгеймера (БА) – мультифакториальное заболевание, ведущее к прогрессирующему снижению памяти, зрительно-пространственных функций, эмоциональным и личностным изменениям. В настоящее время в качестве его наиболее раннего додементного клинического этапа рассматривается синдром мягкого когнитивного снижения амнестического типа (amnestic mild cognitive impairment, aMCI). В развитии и прогрессировании aMCI и начальной стадии БА играет роль нейровоспаление, которое может поддерживаться иммунологическими нарушениями системного характера. С учётом этого представляется актуальным исследование факторов (включая инфекционные), влияющих на характер иммунного статуса и выраженность системного воспалительного ответа у страдающих когнитивными расстройствами альцгеймеровского типа на различных стадиях.
Цель данной работы – получение новых данных о возможной роли герпесвирусов в возникновении и прогрессии aMCI и БА.
Материал и методы. Обследованы 100 больных с диагнозом aMCI, 45 пациентов с БА и 40 лиц контрольной группы. Определяли частоту выявления ДНК герпесвирусов (вирус Эпштейна–Барр (EBV), герпесвирусы человека 6 и 7 типов (HHV-6, HHV-7), цитомегаловирус (CMV)), уровни вирусной нагрузки, серологические маркёры герпесвирусных инфекций (ГВИ) (HHV-1- и CMV-инфекции). Иммунологические исследования включали оценку концентрации основных про- и противовоспалительных цитокинов, показателей гуморального и клеточного иммунитета.
Результаты. Установлены повышенная частота обнаружения EBV в слюне и более высокие уровни ДНК EBV в слюне при когнитивных расстройствах альцгеймеровского типа по сравнению с контрольной группой. Выявлено наличие связи между присутствием активной EBV-инфекции и изменениями иммунологических показателей у лиц с aMCI. Обнаружено, что уровень антител (АТ) IgG к CMV связан со стадией когнитивных расстройств у больных.
Обсуждение. Результаты указывают на возможную роль ГВИ, вызываемых EBV и CMV, в развитии иммунологических изменений при мягком когнитивном снижении и прогрессировании когнитивных расстройств альцгеймеровского типа.
Заключение. Полученные данные могут иметь значение для разработки методов прогнозирования течения БА, в том числе на её додементной стадии, и подходов к индивидуализированной терапии и профилактике.
 129-139
129-139


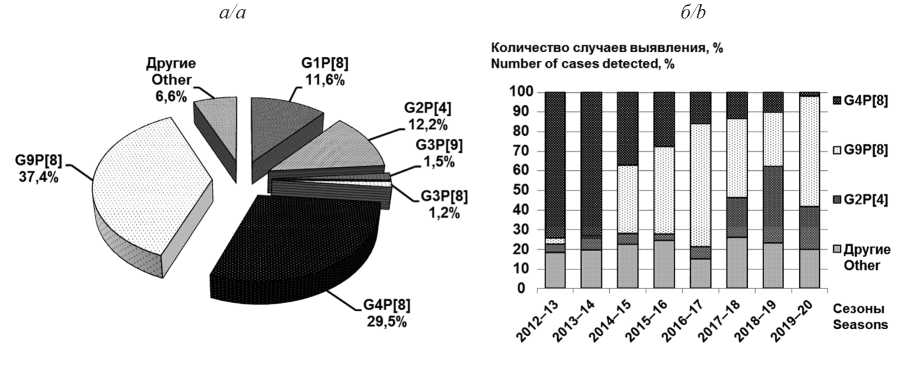
Молекулярный мониторинг ротавирусов (Reoviridae: Sedoreovirinae: Rotavirus: Rotavirus A), циркулирующих в Нижнем Новгороде (2012–2020 гг.): обнаружение штаммов с новыми генетическими характеристиками
Аннотация
Введение. В Российской Федерации зарегистрирована пентавалентная ротавирусная вакцина, однако при отсутствии массовой иммунизации детского населения охват целевой когорты остаётся низким, и ежегодный подъём заболеваемости ротавирусной инфекцией неизбежен. В связи с этим молекулярный мониторинг циркулирующих в нашей стране ротавирусов с целью поиска новых вариантов, обладающих эпидемическим потенциалом, является актуальной задачей.
Материал и методы. Для характеристики ротавирусов, циркулировавших в Нижнем Новгороде в 2012-2020 гг., применяли ПЦР-генотипирование и секвенирование нуклеотидных последовательностей генов VP4 и VP7. Филогенетический анализ выявленных в разных городах России штаммов проводили с использованием байесовского подхода в пакете программ BEAST.
Результаты. Спектр был представлен 17 генотипами с доминированием G9P[8] (37,4%). Выявлены ранее не идентифицированные на территории Нижнего Новгорода генотипы G1P[4], G1P[9], G2P[8], G4P[4], G4P[6], G8P[8] и G9P[4]. Показана циркуляция DS-1-подобных штаммов с генотипами G1P[8], G3P[8], G8P[8], G9P[8] и коротким электрофоретипом РНК. Ротавирусы основных генотипов характеризовались генетической гетерогенностью и принадлежали разным филогенетическим линиям и/или сублиниям (P[4]-IV-а; P[4]-IV-b; P[8]-3.1; P[8]-3.3; P[8]-3.4 и P[8]-3.6; G1-I; G1-II; G2-IVa-1; G2-IVa-3; G3-1; G3-3; G4-I-c; G9-III; G9-VI).
Обсуждение. Представленные результаты дополняют имеющиеся данные о генотиповой структуре популяций ротавирусов в России и характеризуют генетическое разнообразие нижегородских и российских штаммов. DS-1-подобные вирусы генотипа G3P[8] были представителями новой для территории РФ линии G3-1 и имели наибольшее количество аминокислотных замен в области антигенных эпитопов белка VP7.
Заключение. Появление и распространение в нашей стране штаммов с новыми генетическими характеристиками может способствовать преодолению ротавирусами иммунологического прессинга, создаваемого естественным и искусственным иммунитетом, и сохранению либо подъёму уровня заболеваемости ротавирусной инфекцией.
 140-151
140-151


Реактивация инфекции, вызванной вирусом Эпштейна–Барр (Herpesviridae: Lymphocryptovirus, HHV-4), на фоне COVID-19: эпидемиологические особенности
Аннотация
Введение. Иммунодефициты, лежащие в основе развития тяжёлых форм новой коронавирусной инфекции, могут быть следствием сочетанного инфицирования SARS-CoV-2 и другими патогенами, в том числе вирусом Эпштейна–Барр (EBV).
Цель работы – изучение эпидемиологических особенностей активной EBV-инфекции на фоне COVID-19.
Материал и методы. С марта по май 2020 г. в Москве на маркёры EBV-инфекции обследованы пациенты (95 человек), находившиеся в стационаре для лечения COVID-19, и доноры крови (92 человек).
Результаты. При сходных показателях превалентности EBV-инфекции в исследуемых группах частота обнаружения индикаторов её активности у доноров (10,9%) была значительно ниже, чем среди пациентов (80%). Достоверные различия по данному параметру установлены также между подгруппами пациентов с интерстициальной пневмонией на фоне наличия (96,6%) либо отсутствия (97,2%) SARS-CoV-2 в мазке из носоглотки и больных с лёгким течением COVID-19 (43,3%). Средние коэффициенты позитивности IgG к капсидному и ядерному антигенам вируса у доноров были больше, чем в группе пациентов (р < 0,05). У больных с маркёрами активной EBV-инфекции значительно чаще выявлялись пневмония, превышение референсных значений активности аланинаминотрансферазы (АЛТ) и относительного числа моноцитов (отношение шансов – 23,6; 3,5 и 9,7 соответственно).
Обсуждение. Настоящее исследование позволило изучить частоту распространения и проанализировать эпидемиологические особенности активной EBV-инфекции у пациентов с COVID-19.
Заключение. Значимо более высокая частота обнаружения индикаторов активной EBV-инфекции среди пациентов, находившихся на стационарном лечении по поводу COVID-19 (особенно со среднетяжёлым течением), указывает на сочетанное участие в развитии интерстициальной пневмонии SARS-CoV-2 и EBV. Наличие низких концентраций IgG к белкам последнего является предиктором реактивации вызываемого им инфекционного процесса. Превышение референсных значений активности АЛТ и относительного количества моноцитов у пациентов должно служить поводом к обследованию на маркёры EBV-инфекции.
 152-161
152-161


В ПОМОЩЬ ВИРУСОЛОГУ
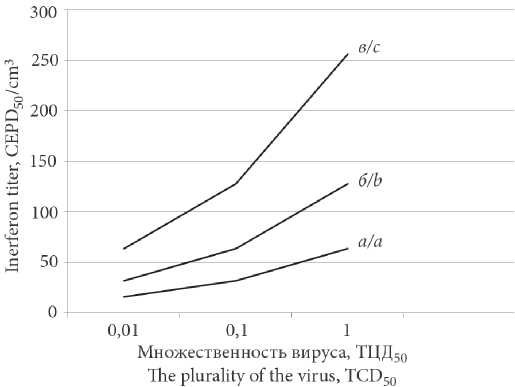
Интерфероногенная активность штамма ВН-3 вируса гепатита уток I типа (Picornaviridae: Avihepatovirus: Avihepatovirus A)
Аннотация
Введение. Вирусный гепатит утят типа I (ВГУ-I) – малоизученное контагиозное заболевание, возбудителем которого является РНК-содержащий вирус гепатита уток (Anatinae) I типа (Picornaviridae: Avihepatovirus: Avihepatovirus A). Болезнь широко распространена во многих странах, включая Россию, и наносит значительный ущерб промышленному утководству. В решении проблемы разработки эффективных средств для борьбы с этой инфекцией среди прочего большое значение имеет изучение интерфероногенной активности штаммов её возбудителя.
Материал и методы. В исследованиях использован штамм ВН-3 вируса гепатита уток I типа, выделенный из печени больных утят. Он адаптирован к развивающимся 10–12-суточным утиным эмбрионам, культурам куриных и утиных фибробластов. Данный штамм депонирован в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «Национальный центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Минздрава России (ФНИЦЭМ). Эксперименты проводились с применением стандартного метода тканевых культур.
Результаты и обсуждение. Представлены данные относительно способности вакцинного штамма ВН-3 к индукции интерферона (ИФН) и его чувствительности к действию экзогенного ИФН в культуре утиных фибробластов. Показано, что интерфероногенная активность штамма находится в прямой зависимости от множественности заражения. Максимальный показатель индукции (1 : 256 ЦЭПД50) отмечен при внесении вируса в дозе 1,0 ТЦД50/кл через 72–96 ч после инокуляции культуры клеток. Экзогенный ИФН в титре 1 : 128 полностью подавлял цитопатический эффект возбудителя и предотвращал гибель утиных эмбрионов при инфицировании дозой, равной 100 ТЦД50/кл.
Заключение. Полученные результаты позволяют утверждать, что вакцинный штамм ВН-3 вируса гепатита уток I типа обладает выраженной интерфероногенной активностью и чувствительностью к действию экзогенного ИФН. Это может иметь значение для работ по созданию эффективных терапевтических препаратов против ВГУ-I.
 162-166
162-166