Том 65, № 2 (2020)
- Год: 2020
- Выпуск опубликован: 16.05.2020
- Статей: 9
- URL: https://virusjour.crie.ru/jour/issue/view/33
- DOI: https://doi.org/10.36233/0507-4088-2020-65-2
Весь выпуск
ОБЗОРЫ
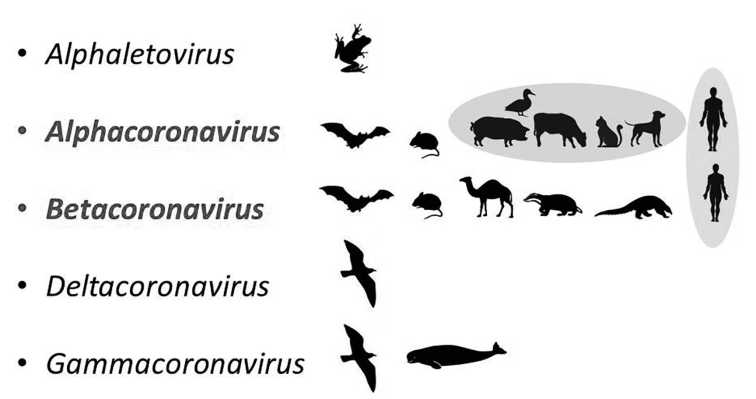
Истоки пандемии COVID-19: экология и генетика коронавирусов (Betacoronavirus: Coronaviridae) SARS-CoV, SARS-CoV-2 (подрод Sarbecovirus), MERS-CoV (подрод Merbecovirus)
Аннотация
С начала 2000-х годов зарегистрировано три независимых случая появления новых зооантропонозных коронавирусов (Betacoronavirus) человека, обладающих эпидемическим и пандемическим потенциалом. Первая вспышка инфекции (ТОРС, SARS), вызванная вирусом SARS-CoV, возникла осенью 2002 г. в КНР (провинция Гуандун). Вторая вспышка (БВРС, MERS), связанная с новым вирусом MERS-CoV, появилась осенью 2012 г. в Саудовской Аравии. Третья эпидемия, переросшая в пандемию COVID-19, вызванная вирусом SARS-CoV-2, возникла осенью 2019 г. в КНР (провинция Хубэй). В настоящем обзоре рассмотрены экологические и генетические аспекты, обусловившие появление новых зооантропонозных коронавирусов человека. Основным механизмом адаптации зоонозных бетакоронавирусов к человеку является изменение структуры рецептор-связывающего домена поверхностного белка S, в результате чего он приобретает способность связывать клеточные рецепторы эпителиальных клеток респираторного и пищеварительного трактов человека. Этот процесс определяется высокой генетической изменчивостью коронавирусов и их способностью к рекомбинации в процессе межпопуляционных взаимоотношений вирусов и их природных резервуаров - летучих мышей (Microchiroptera, Chiroptera). Появление вирусов SARS-CoV, SARS-CoV-2 (подрод Sarbecovirus) и MERS-CoV (подрод Merbecovirus) связано с эволюцией этих и других вирусов, протекающей в популяциях летучих мышей, с их дальнейшей передачей человеку напрямую или через промежуточных позвоночных хозяев, экологически связанных с летучими мышами.
Статья подготовлена по материалам доклада на заседании Научного совета РАН «Науки о жизни» «Коронавирус - глобальный вызов науке»: Львов Д.К., Альховский С.В., Бурцева Е.И. Истоки пандемии COVID-19: происхождение, биология и генетика коронавирусов SARS-CoV, SARS-CoV-2, MERS-CoV (16 апреля 2020 г., зал заседаний Президиума РАН, Москва Ленинский проспект, д. 14).
 62-70
62-70


Современное состояние проблемы прионных болезней и причины их опасности для человека и животных
Аннотация
 71-76
71-76


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Древние варианты вируса Эпштейна–Барр (Herpesviridae, Lymphocryptovirus, HHV-4): гипотезы и факты
Аннотация
Введение. Молекулярные исследования показали, что вирусы появились на ранних этапах эволюции жизни на земле. В течение миллионов лет они развивались за счёт изменения старых и приобретения новых последовательностей в РНК или ДНК. Предполагается, что у большинства вирусов есть общие предки. Такой предок, древний штамм, вероятно, существовал и у вируса Эпштейна-Барр (ВЭБ).
Цель исследования - поиск персистирующих в наши дни в исторически сложившихся этносах России древних штаммов ВЭБ.
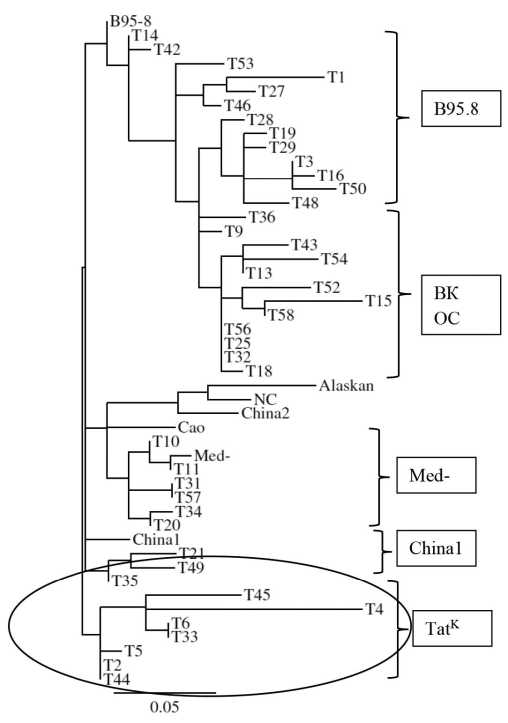
Материал и методы. Объектом исследования стал онкоген LMP1 ВЭБ как наиболее пригодный для молекулярно-генетического анализа. LMP1 амплифицировали из смывов полости рта представителей двух древних этносов России - татар и славян в третьем поколении. Ампликоны LMP1 секвенировали в обоих направлениях, их нуклеотидные последовательности, транслированные в аминокислотные, оценивали с помощью классификации R. Edwards и соавт. (1999). Для установления генетического родства между образцами LMP1 построили филогенетическое древо методом «присоединения соседа» (neighbour-joining) с использованием пакета программ MEGA.
Результаты и обсуждение. Анализ образцов LMP1 из смывов полости рта славян выявил среди них варианты LMP1 с разной степенью трансформирующего потенциала: B95.8/A, China1, Med- и NC. Анализ образцов LMP1 из смывов полости рта татар позволил идентифицировать такие варианты онкобелка, как B95.8/А, China1, Med-, а также группу образцов вне классификации. Важной находкой стало обнаружение у татар 7 образцов LMP1, обозначенных как LMP1-TatK, содержавших две уникальные делеции 5 а.к. в кодонах 312-316 и 382-386, отсутствующие в образцах LMP1 славян и в контрольных группах - онкологических больных и здоровых лиц, а также в открытых компьютерных базах данных. Уникальность варианта LMP1-TatK подтверждается и при филогенетическом анализе образцов LMP1 татарского происхождения, и при анализе 11 а.к. повторов и 5 а.к. вставок в С-терминальной области онкобелка. Показатели заболеваемости и смертности от новообразований, включающих ВЭБ-ассоциированные патологии, у двух изучаемых этносов, инфицированных разными штаммами ВЭБ, практически не различались.
Заключение. Полученные данные позволили предположить, что, во-первых, LMP1-TatK относится к эволюционно древнему штамму ВЭБ, персистирующему у татар, а во-вторых, LMP1-TatK относится к так называемому Волжскому штамму вируса, распространённому среди населения Поволжья. Исследование изолятов ВЭБ от жителей этого региона, возможно, прольёт свет на происхождение LMP1-TatK.
 77-86
77-86


Интерферон-регулирующая активность препарата ЦелАгрип и его влияние на образование активных форм кислорода и экспрессию генов врождённого иммунитета в перевиваемых культурах клеток лимфомы Бёркитта
Аннотация
Введение. Интерфероны (IFN) и их индукторы эффективны в подавлении вирусной репродукции и коррекции механизмов врождённого иммунитета.
Цель исследования - проверить гипотезу возможного участия индуктора IFN ЦелАгрип (ЦА) в качестве активатора или супрессора противовирусного ответа в культурах клеток лимфомы Бёркитта (ЛБ), различающихся по способности продуцировать антигены вируса Эпштейна-Барр (ВЭБ).
Материал и методы. Использовали линии человеческих клеток ЛБ Р3НR-1 и Namalva, спонтанно продуцирующие и не продуцирующие антигены ВЭБ. Выполнен кинетический анализ динамики продукции активных форм кислорода (АФК) и определена экспрессия группы генов методом ПЦР в реальном времени в ответ на обработку ЦА.
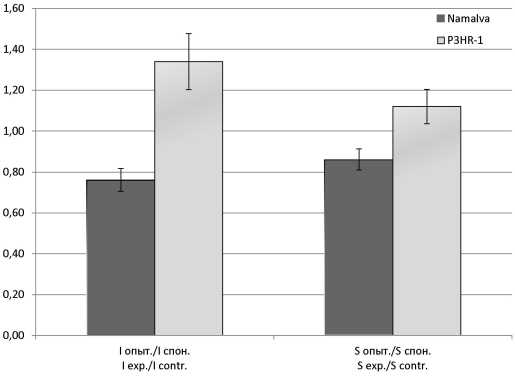
Результаты и обсуждение. При обработке ЦА в клетках Namalva обнаружено снижение индекса активации АФК, в клетках Р3НR-1 наблюдали его повышение. В клетках Namalva после обработки ЦА отсутствовала достоверная активация генов IFN-α, -β и -λ, но возрастала кратность экспрессии гена ISG15 более чем в 1200 раз и гена P53 (TP53) - в 4,5 раза. При обработке ЦА клеток Р3НR-1 экспрессия генов IFN-α возрастала более чем в 200 раз, IFN-λ - в 100 раз и гена ISG15 - в 2,2 раза. Предполагается взаимосвязь IFN-индуцирующего действия ЦА с активностью ISG15 и АФК в перевиваемых культурах клеток ЛБ, продуцирующих и не продуцирующих антигены ВЭБ.
Заключение. В клетках Namalva, не продуцирующих антигены ВЭБ, при обработке ЦА подавляется генерация АФК и активизируется экспрессия генов ISG15 и P53 (TP53); в клетках P3HR-1, продуцирующих антигены ВЭБ, наблюдается обратная картина: активизируются образование АФК и экспрессия генов IFN-α и -λ и супрессируется активность генов ISG15 и P53 (TP53).
 87-94
87-94


Выявление пестивирусов крупного рогатого скота при помощи мультиплексной полимеразной цепной реакции в режиме реального времени
Аннотация
Введение. Пестивирусы - причина репродуктивных проблем, болезней желудочно-кишечного и респираторного тракта животных. Для крупного рогатого скота значение имеют три вида: Pestivirus A, B и H. В настоящее время необходимы быстрые и надёжные методы дискриминации данных патогенов.
Цели и задачи исследования: разработка мультиплексной полимеразной цепной реакции (ПЦР) для одновременного выявления и дифференциации трёх вирусов в режиме реального времени (РТ-ПЦР).
Материал и методы. Мишенью для амплификации служили нуклеотидные последовательности консервативных участков генов 5´-UTR пестивирусов A, B и H.
Результаты. Реакция показала высокую специфичность, чувствительность, воспроизводимость и выявляла РНК вирусов в концентрации не менее 0,6-1,2 lg ТЦД50/см3. Перекрёстных реакций с другими пестивирусами не наблюдали. РТ-ПЦР подтвердила результаты, полученные ранее в ОТ-ПЦР в режиме гель-электрофореза. При параллельном исследовании 1823 проб биоматериала результаты двух реакций полностью совпали. Pestivirus spр. выявлены в 76 пробах: Pestivirus A присутствовал в 73 пробах, B - в трёх, а H не обнаружен.
Обсуждение. Разработана двухшаговая РТ-ПЦР для одновременного выявления и типирования трёх пестивирусов. Для первой реакции использовали модифицированные панпраймеры S. Vilcek и соавт., а для типирования - праймеры и зонды собственного дизайна, что обеспечило высокую эффективность реакции.
Заключение. На молочных комплексах по содержанию скота создаются условия для циркуляции патогенных вирусов. В такой ситуации необходимы методы экспресс-диагностики, позволяющие в короткие сроки выявить несколько вирусов. Триплексный анализ в режиме реального времени может быть рекомендован в качестве экспресс-метода при массовых эпизоотологических исследованиях, а также для скрининга эмбрио-нальной сыворотки, используемой для культивирования вирусов в медицине и ветеринарии.
 95-102
95-102


In silico идентификация B- и T-клеточных эпитопов белка CD2v вируса африканской чумы свиней (African swine fever virus, Asfivirus, Asfarviridae)
Аннотация
Ведение. Вирус африканской чумы свиней (АЧС) - крупный ДНК-вирус, единственный представитель семейства Asfarviridae. Распространение вируса АЧС на территории РФ, стран Восточной Европы и Китая свидетельствует о неэффективности существующих способов борьбы с заболеванием и стимулирует исследования, направленные на создание вакцин. Одним из значимых антигенов, необходимых для формирования иммунной защиты против АЧС, является серотипспецифический вирусный белок CD2v.
Цель работы - идентификация B- и T-клеточных эпитопов в белке CD2v вируса АЧС с использованием методов in silico прогнозирования.
Материал и методы. Первичную последовательность белка CD2v вируса АЧС штамма Georgia 2007/1 анализировали с помощью программ BCPred, DiscoTop, NetCTLpan, VaxiJen, PVS и Epitope Conservancy Analysis.
Результаты. На основании проведённого комплексного многопараметрического анализа определены четыре B-клеточных иммуногенных эпитопa в секреторной области белка. Анализ секреторной области белка CD2v вируса АЧС в программе NetCTLpan позволил выявить пять T-клеточных эпитопов с 32-й по 197-ю позицию аминокислот, имеющих перекрёстное связывание с 1-й по 13-ю аллель главного комплекса гистосовместимости I класса свиньи.
Обсуждение. В данном исследовании представлены результаты использования методов прогнозирования in silico для выявления B- и Т-клеточных эпитопов белка CD2v вируса АЧС. Результаты анализа свидетельствуют о кластерном распределении эпитопов в белке CD2v. Наибольший интерес для дальнейшего использования в качестве компонента рекомбинантной полиэпитопной вакцины против АЧС представляет растворимая область белка CD2v с 17-й по 204-ю аминокислоту, содержащая В- и Т-клеточные эпитопы.
Заключение. Идентифицированы B- и T-клеточные эпитопы в секреторной области белка CD2v (с 17-й по 204-ю позицию аминокислот) вируса АЧС с помощью in silico программ. Анализ консервативности B- и T-клеточных эпитопов позволил сформировать карту распределения иммунных эпитопов в последовательности белка CD2v.
 103-112
103-112


В ПОМОЩЬ ВИРУСОЛОГУ
Метод оценки нейраминидазной активности препаратов RDE с помощью вируса гриппа
Аннотация
Введение. Для определения уровня противовирусных антител в сыворотках крови людей и животных используют классическую реакцию торможения гемагглютинации (РТГА). При постановке РТГА требуется обработка исследуемых сывороток рецептор-разрушающим ферментом (RDE) для удаления сывороточных гликанов, нарушающих точность реакции РТГА. При использовании препаратов RDE для оптимизации их количества в РТГА необходимо знать их реальную нейраминидазную активность. В настоящей статье разработан простой и экономичный метод тестирования нейраминидазной активности рецептор-разрушающих препаратов с использованием стандартного лабораторного реагентного оснащения и оборудования.
Цель - разработать усовершенствованный простой и удобный метод для оценки активности нейраминидазы с помощью вируса гриппа.
Материал и методы. В основе метода лежит способность нейраминидазы гидролизовать остатки сиаловой кислоты на клеточной поверхности эритроцитов, что лишает эритроциты способности к агглютинации вирусом гриппа, так как именно к этим остаткам прикрепляется вирус, вызывая их агглютинацию.
Результаты и обсуждение. Разработан простой и удобный метод для оценки активности нейраминидазы способом двукратных разведений с эритроцитами человека или животных и последующей инкубацией с вирусом гриппа А для тестирования гемагглютинации.
Заключение. Метод позволяет точно оценить рецептор-разрушающую (нейраминидазную) активность препаратов RDE и сравнить их между собой, что необходимо для оптимизации постановки РТГА при мониторинге сывороток крови животных и людей, больных или переболевших острой респираторной вирусной инфекцией, в том числе гриппом. Разработанный метод может быть включён в регламент методических указаний для постановки РТГА при мониторинге гриппа и других острых респираторных вирусных инфекций в различных лабораториях.
 113-118
113-118


РЕЦЕНЗИИ
Ф.И. Ершов. История вирусологии от Д.И. Ивановского до наших дней. – М.: ГЭОТАР-Медиа; 2020.
Аннотация
 119-119
119-119


НЕКРОЛОГИ
 120-120
120-120