In situ гели как современный способ интраназальной доставки вакцин
- Авторы: Бахрушина Е.О.1, Михел И.Б.1, Кондратьева В.М.2, Демина Н.Б.1, Гребенникова Т.В.2
-
Учреждения:
- ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России (Сеченовский Университет)
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- Выпуск: Том 67, № 5 (2022)
- Страницы: 395-402
- Раздел: ОБЗОРЫ
- URL: https://virusjour.crie.ru/jour/article/view/645
- DOI: https://doi.org/10.36233/0507-4088-139
- ID: 645
Цитировать
Аннотация
Непрерывное появление новых патогенов и эволюция устойчивости микроорганизмов к препаратам делают абсолютно необходимой разработку инновационных эффективных стратегий вакцинации. Использование назальной вакцинации может повысить удобство и безопасность, вызвать как местные, так и системные иммунные реакции. Интраназальное введение тем не менее обладает рядом проблем, решение которых возможно с использованием последних достижений фармацевтической науки. Одним из аспектов может быть использование для производства интраназальных вакцин in situ систем – полимерных композиций, обеспечивающих направленный, контролируемый физиологическими условиями носовой полости переход «золь – гель». При этом гелеобразование вводимой дозы при соприкосновении со слизистой носовой полости предполагает длительную экспозицию лекарства на месте введения, большую мукоадгезию, противодействие мукоцилиарному клиренсу, модифицированное и более полное высвобождение. Такие полимеры, как хитозан, камеди, блок-сополимеры полиоксиэтилен и полиоксипропилен (полоксамеры, проксанолы), карбомеры, выпускаются рядом как иностранных, так и отечественных производителей. Для эффективного проведения фармацевтической разработки новых интраназальных систем доставки ИБП, соответствующих концепции QbD, необходимы не только знания ассортимента вспомогательных веществ, но и простые, доступные, воспроизводимые методики определения показателей критических параметров подобных систем доставки. В соответствии с проведённым научным поиском были выделены основные показатели стандартизации in situ интраназальных систем: температура и время гелеобразования, прочность геля, реологические характеристики, мукоадгезия, высвобождение, время назального мукоцилиарного клиренса.
Ключевые слова
Полный текст
Введение
Наиболее эффективными методами профилактики и лечения инфекционных заболеваний являются вакцинация и введение иммунобиологических препаратов (ИБП). Примечательно, что вакцины, вводимые интраназально, могут индуцировать иммунитет слизистой оболочки, ткани которой содержат как антигенпрезентирующие, так и антигенпроцессинговые клетки, способные инициировать клеточно-опосредованные иммунные реакции, включая иммунологическую память. Назальные вакцины также могут вызывать системный иммунитет через общий иммунитет слизистой системы [1].
Первое упоминание об интраназальной вакцинации в базе данных медицинских публикаций PubMed содержится в статье 1954 г. советского учёного Х.М. Розенберга [2]. Первым ИБП, использованным для интраназального введения у живых организмов, является туберкулёзная вакцина БЦЖ [3].
Недавно разработанным многообещающим подходом к созданию вакцин является использование VLP (virus-like particles – вирусоподобные частицы), которые состоят из специфических вирусных белков и спонтанно собираются в конфигурации, имитирующие конформационную структуру вирусов, но без вирусных генов. Интраназальная вакцинация VLP от гриппа индуцирует более высокие уровни перекрёстно-реактивных антител IgA и IgG, чем парентеральная. В результате проведённых доклинических исследований было отмечено увеличение как гуморального, так и клеточного иммунного ответа.
На сегодняшний день имеются зарегистрированные или находящиеся в фазе клинических испытаний интраназальные вакцины как в России («Гам-КОВИД-Вак», «VLP-корона»), так и в США (AdCOVID, MV-014-212) и странах Европейского союза (COVI-VAC, ChAdOx1-S). Вакцины, разработанные для внутримышечного введения, предназначены для выработки гуморальных и клеточно-опосредованных иммунных реакций. Однако обеспечивается слабая защита от репликации и распространения вируса в верхних дыхательных путях из-за отсутствия местного иммунного ответа антитела IgA (sIgA). В данный момент разрабатывается ряд новых назальных вакцин против COVID-19, результаты доклинических и клинических исследований выявили высокую выработку нейтрализующих антител и реакцию слизистых оболочек на IgA и Т-клеточные реакции.
Интраназальная доставка вакцин предлагает много преимуществ, по сравнению с традиционными инъекционными путями введения: отсутствие инвазии, высокую васкуляризацию носовой полости, возможность достижения лекарственным препаратом спинномозговой жидкости, минуя гематоэнцефалический барьер. Главным минусом интраназального пути введения является мукоцилиарный клиренс, нацеленный на быстрое удаление посторонних веществ из носовой полости [4]. Другая физиологическая особенность слизистой оболочки носовой полости – активный клиренс, заключающийся не только в активном колебании ресничек, удаляющих инородные объекты и лекарственные препараты с поверхности слизистой оболочки, но также в наличии большого количества ферментов и специфического интерферона, который, в свою очередь, защищает организм от патогенов, прибавляет сложностей в интраназальной вакцинации [5]. Однако эти моменты возможно скорректировать, подобрав правильный состав вспомогательных веществ, который улучшит адгезию препарата на слизистой оболочке и обеспечит его полное проникновение в системный кровоток [6]. Одним из решений проблем интраназального введения ИБП является использование in situ систем доставки.
In situ системы на основе smart-полимеров представляют собой современные системы направленной доставки, изменяющие своё фазовое состояние в ответ на специфические стимулы в предполагаемом месте всасывания (значение рН, наличие специфических ионов, влаги и др.).
Таким образом, цель настоящего исследования можно определить как обзор особенностей и основных аспектов фармацевтической разработки in situ систем для интраназальной доставки ИБП.
In situ матрицы для интраназальной доставки вакцин
Для получения in situ систем используется многообразие полимеров с различными механизмами гелеобразования и стимулами фазового перехода. Эти полимеры подразделяются на природные (хитозан, пектин, камеди) и синтетические (полоксамеры, карбополы, поливиниловый спирт и др.).
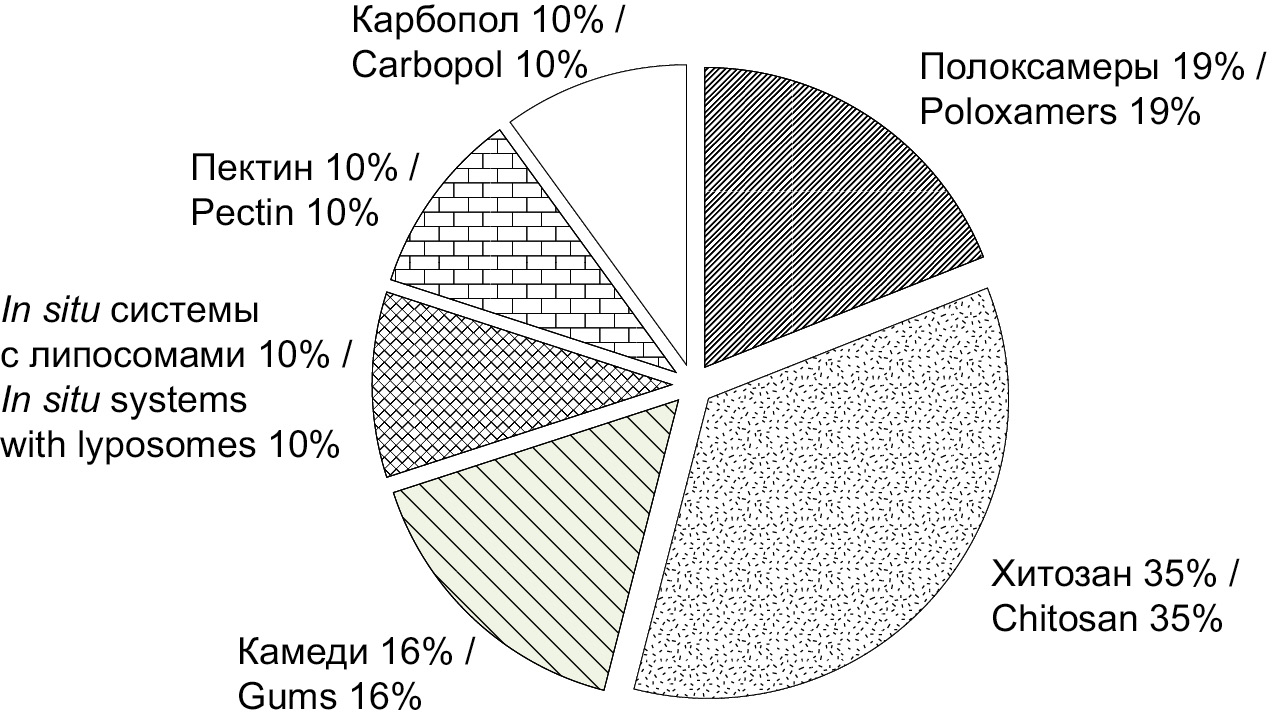
При анализе базы данных медицинских публикаций PubMed по ключевым словам intranasal in situ vaccine, intranasal in situ peptide, intranasal in situ protein за период 2000–2022 гг. была определена частота использования различных полимеров в технологии изготовления in situ систем-носителей ИБП (рисунок). Наибольшей популярностью характеризуются натуральные полимеры – хитозан (35%) и различные камеди (16%), а также синтетические полоксамеры (19%). Рассмотрим основные характеристики полимеров подробнее.
Рисунок. Соотношение использования полимеров на основе анализа базы данных медицинских публикаций PubMed.
Хитозан – это природный биополисахарид катионной природы. Мукоадгезивность хитозана можно объяснить электростатическим взаимодействием между его положительно заряженной молекулой катионной природы и отрицательно заряженным муцином [7–20].
Полианионы и поликатионы (такие, как хитозан) способны к многоточечному кооперативному взаимодействию с иммунокомпетентными клетками и могут рассматриваться как потенциальные иммуномодуляторы [21].
Полоксамеры представляют собой неионные триблок-сополимеры [9, 10, 15–17, 22, 23]. В фармацевтической технологии ИБП наиболее широко используемыми являются полоксамеры 188, 407, 124.
В исследованиях для водного раствора полоксамера 407 показан in situ фазовый переход – при повышении температуры из золя в гель из-за уменьшения межмолекулярных взаимодействий [24].
Полоксамер 188 – это безопасный биосовместимый полимер, который может быть использован в системе доставки белковых лекарств [25]. В последнее десятилетие стали активно изучать фармакологическую активность полоксамера 188, и было доказано, что он может использоваться в лечении серповидноклеточной анемии [26]. Также стоит упомянуть гемореологические, антитромботические, противовоспалительные свойства полоксамера 188, которые сейчас очень активно исследуются [27].
Из перечисленных ранее триблок-сополимеров полоксамер 124 может использоваться как солюбилизатор, пластификатор и эмульгатор, однако его фармакокинетические свойства in vivo всё ещё неясны [28, 29].
Как уже отмечалось, основным термочувствительным компонентом является полоксамер 407. Кроме того, введение в состав комплекса с полоксамером 407 других эксципиентов способно регулировать температуру фазового перехода, а также повысить стабильность композиции, улучшить биофармацевтические свойства [30].
На сегодняшний день российской промышленностью выпускается аналог полоксамера 188, однако промышленно производимой альтернативы термочувствительному полоксамеру 407 по-прежнему нет [31, 32].
Для получения in situ систем также изучено использование трёх видов камедей: геллановой, ксантановой и гуаровой [33–37]. Камеди в составе in situ систем реализуют ионселективный фазовый переход [38].
Геллановая камедь – внеклеточный анионный водорастворимый полисахарид, продуцируемый бактериями Sphingomonas elodea [39].
Гуаровая камедь представляет собой галактоманнановый полисахарид, извлечённый из гуаровых бобов.
Ксантановая камедь – природный полисахарид, образующийся в результате ферментации грамотрицательной бактерии Xanthomonas campestris.
Пектин – это анионный биополимер, широко используемый в пищевой промышленности [40–42]. В свободной форме пектин проявляет антиканцерогенные свойства при раке толстой кишки [43]. Основное мировое производство и рынок как пищевого, так и фармацевтического пектина сосредоточены в Европе, Южной Америке, Китае и Иране. На данный момент в России не налажено собственное производство пектина [44].
Карбомеры представляют собой высокомолекулярные сшитые полимеры полиакриловой кислоты [23, 45]. В медицинской практике водные растворы карбомеров используются вагинально в качестве спермицида, который также защищает от ВИЧ-инфекции и, возможно, других заболеваний, передающихся половым путём [46].
Разработка интраназальных in situ систем доставки иммунобиологических препаратов
При применении обычных назальных гелей часто возникает проблема точности дозирования препарата, у пациентов имеются жалобы на ощущение присутствия инородного тела в носу. Для решения возникающих проблем учёные из Китайского университета Гонконга разработали термореверсивный in situ гель для интраназальной доставки ингибитора репликации ВИЧ-1 (DB213) на основе комбинации полоксамеров 407, 188 и хитозана [16].
Одним из первых исследований в области интраназальной in situ доставки ИБП с in vivo испытанием препарата является работа индийских учёных T. Shailja и соавт. по разработке липосомальной in situ гелеобразующей системы доставки вакцины против гепатита В [47]. Для достижения поставленной цели был изготовлен липосомальный состав из яичного лецитина и холестерола, а in situ полимером служила полиакриловая кислота. По результатам in vitro оценки высвобождение препарата достигало 54%, но при исследовании in vivo были обнаружены отличные мукоадгезивные свойства.
В 2020 г. J.G. Bedford и соавт. разработали противогриппозную in situ вакцину, где в качестве полимеров для обеспечения её in situ свойств были выбраны хитозан и полоксамеры 188 и 407 [10]. Улучшенная мукоадгезия, достигаемая, по мнению авторов, за счёт хитозана, была доказана как в in vitro, так и в in vivo испытаниях.
Исследователи из США разработали порошковую норовирусную вакцину GelVac® [40, 41]. Инактивированная вакцина против гриппа H5N1 на основе назального порошка GelVac® была одобрена FDA (U.S. Food and Drug Administration – Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) для тестирования на людях. Испытания на морских свинках показали высокую и более долговременную иммунизацию по сравнению с введением не in situ вакцин. Появление иммунного ответа было обусловлено повышением уровня IgA в крови, подклассы IgG1 и IgG2 определяли методом иммуноферментного анализа с использованием объединённых образцов сыворотки из каждой группы.
В ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика имени Н.Ф. Гамалеи» Минздрава России был протестирован адъювант для интраназального введения вакцины на основе VLP для профилактики COVID-19. Данный адъювант состоял из геля, полученного посредством смеси геллановой камеди 0,5 и 2% полоксамера 124, растворённого в дистиллированной воде с добавлением 15% PBS (phosphate buffered saline – фоcфатно-cолевой буфеp). По результатам предварительных экспериментов данный гель показал высокое удерживание в носовой полости – до 83%. В группе мышей линии hACE2 AC70, иммунизированных интраназально вакциной на основе VLP, содержащей 80 мкг антигена в дозе и данный адъювант в соотношении 3 : 2, показана активация Т-клеточного иммунного ответа, что выражалось в статистически значимом увеличении индекса специфической пролиферации (3,3 ± 0,28) в реакции бласттрансформации лимфоцитов, коррелирующим с формированием интерферона-γ секретирующих клеток. После инфицирования животных вирусом SARS-CoV-2, получивших трёхкратную дозу вакцины интраназально, половина животных выжила, при этом в контрольной группе животных, не получивших вакцину, все животные погибли. При этом была показана безопасность данного геля. Так, иммунизация вакциной на основе VLP с гелевым адъювантом не влияла на индивидуальную массу тела и прирост массы тела в течение 42 дней эксперимента в ходе трёхкратной иммунизации интраназально. В группе иммунизированных животных отмечено потребление корма и воды выше, чем в контрольной группе.
При плановой аутопсии мышей линии hACE2 AC70 на 7-й день после второй и третьей иммунизации в ходе визуального осмотра внешнего состояния тела, внутренних органов и тканей, полости черепа, грудной, брюшной и тазовой полостей, каркаса и скелетно-мышечной системы макроскопических изменений, связанных с действием вакцины с адъювантом, не выявлено.
Безусловно, необходимо совершенствовать состав гелей для интраназальных вакцин, чтобы оптимизировать формуляцию и усилить протективное действие вакцин.
Дизайн фармацевтической разработки in situ интраназальных иммунобиологических препаратов
Основным достижением современных R&D (Research and Development) процессов в фармацевтической технологии и биотехнологии являются оптимизация и стандартизация проведения фармацевтической разработки [48, 49]. Одним из наиболее широко используемых методов является построение пространства проектных параметров (design space). Подобные методы активно используются для разработки твёрдых лекарственных форм (функция желательности Харрингтона, SeDeM expert system) [50, 51] и документально зафиксированы в ICH Q8.
Таким образом, при использовании всех современных возможностей для ускорения R&D процессов перед исследователями остаются две основные задачи: обоснованного выбора пула вспомогательных веществ для проведения разработки и основных критических параметров для конкретной разрабатываемой системы, а также воспроизводимых доступных методик, обеспечивающих достоверность получаемых результатов.
Выбор эксципиентов для создания новых интраназальных in situ систем доставки ИБП может базироваться на научном и патентном поиске (рисунок). Проверка эффективности и выживаемости иммунобиологических субстанций является обязательным этапом фармацевтической разработки ИБП [52].
Выбор критических параметров для in situ интраназальных систем доставки: температура и время гелеобразования, реологические параметры, высвобождение in vitro, мукоадгезия in vitro / ex vivo, противодействие мукоцилиарному клиренсу in vivo [6].
Температуру гелеобразования большинство исследователей определяют по методике J.C. Gilbert и соавт., описанной в статье 1987 г. [53].
По схожим методикам также определяют время гелеобразования и прочность геля, определяющие способность состава нивелировать мукоцилиарный клиренс [10, 11, 16–18, 22, 23, 54].
Для оценки высвобождения ИБП из лекарственных форм часто используют тестер с вертикальной диффузионной ячейкой Франца [4, 8, 9, 24, 34].
Для in vitro оценки прочности мукоадгезии полимерных составов после in situ гелеобразования в носовой полости канадские ученые из Университета Макмастер предложили рассчитывать силу мукоадгезии путём построения градуировочного графика, зависимость силы натяжения от конечного положения пластин с 2% раствором муцина и исследуемым составом полимеров [13].
Для более таргетного скрининга некоторые авторы изучают время назального мукоцилиарного клиренса по методике, предложенной N.M. Zaki и соавт. в 2007 г. [55].
Заключение
Использование in situ систем доставки для интраназального введения вакцин позволяет достигать как местного, так и системного действия ИБП без нарушения кожных покровов. Накоплен значительный опыт как в R&D процессах, так и в доклинических и клинических исследованиях подобных систем введения белковых и других частиц. Научный поиск показал, что термореверсивные составы полимеров являются наиболее распространёнными для интраназальной in situ доставки ИБП, а ионселективные полимеры могут быть отличной альтернативой для дальнейшего изучения и разработки новых in situ систем интраназальной доставки.
Участие авторов: Бахрушина Е.О., Гребенникова Т.В. – разработка концепции обзора, написание статьи; Михел И.Б., Кондратьева В.М. – подбор источников литературы, анализ данных; Демина Н.Б., Гребенникова Т.В. – рецензирование, одобрение статьи для публикации.
Финансирование. Исследование выполнено за счёт государственного бюджета.
Конфликт интересов. Авторы заявляют об отсутствии потенциальных конфликтов интересов.
Об авторах
Елена Олеговна Бахрушина
ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России (Сеченовский Университет)
Автор, ответственный за переписку.
Email: bakhrushina_e_o@staff.sechenov.ru
ORCID iD: 0000-0001-8695-0346
кандидат фармацевтических наук, доцент, доцент кафедры фармацевтической технологии
Россия, 119991, г. МоскваИосиф Бениаминович Михел
ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: mikheliosif@gmail.com
ORCID iD: 0000-0002-2866-0049
студент 5 курса ОД Института фармации им. А.П. Нелюбина
Россия, 119991, г. МоскваВалерия Михайловна Кондратьева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: 1999valeriak@mail.ru
ORCID iD: 0000-0001-9163-4516
аспирант
Россия, 123098, г. МоскваНаталья Борисовна Демина
ФГАОУ ВО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: demina_n_b@staff.sechenov.ru
ORCID iD: 0000-0003-4307-8791
доктор фармацевтических наук, профессор, профессор по кафедре фармацевтической и биомедицинской технологии
Россия, 119991, г. МоскваТатьяна Владимировна Гребенникова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: t_grebennikova@mail.ru
ORCID iD: 0000-0002-6141-9361
доктор биологических наук, профессор, чл.-корр. РАН, зав. лабораторией молекулярной диагностики, зав. отделом молекулярной вакцинодогии и иммунодиагностики
Россия, 123098, г. МоскваСписок литературы
- Xu H., Cai L., Hufnagel S., Cui Z. Intranasal vaccine: Factors to consider in research and development. Int. J. Pharm. 2021; 609: 121180. https://doi.org/10.1016/j.ijpharm.2021.121180
- Иванов Б.А. Отечественная литература по вопросам микробиологии, иммунологии, инфекционным болезням и эпидемиологии за конец 1954 г. и первый квартал 1955 г. Журнал микробиологии, эпидемиологии и иммунобиологии. 1955; 32(12): 97–105.
- Розенберг Х.М. Экспериментальное изучение интраназального метода вакцинации БЦЖ. Журнал микробиологии, эпидемиологии и иммунобиологии. 1954; 31(7): 75–81.
- Порфирьева Н.Н., Семина И.И., Мустафин Р.И., Хуторянский В.В. Интраназальное введение как способ доставки лекарств в головной мозг (обзор). Разработка и регистрация лекарственных средств. 2021; 10(4): 117–27. https://doi.org/10.33380/2305-2066-2021-10-4-117-127
- Кунельская Н.Л., Артемьева-Карелова А.В. Основные компоненты назального секрета. Мукоактивные средства во врачебной практике. Лечебное дело. 2013; (3): 5–7.
- Бахрушина Е.О., Демина Н.Б., Шумкова М.М., Родюк П.С., Шуликина Д.С., Краснюк И.И. Интраназальные системы доставки in situ: перспективы применения и основные фармацевтические аспекты разработки (обзор). Разработка и регистрация лекарственных средств. 2021; 10(4): 54–63. https://doi.org/10.33380/2305-2066-2021-10-4-54-63
- Иванушко Л.А., Соловьева Т.Ф., Запорожец Т.С., Сомова Л.М., Горбач В.И. Антибактериальные и антитоксические свойства хитозана и его производных. Тихоокеанский медицинский журнал. 2009; (3): 82–5.
- Kempe S., Mäder K. In situ forming implants – an attractive formulation principle for parenteral depot formulations. J. Control. Release. 2012; 161(2): 668–79. https://doi.org/10.1016/j.jconrel.2012.04.016
- Vigani B., Rossi S., Sandri G., Bonferoni M.C., Caramella C.M., Ferrari F. Recent advances in the development of in situ gelling drug delivery systems for non-parenteral administration routes. Pharmaceutics. 2020; 12(9): 859. https://doi.org/10.3390/pharmaceutics12090859
- Bedford J.G., Caminschi I., Wakim L.M. Intranasal delivery of a chitosan-hydrogel vaccine generates nasal tissue resident memory CD8+ t cells that are protective against influenza virus infection. Vaccines (Basel). 2020; 8(4): 572. https://doi.org/10.3390/vaccines8040572
- Ozbılgın N.D., Saka O.M., Bozkır A. Preparation and in vitro/in vivo evaluation of mucosal adjuvant in situ forming gels with diphtheria toxoid. Drug Deliv. 2014; 21(2): 140–7. https://doi.org/10.3109/10717544.2013.834754
- Zhao K., Shi X., Zhao Y., Wei H., Sun Q., Huang T., et al. Preparation and immunological effectiveness of a swine influenza DNA vaccine encapsulated in chitosan nanoparticles. Vaccine. 2011; 29(47): 8549–56. https://doi.org/10.1016/j.vaccine.2011.09.029
- Majcher M.J., Babar A., Lofts A., Leung A., Li X., Abu-Hijleh F., et al. In situ-gelling starch nanoparticle (SNP)/O-carboxymethyl chitosan (CMCh) nanoparticle network hydrogels for the intranasal delivery of an antipsychotic peptide. J. Control. Release. 2021; 330: 738–52. https://doi.org/10.1016/j.jconrel.2020.12.050
- Agrawal A.K., Gupta P.N., Khanna A., Sharma R.K., Chandrawanshi H.K., Gupta N., et al. Development and characterization of in situ gel system for nasal insulin delivery. Pharmazie. 2010; 65(3): 188–93.
- Luppi B., Bigucci F., Mercolini L., Musenga A., Sorrenti M., Catenacci L., et al. Novel mucoadhesive nasal inserts based on chitosan/hyaluronate polyelectrolyte complexes for peptide and protein delivery. J. Pharm. Pharmacol. 2009; 61(2): 151–7. https://doi.org/10.1211/jpp/61.02.0003
- Wang Q., Wong C.H., Chan H.Y.E., Lee W.Y., Zuo Z. Statistical Design of Experiment (DoE) based development and optimization of DB213 in situ thermosensitive gel for intranasal delivery. Int. J. Pharm. 2018; 539(1-2): 50–7. https://doi.org/10.1016/j.ijpharm.2018.01.032
- Ahmad N., Ahmad R., Ahmad F.J., Ahmad W., Alam M.A., Amir M., et al. Poloxamer-chitosan-based Naringenin nanoformulation used in brain targeting for the treatment of cerebral ischemia. Saudi J. Biol. Sci. 2020; 27(1): 500–17. https://doi.org/10.1016/j.sjbs.2019.11.008
- Díaz A.G., Quinteros D.A., Gutiérrez S.E., Rivero M.A., Palma S.D., Allemandi D.A., et al. Immune response induced by conjunctival immunization with polymeric antigen BLSOmp31 using a thermoresponsive and mucoadhesive in situ gel as vaccine delivery system for prevention of ovine brucellosis. Vet. Immunol. Immunopathol. 2016; 178: 50–6. https://doi.org/10.1016/j.vetimm.2016.07.004
- Zadeh S.N., Rajabnezhad S., Zandkarimi M., Dahmardeh S., Mir L., Darbandi M.A., et al. Mucoadhesive microspheres of chitosan and polyvinyl alcohol as a carrier for intranasal delivery of insulin: in vitro and in vivo studies. MOJ Bioequiv. Availab. 2017; 3(2): 00030.
- Krauland A.H., Guggi D., Bernkop-Schnürch A. Thiolated chitosan microparticles: a vehicle for nasal peptide drug delivery. Int. J. Pharm. 2006; 307(2): 270–7. https://doi.org/10.1016/j.ijpharm.2005.10.016
- Das S.S., Kar S., Singh S.K., Hussain A., Verma P.R.P., Beg S. Chapter 13: Carboxymethyl chitosan in advanced drug-delivery applications. In: Hasnain M.S., Beg S., Nayak A.K., eds. Chitosan in Drug Delivery. Academic Press; 2022: 323–60. https://doi.org/10.1016/B978-0-12-819336-5.00006-6
- Park J.S., Oh Y.K., Yoon H., Kim J.M., Kim C.K. In situ gelling and mucoadhesive polymer vehicles for controlled intranasal delivery of plasmid DNA. J. Biomed. Mater. Res. 2002; 59(1): 144–51. https://doi.org/10.1002/jbm.1227
- Mura P., Mennini N., Nativi C., Richichi B. In situ mucoadhesive-thermosensitive liposomal gel as a novel vehicle for nasal extended delivery of opiorphin. Eur. J. Pharm. Biopharm. 2018; 122: 54–61. https://doi.org/10.1016/j.ejpb.2017.10.008
- Otero-Espinar F.J., Fernández-Ferreiro A., González-Barcia M., Blanco-Méndez J., Luzardo A. Chapter 6: Stimuli sensitive ocular drug delivery systems. In: Grumezescu A.M., ed. Drug Targeting and Stimuli Sensitive Drug Delivery Systems. William Andrew Publishing; 2018: 211–70. https://doi.org/10.1016/B978-0-12-813689-8.00006-9
- Tian J.L., Zhao Y.Z., Jin Z., Lu C.T., Tang Q.Q., Xiang Q., et al. Synthesis and characterization of Poloxamer 188-grafted heparin copolymer. Drug Dev. Ind. Pharm. 2010; 36(7): 832–8. https://doi.org/10.3109/03639040903520983
- Zylke J. Poloxamer 188 for Sickle Cell Disease. JAMA. 2021; 325(15): 1524. https://doi.org/10.1001/jama.2021.3399
- Emanuele M., Balasubramaniam B. Differential effects of commercial-grade and purified poloxamer 188 on renal function. Drugs R.D. 2014; 14(2): 73–83. https://doi.org/10.1007/s40268-014-0041-0
- Li Y., Cui Y., Li L., Lin X., Zhou X., Zhu H., et al. A UHPLC-Q-TOF/MS method for the determination of poloxamer 124 and its application in a tissue distribution study in rats. Anal. Methods. 2021; 13(45): 5516–22. https://doi.org/10.1039/d1ay01373d
- Li Y., Cui Y., Li L., Lin X., Zhou X., Zhu H., et al. Ultra-high-performance liquid chromatography coupled with quadrupole time of flight mass spectrometry method for quantifying polymer poloxamer 124 and its application to pharmacokinetic study. J. Sep. Sci. 2021; 44(20): 3822–9. https://doi.org/10.1002/jssc.202100552
- Bakhrushina E.O., Novozhilova E.V., Kashperko A.S., Sokolova A.V., Demina N.B., Krasnyuk I.I. Biopharmaceutical study of binary poloxamer systems as in situ drug delivery systems poloxamer polycomplexes: The study. Int. J. Appl. Pharm. 2022; 14(3): 162–5. https://doi.org/10.22159/ijap.2022v14i3.43930
- Аршинцева Е.В., Пушкин С.Ю. Сравнительное изучение острой токсичности полоксамеров при внутривенном введении на аутбредных крысах. Интернаука: научный журнал. 2022; 13(236). https://doi.org/10.32743/26870142.2022.13.236.336593
- Воробьев С.И. Биологические и физико-химические свойства неионогенных поверхностно-активных веществ-стабилизаторов эмульсий. Российский биотерапевтический журнал. 2009; 8(3): 3–8.
- Kola M., Puri G.K., Unnisa M.T., Swapna J., Phanivarma K. Formulation, optimization and evaluation of rasagiline mesylate in situ nasal gel. Indo Am. J. Pharm. Res. 2018; 8(09): 1645–54.
- Bertram U., Bernard M.C., Haensler J., Maincent P., Bodmeier R. In situ gelling nasal inserts for influenza vaccine delivery. Drug Dev. Ind. Pharm. 2010; 36(5): 581–93. https://doi.org/10.3109/03639040903382673
- Thakkar J.H., Prajapati S.T. Formulation development and characterization of in-situ gel of Rizatriptan Benzoate for intranasal delivery. J. Drug Deliv. Ther. 2021; 11(1-S): 1–6.
- Bertram U., Bodmeier R. In situ gelling, bioadhesive nasal inserts for extended drug delivery: in vitro characterization of a new nasal dosage form. Eur. J. Pharm. Sci. 2006; 27(1): 62–71. https://doi.org/10.1016/j.ejps.2005.08.005
- Cao S.L., Ren X.W., Zhang Q.Z., Chen E., Xu F., Chen J., et al. In situ gel based on gellan gum as new carrier for nasal administration of mometasone furoate. Int. J. Pharm. 2009; 365(1-2): 109–15. https://doi.org/10.1016/j.ijpharm.2008.08.042
- Демина Н.Б., Бахрушина Е.О., Бардаков А.И., Краснюк И.И. Биофармацевтические аспекты дизайна интраназальных лекарственных форм. Фармация. 2019; 68(3): 12–7.
- Maia F.R., Correlo V.M., Oliveira J.M., Reis R.L. Chapter 32: Natural origin materials for bone tissue engineering: properties, processing, and performance. In: Atala A., Lanza R., Mikos A.G., Nerem R., eds. Principles of Regenerative Medicine (Third Edition). Academic Press; 2019: 535–58. https://doi.org/10.1016/B978-0-12-809880-6.00032-1
- Ball J.P., Springer M.J., Ni Y., Finger-Baker I., Martinez J., Hahn J., et al. Intranasal delivery of a bivalent norovirus vaccine formulated in an in situ gelling dry powder. PLoS One. 2017; 12(5): e0177310. https://doi.org/10.1371/journal.pone.0177310
- Velasquez L.S., Shira S., Berta A.N., Kilbourne J., Medi B.M., Tizard I., et al. Intranasal delivery of Norwalk virus-like particles formulated in an in situ gelling, dry powder vaccine. Vaccine. 2011; 29(32): 5221–31. https://doi.org/10.1016/j.vaccine.2011.05.027
- Dukovski B.J., Plantić I., Čunčić I., Krtalić I., Juretić M., Pepić I., et al. Lipid/alginate nanoparticle-loaded in situ gelling system tailored for dexamethasone nasal delivery. Int. J. Pharm. 2017; 533(2): 480–7. https://doi.org/10.1016/j.ijpharm.2017.05.065
- Giri T.K. 5-nanoarchitectured polysaccharide-based drug carrier for ocular therapeutics. In: Holban A.M., Mihai G.A. Nanoarchitectonics for Smart Delivery and Drug Targeting. William Andrew Publishing; 2016: 119–41. https://doi.org/10.1016/B978-0-323-47347-7.00005-7
- Икласова А.Ш., Сакипова З.Б., Бекболатова Э.Н. Пектин: состав, технология получения, применение в пищевой и фармацевтической промышленности. Вестник Казахского национального медицинского университета. 2018; (3): 243–6.
- Patil P.R., Salve V.K., Thorat R.U., Sadhana S. Formulation and evaluation of ion-sensitive in-situ nasal gel of Zolmitriptan. Int. J. Pharm. Pharm. Sci. 2015; (7): 478–86.
- Gaganjot K., Grewal J., Jyoti K., Jain U.K., Chandra R., Madan J. Chapter 15: Oral controlled and sustained drug delivery systems: Concepts, advances, preclinical, and clinical status. In: Grumezescu A.M., ed. Drug Targeting and Stimuli Sensitive Drug Delivery Systems. William Andrew Publishing; 2018: 567–626. https://doi.org/10.1016/B978-0-12-813689-8.00015-X.
- Tiwari S., Goyal A.K., Mishra N., Vaidya B., Mehta A., Dube D., et al. Liposome in situ gelling system: Novel carrier based vaccine adjuvant for intranasal delivery of recombinant protein vaccine. Procedia Vaccinol. 2009; 1(1): 148–63. https://doi.org/10.1016/j.provac.2009.07.027
- Бркич Г.Э., Пятигорская Н.В., Каргин В.С., Зырянов О.А. Разработка дизайна исследований по определению эффективности и безопасности инновационного лекарственного средства. Медико-фармацевтический журнал «Пульс». 2022; 24(5): 19–23. https://doi.org/10.26787/nydha-2686- 6838-2022-24-5-19-23
- Зырянов О.А. Разработка состава и технологии получения лекарственной формы на основе триазатрициклотетрадекана потенциального модулятора AMPA-рецептора: Дисс. … канд. фарм. наук. М.; 2021.
- Flórez Borges P., García-Montoya E., Pérez-Lozano P., Jo E., Miñarro M., Manich A., et al. The role of SeDeM for characterizing the active substance and polyvinyilpyrrolidone eliminating metastable forms in an oral lyophilizate-A preformulation study. PLoS One. 2018; 13(4): e0196049. https://doi.org/10.1371/journal.pone.0196049
- Гуленков А.С., Мизина П.Г., Бахрушина Е.О., Бардаков А.И., Нюдочкин А.В. Фармацевтико-технологическое исследование адсорбированного жидкого растительного экстракта антимикробного действия. Разработка и регистрация лекарственных средств. 2022; 11(2): 94–101. https://doi.org/10.33380/2305-2066-2022-11-2-94-101
- Бахрушина Е.О., Анурова М.Н., Алешкин А.В., Демина Н.Б., Краснюк И.И., Пятигорская Н.В. и др. Современные тенденции применения и создания лекарственных препаратов бактериофагов. Вестник Российской академии медицинских наук. 2021; 76(4): 351–60. https://doi.org/10.15690/vramn1380
- Gilbert J.C., Richardson J.L., Davies M.C., Palin K.J., Hadgraft J. The effect of solutes and polymers on the gelation properties of pluronic F-127 solutions for controlled drug delivery. J. Control. Release. 1987; 5(2): 113–8. https://doi.org/10.1016/0168-3659(87)90002-2
- Nižić L., Ugrina I., Špoljarić D., Saršon V., Kučuk M.S., Pepić I., et al. Innovative sprayable in situ gelling fluticasone suspension: Development and optimization of nasal deposition. Int. J. Pharm. 2019; 563: 445–56. https://doi.org/10.1016/j.ijpharm.2019.04.015
- Zaki N.M., Awad G.A., Mortada N.D., ElHady S.S.A. Enhanced bioavailability of metoclopramide HCl by intranasal administration of a mucoadhesive in situ gel with 28 modulated rheological and mucociliary transport properties. Eur. J. Pharm. Sci. 2007; 32(4-5): 296–307. https://doi.org/10.1016/j.ejps.2007.08.006
Дополнительные файлы