Электронно-микроскопическое исследование неокортекса сирийских хомяков (Mesocricetus auratus) при инфекции вируса SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus: Sarbecovirus)
- Авторы: Парамонова Н.М.1,2, Чепур С.В.1, Первак М.О.1, Мясников В.А.1, Тюнин М.А.1, Ильинский Н.С.1, Каневский Б.А.1, Смирнова А.В.1
-
Учреждения:
- ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
- ФГБУН «Институт эволюционной физиологии и биохимии имени И.М. Сеченова» Российской академии наук
- Выпуск: Том 67, № 5 (2022)
- Страницы: 403-413
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/640
- DOI: https://doi.org/10.36233/0507-4088-130
- ID: 640
Цитировать
Полный текст
Аннотация
Введение. У пациентов, перенёсших COVID-19, выявляют признаки поражения центральной нервной системы, в том числе непосредственно ассоциированные с вирусом SARS-CoV-2. В связи с этим особую актуальность приобретают морфологические исследования изменений, вызываемых SARS-CoV-2, в коре головного мозга для изучения механизмов их формирования и разработки подходов к доклинической оценке эффективности противовирусных лекарственных средств.
Цель работы – изучение динамики ультраструктурных изменений в неокортексе сирийских хомяков после заражения вирусом SARS-CoV-2.
Материалы и методы. Самцов сирийских хомяков массой тела 80–100 г в возрасте 4–6 недель интраназально заражали 26 мкл культуры SARS-CoV-2 с концентрацией вирусных частиц 4×104 ТЦД50/мл. Эвтаназию выполняли на 3-и, 7-е или 28-е сутки после заражения, мозг извлекали с иссечением коры. Исследование материала проводили методом трансмиссионной электронной микроскопии.
Результаты и обсуждение. Установлено, что через трое суток после заражения в неокортексе возрастает количество умеренно гиперхромных нейронов, тогда как к 7-м суткам значимо увеличивается количество апоптотических клеток. В эти же сроки нарастают признаки нейронофагии и представительство атипичной глии. На 28-е сутки после заражения животных возрастает количество деструктивно изменённых олигодендроцитов. Показано, что вирусная инвазия уже на 3-и сутки после заражения сопряжена с конформационными изменениями клеток неокортекса – преобразованиями ядра, шероховатого эндоплазматического ретикулума и аппарата Гольджи, а также со спазмом микрососудов в сочетании с отёком периваскулярного пространства.
Заключение. В результате электронно-микроскопического исследования описаны ультраструктурные изменения неокортекса на экспериментальной модели инфекции SARS-CoV-2. Полученные данные могут быть применены для изучения патогенеза инфекции и поиска направлений разработки новых лекарственных средств.
Ключевые слова
Полный текст
Введение
SARS-СoV-2 как возбудитель COVID-19 стал объектом пристального изучения в силу высокой социальной значимости пандемийной ситуации [1, 2]. Биология вируса, генетическая изменчивость и многообразие вариантов его белков были детально описаны в отечественной [3–5] и зарубежной [6, 7] научной литературе.
Ранее считали, что влияние вируса SARS-СoV-2 на организм человека ограничено респираторной системой. В связи с возникновением у пациентов аносмии и агевзии научным сообществом было выдвинуто предположение о воздействии вируса на центральную нервную систему (ЦНС) [8], которое позже подтвердилось при анализе симптомов неврологических и психических расстройств [9–11] у пациентов в остром и отдалённом периодах течения COVID-19.
Основными способами защиты от вируса к настоящему времени признаны вакцинопрофилактика и иммунотерапия [12–15], тогда как данные о противовирусной активности средств химиотерапии более скромны [16], а критерии оценки их эффективности в рамках доклинических исследований до настоящего времени не уточнены.
Необходимость проведения электронно-микроскопического исследования (ЭМИ) неокортекса на экспериментальной модели инфекции SARS-CoV-2 определена различной эффективностью антиметаболитов синтеза вирусной рибонуклеиновой кислоты (РНК) и ингибиторов РНК-полимеразы, активность которых в отношении РНК-содержащих вирусов в культуре доказана [17]. Высказано предположение, что различная эффективность препаратов может быть сопряжена в первую очередь с их способностью воздействовать на вирусные частицы за гистогематическими барьерами. Направленная модификация молекул препаратов с учётом гистотопографических особенностей репликации вируса может повысить их эффективность и расширить безопасное применение.
В связи со значимыми поражениями ЦНС при COVID-19 [2] цель исследования – изучение ультраструктурных изменений нейронов и глиальных клеток – представляет фундаментальный и практический интерес для выявления особенностей патогенеза повреждений и разработки подходов к оценке эффективности противовирусных лекарственных средств на доклиническом этапе.
Материал и методы
Экспериментальное исследование проводили на 24 самцах сирийских хомяков [18] в возрасте 4–6 недель массой тела 80–100 г, полученных из питомника ЗАО «НПО «Дом фармации» (Санкт-Петербург). Животных содержали в стандартных условиях вивария.
Культуру вируса SARS-CoV-2 выделяли из ПЦР-позитивного (полимеразная цепная реакция) материала, полученного от больных COVID-19, и накапливали на культуре клеток почки африканской зелёной мартышки (Chlorocebus sabaeus) Vero (B) («БиолоТ», Россия), согласно ранее описанным в литературе методикам [19, 20]. На этой же клеточной линии определяли тканевую цитопатическую дозу вируса (ТЦД50/мл) по методу Рида и Менча [21].
Были сформированы контрольная и опытные группы животных. Массу животных регистрировали до заражения и ежедневно в течение последующих 28 суток. Перед заражением животных наркотизировали раствором «Золетил 100» в дозе 40 мг/кг внутрибрюшинно. Далее механическим дозатором интраназально каждому хомяку опытной группы вводили по 26 мкл культуры вируса, содержащей SARS-CoV-2 в количестве 4×104 ТЦД50/мл [22]. Эвтаназию животных проводили на 3-и, 7-е или 28-е сутки после заражения передозировкой общего анестетика (растворы «Ксила» 20 мг/мл и «Золетил 100» 50 мг/мл, соотношение 1 : 1) в объеме 1 мл на 1 кг массы тела внутримышечно.
Для ЭМИ извлечённый мозг рассекали на фронтальные срезы толщиной в 1–1,5 мм и префиксировали в охлаждённой до 4 °C смеси 4% параформальдегида и 0,5% глутарового альдегида (на 0,1 М какодилатном буфере (рН 7,2–7,4)). Выделенные кусочки неокортекса сенсомоторного отдела коры через 1,5–2 ч дофиксировали в растворе 1% четырёхокиси осмия (все реактивы – Sigma-Aldrich, Германия). Обезвоживали материал в растворах этилового спирта восходящей концентрации и абсолютного ацетона. В процессе дегидратации контрастировали ткань в кусочках 3,5% уранилацетатом на 70° этаноле. Пропитку и заливку смесью аралдитов (Fluka, Швейцария) с ориентацией кусочков выполняли под лупой. Полимеризацию проводили в термостате при 37 и 60 °C в течение трёх суток [23].
Ультратонкие срезы 50–60 нм готовили на ультратоме LKB-III (LKB, Швеция). Регистрацию изменений структуры тканей и их фотофиксацию осуществляли на электронном микроскопе FEI Tecnai G2 Spirit BioTWIN (FEI Company, Нидерланды) при ускоряющем напряжении 80 кВ, предоставленном Центром коллективного пользования Института эволюционной физиологии и биохимии имени И.М. Сеченова РАН. В каждом образце проводили морфометрический анализ клеток и сосудов, а также их подсчёт.
Результаты описательной статистики приведены в виде медианы (Me) и межквартильного размаха ([Q1; Q3]). Для множественных сравнений показателей несвязанных групп применяли Н-критерий Краскела–Уоллиса при номинальном уровне статистической значимости различий p < 0,05. Сравнение проводили с аналогичными характеристиками животных группы виварного контроля.
Животных содержали в надлежащих условиях вивария (разрешение Главного государственного ветеринарного инспектора Санкт-Петербурга № 78-1102/19, сертификат ISO 9001:2015 № ST.RU.0001.M0017187, сертификат соответствия стандарту GLP № GLP-0727-1020). Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus Author Guidelines For Animal Use (IAVES, 23 July 2010). Протокол исследования одобрен Комитетом по этике биомедицинских исследований организации (протокол № 21 от 23.11.2020).
Результаты и обсуждение
Изменения клеток неокортекса
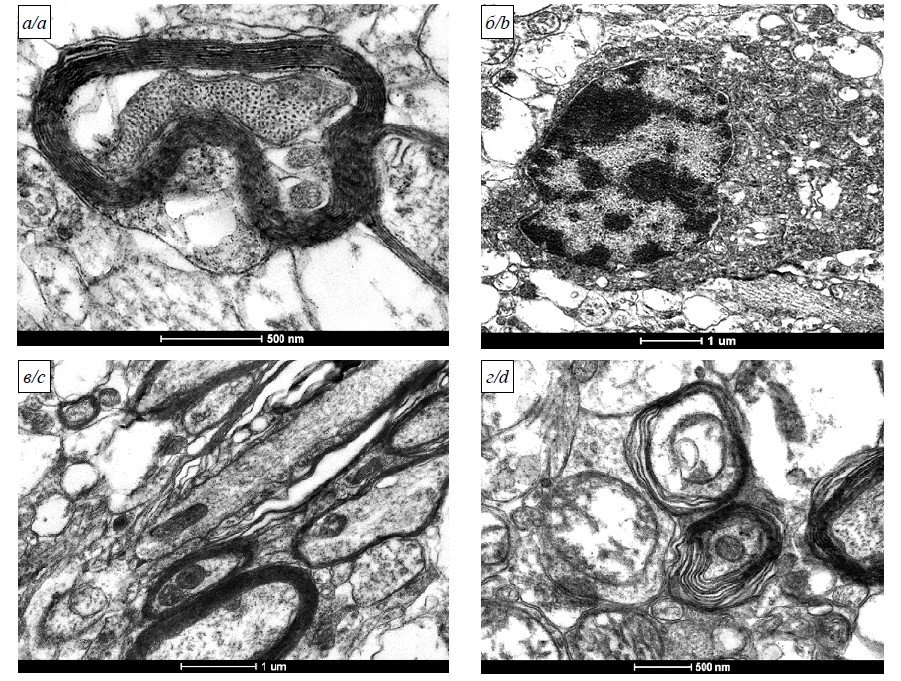
При инфицировании животных SARS-CoV-2 отчётливо прослеживали появление вирусных частиц в нейронах сенсомоторного неокортекса с признаками повышения синтеза белка. Выявляли нейроны с глубоко узурированными контурами ядер, в некоторых из них наблюдали активные крупные ядрышки (рис. 1). В цитоплазме отмечали массу рибосом, как собранных в полисомы, так и адгезированных на мембранах органелл.
Рис. 1. Ультраструктурные изменения неокортекса сирийских хомяков после заражения SARS-CoV-2 4×104 ТЦД50/мл (26 мкл/особь интраназально): а – умеренно гиперхромный нейрон с деформированным контуром ядра (+), крупным ядрышком (Яш) и скоплением РНК-позитивного материала в цитоплазме; б – апоптоз нейрона на стадии фрагментации ядра, на вклейке – большое скопление вирусов; в – вирусные частицы в терминальных участках неравномерно расширенных канальцев эндоплазматического ретикулума; г – фрагмент дендрита с мультивезикулярными тельцами (МВТ), содержащий вирионы. Электронограммы. Увеличения: а – 16 500; б – 6000; вклейка – 17 000; в, г – 60 000.
Шероховатый эндоплазматический ретикулум (ЭР) был гипертрофирован и неравномерно расширен, на терминальных фрагментах канальцев прослеживали вирусные частицы, их отшнуровывание и миграцию к аппарату Гольджи (АГ). Уже к 3-м суткам эксперимента отмечали выраженные изменения АГ: мембраны его цистерн набухали, слипались, сливаясь в единый конгломерат, часто с гомогенизированным содержимым внутри. По периферии АГ в цистернах локализовались вирусные частицы, ассоциированные и с мембранами, и с элементами цитоскелета. По-видимому, слабоконтрастные вирионы за счёт белкового процессинга в АГ приобретают отчетливую белковую короновидную структуру поверхности, а затем отшнуровываются от терминальных участков цистерн органеллы. На 7-е сутки после заражения SARS-CoV-2 в нейронах сенсомоторного отдела коры количество повреждений АГ значительно возрастало.
Практически каждый нейрон всех слоёв неокортекса содержал множество вирусов различной степени зрелости и локализации. В нейронах вирусные частицы отмечали не только в перикарионах, но и в отростках нейроцитов, в том числе миелинизированных, а также в пресинаптических аксонных терминалях и шипиках дендритов.
Нарастающие в течение инфекционного процесса деструктивные изменения приводили, по-видимому, к формированию мультивезикулярных телец (МВТ). На ранних сроках в нейронах МВТ встречались относительно редко, их количество возрастало со временем. По аналогии с прослеженными ранее изменениями клеток культуры Vero (B) МВТ, как и везикулы промежуточного компартмента (ПК), играющего важную роль в сопряжении ЭР и АГ, можно считать транспортной формой [24], обеспечивающей выход вируса из заражённых нейронов на поздних сроках инфекционного процесса. Таким образом, в отличие от эпителиальных клеток культуры, в цитозоле нейроцитов удалось проследить свободную миграцию вирусов, массовый выход которых возможен при достижении критических параметров и гибели клетки.
Для системной оценки изменений нейронов и глии проводили морфометрический анализ клеточных популяций (табл. 1). Установлено, что через трое суток после заражения в неокортексе возрастает количество умеренно гиперхромных нейронов, тогда как к 7-м суткам значимо увеличивается количество апоптотически изменённых клеток (рис. 1 б), по-видимому, как результат глубокой вирус-ассоциированной перестройки метаболизма, сохранявшейся до окончания периода наблюдения. В эти же сроки прослеживали нарастание представительства атипичной глии и признаков нейронофагии.
Таблица 1. Состав популяций нейронов и глии в неокортексе сирийских хомяков после заражения SARS-CoV-2 4×104 ТЦД50/мл (26 мкл/особь интраназально), Me [Q1; Q3], %
Table 1. The neuronal and glial cell composition of the Syrian hamsters neocortex after SARS-CoV-2 infection with 4×104 TCID50/ml (26 µl/individual, intranasally), Me [Q1; Q3], %
Популяция клеток Cell population | Характеристика Characteristic | Продолжительность наблюдения (группа) Observation period (group) | |||
Контроль Control (n = 9) | 3 суток 3 days (n = 5) | 7 суток 7 days (n = 5) | 28 суток 28 days (n = 5) | ||
Нейроны Neurons | Нормохромные Normochromic | 75,5 | 71,3 | 79,0 | 67,8 |
Умеренно гиперхромные Moderately hyperchromic | 13,8 | 17,2* | 12,3 | 12,4 | |
Гиперхромные Hyperchromic | 7,6 | 10,1 | 6,8 | 14,1 | |
Апоптотические Apoptotic | 0,4 | 0 | 5,6* | 6,4* | |
Парные Twin | 17,4 | 19,1 | 20,9 | 17,0 | |
Прилежащие к базальной мембране Adjacent to basement membrane | 1,7 | 3,3* | 2,4 | 1,4 | |
Олигодендроциты Oligodendrocytes | Нормохромные Normochromic | 80,9 | 84,2 | 81,3 | 72,5 |
Гиперхромные Hyperchromic | 7,7 | 10,3 | 7,9 | 17,5* | |
Апоптотические Apoptotic | 10,0 | 5,3 | 18,8 | 12,5 | |
Астроциты Astrocytes | Нормохромные Normochromic | 95,1 | 95,6 | 94,7 | 100,0 |
Гиперхромные Hyperchromic | Не прослежены Not traced | ||||
Апоптотические Apoptotic | 4,9 | 2,8 | 5,3 | 0 | |
Атипичные глиоциты Atypical gliocytes | 3,6 | 11,3* | 8,6* | 4,7 | |
Примечание. *Различия статистически значимы по сравнению с группой контроля (Н-критерий Краскела–Уоллиса, p < 0,05).
Note. *The differences are statistically significant compared to control group (Kruskal–Wallis H test, p < 0.05).
Репродукция вируса
Ультраструктурный анализ неокортекса заражённых SARS-CoV-2 животных выявил формирование вирусных «фабрик». Их наличие отмечали преимущественно в нейронах, глиоцитах и эпендимоцитах (рис. 2). Причем в последних формирование вирусных частиц прослеживали с участием шероховатого ЭР, тогда как в нейронах и глиоцитах вирусные «фабрики» сформированы на основе АГ, что подтверждают и другие авторы [25]. Вирусные «фабрики» всегда ассоциированы с митохондриями (Мх), обеспечивающими процесс репродукции вируса энергетически, а также, возможно, триггерными сигналами.
Рис. 2. Варианты вирусных «фабрик» в неокортексе сирийских хомяков после заражения SARS-CoV-2 4×104 ТЦД50/мл (26 мкл/особь интраназально): а – вирусные «фабрики», сформированные в нейронах комплексом Гольджи; б – в дендритах нейронов «фабрики» сформированы аппаратом Гольджи и шероховатым эндоплазматическим ретикулумом уже на 3-и сутки инфицирования; в эпендимоцитах (в) и эндотелии пиальных сосудов (г) вирусный процессинг в основном задействует структуры эндоплазматического ретикулума. Электронограммы. Увеличения: а – 43 000; б – 26 500; в – 60 000; г – 26 500.
Следует отметить, что персистирование вируса в паренхиме мозга на первых этапах инфекционного процесса не приводит к существенным дистрофическим изменениям нейронов и глиоцитов, а напротив, поддерживает уровень их усиленной пластической и необходимой энергетической активности. Вирусные «фабрики» в нейронах неокортекса прослеживали до 28 суток, когда в ткани лёгких ПЦР-методами вирус уже не определялся [26, 27].
Аутоиммунная агрессия и демиелинизация
Помимо повреждения нейритов и глиоцитов, прослеживали изменения миелиновых волокон. Осевые цилиндры нередко соответствовали вариантам валлеровского перерождения с тёмной дегенерацией и распадом аксонов погибших нейронов. С большей частотой демиелинизация прослежена без дегенерации нейритов как самостоятельный патологический процесс, опосредованный повреждением олигодендроцитов (рис. 3). Прослеживали расширение узлов перехватов Ранвье и отслоение формирующих междоузлие миелиновых ламелл. Деструкция миелиновых оболочек проявлялась в расслоении и разволокнении ламелл, зернистом и везикулярном распаде миелина. Частота наблюдений дегенерации миелинового аппарата возрастала со временем наблюдения, что коррелировало с увеличением количества гиперхромных вакуолизированных олигодендроцитов к 28-м суткам после заражения, по-видимому, связанным с аутоиммунным повреждением этих клеток. Элиминация заражённых олигодендроцитов к окончанию периода наблюдения, вероятно, также опосредована аутоиммунным конфликтом.
Рис. 3. Повреждение олигодендроцитов и миелинового аппарата в неокортексе сирийских хомяков на 7-е сутки после заражения SARS-CoV-2 4×104 ТЦД50/мл (26 мкл/особь интраназально): а – проявления валлеровского перерождения с тёмной дегенерацией нейрита; б – апоптоз олигодендроцита на стадии фрагментации ДНК; в – дезорганизация миелинового аппарата в зоне перехвата Ранвье; г – расслоение ламелл миелиновой оболочки. Электронограммы. Увеличения: а – 43 000; б – 11 500; в – 16 500; г – 26 500.
Изменения гематоэнцефалического барьера
Нейроны и глиоциты представляют вариант забарьерных популяций клеток, поражение которых подтверждает способность вируса поражать укрытые от прямого иммунного контроля структуры. Для косвенной характеристики функциональной активности формирующих гематоэнцефалический барьер микрососудов неокортекса оценивали профиль базальной мембраны (БМ), степень нарушения её регулярной коллагеновой структуры и состояние периваскулярных отростков астроцитов (табл. 2). Установлено, что вирусная инвазия сопровождается спазмом микрососудов с извилистым профилем БМ и участками периваскулярных отёков уже на 3-и – 7-е сутки после заражения. По-видимому, эти изменения, наряду с выявленным в некоторых случаях тромбозом (рис. 4), способствуют гипоксии тканей, что подтверждает значимое увеличение к этому времени количества гиперхромных и умеренно гиперхромных нейронов, взаимодействующих с БМ сосудов без глиальных посредников. Компенсаторные изменения сопряжены с активацией «спящих» резервных сосудов, количество которых сокращается начиная с 7-х суток и до окончания наблюдения.
Таблица 2. Изменения микрососудов неокортекса сирийских хомяков после заражения SARS-CoV-2 4×104 ТЦД50/мл (26 мкл/особь интраназально), Me [Q1; Q3], %
Table 2. Microvascular changes in the Syrian hamsters neocortex after SARS-CoV-2 infection with 4×104 TCID50/ml (26 µl/individual, intranasally), Me [Q1; Q3], %
Состояние сосуда Condition of the vessel | Периваскулярное пространство Perivascular space | Продолжительность наблюдения (группа)/ Observation period (group) | |||
Контроль/Control (n = 9) | 3 суток/3 days (n = 5) | 7 суток/7 days (n = 5) | 28 суток/28 days (n = 5) | ||
Норма Normal | Без отёка /Without edema | ||||
С отёком/With edema | |||||
Констрикция Constriction | Без отёка/Without edema | ||||
С отёком/With edema | |||||
Дилатация Dilatation | Без отёка/Without edema | Не прослежены/Not traced | |||
С отёком/With edema | В единичном количестве на 7-е сутки после заражения/ In a single amount at day 7 post-infection | ||||
«Спящие» Dormant | Без отёка/Without edema | ||||
С отёком/With edema | |||||
Итого сосудов с отёком БМ Total vessels with edema of basal membrane | |||||
Примечание. *Различия статистически значимы по сравнению с группой контроля (Н-критерий Краскела–Уоллиса, p < 0,05).
Note. *The differences are statistically significant compared to control group (Kruskal–Wallis H test, p < 0.05).
Рис. 4. Структурные изменения гематоэнцефалического барьера в неокортексе сирийских хомяков после заражения SARS-CoV-2 4×104 ТЦД50/мл (26 мкл/особь интраназально): а – спазмированный капилляр с отёчным периваскулярым пространством (ПВПр); б – прямой контакт (стрелки) нейрона (Н) с микрососудом, заполненным эритроцитами (Эр); в – спящий резервный капилляр, просвет (ПрК) которого перекрыт ядром эндотелиоцита (ЯЭц); г – вирусные тельца проникают в нейрон (Н), преодолевая базальную мембрану (БМ) сосуда. Электронограммы. Увеличения: а – 6000; б – 4200; в – 11 500; г – 60 000.
Прослеженные электронно-микроскопические изменения структур неокортекса не позволяют относиться к COVID-19 исключительно как к респираторной инфекции. Подобно вирусу геморрагической лихорадки Эбола, пролиферация которого также происходит в головном мозге [28], применительно к SARS-CoV-2 прослежено значение этой системы в вирусной репродукции и накоплении, что ввиду особенностей проницаемости гематоэнцефалического барьера определяет сложности проведения противовирусной химиотерапии.
Заключение
Проведённое ЭМИ предоставило важную информацию для формирования подходов к терапии новой коронавирусной инфекции. Забарьерное персистирование вируса объяснило формирование когнитивных нарушений и расстройств внимания у реконвалесцентов COVID-19. Формирующиеся демиелинизирующие процессы, сопряжённые, по-видимому, с иммунным контролем и элиминацией контаминированных вирусом глиальных клеток, определяют болевые проявления и мигрирующие нарушения двигательной активности. Принципиально важно, что большинство применяемых антиметаболитов синтеза РНК и блокаторов вирусной РНК-зависимой РНК-полимеразы представляют достаточно гидрофильные соединения, а их способность воздействовать на вирусную продукцию в нервной ткани весьма ограничена. Это обстоятельство определяет необходимость проведения дальнейшего дизайна молекул лекарств, создания универсальных и безопасных в применении противовирусных средств. Вместе с тем прослеженная роль АГ определяет возможность влияния на гликозилирование как вирусных белков, так и их мишеней на поверхности клеток, что, вероятно, и достигалось посредством применения гидроксихлорохина и его производных [1, 29], показавших свою эффективность в попытках ранней краткосрочной терапии COVID-19 [30].
Таким образом, результаты проведённого морфологического анализа компартментализации метаболических процессов могут быть применены для выявления механизмов протекания инфекции SARS-CoV-2 и поиска направлений разработки новых лекарственных средств.
Участие авторов: Парамонова Н.М. – концепция и дизайн исследования, обработка материала, электронная микроскопия, написание текста статьи; Чепур С.В. – концепция и дизайн исследования, статистическая обработка результатов, написание текста статьи; Первак М.О. – обработка материала, редактирование статьи; Мясников В.А. – концепция и дизайн исследования, редактирование; Тюнин М.А. – концепция и дизайн исследования, редактирование; Ильинский Н.С. – сбор и обработка материала, редактирование статьи; Каневский Б.А – вирусологическая работа, редактирование статьи, Смирнова А.В. – вирусологическая работа, обработка материала, редактирование статьи.
Благодарности. Авторы выражают искреннюю благодарность А.С. Никишину и П.С. Баевой за участие в создании биологических моделей.
Финансирование. Исследование выполнено за счёт государственного бюджета.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Этическое утверждение. Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus author guidelines for animal use (IAVES, 23 July 2010). Программа и протокол исследования одобрен Комитетом по этике биомедицинских исследований ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации, 195043, г. Санкт-Петербург, Россия (протокол № 21 от 23.11.2020 г.).
Об авторах
Наталья Михайловна Парамонова
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации; ФГБУН «Институт эволюционной физиологии и биохимии имени И.М. Сеченова» Российской академии наук
Email: gniiivm_2@mil.ru
ORCID iD: 0000-0001-5451-3555
SPIN-код: 2945-3310
старший научный сотрудник
Россия, 195043, г. Санкт-Петербург; 194223, г. Санкт-ПетербургСергей Викторович Чепур
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Email: gniiivm_2@mil.ru
ORCID iD: 0000-0002-7625-2744
SPIN-код: 3828-6730
доктор медицинских наук, профессор, начальник
Россия, 195043, г. Санкт-ПетербургМария Олеговна Первак
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Email: gniiivm_7@mil.ru
ORCID iD: 0000-0002-1395-823X
младший научный сотрудник
Россия, 195043, г. Санкт-ПетербургВадим Александрович Мясников
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Email: gniiivm_7@mil.ru
ORCID iD: 0000-0001-7232-4678
кандидат медицинских наук, начальник научно-исследовательского испытательного центра
Россия, 195043, г. Санкт-ПетербургМихаил Александрович Тюнин
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Email: gniiivm_7@mil.ru
ORCID iD: 0000-0002-6974-5583
SPIN-код: 6161-7029
кандидат медицинских наук, заместитель начальника научно-исследовательского испытательного центра
Россия, 195043, г. Санкт-ПетербургНикита Сергеевич Ильинский
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Email: nika_il2@mail.ru
ORCID iD: 0000-0001-7406-753X
SPIN-код: 5511-7800
заместитель начальника научно-исследовательского отдела
Россия, 195043, г. Санкт-ПетербургБорис Александрович Каневский
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Email: gniiivm_7@mil.ru
ORCID iD: 0000-0002-6255-8232
SPIN-код: 2549-9294
заместитель начальника научно-исследовательского отдела
Россия, 195043, г. Санкт-ПетербургАнна Владимировна Смирнова
ФГБУ «Государственный научно-исследовательский испытательный институт военной медицины» Министерства обороны Российской Федерации
Автор, ответственный за переписку.
Email: janis_1@mail.ru
ORCID iD: 0000-0003-0483-5032
SPIN-код: 4897-0219
научный сотрудник
Россия, 195043, г. Санкт-ПетербургСписок литературы
- Чепур С.В., Плужников Н.Н., Чубарь О.В., Бакулина Л.С., Литвиненко И.В., Макаров В.А. и др. Респираторные РНК-вирусы: как подготовиться к встрече с новыми пандемическими штаммами. Успехи современной биологии. 2020; 140(4): 359–77. https://doi.org/10.31857/S0042132420040043
- Machhi J., Herskovitz J., Senan A.M., Dutta D., Nath B., Oleynikov M.D., et al. The Natural History, Pathobiology, and Clinical Manifestations of SARS-CoV-2 Infections. J. Neuroimmune Pharmacol. 2020; 15(3): 359–86. https://doi.org/10.1007/s11481-020-09944-5
- Харченко Е.П. Коронавирус SARS-CoV-2: особенности структурных белков, контагиозность и возможные иммунные коллизии. Эпидемиология и вакцинопрофилактика. 2020; 19(2): 13–30. https://doi.org/10.31631/2073-3046-2020-19-2-13-30
- Бруякин С.Д., Макаревич Д.А. Структурные белки коронавируса SARS-CoV-2: роль, иммуногенность, суперантигенные свойства и возможности использования для терапевтических целей. Вестник Волгоградского государственного медицинского университета. 2021; (2): 18–27. https://doi.org/10.19163/1994-9480-2021-2(78)-18-27
- Пащенков М.В., Хаитов М.Р. Иммунный ответ против эпидемических коронавирусов. Иммунология. 2020; 41(1): 5–18. https://doi.org/10.33029/0206-4952-2020-41-1-5-18
- Pan Y., Li X., Yang G., Fan J., Tang Y., Zhao J., et al. Serological immunochromatographic approach in diagnosis with SARS-CoV-2 infected COVID-19 patients. J. Infect. 2020; 81(1): e28–32. https://doi.org/10.1016/j.jinf.2020.03.051
- Rodríguez Y., Novelli L., Rojas M., De Santis M., Acosta-Ampudia Y., Monsalve DM., et al. Autoinflammatory and autoimmune conditions at the crossroad of COVID-19. J. Autoimmun. 2020; 114: 102506. https://doi.org/10.1016/j.jaut.2020.102506
- Nalbandian A., Sehgal K., Gupta A., Madhavan M.V., McGroder C., Stevens J.S., et al. (2021). Post-acute COVID-19 syndrome. Nat. Med. 2021; 27(4): 601–15. https://doi.org/10.1038/s41591-021-01283-z
- Mao L., Jin H., Wang M., Hu Y., Chen S., He Q., et al. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol. 2020; 77(6): 683–690. https://doi.org/10.1001/jamaneurol.2020.1127
- Pinna P., Grewal P., Hall J.P., Tavarez T., Dafer R.M., Garg R., et al. Neurological manifestations and COVID-19: Experiences from a tertiary care center at the Frontline. Journal of the neurological sciences. J. Neurol. Sci. 2020; 415: 116969. https://doi.org/10.1016/j.jns.2020.116969
- Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z., et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020; 395(10229): 1054–62. https://doi.org/10.1016/S0140-6736(20)30566-3
- Xiao A.T., Gao C., Zhang S. Profile of specific antibodies to SARS-CoV-2: The first report. J. Infect. 2020; 81(1): 147–78. https://doi.org/10.1016/j.jinf.2020.03.012
- Logunov D.Y., Dolzhikova I.V., Shcheblyakov D.V., Tukhvatulin A.I., Zubkova O.V., Dzharullaeva A.S., et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021; 397(10275): 671–81. https://doi.org/10.1016/S0140-6736(21)00234-8
- Jones I., Roy P. Sputnik V COVID-19 vaccine candidate appears safe and effective. Lancet. 2021; 397(10275): 642–3. https://doi.org/10.1016/S0140-6736(21)00191-4
- Dassarma B., Tripathy S., Matsabisa M. Emergence of ancient convalescent plasma (CP) therapy: to manage COVID-19 pandemic. Transfus. Clin. Biol. 2021; 28(1): 123–127. https://doi.org/10.1016/j.tracli.2020.11.004
- Chakraborty C., Sharma A.R., Sharma G., Bhattacharya M., Lee S.S. SARS-CoV-2 causing pneumonia-associated respiratory disorder (COVID-19): diagnostic and proposed therapeutic options. Eur. Rev. Med. Pharmacol. Sci. 2020; 24(7): 4016–26. https://doi.org/10.26355/eurrev_202004_20871
- Wu X., Yu K., Wang Y., Xu W., Ma H., Hou Y., et al. Efficacy and safety of Triazavirin therapy for coronavirus disease 2019: a pilot randomized controlled trial. Engineering (Beijing). 2020; 6(10): 1185–91. https://doi.org/10.1016/j.eng.2020.08.011
- Chan J.F.W., Zhang A.J., Yuan S., Poon V.K.M., Chan C.C.S., Lee A.C.Y., et al. Simulation of the clinical and pathological manifestations of coronavirus disease 2019 (COVID-19) in a golden Syrian hamster model: implications for disease pathogenesis and transmissibility. Clin. Infect. Dis. 2020; 71(9): 2428–46. https://doi.org/10.1093/cid/ciaa325
- TaŞtan C., Yurtsever B., Sir KarakuŞ G., Dİlek KanÇaĞi D., Demİr S., Abanuz S., et al. SARS-CoV-2 isolation and propagation from Turkish COVID-19 patients. Turk. J. Biol. 2020; 44(3): 192–202. https://doi.org/10.3906/biy-2004-113
- Yao P., Zhang Y., Sun Y., Gu Y., Xu F., Su B., et al. Isolation and growth characteristics of SARS-CoV-2 in vero cell. Virol. Sin. 2020; 35(3): 348–50. https://doi.org/10.1007/s12250-020-00241-2
- Reed L.J., Muench H. A simple method of estimating fifty percent endpoints. Am. J. Hygiene. 1938; 27: 493–7. https://doi.org/10.1093/oxfordjournals.aje.a118408
- Макаренко И.Е., Авдеева О.И., Ванатиев Г.В., Рыбакова А.В., Ходько С.В., Макарова М.Н. и др. Возможные пути и объемы введения лекарственных средств лабораторным животным. Международный вестник ветеринарии. 2013; (3): 72–84.
- Гайер Г., ред. Электронная гистохимия. Пер. с нем. М.: Мир; 1974.
- Saraste J., Prydz K. Assembly and cellular exit of coronaviruses: hijacking an unconventional secretory pathway from the pre-Golgi intermediate compartment via the golgi ribbon to the extracellular space. Cells. 2021; 10(3): 503. https://doi.org/10.3390/cells10030503
- Hackstadt T., Chiramel A.I., Hoyt F.H., Williamson B.N., Dooley C.A., Beare P.A., et al. Disruption of the Golgi apparatus and contribution of the endoplasmic reticulum to the SARS-CoV-2 replication complex. Viruses. 2021; 13(9): 1798. https://doi.org/10.3390/v13091798
- Чепур С.В., Мясников В.А., Тюнин М.А., Ильинский Н.С., Никишин А.С., Исаева А.А. и др. Модель новой коронавирусной инфекции у золотистых сирийских хомячков: основные патологические изменения. Биомедицина. 2021; 17(3): 90–4. https://doi.org/10/33647/2074-5982-17-3-90-94
- Чепур С.В., Тюнин М.А., Мясников В.А., Алексеева И.И., Владимирова О.О., Ильинский Н.С. и др. Поражение органов и тканей SARS-CoV-2: биологическая модель на сирийских хомяках Mesocricetus auratus для экспериментальных (доклинических) исследований. Клиническая и экспериментальная морфология. 2021; 10(4): 25–34. https://doi.org/10.31088/CEM2021.10.4.25-34
- Billioux B.J., Smith B., Nath A. Neurological complications of Ebola virus infection. Neurotherapeutics. 2016; 13(3): 461–70. https://doi.org/10.1007/s131311-016-0457-z
- Чепур С.В., Плужников Н.Н., Сайганов С.А., Бакулина Л.С., Чубарь О.В., Юдин М.А. и др. Гипотеза матричного синтеза апериодических полисахаридов. Успехи современной биологии. 2019; 139(6): 583–93. https://doi.org/10.1134/S0042132419060012
- Sinha N., Balayla G. Hydroxychloroquine and COVID-19. Postgrad. Med. J. 2020; 96(1139): 550–5. https://doi.org/10.1136/postgradmedj-2020-137785
Дополнительные файлы