Сравнительное изучение Ухань-подобного и омикрон-подобного вариантов SARS-CoV-2 на экспериментальных животных моделях
- Авторы: Ленева И.А.1, Смирнова Д.И.1, Карташова Н.П.1, Грачева А.В.1, Иванина А.В.1, Глубокова Е.А.1, Корчевая Е.Р.1, Панкратов А.А.2, Трунова Г.В.2, Хохлова В.А.2, Свитич О.А.1, Зверев В.В.1, Файзулоев Е.Б.1
-
Учреждения:
- ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
- ФГБУ «Московский научно-исследовательский онкологический институт имени П.А. Герцена» Минздрава России
- Выпуск: Том 67, № 5 (2022)
- Страницы: 439-449
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/627
- DOI: https://doi.org/10.36233/0507-4088-135
- ID: 627
Цитировать
Полный текст
Аннотация
Введение. Изменчивость SARS-CoV-2 оказалась выше ожидаемой, а появление новых вариантов вызывает обеспокоенность об их потенциально более высокой вирулентности, трансмиссивности, способности уклоняться от иммунных реакций, вызванных предыдущей инфекцией или вакцинацией. В связи с этим важно изучение патогенеза таких вариантов на экспериментальных моделях SARS-CoV-2.
Цель работы – сравнение патогенности вариантов Ухань и BA.1.1 (омикрон) у мышей BALB/c и сирийских хомяков.
Материал и методы. В исследовании использованы штаммы SARS-CoV-2 Dubrovka, филогенетически близкий к штамму Wuhan-Hu-1, и LIA, филогенетически близкий к штамму омикрон, мыши BALB/c, трансгенные мыши B6.Cg-Tg(K18-ACE2)2Prlmn/HEMI Hemizygous for Tg(K18-ACE2)2Prlmn, сирийские золотистые хомяки. Заражение животных проводили интраназально, определение вирулентности выполняли посредством комплекса клинических, патоморфологических и вирусологических методов.
Результаты. Сравнительные исследования штаммов SARS-CoV-2 Dubrovka (Ухань-подобного) и LIA (омикрон-подобного) на моделях животных продемонстрировали их различную патогенность. При параллельном заражении мышей BALB/c вариантами Dubrovka и LIA инфекция протекала без серьёзных клинических признаков и повреждений лёгких. Заражение штаммом LIA приводило к системному заболеванию с высоким содержанием вирусной РНК в лёгких и тканях мозга животных. Вирусная РНК у мышей при заражении штаммом Dubrovka была преходящей и не обнаруживалась в лёгких уже на 7-й день после заражения. Напротив, у хомяков штамм Dubrovka обладал большей патогенностью, чем штамм LIA. При инфицировании штаммом Dubrovka поражения лёгких были значительнее, наблюдались потеря массы тела и распространение вируса по органам, в частности в ткани головного мозга, в то время как при заражении штаммом LIA вирус в тканях головного мозга не определялся.
Заключение. Изучение различных вариантов SARS-CoV-2 у видов, изначально невосприимчивых к инфекции, важно для мониторинга зоонозных резервуаров, создающих риск распространения новых вариантов у людей.
Полный текст
Введение
SARS-CoV-2 – вирус зоонозного происхождения, вызвавший новую коронавирусную инфекцию в 2019 г. (COVID-19) в Ухане, Китайская Народная Республика [1, 2], откуда он быстро распространился по всему миру, и в марте 2020 г. Всемирная организация здравоохранения объявила пандемию. Изменчивость вируса оказалась выше ожидаемой, появление новых вариантов SARS-CoV-2 вызывало обеспокоенность тем, что потенциально они могут быть более заразными и (или) уклоняться от иммунных реакций, вызванных предыдущей инфекцией или вакцинацией [3, 4].
К настоящему времени наиболее широкое распространение [5–13] получил сильно мутировавший по сравнению с первоначальным вариантом Ухань вариант B.1.1.529 (омикрон), демонстрирующий беспрецедентное накопление мутаций в белке S, некоторые из которых связаны с повышенной трансмиссивностью и уклонением от антител [14–18]. Такие мутации могут изменить восприимчивость других видов-хозяев к вирусу, тем самым потенциально расширяя область его обитания в животных [19, 20], а также создать новые возможности для моделирования инфекции в них.
Модели лабораторных животных, которые воспроизводят клинические и патологические особенности COVID-19 у человека, являются инструментами для изучения патогенеза, механизмов и путей передачи возбудителя, Кроме того, моделированию новой коронавирусной инфекции и её последствий на животных, дальнейшему сопоставлению полученных в этой модели данных с клиническими наблюдениями принадлежит важнейшая роль в оценке эффективности противовирусных препаратов и вакцин.
Модель вирусной инфекции должна воспроизводить клинические признаки заболевания, его тяжесть и сопоставимый уровень вирусной репликации, а также у модельного животного должны быть клеточные рецепторы, аналогичные человеческим [21]. В качестве рецептора для взаимодействия с SARS-CoV-2 был идентифицирован человеческий ангиотензинпревращающий фермент 2 (angiotensin-converting enzyme 2 – ACE2) [20]. Ландшафт восприимчивых видов животных определяется мутациями S-белка, которые могут модулировать сродство с ACE2 [22]. Инбредные мыши (WT, BALB/c, C57BL6, 129S) поддерживают репликацию вируса штамма Ухань, но клинические признаки заболевания не выявляются. Была разработана специальная трансгенная модель мыши, имеющая рецептор ACE2, аналогичный человеческому [23], и в которой инфекция носит летальный характер. Однако экспрессируемый человеческий рецептор АСЕ2 в таких трансгенных мышах не является физиологическим, эти мыши труднодоступны и очень дороги. Появились сообщения о том, что новые варианты, такие как B.1.351 (бета) и B.1.1.529 (омикрон), могут заражать устойчивых к SARS-CoV-2 мышей дикого типа (WT) [24–27], однако полный анализ чувствительности in vivo этих вирусов к настоящему времени не проведён. В отличие от мышиной модели, у сирийских хомяков клиническая картина SARS-CoV-2, патология лёгких, включая пневмонию, наиболее близко воссоздаёт инфекцию у человека [28].
Изучение штаммов SARS-CoV-2 в этой модели выявило их гетерогенность и различную патогенность, при этом данные по варианту B.1.1.529 (омикрон) неоднозначны, отличаются в различных исследованиях и зависят от штамма [29–31]. Нами от пациентов с лабораторно-подтверждённой инфекцией COVID-19 были выделены и охарактеризованы штаммы Dubrovka, филогенетически близкий к штамму Ухань, и LIA, филогенетически близкий к штамму омикрон, однако их изучение в моделях лабораторных животных не проводилось и данные об их патогенности у животных отсутствуют.
Целью нашей работы являлось сравнение инфекционности штаммов Dubrovka (Ухань-подобного) и LIA (омикрон-подобного) SARS-CoV-2 в моделях мышей BALB/c и сирийских хомяков, характеристика патогенеза и прогрессирования инфекции в этих моделях.
Материалы и методы
Вирусы и клетки
В работе использовались лабораторные штаммы коронавируса SARS-CoV-2: Dubrovka (идент. № GenBank: MW514307.1, выделен от пациента 4 июня 2020 г., классификация по Pango B.1.1.317), филогенетически близкий к штамму Wuhan-Hu-1, идент. № GenBank: MN908947.3) [29] и LIA (идент. № GenBank: ON032858.1, выделен от пациента 27 января 2022 г., классификация по Pango BA.1.15), филогенетически близкий к штамму омикрон. Штаммы вирусов SARS-CoV-2 были выделены на культуре клеток Vero CCL81 из назофарингеальных мазков больных СOVID-19. Культивирование вирусов проводили на клетках эпителия почки африканской зелёной мартышки Vero CCL81 (ATСС) из коллекции Научно-исследовательского института вакцин и сывороток (НИИВС) имени И.И. Мечникова при 37 °C в питательной среде DMEM (Dulbecco’s modified Eagles medium) с L-глутамином (300 мкг/мл) и глюкозой 4,5 г/л, смесью антибиотиков (пенициллин 100 МЕ/мл и стрептомицин 100 мкг/мл) в атмосфере 5% СО2. Штамм Dubrovka прошёл 20 последовательных пассажей и вызывал выраженное цитопатогенное действие (ЦПД). Штамм LIA прошёл 5 последовательных пассажей и вызывал менее выраженное ЦПД с гибелью до 20% клеток через 96 ч после заражения. Образцы вирусного материала для проведения работы хранились при температуре –80 °C в виде аликвот. Для титрования вирусов для заражения животных, вирусного материала из лёгких животных и характеристики вирусов также использовали перевиваемую культуру клеток эпителия почки африканской зелёной мартышки Vero CCL81.
Животные и эксперименты с ними
В опытах использовали самок мышей линии BALB/c массой 12–14 г, полученных из питомника «Стезар» (Владимирская обл.), самок и самцов трансгенных мышей линии B6.Cg-Tg(K18-ACE2)2Prlmn/HEMI Hemizygous for Tg(K18-ACE2)2Prlmn (Jackson Immunoresearch, West Grove, PA, USA), а также самок сирийских золотистых хомяков массой 50–60 г, полученных из ФИБХ РАН «Питомник «Пущино» (р. п. Столбовая, Московская обл.). Содержание животных соответствовало правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник. Кормили животных брикетированными кормами в соответствии с утверждёнными нормами. Все эксперименты были утверждены Этическим комитетом по работе с животными НИИВС имени И.И. Мечникова (протокол № 11 от 01.12.2021).
Мышей и хомяков заражали интраназально под лёгким эфирным наркозом в объёме 30 и 100 мкл соответственно на обе ноздри в указанных для каждого опыта дозах. За животными велось ежедневное наблюдение в течение последующих 4–7 дней, проводилось ежедневное взвешивание. Уменьшение или увеличение массы тела рассчитывалось отдельно для каждой мыши и выражалось в процентах. При этом за 100% принималась масса животного перед инфицированием. Для всех мышей одной группы определялось среднее значение процента потери или увеличения массы.
Получение лёгких и других органов животных
В указанные дни после инфицирования вирусом в каждой группе забивали по 3–4 мыши или хомяка и в стерильных условиях извлекали лёгкие, ткани головного мозга, другие органы. Органы трёхкратно промывали в растворе 0,01 М фосфатно-солевого буфера (ФСБ). Далее левые лёгкие, головной мозг и другие органы гомогенизировали и ресуспендировали в 1 мл холодного стерильного раствора 0,01М ФСБ. Суспензию осветляли от клеточного дебриса центрифугированием при 2000 g в течение 10 мин, супернатант использовали для определения инфекционного титра вируса в культуре клеток и проведения полимеразной цепной реакции (ПЦР). Хранение полученных образцов осуществлялось при –80 °C до постановки экспериментов. Правые лёгкие фиксировали в 10% растворе формалина для гистологических исследований.
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus Author Guidelines for Animal Use (IAVES, 23 July, 2010). Протокол исследования одобрен Этическим комитетом организации (протокол № 11 от 01.12.2021).
Определение титра вируса в лёгких животных
Для определения инфекционного титра вируса из лёгких мышей или хомяков клетки Vero CCL81 рассаживали в 96-луночные планшеты фирмы Costar со средней плотностью 10 000 клеток на лунку и выращивали в среде DMEM в присутствии 5% фетальной сыворотки телят, 10 мМ глутамина и антибиотиков (пенициллин 100 МЕ/мл и стрептомицин 100 мкг/мл) до формирования полного монослоя (в течение 3 дней). Перед заражением вирусом культуру клеток 2 раза промывали средой DMEM без сыворотки. Готовили 10-кратные разведения каждой пробы вируса из лёгких с 10–1 до 10–7. Приготовленные разведения в объёме 200 мкл вносили в планшеты с культурой клеток и инкубировали в атмосфере 5% CO2 при 37 °C в течение 5 суток до появления ЦПД в клетках вирусного контроля. Расчёт титра вируса проводили с использованием формулы M.A. Ramakrishnan в программе Excel [30] и выражали в lg ТЦИД50 / 0,1 мл (тканевой цитопатической инфекционной дозы 50). Далее рассчитывали среднее значение титра для проб от мышей одной группы.
Количественное определение РНК коронавируса SARS-CoV-2 в органах животных методом ПЦР
Для выделения рибонуклеиновой кислоты (РНК) использовали осветлённые центрифугированием гомогенаты лёгких и других органов животных. Выделение вирусной РНК проводили коммерческим набором реагентов для экстракции ДНК/РНК из биологического материала «МагноПрайм ЮНИ» (ТУ 21.20.23-024-09286667-2018, ООО «НекстБио», Россия) в соответствии с инструкцией производителя.
Количественное определение РНК вируса SARS-CoV-2 проводили методом обратной транскрипции и ПЦР с детекцией в режиме реального времени (ОТ-ПЦР-РВ), как описано A.V. Gracheva и соавт. [31]. Для выявления вирусной РНК были использованы праймеры и зонды к гену N (нуклеокапсида) вируса COVID-19-N-F, COVID-19-N-R, COVID-19-N-P (таблица). Реакцию ОТ-ПЦР-РВ проводили с использованием реагентов «2,5х реакционная смесь для ПЦР-РВ с Tag-полимеразой» и «обратная транскриптаза MMLV» («Синтол», Россия). Реакционная смесь объёмом 25 мкл содержала по 10 пмоль каждого праймера и 5 пмоль зонда, 10 мкл 2,5х реакционной смеси с Taq-ДНК полимеразой, 0,6 мкл обратной транскриптазы. Температурно-временной режим: 45 °C – 10 мин (1 цикл); 95 °C – 5 мин (1 цикл); 95 °C – 5 сек, 55 °C – 45 сек (45 циклов). Учёт флуоресцентного сигнала проводили на канале FAM. Все олигонуклеотиды синтезированы в OOO «Синтол» (Россия) [31].
Таблица. Последовательности олигонуклеотидов, использованные в работе
Table. Oligonucleotide sequences used in the work
Название Name | Последовательность 5’–3’ Sequence 5’–3’ |
COVID-19-N-F | GCGTTCTTCGGAATGTCG |
COVID-19-N-R | TTGGATCTCTTTGTCATCCAATTTG |
COVID-19-N-P | FAM-AACGTGGTTGACCTACAGGT-BHQ1 |
COVN-PC | GCGTTCTTCGGAATGTCGCGCGCATTGGCATGGAAGTCACCTTCGGAACCTTCGGAACGGAACGTGTGTTGACACCTACAGGTGCCATCAAATTGGAATGACAAAGATCCAA |
Реакции ОТ и ПЦР-РВ проводили в амплификаторе «ДТпрайм-4» («ДНК-технология», Россия). Значение порогового цикла в ПЦР-РВ определялось автоматически с помощью программы RealTime_PCR v.7.7 («ДНК-Технология») на основе математического анализа формы кривой амплификации (метод геометрический, Cp). Для построения калибровочного графика использовали десятикратные разведения синтетического олигонуклеотида COVN-PC (таблица). Для расчёта концентрации вирусной РНК применяли тип анализа оптических данных «количественный со стандартами». Количество выражали в lg копий РНК в 1 мл гомогената соответствующего органа при изучении содержания вируса в крови животных в 1 мл сыворотки крови.
Гистологическое изучение лёгких животных
Для гистологического исследования правое лёгкое мышей фиксировали в 10% нейтральном забуференном формалине в течение 24 ч, обезвоживали и заливали в гистомикс. На этапе заливки материал ориентировали вдоль длинной оси. Cерийные срезы толщиной 3–5 мкм изготавливали на ротационном микротоме Leica RM 2125 RTS (Leica, Германия), затем окрашивали гематоксилином и эозином и заключали в канадский бальзам. Полученные гистологические препараты исследовали под световым микроскопом Olympus BX51 (Olympus, Япония) с системой фоторегистрации гистопрепаратов и обработки изображений.
Результаты
Сравнительное изучение патогенеза инфекции у мышей различных линий при заражении их вариантами SARS-CoV-2 Dubrovka (Ухань-подобным) и LIA (омикрон-подобным)
При изучении патогенеза инфекции при заражении штаммами Dubrovka (Ухань-подобным) и LIA (омикрон-подобным) были использованы мыши линии BALB/c. В качестве контрольных мышей при заражении штаммом Dubrovka (Ухань-подобным) использовали трансгенных мышей K18-hACE2, экспрессирующих человеческий ACE2-рецептор, используемый SARS-CoV-2 для проникновения в клетки. Состояние, смертность и массу животных контролировали ежедневно. При параллельном заражении мышей BALB/c штаммами Dubrovka и LIA в обоих случаях инфекция протекала без серьёзных клинических признаков болезни, смертности и практически без потери массы (рис. 1). Напротив, при заражении трансгенных мышей K18-hACE2 дозой 103,5 ТЦИД50 на 7-й день после инфицирования 3 из 7 животных погибли, а у оставшихся 4 фиксировалось тяжёлое состояние (низкая температура, невозможность принимать пищу и воду, потеря способности к движению) и потеря около 25% первоначальной массы. В связи с этим на основании Правил обращения с лабораторными животными они были гуманно умерщвлены и рассматривались как умершие в этот день. Таким образом, гибель всех животных в этой группе на 7-й день после заражения можно рассматривать как полную (100%,) потеря массы достигала максимума к этому дню, составляя примерно 25% (рис. 1).
Рис. 1. Показатели мышей линий BALB/c и K18-hACE2, заражённых штаммами Dubrovka и LIA: а – масса тела (линия показывает значение массы M ± SD); б – выживаемость; в – средние значения концентраций РНК SARS-CoV-2 в тканях различных органов мышей линии BALB/c, зараженных штаммами Dubrovka и LIA; г – инфекционный титр вируса (lg ТЦИД50/мл) и содержание вирусной РНК (lg копий РНК/мл) SARS-CoV-2 штамма Dubrovka в лёгких мышей K18-hACE2 на 4-й и 7-й день после инфицирования.
Изучение органов животных, взятых на 4-й день после инфицирования штаммом LIA (омикрон-подобным), выявило высокое содержание вирусной РНК в лёгких, тканях сердца, головного мозга и крови (на уровне 5,0–7,0 lg копий РНК/мл). При заражении штаммом Dubrovka (Ухань-подобным) вирусная РНК у мышей была преходящей: 2,1–2,5 lg копий РНК/мл Dubrovka против более 6 lg копий РНК/мл LIA на 4-й день после инфекции и не обнаруживалась в лёгких уже на 7-й день после заражения (рис. 1). Также не было выявлено вируса в тканях головного мозга и в крови. Напротив, при заражении этим же штаммом трансгенных мышей K18-hACE2, взятых в качестве контроля, титр вируса в лёгких был наибольшим на 4-й день после инфицирования (на 7-й день после инфекции титр был ниже, оставаясь относительно высоким – 6,9 ± 0,69 lg ТЦИД50 / 0,1 мл против 4,9 ± 0,57 lg ТЦИД50 / 0,1 мл). Высокие титры вируса в лёгких и других органах трансгенных мышей K18-hACE2 при заражении штаммом Dubrovka (Ухань-подобным) свидетельствуют об остром развитии системной инфекции, которая закончилась смертью животных.
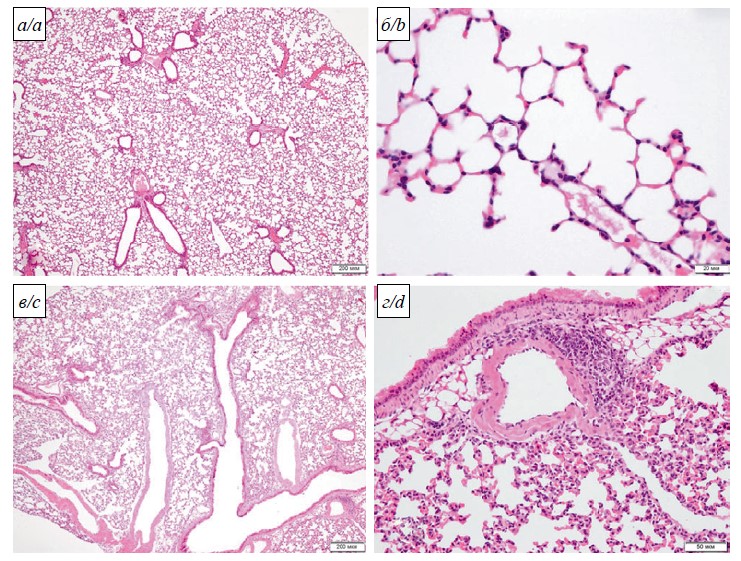
Гистологическое исследование показало, что гистоструктура лёгких мышей BALB/c, инфицированных штаммом Dubrovka (Ухань-подобным), в целом соответствовала таковой у интактных мышей (рис. 2). Однако в лёгких мышей этой группы чаще, чем у незаражённых животных, встречались небольшие скопления лимфоцитов, располагавшиеся в стенке бронхов либо периваскулярно (рис. 2 в, г). Эти слабо выраженные воспалительные изменения, вероятно, являются иммунным ответом на антигенную стимуляцию и не оказывают значительного повреждающего действия. Несмотря на высокое содержание вируса в лёгких, при заражении мышей BALB/c вариантом LIA (омикрон-подобным) в различных дозах (от 103,5 до 104,5 lg ТЦИД50) признаки развития интерстициальной (вирусной) пневмонии, так же как и в случае заражения штаммом Dubrovka (Ухань-подобный), не обнаружены.
Рис. 2. Морфологическая характеристика лёгких интактных (а, б) и инфицированных штаммом Dubrovka (Ухань-подобным) (в, г) мышей линии BALB/c: а – просветы бронхов и бронхиол свободные, паренхима органа выглядит воздушной; б – просветы альвеол равномерно воздушные, межальвеолярные перегородки тонкие, сосуды и капилляры умеренно полнокровны; в – гистоструктура лёгкого соответствует варианту нормы; г – небольшое лимфоидное скопление (бронхо-ассоциированная лимфоидная ткань) в области контакта бронха и кровеносного сосуда. Увеличение: а, в – ×40; б – ×400; г – ×200; окрашивание: гематоксилин и эозин.
Сравнительное изучение патогенеза инфекции у золотистых сирийских хомяков при заражении их вариантами SARS-CoV-2 Dubrovka (Ухань-подобным) и LIA (омикрон-подобным)
Интраназальное заражение сирийских хомяков штаммом Dubrovka (Ухань-подобным) в дозе 104,5 ТЦИД50 вызывало снижение массы животных на 8–10% без проявления явных клинических признаков заболевания и смертности (рис. 3). Вирусологическое изучение органов хомяков , зараженных штаммом Dubrovka (Ухань-подобный), взятых на 4-й день после инфицирования, выявило высокую концентрацию РНК SARS-CoV-2 в лёгких (8,2 lg копий РНК/мл) и тканях головного мозга (7,7 lg копий РНК/мл). Кроме того, РНК надёжно определялась в тканях сердца и в крови (на уровне 6,5-6,7 lg копий РНК/мл) (рис. 3).
Заражение сирийских хомяков штаммом LIA (омикрон-подобным) в различных дозах (от 103,5 до 104,5 ТЦИД50) не вызывало видимых признаков заболевания и потери массы у животных (рис. 3). При вирусологическом изучении лёгких в них обнаружился одинаково высокий, не зависящий от дозы заражения уровень вирусной РНК (около 9 lg копий РНК/мл), однако вирус в тканях головного мозга и других органах практически определялся (рис. 3).
Рис. 3. Показатели золотистых сирийских хомяков, заражённых штаммами Dubrovka и LIA: a – масса тела (линия показывает значение массы M ± SD); б – средние значения концентраций РНК SARS-CoV-2 в тканях различных органов.
Макроскопическое сравнение лёгких сирийских хомяков выявило у инфицированных штаммом Dubrovka (Ухань-подобным) скопления и (или) кровоизлияния, которые отсутствовали у инфицированных LIA (омикрон-подобным). На микроскопическом уровне в гистологических препаратах лёгких у всех животных, инфицированных штаммом Dubrovka (Ухань-подобным), наблюдали выраженные воспалительные изменения, морфологическая картина которых соответствовала вирусной пневмонии. В некоторых долях лёгких площадь обширных сливных безвоздушных зон и прилегающих к ним участков со сниженной воздушностью, оценённая на качественном уровне, достигала 80% от площади доли (рис. 4 а, б). Воспалительные изменения в стенке бронхов и бронхиол, расположенных в очагах пневмонии, были незначительными. Лимфогистиоцитарный инфильтрат редко проникал глубже их адвентициальной оболочки. В их просвете содержались немногочисленные десквамированные эпителиоциты, единичные макрофаги и нейтрофилы. Сосуды в очагах пневмонии были полнокровны, окружены умеренно выраженным воспалительным инфильтратом из диффузно рассеянных лимфоцитов, гистиоцитов и небольшой примеси полиморфноядерных лейкоцитов. Наблюдали выраженный периваскулярный отёк.
Окружающая паренхима в лёгких животных, инфицированных штаммом Dubrovka (Ухань-подобным), представляла собой безвоздушные поля, в которых просвет альвеол не определялся, межальвеолярные перегородки были разрушены за счёт воспалительного инфильтрата, интерстициального отёка и гибели респираторного эпителия. Воспалительный инфильтрат состоял из гистиоцитов, лимфоцитов, единичных нейтрофилов, среди них были видны остатки ядер погибших клеток, островки пролиферирующего респираторного эпителия и фибробласты. Сосуды и капилляры были в состоянии резкого полнокровия. В прилегающих участках паренхимы со сниженной воздушностью отмечено утолщение межальвеолярных перегородок за счёт полнокровия микрососудов, интерстициального отёка и лимфогистиоцитарного инфильтрата. Просветы альвеол в этих участках содержали отёчную жидкость, эритроциты, единичные десквамированные альвеолоциты, макрофаги, лимфоциты, редко нити фибрина.
В лёгких всех хомяков, заражённых штаммом LIA (омикрон-подобным) в наиболее высокой из всех изученных доз (104,5 ТЦИД50), также развивались выраженные альтеративно-воспалительные изменения, соответствовавшие интерстициальной (вирусной) пневмонии, морфологическая картина которой была идентична таковой при заражении штаммом Dubrovka (Ухань-подобным). Однако в этом случае площадь крупных очагов пневмонии была значительно меньше, чем при заражении штаммом Dubrovka (Ухань-подобным) (не более 30–50% от площади гистологических срезов наиболее поражённых долей при заражении штаммом LIA (омикрон-подобным) против 80% при заражении штаммом Dubrovka (Ухань-подобным) (рис. 4). Несмотря на то что содержание вируса в лёгких хомяков, заражённых штаммом LIA (омикрон-подобным), при всех дозах заражения было примерно одинаковым, при гистологическом изучении было выявлено, что общая площадь очагов пневмонии, оценённая на качественном уровне, снижалась с уменьшением дозы заражения и составляла не более 15–20 и 5% от общей площади гистологического среза долей при заражении дозами 104 и 103,5 ТЦИД50 соответственно.
Рис. 4. Альтеративно-воспалительные изменения в лёгких сирийских хомяков на 4-е сутки после инфицирования SARS-CoV-2 штаммом Dubrovka (Ухань-подобным): а – сливные очаги вирусной пневмонии; б – перибронхиальный безвоздушный очаг пневмонии: просвет бронха свободный; эпителиальная выстилка сохранена, слабая воспалительная инфильтрация стенки бронха; в прилегающей паренхиме межальвеолярные перегородки разрушены за счёт воспалительного инфильтрата, отёка и гибели респираторного эпителия; в – участок паренхимы лёгкого со сниженной воздушностью: выраженный периваскулярный отёк, просветы альвеол щелевидные, в них отёчная жидкость, десквамированный эпителий, макрофаги, эритроциты, лимфоциты; г – участок паренхимы лёгкого со сниженной воздушностью: интраальвеолярный отёк, интраальвеолярные кровоизлияния, утолщённые за счёт лимфогистиоцитарного инфильтрата и интерстициального отёка, межальвеолярные перегородки, резкое полнокровие капилляров. Увеличение: а – ×40, в – ×200, б, г – ×400; окрашивание: гематоксилин и эозин.
Обсуждение
Ранее было показано, что различные линии инбредных мышей не восприимчивы к первоначальному штамму SARS-CoV-2, вызвавшему COVID-19. Ключевым рецептором при взаимодействии с SARS-CoV-2 у людей является ACE2, взаимодействие с которым происходит через рецептор-связывающий домен (RBD) S-белка вируса SARS-CoV-2. Мышиный ACE2 (mACE2) не допускает заражения SARS-CoV-2, что явилось основанием для использования специальной модельной трансгенной мыши K18-hACE2, экспрессирующей рецептор ACE2, аналогичный человеческому (hACE2) [23]. Полученные нами вирусологические и патологические характеристики показали, что штамм Dubrovka (Ухань-подобный) не вызывает продуктивной инфекции у мышей BALB/c, что совпадает с предыдущими исследованиями [24–27]. Напротив, при заражении штаммом LIA (омикрон-подобным) у мышей BALB/c наблюдалось размножение вируса в лёгких, тканях головного мозга, сердца, в крови. Важным аспектом этой инфекции являлось отсутствии смертности, явных клинических и неврологических проявлений и повреждения лёгких, выявляемых в гистологических исследованиях, в отличие от трансгенных мышей, экспрессирующих hACE2, у которых при заражении штаммом Dubrovka (Ухань-подобным) развилось тяжёлое клиническое течение, приводящее к смерти. Показано, что вариант омикрон также патогенен для трансгенных мышей K18-hACE2, однако потеря массы, смертность, воспалительные реакции выражены слабее, чем при инфицировании вариантом Ухань [29]. Наши результаты подтверждают данные об адаптации вируса к мышам, однако механизм этого процесса остаётся невыясненным. Молекулярные и генетические исследования показали, что наличие мутаций в S-гене у варианта BA.1 (омикрон) приводит к повышенному сродству только с рецептором mACE2, что даёт основание предполагать, что пониженная вирулентность этого штамма, вероятно, связана, помимо сродства RBD с ACE2, с другими факторами, в частности с более низкой фузогенностью [32, 33].
В наших экспериментах при параллельном моделировании инфекции обоими штаммами у сирийских хомяков мы не обнаружили значительных различий в концентрации вирусной РНК в лёгких на 4-й день после инфицирования. Однако у хомяков, инфицированных штаммом Dubrovka (Ухань-подобным), по данным гистологических исследований поражения лёгких были значительнее, наблюдались потеря массы и распространение вируса по органам. Наиболее значимым отличием между вариантами в модели сирийских хомяков было наличие инфекции в тканях головного мозга при заражении штаммом Dubrovka (Ухань-подобным), в то время как при заражении штаммом LIA (омикрон-подобным) вирус в тканях головного мозга не определялся. Таким образом, в отличие от мышиной модели, у сирийских хомяков штамм Dubrovka (Ухань-подобный) был более вирулентным, чем штамм LIA (омикрон-подобный), что сопоставимо с более лёгким течением болезни у людей, инфицированных коронавирусом BA.1 (омикрон).
Интересным фактом является то, что, несмотря на активное размножение вируса в лёгких сирийских хомяков при заражении обоими штаммами и мышей линии BALB/c при инфицировании штаммом LIA (омикрон-подобным), у заражённых животных не наблюдаются смертность и явные клинические и неврологические симптомы заболевания, что может быть обусловлено быстрым и эффективным иммунным ответом [34] или неспособностью вируса поддерживать множественные циклы репликации. Для лучшего понимания этого процесса необходимы дальнейшее изучение гуморального и клеточного иммунитета в этих моделях, корреляция их с вирусологическими, патоморфологическими, клиническими характеристиками и исследованиями у людей.
Заключение
Доброкачественное течение болезни, при которой, однако, фиксируется размножение вируса в лёгких, приводящее к развитию вирусной пневмонии, наблюдаемое нами на моделях сирийских хомяков и мышей линии BALB/c, сопоставимо с инфекцией, вызванной SARS-CoV-2 на других моделях животных, в частности у приматов и хорьков. Благоприятный исход заболевания как в этих моделях, так и у людей в конечном счёте устраняется действием иммунного ответа [34]. Наши данные об адаптации омикрон-подобного штамма SARS-CoV-2 к мышам в совокупности с этим обстоятельством вызывают опасения по поводу распространения тропизма новых вариантов к новым хозяевам, которые изначально были невосприимчивы к данной инфекции. Это создаёт потенциальный риск возникновения новых зоонозных резервуаров и распространения новых вариантов у людей, что диктует необходимость постоянного мониторинга возникающих вариантов SARS-CoV-2.
Участие авторов. Все авторы внесли существенный вклад в проведении экспериментов, поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Финансирование. Исследование выполнено за счет государственного бюджета.
Благодарность. Исследование выполнено с использованием оборудования Центра коллективного пользования ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Этическое утверждение. Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus Author Guidelines for Animal Use (IAVES, 23 July, 2010). Протокол исследования одобрен Этическим комитетом организации (протокол № 11 от 01.12.2021).
Об авторах
Ирина Анатольевна Ленева
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Автор, ответственный за переписку.
Email: wnyfd385@yandex.ru
ORCID iD: 0000-0002-7755-2714
д.б.н., зав. лаб. экспериментальной вирусологии
Россия, 105064, г. МоскваДарья Ильинична Смирнова
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: daria.sm.1995@mail.ru
ORCID iD: 0000-0001-7325-0834
м.н.с., лаб. молекулярной вирусологии
Россия, 105064, г. МоскваНадежда Павловна Карташова
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: nadezdakartasova10571@gmail.com
ORCID iD: 0000-0003-2096-5080
н.с. лаб. экспериментальной вирусологии
Россия, 105064, г. МоскваАнастасия Вячеславовна Грачева
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: anastasiia.gracheva.95@mail.ru
ORCID iD: 0000-0001-8428-4482
м.н.с., лаб. молекулярной вирусологии
Россия, 105064, г. МоскваАнна Валерьевна Иванина
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: ivanina.anna97@mail.ru
ORCID iD: 0000-0002-7289-693X
лаборант-исследователь лаб. экспериментальной вирусологии
Россия, 105064, г. МоскваЕкатерина Андреевна Глубокова
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: eaglubokova@yandex.ru
ORCID iD: 0000-0002-5925-9733
м.н.с., лаб.экспериментальной вирусологии
Россия, 105064, г. МоскваЕкатерина Романовна Корчевая
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: c.korchevaya@gmail.com
ORCID iD: 0000-0002-6417-3301
м.н.с., лаб. молекулярной вирусологии
Россия, 105064, г. МоскваАндрей Александрович Панкратов
ФГБУ «Московский научно-исследовательский онкологический институт имени П.А. Герцена» Минздрава России
Email: andreimnioi@yandex.ru
ORCID iD: 0000-0001-7291-9743
к.б.н., зав. отделением экспериментальной фармакологии и токсикологии
Россия, 125284, г. МоскваГалина В. Трунова
ФГБУ «Московский научно-исследовательский онкологический институт имени П.А. Герцена» Минздрава России
Email: gtrunovamnioi@mail.ru
ORCID iD: 0000-0003-2917-4496
к.б.н., старший научный сотрудник отделения экспериментальной фармакологии и токсикологии
Россия, 125284, г. МоскваВарвара А. Хохлова
ФГБУ «Московский научно-исследовательский онкологический институт имени П.А. Герцена» Минздрава России
Email: nostocus@yandex.ru
ORCID iD: 0000-0002-0339-2068
младший научный сотрудник отделения экспериментальной фармакологии и токсикологии
Россия, 125284, г. МоскваОксана Анатольевна Свитич
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: svitichoa@yandex.ru
ORCID iD: 0000-0003-1757-8389
д.м.н., проф., член-корр. РАН, зав. лаб. молекулярной иммунологии, директор
Россия, 105064, г. МоскваВиталий Васильевич Зверев
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: vitalyzverev@outlook.com
ORCID iD: 0000-0001-5808-2246
д.б.н., проф., академик РАН, зав. лаб. молекулярной биотехнологии
Россия, 105064, г. МоскваЕвгений Бахтиерович Файзулоев
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: faizuloev@mail.ru
ORCID iD: 0000-0001-7385-5083
к.б.н., зав. лаб. молекулярной вирусологии
Россия, 105064, г. МоскваСписок литературы
- Holmes E.C., Goldstein S.A., Rasmussen A.L., Robertson D.L., Crits-Christoph A., Wertheim J.O., et al. The origins of SARS-CoV-2: A critical review. Cell. 2021; 184(19): 4848–56. https://doi.org/10.1016/j.cell.2021.08.017
- Rasmussen A.L. On the origins of SARS-CoV-2. Nat. Med. 2021; 27(1): 9. https://doi.org/10.1038/s41591-020-01205-5
- Trinité B., Pradenas E., Marfil S., Rovirosa C., Urrea V., TarrésFreixas F., et al. Previous SARS-CoV-2 infection increases B.1.1.7 cross-neutralization by vaccinated individuals. Viruses. 2021; 13(6): 1135. https://doi.org/10.3390/v13061135
- Wang P., Nair M.S., Liu L., Iketani S., Luo Y., Guo Y., et al. Antibody resistance of SARS-CoV-2 variants B.1.351 and B.1.1.7. Nature. 2021; 593(7857): 130–5. https://doi.org/10.1038/s41586-021-03398-2
- Mullen J.L., Tsueng G., Latif A.A., Alkuzweny M., Cano M., Haag E., et al. Center for Viral Systems Biology. Outbreak.info. 2020. Available at: https://outbreak.info/
- Wang R., Chen J., Gao K., Hozumi Y., Yin C., Wei G.W. Analysis of SARS-CoV-2 mutations in the United States suggests presence of four substrains and novel variants. Commun. Biol. 2021; 4(1): 228. https://doi.org/10.1038/s42003-021-01754-6
- Dejnirattisai W., Zhou D., Supasa P., Liu C., Mentzer A.J., Ginn H.M., et al. Antibody evasion by the P.1 strain of SARS-CoV-2. Cell. 2021; 184(11): 2939–54.e9. https://doi.org/10.1016/j.cell.2021.03.055
- Planas D., Bruel T., Grzelak L., Guivel-Benhassine F., Staropoli I., Porrot F., et al. Sensitivity of infectious SARS-CoV-2 B.1.1.7 and B.1.351 variants to neutralizing antibodies. Nat. Med. 2021; 27(5): 917–24. https://doi.org/10.1038/s41591-021-01318-5
- Dhar M.S., Marwal R., Vs R., Ponnusamy K., Jolly B., Bhoyar R.C., et al. Genomic characterization and epidemiology of an emerging SARS-CoV-2 variant in Delhi, India. Science. 2021; 374(6570): 995–9. https://doi.org/10.1126/science.abj9932
- Parums D. Editorial: Revised World Health Organization (WHO) terminology for variants of concern and variants of interest of SARS-CoV-2. Med. Sci. Monit. 2021; 27: e933622. https://doi.org/10.12659/MSM.933622
- Karim S.S.A., Karim Q.A. Omicron SARS-CoV-2 variant: a new chapter in the COVID-19 pandemic. Lancet. 2021; 398(10317): 2126–8. https://doi.org/10.1016/S0140-6736(21)02758-6
- Allen H., Tessier E., Turner C., Anderson C., Blomquist P., Simons D., et al. Comparative transmission of SARS-CoV-2 Omicron (B.1.1.529) and Delta (B.1.617.2) variants and the impact of vaccination: national cohort study, England. medRxiv. 2022. Preprint. https://doi.org/10.1101/2022.02.15.22271001
- Lambrou A.S., Shirk P., Steele M.K., Paul P., Paden C.R., Cadwell B., et al. Genomic surveillance for SARS-CoV-2 variants: Predominance of the Delta (B.1.617.2) and omicron (B.1.1.529) variants – United States, June 2021 – January 2022. MMWR Morb. Mortal. Wkly Rep. 2022; 71(6): 206–11. https://doi.org/10.15585/mmwr.mm7106a4
- Petersen E., Ntoumi F., Hui D.S., Abubakar A., Kramer L.D., Obiero C., et al. Emergence of new SARS-CoV-2 Variant of Concern Omicron (B.1.1.529) – highlights Africa’s research capabilities, but exposes major knowledge gaps, inequities of vaccine distribution, inadequacies in global COVID-19 response and control efforts. Int. J. Infect. Dis. 2022; 114: 268–72. https://doi.org/10.1016/j.ijid.2021.11.040
- Andrews N., Stowe J., Kirsebom F., Toffa S., Rickeard T., Gallagher E., et al. Covid-19 vaccine effectiveness against the omicron (B.1.1.529) variant. N. Engl. J. Med. 2022; 386(16): 1532–46. https://doi.org/10.1056/NEJMoa2119451
- Grabowski F., Kochańczyk M., Lipniacki T. The spread of SARS-CoV-2 variant omicron with a doubling time of 2.0-3.3 days can be explained by immune evasion. Viruses. 2022; 14(2): 294. https://doi.org/10.3390/v14020294
- Liu L., Iketani S., Guo Y., Chan J.F.W., Wang M., Liu L., et al. Striking antibody evasion manifested by the Omicron variant of SARS-CoV-2. Nature. 2022; 602(7898): 676–81. https://doi.org/10.1038/s41586-021-04388-0
- Planas D., Saunders N., Maes P., Guivel-Benhassine F., Planchais C., Buchrieser J., et al. Considerable escape of SARS-CoV-2 Omicron to antibody neutralization. Nature. 2022; 602(7898): 671–5. https://doi.org/10.1038/s41586-021-04389-z
- Conceicao C., Thakur N., Human S., Kelly J.T., Logan L., Bialy D., et al. The SARS-CoV-2 Spike protein has a broad tropism for mammalian ACE2 proteins. PLoS Biol. 2020; 18(12): e3001016. https://doi.org/10.1371/journal.pbio.3001016
- Liu Y., Hu G., Wang Y., Ren W., Zhao X., Ji F., et al. Functional and genetic analysis of viral receptor ACE2 orthologs reveals a broad potential host range of SARS-CoV-2. Proc. Natl Acad. Sci. USA. 2021; 118(12): e2025373118. https://doi.org/10.1073/pnas.2025373118
- Gretebeck L.M., Subbarao K. Animal models for SARS and MERS coronaviruses. Curr. Opin. Virol. 2015; 13: 123–9. https://doi.org/10.1016/j.coviro.2015.06.009
- Garry R.F. Mutations arising in SARS-CoV-2 spike on sustained human-to-human transmission and human-to-animal passage. Virological. 2021. Available at: https://virological.org/t/mutations-arising-in-sars-cov-2-spike-on-sustained-human-to-human-transmission-and-human-to-animal-passage/578/14
- Bao L., Deng W., Huang B., Gao H., Liu J., Ren L., et al. The pathogenicity of SARS-CoV-2 in hACE2 transgenic mice. Nature. 2020; 583(7818): 830–3. https://doi.org/10.1038/s41586-020-2312-y
- Kant R., Kareinen L., Smura T., Freitag T.L., Jha S.K., Alitalo K., et al. Common laboratory mice are susceptible to infection with the SARS-CoV-2 beta variant. Viruses. 2021; 13(11): 2263. https://doi.org/10.3390/v13112263
- Montagutelli X., Prot M., Levillayer L., Salazar E.B., Jouvion G., Conquet L., et al. bioRxiv. 2021. Preprint. https://doi.org/10.1101/2021.03.18.436013
- Shuai H., Chan J.F.W., Yuen T.T.T., Yoon C., Hu J.C., Wen L., et al. Emerging SARS-CoV-2 variants expand species tropism to murines. EBioMedicine. 2021; 73: 103643. https://doi.org/10.1016/j.ebiom.2021.103643
- Zhang Y.N., Zhang Z.R., Zhang H.Q., Li N., Zhang Q.Y., Li X.D., et al. Different pathogenesis of SARS-CoV-2 Omicron variant in wild-type laboratory mice and hamsters. Signal Transduct. Target. Ther. 2022 Feb 25; 7(1): 62. https://doi.org/10.1038/s41392-022-00930-2
- Imai M., Iwatsuki-Horimoto K., Hatta M., Loeber S., Halfmann PJ., Nakajima N., et al. Syrian hamsters as a small animal model for SARS-CoV-2 infection and countermeasure development. Proc. Natl Acad. Sci USA. 2020; 117(28): 16587–95. https://doi.org/10.1073/pnas.2009799117
- Грачёва А.В., Корчевая Е.Р., Кудряшова А.М., Борисова О.В., Петруша О.А., Смирнова Д.И. и др. Адаптация МТТ-теста для определения нейтрализующих антител к вирусу SARS-CoV-2. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021; 98(3): 253–65. https://doi.org/10.36233/0372-9311-136
- Ramakrishnan M.A. Determination of 50% endpoint titer using a simple formula. World J. Virol. 2016; 5(2): 85–6. https://doi.org/10.5501/wjv.v5.i2.85
- Gracheva A.V., Korchevaya E.R., Ammour Y.I., Smirnova D.I., Sokolova O.S., Glukhov G.S., et al. Immunogenic properties of SARS-CoV-2 inactivated by ultraviolet light. Arch. Virol. 2022; 167(11): 2181–91. https://doi.org/10.1007/s00705-022-05530-7
- Meng B., Abdullahi A., Ferreira I.A.T.M., Goonawardane N., Saito A., Kimura I., et al. Altered TMPRSS2 usage by SARS-CoV-2 Omicron impacts infectivity and fusogenicity. Nature. 2022; 603(7902): 706–14. https://doi.org/10.1038/s41586-022-04474-x
- Suzuki R., Yamasoba D., Kimura I., Wang L., Kishimoto M., Ito J., et al. Attenuated fusogenicity and pathogenicity of SARS-CoV-2 Omicron variant. Nature. 2022; 603(7902): 700–5. https://doi.org/10.1038/s41586-022-04462-1
- Kim Y.I., Kim S.G., Kim S.M., Kim E.H., Park S.J., Yu K.M., et al. Infection and rapid transmission of SARS-CoV-2 in ferrets. Cell Host Microbe. 2020; 27(5): 704–9.e2. https://doi.org/10.1016/j.chom.2020.03.023
Дополнительные файлы