Моделирование смешанной инфекции вирусами Зика и Западного Нила (Flaviviridae: Orthoflavivirus: Orthoflavivirus zikaense, Orthoflavivirus nilense) in vitro и in vivo
- Авторы: Святченко В.А.1, Протопопова Е.В.1, Легостаев С.С.1, Микрюкова Т.П.1, Агафонов А.П.1, Локтев В.Б.1
-
Учреждения:
- ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
- Выпуск: Том 70, № 4 (2025)
- Страницы: 340-348
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16766
- DOI: https://doi.org/10.36233/0507-4088-324
- EDN: https://elibrary.ru/gkebwv
- ID: 16766
Цитировать
Аннотация
Введение. Заболевания человека, вызываемые вирусами Западного Нила (ВЗН) и Зика и передающиеся через укус комара, широко распространены на разных континентах и обусловливают крупные вспышки. Ареалы этих вирусов перекрываются, что создает возможность возникновения микст-инфекций. Знания о подобных микст-инфекциях ограничены.
Цель исследования. Провести изучение особенностей протекания микст-инфекции ВЗН и вируса Зика in vitro и in vivo с целью оценки их возможной интерференции и/или усиления инфекции.
Материалы и методы. В работе использовали штаммы Влг27924 и MR766 ВЗН и вируса Зика соответственно. Инфекционную активность вирусов при моно- и коинфицировании определяли на культуре клеток Vero E6 с помощью полимеразной цепной реакции с обратной транскрипцией, а также на мышах линии BALB/c.
Результаты. При исследовании коинфицирования ВЗН и вирусом Зика in vitro показано, что совместное инфицирование приводит к интерференции, при этом степень конкурентного ингибирования репликации более выражена в отношении вируса Зика (в 1000 раз и более) при сравнении с моноинфекцией. При одновременном инфицировании мышей вирус Зика не влияет на развитие летальной инфекции, вызванной ВЗН. Однако предварительное (за 4 и 20 сут) инфицирование сублетальной дозой вируса Зика достоверно защищает животных от последующего введения 10 и 100 ЛД50 ВЗН. У предварительно инфицированных вирусом Зика коинфицированных животных зарегистрировано появление специфичных к ВЗН вируснейтрализующих антител в более высоком титре, чем у моноинфицированных ВЗН особей.
Заключение. Показано наличие интерференции in vitro между исследованными ортофлавивирусами, наиболее выраженной в отношении вируса Зика. При одновременном инфицировании мышей вирус Зика не влияет на течение и исход инфекционного процесса, вызванного ВЗН. Предварительное инфицирование мышей вирусом Зика обеспечивает защиту животных от летальной инфекции ВЗН, праймируя индукцию более высокого уровня вируснейтрализующих антител.
Ключевые слова
Полный текст
Введение
Многие РНК-содержащие ортофлавивирусы, относящиеся к семейству Flaviviridae (Riboviria; Orthornavirae; Kitrinoviricota; Flasuviricetes; Amarillovirale; Flaviviridae; Orthoflavivirus), вызывают тяжелые заболевания человека [1]. В настоящее время ортофлавивирусы распространены практически повсеместно, формируют природные очаги инфекций, захватывающие подчас целые регионы и континенты, и вызывают глобальные вспышки заболеваний человека [2, 3]. Принято выделять так называемые большие флавивирусные инфекции, которые вызывают вирусы денге, японского энцефалита, Западного Нила (ВЗН), желтой лихорадки и Зика и с которыми ассоциируется десятки миллионов случаев инфицирования человека [4]. Начало глобальной вспышки лихорадки Западного Нила, ассоциированной с генотипом 1а ВЗН, связывают со вспышками заболевания в 1999 г. в США и России [5]. В течение последующих нескольких лет эта инфекция распространилась практически на всех континентах [6–8]. Быстрое распространение инфекции было связано c различными видами диких птиц и комарами рода Culex (Linnaeus, 1758). В РФ постоянно циркулируют ВЗН 1-го и 2-го генотипов в центральной и южной европейской части России, на юге Западной Сибири и в Дальневосточном регионе [6, 7]. Комары Culex pipiens, так же как C. tarsalis и C. Quinquefasciatus, считаются основными векторами для распространения ВЗН в разных регионах мира.
Первоначально вирус Зика был выделен в Уганде в 1947 г. и был ассоциирован с комарами рода Aedes [9]. Позднее его циркуляция была описана в странах бассейна Индийского океана, и в 1966 г. был выделен азиатский генотип вируса Зика [10]. Фактически повсеместное распространение лихорадки Зика началось в 2007 г., и в 2015–2016 гг. заболевание стали регистрировать в странах Центральной и Южной Америки. К концу 2023 г. эта инфекция была зарегистрирована более чем в 92 странах, не считая стран, включая Россию, в которых были выявлены завозные случаи заболевания. Принципиальным вектором для распространения лихорадки Зика считаются комары Aedes aegypti и Ae. albopictus, однако и другие комары рода Aedes могут вовлекаться в распространение вируса Зика [10].
Ортофлавивирусы, как и другие возбудители арбовирусных инфекций, передаются через укусы комаров, которые могут быть заражены сразу несколькими видами патогенов [11]. Так, комары Ae. aegypti и Ae. albopictus были одновременно экспериментально инфицированы вирусами Зика, денге и чикунгунья [12]. Известны случаи микст-инфекций Зика/чикунгунья, Зика/денге, денге/чикунгунья, Зика/денге/чикунгунья у человека, ассоциированных с комарами [13–17]. Клиническая картина микст-инфекций, вызываемых ортофлавивирусами, может отличаться от моноинфекций, что затрудняет их диагностику и лечение. Важно отметить, что для ряда микст-инфекций характерно модулирование вирулентности вирусов, что может приводить к усилению (ослаблению) тяжести заболевания [18, 19]. Так, последовательное инфицирование различными субтипами вируса денге может вызывать резкое усиление тяжести заболевания человека, вплоть до летальных случаев [20]. Этот феномен обычно связывают с действием предсуществующих антител к другому субтипу вируса денге, что вызывает усиление тяжести повторного заболевания лихорадкой денге у человека.
Важность проблемы микст-инфекций обусловлена сложностью профилактики, диагностики и лечения подобных случаев. При этом информации о возникновении, особенностях протекания микст-инфекций и их последствиях в разных регионах мира недостаточно [21].
Целью настоящей работы является экспериментальное исследование особенностей протекания микст-инфекции ВЗН и вируса Зика in vitro и in vivo.
Материалы и методы
В экспериментах использовали ВЗН (штамм Влг27924) и вирус Зика (штамм MR766), полученные из Государственной коллекции возбудителей вирусных инфекций и риккетсиозов ФБУН ГНЦ ВБ «Вектор». Вирусы культивировали на монослойных клеточных культурах Vero E6 и СПЭВ (культура клеток почечной ткани эмбриона свиньи), выращенных до образования 80‒90% конфлюэнтности в среде DMEM F12 (Gibco, США), содержащей 10% фетальной бычьей сыворотки (Gibco, США), пенициллина 100 МЕ/мл и стрептомицина 100 мкг/мл (Gibco, США), в атмосфере с 5% CO2 при температуре 37 °С. Инфекционную активность вирусных препаратов определяли титрованием микрометодом на 96-луночных культуральных планшетах (Greiner, Австрия) с субконфлюэнтным монослоем клеток, как описано ранее [22, 23]. Учет результатов проводили с помощью микроскопии через 6 сут по развитию ЦПД (цитопатогенного действия) и/или с использованием МТТ-теста. Расчет инфекционных титров вирусов осуществляли по методу Спирмена‒Кербера и выражали через lg ТЦД50 (50% тканевая цитопатогенная доза). Вирусные препараты хранили при температуре −80 °C.
Исследование эффектов коинфицирования in vitro проводили с использованием клеток Vero E6 при одновременном и последовательном (с различной очередностью) инфицировании клеточных культур ВЗН и вирусом Зика. Инфицированные клеточные культуры (по три повтора на экспериментальную точку) в 24-луночных культуральных планшетах (Greiner, Австрия) инкубировали при 37 °C в CO2-инкубаторе; через разный период времени отбирали пробы для определения вирусной нагрузки с помощью полимеразной цепной реакции (ПЦР) с обратной транскрипцией (ОТ-ПЦР), как описано нами ранее [24]. В качестве контролей использовали моноинфицированные клеточные культуры. РНК из образцов извлекали с использованием набора РНК Рибо-ПРЕП (ФБУН ЦНИИЭ Роспотребнадзора, Москва). Для определения вирусных РНК применяли наборы реагентов для выявления РНК ВЗН и вируса Зика (ФБУН ГНЦ ВБ «Вектор», Кольцово, Новосибирская обл.) методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени, используя праймеры, специфичные к 3’-UTR и гену NS5 соответственно. Контроль специфичности осуществляли с использованием вирусных суспензий содержащих 106 ТЦД50/мл ВЗН либо вируса Зика. Отсутствие значимого влияния одного вируса на количественность детекции другого в смеси подтверждено модельным экспериментом (рис. S1, дополнительные материалы). Регистрацию результатов проводили с помощью прибора CFX 96 (Bio-Rad, США). Стандартные кривые были получены с помощью 10-кратного серийного разбавления образцов внутреннего положительного контроля (IPCS), поставляемых с соответствующим набором для ПЦР (от 106 до 0,1 копий/реакция). Значения Ct образцов были получены по двум флуоресцентным каналам, для вирусной кДНК и для IPCS. Значения Ct вирусной кДНК были масштабированы относительно значений Ct IPCS [25].
Инфицирование мышей BALB/c массой 10–12 г осуществляли посредством интраперитонеального введения 200 мкл вируссодержащей суспензии, контрольным животным вводили аналогичный объем физиологического раствора. При исследовании смешанного инфицирования использовали следующие экспериментальные схемы: моноинфицирование животных вирусом Зика и ВЗН; одновременное введение вируса Зика и ВЗН; последовательное введение (вирус Зика и через 4 сут ВЗН; вирус Зика и через 20 сут ВЗН). В качестве групп сравнения использовали моноинфицированных ВЗН или вирусом Зика животных. В течение эксперимента состояние животных оценивали ежедневно. Животные содержались однополыми группами в индивидуально вентилируемых клетках (Animal Care Systems) в контролируемых условиях, при температуре 22–26 °C и относительной влажности 30–60%. Гранулированный корм и вода животным предоставлялись ad libitum.
Реакцию нейтрализации (РН) ВЗН или вируса Зика проводили микрометодом на клетках Vero E6 с использованием двукратных серийных разведений (начиная с 1 : 10) индивидуальных мышиных сывороток, прогретых при 56 °С в течение 30 мин [26]. За титры вируснейтрализующих антител принимали обратные величины разведения сывороток, полностью нейтрализующие инфекционную активность ВЗН или вируса Зика в дозе 50 ТЦД50.
Статистический анализ, включая расчет среднего значения, стандартного отклонения и коэффициента вариации среднего значения Ct, выполняли с помощью программы Excel (Microsoft Corp., США). Также статистическую обработку данных осуществляли с помощью статистической программы Statistica 12 (StatSoft Inc., США). Статистическую оценку различий между группами проводили с использованием t-критерия Стьюдента; значение p<0,05 считали значимым.
Эксперименты с инфекционным материалом проводили в соответствии с требованиями правил биобезопасности, регламентированных в СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней» от 28.01.2021. Инфицирование мышей ВЗН и вирусом Зика и все манипуляции с ними проводили в инфекционном виварии ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора в условиях BSL-3.
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus Author Guidelines for Animal Use (IAVES, 23.07.2010). Эксперименты с животными проводили с соблюдением принципов гуманности в соответствии с протоколом, утвержденным Биоэтическим комитетом ФБУН ГНЦ ВБ «Вектор» (Протокол № 2 от 03.04.2023).
Результаты
Микст-инфекция in vitro. Репликационную активность вирусов in vitro при микст-инфицировании в сравнении с моноинфицированием оценивали посредством определения вирусной нагрузки с помощью количественного ПЦР-анализа (табл. 1). Одновременное инфицирование приводило к выраженному ингибированию репликации вируса Зика, при отсутствии выраженного влияния коинфекции на накопление инфекционного ВЗН в инфицированных клетках (табл. 1 а). Последовательное инфицирование приводило к конкурентному ингибированию инфекционной активности вирусов, при этом степень конкурентного ингибирования существенно была более выражена для вируса Зика (табл. 1 б). Так, вирусная нагрузка вирусом Зика в клетках, предварительно инфицированных ВЗН и через 24 ч вирусом Зика, была более чем на 3 порядка ниже, чем в соответствующих моноинфицированных вирусом Зика клетках. В обратных экспериментах отличия в вирусной нагрузке ВЗН в микст-инфицированных и моноинфицированных ВЗН клетках не превышали 1,5 lg.
Таблица 1. Одновременное и последовательное инфицирование культуры клеток Vero E6 вирусом Западного Нила (ВЗН) и вирусом Зика (МОИ 0,5 ТЦД50)
Table 1. Simultaneous and sequential infection of Vero E6 cell culture with West Nile virus (WNV) and Zika virus (MOI 0.5 TCID50)
Одновременное инфицирование (а) Simultaneous infection (а) | ||||
Время после инфицирования Time post-infection | ВЗН (lg копий РНК/мл) WNV (log10 RNA copies/mL) | Вирус Зика (lg копий РНК/мл) Zika virus (log10 RNA copies/mL) | ВЗН/вирус Зика (lg копий РНК/мл) WNV/Zika virus (log10 RNA copies/mL) | |
24 ч / h | < 3,0 | < 3,0 | < 3,0/< 3,0 | |
48 ч / h | 4,3 ± 0,3 | 3,8 ± 0,2 | 4,0 ± 0,3/3,2 ± 0,2 | |
72 ч / h | 6,5 ± 0,4 | 5,7 ± 0,3 | 6,3 ± 0,4/3,5 ± 0,2 | |
96 ч / h | 8,1 ± 0,4 | 7,8 ± 0,3 | 7,7 ± 0,3/3,9 ± 0,3 | |
Последовательное инфицирование (б) Sequential infection (b) | ||||
ВЗН‒24 ч‒вирус Зика WNV‒24 hours‒Zika virus | PBS‒24 ч ‒вирус Зика PBS‒24 hours‒Zika virus | |||
Время после инфицирования вирусом Зика Time post-infection with Zika virus | ВЗН/вирус Зика (lg копий РНК/мл) WNV/ Zika virus (log10 RNA copies/mL) | Вирус Зика (lg копий РНК/мл) Zika virus (log10 RNA copies/mL) | ||
24 ч / h | 4,5 ± 0,3/< 3,0 | < 3,0 | ||
48 ч / h | 6,2 ± 0,4/3,2 ± 0,3 | 4,2 ± 0,2 | ||
72 ч / h | 7,4 ± 0,3/3,4 ± 0,3 | 6,9 ± 0,3 | ||
Вирус Зика‒24 ч‒ВЗН Zika virus‒24 hours‒WNV | PBS‒24 ч‒ВЗН PBS‒24 hours‒WNV | |||
Время после инфицирования ВЗН Time post-infection with WNV | Вирус Зика/ВЗН (lg копий/мл) Zika virus/WNV (log10 RNA copies/mL) | ВЗН (lg копий РНК/мл) WNV (log10 RNA copies/mL) | ||
24 ч / h | 3,5 ± 0,3/< 3,0 | < 3,0 | ||
48 ч / h | 5,1 ± 0,4/3,3 ± 0,3 | 4,2 ± 0,2 | ||
72 ч / h | 6,5 ± 0,4/5,0 ± 0,3 | 6,4 ± 0,2 | ||
Примечание. Значения представляют собой M ± SD трех независимых экспериментов. Для сравнения двух групп использовался t-критерий Стьюдента.
Note. Values represent M ± SD of three independent experiments. Student's t-test was used to compare two groups.
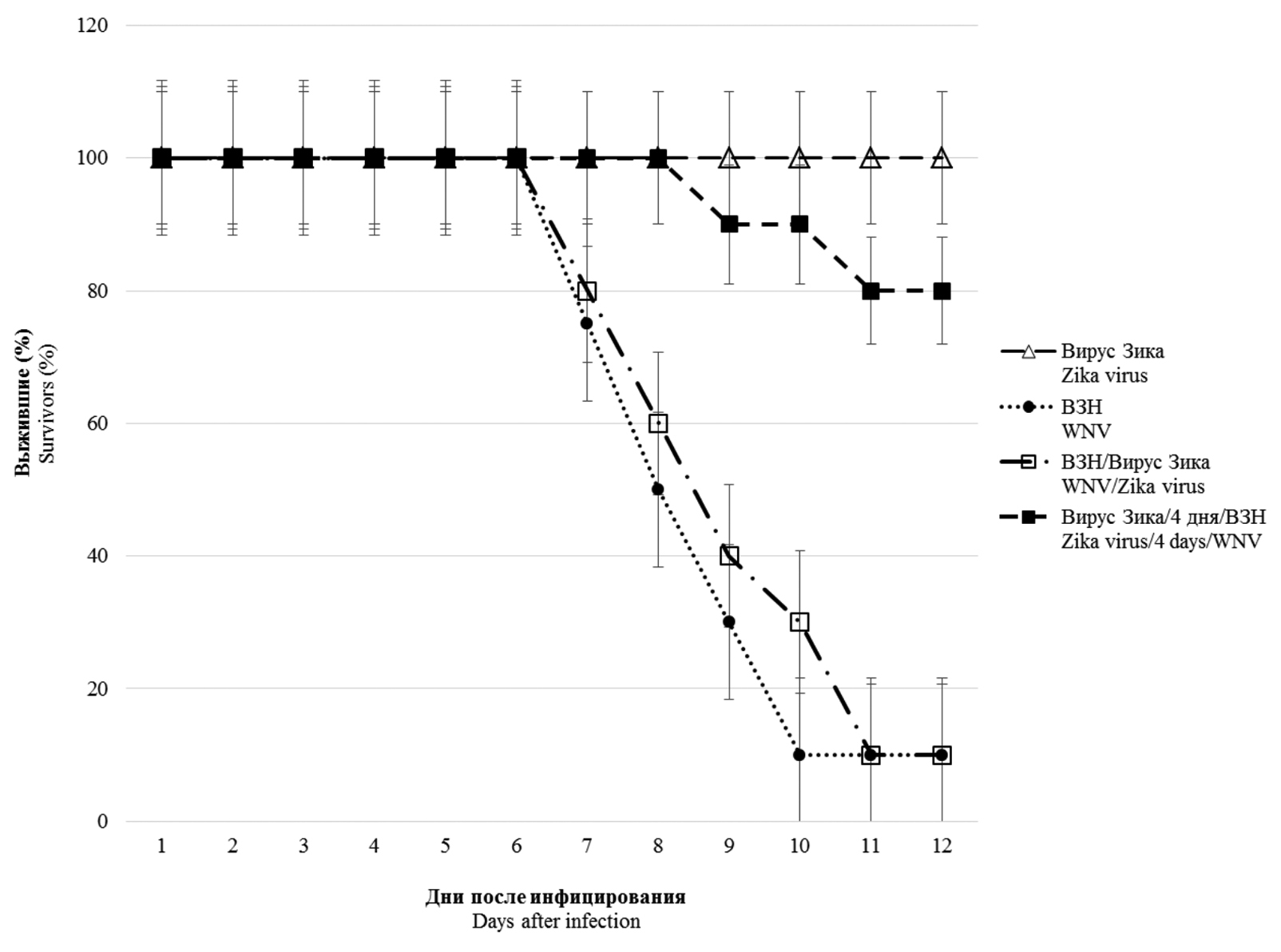
Микст-инфекция in vivo. Коинфекцию ВЗН и вирусом Зика моделировали при одновременном и последовательном инфицировании мышей разными дозами вирусов (вирус Зика и через 4 сут ВЗН; вирус Зика и через 20 сут ВЗН). Как видно из результатов, представленных на рис. 1, инфицирование вирусом Зика (104 ТЦД50/мышь) не вызывало развитие летальной инфекции, а при наблюдении за животными не отмечалось видимых клинических проявлений вирусной инфекции. Напротив, инфицирование мышей ВЗН в дозе 103 ТЦД50 приводило к гибели 90% мышей с развитием клинических проявлений нейроинфекции. При смешанном одновременном инфицировании двумя вирусами вирус Зика не влиял значимым образом на течение и исход инфекционного процесса, вызванного ВЗН. В то же время при предварительном инфицировании животных вирусом Зика (за 4 сут до инфицирования ВЗН) отмечалось выживание 80% мышей, инфицированных 10 ЛД50 ВЗН.
Рис. 1. Выживаемость мышей BALB/c, инфицированных вирусами Западного Нила (ВЗН) и Зика, при разных схемах введения вирусных препаратов.
△ – результаты, полученные при внутрибрюшинном инфицировании вирусом Зика дозой 104 ТЦД50; ● – при внутрибрюшинном инфицировании ВЗН дозой 103 ТЦД50 (10 ЛД50); □ – при одновременном внутрибрюшинном инфицировании вирусом Зика (104 ТЦД50) и ВЗН (10 ЛД50); ■ – при внутрибрюшинном инфицировании вирусом Зика (104 ТЦД50) и через 4 сут внутрибрюшинном инфицировании ВЗН (10 ЛД50) (n = 10; p < 0,05).
Fig. 1. Survival of BALB/c mice infected with West Nile virus (WNV) and Zika virus under different schemes of virus administration.
△ – experimental results obtained by intraperitoneal Zika virus infection with a dose of 104 TCID50; ● – experimental results obtained by intraperitoneal infection of WNV with a dose of 103 TCID50 (10 LD50); □ – experimental results obtained by simultaneous intraperitoneal infection with Zika virus (104 TCID50) and WNV (10 LD50); ■ – experimental results obtained by intraperitoneal infection with Zika virus (104 TCID50) and after 4 days intraperitoneal infection with 10 LD50 of WNV (n = 10; p < 0.05).
На рис. 2 приведены результаты инфицирования мышей BALB/c через 20 сут после предварительного инфицирования вирусом Зика в дозе 104 ТЦД50/мышь. Обнаружена 100 и 90% защита предварительно инфицированных вирусом Зика животных от последующего заражения дозами 10 и 100 ЛД50 ВЗН соответственно. Эти данные свидетельствуют о том, что предварительное инфицирование вирусом Зика обеспечивает выраженную защиту животных от последующего инфицирования летальными дозами ВЗН.
Рис. 2. Выживаемость предварительно инфицированных вирусом Зика мышей BALB/c при последующем инфицировании летальными дозами вируса Западного Нила (ВЗН).
△ – результаты, полученные при внутрибрюшинном инфицировании вирусом Зика (104 ТЦД50) и через 20 сут при внутрибрюшинном инфицировании ВЗН (10 ЛД50); ● – при внутрибрюшинном инфицировании ВЗН (100 ЛД50); □ – при внутрибрюшинном инфицировании ВЗН (10 ЛД50); ■ – при внутрибрюшинном инфицировании вирусом Зика (104 ТЦД50) и через 20 сут при внутрибрюшинном инфицировании ВЗН (100 ЛД50) (n = 10; p < 0,05).
Fig. 2. Survival of Zika virus pre-infected BALB/c mice upon subsequent infection with lethal doses of West Nile virus (WNV).
△ – experimental results obtained by intraperitoneal infection with Zika virus (104 TCID50) and after 20 days intraperitoneal infection with WNV (10 LD50); ● – experimental results obtained by intraperitoneal infection with WNV (100 LD50); □ – experimental results obtained with intraperitoneal infection of WNV (10 LD50); ■ – experimental results obtained by intraperitoneal infection with Zika virus (104 TCID50) and after 20 days intraperitoneal infection with WNV (100 LD50) (n = 10; p < 0.05).
Индукция вируснейтрализующих антител у мышей BALB/c. Индивидуальные сыворотки крови экспериментальных животных были тестированы на наличие вируснейтрализующих антител (табл. 2). Сыворотки мышей, инфицированные вирусом Зика либо ВЗН, нейтрализовали только гомологичные вирусы. Однако после заражения ВЗН сыворотки животных, предварительно инфицированных вирусом Зика, были способны нейтрализовать как вирус Зика, так и ВЗН. При этом титры вируснейтрализующих антител в сыворотках, предварительно инфицированных вирусом Зика и затем инфицированных 100 ЛД50 ВЗН, были существенно выше, чем у животных, инфицированных только ВЗН. Для подтверждения специфичности вируснейтрализующих антител и отсутствия их перекрестной реактивности в реакции нейтрализации была проведена оценка их нейтрализующей активности против гетерологичного вируса. Так, сыворотки выживших мышей после инфицирования ВЗН дозой 10 ЛД50 через 21 сут после заражения имели высокий титр нейтрализующих антител против ВЗН (750 ± 107), но при этом они были не способны нейтрализовать вирус Зика на культуре клеток.
Таблица 2. Индукция вируснейтрализующих антител у мышей BALB/c, инфицированных вирусом Зика и через 20 сут зараженных вирусом Западного Нила (ВЗН) (8 сут после заражения ВЗН)
Table 2. Induction of virus-neutralizing antibodies in BALB/c mice pre-infected with Zika virus and after 20 days infected with West Nile virus (WNV) (8 days after WNV infection)
Сыворотки мышей Mouse serum | Титры вируснейтрализующих антител (M ± SEM) Virus neutralizing antibody titers (M ± SEM) | |
Вирус Зика Zika virus | ВЗН WNV | |
Моноинфекция Mono infection | ||
Вирус Зика (20 сут) Zika virus (20 days) | 82,3 ± 15,4 | < 10 |
ВЗН (8 сут)* WNV (8 days)* | < 10 | 112,6 ± 27,2 |
Коинфекция Co-infection | ||
Вирус Зика/20 сут/ВЗН (8 сут) Zika virus/20 days/WNV (8 days) | 74,5 ± 17,7 | 525,7 ± 73,5 |
Контроль Control | < 10 | < 10 |
Примечание. * ‒ гибель 100% животных к 10-м суткам после инфицирования 100 ЛД50 ВЗН. За титр принимали соответствующее разведение индивидуальной сыворотки животного нейтрализующей 50 ТЦД50 вируса Зика или ВЗН в реакции нейтрализации. Представлены среднегеометрические титры вируснейтрализующих антител (n = 5; p < 0,05).
Note. * ‒ death of 100% of animals to tenth day after infection with 100 LD50 of WNV. The corresponding dilution of an individual animal serum neutralizing 50
Обсуждение
Феномен интерференции между различными вирусами в чувствительной клетке известен достаточно давно и в классическом виде предполагает подавление репликации одного вируса другим [27]. Возможные механизмы этого явления связывают с различными ключевыми моментами репликации вирусов в клетке, индукцией систем противовирусной защиты в клетке, включая системы интерферонов, конкуренцией за ресурсы клетки для синтеза вирусных молекул и вирусных частиц, разными скоростями репликации вирусов и рядом других факторов. Проникновение вирусной частицы в клетку может драматическим образом изменять работу клеточного генома, включая или ингибируя различные гены [28]. В эти изменения могут вовлекаться десятки и сотни клеточных генов. Сложность проведения этих исследований предопределяет недостаточность наших знаний о феномене интерференции между различными вирусами, а развитие исследований по генетическому многообразию виромов показало острую необходимость ускоренного развития исследований в этой области [29]. Особенность ортофлавивирусов состоит в том, что в природных очагах они распространяются, как правило, с помощью векторов [11]. В этом качестве наиболее часто выступают иксодовые клещи и различные виды комаров. В случае совпадения природных очагов возможны случаи микст-инфицирования как беспозвоночных, так и их теплокровных хозяев. Вирус Зика и ВЗН относятся к так называемым «комариным» флавивирусам и циркулируют подчас в одних и тех же регионах, поэтому случаи возникновения коинфицирования вполне вероятны среди чувствительных видов хозяев, включая человека.
В наших экспериментах были использованы вирус Зика и ВЗН, которые широко распространены в современном мире и недавно вызвали практически глобальные вспышки заболеваний в странах с теплым климатом. Результаты, полученные с использованием этих вирусов, показывают наличие интерференции in vitro между этими двумя ортофлавивирусами. Одновременное инфицирование приводит к выраженному ингибированию репликации вируса Зика, при отсутствии столь же выраженного эффекта на репликацию ВЗН в клетках млекопитающих. Последовательное (с различной очередностью) инфицирование также приводит к конкурентному взаимному ингибированию репликации этих вирусов, при этом степень конкурентного ингибирования остается более выражена в отношении вируса Зика. Недавно было показано, что коинфекция клеток Vero ВЗН и вирусом энцефалита Сент-Луис (St. Louis encephalitis virus, SLEV) сопровождается ингибированием репликации SLEV при минимальном влиянии на репликационную активность ВЗН. В то же время коинфицирование комариных клеток СТ (Cx. tarsalis) не оказывало влияния на репликацию любого из вирусов [30].
Моделирование микст-инфекции на лабораторных животных (in vivo) частично подтвердило результаты, полученные на культуре клеток. Так, при одновременном инфицировании мышей BALB/c вирус Зика не влиял значимым образом на течение заболевания и летальный исход инфекционного процесса, вызванного ВЗН. Однако при предварительном инфицировании животных вирусом Зика (за 4 сут до инфицирования ВЗН) отмечалось достоверное снижение инфекционной активности ВЗН для лабораторных животных. Эти результаты свидетельствуют о возможности интерференции in vivo между этими двумя флавивирусами. Оценить обратный эффект нам не удалось вследствие того, что выбранная модель инфекции на животных не обеспечивала развитие клинически выраженной и/или летальной инфекции после введения вируса Зика. При моделировании коинфекции с заражением животных ВЗН через 20 сут после инфицирования вирусом Зика было обнаружено, что предварительное инфицирование вирусом Зика практически полностью защищает животных от последующего инфицирования 10 и 100 ЛД50 ВЗН.
В нашей работе продемонстрировано, что, в отличие от ранее опубликованных данных о смешанной инфекции вирусами Зика и денге [30, 31], инфекция ВЗН у мышей, предварительно инфицированных вирусом Зика, не сопровождалась усилением проявлений инфекции. Более того, при предварительном инфицировании вирусом Зика мы наблюдали формирование выраженной защиты животных от последующего инфицирования ВЗН. Ранее была показана ключевая роль нейтрализующих антител в защите от флавивирусных инфекций [32–34]. Оценка способности сывороток крови нейтрализовать вирус Зика и ВЗН была протестирована в реакции вирусной нейтрализации на культуре клеток Vero E6. Индукция вируснейтрализующих антител была обнаружена только против гомологичного вируса (табл. 2), перекрестная реактивность вируснейтрализующих антител отсутствовала. Важно подчеркнуть, что предварительная инфекция вирусом Зика приводила к более быстрому ответу на инфицирование ВЗН, усиливая последующую выработку нейтрализующих антител против ВЗН. Причем уровень антител был достаточен для защиты животных от летальной инфекции. При моноинфекции ВЗН вируснейтрализующие антитела также были зарегистрированы на 8-е сутки инфекции, но при этом животные погибали к 10-м суткам после инфицирования. Неоднозначность потенциальных исходов смешанного инфицирования ВЗН и вирусом Зика иллюстрируется в работе [35] в, которой показано, что образцы сывороток от серопозитивных по ВЗН лиц эффективно нейтрализуют ВЗН, но усиливают инфекционную активность вируса Зика.
Биологическая значимость предварительной нелетальной инфекции вирусом Зика, обеспечивающей защиту от ВЗН, может ограничивать циркуляцию этих ортофлавивирусов в природных очагах этих инфекций. Эти результаты могут быть полезны для дальнейшего изучения микст-инфекций, вызываемых вирусом Зика и ВЗН, а также для будущей разработки иммунопрофилактических средств широкого спектра действия против флавивирусных инфекций.
Заключение
Таким образом, исследование микст-инфекции двух ортофлавивирусов на модели in vitro показало наличие выраженной интерференции вирусов на культуре клеток Vero E6. Так, ВЗН при одновременном и последовательном инфицировании ингибировал репликацию вируса Зика в клеточной культуре более чем в 1000 раз, обратный эффект не превышал 30 ( 1,5 lg). Моделирование микст-инфекции in vivo показало более сложную картину развития инфекционного процесса у мышей BALB/c. При одновременном микст-инфицировании мышей вирус Зика не влиял значимым образом на развитие летальной инфекции, вызванной ВЗН. При этом предварительное инфицирование мышей нелетальными дозами вируса Зика за 4 и 20 сут до введения ВЗН обеспечивало эффективную защиту животных от летальной инфекции ВЗН и появление высокого уровня вируснейтрализующих антител против этого вируса.
Об авторах
Виктор Александрович Святченко
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: svyat@vector.nsc.ru
ORCID iD: 0000-0002-2729-0592
канд. биол. наук, ведущий научный сотрудник отдела молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, 630559, р.п. Кольцово, Новосибирская областьЕлена Викторовна Протопопова
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: protopopova_ev@vector.nsc.ru
ORCID iD: 0000-0002-2782-8364
канд. биол. наук, ведущий научный сотрудник отдела молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, 630559, р.п. Кольцово, Новосибирская областьСтанислав Сергеевич Легостаев
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: legostaev_ss@vector.nsc.ru
ORCID iD: 0000-0002-6202-445X
младший научный сотрудник отдела молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, 630559, р.п. Кольцово, Новосибирская областьТамара Петровна Микрюкова
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: mikryukova_tp@vector.nsc.ru
ORCID iD: 0000-0003-4350-4260
канд. биол. наук, старший научный сотрудник отдела молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, 630559, р.п. Кольцово, Новосибирская областьАлександр Петрович Агафонов
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: agafonov@vector.nsc.ru
ORCID iD: 0000-0003-2577-0434
д-р биол. наук, генеральный директор
Россия, 630559, р.п. Кольцово, Новосибирская областьВалерий Борисович Локтев
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Автор, ответственный за переписку.
Email: loktev@vector.nsc.ru
ORCID iD: 0000-0002-0229-321X
д-р биол. наук, профессор, академик РАЕН, главный научный сотрудник отдела молекулярной вирусологии флавивирусов и вирусных гепатитов
Россия, 630559, р.п. Кольцово, Новосибирская областьСписок литературы
- Postler T.S., Beer M., Blitvich B.J., Bukh J., de Lamballerie X., Drexler J.F., et al. Renaming of the genus Flavivirus to Orthoflavivirus and extension of binomial species names within the family Flaviviridae. Arch. Virol. 2023; 168(9): 224. https://doi.org/10.1007/s00705-023-05835-1
- Baker R.E., Mahmud A.S., Miller I.F., Rajeev M., Rasambainarivo F., Rice B.L., et al. Infectious disease in an era of global change. Nat. Rev. Microbiol. 2022; 20(4): 193–05. https://doi.org/10.1038/s41579-021-00639-z
- Petersen L.R., Brault A.C., Nasci R.S. West Nile virus: review of the literature. JAMA. 2013; 310(3): 308–15. https://doi.org/10.1001/jama.2013.8042
- van Leur S.W., Heunis T., Munnur D., Sanyal S. Pathogenesis and virulence of flavivirus infections. Virulence. 2021; 12(1): 2814–38. https://doi.org/10.1080/21505594.2021.1996059
- Brüssow H., Figuerola J. The spread of the mosquito-transmitted West Nile virus in North America and Europe. Microb. Biotechnol. 2025; 18(3): e70120. https://doi.org/10.1111/1751-7915.70120
- Kariwa H., Murata R., Totani M., Yoshii K., Takashima I. Increased pathogenicity of West Nile virus (WNV) by glycosylation of envelope protein and seroprevalence of WNV in wild birds in Far Eastern Russia. Int. J. Environ. Res. Public Health. 2013; 10(12): 7144–64. https://doi.org/10.3390/ijerph10127144
- Korobitsyn I.G., Moskvitina N.S., Tyutenkov O.Y., Gashkov S.I., Kononova Y.V., Moskvitin S.S., et al. Detection of tick-borne pathogens in wild birds and their ticks in Western Siberia and high level of their mismatch. Folia Parasitol. (Praha). 2021; 68: 2021.024. https://doi.org/10.14411/fp.2021.024
- Duggal N.K., Langwig K.E., Ebel G.D., Brault A.C. On the fly: interactions between birds, mosquitoes, and environment that have molded West Nile virus genomic structure over two decades. J. Med. Entomol. 2019; 56(6): 1467–74. https://doi.org/10.1093/jme/tjz112
- Dick G.W.A., Kitchen S.F., Haddow A.J., Zika virus (I). Isolations and serological specificity. Trans. R. Soc. Trop. Med. Hyg. 1952; 46: 509–20. https://doi.org/10.1016/0035-9203(52)90042-4
- Rabe I.B., Hills S.L., Haussig J.M., Walker A.T., Dos Santos T., San Martin J.L., et al. A review of the recent epidemiology of Zika virus infection. Am. J. Trop. Med. Hyg. 2025; 112(5): 1026–35. https://doi.org/10.4269/ajtmh.24-0420
- Pielnaa P., Al-Saadawe M., Saro A., Dama M.F., Zhou M., Huang Y., et al. Zika virus-spread, epidemiology, genome, transmission cycle, clinical manifestation, associated challenges, vaccine and antiviral drug development. Virology. 2020; 543: 34–42. https://doi.org/10.1016/j.virol.2020.01.015
- Rückert C., Weger-Lucarelli J., Garcia-Luna S.M., Young M.C., Byas A.D., Murrieta R.A., et al. Impact of simultaneous exposure to arboviruses on infection and transmission by Aedes aegypti mosquitoes. Nat. Commun. 2017; 8: 15412. https://doi.org/10.1038/ncomms15412
- Laredo-Tiscareño S.V., Machain-Williams C., Rodríguez-Pérez M.A., Garza-Hernandez J.A., Doria-Cobos G.L., Cetina-Trejo R.C., et al. Arbovirus surveillance near the Mexico–us border: Isolation and sequence analysis of chikungunya virus from patients with dengue-like symptoms in Reynosa, Tamaulipas. Am. J. Trop. Med. Hyg. 2018; 99(1): 191–94. https://doi.org/10.4269/ajtmh.18-0117
- Cherabuddi K., Iovine N.M., Shah K., White S.K., Paisie T., Salemi M., et al. Zika and Chikungunya virus co-infection in a traveller returning from Colombia, 2016: virus isolation and genetic analysis. JMM Case Rep. 2016; 3(6): e005072. https://doi.org/10.1099/jmmcr.0.005072
- Iovine N.M., Lednicky J., Cherabuddi K., Crooke H., White S.K., Loeb J.C., et al. Coinfection with Zika and Dengue-2 viruses in a traveler returning from Haiti, 2016: clinical presentation and genetic analysis. Clin. Infect. Dis. 2017; 64(1): 72–5. https://doi.org/10.1093/cid/ciw667
- Laredo-Tiscareño S.V., Garza-Hernandez J.A., Salazar M.I., De Luna-Santillana E.J., Tangudu C.S., Cetina-Trejo R.C., et al. Surveillance for flaviviruses near the Mexico-U.S. border: co-circulation of Dengue virus serotypes 1, 2, and 3 and West Nile virus in Tamaulipas, Northern Mexico, 2014–2016. Am. J. Trop. Med. Hyg. 2018; 99(5): 1308–17. https://doi.org/10.4269/ajtmh.18-0426
- Slavov S.N., Gonzaga F.A.C., Pimentel B.M.S., Ramos D.D.A.R., de Araújo W.N., Covas D.T., et al. Zika virus RNA surveillance in blood donors in the Federal District of Brazil during the 2016 outbreak. Hematol. Transfus. Cell Ther. 2020; 42(4): 394–96. https://doi.org/10.1016/j.htct.2019.08.006
- Vasilakis N., Shell E.J., Fokam E.B., Mason P.W., Hanley K.A., Estes D.M., et al. Potential of ancestral sylvatic dengue-2 viruses to re-emerge. Virology. 2007; 358(2): 402–12. https://doi.org/10.1016/j.virol.2006.08.049
- Aaskov J., Buzacott K., Thu H.M., Lowry K., Holmes E.C. Long-term transmission of defective RNA viruses in humans and Aedes mosquitoes. Science. 2006; 311(5758): 236–38. https://doi.org/10.1126/science.1115030
- Paz-Bailey G., Adams L.E., Deen J., Anderson K.B., Katzelnick L.C. Dengue. Lancet. 2024; 403(10427): 667–82. https://doi.org/10.1016/S0140-6736(23)02576-X
- Rodriguez-Morales A.J., Villamil-Gómez W.E., Franco-Paredes C. The arboviral burden of disease caused by co-circulation and co-infection of dengue, chikungunya and Zika in the Americas. Travel Med. Infect. Dis. 2016; 14(3): 177–9. https://doi.org/10.1016/j.tmaid.2016.05.004
- Svyatchenko V.A., Nikonov S.D., Mayorov A.P., Gelfond M.L., Loktev V.B. Antiviral photodynamic therapy: inactivation and inhibition of SARS-CoV-2 in vitro using methylene blue and Radachlorin. Photodiagnosis Photodyn. Ther. 2021; 33: 102112. https://doi.org/10.1016/j.pdpdt.2020.102112
- Toth K., Spencer J.F., Dhar D., Sagartz J.E., Buller R.M., Painter G.R., et al. Hexadecyloxypropyl-cidofovir, CMX001, prevents adenovirus induced mortality in a permissive, immunosuppressed animal model. Proc. Natl. Acad. Sci. USA. 2008; 105(20): 7293–97. https://doi.org/10.1073/pnas.0800200105
- Svyatchenko V.A., Ternovoi V.A., Lutkovskiy R.Y., Protopopova E.V., Gudymo A.S., Danilchenko N.V., et al. Human adenovirus and influenza A virus exacerbate SARS-CoV-2 infection in animal models. Microorganisms. 2023; 11(1): 180. https://doi.org/10.3390/microorganisms11010180
- Sanders R., Mason D.J., Foy C.A., Huggett J.F. Evaluation of digital PCR for absolute RNA quantification. PLoS One. 2013; 8(9): e75296. https://doi.org/10.1371/journal.pone.0075296
- Petrović T., Blazquez A.B., Lupulović D., Lazić G., Escribano-Romero E., Fabijan D., et al. Monitoring West Nile virus (WNV) infection in wild birds in Serbia during 2012: first isolation and characterisation of WNV strains from Serbia. Euro. Surveill. 2013; 18(44): 20622. https://doi.org/10.2807/1560-7917.es2013.18.44.20622
- DaPalma T., Doonan B.P., Trager N.M., Kasman L.M. A systematic approach to virus-virus interactions. Virus Res. 2010; 149(1): 1–9. https://doi.org/10.1016/j.virusres.2010.01.002
- Zhu Y., He Z., Qi Z. Virus-host Interactions in early Japanese encephalitis virus infection. Virus Res. 2023; 331: 199120. https://doi.org/10.1016/j.virusres.2023.199120
- Du Y., Wang C., Zhang Y. Viral coinfections. Viruses. 2022; 14(12): 2645. https://doi.org/10.3390/v14122645
- Gallichotte E.N., Fitzmeyer E.A., Williams L., Spangler M.C., Bosco-Lauth A.M., Ebel G.D. WNV and SLEV coinfection in avian and mosquito hosts: impact on viremia, antibody responses, and vector competence. J. Virol. 2025; 98(10): e0104124. https://doi.org/10.1128/jvi.01041-24
- Dejnirattisai W., Supasa P., Wongwiwat W., Rouvinski A., Barba-Spaeth G., Duangchinda T., et al. Dengue virus sero-cross-reactivity drives antibody-dependent enhancement of infection with zika virus. Nat. Immunol. 2016; 17(9): 1102–08. https://doi.org/10.1038/ni.3515
- Stettler K., Beltramello M., Espinosa D.A., Graham V., Cassotta A., Bianchi S., et al. Specificity, cross-reactivity, and function of antibodies elicited by Zika virus infection. Science. 2016; 353(6301): 823–26. https://doi.org/10.1126/science.aaf8505
- Lobigs M., Diamond M.S. Feasibility of cross-protective vaccination against flaviviruses of the Japanese encephalitis serocomplex. Expert Rev. Vaccines. 2012; 11(2): 177–87. https://doi.org/10.1586/erv.11.180
- Sapparapu G., Fernandez E., Kose N., Bin C., Fox J.M., Bombardi R.G., et al. Neutralizing human antibodies prevent Zika virus replication and fetal disease in mice. Nature. 2016; 540(7633): 443–7. https://doi.org/10.1038/nature20564
- Garg H., Yeh R., Watts D.M., Mehmetoglu-Gurbuz T., Resendes R., Parsons B., et al. Enhancement of Zika virus infection by antibodies from West Nile virus seropositive individuals with no history of clinical infection. BMC Immunol. 2021; 22(1): 5. https://doi.org/10.1186/s12865-020-00389-2
Дополнительные файлы