Гладконосые летучие мыши (семейство Vespertilionidae) как возможный резервуар лисса- и коронавирусов в Западной Сибири и на юге европейской части России
- Авторы: Охлопкова О.В.1,2, Кононова Ю.В.2, Тюменцева М.А.1, Тюменцев А.И.1, Шестопалов А.М.2, Акимкин В.Г.1
-
Учреждения:
- ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
- Научно-исследовательский институт вирусологии ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
- Выпуск: Том 69, № 5 (2024)
- Страницы: 415-428
- Раздел: ОБЗОРЫ
- URL: https://virusjour.crie.ru/jour/article/view/16685
- DOI: https://doi.org/10.36233/0507-4088-267
- EDN: https://elibrary.ru/vpenkk
- ID: 16685
Цитировать
Аннотация
В обзоре приведены современные данные относительно хироптерофауны, обитающей в Западной Сибири и на юге европейской части России. Дана общая характеристика рода лиссавирусов и семейства коронавирусов. Рассмотрен потенциал вирусоносительства в отношении лисса- и коронавирусов в популяциях рукокрылых двух географически отдаленных регионов.
Полный текст
Введение
Возникающие время от времени вспышки инфекционных заболеваний, вызываемых вирусами, обусловливают необходимость исследований, направленных на поиск очагов таких заболеваний и оценку опасности появления новых вирусных эпидемий. Так, изучение вируса SARS-CoV-2 ‒ возбудителя COVID-19 ‒ и путей его передачи человеку выявило важную роль летучих мышей как природных резервуаров потенциально опасных вирусов. Помимо этого, летучие мыши являются источником многих видов лиссавирусов, масштабы распространения, которых, высокая патогенность и практически абсолютная летальность определяют их актуальность и первостепенную значимость для изучения.
В представленном обзоре литературы основное внимание сосредоточено на фауне рукокрылых и потенциале вирусоносительства у некоторых представителей этого отряда в Западной Сибири и на юге европейской части России. Эти географические районы представляют особый интерес для изучения циркуляции лисса- и коронавирусов по нескольким причинам. Во-первых, оба региона отличаются значительным биоразнообразием и наличием различных экосистем и биотопов. Во-вторых, географическое отдаление этих территорий дает возможность провести сравнительный анализ вирусов, циркулирующих в разных климатических и экологических условиях. Также отдельно следует упомянуть о близости Сибирского федерального округа к Китаю, где в силу различных причин могут возникать очаги новых вирусных инфекций. В-третьих, анализируемые регионы характеризуются высокой плотностью населения и активной антропогенной деятельностью, что создает условия для взаимодействия между людьми и дикими животными и потенциально увеличивает риск межвидовой передачи вирусов.
В настоящее время у представителей отряда рукокрылых (Chiroptera) изолированы или выявлены молекулярно-генетическими методами РНК- и ДНК-содержащие вирусы позвоночных, относящиеся к 35 семействам [1]. У видов рукокрылых частота встречаемости вирусных РНК/ДНК в организмах животных различается и зависит как от вируса и его хозяина (переносчика), так и географического распространения [1, 2]. Бо́льшая часть идентифицированных у рукокрылых вирусов не связана с заболеваниями людей, вместе с тем для этих животных установлены носительство и передача вирусов, патогенных для человека (вирус бешенства, вирус Нипах, вирус Марбург и др.). В частности, в России доказано 4 летальных случая лиссавирусной инфекции в период 1977–2007 гг. после контакта с гладконосыми летучими мышами (г. Луганск – 2 случая; Белгородская область – 1 случай; Приморский край – 1 случай) и 3 новых случая в период 2019–2021 гг. на территориях Дальнего Востока [3]. Таким образом, при оценке эпидемиологической значимости рукокрылых следует учитывать совокупность факторов: видовое разнообразие, численность, экологические условия и поведение, ассоциации с известными вирусами.
Согласно информации, приведенной в международной базе данных Higher Taxonomy (https://www.mammaldiversity.org/taxa.html), в настоящее время на территории России зарегистрированы 52 вида рукокрылых. Семейство гладконосых (Vespertilionidae) составляет бόльшую часть хироптерофауны России и включает 18 видов ночниц (Myotis), по 5 видов ушанов (Plecotus) и нетопырей (Pipistrellus), по 4 вида вечерниц (Nyctalus) и кожанов (Eptesicus), 3 вида широкоушек (Barbastella) и по 2 вида кожановидных нетопырей (Hypsugo), трубконосов (Murina) и двухцветных кожанов (Vespertilio). Гладконосые летучие мыши встречаются на всей территории России – от отдельных районов тундры на севере [4] до субтропических районов на юге [5], от балтийского побережья на западе [6] и до Дальнего Востока [7–9]. Вышеперечисленное обусловливает значительный исследовательский интерес именно к этому семейству летучих мышей как к наиболее активно контактирующему с человеческой популяцией посредством селения вблизи человеческих жилищ, зимовки на чердаках и в подвалах.
Рукокрылые других семейств представлены 4 видами подковоносов (Rhinolophus), 2 видами длиннокрылов (Miniopterus) и 1 видом складчатогубов (Tadarida). Представители 4 видов подковоносов, обыкновенный длиннокрыл (M. schreibersii) и широкоухий складчатогуб (T. teniotis) встречаются в некоторых районах юга Европейской части России – на Кавказе и Причерноморье [5, 10], ареал восточного длиннокрыла (M. fuliginosus) в России ограничен югом Приморского края [7].
Видовое разнообразие отряда Chiroptera зависит от совокупности факторов, основными из которых являются наличие благоприятных экологических условий и доступность кормовой базы. Вследствие этого наибольшее число видов характерно для экваториальных, тропических и субтропических широт, с постепенным снижением к северу в Северном полушарии и к югу в Южном [11]. Ростовская и Новосибирская области, исследуемые как территории риска в представленном анализе научной литературы, располагаются в пределах умеренного климатического пояса Северной Евразии, но существенно отличаются между собой по средним годовым температурам, ландшафтному разнообразию и степени антропогенной трансформации естественных биоценозов. Изучение вирусов рукокрылых, циркулирующих в этих двух удаленных друг от друга регионах, может дать представление о характере генетического разнообразия и предположительных границах распространения отдельных видов или генетических вариантов вирусов. Хироптерофауна и вирусы рукокрылых именно этих регионов совместно формируют единый виромный ландшафт, представленный на Евразийском континенте, в котором значительное место занимают вирусы, циркулирующие среди представителей семейства гладконосых летучих мышей.
Целью настоящей работы является сравнительный анализ потенциала вирусоносительства в отношении лисса- и коронавирусов в популяциях гладконосых летучих мышей двух отдаленных регионов Российской Федерации. Полученная информация о взаимосвязи фауны рукокрылых и видовой восприимчивости к потенциально опасным для человека вирусам может быть использована для прогнозирования эпидемиологических рисков в системе мониторинга некоторых ассоциированных с рукокрылыми вирусных инфекций.
Характеристика лиссавирусов и коронавирусов, циркулирующих среди представителей семейства Vespertilionidae
Лиссавирусы (Rhabdoviridae: Lyssavirus). Лиссавирусы являются одним из 13 родов семейства рабдовирусов. Геном лиссавирусов представлен одноцепочечной линейной отрицательной РНК длиной около 11,9–12,3 т.п.н. Вирионы состоят из двух структурных единиц. Длина вирионов составляет от 130 до 380 нм. Генетическая структура лиссавирусов консервативна и представлена 5 генами структурных белков. Это 3’– N (нуклеопротеин) – P (фосфопротеин, кофактор репликации РНК) – M (матриксный белок) – G (поверхностный гликопротеин) – L (вирусные РНК-полимеразы) –5’ [4].
Лиссавирусы – нейротропные патогены, вызывающие острый прогрессирующий энцефаломиелит. Чувствительность ко всем представителям рода всех млекопитающих обусловлена общностью патогенеза – взаимодействием с никотиновым ацетилхолиновым рецептором нервного окончания, являющегося универсальным медиатором передачи нервных импульсов в синаптических соединениях [5]. Передача инфекции происходит по эпизоотическим цепям векторного типа, возникающим при травматизирующих контактах с больным животным-источником. В результате заражения возбудитель проникает в моторные или сенсорные нейроны и центростремительно распространяется по центральной нервной системе, используя ретроградный аксональный транспорт по нейронным связям [11, 12].
В естественной среде лиссавирусы связаны с конкретными животными-резервуарами, преимущественно с хищниками и летучими мышами, в рамках паразитарных систем двух архетипов – наземной и воздушно-наземной. Основными хозяевами лиссавирусов в филогенетическом отношении их естественно-исторического происхождения являются представители отряда рукокрылых. Хищники (отряд Carnivora) поддерживают циркуляцию только вируса бешенства (RABV). С рукокрылыми умеренного пояса Евразии связаны следующие лиссавирусы: European bat 1 lyssavirus – EBLV-1 (Lyssavirus hamburg согласно современной классификации ICTV), European bat 2 lyssavirus – EBLV-2 (L. helsinki), Aravan lyssavirus – ARALV (L. aravan), Khujand lyssavirus – KHULV (L. khujand), West Caucasian bat lyssavirus – WCBLV (L. caucasicus), Irkut lyssavirus – IRKLV (L. irkut), Bokeloh bat lyssavirus – BBLV (L. bokeloh), Lleida bat lyssavirus – LLEBLV (L. lleida) и Kotalahti bat lyssavirus – KBLV (L. kotalahti). Как правило, распространение конкретных лиссавирусов видоспецифично, но не исключает их передачи другим видам в общих колониях или случайным хозяевам – домашним животным или человеку [12].
Коронавирусы (Coronaviridae: Alphacoronavirus, Betacoronavirus). Семейство Coronaviridae представляет собой монофилетический кластер в порядке Nidovirales. Это оболочечные плюс-РНК-вирусы, которые поражают позвоночных 3 классов: млекопитающих (корона- и торовирусы), птиц (коронавирусы) и рыб (бафинивирусы). Вирионы могут быть сферическими, диаметром от 120 до 160 нм (Coronavirinae), палочковидными, размером от 170 до 200 × 75–88 нм (Bafinivirus), или представлять собой смесь этих двух форм. При этом палочковидные частицы характерно изогнуты в форме полумесяца (Torovirus) [13]. Частицы обычно имеют крупные выступы на поверхности в виде булавы или лепестков («пепломеры» или «шипы»). Нуклеокапсиды обладают спиралевидной формой и могут быть отделены от вирусной частицы при обработке детергентами. В то время как у коронавируса структура нуклеокапсида неплотная, у торовирусов она имеет характерную трубчатую форму [14].
По размеру генома и генетической сложности коронавирусы являются самыми крупными РНК-вирусами, обнаруженными на данный момент. По этим характеристикам с ними могут сравниться только окавирусы – крупные нидовирусы беспозвоночных из семейства Roniviridae. Механизм репликации подробно изучен только для коронавирусов. Однако наличие очевидно ограниченных данных по торо- и бафинивирусам позволяет сделать предположение о наличии у них схожих биологических характеристик. Вирионы этих вирусов прикрепляются к специальным рецепторам на поверхности клетки-хозяина с помощью шипов и высвобождают свой геном в клетку-мишень через слияние вирусной оболочки с плазматической мембраной и/или ограничительной мембраной эндоцитарного везикула [13].
Изучение рукокрылых как возможных переносчиков коронавирусов началось после возникновения случаев атипичной пневмонии в 2002–2004 гг. [15], и было интенсифицировано после обнаружения W. Li и соавт. у представителей рода Rhinolophus (R. pearsoni, R. pussilus, R. macrotis) в Китае РНК коронавируса, генетически близкого к возбудителю атипичной пневмонии SARS-CoV [16]. Позже несколькими группами исследователей было показано, что маркеры различных коронавирусов (РНК, специфические антитела) у рукокрылых встречаются в Северной и Южной Америке, Европе и Африке [17–20]. После вспышки ближневосточного респираторного синдрома в 2012–2015 гг., вызванной коронавирусом MERS-CoV и охватившей несколько стран мира, РНК генетически близких к нему коронавирусов была обнаружена у рукокрылых в Африке и Европе [21, 22]. Родственный возбудителю COVID-19, SARS-CoV-2-подобный вирус был идентифицирован у R. affinis в Китае за несколько лет до пандемии новой коронавирусной инфекции [23]. Обнаружение у рукокрылых генетического материала коронавирусов, родственных возбудителям тяжелых заболеваний человека (SARS-CoV, MERS-CoV, SARS-CoV-2), дало основание рассматривать отдельные виды этих животных в качестве потенциальных хозяев предшественников высокопатогенных коронавирусов человека.
Физико-географическая характеристика анализируемых регионов
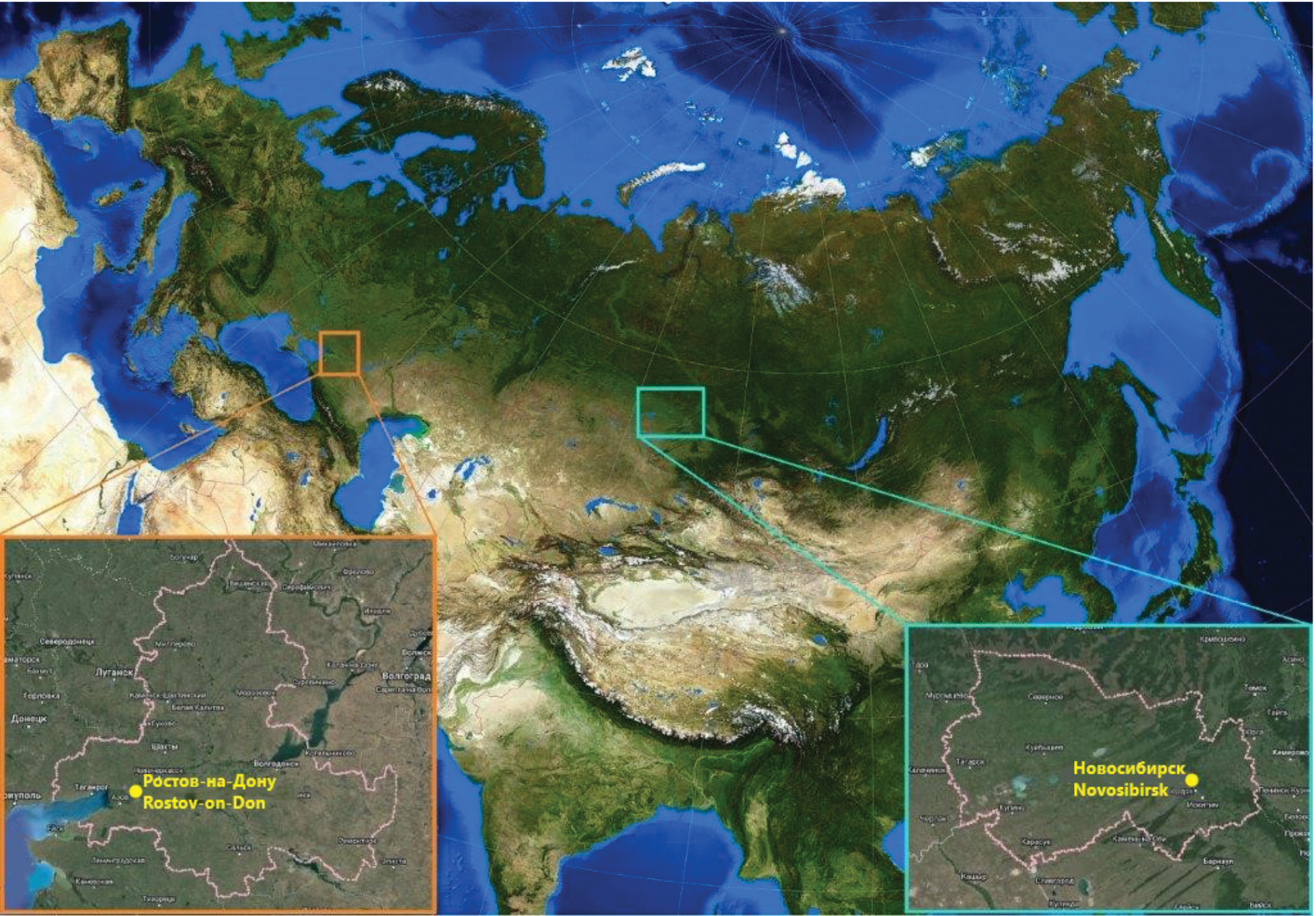
Юг европейской части России. Административным центром Южного федерального округа является Ростовская область (далее – РО), которая расположена между 50º14’ – 45º51’ с.ш. и 38º14’ – 44º20’ в.д. (рисунок), в бассейне Нижнего Дона, включает в себя юго-запад Русской равнины и северо-западную часть Предкавказья. На крайнем юго-западе омывается водами Таганрогского залива Азовского моря, на востоке – Цимлянским водохранилищем. На территории РО распространены три зональных типа природных ландшафтов: степной, сухостепной и полупустынный, которые сменяют друг друга с запада на восток. Степной тип ландшафтов занимает почти всю территорию области, кроме ее юго-восточной части. Сухостепной тип ландшафтов занимает восточную часть Доно-Чирского междуречья и среднюю часть Сало-Манычской равнины, простираясь на запад по долине р. Маныч. Полупустынный тип ландшафтов приурочен к склонам и надпойменным террасам рек восточной окраины Сало-Манычской равнины [12].
Рисунок. Географическое положение анализируемых регионов на карте Евразии, их административные центры.
Оранжевая рамка – Ростовская область, светло-голубая рамка – Новосибирская область.
Figure. Geographical location of the analyzed regions on the map of Eurasia, and their administrative centers.
Orange frame – Rostov region, light blue frame – Novosibirsk region.
Рельеф в основном равнинный. На западе – восточные отроги Донецкого кряжа, на севере – Донская гряда, на юго-востоке – пологие отроги возвышенности Ергени, на юге – Кумо-Манычская впадина. Поверхность области пересечена долинами рек, оврагами и балками. Основная река – Дон с притоками. Лесистость – 2,5% [13]. Также широкое распространение получили искусственные (антропогенные) формы рельефа, особенно на орошаемых землях. Это постоянные и временные оросительные каналы, терриконы, курганы. Согласно данным портала Köppen-Geiger Climate Classification Map (https://www.koppen-map.com/), климат большей части РО классифицируется как Dfa (холодный континентальный, без сухого сезона, жаркое лето), в северных районах области климат относится к типу Dfb (холодный континентальный, без сухого сезона, теплое лето).
Западная Сибирь. Новосибирская область (далее – НСО) как наиболее характерная в климато-географическом отношении территория Сибирского федерального округа расположена между 57º14’ – 53º17’ с.ш. и 75º05’ – 85º07’ в.д. (рисунок), на стыке Алтае-Саянской горной страны и Западно-Сибирской равнины, граница между которыми проходит приблизительно по р. Обь. Долина р. Оби разделяет ее территорию на две неравные части. Левобережная часть, составляющая около 80% территории, расположена на обширной равнине Обь-Иртышского междуречья (Васюганская равнина, Барабинская и Кулундинская низменности). Пологосклонные возвышенности здесь чередуются с обширными низменностями, слабо расчлененными негустой сетью широких плоскодонных и неглубоких долин с медленно текущими реками. В рельефе присутствуют гривы и межгривные понижения, вытянутые с северо-востока на юго-запад, протяженностью в десятки километров. В понижениях – болота и озера. Главная река – Обь. НСО расположена в зонах южной тайги, смешанных лесов и лесостепи, лесистость – 26% [24]. На севере области находится южная часть Васюганской равнины – водораздел между притоками Иртыша и Оби, южная часть самой обширной в мире системы западносибирских верховых болот. Западная и центральная часть области занята Барабинской низменностью с характерным гривным рельефом, многочисленными бессточными озерами и низинными болотами. Для юго-западной и южной частей НСО (Кулундинская равнина) характерно сочетание долин и замкнутых котловин, широко распространены озера с сильно минерализованной водой. Правобережная (восточная) часть НСО характеризуется более расчлененным и возвышенным рельефом. Здесь начинаются отроги Салаирского кряжа – системы пологих холмов-увалов, покрытых лесом, изрезанных глубокими руслами многочисленных мелких рек и ручьев [25]. Климат большей части НСО относится к типу Dfb (холодный континентальный, без сухого сезона, теплое лето). В северных районах области (зона подтаежных лесов) тип климата Dfc (холодный континентальный, без сухого сезона, холодное лето), на юго-западе, в степях Кулундинской равнины климат ряда районов классифицирован как BSk (сухой степной холодный) (https://www.koppen-map.com/).
Таким образом, Западная Сибирь и юг европейской части России располагаются в пределах умеренного климатического пояса Северной Евразии, но существенно отличаются между собой по средним годовым температурам, ландшафтному разнообразию и степенью антропогенной трансформации естественных биоценозов. Эти отличия, в свою очередь, будут оказывать влияние на фауну рукокрылых в этих регионах.
Фауна рукокрылых Западной Сибири и юга европейской части России
Юг европейской части России. По состоянию на 2013 г. на юге европейской части России было документировано 15 видов рукокрылых, относящихся к семейству гладконосых [4, 7], что составляет 33% от видов гладконосых летучих мышей из фауны России. К оседлым видам относятся все ночницы (Myotis daubentonii, M. mystacinus, M. dasycneme, M. aurascens), нетопырь Куля (Pipistrellus kuhlii), поздний кожан (Eptesicus serotinus) и бурый ушан (Plecotus auritus) [4]. В период с мая по сентябрь в разные годы на территории РО регистрировались выводковые колонии лесных нетопырей (P. nathusii), нетопырей-карликов (P. pipistrellus), двухцветных кожанов (Vespertilio murinus), рыжих вечерниц (Nyctalus noctula), а также взрослые особи малого нетопыря (P. pygmaeus), северного кожанка (E. nilssonii), малой (N. leisleri) и гигантской (N. lasiopterus) вечерниц при сезонных миграциях [4].
Ландшафтное распределение рукокрылых в Южном федеральном округе неоднородно вследствие наличия (отсутствия) подходящих мест для дневных убежищ, размножения и зимовки (дупла деревьев, естественные и искусственные пещеры, жилые и хозяйственные помещения) и кормовой базы (временные и постоянные пресные водоемы, где происходит выплод насекомых). Наибольшая частота встречаемости в период активности наблюдается в степной зоне, где были отмечены представители всех 15 видов рукокрылых [7], наиболее многочисленными из которых являются малая и прудовая ночницы, рыжая вечерница, нетопырь Куля, нетопырь-карлик и малый нетопырь. Высокая численность и видовое разнообразие летучих мышей в этой зоне связано с наличием естественных лесов (лесистость в зоне 12%) и заселенностью людьми (наличие жилых и хозяйственных построек). В сухостепной зоне встречаются нетопырь Куля, нетопырь-карлик, двухцветный и поздний кожаны, рыжая вечерница, численность животных при этом ниже, чем в степной зоне. В полупустынной зоне, наименее благоприятной для рукокрылых, описаны немногочисленные встречи нетопыря Куля и позднего кожана [7]. Из 15 видов летучих мышей в РО в искусственных сооружениях, включая жилье человека, регистрировались представители 12 видов (исключение – малая и гигантская вечерницы, степная ночница) [7]. К синантропным видам относятся нетопырь Куля и двухцветный кожан [4].
Опубликованные данные о зимовках летучих мышей на территориях юга европейской части России отрывочны. Достоверно известно о зимовках рыжей вечерницы [26] и нетопыря Куля [27], последний предпочитает зимовать исключительно в постройках человека и может выходить из состояния спячки во время оттепелей. S.V. Gazaryan и соавт. со ссылкой на более ранние исследования сообщают о зимних находках на территории РО прудовой, водяной (M. daubentonii) и усатой (M. mystacinus) ночниц, позднего кожана и бурого ушана [6].
Западная Сибирь. Хироптерофауна Сибири насчитывает 10 видов гладконосых летучих мышей (около 22% от видов Vespertilionidae в России). Информация по видовому составу рукокрылых в Западной Сибири составлена главным образом на основании данных IUCN Red List of Threatened Species (www.iucnredlist.org) вследствие крайне отрывочных сведений в научной литературе. Основные данные о видовом составе касаются мест зимовок рукокрылых в пещерах Салаирского кряжа. A.D. Botvinkin и соавт. приводят данные о наличии в четырех пещерах Салаирского кряжа, находящихся в пределах НСО, 5 видов ночниц – прудовой (M. dasycneme), восточной (M. petax), сибирской (M. sibirica), Иконникова (M. ikonnikovi) и длиннохвостой (M. longicaudatus); сибирского трубконоса (M. hilgendorfi) и сибирского ушана (P. ognevi) за период наблюдения с 1978 по 2009 г. [7]. Присутствие прудовой, восточной, сибирской ночниц и сибирского ушана отмечалось в пещерах в разные сезоны года, а ночницы Иконникова, длиннохвостого и сибирского трубконоса – только в зимнее время. Количество зверьков в пещерах может варьировать в зависимости от разных факторов – года наблюдения, сезона, размеров пещер. Наиболее крупная зимовочная колония летучих мышей находится в Барсуковской пещере (54°22′14′′ с.ш. 83°57′42′′ в.д.) и может насчитывать до нескольких сотен зимующих животных [7]. Данные по видовому распределению рукокрылых и периоду активности в степной, лесостепной и лесной зонах НСО в доступной литературе отсутствуют. Ареал рыжей вечерницы в НСО, согласно www.iucnredlist.org, находится в южных, юго-восточных и восточных районах, животные встречаются только в летний период. Вся территория НСО находится в пределах ареалов двухцветного кожана и северного кожанка (www.iucnredlist.org). Относительно последнего A.D. Botvinkin и соавт. была описана находка взрослой самки у входа в Барсуковскую пещеру в апреле 1981 г. [7]. К оседлым видам можно отнести прудовую, восточную и сибирскую ночниц, сибирского ушана. Официальной статистики по видовому составу летучих мышей, залетающих в летний период в жилые помещения или зимующих в них в населенных пунктах Сибирского федерального округа, нет. Можно предполагать, что в летний период двухцветный кожан, являющийся синантропным видом в разных частях ареала [7], также использует жилые и хозяйственные постройки для выводковых колоний или мест дневных убежищ.
Таким образом, можно заключить, что фауна рукокрылых юга европейской части страны характеризуется большим видовым разнообразием в сравнении с хироптерофауной Западной Сибири. Большая часть видов специфичны для РО или НСО, при этом прудовая ночница, рыжая вечерница, двухцветный кожан и северный кожанок отмечены в обоих регионах. Видовое разнообразие рукокрылых на юго-западе России обусловлено более благоприятным температурным режимом для питания, размножения и зимовки, несмотря на наличие на ее территории больших открытых пространств, лишенных потенциальных мест убежищ. При этом число зимующих видов летучих мышей одинаково для обоих регионов, несмотря на более суровый температурный режим периода зимовки в Сибири. В отличие от РО, где установлена зимовка в населенных пунктах некоторых видов летучих мышей (P. kuhlii и N. noctula), все зимующие в НСО виды формируют зимовочные колонии в пещерах Салаирского кряжа, что делает эти локации уникальными «инкубаторами», поддерживающими в течение нескольких месяцев состояние спячки для сотен зверьков. В целом, видовое разнообразие представителей Chiroptera в рассматриваемых регионах показывает зависимость от зональности и согласуется с моделью глобального распределения рукокрылых, описанной ранее [28].
Потенциал вирусоносительства у гладконосых летучих мышей, обитающих в Западной Сибири и на юге европейской части России
В настоящее время у рукокрылых идентифицированы или изолированы представители 24 семейств РНК-содержащих и 11 семейств ДНК-содержащих вирусов позвоночных [1]. Разнообразие и число видов вирусов, связанных с отрядом Chiroptera, неоднородно и фактически совпадает с распределением животных-хозяев – наибольшее разнообразие вирусов рукокрылых характерно для территорий экваториального, субэкваториального, тропического и субтропического поясов [2, 28]. Для гладконосых летучих мышей умеренного пояса Евразии к актуальным для здравоохранения и часто встречающимся у них вирусам или их маркерам (РНК, вирусные антигены, специфические антитела) можно отнести: лиссавирусы (Rhabdoviridae: Lyssavirus), альфа- и бетакоронавирусы (Coronaviridae: Alphacoronavirus, Betacoronavirus), включая SARS-CoV- и MERS-CoV-подобные, а также астровирусы (Astraviridae: Mamastrovirus), парамиксовирусы (Paramyxoviridae), реовирусы (Spinareoviridae: Orthoreovirus), хепевирусы (Hepeviridae: Chirohepevirus), флавивирусы (Flavivivridae: Flavivirus), наировирусы (Nairoviridae), хантавирусы (Hantaviridae) и вирусы гриппа А (Orthomyxoviridae: Alphainfluenzavirus) [2, 10–13, 29]. Для видов фауны рукокрылых Западной Сибири и юга европейской части страны был проведен поиск информации в открытых источниках о случаях идентификации у них актуальных РНК-содержащих вирусов или их маркеров, таких как лисс- и коронавирусы, за доступный период наблюдения, ввиду их наибольшей актуальности и необходимости в углубленном изучении (таблица). Причем все виды летучих мышей, упомянутые в подразделе, относятся к семейству гладконосых.
Таблица. Вирусы, идентифицированные у видов гладконосых летучих мышей, распространенных в Сибири и на юге европейской части России [2, 9–13, 29]
Table. Viruses identified in species of plain-nosed bats, distributed in Siberia and southern European Russia bats in Siberia and southern European Russia [2, 9–13, 29]
Виды летучих мышей Bat species | Lyssavirus (Rhabdoviridae) | Coronaviridae | Другие вирусы Other viruses | ||||||||||||||||||
KHULV | EBLV-2 | EBLV-1 | RABV | Lissavirus sp. | IRKLV | Alphacoronavirus | Betacoronavirus | MERS-CoV-related | Mamastrovirus | Orthoreovirus sp. | Chirohepevirus | Paramyxovirinae | Yokose virus | Sokuluk virus | Usutu virus | Issyk-Kul virus | Influenza A H3N2 virus | Brno loanvirus | Ledentevirus-like | ||
Юг европейской части России South of the European part of Russia | M. daubentonii | + | + | + | + | + | + | + | + | ||||||||||||
M. mystacinus | + | + | + | + | |||||||||||||||||
M. aurascens | + | ||||||||||||||||||||
P. kuhlii | + | + | + | + | + | + | |||||||||||||||
P. nathusii | + | + | + | + | + | + | |||||||||||||||
P. pipistrellus | + | + | + | + | + | + | + | + | |||||||||||||
P. pygmaeus | + | + | + | ||||||||||||||||||
N. leisleri | + | + | |||||||||||||||||||
N. lasiopterus | + | + | |||||||||||||||||||
P. auritus | + | + | + | + | |||||||||||||||||
E. serotinus | + | + | + | + | + | + | + | ||||||||||||||
Общие виды Common | V. murinus | + | + | + | + | + | + | ||||||||||||||
N. noctula | + | + | + | + | + | + | + | + | + | + | |||||||||||
M. dasycneme | + | + | |||||||||||||||||||
E. nilssonii | + | + | + | ||||||||||||||||||
Сибирь Siberia | M. petax | + | + | + | + | ||||||||||||||||
M. sibirica | + | ||||||||||||||||||||
M. ikonnikovi | + | ||||||||||||||||||||
M. longicaudatus | |||||||||||||||||||||
M. hilgendorfi | + | + | |||||||||||||||||||
P. ognevi | + | ||||||||||||||||||||
Европейский лиссавирус летучих мышей 1 (EBLV-1) широко распространен в популяции позднего кожана E. serotinus в континентальной Европе [13], а в 2018 г. его вирусная РНК была впервые обнаружена у E. serotinus в Великобритании [30]. EBLV-1 является самым распространенным в Европе лиссавирусом после вируса бешенства – в базе GenBank представлены несколько десятков последовательностей полного генома вируса из разных стран, включая Россию (MF187867, LT839613) [24, 25, 31]. По данным Всемирной организации здравоохранения, первый случай лиссавирусной инфекции у летучих мышей в Европе был зарегистрирован в Германии в 1954 г. [32]. Помимо поздних кожанов, считающихся естественным хозяином EBLV-1, маркеры вирусной инфекции (РНК, антиген, специфические антитела) в разное время были обнаружены у нескольких видов рукокрылых [13, 31], при этом изоляты вируса, доступные в GenBank, известны только для E. serotinus [24]. M.A. Selimov и соавт. получили изоляты Yuli-like вируса (EBLV-1) от рыжей вечерницы и двухцветного кожана на Украине [33], что указывает на возможность участия других видов рукокрылых в поддержании циркуляции EBLV-1. Вирус является патогенным для летучих мышей, человека и некоторых домашних животных. В отношении естественного хозяина E. serotinus описаны случаи массовой гибели животных в выводковых колониях [34], бессимптомное вирусоносительство с сероконверсией [35] и спорадическая гибель отдельных особей [36]. Экспериментальное заражение поздних кожанов геновариантом EBLV-1a при внутримозговом и подкожном введении вируса приводило к развитию заболевания, проявляющегося в виде отказа от пищи, тремора, раздражительности, агрессивности, параличей, приводящего к гибели животного [37]. L. Rønsholt и соавт. описан случай изоляции EBLV-1 из нильских крыланов (Rousettus aegyptiacus), погибших с признаками рабической инфекции через 9 дней после переезда из зоопарка Роттердама (Голландия) в Данию [38]. W.H. Van der Poel и соавт. показана патогенность для нильских крыланов изолятов EBLV-1 как от R. aegyptiacus, так и от естественных хозяев E. serotinus при разных путях заражения [39]. I.V. Kuz’min и соавт. показали патогенность российского штамма Yuli (EBLV-1) для нетопырей-карликов при экспериментальном заражении как в активном состоянии, так и при выходе из зимней спячки, в которую они были погружены после заражения [40]. Североамериканские большие бурые кожаны E. fuscus продемонстрировали чувствительность к двум штаммам EBLV-1a при разных путях заражения [41]. Вирус является патогенным для человека – за все время наблюдения документировано 3 случая заражения людей – два в 1977 г. (Украина) [42] и 1985 г. (Россия) [33, 43] и один во Франции в 2019 г. [44]. Инфекция, вызванная EBLV-1 у человека, проявлялась по типу прогрессирующего энцефалита с признаками гидрофобии [33], параличами, застоем слюны и дисфонией [44] и приводила к смерти заболевшего. В 2 случаях установлена связь с рукокрылыми – в случае из России заражение 11-летней девочки произошло после укуса летучей мыши в губу [33], а в случае из Франции во флигеле дома 59-летнего заболевшего мужчины находилась колония летучих мышей [44]. Описаны также случаи инфекции EBLV-1 у диких и домашних животных – у домашних овец в Дании [45], каменной куницы в Германии [46], домашних кошек во Франции [47].
Европейский лиссавирус летучих мышей 2 (EBLV-2) впервые был выделен в Финляндии в 1985 г. из головного мозга 30-летнего мужчины, умершего вследствие энцефалита с признаками рабической инфекции. Заболевший был биологом, работавшим с рукокрылыми и имевшим в анамнезе множественные укусы этих животных [48]. В последующее время вирус или его маркеры были обнаружены у прудовых и водяных ночниц в нескольких странах Западной и Северной Европы [49]. Имеется также сообщение об идентификации EBLV-2 у M. daubentonii на Украине в 1996 г. [50], что, вероятно, является самой восточной точкой обнаружения вируса. В отличие от EBLV-1, изоляция EBLV-2 или выявление его маркеров за все время наблюдения было характерно только для этих двух видов ночниц [13, 49], что свидетельствует о видовой специфичности вируса. Все описанные случаи EBLV-2 у естественных хозяев M. dasycneme и M. daubentonii относятся к одиночным особям, найденным погибшими или больными [51]. Экспериментальная инфекция EBLV-2 у водяных ночниц приводила к развитию болезни и гибели животных только при внутримозговом заражении, при других путях заражения вирус демонстрировал низкую патогенность для естественных хозяев [52]. За весь период наблюдения с 1985 г. описано 2 случая фатального энцефалита у людей, вызванного EBLV-2. В обоих случаях заболеванию предшествовал контакт с рукокрылыми [48, 49]. Случаев заражения EBLV-2 диких и домашних животных на эндемичных территориях отмечено не было.
Интенсивное изучение лиссавирусов у рукокрылых центральной Евразии началось в 80-х гг. прошлого века [43]. Первое сообщение относится к изоляции вируса бешенства от двухцветного кожана в Западной Сибири [53], у которого была исследована патогенность для нетопырей-карликов и беспородных белых мышей [40]. Позже V.A. Ternovoĭ и соавт. подтвердили наличие РНК вируса бешенства в образцах головного мозга восточной ночницы M. petax (DQ860254, DQ860249, DQ860255) и ушана Огнева P. ognevi (DQ860256), собранных в местах зимовок в НСО в 2001–2002 гг. [54]. A.I. Karagulov и соавт. обнаружили РНК вируса бешенства в образцах головного мозга V. murinus и E. serotinus из 6 областей Казахстана, включая Северо-Казахстанскую область, географически и экологически близкую к южным районам Западной Сибири [55]. Для одного образца от E. serotinus удалось определить нуклеотидную последовательность участка N гена (OP585396) вируса бешенства, что является подтверждением его циркуляции среди рукокрылых этого вида. Таким образом, изоляция вируса и неоднократное обнаружение его РНК у представителей нескольких видов рукокрылых центральной Евразии позволяют расширить представление об участии этих животных в циркуляции вируса бешенства в этом регионе.
С рассматриваемыми в данной работе видами усатая ночница и сибирский трубконос связаны, соответственно, лиссавирусы Худжанд (Khujand) (KHULV) и Иркут (IRKLV) [43]. Лиссавирус Худжанд был изолирован в 2001 г. в окрестностях г. Худжанд (Таджикистан) от самки усатой ночницы с признаками заторможенности [56]. Это единственное сообщение об изоляции вируса. Случаев заболевания, вызванного KHULV у людей или животных, в последующие годы описано не было. Лиссавирус Иркут был изолирован от самца сибирского трубконоса в 2002 г. в г. Иркутске (Россия). Животное залетело в квартиру и несколько дней находилось на передержке, в течение которых развивались слабость, отказ от пищи и воды, приведшие к последующей гибели [57]. Y. Liu и соавт. IRKLV был изолирован из головного мозга клинически здорового самца большого трубконоса M. leucogaster, отловленного в 2012 г. в провинции Цзилинь в Китае [42]. Вирус является патогенным для человека – G.N. Leonova и соавт. описан случай фатального лиссавирусного энцефалита у 20-летней девушки в 2007 г. в Приморском крае (Россия). В анамнезе заболевшей была травма губы, полученная от летучей мыши примерно за месяц до начала болезни. Из головного мозга умершей был изолирован вирус Ozernoe, последовательность полного генома которого (FJ905105) продемонстрировала 92% гомологии с геномом IRKLV, выделенного из M. hilgendorfi [58]. В 2017 г. РНК IRKLV была обнаружена в головном мозге умершей собаки в Китае, в г. Фусин, провинция Ляонин [58]. Экспериментальное внутримышечное заражение китайским штаммом IRKV-THChina12 домашних собак и кошек показало низкую (20% летальность) патогенность IRKLV для собак и среднюю (60% летальность) для кошек [59]. Серологическое обследование рукокрылых из Центральной Европы (Чехия, Польша) и России (Алтайский край), проведенное V. Seidlova и соавт., выявило наличие антител к лиссавирусам у представителей видов, у которых ранее были изолированы лиссавирусы или обнаруживалась вирусная РНК [60]. Серопозитивные особи встречались среди N. noctula в Чехии, среди российских V. murinus, M. hilgendorfi, и M. petax, а также впервые среди сибирских ночниц (M. sibirica). Ночницы M. petax и M. sibirica относятся к оседлым видам, в связи с чем обнаружение у них маркеров лиссавирусной инфекции свидетельствует о циркуляции лиссавирусов в их западносибирской популяции.
В настоящее время у рукокрылых в разных регионах мира идентифицированы многочисленные альфа- и бетакоронавирусы. С гладконосыми Vespertilionidae связана наибольшая частота встречаемости РНК альфакоронавирусов в Европе и Азии, в то время как для бетакоронавирусов они являются вторыми по частоте обнаружения вирусной РНК после подковоносых Rhinolophidae в Европе, и третьими после Rhinolophidae и крыланов Pteropodidae в Азии [61]. Внутри рода Alphacoronavirus вирусы 9 из 14 подродов были идентифицированы у рукокрылых, при этом с гладконосыми связаны подроды Colacovirus, Pedacovirus, Nyctacovirus и Myotacovirus. Внутри Betacoronavirus 4 подрода из 5 ассоциированы с рукокрылыми, из которых только Merbecovirus был обнаружен у гладконосых [62].
Носительство коронавирусов среди европейских видов рукокрылых достаточно хорошо изучено – C. Kohl и соавт. приводят данные по находкам РНК альфа- и бетакоронавирусов у рукокрылых в разных странах Европы за несколько лет наблюдений [10]. У рукокрылых из фауны России также был обнаружен генетический материал альфа- и бетакоронавирусов, включая SARS-CoV- и MERS-CoV-подобные [63–67]. РНК альфакоронавирусов была обнаружена в образцах фекалий P. kuhlii, отловленных в г. Ростов-на-Дону в 2021 г. [64]. РНК коронавирусов (без идентификации до рода) также была обнаружена в орофарингеальных мазках P. kuhlii и E. serotinus в соседних с Ростовской областью регионах – Республике Адыгея и Краснодарском крае [65], что свидетельствует о циркуляции коронавирусов среди рукокрылых на юге России. По данным литературы, с нетопырями ассоциированы MERS-CoV-подобные вирусы в нескольких странах Европы, включая Россию [21, 22, 66]. Рукокрылые центральной Евразии в этом отношении изучены недостаточно. A.I. Karagulov и соавт. обнаружили РНК альфакоронавирусов в образцах фекалий V. murinus и E. serotinus в западных и южных областях Казахстана [55].
Относительно недавно РНК альфакоронавирусов была идентифицирована у восточных ночниц и ночниц Иконникова (M. ikonnikovi) на юге Западной Сибири [67], что указывает на необходимость дополнительных исследований коронавирусов в популяциях рукокрылых в этом регионе.
Все перечисленные выше случаи выявления коронавирусов у рукокрылых в Европе и центральной Евразии касаются только обнаружения вирусной РНК без выделения живых вирусов. Патогенность выявленных коронавирусов для их естественных хозяев не установлена. A. Moreno и соавт. идентифицировали полный геном MERS-CoV-подобного вируса в свежих трупиках P. kuhlii и H. savii, полученных из Центра реабилитации рукокрылых [22], однако нельзя утверждать, что именно MERS-подобный коронавирус был в этих случаях причиной смерти животных. Из наземных животных в Евразии только у ежей (Erinaceus europaeus, E. amurensis) за все время наблюдения были идентифицированы генетически близкие к рукокрылым MERS-подобные коронавирусы [68–70] без каких-либо клинических проявлений. Случаев заражения людей коронавирусами рукокрылых в Европе или центральной Евразии описано не было. Однако, учитывая разнообразие выявленных коронавирусов, в том числе MERS-CoV-подобных у мигрирующих (P. nathusii) и синантропных (P. kuhlii) видов рукокрылых, актуальным является мониторинг этих вирусов в популяциях рукокрылых, как в Западной Сибири, так и на юге европейской части России.
Заключение
Таким образом, в настоящее время в европейской части России у гладконосых летучих мышей выявлена циркуляция представителей таких вирусных родов и семейств, как лиссавирусы, альфа- и бетакоронавирусы, астровирусы, парамиксовирусы, реовирусы, хепевирусы, флавивирусы, наировирусы, хантавирусы и вирусы гриппа А. Среди них летальные случаи в человеческой популяции были установлены для европейского лиссавируса летучих мышей EBLV-1. На территориях Западной Сибири у гладконосых летучих мышей установлено наличие лиссавирусов EBLV-1 и IRKLV. Причем лиссавирус Иркут был изолирован от большого трубконоса Murina leucogaster (г. Иркутск). Альфакоронавирусы были выявлены среди рукокрылых как на территориях Западной Сибири, так и в европейской части России. Однако на европейских территориях помимо альфакоронавирусов были идентифицированы и бетакоронавирусы, включая SARS-CoV- и MERS-CoV-подобные. В целом у гладконосых летучих мышей юга европейской части России количество выявленных вирусов выше, чем в Сибири, что позволяет сделать вывод о более высоком потенциале вирусоносительства. Доказанное присутствие таких опасных для человека вирусов, как европейский лиссавирус летучих мышей, в популяциях семейства гладконосых этих регионов свидетельствует о существовании опасности возникновения природных очагов инфицирования. В этой связи необходимы дальнейшие систематические исследования видового состава и распределения генетических вариантов лисса- и коронавирусов у гладконосых летучих мышей на данных территориях.
По состоянию на 2024 г. млекопитающие семейства Vespertilionidae являются природными резервуарами или переносчиками ряда опасных для человека вирусов. В то же время в РФ эпидемический потенциал вирусов, выявляемых у этих животных, изучен недостаточно и фрагментарно, что не дает возможности для надежного прогнозирования ситуации. Однозначно должен быть пересмотрен подход к мониторингу и оценке существующих эпидемиологических угроз, особенно в связи с пандемией новой коронавирусной инфекции (COVID-19), причиной которой стал известный факт, но недостаточно изученный ранее.
Об авторах
Олеся Викторовна Охлопкова
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; Научно-исследовательский институт вирусологии ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Автор, ответственный за переписку.
Email: ohlopkova.lesia@yandex.ru
ORCID iD: 0000-0002-8214-7828
канд. биол. наук, старший научный сотрудник лаборатории экспериментальной фармакологии отдела молекулярной диагностики и эпидемиологии, старший научный сотрудник лаборатории геномики и эволюции вирусов
Россия, 111123, г. Москва; 630060, г. НовосибирскЮлия Владимировна Кононова
Научно-исследовательский институт вирусологии ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: yuliakononova07@yandex.ru
ORCID iD: 0000-0002-3677-3668
канд. биол. наук, старший научный сотрудник
Россия, 630060, г. НовосибирскМарина Алексеевна Тюменцева
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: tyumantseva@cmd.ru
ORCID iD: 0000-0002-3145-3702
канд. биол. наук, заведующий лабораторией геномного редактирования отдела молекулярной диагностики и эпидемиологии
Россия, 111123, г. МоскваАлександр Игоревич Тюменцев
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: tyumantsev@cmd.ru
ORCID iD: 0000-0003-0537-2586
канд. биол. наук, заведующий лабораторией экспериментальной фармакологии отдела молекулярной диагностики и эпидемиологии
Россия, 111123, г. МоскваАлександр Михайлович Шестопалов
Научно-исследовательский институт вирусологии ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: amshestopalov@frcftm.ru
ORCID iD: 0000-0002-9734-0620
д-р биол. наук, профессор, заслуженный деятель науки РФ, директор
Россия, 630060, г. НовосибирскВасилий Геннадьевич Акимкин
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: akimkin@pcr.ms
ORCID iD: 0000-0003-4228-9044
д-р мед. наук, академик РАН, профессор, заслуженный врач Российской Федерации, лауреат Премии Правительства Российской Федерации в области науки и техники, директор
Россия, 111123, г. МоскваСписок литературы
- Van Brussel K., Holmes E.C. Zoonotic disease and virome diversity in bats. Curr. Opin. Virol. 2022; 52: 192–202. https://doi.org/10.1016/j.coviro.2021.12.008
- Liu Z., Liu Q., Wang H., Yao X. Severe zoonotic viruses carried by different species of bats and their regional distribution. Clin. Microbiol. Infect. 2024; 30(2): 206–10. https://doi.org/10.1016/j.cmi.2023.09.025
- Полещук Е.М., Тагакова Д.Н., Сидоров Г.Н., Орлова Т.С., Гордейко Н.С., Кайсаров А.Ж. Случаи летальной лиссавирусной инфекции у людей после контактов с рукокрылыми на Дальнем Востоке России в 2019–2021 гг. Вопросы вирусологии. 2023; 68(1): 45–58. https://doi.org/10.36233/0507-4088-156 https://elibrary.ru/bjmlbx
- Сидорчук А.А. Рец. на кн.: Макаров В.В., Гулюкин А.М., Гулюкин М.И. Бешенство: естественная история на рубеже столетий. М.: ЗооВетКнига; 2015. Вопросы вирусологии. 2018; 63(1): 48. https://elibrary.ru/yoomce
- Алексеева С.В. Рец. на кн.: Макаров В.В., Лозовой Д.А. Новые особо опасные инфекции, ассоциированные с рукокрылыми. Владимир; 2016. Ветеринария сегодня. 2017; (2): 67–8. https://elibrary.ru/yrtnpb
- Газарян С.В., Бахтадзе Г.Б., Малиновкин А.В. Современное состояние изученности рукокрылых ростовской области. Plecotus et al. 2010; (13): 50–8. https://elibrary.ru/wcnffh
- Ботвинкин А.Д., ВахрушевА.В., Кузьмин И.В., Морозов П.Н., Шевырногов С.З. Из истории наблюдений за рукокрылыми в пещерах Салаира (Новосибирская область). Plecotus et al. 2015; (18): 45–53. https://elibrary.ru/vucerz
- Arai S., Yanagihara R. Genetic diversity and geographic distribution of bat-borne hantaviruses. Curr. Issues. Mol. Biol. 2020; 39: 1–28. https://doi.org/10.21775/cimb.039.001
- Wang B., Yang X.L. Chirohepevirus from bats: insights into hepatitis E virus diversity and evolution. Viruses. 2022; 14(5): 905. https://doi.org/10.3390/v14050905
- Kohl C., Nitsche A., Kurth A. Update on potentially zoonotic viruses of European bats. Vaccines (Basel). 2021; 9(7): 690. https://doi.org/10.3390/vaccines9070690
- Johnson N., Cunningham A.F., Fooks A.R. The immune response to rabies virus infection and vaccination. Vaccine. 2010; 28(23): 3896–901. https://doi.org/10.1016/j.vaccine.2010.03.039
- Wambugu E.N., Kimita G., Kituyi S.N., Washington M.A., Masakhwe C., Mutunga L.M., et al. Geographic distribution of rabies virus and genomic sequence alignment of wild and vaccine strains, Kenya. Emerg. Infect. Dis. 2024; 30(8): 1642–50. https://doi.org/10.3201/eid3008.230876.
- Maier H.J., Bickerton E., Britton P. Preface. Coronaviruses. Methods Mol. Biol. 2015; 1282: v. https://doi.org/10.1007/978-1-4939-2438-7
- de Vries A.A.F., Horzinek M.C., Rottier P.J.M., de Groot R.J. The genome organization of the nidovirales: similarities and differences between Arteri-, Toro-, and Coronaviruses. Semin. Virol. 1997; 8(1): 33–47. https://doi.org/10.1006/smvy.1997.0104
- Poon L.L., Chu D.K., Chan K.H., Wong O.K., Ellis T.M., Leung Y.H., et al. Identification of a novel coronavirus in bats. J. Virol. 2005; 79(4): 2001–9. https://doi.org/10.1128/JVI.79.4.2001-2009.2005
- Li W., Shi Z., Yu M., Ren W., Smith C., Epstein J.H., et al. Bats are natural reservoirs of SARS-like coronaviruses. Science. 2005; 310(5748): 676–9. https://doi.org/10.1126/science.1118391
- Dominguez S.R., O’Shea T.J., Oko L.M., Holmes K.V. Detection of group 1 coronaviruses in bats in North America. Emerg. Infect. Dis. 2007; 13(9): 1295–300. https://doi.org/10.3201/eid1309.070491
- Müller M.A., Paweska J.T., Leman P.A., Drosten C., Grywna K., Kemp A., et al. Coronavirus antibodies in African bat species. Emerg. Infect. Dis. 2007; 13(9): 1367–70. https://doi.org/10.3201/eid1309.070342
- Gloza-Rausch F., Ipsen A., Seebens A., Göttsche M., Panning M., Drexler J.F., et al. Detection and prevalence patterns of group I coronaviruses in bats, northern Germany. Emerg. Infect. Dis. 2008; 14(4): 626–31. https://doi.org/10.3201/eid1404.071439
- Carrington C.V., Foster J.E., Zhu H.C., Zhang J.X., Smith G.J., Thompson N., et al. Detection and phylogenetic analysis of group 1 coronaviruses in South American bats. Emerg. Infect. Dis. 2008; 14(12): 1890–3. https://doi.org/10.3201/eid1412.080642
- Annan A., Baldwin H.J., Corman V.M., Klose S.M., Owusu M., Nkrumah E.E., et al. Human betacoronavirus 2c EMC/2012-related viruses in bats, Ghana and Europe. Emerg. Infect. Dis. 2013; 19(3): 456–9. https://doi.org/10.3201/eid1903.121503
- Moreno A., Lelli D., de Sabato L., Zaccaria G., Boni A., Sozzi E., et al. Detection and full genome characterization of two beta CoV viruses related to Middle East respiratory syndrome from bats in Italy. Virol. J. 2017; 14(1): 239. https://doi.org/10.1186/s12985-017-0907-1
- Zhou P., Yang X.L., Wang X.G., Hu B., Zhang L., Zhang W., et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020; 579(7798): 270–3. https://doi.org/10.1038/s41586-020-2012-7
- Forró B., Marton S., Fehér E., Domán M., Kemenesi G., Cadar D., et al. Phylogeny of Hungarian EBLV-1 strains using whole-genome sequence data. Transbound. Emerg. Dis. 2021; 68(3): 1323–31. https://doi.org/10.1111/tbed.13789
- Selimov M.A., Tatarov A.G., Botvinkin A.D., Klueva E.V., Kulikova L.G., Khismatullina N.A. Rabies-related Yuli virus; identification with a panel of monoclonal antibodies. Acta Virol. 1989; 33(6): 542–6.
- Смирнов Д.Г., Забашта А.В. Распространение рыжей вечерницы (Nyctalus noctula) в ростовской области и проблема расширения северной границы области её зимовки. Российский журнал биологических инвазий. 2023; 14(4): 621–33. https://doi.org/10.35885/1996-1499-16-3-168-183 https://elibrary.ru/raavaq
- Миноранский В.А., Малиновкин А.В. Нетопырь куля (Pipistrellus kuhlii kuhl.) в Ростовской области. Известия высших учебных заведений. Северо-Кавказский регион. Серия: естественные науки. 2015; (2): 80–3. https://elibrary.ru/txjfqr
- Alves D.M.C.C., Diniz-Filho J.A.F., Souza K.D, Gouveia S.F., Villalobos F. Geographic variation in the relationship between large-scale environmental determinants and bat species richness. Basic Appl. Ecol. 2018; 27: 1–8. https://doi.org/10.1016/j.baae.2017.12.002
- Yang W., Schountz T., Ma W. Bat influenza viruses: current status and perspective. Viruses. 2021; 13(4): 547. https://doi.org/10.3390/v13040547
- Folly A.J., Marston D.A., Golding M., Shukla S., Wilkie R., Lean F.Z.X., et al. Incursion of European Bat Lyssavirus 1 (EBLV-1) in serotine bats in the United Kingdom. Viruses. 2021; 13(10): 1979. https://doi.org/10.3390/v13101979
- Harris S.L., Brookes S.M., Jones G., Hutson A.M., Racey P.A., Aegerter J., et al. European bat lyssaviruses: Distribution, prevalence and implications for conservation. Biol. Conserv. 2006; 131(2): 193–210. https://doi.org/10.1016/j.biocon.2006.04.006
- Pérez-Jordá J.L., Ibánez C., Muñoz-Cervera M., Téllez A. Lyssavirus in Eptesicus serotinus (Chiroptera: Vespertilionidae). J. Wildl. Dis. 1995; 31(3): 372–7. https://doi.org/10.7589/0090-3558-31.3.372
- Selimov M.A., Smekhov A.M., Antonova L.A., Shablovskaya E.A., King A.A., Kulikova L.G. New strains of rabies-related viruses isolated from bats in the Ukraine. Acta Virol. 1991; 35(3): 226–31.
- Picard-Meyer E., Servat A., Wasniewski M., Gaillard M., Borel C., Cliquet F. Bat rabies surveillance in France: first report of unusual mortality among serotine bats. BMC Vet. Res. 2017; 13(1): 387. https://doi.org/10.1186/s12917-017-1303-1
- Robardet E., Borel C., Moinet M., Jouan D., Wasniewski M., Barrat J., et al. Longitudinal survey of two serotine bat (Eptesicus serotinus) maternity colonies exposed to EBLV-1 (European Bat Lyssavirus type 1): Assessment of survival and serological status variations using capture-recapture models. PLoS Negl. Trop. Dis. 2017; 11(11): e0006048. https://doi.org/10.1371/journal.pntd.0006048
- Mingo-Casas P., Sandonís V., Obón E., Berciano J.M., Vázquez-Morón S., Juste J., et al. First cases of European bat lyssavirus type 1 in Iberian serotine bats: Implications for the molecular epidemiology of bat rabies in Europe. PLoS Negl. Trop. Dis. 2018; 12(4): e0006290. https://doi.org/10.1371/journal.pntd.0006290
- Freuling C., Vos A., Johnson N., Kaipf I., Denzinger A., Neubert L., et al. Experimental infection of serotine bats (Eptesicus serotinus) with European bat lyssavirus type 1a. J. Gen. Virol. 2009; 90(Pt 10): 2493–502. https://doi.org/10.1099/vir.0.011510-0
- Rønsholt L., Sørensen K.J., Bruschke C.J., Wellenberg G.J., van Oirschot J.T., Johnstone P., et al. Clinically silent rabies infection in (zoo) bats. Vet. Rec. 1998; 142(19): 519–20. https://doi.org/10.1136/vr.142.19.519
- Van der Poel W.H., van der Heide R., van Amerongen G., van Keulen L.J., Wellenberg G.J., Bourhy H., et al. Characterisation of a recently isolated lyssavirus in frugivorous zoo bats. Arch. Virol. 2000; 145(9): 1919–31. https://doi.org/10.1007/s007050070066
- Kuz’min I.V., Botvinkin A.D., Shaĭmardanov R.T. Experimental lyssavirus infection in chiropters. Voprosy virusologii. 1994; 39(1): 17–21.
- Franka R., Johnson N., Müller T., Vos A., Neubert L., Freuling C., et al. Susceptibility of North American big brown bats (Eptesicus fuscus) to infection with European bat lyssavirus type 1. J. Gen. Virol. 2008; 89(Pt 8): 1998–2010. https://doi.org/10.1099/vir.0.83688-0
- Liu Y., Zhang S., Zhao J., Zhang F., Hu R. Isolation of Irkut virus from a Murina leucogaster bat in China. PLoS Negl. Trop. Dis. 2013; 7(3): e2097. https://doi.org/10.1371/journal.pntd.0002097
- Kuzmin I.V., Botvinkin A.D., Poleschuk E.M., Orciari L.A., Rupprecht C.E. Bat rabies surveillance in the former Soviet Union. Dev. Biol. (Basel). 2006: 125: 273–82.
- Regnault B., Evrard B., Plu I., Dacheux L., Troadec E., Cozette P., et al. First case of lethal encephalitis in Western Europe due to European bat lyssavirus type 1. Clin. Infect. Dis. 2022; 74(3): 461–6. https://doi.org/10.1093/cid/ciab443
- Tjørnehøj K., Fooks A.R., Agerholm J.S., Rønsholt L. Natural and experimental infection of sheep with European bat lyssavirus type-1 of Danish bat origin. J. Comp. Pathol. 2006; 134(2-3): 190–201. https://doi.org/10.1016/j.jcpa.2005.10.005
- Müller T., Cox J., Peter W., Schäfer R., Johnson N., McElhinney L.M., et al. Spill-over of European bat lyssavirus type 1 into a stone marten (Martes foina) in Germany. J. Vet. Med. B. Infect. Dis. Vet. Public Health. 2004; 51(2): 49–54. https://doi.org/10.1111/j.1439-0450.2003.00725.x
- Dacheux L., Larrous F., Mailles A., Boisseleau D., Delmas O., Biron C., et al. European bat Lyssavirus transmission among cats, Europe. Emerg. Infect. Dis. 2009; 15(2): 280–4. https://doi.org/10.3201/eid1502.080637
- Lumio J., Hillbom M., Roine R., Ketonen L., Haltia M., Valle M., et al. Human rabies of bat origin in Europe. Lancet. 1986; 1(8477): 378. https://doi.org/10.1016/s0140-6736(86)92336-6
- McElhinney L.M., Marston D.A., Wise E.L., Freuling C.M., Bourhy H., Zanoni R., et al. Molecular epidemiology and evolution of European bat lyssavirus 2. Int. J. Mol. Sci. 2018; 19(1): 156. https://doi.org/10.3390/ijms19010156
- Harris S.L., Brookes S.M., Jones G., Hutson A.M., Racey P.A., Aegerter J., et al. European bat lyssaviruses: Distribution, prevalence and implications for conservation. Biol. Conserv. 2006; 131(2): 193–210. https://doi.org/10.1016/j.biocon.2006.04.006
- Johnson N., Wakeley P.R., Brookes S.M., Fooks A.R. European bat lyssavirus type 2 RNA in Myotis daubentonii. Emerg. Infect. Dis. 2006; 12(7): 1142–4. https://doi.org/10.3201/eid1207.060287
- Johnson N., Vos A., Neubert L., Freuling C., Mansfield K.L., Kaipf I., et al. Experimental study of European bat lyssavirus type-2 infection in Daubenton’s bats (Myotis daubentonii). J. Gen. Virol. 2008; 89(Pt. 11): 2662–72. https://doi.org/10.1099/vir.0.2008/003889-0
- Ботвинкин А.Д. Вирус бешенства выделен от летучей мыши в Западной Сибири. Журнал микробиологии, эпидемиологии и иммунобиологии. 1988; 65(7): 97–8. https://elibrary.ru/tfsull
- Терновой В.А., Зайковская А.В., Томиленко А.А., Рассадкин Ю.Н., Аксенов В.И., Чаусов Е.В., et al. Лиссавирусы у летучих мышей, обитающих на юге Западной Сибири. Вопросы вирусологии. 2005; 50(1): 31–4. https://elibrary.ru/hrxxvd
- Karagulov A.I., Argimbayeva T.U., Omarova Z.D., Tulendibayev A.B., Dushayeva L.Z., Svotina M.A., et al. The prevalence of viral pathogens among bats in Kazakhstan. Viruses. 2022; 14(12): 2743. https://doi.org/10.3390/v14122743
- Kuzmin I.V., Orciari L.A., Arai Y.T., Smith J.S., Hanlon C.A., Kameoka Y., et al. Bat lyssaviruses (Aravan and Khujand) from Central Asia: phylogenetic relationships according to N, P and G gene sequences. Virus Res. 2003; 97(2): 65–79. https://doi.org/10.1016/s0168-1702(03)00217-x
- Botvinkin A.D., Poleschuk E.M., Kuzmin I.V., Borisova T.I., Gazaryan S.V., Yager P., et al. Novel lyssaviruses isolated from bats in Russia. Emerg. Infect. Dis. 2003; 9(12): 1623–5. https://doi.org/10.3201/eid0912.030374
- Leonova G.N., Somova L.M., Belikov S.I., Kondratov I.G., Plekhova N.G., Krylova N.V., et al. The fatal case of lyssavirus encephalitis in the Russian Far East. Encephalitis. 2013. https://doi.org/10.5772/52869
- Chen T., Miao F.M., Liu Y., Zhang S.F., Zhang F., Li N., et al. Possible transmission of Irkut virus from dogs to humans. Biomed. Environ. Sci. 2018; 31(2): 146–8. https://doi.org/10.3967/bes2018.017
- Seidlova V., Zukal J., Brichta J., Anisimov N., Apoznański G., Bandouchova H., et al. Active surveillance for antibodies confirms circulation of lyssaviruses in Palearctic bats. BMC Vet. Res. 2020; 16(1): 482. https://doi.org/10.1186/s12917-020-02702-y
- Wang Z., Huang G., Huang M., Dai Q., Hu Y., Zhou J., et al. Global patterns of phylogenetic diversity and transmission of bat coronavirus. Sci. China Life Sci. 2023; 66(4): 861–74. https://doi.org/10.1007/s11427-022-2221-5
- Ruiz-Aravena M., McKee C., Gamble A., Lunn T., Morris A., Snedden C.E., et al. Ecology, evolution and spillover of coronaviruses from bats. Nat. Rev. Microbiol. 2022; 20(5): 299–314. https://doi.org/10.1038/s41579-021-00652-2
- Alkhovsky S., Lenshin S., Romashin A., Vishnevskaya T., Vyshemirsky O., Bulycheva Y., et al. SARS-like coronaviruses in Horseshoe bats (Rhinolophus spp.) in Russia, 2020. Viruses. 2022; 14(1): 113. https://doi.org/10.3390/v14010113
- Korneenko E.V., Samoilov A.E., Chudinov I.K., Butenko I.O., Sonets I.V., Artyushin I.V., et al. Alphacoronaviruses from bats captured in European Russia in 2015 and 2021 are closely related to those of Northern Europe. Front. Ecol. Evol. 2024; 12: 1324605. https://doi.org/10.3389/fevo.2024.1324605
- Popov I.V., Ohlopkova O.V., Donnik I.M., Zolotukhin P.V., Umanets A., Golovin S.N., et al. Detection of coronaviruses in insectivorous bats of Fore-Caucasus, 2021. Sci. Rep. 2023; 13(1): 2306. https://doi.org/10.1038/s41598-023-29099-6
- Speranskaya A.S., Artiushin I.V., Samoilov A.E., Korneenko E.V., Khabudaev K.V., Ilina E.N., et al. Identification and Genetic Characterization of MERS-Related Coronavirus Isolated from Nathusius’ Pipistrelle (Pipistrellus nathusii) near Zvenigorod (Moscow Region, Russia). Int. J. Environ. Res. Public Health. 2023; 20(4): 3702. https://doi.org/10.3390/ijerph20043702
- Яшина Л.Н., Жигалин А.В., Абрамов С.А., Лучникова Е.М., Сметанникова Н.А., Дупал Т.А. и др. Выявление коронавирусов (Coronaviridae) у рукокрылых на территории Северного Кавказа и юга Западной Сибири. Вопросы вирусологии. 2024; 69(3): 255–65. https://doi.org/10.36233//0507-4088-233 https://elibrary.ru/konejo
- Corman V.M., Kallies R., Philipps H., Göpner G., Müller M.A., Eckerle I., et al. Characterization of a novel betacoronavirus related to middle East respiratory syndrome coronavirus in European hedgehogs. J. Virol. 2014; 88(1): 717–24. https://doi.org/10.1128/JVI.01600-13
- Pomorska-Mól M., Ruszkowski J.J., Gogulski M., Domanska-Blicharz K. First detection of Hedgehog coronavirus 1 in Poland. Sci. Rep. 2022; 12(1): 2386. https://doi.org/10.1038/s41598-022-06432-z
- Lau S.K.P., Luk H.K.H., Wong A.C.P., Fan R.Y.Y., Lam C.S.F., Li K.S.M., et al. Identification of a novel Betacoronavirus (Merbecovirus) in Amur hedgehogs from China. Viruses. 2019; 11(11): 980. https://doi.org/10.3390/v11110980
Дополнительные файлы