Дефектные провирусы ВИЧ: возможное участие в патогенезе ВИЧ-инфекции
- Авторы: Бобкова М.Р.1
-
Учреждения:
- ФГБНУ «НИИ вакцин и сывороток им. И.И. Мечникова»
- Выпуск: Том 69, № 5 (2024)
- Страницы: 399-414
- Раздел: ОБЗОРЫ
- URL: https://virusjour.crie.ru/jour/article/view/16678
- DOI: https://doi.org/10.36233/0507-4088-261
- EDN: https://elibrary.ru/pselci
- ID: 16678
Цитировать
Аннотация
Обзорная статья содержит анализ информации, полученной в результате поиска литературы по теме «дефектные геномы ВИЧ (ВИЧ, Human immunodeficiency virus-1, Lentivirus, Orthoretrovirinae, Retroviridae)». Рассматриваются вопросы происхождения дефектных геномов ВИЧ, возможность их транскрипции и трансляции, участие дефектных РНК и белков в стимуляции естественного и адаптивного иммунитета, вклад в патогенез ВИЧ-инфекции и гиперактивацию иммунной системы в условиях успешной антиретровирусной терапии (АРТ), эволюционные процессы в популяции провирусов ВИЧ под действием АРТ, возможные проблемы разработок элиминации резервуаров и эрадикации ВИЧ, связанные с существованием дефектных ВИЧ.
Ключевые слова
Полный текст
Введение
Широкое внедрение и совершенствование антиретровирусной терапии (АРТ) позволило существенно снизить заболеваемость и смертность людей, живущих с ВИЧ (ЛЖВ). Действие АРТ направлено на одновременное ограничение нескольких этапов репликации вируса и предотвращение заражения новых клеток-мишеней, однако полное излечение ВИЧ-инфекции остается недостижимым вследствие существования резервуаров – как клеточных (латентно инфицированных клеток, содержащих провирусную ДНК ВИЧ), так и анатомических (органов и тканей, где продолжается репликация вируса) [1, 2].
По этой причине отмена лечения даже после длительного отсутствия вирусной нагрузки (ВН) неизбежно приводит к быстрому восстановлению продукции вируса. Пожизненное лечение увеличивает ожидаемый срок жизни ЛЖВ, практически приближая его к среднестатистическому для неинфицированных людей, однако может быть осложнено токсичностью АРТ-препаратов, взаимодействием лекарств, проблемами соблюдения режима лечения, стигматизацией, а также значительными экономическими затратами.
Успех АРТ в клинических условиях принято оценивать снижением ВН до неопределяемого уровня (обычно менее 20–50 копий РНК/мл крови) и ростом абcолютного и относительного числа CD4+ Т-клеток. Несмотря на улучшение функции иммунной системы на фоне успешной АРТ, у ЛЖВ отмечается более высокий риск новых заболеваний и смерти от серьезных осложнений, не связанных со СПИДом, по сравнению с неинфицированными лицами того же возраста. Среди состояний повышенного риска находятся рак, не связанный со СПИДом, хронические сердечно-сосудистые заболевания, заболевания печени и почек. Как теперь установлено [3–5], этот повышенный риск обусловлен хорошо известным феноменом повышения маркеров хронического воспаления и иммунной активации (гиперактивации) [2, 6–9]. Маркеры активации не зависят от эффективности подавления ВН и продолжают возрастать в течение жизни даже у самых успешных пациентов с длительно неопределяемой ВН; также практически не зависит от успеха АРТ и объем резервуаров [10, 11].
На сегодняшний день причина ВИЧ-ассоциированной хронической активации иммунной системы у ЛЖВ остается не до конца понятной. Предполагается, что роль в этом феномене играют несколько процессов; к ним относятся микробная транслокация [12], хроническая коинфекция с другими патогенами, такими как цитомегаловирус [13], особенности генетики хозяина [14], факторы образа жизни (например, курение и употребление наркотиков) [15], а также явление так называемой низкой виремии (low level viremia) ВИЧ, источником которой, по всей вероятности, является периодическая активация резервуаров [16–18].
Между тем значительное число работ в последние годы было посвящено так называемым «дефектным» (далее без кавычек) геномам вирусов (к их числу относятся вирус гриппа, буньявирусы, флавивирусы, альфавирусы, коронавирусы, пикорнавирусы) [19, 20], в том числе провирусам ВИЧ (defective provirus). Сам факт их существования был описан очень давно – в 1997 г. было обнаружено значительное присутствие провирусных геномов ВИЧ, имеющих делеции разного размера, в периферических мононуклеарных клетках (peripheral blood mononuclear cells) у ЛЖВ [21]. Как стало очевидно позднее, дефектные провирусы не просто часто встречаются, а составляют от 90% [11] до 99,8% [10] всей провирусной популяции.
Общим свойством дефектных провирусов является их неспособность производить инфекционные вирусные частицы, и в течение ряда лет консенсусное мнение считало их «тупиковым продуктом» размножения ВИЧ, образующим «кладбище» вирусов [22]. Данные последних лет дают основания полностью пересмотреть эту точку зрения и утверждать, что провирусы ВИЧ у пациентов, получающих АРТ и достигших полной супрессии репликации ВИЧ (далее – АРТ-пациенты), не являются дефектными в общем смысле, а скорее, представляют собой неполные формы провирусов, способные производить транскрипты клеточно-ассоциированной РНК и экспрессировать новые белки, связанные с ВИЧ. Эта информация дает основу для анализа возможного участия дефектных вирусов в патофизиологии ВИЧ-инфекции в условиях успешной АРТ, включая феномен хронической активации иммунной системы. Некоторые из известных на данный момент сведений о дефектных провирусах ВИЧ будут изложены в данном обзоре.
Происхождение дефектных геномов ВИЧ
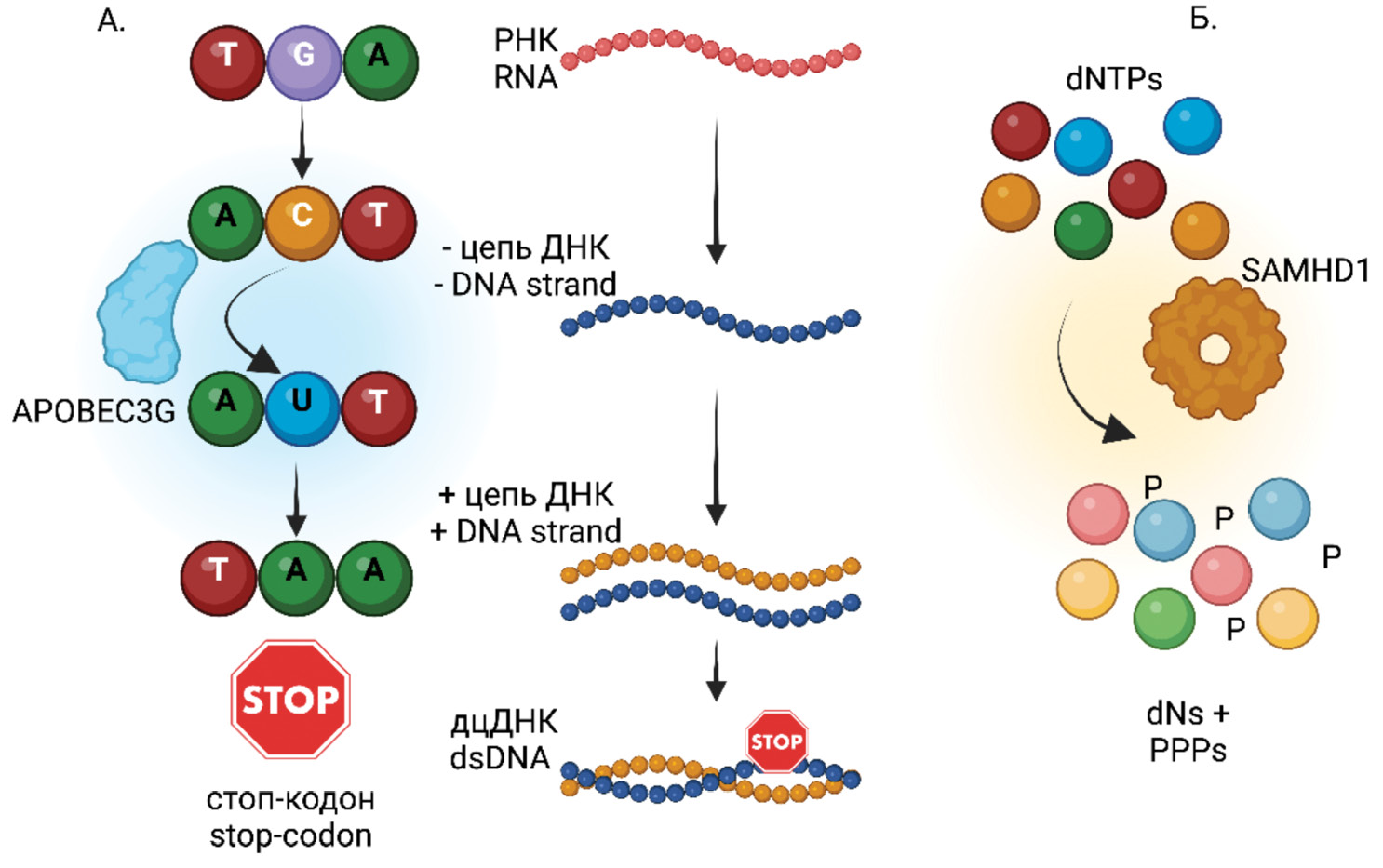
Формирование дефектных геномов ВИЧ является результатом комбинации ошибок, происходящих на разных этапах репликации вируса, действия хозяйских факторов рестрикции и последующего отбора под контролем иммунной системы [23]. Наиболее уязвимым в отношении ошибок является, бесспорно, этап обратной транскрипции (reverse transcription). Обратная транскриптаза (reverse transcriptase, RT) ВИЧ на стадии синтеза кДНК работает с невысокой точностью и совершает около 10−5 ошибочных включений нуклеотидов (мутаций)/нуклеотид/цикл репликации, при этом у фермента отсутствует механизм коррекции (proofreading). В дополнение к этому мутации и делеции генерируются в момент смены матрицы в ходе обратной транскрипции, когда RT совершает характерные «прыжки» [24]. Более того, процесс обратной транскрипции включает диссоциацию RT и повторную инициацию синтеза на матрице геномной РНК, что приводит к образованию мутантных и укороченных промежуточных продуктов кДНК ВИЧ [23, 25–27] (рис. 1). Малые делеции (один/несколько нуклеотидов) также способны нанести заметный урон провирусной ДНК, проявляющийся образованием стоп-кодонов или сдвигом рамки считывания [22, 25].
Рис. 1. Причины формирования дефектных ВИЧ.
а ‒ делеции фрагментов генома ВИЧ; б ‒ гипермутации G→A на примере APOBEC3G; в ‒ инсерция (вставка); г ‒ стоп-кодоны; д ‒ механическое повреждение ДНК.
Fig. 1. Causes of Defective HIV Virus Formation.
a ‒ deletions in HIV genome fragments; b ‒ G→A hypermutations, illustrated with APOBEC3G; c ‒ insertions; d ‒ stop codons; e ‒ mechanical DNA damage.
Помимо больших и малых делеций, у дефектных провирусов можно встретить «нехватки» 5’- и 3’-концевых фрагментов генома и инверсии участков генома, образующиеся преимущественно на стадии RT, а также гипермутации и дефекты донорно-акцепторных участков сплайсинга [10, 27–29].
Вклад в формирование делеций может вносить клеточный фактор рестрикции SAMHD1 [30–34], который снижает внутриклеточную концентрацию нуклеотидов в покоящихся CD4+ Т-клетках и миелоидных клетках, ограничивая таким образом эффективность и завершение обратной транскрипции. Другой рестрикционный фактор хозяйской клетки – APOBEC3G – также действует на этапе обратной транскрипции, выступая в роли цитидиндезаминазы (C→U) в составе вновь синтезированной минус-цепи кДНК. Результатом становится гипермутация ВИЧ, вызванная заменой гуанина на аденин (G→A) в составе плюс-цепи ДНК и сопряженная с формированием стоп-кодонов [32, 35, 36] (рис. 2).
Рис. 2. Вклад рестрикционных факторов хозяйской клетки в формирование мутаций в геноме ВИЧ на этапе обратной транскрипции.
а – APOBEC3G – цитидиндезаминаза; б – SAMHD1 – фосфогидролаза.
Fig. 2. Contribution of Host Cell Restriction Factors to the Formation of Mutations in the HIV Genome During Reverse Transcription.
a ‒ APOBEC3G – a cytidine deaminase; b ‒ SAMHD1 – a phosphohydrolase.
Наконец, ошибки в последовательности провируса могут появляться и на этапе его интеграции в хромосомную ДНК клетки. Этот сложнейший процесс, описанный многими авторами [30, 37, 38], здесь детализирован не будет, напомним лишь, что последний этап интеграции – перенос цепи – требует «достраивания» концевых фрагментов провируса с участием хозяйских ферментов репарации ДНК. Механизм восстановления поврежденных ДНК, как известно, подвержен ошибкам (error-prone) [39], которые и становятся источником дефектных провирусов.
Дефектные геномы могут транскрибироваться
В условиях успешной АРТ большинство клеток, несущих провирусную ДНК, находятся в латентном состоянии и не производят вирусных частиц, тем не менее, как оказалось, до 7% провирусов остаются транскрипционно активными [40]. Транскрипция в латентно инфицированных клетках происходит так же, как и в клетках с активной репликацией ВИЧ, и включает несколько этапов, подробно описанных в литературе [2, 41].
Кратко, длинный концевой повтор ВИЧ (long terminal repeat, LTR) действует как энхансер и промотор, рекрутирующий активаторы транскрипции клетки-хозяина, репрессоры, факторы ремоделирования хроматина и комплекс РНК-полимеразы – RNAP II, каждый из которых влияет на активацию или репрессию транскрипции. Регуляторный белок ВИЧ Tat связывает петлю TAR (trans-activation response) – элемент на 5’-конце первичного транскрипта ВИЧ – и рекрутирует PTEFb (positive transcription elongation factor b), кофактор, который повышает процессивность RNAPII. Результатом ее активности становятся полноразмерные транскрипты РНК ВИЧ. Часть из них становится в последующем геномной РНК и входит в состав новых вирусных частиц; несплайсированные матричные РНК (мРНК) нужны также для синтеза белков Gag и Pol, другая часть РНК подвергается сплайсингу с образованием белков Env, Vif, Vpr и Vpu (частично (однократно) сплайсированная мРНК) и Tat, Rev и Nef (множественно сплайсированный вариант мРНК) (рис. 3).
Рис. 3. Варианты сплайсинга полноразмерной РНК ВИЧ.
Fig. 3. Splicing Variants of Full-Length HIV RNA.
Значительная часть провирусных последовательностей, обнаруженных у ЛЖВ, получающих АРТ, являются дефектными и содержат мутации, которые могут затрагивать структуру LTR, основные донорные последовательности сплайсинга и ψ-упаковочный элемент (шпилечная последовательность РНК, необходимая для димеризации геномов в ходе упаковки [42]). Как выяснилось, в крови пациентов с полностью подавленной ВН обнаруживаются транскрипты как интактных, так и дефектных провирусов в сопоставимых количествах [11, 28, 43], при этом результат транскрипции последних зависит от характера и масштаба дефекта.
Отсутствие промоторного 5′-концевого фрагмента приводит к формированию неканонических транскриптов РНК, содержащих последовательности env и nef (рис. 3); в этом случае, по-видимому, используются альтернативные участки для инициации транскрипции, например, такие участки имеются в составе гена env [28]. Если дефект затрагивает донорные участки сплайсинга, проблема решается путем использования механизмов альтернативного сплайсинга [44]; в этот процесс активно вмешиваются внутригенные цис-действующие элементы (intragenic cis-acting elements), взаимодействующие с транскрипционным аппаратом клетки.
Еще один способ образования транскриптов на матрице дефектных провирусов – синтез антисмысловой (antisense) РНК на комплементарной цепи ДНК, начиная с 3’-LTR. Факт существования таких транскриптов подтвержден [45], однако неясно пока, регулируется ли антисмысловая транскрипция теми же сигнальными каскадами, что и транскрипция с 5’-LTR.
Нередко у дефектных вирусов бывает делетирована область генома tat/rev; в этих случаях уровень транскрипции без белка Tat заметно снижается, а экспорт РНК из ядра клетки оказывается затруднен в отсутствие белка Rev [10].
Наконец, наличие делеций и стоп-кодонов приводит к преждевременной остановке синтеза мРНК, и такие короткие транскрипты также обнаруживаются у АРТ-пациентов [28].
Таким образом, даже в случае успеха АРТ в клетках пациентов на заметном уровне детектируются несплайсированые и частично сплайсированные РНК – производные интактных провирусов, а также разнообразные неканонические РНК, имеющие происхождение от дефектных провирусов.
Дефектные геномы могут производить белки
Присутствие в латентно инфицированных клетках значительного количества необычных РНК закономерно поставило вопрос о том, способны ли они служить матрицей для синтеза белков. Ответ на этот вопрос уже получен, и сейчас хорошо известно, что значительная часть неканонических РНК обеспечивает трансляцию белков – таких же аномальных, как и их нуклеотидные матрицы [17, 28, 44].
Чаще всего дефекты провируса – делеции, инверсии и точечные мутации – связаны с нарушением рамок считывания (open reading frame, ORF), и очевидным выходом из этой ситуации является использование альтернативных ORFs; такие, обычно укороченные (криптические), белки действительно можно найти у успешных АРТ-пациентов [22, 28, 46]. Альтернативный сплайсинг РНК аналогичным образом приводит к образованию аберрантных белков [44].
Описаны также случаи использования альтернативных трансляционных стартовых кодонов (например, вместо традиционного AUG-кодона инициация синтеза белков может происходить с участием кодона CUG), трансляции антисмысловых РНК, а также механизма leaky ribosomal scanning, когда рибосома, столкнувшись с «неблагоприятным нуклеотидным контекстом» вокруг стартового кодона, продолжает движение вдоль молекулы РНК в поисках оптимального места «посадки» [23].
Вопрос о том, могут ли аномальные белки формировать вирусоподобные частицы, пока остается открытым. Не менее интересен вопрос об их иммуногенности, и в этом отношении некоторая определенность уже достигнута. Показано, например, что дефектные рибосомные продукты (defective ribosomal products, DRiPs) быстро деградируют по протеасомному пути и «загружаются» на молекулы MHC-I, экспонирующие их на поверхности клетки [28]. Та же судьба постигает и белки – продукты антисмысловых РНК, при этом они вызывают образование циркулирующих антител [47]. Наконец, неканонические пептиды ВИЧ активируют CD8+ Т-клетки от ЛЖВ, получающих АРТ, что также указывает на наличие у них иммуностимулирующей активности [48].
Все эти наблюдения наводят на мысль о том, что дефектные провирусы ВИЧ, не способные дать жизнеспособное потомство и не являющиеся по этой причине вполне «живыми» (один из исследователей назвал их «зомби-вирусами» [22]), сохраняют способность генерировать важные для патогенеза инфекции макромолекулы. Вопрос о том, каким образом криптические транскрипты и белки – продукты дефектных провирусов становятся иммуномодуляторами и влияют на иммунные реакции хозяина, активно изучается.
Неканонические РНК и естественный иммунитет
В цикле размножения ВИЧ участвуют несколько видов нуклеиновых кислот вируса: вирусная РНК, кДНК, РНК-транскрипты провирусной ДНК – в цитозоле, провирусная ДНК и РНК-транскрипты – в ядре клетки. Все эти молекулы способны выступить в роли внутриклеточных патоген-ассоциированных молекулярных паттернов (intracellular pathogen-associated molecular patterns, PAMPs) и взаимодействовать с патоген-распознающими рецепторами (pathogen recognition receptors, PRRs) [23].
К PRRs, распознающим молекулы ДНК, прежде всего относится цитозольный ДНК-сенсор cGAS (cyclic guanosine adenosine synthase) [49]. В норме ДНК в цитоплазме находиться не должна, и обнаружение чужеродной ДНК вирусного или бактериального происхождения является решающим элементом иммунитета у многих организмов. В клетках млекопитающих для решения этой задачи имеется система cGAS-STING (cyclic GMP-AMP synthase – stimulator of interferon genes).
После связывания ДНК cGAS выступает в роли аллостерического триггера реакции между GMP и AMP с образованием циклического cGAMP, который, в свою очередь, связывает молекулы стимулятора генов интерферона (STING), стимулирующего фосфорилирование IRF3 (interferon regulatory factor 3). Цепочка событий завершается перемещением IRF3 в ядро клетки и транскрипцией генов интерферонов α и ß (рис. 4) [49].
Рис. 4. Молекулы РНК и ДНК ВИЧ – стимуляторы естественного иммунитета.
ДНК-сенсоры: IFI16 и комплекс cGAS-STING; РНК-сенсоры: MAVS и RIG-1; IRF3 – фактор регуляции интерферона.
Fig. 4. HIV RNA and DNA Molecules as Stimulators of Innate Immunity.
DNA sensors: IFI16 and the cGAS-STING complex; RNA sensors: MAVS and RIG-1; IRF3 – interferon regulatory factor.
Белок IFI16 (gamma-interferon-inducible protein 16) – еще один ДНК-сенсор, который также рекрутирует STING после связывания с ДНК. Последующие события приводят к индукции интерферонов и провоспалительных цитокинов. В дополнение к этому наблюдается пироптоз (pyroptosis) CD4+ T-клеток – ускоренная программируемая гибель клеток, сопровождающаяся активным выделением клеткой интерлейкина (IL) 1β и IL-18 [50].
РНК ВИЧ, в свою очередь, привлекает к себе внимание цитозольных РНК-сенсоров; одним из примеров служит тандем белков MAVS (mitochondrial antiviral-signaling protein) и RIG-1 (retinoic acid-inducible gene I) [51].
Белок MAVS расположен на внешней мембране митохондрий, пероксисом и эндоплазматического ретикулума. При вирусной инфекции цитозольный белок RIG-1 (иногда вместо него работает Toll-like рецептор TLR-3) обнаруживает присутствие вируса и связывается с MAVS. После присоединения нескольких клеточных белков [51] формируется MAVS-сигнальный комплекс, результатом деятельности которого становится фосфорилирование и перемещение в ядро уже упомянутого фактора IRF3, а вслед за этим – традиционная активация транскрипции генов интерферонов и провоспалительных цитокинов (рис. 4) [23].
Таким образом, в инфицированной клетке всегда находятся ВИЧ-ассоциированные молекулы ДНК и РНК, действующие как PAMPs и инициирующие воспалительный ответ естественных механизмов иммунной системы. Данных, прямо указывающих на участие в этих процессах неканонических ДНК и РНК – продуктов дефектных геномов ВИЧ, в литературе пока нет. Впрочем, поскольку описанный процесс распознавания РНК/ДНК носит неспецифический характер, нет оснований считать, что эти молекулы могут вести себя принципиально иначе, чем интактные РНК, и на сегодняшний момент большинство специалистов убеждены в том, что именно дефектные РНК и ДНК являются основными триггерами сигнальных каскадов воспалительной реакции естественного звена иммунитета у пациентов в отсутствие ВН ВИЧ.
Белки – продукты дефектных геномов ВИЧ и гиперактивация иммунной системы
Образующиеся в ходе транскрипции дефектных провирусов ВИЧ неканонические РНК также имеют разнообразные дефекты, поэтому, как уже упоминалось выше, если таким РНК суждено стать матрицей для трансляции, образующиеся (аберрантные, криптические) белки отличаются от обычных белков вируса размерами, структурой и антигенными свойствами [28, 44]. Тем не менее дефекты не обязательно затрагивают все гены вируса, и в случае сохранения рамок считывания и целостности отдельных генов после завершения процессов созревания РНК (сплайсинга и модификации) такие РНК вполне могут стать матрицей для трансляции полноценных белков ВИЧ. Так, в работе [46] было продемонстрировано длительное присутствие белков Nef и Gag у АРТ-пациентов после достижения неопределяемой ВН. Авторы исследования [52] наблюдали сходные результаты и сделали правомерные выводы о том, что продукция белка Nef в условиях отсутствия активной репликации вируса, хотя бы частично, объясняется наличием пула клеток, несущих трансляционно-компетентные дефектные провирусы.
Аберрантные белки наряду с интактными белками ВИЧ сохраняли способность вызывать CD4 и CD8 T-клеточный ответ [22, 28]. В работе [4] в качестве суррогатного маркера количества вирусных белков в плазме крови АРТ-пациентов использовали интенсивность полос на вестерн-блоте, параллельно оценивая количество интактных провирусов. Как оказалось, антитела к белкам ВИЧ сохранялись у таких пациентов в течение 10–20 лет после достижения неопределяемой ВН, т.е. прекращения репликации вируса. К этому моменту интактных геномов почти не оставалось, а пул провирусов был представлен в основном дефектными геномами, которые и выполняли роль матрицы для синтеза вирусных белков-антигенов.
Таким образом, набор белков в клетке, несущей дефектный провирус, включает как интактные, так и криптические белки ВИЧ, при этом и те и другие способны вызывать иммунный ответ – как гуморальный, так и клеточный (рис. 5). Независимо от направленности этого ответа, иммунные клетки у АРТ-успешных пациентов оказываются вовлеченными в непрерывный процесс антигенной стимуляции, которая, по мнению многих экспертов, и является причиной хронической активации иммунной системы [4, 17, 22, 28]. Этот же феномен лежит в основе так называемого «истощения» ВИЧ-специфических CD8+ цитотоксических лимфоцитов [53, 54].
Рис. 5. Формирование клеточного иммунного ответа на интактные и дефектные белки ВИЧ.
Fig. 5. Formation of the Cellular Immune Response to Intact and Defective HIV Proteins.
Поиски прямых подтверждений наличия ассоциации между персистенцией неполноразмерных (т.е. дефектных) клеточно-ассоциированных (cell associated, CA) РНК ВИЧ, гуморальным ответом на ВИЧ (количеством антител) и маркерами воспаления (цитокин IL-6, D-димер) привели к обнаружению прямой корреляции между ними [4]. Аналогично, в работе [43] содержание коротких (т.е. неканонических) CA РНК было сильно ассоциировано со степенью хронической иммунной активации, определяемой коэкспрессией HLA-DR и CD38 на CD8+ Т-клетках. Эти и другие наблюдения послужили доказательством связи между экспрессией дефектных ВИЧ и активацией иммунной системы; авторы отмечают, что этот феномен, в свою очередь, может приводить к недостаточному увеличению количества клеток CD4+, несмотря на высокую эффективность АРТ (т.е. в отсутствие репликации вируса); клиницисты называют такие результаты дискордантными.
В совокупности результаты исследования дефектных РНК и белков ВИЧ все ближе подводят к выводу о том, что персистирующие дефектные провирусы, особенно те из них, которые транскрипционно активны, не являются «генетическим мусором», не имеющим отношения к патогенезу ВИЧ-инфекции и ее лечению, а, напротив, в ходе успешной АРТ обеспечивают непрерывное (и, к сожалению, избыточное) взаимодействие между «остаточной экспрессией» генов ВИЧ и иммунной системой [10, 55].
Дефектные геномы ВИЧ и методы оценки резервуаров
Сохранение латентных вирусных геномов у ЛЖВ, получающих АРТ, является основным препятствием на пути излечения от ВИЧ-инфекции [1, 2]. Вирусные резервуары – это прежде всего клетки, содержащие геномы ВИЧ, которые обладают способностью продуцировать инфекционные вирионы. Разработки, направленные на эрадикацию или функциональное излечение ВИЧ-инфекции, обязательно должны основываться на том или ином методе количественной оценки объема резервуара, позволяющем измерить эффект воздействия испытуемого препарата. Важно подчеркнуть здесь, что истинным резервуаром можно считать только те клетки, в которых латентный вирус может быть индуцирован (активирован) с последующим образованием новых вирионов.
Точная количественная оценка клеточных резервуаров ВИЧ является сложной задачей и основана на двух основных подходах – с применением культуральных либо молекулярных методов. Первая группа методов (дорогих и трудоемких) действительно измеряет количество только индуцируемых («живых», или репликативно компетентных) провирусов, однако условия индукции в культуре клеток заметно отличаются от природных, и значительную часть провирусов индуцировать не удается. По этой причине результаты применения таких методов оказываются многократно занижены по отношению к реальному объему резервуара. Вторая группа, основанная на вариантах ПЦР, проста и экономически эффективна, но эти методы так же многократно переоценивают объем резервуаров, поскольку не способны различить между собой интактные и дефектные геномы ВИЧ [29, 56]. Таким образом, единый простой подход, который позволил бы одновременно оценить генетическую целостность и индуцируемость резервуара, все еще отсутствует. Попытки объединить в одном методе достоинства каждого из подходов делаются постоянно, и многие из них демонстрируют впечатляющие результаты [2], однако до сих пор не позволяют сравнивать между собой данные, полученные в разных лабораториях мира. Тем не менее существует возможность производить сравнительные оценки в динамике наблюдения пациента либо между группами пациентов, обследуемых в одном эксперименте. Именно так были получены данные, касающиеся изучения состава популяции персистирующих геномов ВИЧ («провирусного ландшафта»).
Клональная экспансия и активация латентных провирусов ВИЧ
Вопросы происхождения так называемой «остаточной виремии», т.е. присутствия единичных копий РНК ВИЧ в плазме крови у пациентов с ВН, не определяемой обычными методами, давно и много дебатируются в литературе [18, 57–59] и в данном обзоре детально обсуждаться не будут. Кратко, общепринятое мнение состоит в том, что появление новых вирусных частиц у таких пациентов связано главным образом не с продолжающейся репликацией вируса, которая ингибирована препаратами АРТ, а является результатом продукции вируса из латентно инфицированных клеток, время от времени размножающихся в ходе клональной экспансии (рис. 6).
Рис. 6. Происхождение вирусных частиц ВИЧ.
а – продолжающаяся репликация ВИЧ с повторными циклами заражения; б – клональная экспансия с последующей периодической активацией провируса.
Fig. 6. Origin of HIV Viral Particles.
a ‒ ongoing HIV replication with repeated infection cycles; b ‒ clonal expansion followed by periodic activation of the provirus.
Клональной экспансией называют процесс быстрого деления клеток, приводящий к размножению генетически идентичных клонов клеток из одной родительской клетки. Свидетельства такого развития событий применительно к латентно инфицированным ВИЧ клеткам были получены в работах, посвященных анализу участков интеграции провирусной ДНК у вирусов, выделенных от АРТ-пациентов с отсутствием ВН.
Основная гипотеза этих исследований была основана на том, что встраивание провируса в хромосомную ДНК – процесс случайный, поэтому в случае повторяющихся циклов заражения будут выявлены разные участки локализации провирусов в хозяйской ДНК. Если же источником вируса являются одни и те же покоящиеся клетки, содержащие один вид ДНК с одинаковой точкой интеграции, генетический анализ выявит полное единообразие провирусов и их локализации, поскольку независимая интеграция ДНК ВИЧ с идентичной локализацией в разных клетках очевидно невозможна (рис. 7). Именно последний вариант был обнаружен в указанных исследованиях [60, 61]. Важно заметить, что для большинства латентных клеток деление в ходе экспансии не является поводом для активации провируса, и по окончании митоза они сохраняют свое «бездеятельное» состояние.
Рис. 7. Вариабельность ВИЧ и участков интеграции провируса в условиях продолжающейся репликации (а) и клональной экспансии (б).
Fig. 7. Variability of HIV and Provirus Integration Sites Under Conditions of ongoing replication (a); clonal expansion (b).
С пониманием причин активации провируса в покоящихся Т-клетках дело обстоит сложнее, и вероятных причин, по-видимому, несколько. Наиболее обсуждаемая тема – влияние участка интеграции провирусного генома в хромосомную ДНК на вероятность его транскрипции. Все больше данных свидетельствуют о том, что интеграция провируса ВИЧ вблизи транскрипционно активных участков хромосомы (геномный контекст провируса) может влиять на его экспрессию (рис. 8) [17, 55, 62]. Провирус, встроившийся вблизи активно транскрибируемого хозяйского гена, имеет больше шансов на собственную экспрессию, т.к. предположительно оказывается в благоприятном окружении способствующих транскрипции эпигенетических факторов. Одним из таких факторов оказался H3K36me3 – модифицированный гистон H3, известный своим участием в экcпрессии генов человека [63]. Среди других причин активации провируса ВИЧ – воздействие факторов физической и химической природы, инфекционные заболевания, вакцинация, а также уровень гиперактивации иммунной системы в целом [18, 64].
Рис. 8. Влияние геномного контекста провируса ВИЧ на эффективность его транскрипции.
а – интеграция в участок эухроматина; б – интеграция в гетерохроматиновую область генома.
Fig. 8. Effect of the Genomic Context of the HIV Provirus on Transcription Efficiency.
a ‒ integration into a euchromatic region; b ‒ integration into a heterochromatic region of the human genome.
Эти рассуждения относятся прежде всего к интактным провирусам, и специальных исследований, оценивающих эффективность транскрипции дефектных геномов ВИЧ, пока почти нет. Ответ на этот вопрос требует технически сложных экспериментов, поскольку для него необходима комбинированная оценка целостности провируса и его транскрипционной активности в одной и той же клетке. В недавнем уникальном исследовании был использован флуоресцентный метод гибридизации in situ (flow-fluorescence in situ hybridization, FISH) в одной клетке для идентификации ВИЧ-инфицированных клеток, которые экспрессируют вирусную РНК в ходе АРТ [65]. Как показали результаты исследования, почти все провирусы ВИЧ, секвенированные из клеток, содержащих клеточно-ассоциированную РНК (СА) ВИЧ, были дефектными. Даже если предположить, что эффективность транскрипции
таких провирусов снижена по отношению к интактным геномам, следует не забывать о значительном преобладании дефектных вариантов ВИЧ; даже низкого уровня транскрипции и трансляции этих персистирующих провирусов может быть достаточно, чтобы вызвать и поддерживать воспалительные и иммунные реакции у АРТ-пациентов [23, 28].
Эволюция популяции латентных провирусов ВИЧ
Итак, в поддержании хронической активации иммунной системы у АРТ-пациентов принимают участие оба вида провирусов – интактные и дефектные, однако, как выяснилось, провирусный ландшафт в динамике лечения претерпевает изменения.
Во-первых, анализ интактных провирусных последовательностей у ЛЖВ до и после начала АРТ указывает на то, что подавляющая часть скрытого интактного резервуара ВИЧ у АРТ-пациентов состоит из вирусов, циркулировавших в момент начала лечения. После достижения неопределяемой ВН механизмам эволюции, в роли которых прежде всего выступают CD8+ цитотоксические клетки, становится «не с чем работать», и в ходе АРТ заметных эволюционных событий в популяции вируса не происходит [66]. Эти результаты вновь поддерживают точку зрения о том, что репликация ВИЧ не является механизмом поддержания резервуара ВИЧ в ходе успешной терапии, и после начала АРТ основным источником ВН становится периодическая активация резервуаров, содержащих однородные провирусные геномы (рис. 9).
Рис. 9. Основные события эволюции популяции провирусов ВИЧ.
а – период от заражения до начала АРТ; б–г – клональная экспансия как основной источник вирусной нагрузки; в – отбор провирусов, встроенных в гетерохроматиновые участки генома хозяина; г – отбор дефектных провирусов. Этапы в и г происходят параллельно.
Fig. 9. Key Events in the Evolution of the HIV Proviral Population.
a ‒ the period from infection to the start of ART; b‒d ‒ clonal expansion as the main source of HIV; c ‒ selection of proviruses integrated into heterochromatic regions of the host genome; d ‒ selection of defective proviruses. Stages C and D occur in parallel.
Во-вторых, соотношение интактных и дефектных вирусов в динамике АРТ оказалось непостоянным, и во многих исследованиях было показано, что в ходе лечения доля интактных провирусов постепенно снижается [10, 28, 55]. Если перед началом АРТ она составляла до 36%, то спустя 3 года после достижения неопределяемой ВН пропорция снижалась до 6% [22].
В-третьих, были получены важные данные о локализации провирусных геномов ВИЧ. Весьма любопытно выглядят результаты сравнительного исследования локализации интактных и дефектных провирусов у элитных контроллеров, поддерживающих неопределяемую ВН в отсутствие АРТ: как оказалось, первые из них преимущественно обнаруживаются в участках гетерохроматина, характеризующихся низким уровнем транскрипции, а вторые – в активно транскрибируемых эухроматиновых участках [67]. Это позволило авторам высказать гипотезу о том, что иммунная система с течением времени формирует резервуар вируса, отдавая предпочтение тем из провирусов, которые располагаются в «безмолвных» регионах хозяйского генома. Эксперименты по реактивации провируса подтвердили это предположение: относительно небольшие группы латентно инфицированных клеток легко индуцировались с образованием новых вирионов, в то время как вторая, более крупная группа инфицированных клеток содержала интактный провирус, более устойчивый к реактивации [55]. Авторы считают, что интактные провирусы, интегрированные в участки гетерохроматина и демонстрирующие признаки «глубокой латентности», по-видимому, обладают преимуществами для отбора и сохраняются в течение длительного времени, вероятно, из-за очень низкой или отсутствия провирусной транскрипции и последующей защиты от антивирусного иммунного распознавания.
Все вышесказанное однозначно указывает на то, что популяция резервуарных клеток, содержащих провирусы ВИЧ, с течением времени претерпевает существенную эволюцию под действием иммунной системы, при этом критическим моментом является начало АРТ (рис. 9). Картина в целом выглядит примерно следующим образом: формирование резервуара ВИЧ происходит в течение 7–10 сут после заражения, при этом провирусный ландшафт достаточно разнообразен и включает дефектные провирусы. Главным фактором иммунной системы, воздействующим на процесс эволюции провирусной популяции, становится цитотоксический ответ Т-лимфоцитов (CD8+), устраняющих клетки, экспрессирующие чужеродные вирусные белки [10].
Быстрые эволюционные изменения, наблюдаемые в популяции ВИЧ до начала АРТ, сменяются стабилизацией и снижением вариабельности провирусов вскоре после ее назначения. В ходе лечения иммунная система непрерывно удаляет репликативно компетентные провирусы и отбирает интактные провирусы, которые находятся в состоянии «глубокой латентности», т.е. в составе гетерохроматина. Некоторые авторы [10, 19] называют этот процесс «естественным излечением» на фоне АРТ, которое, впрочем, никогда не заканчивается эрадикацией вируса. В условиях хронической ВИЧ-инфекции клетки, несущие дефектные провирусы, могут не распознаваться хозяином как чужеродные из-за неадекватной презентации главным комплексом гистосовместимости [46]. Это может служить объяснением преимущественной клональной экспансии и персистенции клеток, несущих дефектные провирусы, которые со временем занимают доминирующее положение [55].
У пациентов, в течение длительного времени получающих успешную АРТ, более 90% провирусов представлены дефектными геномами. Эти геномы вносят заметный вклад в гиперактивацию иммунной системы и истощение цитотоксических клеток, но не являются источником «возвращения» вируса в случае прекращения АРТ. Напротив, большинство интактных провирусов теоретически способны продуцировать репликативно компетентные вирусы, однако в реальности доля таких провирусов невелика, и большинство из них не удается вывести из состояния латентности путем индукции [68].
Дефектные провирусы и эрадикация ВИЧ
Главная практическая цель АРТ на сегодняшний день – неограниченно долгое поддержание неопределяемой ВН. Для большинства ЛЖВ эта цель является вполне достижимой, однако по мере приобретения опыта лечения и получения новых знаний становится понятно, что отсутствие ВН – не всегда достаточное условие восстановления здоровья, и риски коморбидных заболеваний повышены даже у самых успешных АРТ-пациентов. Новой целью исследователей закономерно стала полная эрадикация ВИЧ-инфекции либо ее функциональное излечение, и литература последних лет содержит лавинообразно увеличивающееся количество информации на эту тему.
Текущие стратегии излечения ВИЧ-инфекции сосредоточены либо на ликвидации провирусного резервуара ВИЧ, либо на перманентной инактивации латентных провирусов, либо на генно-терапевтических подходах [1, 2]. Примерами первой группы предлагаемых подходов являются многообразные технологии «kick-and-kill», включающие активацию пула латентных провирусов с последующей интенсивной АРТ и параллельным применением терапевтической вакцины. Предполагается, что все активированные провирусы произведут вирусные частицы, которые будут уничтожены CTL-клетками, а новые раунды заражения будут предотвращены при помощи АРТ-ингибиторов. Альтернативный подход «block-and-lock» из второй группы методов основан на применении инактивирующих агентов или специально сконструированных транскрипционных репрессоров, которые надежно и стойко ингибируют транскрипцию провирусов ВИЧ, оставшиеся же в составе хромосомной ДНК геномы ВИЧ должны будут «мирно сосуществовать» со своим генным окружением, как это делают эндогенные ретровирусы. Наконец, многочисленная группа методов генной терапии основывается на всех существующих технологиях, например, CRISPR-Cas9 или нуклеазах с «цинковыми пальцами»; основная проблема здесь – сложность доставки генного инструментария во все инфицированные клетки взрослого организма.
Существование дефектных провирусов способно осложнить разработку и внедрение всех перечисленных методов, поскольку можно предположить, что все они будут иметь минимальное влияние на присутствие дефектных геномов ВИЧ. Информация о том, как регулируется транскрипция дефектных провирусных последовательностей, носит крайне ограниченный характер, и неизвестно, повлияют ли агенты реверсии латентности (latency reversing agents), используемые kick-and-kill для активации провирусов, или репрессоры транскрипции, необходимые для реализации стратегии block-and-lock, на активность внутригенных цис-транскрипционных элементов и экспрессию криптических пептидов [11, 55]. Кроме того, существует большая вероятность того, что дефектные белки не будут распознаны терапевтической вакциной [28], созданной в расчете на обычные белки вируса.
Технологии редактирования генов в зависимости от того, на какие последовательности нацелены сконструированные нуклеазы, таят в себе опасность создания дополнительных дефектных провирусов [28]. Кроме того, сообщалось, что CRISPR-Сas9 может производить негомологичное соединение концов ДНК и тем самым способствовать образованию транскрипционно активных эписомальных элементов [69].
О сложностях создания универсальных методов оценки объема резервуаров ВИЧ было написано выше, и здесь мы лишь подчеркнем, что в отсутствие таких методов оценить результат применения любого из подходов будет крайне затруднительно. Это означает, что, изучая способы воздействия на латентный резервуар ВИЧ, необходимо развивать исследования, направленные на детальное понимание способов формирования, регуляции и функциональных последствий активности дефектных провирусов.
Заключение
Наблюдения и экспериментальные работы последнего десятилетия позволили по-новому взглянуть на события, происходящие в популяции ВИЧ после установления неопределяемого уровня ВН в результате АРТ. Как стало понятно, прекращение репликации вируса – это не «конец истории», и патогенез инфекции продолжается даже в условиях длительного подавления ВН ВИЧ. Главную роль в «патофизиологии успешной АРТ» играют клетки-резервуары, содержащие провирусную ДНК ВИЧ, а среди них, как ни парадоксально, – клетки, содержащие дефектные провирусы.
Традиционное отношение к дефектным геномам ВИЧ как к побочному малозначительному продукту репликации вируса сменяется уверенностью в том, что эти провирусы могут быть биологически активны, а образующиеся РНК-транскрипты и белки – служить триггерами естественного и адаптивного иммунного ответа с последующей хронической активацией иммунной системы, имеющей долгосрочные клинические последствия. Именно персистенцией таких провирусов объясняется многолетнее сохранение серопозитивности и гиперактивации у АРТ-пациентов.
В дополнение к этому, дефектные провирусы могут стать серьезным препятствием на пути к созданию средств эрадикации ВИЧ, а это означает, что без специальных усилий, направленных на элиминацию клеток, несущих дефектные провирусы, реализовать не удастся ни одну из существующих на данный момент стратегий.
Влияние дефектных геномов на клинический исход инфекции и эволюцию популяции ВИЧ можно считать доказанным. Более того, наблюдается быстрый прогресс в понимании молекулярных механизмов, которые регулируют формирование дефектных геномов ВИЧ и объясняют их противоречивую роль в персистенции вирусов. Поиск средств излечения ВИЧ-инфекции остается сложной задачей, но в случае успеха он окажется важнейшим шагом на пути к достижению «поколения, свободного от СПИДа». Исследования «дефектных» провирусов должны стать ключевыми для будущей работы в этом направлении.
Об авторах
Марина Ридовна Бобкова
ФГБНУ «НИИ вакцин и сывороток им. И.И. Мечникова»
Автор, ответственный за переписку.
Email: mrbobkova@mail.ru
ORCID iD: 0000-0001-5481-8957
д-р биол. наук, главный специалист лаборатории биологии лентивирусов
Россия, 105064, г. МоскваСписок литературы
- Бобкова М.Р. Стратегии излечения ВИЧ-инфекции: основные методологические подходы и проблемы их реализации. ВИЧ-инфекция и иммуносупрессии. 2020; 12(1): 22–31. https://doi.org/10.22328/2077-9828-2020-12-1-22-31 https://elibrary.ru/gsllxf
- Бобкова М.Р. Латентность ВИЧ. М.: Человек; 2021.
- Grund B., Baker J.V., Deeks S.G., Wolfson J., Wentworth D., Cozzi-Lepri A., et al. Relevance of interleukin-6 and D-dimer for serious non-AIDS morbidity and death among HIV-positive adults on suppressive antiretroviral therapy. PLoS One. 2016; 11(5): e0155100. https://doi.org/10.1371/journal.pone.0155100
- Singh K., Natarajan V., Dewar R., Rupert A., Badralmaa Y., Zhai T., et al. Long-term persistence of transcriptionally active ‘defective’ HIV-1 proviruses: implications for persistent immune activation during antiretroviral therapy. AIDS. 2023; 37(14): 2119–30. https://doi.org/10.1097/qad.0000000000003667
- Trickey A., May M.T., Vehreschild J., Obel N., Gill M.J., Crane H., et al. Cause-specific mortality in HIV-positive patients who survived ten years after starting antiretroviral therapy. PLoS One. 2016; 11(8): e0160460. https://doi.org/10.1371/journal.pone.0160460
- Bandera A., Colella E., Rizzardini G., Gori A., Clerici M. Strategies to limit immune-activation in HIV patients. Expert Rev. Anti Infect. Ther. 2017; 15(1): 43–54. https://doi.org/10.1080/14787210.2017.1250624
- Elvstam O., Medstrand P., Jansson M., Isberg P.E., Gisslén M., Björkman P. Is low-level HIV-1 viraemia associated with elevated levels of markers of immune activation, coagulation and cardiovascular disease? HIV Med. 2019; 20(9): 571–80. https://doi.org/10.1111/hiv.12756
- Utay N.S., Hunt P.W. Role of immune activation in progression to AIDS. Curr. Opin. HIV AIDS. 2016; 11(2): 131–7. https://doi.org/10.1097/coh.0000000000000242
- Younas M., Psomas C., Reynes C., Cezar R., Kundura L., Portalès P., et al. Residual viremia is linked to a specific immune activation profile in HIV-1-infected adults under efficient antiretroviral therapy. Front. Immunol. 2021; 12: 663843. https://doi.org/10.3389/fimmu.2021.663843
- Fombellida-Lopez C., Berkhout B., Darcis G., Pasternak A.O. Persistent HIV-1 transcription during ART: time to reassess its significance? Curr. Opin. HIV AIDS. 2024; 19(3): 124–32. https://doi.org/10.1097/coh.0000000000000849
- Kuniholm J., Armstrong E., Bernabe B., Coote C., Berenson A., Patalano S.D., et al. Intragenic proviral elements support transcription of defective HIV-1 proviruses. PLoS Pathog. 2021; 17(12): e1009982. https://doi.org/10.1371/journal.ppat.1009982
- Marchetti G., Tincati C., Silvestri G. Microbial translocation in the pathogenesis of HIV infection and AIDS. Clin. Microbiol. Rev. 2013; 26(1): 2–18. https://doi.org/10.1128/cmr.00050-12
- Freeman M.L., Lederman M.M., Gianella S. Partners in Crime: The Role of CMV in immune dysregulation and clinical outcome during HIV infection. Curr. HIV/AIDS Rep. 2016; 13(1): 10–9. https://doi.org/10.1007/s11904-016-0297-9
- Sherman B.T., Hu X., Singh K., Haine L., Rupert A.W., Neaton J.D., et al. Genome-wide association study of high-sensitivity C-reactive protein, D-dimer, and interleukin-6 levels in multiethnic HIV+ cohorts. AIDS. 2021; 35(2): 193–204. https://doi.org/10.1097/qad.0000000000002738
- Shirley D.K., Kaner R.J., Glesby M.J. Effects of smoking on non-AIDS-related morbidity in HIV-infected patients. Clin. Infect. Dis. 2013; 57(2): 275–82. https://doi.org/10.1093/cid/cit207
- Rapid Response Service. Low-level HIV viremia: Definitions, predictors, mechanisms, and clinical outcomes. Toronto, ON: The Ontario HIV Treatment Network; 2022. Available at: https://www.ohtn.on.ca/wp-content/uploads/2022/01/RR166_Low-level-viremia_version2.pdf
- Wu F., Simonetti F.R. Learning from persistent viremia: mechanisms and implications for clinical care and HIV-1 cure. Curr. HIV/AIDS Rep. 2023; 20(6): 428–39. https://doi.org/10.1007/s11904-023-00674-w
- Бобкова М.Р. Низкая виремия при ВИЧ-инфекции: причины и следствия. ВИЧ-инфекция и иммуносупрессии. 2024; 16(2): 7–22. https://doi.org/10.22328/2077-9828-2024-16-2-7-22 https://elibrary.ru/zlmcgr
- Genoyer E., Lopez C.B. The impact of defective viruses on infection and immunity. Annu. Rev. Virol. 2019; 6(1): 547–66. https://doi.org/10.1146/annurev-virology-092818-015652
- Wang H., Cui X., Cai X., An T. Recombination in positive-strand RNA viruses. Front. Microbiol. 2022; 13: 870759. https://doi.org/10.3389/fmicb.2022.870759
- Sanchez G., Xu X., Chermann J.C., Hirsch I. Accumulation of defective viral genomes in peripheral blood mononuclear cells of human immunodeficiency virus type 1-infected individuals. J. Virol. 1997; 71(3): 2233–40. https://doi.org/10.1128/jvi.71.3.2233-2240.1997
- Imamichi H., Dewar R.L., Adelsberger J.W., Rehm C.A., O’Doherty U., Paxinos E.E., et al. Defective HIV-1 proviruses produce novel protein-coding RNA species in HIV-infected patients on combination antiretroviral therapy. Proc. Natl Acad. Sci. USA. 2016; 113(31): 8783–8. https://doi.org/10.1073/pnas.1609057113
- Kilroy J.M., Leal A.A., Henderson A.J. Chronic HIV transcription, translation, and persistent inflammation. Viruses. 2024; 16(5): 751. https://doi.org/10.3390/v16050751
- Berkhout B., van Wamel J., Klaver B. Requirements for DNA strand transfer during reverse transcription in mutant HIV-1 virions. J. Mol. Biol. 1995; 252(1): 59–69. https://doi.org/10.1006/jmbi.1994.0475
- Ho Y.C., Shan L., Hosmane N.N., Wang J., Laskey S.B., Rosenbloom D.I., et al. Replication-competent noninduced proviruses in the latent reservoir increase barrier to HIV-1 cure. Cell. 2013; 155(3): 540–51. https://doi.org/10.1016/j.cell.2013.09.020
- López CB. Defective viral genomes: critical danger signals of viral infections. J. Virol. 2014; 88(16): 8720–3. https://doi.org/10.1128/jvi.00707-14
- Vignuzzi M., Lopez C.B. Defective viral genomes are key drivers of the virus-host interaction. Nat. Microbiol. 2019; 4(7): 1075–87. https://doi.org/10.1038/s41564-019-0465-y
- Kuniholm J., Coote C., Henderson A.J. Defective HIV-1 genomes and their potential impact on HIV pathogenesis. Retrovirology. 2022; 19(1): 13. https://doi.org/10.1186/s12977-022-00601-8
- Reeves D.B., Gaebler C., Oliveira T.Y., Peluso M.J., Schiffer J.T., Cohn L.B., et al. Impact of misclassified defective proviruses on HIV reservoir measurements. Nat. Commun. 2023; 14(1): 4186. https://doi.org/10.1038/s41467-023-39837-z
- Бобкова М.Р. Клеточные белки – потенциальные мишени антиретровирусной терапии. Вопросы вирусологии. 2023; 68(6): 488–504. https://doi.org/10.36233/0507-4088-207 https://elibrary.ru/klgwak
- Hadpech S., Moonmuang S., Chupradit K., Yasamut U., Tayapiwatana C. Updating on roles of HIV intrinsic factors: a review of their antiviral mechanisms and emerging functions. Intervirology. 2022; 65(2): 67–79. https://doi.org/10.1159/000519241
- Ramdas P., Sahu A.K., Mishra T., Bhardwaj V., Chande A. From entry to egress: strategic exploitation of the cellular processes by HIV-1. Front. Microbiol. 2020; 11: 559792. https://doi.org/10.3389/fmicb.2020.559792
- Nchioua R., Bosso M., Kmiec D., Kirchhoff F. Cellular factors targeting HIV-1 transcription and viral RNA transcripts. Viruses. 2020; 12(5): 495. https://doi.org/10.3390/v12050495
- Ghimire D., Rai M., Gaur R. Novel host restriction factors implicated in HIV-1 replication. J. Gen. Virol. 2018; 99(4): 435–46. https://doi.org/10.1099/jgv.0.001026
- Colomer-Lluch M., Ruiz A., Moris A., Prado J.G. Restriction factors: from intrinsic viral restriction to shaping cellular immunity against HIV-1. Front. Immunol. 2018; 9: 2876. https://doi.org/10.3389/fimmu.2018.02876
- Schaller T., Herold N. The early bird catches the worm – can evolution teach us lessons in fighting HIV? Curr. HIV Res. 2016; 14(3): 183–210. https://doi.org/10.2174/1570162x14999160224094914
- Bedwell G.J., Engelman A.N. Factors that mold the nuclear landscape of HIV-1 integration. Nucleic Acids Res. 2021; 49(2): 621–35. https://doi.org/10.1093/nar/gkaa1207
- Craigie R., Bushman F.D. HIV DNA integration. Cold Spring Harb. Perspect. Med. 2012; 2(7): a006890. https://doi.org/10.1101/cshperspect.a006890
- Rodgers K., McVey M. Error-prone repair of DNA double-strand breaks. J. Cell. Physiol. 2016; 231(1): 15–24. https://doi.org/10.1002/jcp.25053
- Wiegand A., Spindler J., Hong F.F., Shao W., Cyktor J.C., Cillo A.R., et al. Single-cell analysis of HIV-1 transcriptional activity reveals expression of proviruses in expanded clones during ART. Proc. Natl Acad. Sci. USA. 2017; 114(18): E3659–68. https://doi.org/10.1073/pnas.1617961114
- Dutilleul A., Rodari A., Van Lint C. Depicting HIV-1 transcriptional mechanisms: a summary of what we know. Viruses. 2020; 12(12): 1385. https://doi.org/10.3390/v12121385
- Ding P., Kharytonchyk S., Waller A., Mbaekwe U., Basappa S., Kuo N., et al. Identification of the initial nucleocapsid recognition element in the HIV-1 RNA packaging signal. Proc. Natl Acad. Sci. USA. 2020; 117(30): 17737–46. https://doi.org/10.1073/pnas.2008519117
- Ishizaka A., Sato H., Nakamura H., Koga M., Kikuchi T., Hosoya N., et al. Short intracellular HIV-1 transcripts as biomarkers of residual immune activation in patients on antiretroviral therapy. J. Virol. 2016; 90(12): 5665–76. https://doi.org/10.1128/jvi.03158-15
- Sertznig H., Hillebrand F., Erkelenz S., Schaal H., Widera M. Behind the scenes of HIV-1 replication: Alternative splicing as the dependency factor on the quiet. Virology. 2018; 516: 176–88. https://doi.org/10.1016/j.virol.2018.01.011
- Mancarella A., Procopio F.A., Achsel T., De Crignis E., Foley B.T., Corradin G., et al. Detection of antisense protein (ASP) RNA transcripts in individuals infected with human immunodeficiency virus type 1 (HIV-1). J. Gen. Virol. 2019; 100(5): 863–76. https://doi.org/10.1099/jgv.0.001244
- Imamichi H., Smith M., Adelsberger J.W., Izumi T., Scrimieri F., Sherman B.T., et al. Defective HIV-1 proviruses produce viral proteins. Proc. Natl Acad. Sci. USA. 2020; 117(7): 3704–10. https://doi.org/10.1073/pnas.1917876117
- Vanhee-Brossollet C., Thoreau H., Serpente N., D’Auriol L., Levy J.P., Vaquero C. A natural antisense RNA derived from the HIV-1 env gene encodes a protein which is recognized by circulating antibodies of HIV+ individuals. Virology. 1995; 206(1): 196–202. https://doi.org/10.1016/s0042-6822(95)80034-4
- Pollack R.A., Jones R.B., Pertea M., Bruner K.M., Martin A.R., Thomas A.S., et al. Defective HIV-1 proviruses are expressed and can be recognized by cytotoxic T lymphocytes, which shape the proviral landscape. Cell Host Microbe. 2017; 21(4): 494–506.e4. https://doi.org/10.1016/j.chom.2017.03.008
- Decout A., Katz J.D., Venkatraman S., Ablasser A. The cGAS-STING pathway as a therapeutic target in inflammatory diseases. Nat. Rev. Immunol. 2021; 21(9): 548–69. https://doi.org/10.1038/s41577-021-00524-z
- Unterholzner L., Keating S.E., Baran M., Horan K.A., Jensen S.B., Sharma S., et al. IFI16 is an innate immune sensor for intracellular DNA. Nat. Immunol. 2010; 11(11): 997–1004. https://doi.org/10.1038/ni.1932
- Wu B., Hur S. How RIG-I like receptors activate MAVS. Curr. Opin. Virol. 2015; 12: 91–8. https://doi.org/10.1016/j.coviro.2015.04.004
- Ferdin J., Goričar K., Dolžan V., Plemenitaš A., Martin J.N., Peterlin B.M., et al. Viral protein Nef is detected in plasma of half of HIV-infected adults with undetectable plasma HIV RNA. PLoS One. 2018; 13(1): e0191613. https://doi.org/10.1371/journal.pone.0191613
- Fenwick C., Joo V., Jacquier P., Noto A., Banga R., Perreau M., et al. T-cell exhaustion in HIV infection. Immunol. Rev. 2019; 292(1): 149–63. https://doi.org/10.1111/imr.12823
- Verdon D.J., Mulazzani M., Jenkins M.R. Cellular and molecular mechanisms of CD8(+) T cell differentiation, dysfunction and exhaustion. Int. J. Mol. Sci. 2020; 21(19): 7357. https://doi.org/10.3390/ijms21197357
- Lichterfeld M., Gao C., Yu X.G. An ordeal that does not heal: understanding barriers to a cure for HIV-1 infection. Trends Immunol. 2022; 43(8): 608–16. https://doi.org/10.1016/j.it.2022.06.002
- Roux H., Chomont N. Measuring human immunodeficiency virus reservoirs: do we need to choose between quantity and quality? J. Infect. Dis. 2024; 229(3): 635–43. https://doi.org/10.1093/infdis/jiad381
- Halvas E.K., Joseph K.W., Brandt L.D., Guo S., Sobolewski M.D., Jacobs J.L., et al. HIV-1 viremia not suppressible by antiretroviral therapy can originate from large T cell clones producing infectious virus. J. Clin. Invest. 2020; 130(11): 5847–57. https://doi.org/10.1172/jci138099
- Virgilio M.C., Collins K.L. The impact of cellular proliferation on the HIV-1 reservoir. Viruses. 2020; 12(2): 127. https://doi.org/10.3390/v12020127
- White J.A., Wu F., Yasin S., Moskovljevic M., Varriale J., Dragoni F., et al. Clonally expanded HIV-1 proviruses with 5’-leader defects can give rise to nonsuppressible residual viremia. J. Clin. Invest. 2023; 133(6): e165245. https://doi.org/10.1172/jci165245
- Bui J.K., Sobolewski M.D., Keele B.F., Spindler J., Musick A., Wiegand A., et al. Proviruses with identical sequences comprise a large fraction of the replication-competent HIV reservoir. PLoS Pathog. 2017; 13(3): e1006283. https://doi.org/10.1371/journal.ppat.1006283
- Maldarelli F., Wu X., Su L., Simonetti F.R., Shao W., Hill S., et al. HIV latency. Specific HIV integration sites are linked to clonal expansion and persistence of infected cells. Science. 2014; 345(6193): 179–83. https://doi.org/10.1126/science.1254194
- Linden N., Jones R.B. Potential multi-modal effects of provirus integration on HIV-1 persistence: lessons from other viruses. Trends Immunol. 2022; 43(8): 617–29. https://doi.org/10.1016/j.it.2022.06.001
- Mohammadi A., Etemad B., Zhang X., Li Y., Bedwell G.J., Sharaf R., et al. Viral and host mediators of non-suppressible HIV-1 viremia. Nat. Med. 2023; 29(12): 3212–23. https://doi.org/10.1038/s41591-023-02611-1
- Crespo-Bermejo C., de Arellano E.R., Lara-Aguilar V., Valle-Millares D., Gomez-Lus M.L., Madrid R., et al. Persistent low-Level viremia in persons living with HIV undertreatment: An unresolved status. Virulence. 2021; 12(1): 2919–31. https://doi.org/10.1080/21505594.2021.2004743
- Sannier G., Dubé M., Dufour C., Richard C., Brassard N., Delgado G.G., et al. Combined single-cell transcriptional, translational, and genomic profiling reveals HIV-1 reservoir diversity. Cell Rep. 2021; 36(9): 109643. https://doi.org/10.1016/j.celrep.2021.109643
- Brodin J., Zanini F., Thebo L., Lanz C., Bratt G., Neher R.A., et al. Establishment and stability of the latent HIV-1 DNA reservoir. Elife. 2016; 5: e18889. https://doi.org/10.7554/elife.18889
- Lian X., Gao C., Sun X., Jiang C., Einkauf K.B., Seiger K.W., et al. Signatures of immune selection in intact and defective proviruses distinguish HIV-1 elite controllers. Sci. Transl. Med. 2021; 13(624): eabl4097. https://doi.org/10.1126/scitranslmed.abl4097
- Abrahams M.R., Joseph S.B., Garrett N., Tyers L., Moeser M., Archin N., et al. The replication-competent HIV-1 latent reservoir is primarily established near the time of therapy initiation. Sci. Transl. Med. 2019; 11(513): eaaw5589. https://doi.org/10.1126/scitranslmed.aaw5589
- Lai M., Maori E., Quaranta P., Matteoli G., Maggi F., Sgarbanti M., et al. CRISPR/Cas9 ablation of integrated HIV-1 accumulates proviral DNA circles with reformed long terminal repeats. J. Virol. 2021; 95(23): e0135821. https://doi.org/10.1128/jvi.01358-21
Дополнительные файлы