Оценка анти-ВИЧ-1 (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodeficiency virus type 1) активности 6НР и 3ТС in vitro с использованием вариантов клеточной линии МТ-4 с различной репликативной активностью
- Авторы: Калнина Л.Б.1, Селимова Л.М.1, Носик Д.Н.1
-
Учреждения:
- Институт вирусологии им. Д.И. Ивановского ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- Выпуск: Том 69, № 5 (2024)
- Страницы: 441-448
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16669
- DOI: https://doi.org/10.36233/0507-4088-247
- EDN: https://elibrary.ru/ptyvcq
- ID: 16669
Цитировать
Аннотация
Введение. Химиотерапия ВИЧ-инфекции остается единственным средством лечения болезни. Процесс создания новых и усовершенствование созданных ранее препаратов являются по-прежнему приоритетным направлением. Одним из доклинических этапов испытания эффективности лекарственных средств является исследование in vitro в модельной системе «вирус‒клетка».
Цель исследования. Изучить противовирусную эффективность нуклеозидных ингибиторов обратной транскриптазы (НИОТ) 6НР и 3ТС при репликации ВИЧ-1 в неопластической линии клеток МТ-4.
Материалы и методы. Использовали два варианта клеточной линии CD4+ Т-лимфоцитов МТ-4 (МТ-4/1 и МТ-4/2), трансформированных Т-лимфотропным вирусом человека 1-го типа (Retroviridae: Orthoretrovirinae: Deltaretrovirus: HTLV-1), с разным уровнем репликации ВИЧ-1. Для подавления вируса использовали препараты аммоний-3’-азидо-3’-дезокситимидин-5’-карбомоилфосфонат (6НР) и 2´,3´-дидезокси-3´-тиацитидин (3ТС).
Результаты и обсуждение. Репликативная активность ВИЧ-1 для разных штаммов вируса была выше в линии МТ-4/2, чем в линии МТ-4/1. Использование каждого из противовирусных веществ по отдельности показало более существенное ингибирование вирусной активности в клетках МТ-4/1, чем в клетках МТ-4/2. При комбинированном использовании антивирусный эффект был во всех случаях практически одинаков и колебался в пределах 87‒96% для линии МТ-4/1 и 83‒89% для линии МТ-4/2. Высокая эффективность наблюдалась при совместном использовании меньших концентраций препаратов по сравнению с индивидуальным применением.
Заключение. Сочетанное использование НИОТ 6НР и 3ТС является перспективным для лечения ВИЧ-инфицированных пациентов на разных сроках инфекции и с различным уровнем вирусной нагрузки.
Ключевые слова
Полный текст
Введение
Антиретровирусная терапия (АРТ) успешно применяется для лечения ВИЧ-инфекции и способна эффективно подавлять репликацию вируса. Благодаря внедрению во всем мире планомерного подхода к лечению инфекции были спасены миллионы жизней. С 2001 г. было предотвращено 16,5 млн смертей, связанных со СПИДом. По данным ЮНАЙДС/UNAIDS1, инвестиции в организацию максимально возможного вовлечения ВИЧ-инфицированных людей в АРТ позволили к концу 2022 г. получить лечение 27,5 млн (73%) человек из 37,7 млн живущих с ВИЧ-1. Охват лечением в 2023 г. в России составил 86,5% от числа состоявших на диспансерном наблюдении и 58,8% от числа живущих с диагнозом ВИЧ-инфекция.
Вместе с тем по ряду причин не во всех случаях удается добиться положительных результатов [1]. Учитывая сложные патогенетические особенности развития инфекции и затраты, связанные с пожизненным лечением, разработка эффективных лечебных подходов в настоящее время, как и ранее, остается приоритетным направлением. Более результативными принято считать терапевтические схемы, включающие использование трех препаратов, подавляющих вирус на разных стадиях репликации. Обзор наиболее значимых исследований, в которые включались два препарата для начального лечения ВИЧ-1 или для поддержания высокого уровня подавления репликации вируса на бессимптомной стадии, продемонстрировал, что после более чем двух десятилетий использования трех препаратов в ближайшем будущем может произойти смена приоритетов. Для определенных групп населения, где необходимо свести к минимуму токсичность лекарств, где есть непереносимость лекарств или необходим более простой режим их приема, применение двухкомпонентной терапии может считаться безопасной и эффективной альтернативой [2].
Первой группой лекарственных средств, способных подавлять репликацию вируса на стадии обратной транскрипции [3], стали нуклеозидные ингибиторы обратной транскриптазы (НИОТ). Среди них первое соединение, одобренное для лечения ВИЧ-1 [4], аналог тимидина 3’-азидо-3’-дезокситимидин (АЗТ, международное название зидовудин), по-прежнему часто служит компонентом многих схем лечения с применением НИОТ и составляет основу доступных антиретровирусных терапевтических препаратов. Однако выраженная токсичность АЗТ и способность генерировать штаммы, несущие множество мутаций, приводящих к появлению резистентных вариантов вируса со сниженной чувствительностью к нему [5], стимулировали поиск новых лекарственных форм.
Среди успешных исследований по поиску таких препаратов стали работы российских ученых по созданию фосфонатных производных ингибиторов обратной транскриптазы на основе АЗТ. Прежде всего, это 3’-азидо-3’-дезокситимидин-5’-монофосфат натрия (фосфазид) – оригинальный российский анти-ВИЧ-препарат, который прошел полный объем доклинических и клинических испытаний и был зарегистрирован в Российской Федерации в 1999 г. Препарат показал высокую эффективность, сниженную токсичность, пролонгированное действие и замедленное образование резистентных штаммов ВИЧ-1 [6]. Результатом дальнейших исследований стал новый препарат аммоний-3’-азидо-3’-дезокситимидин-5’-карбомоилфосфонат (6НР). Это соединение обладает выраженными антивирусными свойствами и благоприятными фармакокинетическими параметрами. В организме 6НР эффективно превращается в АЗТ. Медленное высвобождение после перорального приема и проникновения в клетки организма, а также пониженная токсичность делают это пролекарство многообещающим в качестве форм АЗТ с пролонгированным высвобождением и антивирусным действием [7].
Следующим НИОТ, относящимся к аналогу цитидина, был 2´,3´-дидезокси-3´-тиацитидин (3TC, международное название ламивудин) [8]. Этот препарат успешно используется в практике лечения ВИЧ-инфекции около 28 лет. По мере сертификации новых препаратов схемы лечения, включающие 3ТС, продолжают широко использоваться в терапии на первоначальном этапе, благодаря его эффективности и относительной безопасности. Препарат широко применяется для лечения пациентов всех возрастов. Благодаря незначительному взаимодействию с различными лекарственными средствами и низкой стоимости, 3TC продолжает использоваться в новых схемах в сочетании с антиретровирусными препаратами нового поколения. Его также назначают пациентам при коинфекции вирусом гепатита В. Среди всех лекарств, впервые одобренных более 20 лет назад для лечения ВИЧ-инфекции, только 3TC по-прежнему рекомендуется в самых последних мировых руководствах. Вместе с тем в качестве компонента различных антиретровирусных схем лечения 3TC продолжает активно изучаться. Препарат обладает уникальным профилем проявления резистентности, способен замедлять ее развитие к AЗT и, возможно, компенсировать сниженную чувствительность к AЗT за счет своего вклада в противовирусное действие. К тому же известно явление усиления антивирусного действия у комбинированных препаратов с минимальными дозами составляющих их ингредиентов, которые сами по себе не способны вызвать заметного антивирусного эффекта [9]. На основе АЗТ и 3ТС был создан «Комбивир», лекарство, объединяющее оба вещества. Этот препарат используется с 1997 г. В 2018 г. был зарегистрирован российский препарат «Фосфаладин», объединяющий фосфазид и ламивудин. Комбинация препаратов в одной таблетке вызывает более сильный и устойчивый эффект, чем при использовании их по отдельности, содействует сокращению полипрагмазии, а также облегчает приверженность соблюдению режима приема лекарств [10].
В связи с созданием нового препарата 6НР было важно более углубленно изучить влияние комбинации 6НР и 3ТС на репликацию ВИЧ-1 в модельной системе in vitro. В работе были использованы две разновидности неопластической СD4+ Т-клеточной линии МТ-4 с разной репликативной активностью. Фенотипические особенности линий нами были описаны ранее [11].
Цель исследования ‒ изучить противовирусную эффективность НИОТ 6НР и 3ТС при репликации ВИЧ-1 в неопластической линии клеток МТ-4.
Материалы и методы
Клетки человека МТ-4/1 и МТ-4/2 были получены из коллекции клеточных линий «Института вирусологии им. Д.И. Ивановского» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Для их культивирования использовали среду RPMI 1640, содержащую 10% сыворотки эмбриона коровы, 2 мM L-глютамина и 50 мкг/мл гентамицина в атмосфере 5% СО2 при температуре 37 °С. Клетки пересевали через 3‒4 сут, плотность при пересеве составляла 2,5‒3,0 × 105 кл/мл. Для заражения клеток использовали штаммы ВИЧ-1 899А, IIIB, НОВ и МС-1979. Первые три штамма относятся к субтипу В, последний ‒ к субтиру G. Штаммы вируса были получены из коллекции вирусов «Института вирусологии им. Д.И. Ивановского» ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Вирусы пассировали на клетках в культуральных флаконах объемом 50 мл в течение 5‒7 сут до развития выраженного цитопатического эффекта, обнаруживаемого под световым микроскопом. Затем отбирали культуральную жидкость и определяли инфекционный титр, выражаемый в lg ТЦИД50/мл (50% тканевая цитопатическая инфекционная доза). Аликвоты проб хранили при −80 °С до заражения клеток. Клетки заражали вирусами при множественности инфекции ‒ около 100 ТЦИД50/клетка. Ежедневно отбирали аликвоты клеточной суспензии и определяли жизнеспособность клеток в присутствии трипанового синего. На 5‒6-е сутки после заражения отбирали культуральную жидкость и определяли ТЦИД50/мл методом конечных разведений с использованием линии МТ-4/1, жизнеспособность клеток измеряли методом МТТ [12].
При исследовании противовирусной активности клетки культивировали в 96-луночных плашках, препараты 6НР и 3ТС (предоставлены компанией «АЗТ Фарма К.Б.», Россия) вносили одновременно с вирусом. Через 3 сут отбирали аликвоты для определения количества белка p24 методом иммуноферментного анализа с использованием коммерческой тест-системы (Genscreen ULTRA HIV Ag-AB, компания «Био-Рад», Франция). Уровень ингибирования вирусной активности в процентах определяли по формуле:
(ЭП − КВ / КК − КВ) × 100%,
где ЭП ‒ показания оптической плотности экспериментальных проб с препаратом; КВ ‒ показания оптической плотности контроля вируса (без препарата); КК ‒ показания контроля клеток. Показания лунки, не содержащей клеток, автоматически вычитали при определении оптической плотности исследуемых проб. Опытные пробы по определению вирусной активности и противовирусной активности препаратов имели по три параллели.
Статистический анализ данных проводили с использованием программы BioStat, v.5 (AnalystSoft, США).
Результаты
При заражении штаммами ВИЧ-1 IIIB, 899А, НОВ и МС1974 двух вариантов линий клеток МТ-4/1 и МТ-4/2, было замечено под световым микроскопом, что инфекционный процесс в линии МТ-4/2 развивался значительно активнее. Наблюдалось выраженное цитопатическое действие для всех перечисленных штаммов вируса, превышающее подобный эффект в линии МТ-4/1. Результаты определения инфекционного титра показали, что для штамма 899А он увеличивался на ~ 4 порядка, IIIB – на ~ 3 порядка, НОВ и МС1974 – на ~ 1 порядок. В дальнейшем для заражения клеток был выбран штамм 899А как наиболее высокопродуктивный и чаще всего используемый нами в работе. Результаты определения жизнеспособности клеток в процессе репликации вируса 899А на разных сроках после заражения представлены на рис. 1. Видно, что количество живых клеток в линии МТ-4/2 уже на 2-е сутки после заражения было существенно меньше, чем в МТ-4/1. На 5-е сутки цитопатическая активность вируса в линии МТ-4/2 была на ~ 20% больше.
Рис. 1. Цитопатическая активность вируса ВИЧ-1/899А при репликации в линии клеток МТ-4/1 и МТ-4/2.
Fig. 1. Cytopathic activity of the HIV-1/899A virus during replication in MT-4/1 and MT-4/2 cell lines.
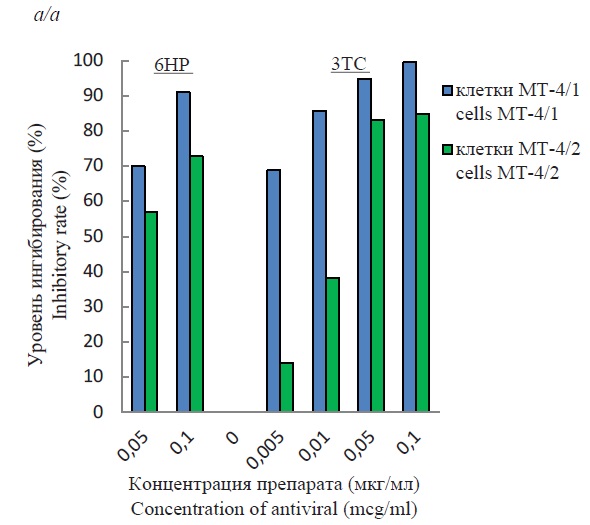
Наличие клеточных линий с разной продуктивной активностью позволило изучить эффективность двух противовирусных препаратов 6НР и 3ТС, подавляющих репликацию вируса на стадии обратной транскрипции. Результаты ингибирования репликации ВИЧ-1 одним препаратом и в сочетанном использовании представлены на рис. 2. Во всех случаях наблюдался дозозависимый противовирусный эффект. Как видно, использованные концентрации каждого из веществ по отдельности приводили к более существенному ингибированию вирусной активности в клетках МТ-4/1 (рис. 2 а). При использовании наименьших концентраций каждого из препаратов процент ингибирования вирусной активности в клетках МТ/4-2 был существенно ниже. Повышение концентрации препаратов приводило к тому, что противовирусный эффект в клетках МТ-4/2 приближался к показаниям для клеток МТ-4/1, но оставался на 10‒15% ниже. При совместном использовании веществ уровень ингибирования был во всех случаях высоким и практически одинаковым и колебался в пределах 87‒96% для линии МТ-4/1 и 83‒89% для линии МТ-4/2 (рис. 2 б). При статистическом анализе полученных результатов уровень значимости (p) был равен 0,05.
Рис. 2. Подавление репликации ВИЧ-1/899А в линии клеток МТ-4/1 и МТ-4/2 препаратами 6НР и 3ТС.
Индивидуальное (а) и комбинированное (б) противовирусное действие.
Fig. 2. Suppression of HIV-1/899A replication in MT-4/1 and MT-4/2 cell lines with compounds 6HP and 3TC.
Individual (a) and combined (b) action of antivirals.
Обсуждение
Наличие двух разновидностей линии МТ-4, в которых продуктивность вирусов одних и тех же штаммов ВИЧ-1 была различной, поставило перед нами задачу выявления возможных причин. Было использовано несколько подходов. Прежде всего, мы предположили, что клетками МТ-4/2 могут секретироваться растворимые факторы, которые способны влиять на репликацию вируса. В связи с этим было изучено влияние растворимых факторов жизнедеятельности этих клеток на репликацию вируса в линии МТ-4/1 [11]. Результаты проведенных опытов показали отсутствие таковых.
Клетки МТ-4 представлены неопластическими CD4+ Т-лимфоцитами, трансформированными Т-лимфотропным дельта-ретровирусом человека 1-го типа (Retroviridae: Orthoretrovirinae: Deltaretrovirus: Human T-lymphotropic virus type 1; ТЛВЧ-1). Инфекция относится к злокачественным новообразованиям лимфоидной и кроветворной систем [13]. Линия клеток была получена от пациентов с Т-клеточной лейкемией/лимфомой взрослых. Клетки в высокой степени активированы и служат удобной моделью для вирусологических и молекулярно-биологических исследований. Известно, что репликация ВИЧ-1 происходит в активированных клетках и поэтому трансформированные клетки служат удобной экспериментальной моделью для изучения особенностей репликации этого вируса. Ранее нами была изучена экспрессия маркеров активации линией МТ-4 [14]. Однако уровень активации двух вариантов линии, использованных в настоящем исследовании, мог быть разным. Основными маркерами для оценки активационного потенциала клеток служат уровни экспрессии наружных белков CD28, CD38 и HLA-DR. Проведенные ранее исследования показали, что в процессе культивирования экспрессия HLA-DR в линиях была сходной и составляла 84‒99%. По уровню экспрессии CD28 и CD38 они отличались. Наиболее существенное различие наблюдалось для белка CD38. Через 72 ч культивирования количество клеток, экспрессирующих этот белок, было в ~ 15 раз больше в высокопродуктивной линии [11]. CD38 является трансмембранным гликопротеином, выполняющим функции рецептора и фермента [15]. Полагают, что полностью его биологическая роль не изучена. Впервые он был обнаружен как рецептор в активированных клетках и в наибольшем количестве ‒ в опухолевых клетках. В настоящее время показано, что белок CD38 играет существенную роль в метаболизме клеток и принимает участие во многих биохимических процессах на клеточном уровне. CD38 служит рецептором в регуляции механизмов высвобождения цитокинов, участвует в передаче сигналов в составе рецепторных комплексов, регулирует клеточную адгезию при межмолекулярных взаимодействиях клеток и внеклеточного пространства и диссеминацию клеток в организме. В качестве бифункционального фермента он контролирует внеклеточный гомеостаз нуклеотидов и внутриклеточные потоки кальция. Эти его функции важны при регулировании особенностей развития патологических процессов при инфекции, онкогенезе и старении. Обладая активностью гликогидролазы, CD38 участвует в накоплении энергии в окислительно-восстановительных реакциях, используя коферменты никотинамидадениндинуклеотида (НАД + ‒ окисленная форма, НАДН ‒ восстановленная форма). Сочетая в себе активность рибозилциклазы аденозиндифосфата (АДФ) и гидролазы циклической АДФ-рибозы (цАДФР), белок катализирует синтез цАДФР, АДФР и адениндинуклеотидфосфата никотиновой кислоты (АДФ-НК). Эти сигнальные молекулы участвуют в мобилизации ионов кальция ([Ca2+]) из внутриклеточных депо кальциевых каналов внутриклеточных мембранных структур (эндоплазматического ретикулума). Внутриклеточный кальций необходим для многих физиологических и патологических процессов, происходящих в клетках крови, включая дегрануляцию, регуляцию взаимодействия белков цитоскелета, активацию клеточных киназ и фосфатаз, транскрипционный контроль и модуляцию поверхностных рецепторов. Ранее было показано, что кальций необходим на ранних этапах проникновения ВИЧ-1 в клетки [16]. Нельзя исключить, что кальций может играть роль на всех этапах взаимодействия вируса с клеткой, поскольку при репликации вируса неизбежно участие всех внутриклеточных мембран. Таким образом, возможно, что обнаруженным в настоящем исследовании усилением экспрессии белка CD38 и его способностью регулировать уровень внутриклеточного кальция можно объяснить повышение репликативной активности вируса в клетках МТ-4/2.
Возможны и другие причины усиления активности ВИЧ-1. Показано, что при репликации ВИЧ-1 в клетках происходят существенные перестройки, сопровождающиеся изменением в структуре мембран [17], снижением водородного показателя цитоплазмы (рН) [18], увеличением концентрации внутриклеточного калия ([K+]i) и натрия ([Na+]i) [19]. Авторы [19] связывают это только с усилением синцитиеобразующей активности ВИЧ-1, которая при этом не приводит к увеличению урожая вируса. Но следует отметить, что, по их данным, в хронически инфицированной ВИЧ-1 неопластической СD4+ Т-линии клеток, в которой практически отсутствует цитопатический эффект, уровень калия существенно выше, чем в контрольных неинфицированных клетках. Это указывает на то, при репликации ВИЧ-1 уровень калия в клетках повышается и это может быть фактором, необходимым для репликации вируса.
Причиной усиления репликации ВИЧ-1 может быть также различие в механизмах взаимодействия других внутриклеточных компонентов, которые могут влиять на инфекционный процесс. Как показали цитометрические исследования клеточных линий, кроме белка CD38, в высокопродуктивной линии усилена экспрессия белка CD28. Через 72 ч после пересева мы наблюдали повышение количества CD28+-клеток в ней в 3,2 раза [11]. Эта костимуляторная поверхностная белковая молекула играет ключевую роль в активации и регуляции функционирования CD4+ Т-клеток [20]. За последнее десятилетие использование передовых технологий позволило получить огромное количество данных о факторах хозяина, которые используются вирусами для распространения инфекции, а также о противовирусных факторах, ответственных за подавление вирусной инфекции. В патогенезе Т-клеточной лейкемии/лимфомы взрослых, по-видимому, функциональная активность этого белка может быть одним из компонентов, регулирующим особенности развития онкогенного процесса. Изучены множественные изменения в гене этого белка и изменения в цепи последовательных активирующих сигналов, в которых этот белок принимает участие [21]. Его активация влияет на сигнальные пути, участвующие в регуляции экспрессии клетками интерлейкина-2 (ИЛ-2). ИЛ-2 регулирует активность индуцируемой Т-клеточной киназы (ИТК, семейство цитоплазматических ТЕС-тирозинкиназ) [22]. Было показано, что ИTK облегчает репликацию ВИЧ-1 и фермент необходим для эффективного проникновения вируса, обратной транскрипции, сборки и высвобождения вирусных частиц [23]. Таким образом, усиление активности ВИЧ-1 в линии МТ-4/2 также можно объяснить повышенной экспрессией белка CD28 и связанным с этим увеличение активности ИТК.
Использование двух вариантов клеточной линии МТ-4 с разной репликативной активностью позволило провести сравнительный анализ эффективности противовирусного действия НИОТ 6НР и 3ТС на ВИЧ-1 в зависимости от вирусной нагрузки. Наши исследования (рис. 2) показали, что степень ингибирования вирусной активности препаратами по отдельности была ниже в линии МТ-4/2. При этом противовирусный эффект 3ТС сильнее зависел от активности вируса, чем 6НР. При совместном использовании препаратов наблюдался высокий противовирусный эффект, и он не зависел от уровня репликации вируса. Высокая противовирусная активность обнаруживалась при совместном использовании меньших концентраций веществ, чем при их отдельном применении. При сочетанном применении препаратов антивирусный эффект был во всех случаях практически одинаков и колебался в пределах 87‒96% для линии МТ-4/1 и 83‒89% для линии МТ-4/2. Нельзя исключить, что метаболизм препаратов 6HP и 3TC в клетках этих линий может иметь свои особенности и их выявление в дальнейшем позволит точнее оценить эффективность испытуемых препаратов.
Заключение
Полученные результаты указывают на то, что в экспериментальной системе in vitro ВИЧ-1/клетки МТ-4 при индивидуальном использовании НИОТ 6НР и 3ТС наблюдался сниженный противовирусный эффект в системе с большей вирусной активностью. Сочетанное использование препаратов показало высокий уровень ингибирования при использовании меньших доз препаратов вне зависимости от репликативной активности вируса. Сочетанное использование этих препаратов является перспективным для лечения ВИЧ-инфицированных пациентов на различных стадиях инфекции и с различным уровнем вирусной нагрузки.
1 Объединённая программа Организации Объединённых Наций по ВИЧ/СПИДу (ЮНЭЙДС). Available at: https://unaids.org/ru
Об авторах
Людмила Борисовна Калнина
Институт вирусологии им. Д.И. Ивановского ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: klb3@yandex.ru
ORCID iD: 0000-0002-2702-8578
канд. биол. наук, ведущий научный сотрудник лаборатории противовирусных и дезинфекционных средств
Россия, 123098, г. МоскваЛюдмила Мидатовна Селимова
Институт вирусологии им. Д.И. Ивановского ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: lselim@mail.ru
ORCID iD: 0000-0003-3709-770X
д-р биол. наук, ведущий научный сотрудник лаборатории противовирусных и дезинфекционных средств
Россия, 123098, г. МоскваДмитрий Николаевич Носик
Институт вирусологии им. Д.И. Ивановского ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: dnnosik@yandex.ru
ORCID iD: 0000-0001-5757-5671
д-р мед. наук, профессор, руководитель лаборатории противовирусных и дезинфекционных средств
Россия, 123098, г. МоскваСписок литературы
- Киреев Д.Е., Кириченко А.А., Лопатухин А.Э., Шлыкова А.В., Галкин Н.Ю., Савельер Е.В. и др. Российская база данных лекарственной устойчивости ВИЧ к антиретровирусным препаратам. Журнал микробиологии, эпидемиологии и иммунобиологии. 2023,100(2):219-227. DOI: https://doi.org/10.36233/0372-9311-345
- Ndung’u T., McCune J.M., Deeks S.G. Why and where an HIV cure is needed and how it might be achieved. Nature. 2019; 576(7787): 397–405. https://doi.org/10.1038/s41586-019-1841-8
- Menéndez-Arias L., Sebastián-Martín A., Álvarez M. Viral reverse transcriptases. Virus Res. 2017; 234: 153–76. https://doi.org/10.1016/j.virusres.2016.12.019
- Mitsuya H., Weinhold K.J., Furman P.A., St Clair M.H., Lehrman S.N., Gallo R.C., et al. 3’-azido-3’-deoxythymidine (BW A509U): an antiviral agent that inhibits the infectivity and cytopathic effect of human T-lymphotropic virus type III/lymphadenopathy-associated virus in vitro. Proc. Natl Acad. Sci. USA. 1985; 82(20): 7096–100. https://doi.org/10.1073/pnas.82.20.7096
- Menéndez-Arias L. Molecular basis of human immunodeficiency virus type 1 drug resistance: overview and recent developments. Antiviral Res. 2013; 98(1): 93–120. https://doi.org/10.1016/j.antiviral.2013.01.007.
- Хандажинская А.Л., Широкова Е.А. 5’-фосфонаты АZT: достижения и перспективы в лечении и профилактике ВИЧ-инфекции. Acta Naturae. 2013; 5(3): 57–65. https://elibrary.ru/rwasll
- Галегов Г.А., Андронова В.Л. АнтиВИЧ/СПИД-препарат 6НР: антивирусная активность, доклиническое изучение. Эффективность у взрослых ВИЧ-инфицированных больных. Вопросы вирусологии. 2019; 64(1): 12–5. https://doi.org/10.18821/0507-4088-2019-64-1-12-15 https://elibrary.ru/yzkhjj
- Quercia R., Perno C.F., Koteff J., Moore K., McCoig C., St Clair M., et al. Twenty-five years of lamivudine: current and future use for the treatment of HIV-1 infection. J. Acquir. Immune Defic. Syndr. 2018; 78(2): 125–35. https://doi.org/ 10.1097/QAI.0000000000001660.
- Perry C.M., Faulds D. Lamivudine. A review of its antiviral activity, pharmacokinetic properties and therapeutic efficacy in the management of HIV infection. Drugs. 1997; 53(4): 657–80. https://doi.org/10.2165/00003495-199753040-00008
- Ma A., Chen D.M., Chau F.M., Saberi P. Improving adherence and clinical outcomes through an HIV pharmacist’s interventions. AIDS Care. 2010; 22(10): 1189–94. https://doi.org/10.1080/09540121003668102
- Носик Д.Н., Калнина Л.Б., Селимова Л.М., Пронин А.В. Увеличение инфекционности вируса иммунодефицита человека при модификации гена CCR5 чувствительных клеток. Доклады Российской Академии наук. Науки о жизни. 2023; 511(1): 344–8. https://doi.org/10.31857/S2686738923700257 https://elibrary.ru/jiltbd
- Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods. 1983; 65(1-2): 55–63. https://doi.org/10.1016/0022-1759(83)90303-4.
- Manns A., Hisada M., La Grenada L. Human T-lymphotropic virus type 1 infection. Lancet. 1999; 353(9): 1951–8. https://doi.org/10.1016/s0140-6736(98)09460-4
- Селимова Л.М., Калнина Л.Б., Носик Д.Н. Поверхностные маркёры неопластической клеточной линии МТ-4 и перспективы её использование в качестве модели при изучении активности иммуномодулирующих препаратов. Клиническая лабораторная диагностика. 2016, 61(12): 822–5. https://doi.org/10.18821/0869-2084-2016-61-12-822-825 https://elibrary.ru/xscfqz
- Morandi F., Airoldi I., Marimpietri D., Bracci C., Faini A.C., Gramignoli R. CD38, a receptor with multifunctional activities: from modulatory functions on regulatory cell subsets and extracellular vesicles, to a target for therapeutic strategies. Cells. 2019; 8(12): 1527–44. https://doi.org/10.3390/cells8121527
- Dimitrov D.S., Broder C.C., Berger E.A., Blumenthal R. Calcium ions are required for cell fusion mediated by the CD4-human immunodeficiency virus type 1 envelope glycoprotein interaction. J. Virol. 1993; 67(3): 1647–52. https://doi.org/10.1128/JVI.67.3.1647-1652.1993
- Cloyd M.W., Lynn W.S. Perturbation of host-cell membrane is a primary mechanism of HIV cytopathology. Virology. 1991; 181(2): 500–11. https://doi.org/10.1016/0042-6822(91)90882-c
- Makutonina A., Voss T.G., Plymale D.R., Fermin C.D., Norris C.H., Vigh S., et al. Human immunodeficiency virus infection of T-lymphoblastoid cells reduces intracellular pH. J. Virol. 1996; 70(10): 7049–55. https://doi.org/10.1128/JVI.70.10.7049-7055.1996
- Voss T.G., Fermin C.D., Levy J.A., Vigh S., Choi B., Garry R.F. Alteration of intracellular potassium and sodium concentrations with induction of cytopathic effects by human immunodeficiency virus. J. Virol. 1996; 70(8): 5447–54. https://doi.org/10.1128/JVI.70.8.5447-5454.1996
- Esensten J.H., Helou Y.A., Chopra G., Weiss A., Bluestone J.A. CD28 costimulation: from mechanism to therapy. Immunity. 2016; 44(5): 973–88. https://doi.org/10.1016/j.immuni.2016.04.020
- Sakamoto Y., Ishida T., Masaki A., Takeshita M., Iwasaki H., Yonekura K., et al. Clinical significance of CD28 gene-related activating alterations in adult T-cell leukaemia/lymphoma. Br. J. Haematol. 2021; 192(2): 281–91. https://doi.org/10.1111/bjh.17211
- Lechner K.S., Neurath M.F., Weigmann B. Role of the IL-2 inducible tyrosine kinase ITK and its inhibitors in disease pathogenesis. J. Mol. Med. (Berl.). 2020; 98(10): 1385–95. https://doi.org/10.1007/s00109-020-01958-z.
- Readinger J.A., Schiralli G.M., Jiang J.K., Thomas C.J., Avery A., Henderson A.J., et al. Selective targeting of ITK blocks multiple steps of HIV replication. Proc. Natl Acad. Sci. USA. 2008; 105(18): 6684–9. https://doi.org/10.1073/pnas.0709659105
Дополнительные файлы