Влияние дезоксирибонуклеата натрия с железом комплекса на экспрессию поверхностных маркеров клеток МТ-4, инфицированных вирусом иммунодефицита человека 1-го типа (ВИЧ-1) (Retroviridae: Primate lentivirus group)
- Авторы: Носик Д.Н.1, Калнина Л.Б.1, Селимова Л.М.1, Каплина Э.Н.2
-
Учреждения:
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- ООО «ФармПак»
- Выпуск: Том 69, № 4 (2024)
- Страницы: 309-319
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16658
- DOI: https://doi.org/10.36233/0507-4088-240
- EDN: https://elibrary.ru/uzlpzs
- ID: 16658
Цитировать
Аннотация
Введение. Cохранение иммунной дисфункции при терапии имеет серьезные последствия для здоровья ВИЧ-инфицированных пациентов. Поэтому важным направлением является поиск препаратов, способных снижать воспалительный потенциал иммунной системы и служащих дополнительным компонентом противовирусных лекарств.
Цель работы – изучить влияние иммуномодулирующего препарата дезоксирибонуклеата натрия с железом комплекс (ДНК-Na-Fe) на экспрессию маркеров активации в клетках линии МТ-4, зараженных ВИЧ-1.
Материалы и методы. В клетках определяли уровни экспрессии на плазматической мембране белков CD4, CD28, CD38, CD62L и HLA-DR. Для оценки вирусной активности определяли количество белка p24 методом иммуноферментного анализа.
Результаты и обсуждение. При изучении экспрессии поверхностных маркеров проанализировали 2 варианта клеточных линий с разной репликативной активностью. Тестировали контрольные клетки, клетки, культивируемые в присутствии ДНК-Na-Fe, зараженные клетки и зараженные клетки, культивируемые в присутствии ДНК-Na-Fe. На основании полученных результатов можно сделать вывод о том, что противовирусная активность препарата при заражении МТ-4-клеток ВИЧ-1 связана с иммуномодулирующей активностью, изменяющей экспрессию мембранных белков CD4, CD28, CD38 и CD62L. Наблюдаемое разнообразие во влиянии ДНК-Na-Fe на экспрессию изученных поверхностных белков в двух линиях клеток, указывает на то, что оно зависит от особенностей совокупных молекулярно-биологических процессов, происходящих в клетках. А усиление эффектов, наблюдаемых в клетках с повышенной репликативной активностью, предполагает активное участие ДНК-Na-Fe в репликации вируса на стадиях проникновения и почкования.
Заключение. Исследования показали, что ДНК-Na-Fe обладает противовирусной и иммуномодулирующей активностью.
Полный текст
Введение
Течение инфекции, вызванной вирусом иммунодефицита человека 1-го типа (ВИЧ-1), тесно связано с функционированием иммунной системы. ВИЧ-1 инфицирует клетки иммунной системы, содержащие основной маркер CD4. В результате действия хорошо скоординированных патогенетических механизмов, используемых вирусом, развитие инфекции приводит к нарушению функционирования всех звеньев иммунитета. Защитные реакции хозяина способствуют контролю и подавлению инфекции посредством активации нескольких путей трансдукции, которые служат для нейтрализации вирусных механизмов репликации в инфицированных клетках [1]. Всестороннее изучение взаимодействия ВИЧ и клетки-хозяина является ключом к разработке эффективных схем лечения инфекции. Представляется важным также дополнительное понимание иммунного контроля ВИЧ-1 у людей, которые самостоятельно контролируют инфекцию [2]. Несмотря на прогресс в профилактике и лечении, главным препятствием в эффективности химиотерапии является возникновение долгоживущих латентных резервуаров вируса [3]. За более чем 40-летний период изучения ВИЧ-инфекции и создания большой группы эффективных противовирусных препаратов, внедрения комплексной антиретровирусной терапии (АРТ) были достигнуты существенные результаты, позволившие улучшить организацию мер по борьбе с распространением болезни и повысить качество жизни людей, живущих с ВИЧ (ЛЖВ). По данным Объединенной программы Организации Объединенных Наций по ВИЧ/СПИД (ЮНЭЙДС, UNAIDS), к 2023 г. число ЛЖВ оставляло около 39 (33,1–45,7) млн человек. Пять стран: Ботсвана, Эсватини, Руанда, Танзания и Зимбабве ‒ к 2022 г. уже достигли целей тестирования и лечения по новой стратегии ЮНЭЙДС на 2021–2026 гг. Целью стратегии является достижение показателей «95–95–95» (95% ЛЖВ знают о своем ВИЧ-статусе, 95%, знающих свой статус, получают АРТ, 95%, получающих терапию, достигли неопределяемого уровня вирусной нагрузки). Несмотря на этот несомненный успех, существующие стратегии лечения имеют ограничения. Для многих больных пожизненное лечение является сложной задачей. Приверженность к АРТ остается проблемой, особенно среди тех пациентов, которые не могут полностью соблюдать режим лечения. Токсичность лекарств и сохранение иммунной дисфункции при АРТ имеют серьезные последствия для здоровья. Эти факторы подчеркивают важность поиска новых средств борьбы с вирусом. Поиск эффективных методов терапии в настоящее время является ключевым приоритетом для ВИЧ-сообществ. Особое место отводится проблеме изучения иммуномодулирующих препаратов, способных снижать воспалительный потенциал клеток иммунной системы [4]. Целенаправленное лечение воспаления является вероятной стратегией снижения риска заражения ВИЧ и замедления прогрессирования заболевания. Хроническое воспаление и нарушение функций CD4+-Т-лимфоцитов наблюдаются даже при эффективной АРТ. Приблизительно у 15–30% пациентов не происходит оптимального восстановления количества CD4+-Т-клеток [5]. Лекарственные препараты на основе природного сырья с уменьшенными побочными эффектами в сочетании с противовоспалительными свойствами являются перспективными вариантами. Противовирусным и иммуномодулирующим свойствами обладают препарат дезоксирибонуклеат натрия (ДНК-Na) и его комплекс с железом (ДНК-Na-Fe), созданные на основе двухнитевой ДНК природного происхождения [6, 7].
Цель исследования ‒ изучение экспрессии CD4, CD28, CD38, CD62L и HLA-DR белков цитоплазматической мембраны CD4+-Т-лимфоцитов неопластической клеточной линии МТ-4 [8], инфицированной ВИЧ-1, в присутствии ДНК-Na-Fe.
Материалы и методы
Клетки МТ-4 были получены из коллекции клеточных линий Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Клетки культивировали в среде RPMI 1640, содержащей 10% сыворотки эмбриона коровы, 2 мM L-глютамина и 50 мкг/мл гентамицина, в атмосфере 5% СО2 при температуре +37 °С. Пересевали через 3–4 сут, плотность при пересеве составляла 2,5–3,0 × 105 кл/мл. Для заражения использовали штамм ВИЧ-1/899А, полученный из коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. Вирус пассировали на клетках в культуральных флаконах объемом 50 мл в течение 5–7 сут до развития выраженного цитопатического эффекта, обнаруживаемого под световым микроскопом. Затем отбирали культуральную жидкость и определяли инфекционный титр, выражаемый в lg ТЦИД50/мл (50% тканевая цитопатическая инфекционная доза). До использования аликвоты проб хранили при −80 °С. Клетки заражали вирусом при множественности инфекции около 100 ТЦИД50/клетка. Для изучения влияния ДНК-Na-Fe на экспрессию поверхностных белков в культуральную жидкость вносили ДНК-Na-Fe до конечной концентрации 500 мг/мл (разработчик ООО «ФармПак», производство ООО «ФЗ Иммуноплекс». Коммерческий раствор содержит 15 мг натрия дезоксирибонуклеата и 0,048 мг железа окисного хлорида в 5 мл воды для инъекций). Через 48 и 72 ч после культивирования проб определяли жизнеспособность клеток в присутствии трипанового синего и отбирали аликвоты для определения количества белка p24 методом иммуноферментного анализа с использованием коммерческой тест-системы (Genscreen ULTRA HIV Ag-AB, «Био-Рэд», Франция). Уровень ингибирования вирусной активности в процентах определяли по формуле:
(ЭП – КВ / КК − КВ) × 100%,
где: ЭП – показания оптической плотности экспериментальных проб с препаратом; КВ – показания оптической плотности контроля вируса (без препарата); КК – показания контроля клеток.
Показания лунки, не содержащей клеток, автоматически вычитали при определении оптической плотности исследуемых проб. Опытные пробы имели по три параллели.
Для анализа наружных фенотипических маркеров клетки окрашивали моноклональными антителами фирмы Beckman Coulter (США): CD4 (PE или PC5), CD28 (PC5), CD38 (PC5), CD62L(PE), HLA-DR (PE), IgG1 (PE), IgG1 (PC-5), IgG2a (PE). Суспензию клеток предварительно отмывали 3 раза в 0,01М фосфатно-солевом буферном растворе (рН 7,2) путем центрифугирования при 800 об/мин в течение 6 мин. Затем суспендировали в том же растворе при концентрации 2 × 106 кл/мл. Анализ окрашенных клеток проводили на проточном цитофлуориметре EPICS XL (Beckman Coulter, США). Полученные гистограммы были обработаны с использованием программы Kaluza (Beckman Coulter, Software Version 1.2, США).
Статистический анализ данных осуществляли с использованием программы BioStat v.5 (AnalystSoft, США) и Kaluza. Уровень значимости (α) был равен 0,05, колебания коэффициентов вариации во всех изученных образцах при сравнительном анализе результатов цитометрии были в пределах нормы (> 10%).
Результаты
Большинство белков плазматической мембраны иммунных клеток являются многофункциональными, и их активность может определяться многими факторами. Клетки МТ-4 – это неопластические CD4+- Т-лимфоциты, трансформированные Т-лимфотропным вирусом человека 1-го типа (Retroviridae: Orthoretrovirinae: Deltaretrovirus: Human T-lymphotropic virus type 1, ТЛВЧ-1). И эта их особенность, а также ВИЧ-1 могут быть причиной колебаний в экспрессии различных регуляторных белков клетки в целом и мембранных белков в частности. Следует отметить, что при анализе контрольных клеток в наших исследованиях неизменными были такие показатели экспрессии мембранных белков, как количество CD4+, CD25+, CD95+ и HLA-DR+. Практически около 100% клеток содержали эти маркеры [9]. В количестве остальных маркеров наблюдались существенные колебания. Вируспродуцирующая активность клеток в процессе длительного культивирования также может меняться. Поэтому в работе использовали два варианта клеток, которые были заморожены в разные периоды культивирования, одновременно подняты из азота и обозначены как Л1 и Л2. Свойства клеток линии Л1, модифицированных по двум аллелям гена ссr5, были описаны ранее [10]. Заражение клеток и окрашивание моноклональными антителами проводили в одинаковых условиях в одном и том же эксперименте. Жизнеспособность клеток через 48 и 72 ч после анализа всех опытных проб составляла 95% и более. Во всех опытах уровень вирусной активности без добавления препарата через 48 ч после заражения был практически одинаковым, через 72 ч в Л1 активность вируса была в среднем приблизительно в 1,2 раза выше. Как правило, максимальная вирусная активность в используемой нами модели «вирус‒клетка» наблюдается на 5–6-е сутки после заражения. Изучение противовирусной активности ДНК-Na-Fe показало, что в клетках линии Л1 уровень ингибирования вирусной активности составлял 32 ± 1,7 и 49,6 ± 1,3%, в Л2 – 13,8 ± 2 и 26,7 ± 1,4% через 48 и 72 ч после заражения соответственно.
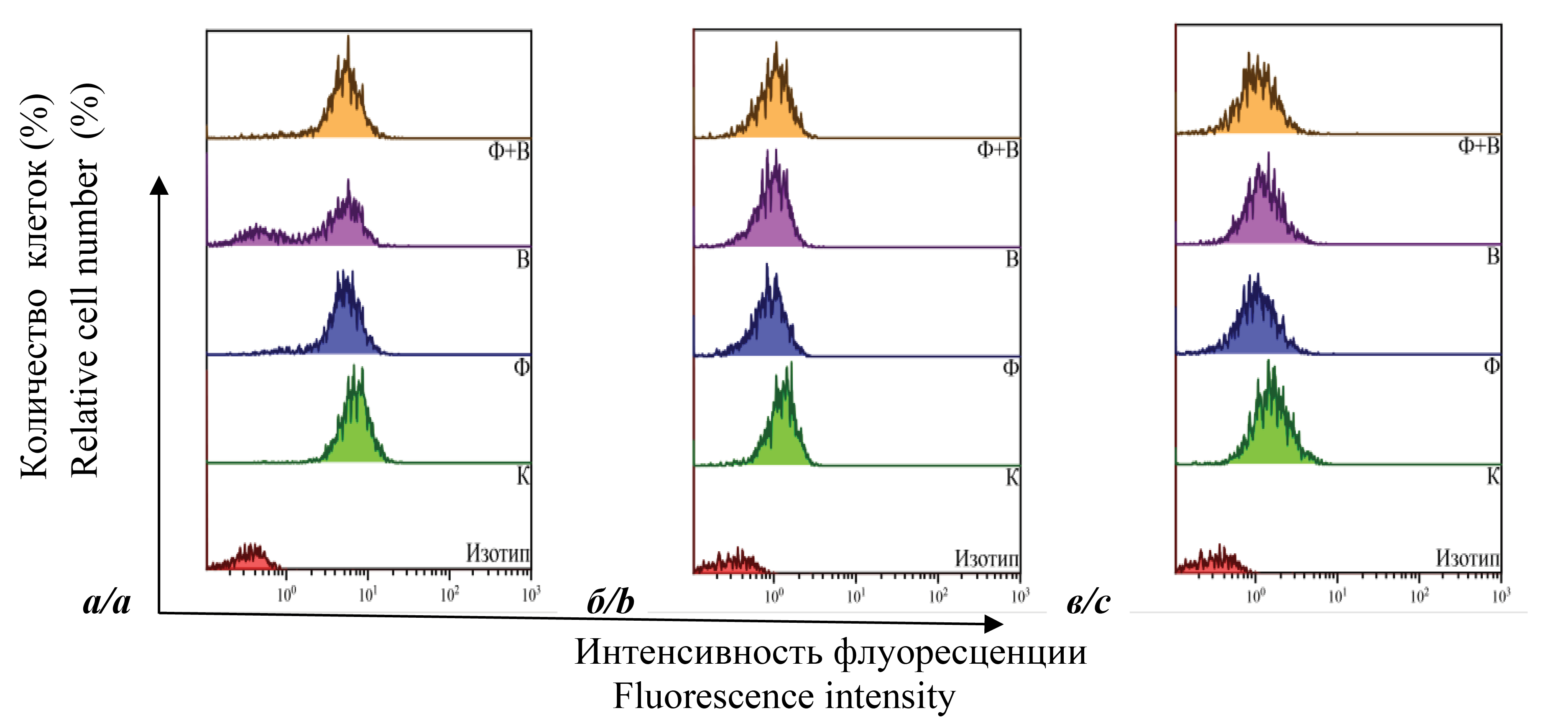
На рис. 1 представлены результаты определения количества клеток, содержащих следующие поверхностные маркеры – CD4+, CD28+, CD38+, CD62L+ и HLA-DR+. Были проанализированы незараженные клетки (К); незараженные клетки, культивируемые в присутствии ДНК-Na-Fe (Ф); зараженные клетки (В); зараженные клетки, культивируемые в присутствии ДНК-Na-Fe (Ф + В). Из рисунка видно, что через 48 ч после заражения количество CD4+-клеток во всех пробах двух линий было практически одинаково и составляет от 94 до 99%. Присутствие ДНК-Na-Fe в пробах Ф и Ф + В не меняло значения показателя. По интенсивности флуоресценции (ИФ; показатель плотности экспрессии маркера или средней интенсивности флуоресценции) существенных изменений также не наблюдалось. Через 72 ч после заражения количественный показатель также практически не менялся для всех проб, за исключением В. Этот показатель существенно снижается для Л1 (приблизительно на 27%) и незначительно (~ 5%) для Л2. В присутствии ДНК-Na-Fe он увеличивался и практически соответствовал пробам К и Ф. Результаты для проб Л1 представлены в виде однопараметрических гистограмм на рис. 2 (а). Видно, что часть клеток в пробе В теряет этот маркер, а добавление ДНК-Na-Fe устраняет эффект. Из гистограмм также видно, что препарат снижал ИФ незараженных клеток, а повышение количества зараженных клеток, несущих CD4+, пробы Ф + В сопровождалось повышением ИФ и соответствовало пробе Ф. По ИФ CD4+-клеток проб Л2 наблюдалась сходная динамика.
Рис. 1. Результаты определения количества клеток, содержащих поверхностные маркеры клеточной линии МТ-4, с использованием метода проточной цитометрии. а – Л1, б – Л2. К – контрольные клетки; Ф – клетки, культивируемые с ДНК-Na-Fe; В – зараженные клетки; Ф + В – зараженные клетки, культивируемые с ДНК-Na-Fe.
Fig. 1. The results of determining the number of cells containing surface markers of MT-4 cells using the flow cytometry method. a – L1, b – L2. K – control cells; F – cells cultured with DNA-Na-Fe; B – infected cells; F + B – infected cells cultured with DNA-Na-Fe.
Рис. 2. Однопараметрические гистограммы распределения клеток, содержащих поверхностные маркеры CD4, CD28, CD38. CD4+ – через 72 ч после заражения Л1 (а); CD28+ – через 48 ч после заражения Л1 (б); CD38+ – через 48 ч после заражения Л1 (в). К – контрольные клетки; Ф – клетки, культивируемые с ДНК-Na-Fe; В – зараженные клетки; Ф + В – зараженные клетки, культивируемые с ДНК-Na-Fe.
Fig. 2. Single-parameter histograms of the distribution of cells containing surface markers CD4, CD28, CD38. CD4+ – 72 hours after infection L1 (а); CD28+ – 48 hours after infection L1 (b); CD38+ – 48 hours after infection L1 (c). K – control cells; F – cells cultured with DNA-Na-Fe; B – infected cells; F + B – infected cells cultured with DNA-Na-Fe.
Как видно из рис. 1, имеются различия в количестве CD28+-клеток через 48 и 72 ч после культивирования. Для линии клеток Л1 было зарегистрировано его существенное снижение относительно К во всех пробах через 48 ч. Через 72 ч этот показатель относительно контроля снижался в пробе Ф и наибольшее снижение (~ 64%) отмечалось в пробе В. Для пробы Ф + В он повышался до уровня К. Для клеток линии Л2 через 48 ч были зафиксированы незначительные колебания количества CD28+-клеток относительно контроля, через 72 ч во всех опытных пробах этот показатель снижался приблизительно на 10,0 ± 2,6%. Заметные изменения в ИФ наблюдались только в Л1 через 48 ч (рис. 2 б). Видно, что во всех экспериментальных пробах ИФ ниже контроля и практически идентична для всех опытных проб. Таким образом, по уровню экспрессии CD28 можно заключить, что ДНК-Na-Fe снижает количество клеток, содержащих этот маркер. Также заражение клеток приводит к снижению экспрессии этого белка, но явный эффект проявлялся через 72 ч после заражения. Существенных закономерностей по уровню экспрессии белка CD28 в зараженных клетках в присутствии ДНК-Na-Fe выявить не удалось. Но этот показатель был ниже или сравним с пробами К.
В большинстве опытных проб наблюдалось снижение количества белка CD38+ для обеих линий (рис. 1). Наибольшее – для Л1 в зараженных клетках через 72 ч (~ 52%). В остальных случаях снижение экспрессии этого белка в зараженных клетках было следующим: около 20% в Л1 через 48 ч после заражения и около 6% через 72 ч в Л2, либо не изменялось (через 48 ч в Л2). В обеих линиях добавление ДНК-Na-Fe снижало уровень экспрессии этого белка в пределах около 27–40% в течение всего периода культивирования клеток. И этот показатель существенно не менялся при сравнении с пробами, в которых заражение клеток проводили с препаратом, разница составляла ± 5%. При этом экспрессия белка CD38 в зараженных клетках при добавлении ДНК-Na-Fe во всех пробах была существенно ниже К (приблизительно на 22–37%). Стабильное снижение ИФ во всех пробах наблюдалось только в Л1, и в большей степени было выражено через 48 ч (рис. 2 в). В Л2 в пробах Ф + В этот показатель был практически равен К, а в пробах, где присутствовал препарат, было зарегистрировано его незначительное снижение ‒ приблизительно на 7–9%. Как видно, этот показатель был ниже во всех пробах относительно пробы К. Таким образом, можно заключить, что ДНК-Na-Fe снижал экспрессию белка CD38 в незараженных и зараженных клетках.
Изучение экспрессии белка CD62L показало, что в Л1 во всех пробах наблюдалось увеличение клеток, несущих этот маркер, по сравнению с контролем через 48 и 72 ч после заражения (рис. 1 а). В незараженных клетках ДНК-Na-Fe увеличивал этот показатель приблизительно в 3 раза по сравнению с К. Существенное увеличение отмечалось для пробы В через 48 ч (~ 4 раза) и незначительное (~ 1,2 раза) через 72 ч. В пробе Ф + В через 48 ч он был сравним с показаниями пробы Ф, через 72 ч, был ниже показаний Ф и выше В. Во всех пробах Л1 наблюдалось также увеличение ИФ (рис. 3 а и б). Исключение составляла проба В через 72 ч после заражения (рис. 3 б). Результаты, полученные для Л2, сложно интерпретировать, т.к. количество CD62L+-клеток было незначительным. Можно только отметить, что в целом кинетика была сходна с Л1.
Рис. 3. Однопараметрические гистограммы распределения клеток, содержащих поверхностные маркеры CD62L и HLA-DR. CD62L+ – Л1 через 48 ч после заражения (а) и 72 ч после заражения (б); HLA-DR+ – через 48 ч после заражения Л1 (в) и Л2 (г), Л2 через 72 ч после заражения (д). К – контрольные клетки; Ф – клетки, культивируемые с ДНК-Na-Fe; В – зараженные клетки; Ф + В – зараженные клетки, культивируемые с ДНК-Na-Fe.
Fig. 3. Single-parameter histograms of the distribution of cells containing surface markers CD62L and HLA-DR. CD62L+ – L1 48 hours after infection (a) and 72 hours after infection (b); HLA-DR+ – 48 hours after infection L1 (c) and L2 (d), L2 72 hours after infection (e). K – control cells; F – cells cultured with DNA-Na-Fe; B – infected cells; F + B – infected cells cultured with DNA-Na-Fe.
Количество клеток HLA-DR+ для обеих линий через 48 и 72 ч составляло для всех проб около 99±5%. В отношении ИФ необходимо отметить следующие существенные изменения. Для Л1 этот показатель увеличивался через 48 ч во всех опытных образцах относительно контроля (рис. 3 в), но в пробах с ДНК-Na-Fe (Ф и Ф + В) в большей степени, чем в пробе В. Через 72 ч ИФ несущественно повышался в пробе Ф и Ф + В и снижался в пробе В. Анализ проб Л2 показал следующие значения относительно контроля. Через 48 ч ДНК-Na-Fe снижал ИФ. Наличие вируса существенно повышало этот показатель. В пробе Ф + В этот показатель снижался, но был выше, чем для проб К и Ф (рис. 3 г). Через 72 ч ИФ был ниже, чем в контроле, во всех опытных образцах. При этом снижение было наиболее выражено в пробе В, в меньшей степени в пробе Ф + В. ДНК-Na-Fe снижал этот показатель в пробе Ф незначительно (рис. 3 д).
Обсуждение
Особенности репликации ВИЧ-1 в настоящее время изучены очень хорошо [11]. Мембранный белок CD4- Т-лимфоцитов – это основной рецептор, используемый вирусом на ранних этапах инфицирования. Известно, что в процессе репликации вируса количество CD4+ в инфицированных клетках снижается. Это механизм, используемый вирусом для облегчения процесса почкования зрелых вирусных частиц с участием вирусных белков nef и vpu. При анализе экспрессии этого белка двумя клеточными линиями ярко выраженный эффект снижения количества CD4+ наблюдался только в клетках линии Л1 через 72 ч после заражения, вероятно, в начале развития активной фазы почкования вирусного потомства (рис. 1 а, рис. 2 а). Но в обеих линиях было зарегистрировано снижение ИФ. Это указывает на то, что и в Л2 вирусоспецифический эффект снижения уровня CD4 также присутствовал, но был выражен слабее. Скорее всего, это связано с тем, что вирусная активность в Л1, как показали исследования, выше, чем в Л2. Возможно, что на более поздних сроках инфекции этот эффект был бы выражен более значимо. Заражение клеток в присутствии ДНК-Na-Fe привело к восстановлению количества CD4+-клеток до уровня контроля и к повышению ИФ (рис. 1 а, рис. 2 а), что способствовало снижению урожая вируса. Вируспродуцирующая активность клеток в присутствии ДНК-Na-Fe снижалась в обеих линиях. Противовирусный эффект в системе с более активной репликацией вируса был выше. Это предполагает, что его использование может быть более эффективным на стадиях ВИЧ-инфекции с высокой вирусной нагрузкой ‒ на стадия острой инфекции и поздней стадии СПИДа. Таким образом, можно предположить, что усиление экспрессии CD4 зараженными клетками в присутствии ДНК-Na-Fe связано со способностью препарата влиять на механизмы, изменяющие метаболизм этого белка, и/или снижать активность вирусных белков nef и vpu. Следует отметить, что в незараженных клетках препарат снижал ИФ относительно контроля (рис. 2 а). Этот факт также свидетельствует о влиянии ДНК-Na-Fe на метаболизм белка CD4, что таким образом может приводить к снижению чувствительности клеток к инфекции. Нельзя исключить, что ДНК-Na-Fe обладает способностью активировать противовирусные клеточные факторы.
CD4-Т-клеткам принадлежит важная роль в развитии и координации адаптивного иммунитета. Для организации эффективного иммунного ответа необходима их активация. Существенным компонентом при активации Т-клеток служит костимуляторный мембранный белок CD28, который исключает развитие аберрантного иммунного ответа. CD28 регулирует широкий спектр клеточных процессов: от пролиферации и выживания до содействия дифференцировке специализированных субпопуляций Т-клеток. С момента своего первого обнаружения более 20 лет назад CD28 оставался предметом интенсивных исследований благодаря важности для нормального функционирования Т-клеток и его потенциала как терапевтической мишени [12, 13]. Показано, что, как и в случае с рецептором вируса CD4, при заражении вирусом количество его на клеточной мембране снижается при участии тех же вирусных белков – nef и vpu [14]. Наши исследования показали, что вирус существенно снижал экспрессию этого белка в клетках линии Л1 через 48 и 72 ч после заражения, а добавление ДНК-Na-Fe через 72 ч после заражения устраняло этот эффект (рис. 1 б). В Л2 была отмечена в целом сходная динамика. Но эффекты, наблюдаемые для Л2, были выражены слабее. Это, видимо, также связано с пониженной вирусной активностью в клетках. В целом можно сделать вывод о том, что противовирусная активность ДНК-Na-Fe связана с изменением метаболизма CD28, как и в случае с CD4. Через 72 ч после заражения его количество в Л1 в пробе Ф + В восстанавливалось до уровня контроля. Эта его особенность в системе in vivo может способствовать повышению иммунокомпетентности инфицированных Т-клеток. ДНК-Na-Fe также снижал количество клеток CD28+ в контрольных пробах в обеих линиях, что свидетельствует о его иммуномодулирующих свойствах, выражающихся в снижении активации иммунной системы. Что, в свою очередь, может снижать чувствительность к различным инфекциям. Что же касается возможного влияния ДНК-Na-Fe на снижение костимуляторной способности нормальных клеток, то это требует дополнительных исследований. Повышенный уровень белка СD28 является неблагоприятным прогностическим фактором при различных лимфомах [15]. В норме в организме сохраняется баланс между стимулирующими и ингибирующими сигналами, которые определяют конечную природу Т-клеточных ответов и могут быть обусловлены множеством факторов, включая сложные взаимодействия рецептора и лиганда между членами семейства CD28 в зависимости от типа клеток. Несмотря на центральную роль CD28, членов его семейства и лигандов для иммунной функции, многие аспекты биологии CD28 остаются неясными. Внедрение базового понимания функции CD28 в иммуномодулирующей терапии было противоречивым, с успехами и неудачами. Нельзя исключить, что ДНК-Na-Fe может помогать в регуляции костимулирующих сигналов и служить дополнительным регулятором сохранения необходимого баланса. Разное влияние ДНК-Na-Fe на экспрессию белка CD28 в клетках Л1 и несущественный эффект в клетках Л2 указывает на сложный механизм регуляции экспрессии генома в клетках МТ-4 в норме и при ВИЧ-инфекции. Своевременное включение и выключение конкретных генов в определенных клетках вызывает их физиологические изменения. В целом можно заключить, что через 72 ч после заражения количество клеток, экспрессирующих белок CD28+, существенно уменьшается, а присутствие ДНК-Na-Fe в зараженных клетках устраняет вирусный эффект и восстанавливает этот показатель до нормы. Таким образом, следует отметить, что препарат снижал уровень активации неинфицированных клеток, но увеличивал количество белка CD28+ в зараженных клетках. При этом ИФ снижалась по сравнению с контрольной линией и восстанавливалась через 72 ч культивирования зараженных клеток в присутствии препарата. Поскольку CD28 выполняет важную костимуляторную роль при передаче иммунных сигналов Т-клеточным рецептором, можно сделать вывод о том, что при ВИЧ-инфекции ДНК-Na-Fe может восстанавливать иммунный потенциал зараженных клеток, который снижается при ВИЧ-инфекции.
Одним из важных показателей активации иммунной системы при ВИЧ-инфекции служит мембранный белок CD38. Это многофункциональный трансмембранный белок, и уровень экспрессии его на поверхности иммунных клеток зависит от их активации. Он играет ключевую роль в передаче сигналов регуляции уровня внутриклеточного кальция и модуляции процессов выживания и метаболизма [16, 17]. Данные, накопленные за почти четыре десятилетия, прошедших с момента его открытия, указывают на то, что CD38 играет важную роль в функционировании различных иммунных клеток как в норме, так и при разных патологиях. Поэтому он служит прогностическим маркером и перспективной терапевтической мишенью. Показано взаимодействие CD38 на клеточной мембране с белками CD4 и gp120 ВИЧ-1. Это, в свою очередь, может влиять на взаимодействие вируса с клеткой. В целом при анализе данных о роли CD38 в иммунном ответе при ВИЧ-инфекции наблюдаются существенные расхождения. А использование его антагонистов в терапевтических целях реальных обнадеживающих результатов не дало. Таким образом, несмотря на наличие большого объема данных о разнообразных функциях CD38 в иммунном ответе, необходимы новые и более сложные подходы для определения последствий воздействия на специфическую активность, опосредованную CD38, во время ответа хозяина на инфекцию.
Полученные нами данные с использованием двух вариантов линий показали, что в пробах обеих линий в присутствии ДНК-Na-Fe в неинфицированных и инфицированных клетках происходит существенное снижение экспрессии белка CD38 по сравнению с контролем (рис. 1). В инфицированных клетках Л1 снижение было наименьшим через 48 ч (~ 20%) и наибольшим через 72 ч (~ 50%), в Л2 не изменялось или составляло около 20% соответственно. На основании этих данных можно предположить, что через 72 ч начинается активизация процесса почкования вирусного потомства. И на этом этапе проявляются механизмы снижения его экспрессии вирусными факторами, как и в случае с другими клеточными мембранными белками, способными взаимодействовать с gp120 и препятствующими почкованию. В клетках линии Л2 этот эффект выражен слабее, так же, видимо, вследствие сниженной вирусной активности. Как показали результаты по снижению репликации вируса в пробах Ф + В, ДНК-Na-Fe, снижая активацию клеток, вероятно, способствовал и снижению репликации вируса.
Наружный белок клеточной мембраны CD62L – это молекула клеточной адгезии, обеспечивающая процесс циркуляции лейкоцитов. Белок играет существенную роль в транспорте активированных лимфоцитов в лимфоидные органы и инициации и поддержании иммунного ответа против патогенов при развитии инфекции. Известно, что белок CD62L облегчает проникновение вируса в клетки, помогая адгезии белка вируса gp120 c рецептором CD4 и корецептором. Однако в процессе почкования для успешного высвобождения частиц в окружающую среду количество CD62L должно быть снижено, т.к. он удерживает вирусные частицы на клеточной мембране. Поэтому при заражении лимфоцитов ВИЧ-1 происходит снижение его экспрессии при участии вирусных белков nef и vpu. Эти белки связываются с CD62L в клетке и препятствуют его транспорту к мембране. Вирус использует этот белок на ранних стадиях инфекции для прикрепления к клеткам, а на поздних индуцирует сегрегацию наружного домена или эндоцитоз для облегчения процесса почкования вирусного потомства [18, 19]. Снижение экспрессии этого белка на мембране клеток приводит к снижению циркуляции и активации инфицированных клеток и способствует усилению инфекционного процесса и ухудшению развития адаптивного иммунного ответа.
Изучение экспрессии белка CD62L в линиях Л1 и Л2 показало, что в целом динамика показаний в опытных образцах была сходной, но в Л2 она была существенно ниже, чем в Л1. Это, видимо, как и для описанных выше маркеров, связано с особенностями клеток и их вируспродуцирующей активностью. Поэтому следует остановиться на результатах, полученных для Л1. Во всех пробах наблюдалось увеличение экспрессии CD62L по сравнению с контролем как в количестве, так и по ИФ (рис. 1 а; рис. 3 а, б). Следует отметить, что в зараженных клетках эти показатели через 72 ч были практически равны контролю (рис. 1 а) или ниже (рис. 3 б). Последний результат указывает на то, что вирус способен снижать экспрессию CD62L.
На основании этих данных можно заключить, что эффект ДНК-Na-Fe может быть двояким. С одной стороны, препарат может усиливать заражение клеток вирусом. С другой стороны, увеличение экспрессии белка CD62L в присутствии препарата указывает на то, что ДНК-Na-Fe способен снижать репликацию ВИЧ-1 в системе in vitro. Поэтому наблюдаемый эффект снижения репликации ВИЧ в присутствии ДНК-Na-Fe можно объяснить увеличением экспрессии белка CD62L. Первый негативный эффект может быть нивелирован in vivo известными в настоящее время клеточными механизмами, контролирующими инфекцию и репликацию ВИЧ-1 [1]. А разница во влиянии препарата на экспрессию белка CD62L в МТ-4-клетках, наблюдаемая в разных линиях, указывает на то, что CD62L не обладает высокой специфической активностью и его действие, видимо, зависит от особенностей совокупных молекулярно-биологических процессов, происходящих в клетках.
Маркер иммунных клеток HLA-DR (антиген гистосовместимости II класса) ‒ это основной маркер активации лимфоцитов и моноцитов, который был обнаружен в клетках CD4 у пациентов с Т-клеточным лейкозом, ассоциированным с инфекцией ТЛВЧ-1 [20]. Он регулирует содержание кальция в цитоплазме клеток, проницаемость клеточных мембран, активирует фосфорилирование внутриклеточных белков. Белок HLA-DR тесно связан с иммунным ответом, регуляцией ответов клеток на внешние стимулы и имеет большое значение в развитии аутоиммунных заболеваний, опухолевого иммунитета, при трансплантации органов. При ВИЧ-инфекции особую роль уделяют изучению HLA-DR+-Т-лимфоцитов, т.к. они обладают повышенной пролиферативной активностью [21]. Особое значение имеет пул инфицированных клеток памяти, содержащих активный провирус, который сохраняется при активной АРТ и является источником рецидивов [22].
Как показали наши исследования, во всех изученных пробах двух линий практически более 90% клеток были HLA-DR+ (рис. 1 а, б). И этот показатель не менялся относительно контроля. И, если в количественном отношении разницы не наблюдалось, то показатель ИФ по времени культивирования изменялся (рис. 3 в‒д). Однако полученные результаты противоречивы и не позволяют сделать какие-либо существенные выводы. Можно отметить только то, что и ДНК-Na-Fe, и вирус могут изменять уровень экспрессии белка как по отдельности, так и в комплексе. Ранее нами было показано, что длительное культивирование МТ-4 клеток с ДНК-Na-Fe приводило к снижению количества клеток HLA-DR+ [7].
В целом наблюдаемые различия во влиянии ДНК-Na-Fe на клетки и репликацию вируса в присутствии препарата на экспрессию всех изученных поверхностных белков в разных линиях клеток указывает на то, что они зависят от особенностей совокупных молекулярно-биологических процессов, происходящих в клетках. Различия во влиянии ДНК-Na-Fe на репликацию ВИЧ, наблюдаемые в системах с разной репликативной активностью, указывают на его более активное участие в метаболизме клеток и изменении процессов репликации вируса на стадиях проникновения и почкования дочерних вирионов в более активных системах и/или только при определенных соотношениях всех участников метаболического процесса.
Заключение
Исследования показали, что ДНК-Na-Fe обладает противовирусной и иммуномодулирующей активностью. На основании полученных результатов можно сделать вывод о том, что противовирусная активность препарата при заражении МТ-4-клеток ВИЧ-1 связана с иммуномодулирующей активностью, изменяющей экспрессию мембранных белков CD4, CD28, CD38 и CD62L. Механизмом снижения репликации ВИЧ-1 в присутствии ДНК-Na-Fe можно объяснить его участие в регулировании уровня рецептора СD4 в зараженных клетках, а также белков, являющихся маркерами активации клеток.
Финансирование. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Дезоксирибонуклеат натрия с железом комплекс предоставлен ООО «ФармПак», Россия. В авторский коллектив входит аффилированный сотрудник комании разработчика – ООО «ФармМПарк», не являющийся CEO. ООО «ФармМПарк» не выступал в роли спонсора исследования.
Об авторах
Дмитрий Николаевич Носик
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: dnnosik@yandex.ru
ORCID iD: 0000-0001-5757-5671
д-р мед. наук, профессор, руководитель лаборатории противовирусных и дезинфекционных средств Института вирусологии имени Д.И. Ивановского
Россия, 123098, г. МоскваЛюдмила Борисовна Калнина
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: klb3@yandex.ru
ORCID iD: 0000-0002-2702-8578
канд. биол. наук, ведущий научный сотрудник лаборатории противовирусных и дезинфекционных средств Института вирусологии имени Д.И. Ивановского
Россия, 123098, г. МоскваЛюдмила Мидатовна Селимова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: lselim@mail.ru
ORCID iD: 0000-0003-3709-770X
д-р биол. наук, ведущий научный сотрудник лаборатории противовирусных и дезинфекционных средств Института вирусологии им. Д.И. Ивановского
Россия, 123098, г. МоскваЭлли Николаевна Каплина
ООО «ФармПак»
Email: info@derinat.ru
ORCID iD: 0000-0001-8540-5856
канд. тех. наук, профессор РАЕ, консультант
Россия, 105318, г. МоскваСписок литературы
- Masenga S.K., Mweene B.C., Luwaya E., Muchaili L., Chona M., Kirabo A. HIV-host cell interactions. Cells. 2023; 12(10): 1351. https://doi.org/10.3390/cells12101351
- Hokello J., Tyagi P., Dimri S., Sharma A.L., Tyagi M. Comparison of the biological basis for non-HIV transmission to HIV-exposed seronegative individuals, disease non-progression in HIV long-term non-progressors and elite controllers. Viruses. 2023; 15(6): 1362. https://doi.org/10.3390/v15061362
- Ventura J.D. Human Immunodeficiency Virus 1 (HIV-1): Viral latency, the reservoir, and the cure. Yale J. Biol. Med. 2020; 93(4): 549–60.
- Lv T., Cao W., Li T. HIV-related immune activation and inflammation: current understanding and strategies. J. Immunol. Res. 2021; 2021: 7316456. https://doi.org/10.1155/2021/7316456
- Yang X., Su B., Zhang X., Liu Y., Wu H., Zhang T. Incomplete immune reconstitution in HIV/AIDS patients on antiretroviral therapy: Challenges of immunological non-responders. J. Leukoc. Biol. 2020; 107(4): 597–612. https://doi.org/10.1002/JLB.4MR1019-189R
- Беседнова Н.Н., Макаренкова И.Д., Федянина Л.Н., Авдеева Ж.И., Крыжановский С.П., Кузнецова Т.А. и др. Дезоксирибонуклеиновая кислота про- и эукариот в профилактике и терапии инфекционных болезней. Антибиотики и химиотерапия. 2018; 63(5-6): 52–67. https://elibrary.ru/xvvinv
- Носик Д.Н., Калнина Л.Б., Лобач О.А., Чатаева М.С., Бережная Е.В., Бочкова М.С. и др. Противовирусная и вирулицидная активность дезоксирибонуклеата натрия и его комплекса с железом в отношении вирусов разных царств и семейств. Вопросы вирусологии. 2022; 67(6): 506–15. https://doi.org/10.36233/0507-4088-148 https://elibrary.ru/rtrade
- Miyoshi I., Kubonishi I., Yoshimoto S., Akagi T., Ohtsuki Y., Shiraishi Y., et al. Type C virus particles in a cord T-cell line derived by co-cultivating normal human cord leukocytes and human leukaemic T cells. Nature. 1981; 294(5843): 770–1. https://doi.org/10.1038/294770a0
- Селимова Л.М., Калнина Л.Б., Носик Д.Н. Поверхностные маркёры неопластической клеточной линии МТ-4 и перспективы её использования в качестве модели для изучения активности иммуномодулирующих препаратов. Клиническая лабораторная диагностика. 2016; 61(12): 822–5. https://doi.org/10.18821/0869-2084-2016-61-12-822-825 https://elibrary.ru/xscfqz
- Носик Д.Н., Калнина Л.Б., Селимова Л.М., Пронин А.В. Увеличение инфекционности вируса иммунодефицита человека при модификации гена ccr5 чувствительных клеток. Доклады Российской Академии наук. Науки о жизни. 2023; 511(1): 344–8. https://doi.org/10.31857/S2686738923700257 https://elibrary.ru/jiltbd
- Levesque K., Finzi A., Binette J., Cohen E.A. Role of CD4 receptor down-regulation during HIV-1 infection. Curr. HIV Res. 2004; 2(1): 51–9. https://doi.org/10.2174/1570162043485086
- Boomer J.S., Green J.M. An enigmatic tail of CD28 signaling. Cold Spring Harb. Perspect. Biol. 2010; 2(8): a002436. https://doi.org/10.1101/cshperspect.a002436
- Nandi D., Pathak S., Verma T., Singh M., Chattopadhyay A., Thakur S., et al. T cell costimulation, checkpoint inhibitors and anti-tumor therapy. J. Biosci. 2020; 45: 50.
- Leonard J.A., Filzen T., Carter C.C., Schaefer M., Collins K.L. HIV-1 Nef disrupts intracellular trafficking of major histocompatibility complex class I, CD4, CD8, and CD28 by distinct pathways that share common elements. J. Virol. 2011; 85(14): 6867–81. https://doi.org/10.1128/JVI.00229-11
- Rohr J., Guo S., Huo J., Bouska A., Lachel C., Li Y., et al. Recurrent activating mutations of CD28 in peripheral T-cell lymphomas. Leukemia. 2016; 30(5): 1062–70. https://doi.org/10.1038/leu.2015.357
- Glaría E., Valledor A.F. Roles of CD38 in the Immune Response to Infection. Cells. 2020; 9(1): 228. https://doi.org/10.3390/cells9010228
- Savarino A., Bottarel F., Malavasi F., Dianzani U. Role of CD38 in HIV-1 infection: an epiphenomenon of T-cell activation or an active player in virus/host interactions? AIDS. 2000; 14(9): 1079–89. https://doi.org/10.1097/00002030-200006160-00004
- Vassena L., Giuliani E., Koppensteiner H., Bolduan S., Schindler M., Doria M. HIV-1 Nef and Vpu interfere with L-selectin (CD62L) cell surface expression to inhibit adhesion and signaling in infected CD4+ T lymphocytes. J. Virol. 2015; 89(10): 5687–700. https://doi.org/10.1128/JVI.00611-15
- Segura J., He B., Ireland J., Zou Z., Shen T., Roth G., et al. The role of L-selectin in HIV infection. Front. Microbiol. 2021; 12: 725741. https://doi.org/10.3389/fmicb.2021.725741
- Freedman A.S., Nadler L.M. Immunologic markers in non-Hodgkin’s lymphoma. Hematol. Oncol. Clin. North Am. 1991; 5(5): 871–89.
- Mahalingam M., Pozniak A., McManus T.J., Vergani D., Peakman M. Cell cycling in HIV infection: analysis of in vivo activated lymphocytes. Clin. Exp. Immunol. 1995; 102(3): 481–6. https://doi.org/10.1111/j.1365-2249.1995.tb03841.x
- Horsburgh B.A., Lee E., Hiener B., Eden J.S., Schlub T.E., von Stockenstrom S., et al. High levels of genetically intact HIV in HLA-DR+ memory T cells indicates their value for reservoir studies. AIDS. 2020; 34(5): 659–68. https://doi.org/10.1097/qad.0000000000002465
Дополнительные файлы