Маркеры антропонозных вирусных инфекций у зеленых мартышек, поступивших из мест естественного обитания (Танзания)
- Авторы: Догадов Д.И.1, Кюрегян К.К.2,3, Гончаренко А.М.1, Миносян А.А.1, Кочконян А.А.1, Карлсен А.А.2,3, Вышемирский О.И.1, Карал-оглы Д.Д.1, Михайлов М.М.2,3
-
Учреждения:
- ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
- ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
- ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
- Выпуск: Том 68, № 5 (2023)
- Страницы: 394-403
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/14733
- DOI: https://doi.org/10.36233/0507-4088-188
- EDN: https://elibrary.ru/awajxs
- ID: 14733
Цитировать
Аннотация
Введение. Приматы, наряду с грызунами и летучими мышами, наиболее часто оказываются резервуаром и источником зоонозных вирусных инфекций. Кроме того, у диких обезьян и у приматов, содержащихся в неволе, выявляют различные человеческие вирусы. Изучение вирусного разнообразия у обезьян необходимо для ограничения потенциальной передачи вирусов между людьми и приматами разных видов.
Целью работы являлось изучение маркеров антропонозных вирусных инфекций у зеленых мартышек вервет (Chlorocebus pygerythrus), поступивших из мест естественного обитания (Танзания).
Материалы и методы. Образцы фекалий (n = 56) и сывороток крови (n = 75), полученные от 75 животных на 10-е и 23-и сутки соответственно после поступления в приматологический центр, были протестированы на наличие маркеров антропонозных вирусных инфекций (вирус Эбола, вирус Марбург, вирус лимфоцитарного хориоменингита (ЛХМ), вирус гепатита С (ВГС), вирус простого герпеса 1-го и 2-го типов (ВПГ-1,2), цитомегаловирус (ЦМВ), вирус Эпштейна–Барр (ВЭБ), вирус парагриппа 1-го и 3-го типов, кишечный аденовирус, ротавирус) с применением методов иммуноферментного анализа и полимеразной цепной реакции.
Результаты и обсуждение. У обследованных животных были обнаружены маркеры 6 из 11 исследованных вирусов. Среди маркеров герпесвирусных инфекций IgG-антитела к ВПГ-1,2 (15,9%) и ЦМВ (15,9%) выявлялись в 2 раза реже, чем к ВЭБ (31,8%). Среди маркеров респираторных вирусных инфекций были обнаружены IgG-антитела к вирусу парагриппа 1-го типа (6,8%). Среди маркеров кишечных вирусных инфекций у 14,3% животных был обнаружен антиген ротавируса, а у 94% – ДНК аденовируса обезьян. Маркеры геморрагических лихорадок Эбола, Марбург, ЛХМ, ВГС, а также парагриппа 3-го типа выявлены не были.
Заключение. При импорте обезьян из разных регионов мира необходима система скрининга вирусных инфекций с учетом эпидобстановки как в стране импорта, так и в стране экспорта.
Полный текст
Введение
Вирусные инфекции представляют собой потенциальную угрозу для здоровья популяций диких и лабораторных приматов, а также для персонала, осуществляющего уход за этими животными. Это особенно актуально для учреждений, в которых часто происходит оборот или перемещение животных, а также для заведений и территорий, где обезьян, поступивших из мест естественного обитания, вводят в колонии восприимчивых к инфекции животных [1].
Приматы, наряду с грызунами и летучими мышами, наиболее часто оказываются резервуаром и источником зоонозных вирусных инфекций по сравнению с другими группами млекопитающих [2]. Тесные эволюционные отношения между людьми и обезьянами являются причиной легкости межвидовой передачи различных патогенов [3]. Примером может служить человеческий коронавирус ОС43, обнаруженный у диких шимпанзе в Кот-д`Ивуаре [4], а также SARS-CoV-2, выявленный у горилл в неволе после контакта с инфицированным, но бессимптомно болевшим сотрудником зоопарка Сан-Диего [5]. Кроме того, большое число вирусов человека, включая корона-, герпес-, рота- и энтеровирусы, вирусы, вызывающие гепатит, кишечные аденовирусы, было обнаружены как у содержащихся в неволе, так и диких обезьян [6–13]. Многие значимые для человечества патогены, такие как вирус желтой лихорадки, вирусы Зика, Денге и ВИЧ, возникли в результате зоонозной передачи от приматов [5, 14, 15]. И наоборот, источником некоторых вирусов, обнаруженных среди обезьян, таких как полиовирус, вирус кори, считается человеческая популяция [16–18].
Кроме того, вероятность передачи патогенов увеличивает организованное кормление обезьян в зоопарках и приматологических центрах мира, а также в дикой природе, являющееся одной из наиболее распространенных форм экотуризма. Примером может служить остров Бали, на котором более 700 тыс. туристов ежегодно посещают храмы, где обитают приматы. Так, было описано заражение пенистым вирусом обезьян туриста после контакта с приматами в храме [3].
На сегодняшний день статистические данные свидетельствуют о том, что в общей сложности 140 видов обезьян восприимчивы к инфицированию 186 ДНК- и РНК-содержащими вирусами, из которых около 70% также обнаруживаются у человека [5]. В нашей стране среди обезьян Сухумского приматологического центра были описаны спонтанные вирусные инфекции, патогенные для человека, такие как корь, полиомиелит, вирус гепатита А (ВГА), энцефаломиокардит, сезонная коронавирусная инфекция, а также геморрагическая лихорадка обезьян [19].
В последние десятилетия межвидовая передача вирусов между животными и людьми является основным источником возникновения инфекционных заболеваний и остается глобальной проблемой для общественного здравоохранения. Примером может служить пандемия, вызванная SARS-CoV-2, которая быстро распространилась по всему миру [5].
Таким образом, изучение вирусного разнообразия у обезьян необходимо для ограничения потенциальной передачи вирусов между человеком и разными видами приматов.
Ранее, в рамках карантинных мероприятий, на наличие маркеров энтеральных вирусных гепатитов и респираторных инфекций (вирус кори и аденовирус) нами были обследованы зеленые мартышки, поступившие в "НИИ Медицинской приматологии" в июне 2014 г. Среди обследованных животных были обнаружены маркеры ВГА-инфекции (анти-ВГА IgG – 63,1%, анти-ВГА IgM – 27,5%, Ag ВГА – 27,5%, РНК ВГА – 27,5%) и респираторной аденовирусной инфекции (анти-IgG – 14,8%, анти-IgM – 7,4%), а маркеры инфекции, вызванной вирусом гепатита Е (ВГЕ), и коревой инфекции выявлены не были [6, 10, 20].
Целью настоящей работы являлось дальнейшее, более расширенное определение серологических и молекулярно-генетических маркеров антропонозных вирусных инфекций у зеленых мартышек вервет (Chlorocebus pygerythrus), поступивших из мест естественного обитания (Танзания).
Материалы и методы
В работе использовали сыворотки крови и фекальные образцы от 75 зеленых мартышек вервет (Chlorocebus pygerythrus), поступивших из мест естественного обитания (Танзания) в 2014 г. Фекальные образцы (n = 56) собирали на 10-е, а сыворотки крови (n = 75) – на 23-и сутки после поступления животных. Образцы фекалий и сывороток крови после сбора в 2014 г. хранили без оттаивания при −70 °С в нескольких аликвотах. Обследование на маркеры вирусных инфекций проводили как оперативно (кишечный аденовирус, вирусы Эбола, Марбург, лимфоцитарного хориоменингита (ЛХМ), ротавирус), так и ретроспективно (вирус простого герпеса 1-го, 2-го типов (ВПГ-1,2), цитомегаловирус (ЦМВ), вирус Эпштейна–Барр (ВЭБ), вирус парагриппа 1-го (PI-1) и 3-го (PI-3) типов, вирус гепатита С (ВГС)).
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus Author Guidelines for Animal Use (IAVES, 23 July 2010). Протокол исследования одобрен Этическим комитетом организации (протокол № 135 от 20.05.2014).
Антитела к ВГС (анти-ВГС), ВПГ-1,2 (анти-ВПГ-1,2), ЦМВ (анти-ЦМВ) и ВЭБ (анти-ВЭБ) определяли посредством иммуноферментного анализа (ИФА) с помощью коммерческих тест-систем «ИФА-АНТИ-HCV», «ДС-ИФА-АНТИ-ВПГ-1,2-G», «ДС-ИФА-АНТИ-ЦМВ-G» и «ДС-ИФА-АНТИ-ВЭБ-VCA-G» (НПО «Диагностические системы», Россия). Для детекции антител класса IgG к PI-1 и PI-3 (анти-PI-1 и анти-PI-3) применяли тест-системы «ИФА-Парагрипп-1-IgG» и «ИФА-Парагрипп-3-IgG» (ЗАО «ЭКОлаб», Россия).
Конъюгат к иммуноглобулинам человека из тест-систем «ДС-ИФА-АНТИ-ВПГ-1,2-G», «ДС-ИФА-АНТИ-ЦМВ-G» и «ДС-ИФА-АНТИ-ВЭБ-VCA-G» и «ИФА-Парагрипп-1-IgG» сравнивали при тестировании панелей реактивных и нереактивных сывороток с конъюгатом к иммуноглобулинам обезьян «RABBIT ANTI-MONKEY IgG» (MERCK, США) в разведениях, в зависимости от использовавшегося теста, от 1 : 2500 до 1 : 200 тыс. Средние значения оптической плотности при длине волны 450 нм (ОП450), полученные с двумя конъюгатами, сравнивали с использованием U-критерия Манна–Уитни.
Антиген ротавируса группы А определяли в образцах фекалий с помощью коммерческой тест-системы «ИФА-Rota-Ag» (ЗАО «Вектор Бест», Россия).
Результаты ИФА учитывали на спектрофотометре ImmunoChem-2100 производства «Интермедика сервис» (США). Полученные данные выражали в единицах ОП450, дополнительно для ВПГ ОП450 выражали в титрах, а для ЦМВ – в МЕ/мл.
Выделение нуклеиновых кислот производили из 10% фекальных суспензий с использованием набора «РИБО-преп» (ООО «ИнтерЛабСервис», Россия) согласно инструкции производителя.
Определение ДНК аденовирусов в образцах фекальных экстрактов обезьян осуществляли методом полимеразной цепной реакции (ПЦР) с использованием праймеров к гексону наиболее важных с медицинской точки зрения аденовирусов человека групп A–F [21]. Учет результатов проводили методом электрофореза продуктов ПЦР с помощью набора комплекта реагентов для электрофоретической детекции (ООО «ИнтерЛабСервис», Россия). Ампликоны очищали из агарозного геля с помощью набора QIAquik Gel Extraction Kit (Qiagen, Германия) и выполняли секвенирование по Сэнгеру с помощью автоматизированного генетического анализатора ABI3500 (ABI, США) с набором реагентов Big Dye Terminator v. 3.1 в соответствии с протоколом производителя.
Полученные нуклеотидные последовательности выравнивали друг с другом и соответствующими участками полных или частичных геномных последовательностей аденовирусов, доступных в GenBank на момент проведения исследования, с помощью программы MEGA X. Для подтверждения специфичности и определения вида аденовируса проводили филогенетический анализ с использованием классификации ICTV текущего года для рода Mastadenovirus. Для построения филогенетического дерева использовали метод ML (максимальное правдоподобие), реализованный в пакете PhyML 3.3. Визуализацию полученного дерева осуществляли с помощью FigTree v1.4.4.
Определение генетического материала возбудителей геморрагических лихорадок Эбола, Марбург и вируса ЛХМ выполняли в образцах сыворотки крови методом ПЦР в ФГБНУ «Институт химической биологии и фундаментальной медицины» (Новосибирск) в рамках коммерческого исследования.
Полученные результаты подвергали статистической обработке по общепринятым методикам с использованием программы статистической обработки данных GraphPad. Статистическая обработка данных включала: определение средних показателей величин, расчет 95% доверительного интервала (95% ДИ), выявление достоверности различий средних значений показателей в сравниваемых группах с использованием критерия Фишера (различия оценивали как достоверные при вероятности 95% – p ≤ 0,05).
Результаты
Сравнительный анализ показателей оптической плотности при выявлении антител к вирусам при использовании в ИФА-тест-системах двух типов конъюгатов
Для сравнения эффективности выявления антител к антропонозным вирусам в зависимости от применяемых в ИФА вторичных антител на первом этапе исследования проводили параллельное тестирование с применением конъюгата к иммуноглобулинам человека из коммерческого набора и конъюгата к иммуноглобулинам обезьян. Для тестирования использовали панели сывороток крови обезьян, реактивных и нереактивных в соответствующих тест-системах с применением вторичных антител к иммуноглобулинам обезьян.
Таблица 1. Сравнительный анализ средних значений оптической плотности при определении антител к герпесвирусам и вирусу парагриппа 1-го типа с использованием конъюгатов из коммерческих тест-систем и конъюгатов к иммуноглобулинам обезьян
Table 1. Comparative analysis of mean optical density values when detecting antibodies to herpes viruses and parainfluenza 1 virus using conjugates from commercial ELISA kits and anti-monkey secondary antibodies
Параметр Parameter | ВПГ-1,2 / HSV-1,2 | ЦМВ / CMV | ВЭБ / EBV | PI-1 / PI-1 | ||||
конъюгат тест-системы test system conjugate | конъюгат к Ig обезьян monkey Ig conjugate 1 : 50 000 | конъюгат тест-системы test system conjugate | конъюгат к Ig обезьян monkey Ig conjugate 1 : 50 000 | конъюгат тест-системы test system conjugate | конъюгат к Ig обезьян monkey Ig conjugate 1 : 200 000 | конъюгат тест-системы test system conjugate | конъюгат к Ig обезьян monkey Ig conjugate 1 : 2500 | |
Средние значения ОП450 для реактивных образцов (n = 3) Average OD450 values for reactive samples (n = 3) | 1,722* | 1,199* | 1,257* | 1,251* | 1,835* | 1,619* | 1,331* | 1,019* |
Средние значения ОП450 для нереактивных образцов (n = 3) Average OD450 values for non-reactive samples (n = 3) | 0,104* | 0,146* | 0,113* | 0,150* | 0,129** | 0,481** | 0,348* | 0,331* |
Примечание. Значения р получены при сравнении средний значений ОП450 между двумя конъюгатами с использованием U-критерия Манна – Уитни; * – значения р ≥ 0,05 при сравнительном анализе; ** – значения р ≤ 0,05 при сравнительном анализе.
Note. P values were obtained by comparing the mean OD450 values between the two conjugates using the Mann–Whitney U test; * – p values ≥ 0.05 for comparative analysis; ** – p values ≤ 0.05 for comparative analysis.
Как видно из табл. 1, средние значения ОП450, полученные при использовании конъюгатов к иммуноглобулинам человека из коммерческих тест-систем для выявления антител к герпесвирусам и PI-1 и конъюгатов к иммуноглобулинам обезьян, достоверно не отличались (≥ 0,05, критерий Манна–Уитни), что свидетельствует о взаимозаменяемости конъюгатов и возможности дальнейшего тестирования на данные маркеры с использованием конъюгатов из тест-систем. Исключение составили нереактивные по анти-ВЭБ-образцы, для которых средняя величина ОП450 при использовании конъюгата из тест-системы была достоверно ниже. Это говорит о лучшей работе конъюгата коммерческого набора «ДС-ИФА-АНТИ-ВЭБ-VCA-G» по сравнению с конъюгатом «RABBIT ANTI-MONKEY IgG», который дает «фон» у нереактивных образцов даже при рабочем разведении 1 : 200 тыс.
Среди обследованных животных были обнаружены маркеры 6 из 11 исследованных вирусов (ВПГ, ЦМВ, ВЭБ, PI-1, кишечный аденовирус, ротавирус). В табл. 2 представлены показатели частоты выявления маркеров антропонозных вирусных инфекций у зеленых мартышек вервет, импортированных из мест естественного обитания (Танзания).
Таблица 2. Выявление маркеров антропонозных вирусных инфекций у зеленых мартышек
Table 2. Identification of markers of anthroponotic viral infections in vervet monkeys
№ | Вирус Virus | Маркер Marker | Количество позитивных/исследованных образцов Number of positive samples/of examined samples | % | 95% ДИ CI 95% |
Геморрагические лихорадки / Hemorrhagic fevers | |||||
1 | Вирус Эбола Ebola virus | РНК RNA | 0/75 | 0 | – |
2 | Вирус Марбург Marburg virus | РНК RNA | 0/75 | 0 | – |
3 | Вирус лимфоцитарного хориоменингита (ЛХМ) Lymphocytic choriomeningitis virus (LCMV) | РНК RNA | 0/75 | 0 | – |
Вирусные гепатиты / Viral hepatitis | |||||
4 | Вирус гепатита С (ВГС) Hepatitis C virus (HCV) | Анти-ВГС* Anti-HCV* | 0/44 | 0 | – |
Герпесвирусные инфекции / Herpesvirus infections | |||||
5 | Вирус простого герпеса 1-го и 2-го типов (ВПГ-1,2) Herpes simplex virus types 1 and 2 (HSV-1,2) | Анти-ВПГ-1,2 IgG Anti-HSV-1,2 IgG | 7/44 | 15,9 | 7–30 |
6 | Цитомегаловирус (ЦМВ) Cytomegalovirus (CMV) | Анти-ЦМВ IgG Anti-CMV IgG | 7/44 | 15,9 | 7–30 |
7 | Вирус Эпштейна‒Барр (ВЭБ) Epstein‒Barr virus (EBV) | Анти-ВЭБ IgG Anti-EBV IgG | 14/44 | 31,8 | 19–48 |
Респираторные вирусные инфекции / Respiratory viral infections | |||||
8 | Вирус парагриппа 1-го типа (PI-1) Parainfluenza 1 virus (PI-1) | Анти-PI-1 IgG Anti-PI-1 IgG | 3/44 | 6,8 | 1 – 19 |
9 | Вирус парагриппа 3-го типа (PI-3) Parainfluenza 3 virus (PI-3) | Анти-PI-3 IgG Anti-PI-3 IgG | 0/44 | 0 | – |
Кишечные вирусные инфекции / Intestinal viral infections | |||||
10 | Ротавирус группы А Group A rotavirus | Антиген Antigen | 3/21 | 14,3 | 3 – 36 |
11 | Аденовирусы групп A–F Group A–F adenovirus | ДНК DNA | 31/33 | 94 | 79 – 99 |
Примечание. * – использовалась тест-система для выявления суммарных антител к ВГС.
Note. * – a test system was used to detect total antibodies to HCV.
Геморрагические лихорадки
С учетом того, что вирусные геморрагические лихорадки Марбург и Эбола эндемичны для африканского континента и представляют серьезную опасность для человека, а вирус ЛХМ, несмотря на бессимптомное носительство у своих естественных хозяев ‒ грызунов, также может вызывать тяжелую вирусную геморрагическую лихорадку у обезьян и человека, импортированные животные были исследованы на наличие этих возбудителей. При исследовании образцов сыворотки крови с помощью ПЦР генетический материал этих возбудителей обнаружен не был.
Вирусные гепатиты
Несмотря на то что гепатит С является антропонозом, антитела к структурному (core) и неструктурным (NS3, NS4, NS5) белкам ВГС, а также антитела к белку core класса IgM ранее были обнаружены у низших обезьян рода макак, что говорит о возможном инфицировании их этим вирусом либо вирусом, антигенно схожим с ВГС [22]. В связи с этим импортированные животные были нами протестированы на наличие анти-ВГС, однако положительных образцов выявлено не было.
Герпесвирусные инфекции
Среди герпесвирусных инфекций у обследованных нами зеленых мартышек анти-ВПГ-1,2-IgG и анти-ЦМВ-IgG были выявлены с одинаковой частотой – 15,9% (95% ДИ 7–30%). Следует отметить, что совпадение положительных результатов по обеим инфекциям наблюдалось только у одного животного. Также антитела класса IgG были обнаружены к ВЭБ у 14 (31,8%) из 44 зеленых мартышек (95% ДИ 19–48%), что в 2 раза больше, чем к двум предыдущим вирусам, однако разница была недостоверной (p > 0,05). Титр анти-ВПГ-1,2 в положительных сыворотках варьировал от 1 : 100 до 1 : 400, а средняя геометрическая величина титра составила 1 : 149. Концентрация анти-ЦМВ варьировала от 0,41 до 3,63 МЕ/мл, средняя геометрическая величина концентрации антител составила 0,91 МЕ/мл, а средняя ОП450 антител к ВЭБ – 0,953 (0,296–3,192 ОП450).
Респираторные вирусные инфекции
Среди респираторных вирусов в сыворотках обезьян были выявлены антитела только к PI-1 – 6,8% (95% ДИ 1–19%; n = 44), а анти-PI-3 среди исследуемых животных обнаружены не были.
Кишечные вирусные инфекции
Среди кишечных вирусных инфекций у зеленых мартышек мы исследовали наличие антигена ротавирусов группы А и ДНК кишечных аденовирусов. Антиген ротавируса был обнаружен у 14,3% (95% ДИ 3–36%; n = 21) животных, тогда как ДНК аденовируса была выявлена у 94% (ДИ 79–99%; n = 33).
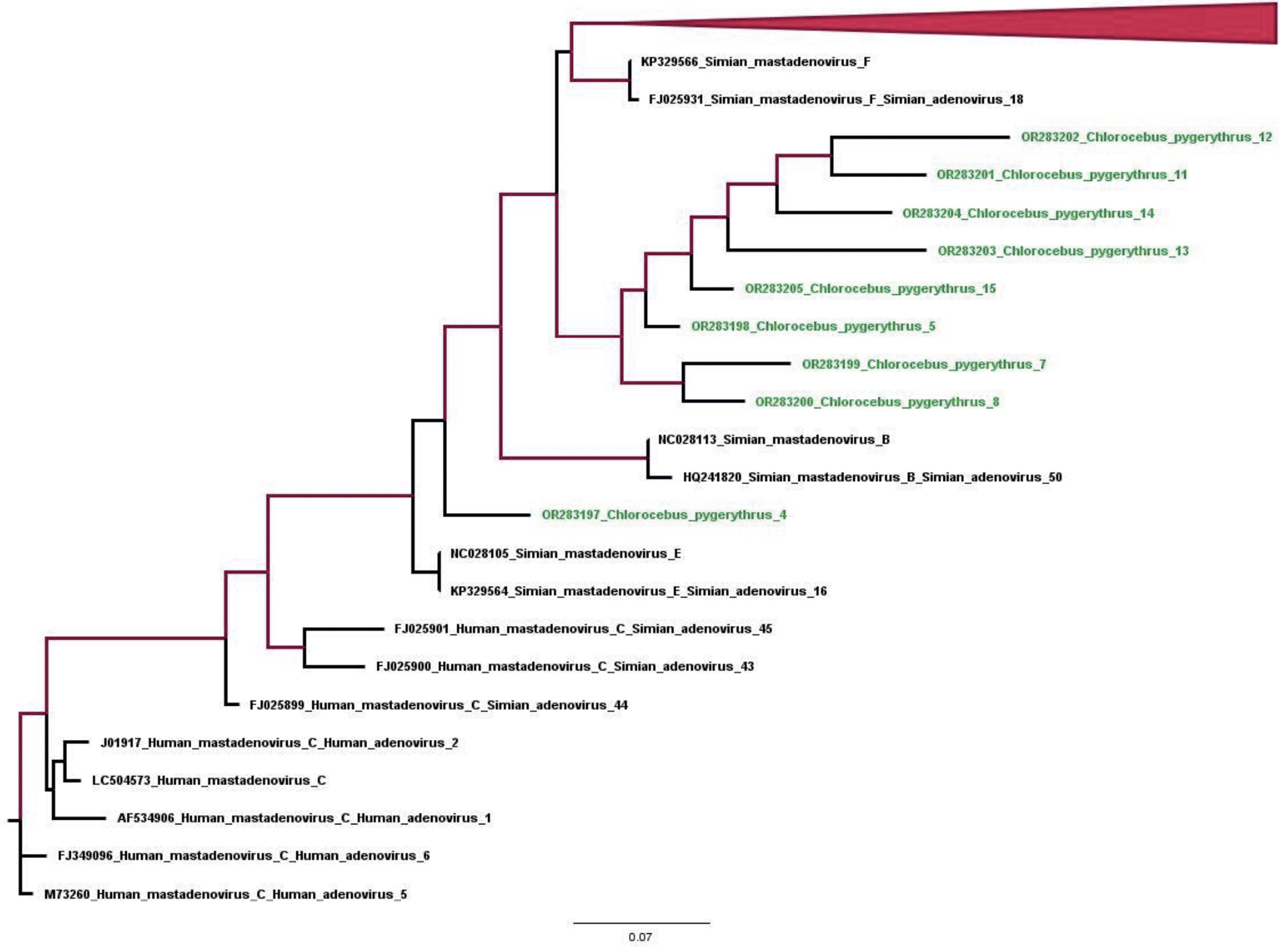
Специфичность детекции аденовирусной ДНК, выявленной с помощью праймеров к гексону аденовируса, была подтверждена секвенированием амплифицированных фрагментов величиной 300 нуклеотидов. Поиск BLAST в базе данных NSBI подтвердил принадлежность амплифицированных последовательностей к участку гексона генома аденовируса (позиции генома 17 124–17 424, нумерация по штамму KP329566 Simian mastadenovirus F). Выделенные последовательности были зарегистрированы в базе данных GenBank (OR283197–283205), филогенетический анализ позволил подтвердить принадлежность исследуемых образцов к роду Simian mastadenovirus (семейству Adenoviridae), но определить вид оказалось невозможно. В дальнейшем для более точной идентификации вируса будет использован набор праймеров, который позволит получить нуклеотидную последовательность всего гексона целиком. Следует отметить, что у животных с выявленной аденовирусной инфекцией не наблюдалось клинических признаков кишечной инфекции.
Обсуждение
Результаты сравнительного анализа средних значений оптической плотности в ИФА для реактивных и нереактивных образцов с использованием вторичных антител к иммуноглобулинам обезьян и конъюгатов из тест-систем, представляющих собой вторичные антитела к иммуноглобулинам человека, продемонстрировали их взаимозаменяемость и возможность применения конъюгата из тест-систем для скрининга сывороток обезьян на антитела к герпесвирусам и вирусу PI-1. Поэтому дальнейшее тестирование в рамках данного исследования проводилось с применением конъюгатов из соответствующих тест-систем по протоколам их производителя.
Среди обследованных животных были обнаружены маркеры 6 из 11 исследованных вирусов (ВПГ, ЦМВ, ВЭБ, вирус PI-1, кишечный аденовирус, ротавирус).
Рисунок. Филогенетическое дерево для нуклеотидных последовательностей участка генома аденовируса, кодирующего белок hexon величиной 281 нт (позиции генома 17 122–17 403, нумерация по штамму KP329566. Simian mastadenovirus F). Дерево построено методом максимального правдоподобия. Красным цветом выделены ветви с достоверностью более 90%.
Figure. Phylogenetic tree for the nucleotide sequences of the adenovirus genome region encoding the 281 nt hexon protein (genome positions 17 122–17 403 , numbering according to strain KP329566. Simian mastadenovirus F). The tree was built using the maximum likelihood method. Branches with > 90% confidence are highlighted in red.
Кишечные инфекции являются одной из основных причин заболеваемости и смертности людей и животных, в том числе и обезьян. И хотя диагностика желудочно-кишечных бактериальных и паразитарных патогенов и их этиологическая роль хорошо изучены, на сегодняшний день мало что известно об эпидемиологии, распространении и роли вирусных агентов в диарейных заболеваниях среди обезьян [13].
Филогенетический анализ последовательностей выделенного нами аденовируса рода Simian mastadenovirus, по-видимому, свидетельствует о циркуляции этой инфекции, не являющейся антропонозной, в естественной среде обитания животных. Как видно на рисунке, все последовательности значительно отличаются друг от друга, что свидетельствует о циркуляции данного аденовируса у зеленых мартышек в местах естественного обитания, а не заражении от единого источника на карантине после отлова или во время транспортировки. Следует также отметить, что высокая степень бессимптомного выявления аденовирусной инфекции у обезьян и доказательства зоонозной передачи требуют осторожности при обращении с приматами и их содержании [23, 24]. Кроме того, вакцинные векторы, полученные из аденовирусов обезьян, представляют собой альтернативу вакцинным векторам аденовируса человека [25]. Выявление антигена ротавируса у 3 животных, учитывая имеющиеся данные литературы [26, 27], свидетельствует о циркуляции ротавирусов группы А у обезьян в местах их отлова, так как заражение этим вирусом на карантине или во время транспортировки повлекло бы за собой вспышку среди большого числа животных, учитывая путь передачи инфекции, как это было описано ранее при вспышке ВГА у этих животных [6].
Вирусы герпеса обезьян эволюционно тесно связаны с герпесвирусами человека. ВПГ человека 1-го и 2-го типов эволюционно связаны с вирусом герпеса В макак (Cercopithecine herpesvirus 1), а также герпесом 2 зеленых мартышек (Cercopithecine herpesvirus 2); ЦМВ человека – с ЦМВ макак резусов (Cercopithecine herpesvirus 8); ВЭБ человека – с ВЭБ-подобным вирусом макак резусов (Cercopithecine herpesvirus 15) [28]. Некоторые из этих вирусов обезьян представляют опасность для человека. Среди них особо следует отметить герпесвирус 2 зеленых мартышек, называемый также SA-8 (Simian agent 8), первоначально выделенный от мартышек этого вида и тесно связанный с вирусом герпеса В макак, заражение которым также описано у человека, в том числе и с проявлением клинических симптомов [8].
Выявление антител к герпесвирусам класса IgG у обезьян на 23-й день после поступления, учитывая минимальный контакт животных с людьми при нахождении в карантинном изоляторе, позволяет предполагать заражение обезьяньими герпесвирусами в естественной среде обитания. Это также подтверждается и данными литературы, в которых описана циркуляция герпесвирусов у обезьян разных видов в местах их естественного обитания [8, 28]. Кроме того, средние титры и значения ОП450 в реактивных по антителам к герпесвирусам сыворотках обезьян были на порядок меньше, чем средние значения оптической плотности, наблюдаемые в реактивных по антителам к этим вирусам сыворотках людей [29, 30]. Учитывая сопоставимую эффективность детекции иммуноглобулинов обезьян с помощью человеческого и обезьяньего конъюгатов, такие различия в значениях оптической плотности могут объясняться возможным антигенным перекрестом герпесвирусов обезьян с герпесвирусами человека при постановках ИФА, что также описано в литературе [8]. Таким образом, результаты выявления антител к герпесвирусам в сыворотках обезьян могут, по-видимому, трактоваться как выявление антител к обезьяньим гомологам герпесвирусов человека.
В связи с тем, что в питомнике ФГБНУ «НИИ Медицинской приматологии» у обезьян, рожденных после 1992 г., отсутствуют антитела к вирусу кори и существует возможность заноса инфекции с импортированными животными, необходим контроль за содержанием обезьян в карантине с соблюдением его сроков как в странах экспорта, так и в странах импорта. Кроме того, необходимо проведение тестирования импортированных обезьян на наличие антител к вирусу кори класса M, свидетельствующих о недавнем инфицировании. Немаловажное значение также имеет скрининг маркеров PI-3, который причастен к патологии респираторного тракта у павианов [10, 31, 32], в отличие от PI-1, данных о причастности которого к патологии респираторного тракта обезьян в литературе мы не нашли. Тем не менее выявление анамнестических антител к данному вирусу у 3 животных, скорее всего, свидетельствует о его циркуляции среди обезьян в местах их отлова, так как заражение этим вирусом на карантине, так же как и в случае с кишечными вирусами, повлекло бы за собой вспышку среди большего числа животных.
Заключение
Полученные результаты указывают на необходимость периодического скрининга обезьян, содержащихся в приматологических центрах, на маркеры антропонозных и зоонозных инфекций, а также других эффективных мер по предотвращению потенциальной циркуляции и межвидовой передачи вирусов. Кроме того, выявление новых вирусов обезьян позволит разработать лучшую диагностику вирусных агентов, а также определить, какие из них связаны с патологией у обезьян.
На сегодняшний день во многих приматологических центрах мира при карантине импортированных животных тестируют, как правило, на туберкулез и латентные вирусные инфекции обезьян, которые необходимы для подтверждения SPF-статуса. Полученные нами результаты свидетельствую, что в современных условиях необходима система расширенного скрининга вирусных инфекций с учетом эпидобстановки как в стране импорта, так и в стране экспорта.
Кроме того, необходима вакцинация сотрудников и обслуживающего персонала для обеспечения протективного иммунитета, а также для снижения вероятности передачи социально значимых инфекций обезьянам от человека и наоборот.
Об авторах
Дмитрий Игоревич Догадов
ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
Автор, ответственный за переписку.
Email: dima_loko86@mail.ru
ORCID iD: 0000-0003-1596-0509
кандидат биол. наук, ведущий научный сотрудник лаборатории инфекционных вирусов
Россия, 354376, СочиКарен Каренович Кюрегян
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: karen-kyuregyan@yandex.ru
ORCID iD: 0000-0002-3599-117X
доктор биол. наук, профессор РАН, заведующий лабораторией молекулярной эпидемиологии вирусных гепатитов, ведущий научный сотрудник лаборатории вирусных гепатитов
Россия, 111123, Москва; 105064, МоскваАлександра Михайловна Гончаренко
ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
Email: morgan_123@rambler.ru
ORCID iD: 0000-0002-6979-9784
научный сотрудник лаборатории инфекционных вирусов
Россия, 354376, СочиАлберт Артурович Миносян
ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
Email: malbert97@bk.ru
ORCID iD: 0009-0007-6459-1451
лаборант-исследователь лаборатории инфекционных вирусов
Россия, 354376, СочиАрмен Арменакович Кочконян
ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
Email: kochkonyan7armen@gmail.com
ORCID iD: 0009-0003-1648-541X
лаборант-исследователь лаборатории инфекционных вирусов
Россия, 354376, СочиАнастасия Андреевна Карлсен
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: karlsen12@gmail.com
ORCID iD: 0000-0002-6013-7768
научный сотрудник лаборатории молекулярной эпидемиологии вирусных гепатитов, научный сотрудник лаборатории вирусных гепатитов
Россия, 111123, Москва; 105064, МоскваОлег Иванович Вышемирский
ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
Email: olegvyshem@mail.ru
ORCID iD: 0000-0002-5345-8926
кандидат биол. наук, ведущий научный сотрудник лаборатории инфекционных вирусов
Россия, 354376, СочиДжина Джинаровна Карал-оглы
ФГБНУ «Научно-исследовательский институт медицинской приматологии» Минобрнауки России
Email: karal_5@mail.ru
ORCID iD: 0000-0003-3606-1668
кандидат биол. наук, заместитель директора по научной деятельности
Россия, 354376, СочиМихаил Михайлович Михайлов
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова»
Email: michmich2@yandex.ru
ORCID iD: 0000-0002-6636-6801
доктор медицинских наук, профессор, член-корр. РАН, главный научный сотрудник лаборатории молекулярной эпидемиологии вирусных гепатитов, заведующий лабораторией вирусных гепатитов
Россия, 111123, Москва; 105064, МоскваСписок литературы
- Wachtman L., Mansfield K. Viral diseases of nonhuman primates. In: Nonhuman Primates in Biomedical Research. Volume 2: Diseases. Elsevier; 2012: 1–104. https://doi.org/10.1016/B978-0-12-381366-4.00001-8
- Olival K.J., Hosseini P.R., Zambrana-Torrelio C., Ross N., Bogich T.L., Daszak P. Host and viral traits predict zoonotic spillover from mammals. Nature. 2017; 546(7660): 646–50. https://doi.org/10.1038/nature22975
- Devaux C.A., Mediannikov O., Medkour H., Raoult D. Infectious disease risk across the growing human-non human primate interface: A review of the evidence. Front. Public Health. 2019; 7: 305. https://doi.org/10.3389/fpubh.2019.00305
- Patrono L.V., Samuni L., Corman V.M., Nourifar L., Röthemeier C., Wittig R.M., et al. Human coronavirus OC43 outbreak in wild chimpanzees, Côte d´Ivoire, 2016. Emerg. Microbes Infect. 2018; 7(1): 118. https://doi.org/10.1038/s41426-018-0121-2
- Liu Z.J., Qian X.K., Hong M.H., Zhang J.L., Li D.Y., Wang T.H., et al. Global view on virus infection in non-human primates and implications for public health and wildlife conservation. Zool. Res. 2021; 42(5): 626–32. https://doi.org/10.24272/j.issn.2095-8137.2021.080
- Dogadov D.I., Korzaya L.I., Karlsen A.A., Kyuregyan K.K. Molecular genetic identification of isolates of the hepatitis A virus (HAV) from monkeys at Adler Primate Center. J. Med. Primatol. 2018; 47(2): 87–92. https://doi.org/10.1111/jmp.12333
- Dogadov D.I., Korzaya L.I., Kyuregyan K.K., Karlsen A.A., Kichatova V.S., Potemkin I.A., et al. Natural infection of captive cynomolgus monkeys (Macaca fascicularis) with hepatitis E virus genotype 4. Arch. Virol. 2019; 164(10): 2515–8. https://doi.org/10.1007/s00705-019-04337-3
- Eberle R., Jones-Engel L. Understanding primate herpesviruses. J. Emerg. Dis. Virol. 2017; 3(1): 1–11. https://doi.org/10.16966/2473-1846.127
- Корзая Л.И., Догадов Д.И., Гончаренко А.М., Лапин Б.А. Сравнительное изучение противокоревого иммунитета у взрослого населения города Сочи и обезьян Адлерского приматологического центра. Журнал микробиологии, эпидемиологии и иммунобиологии. 2019; 96(2): 61–7. https://doi.org/10.36233/0372-9311-2019-2-61-67 https://elibrary.ru/azxijw
- Корзая Л.И., Догадов Д.И., Гончаренко А.М., Карлсен A.A., Кюрегян K.K., Михайлов М.И. Распространение маркёров респираторных вирусов человека среди обезьян адлерского приматологического центра. Вопросы вирусологии. 2022; 66(6): 425–33. https://doi.org/10.36233/0507-4088-77 https://elibrary.ru/cbntjh
- Molina C.V., Heinemann M.B., Kierulff C., Pissinattiet A., da Silva T.F., de Freitas D.G., et al. Leptospira spp., rotavirus, norovirus, and hepatitis E virus surveillance in a wild invasive golden-headed lion tamarin (Leontopithecus chrysomelas; Kuhl, 1820) population from an urban park in Niterói, Rio de Janeiro, Brazil. Am. J. Primatol. 2019; 81(3): e22961. https://doi.org/10.1002/ajp.22961
- Smith G.C., Lester T.L., Heberling R.L., Kalter S.S. Coronavirus-like particles in nonhuman primate feces. Arch. Virol. 1982; 72(1-2): 105–11. https://doi.org/10.1007/BF01314455
- Wang Y., Tu X., Humphrey C., McClureet H., Jiang X., Qin C., et al. Detection of viral agents in fecal specimens of monkeys with diarrhea. J. Med. Primatol. 2007; 36(2): 101–7. https://doi.org/10.1111/j.1600-0684.2006.00167.x
- Gómez J.M., Nunn C.L., Verdú M. Centrality in primate-parasite networks reveals the potential for the transmission of emerging infectious diseases to humans. Proc. Natl Acad. Sci. USA. 2013; 110(19): 7738–41. https://doi.org/10.1073/pnas.1220716110
- Wolfe N.D., Dunavan C.P., Diamond J. Origins of major human infectious diseases. Nature. 2007; 447(7142): 279–83. https://doi.org/10.1038/nature05775
- Albrecht P., Lorenz D., Klutch M.J., Vickers J.H., Ennis F.A. Fatal measles infection in marmosets pathogenesis and prophylaxis. Infect. Immun. 1980; 27(3): 969–78. https://doi.org/10.1128/iai.27.3.969-978.1980
- Choi Y.K., Simon M.A., Kim D.Y., Yoon B.I., Kwon S.W., Lee K.W., et al. Fatal measles virus infection in Japanese macaques (Macaca fuscata). Vet. Pathol. 1999; 36(6): 594–600. https://doi.org/10.1354/vp.36-6-594
- Wallis J., Lee D.R. Primate conservation: The prevention of disease transmission. Int. J. Primatol. 1999; 20(6): 803–26. https://doi.org/10.1023/A:1020879700286
- Lapin B.A., Shevtsova Z.V. Monkey viral pathology in the Sukhum colony and modeling human viral infections. J. Med. Primatol. 2018; 47(4): 273–7. https://doi.org/10.1111/jmp.12351
- Догадов Д.И., Корзая Л.И., Кюрегян K.K., Карлсен A.A., Михайлов М.И. Маркёры вирусного гепатита Е (Hepeviridae, Orthohepevirus, Orthohepevirus A) у импортированных низших обезьян Старого Света. Вопросы вирусологии. 2021; 66(3): 182–8. https://doi.org/10.36233/0507-4088-34 https://elibrary.ru/xvmkmz
- Bányai K., Esona M.D., Liu A., Wang Y., Tu X., Jiang B. Molecular detection of novel adenoviruses in fecal specimens of captive monkeys with diarrhea in China. Vet. Microbiol. 2010; 142(3-4): 416–9. https://doi.org/10.1016/j.vetmic.2009.10.014
- Корзая Л.И., Лапин Б.A., Кебурия В.В., Чикобава М.Г. Естественное инфицирование низших приматов вирусом гепатита С. Бюллетень экспериментальной биологии и медицины. 2002; 133(2): 178–81. https://doi.org/10.1023/A:1015511208671 https://elibrary.ru/lhjutx
- Kosoltanapiwat N., Tongshoob J., Ampawong S., Reamtong O., Prasittichai L., Yindee M., et al. Simian adenoviruses: Molecular and serological survey in monkeys and humans in Thailand. One Health. 2022; 15: 100434. https://doi.org/10.1016/j.onehlt.2022.100434
- Roy S., Vandenberghe L.H., Kryazhimskiy S., Grant R., Calcedo R., Yuan X., et al. Isolation and characterization of adenoviruses persistently shed from the gastrointestinal tract of non-human primates. PLoS Pathog. 2009; 5(7): e1000503. https://doi.org/10.1371/journal.ppat.1000503
- Morris S.J., Sebastian S., Spencer A.J., Gilbert S.C. Simian adenoviruses as vaccine vectors. Future Virol. 2016; 11(9): 649–59. https://doi.org/10.2217/fvl-2016-0070
- Islam A., Hossain M.E., Haider N., Rostal M.K., Mukharjee S.K., Ferdouset J., et al. Molecular characterization of group A rotavirus from rhesus macaques (Macaca mulatta) at human–wildlife interfaces in Bangladesh. Transbound. Emerg. Dis. 2020; 67(2): 956–66. https://doi.org/10.1111/tbed.13431
- Otsyula M., Yee J., Suleman M., Tarara R., Martin J., Woods P., et al. Rotavirus infection in African, non-human primates. Ann. Trop. Med. Parasitol. 1996; 90(6): 659–61. https://doi.org/10.1080/00034983.1996.11813099
- Simmons J.H. Herpesvirus infections of laboratory macaques. J. Immunotoxicol. 2010; 7(2): 102–13. https://doi.org/10.3109/15476910903409843
- Голева О.В., Мурина Е.А., Осипова З.А. Серологические маркеры реактивации вируса Эпштейна-Барр у детей с вирусными энцефалитами. Журнал инфектологии. 2015; 7(1): 70–4. https://elibrary.ru/tqqpvh
- Махнева Н.В., Сюч Н.И., Воронова В.В., Белецкая Л.В. Вирус Эпштейна-Барр и цитомегаловирус при аутоиммунной пузырчатке: действительно ли их роль случайна? Предварительное сообщение. Альманах клинической медицины. 2016; 44(1): 13–7. https://doi.org/10.18786/2072-0505-2016-44-1-13-17 https://elibrary.ru/vrraaj
- Churchill A.E. The isolation of parainfluenza 3 virus from fatal cases of pneumonia in erythrocebus patas monkeys. Br. J. Exp. Pathol. 1963; 44(5): 529–37.
- Sasaki M., Ishii A., Orba Y., Thomas Y., Hang’ombe B.M., Moonga L., et al. Human parainfluenza virus type 3 in wild nonhuman primates, Zambia. Emerg. Infect. Dis. 2013; 19(9): 1500–3. https://doi.org/10.3201/eid1909.121404
Дополнительные файлы