Распределение частот аллелей полиморфизмов генов человека, связанных с вирусными инфекциями
- Авторы: Власенко Н.В.1, Чанышев М.Д.2, Дубоделов Д.В.1, Серков А.А.1, Солопова Г.Г.3, Сацук А.В.3, Сницарь А.В.4, Семененко Т.А.5, Кузин С.Н.1, Акимкин В.Г.1
-
Учреждения:
- ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
- ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора
- ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России
- ГБУЗ «Городская клиническая больница имени В.П. Демихова Департамента здравоохранения города Москвы»
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи» Минздрава России
- Выпуск: Том 68, № 5 (2023)
- Страницы: 404-414
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/14732
- DOI: https://doi.org/10.36233/0507-4088-189
- EDN: https://elibrary.ru/bguoyy
- ID: 14732
Цитировать
Аннотация
Введение. Дизайн исследований, направленных на оценку связи какого-либо генетического фактора с изучаемым признаком (болезнью), в обязательном порядке предполагает сравнение соотношения генотипов или аллельной пропорции в исследуемой группе с данными контрольной группы. При проведении этапа определения соотношения генотипов изучаемых полиморфизмов группы сравнения появляется ряд проблем, которым посвящена настоящая работа.
Цель работы ‒ научное обоснование целесообразности формирования отечественной информационной системы, включающей генетические данные условно здорового населения Российской Федерации с учетом его этнического многообразия.
Материалы и методы. Исследуемая группа, составляющая суммарно 1020 человек, генотипирована по ряду однонуклеотидных полиморфизмов (ОНП) генов человека. Проведена сравнительная характеристика распределения частот исследуемых полиморфизмов с представленными в международных базах в качестве референсных данными. Статистическую обработку выполняли с использованием стандартной четырехпольной таблицы и расчетом показателя χ2.
Результаты. Установлены полиморфизмы генов человека, для которых разница распределения аллелей между условно здоровой популяцией Московского региона и когортой, представленной в международном проекте Ensembl, является статистически значимой (p < 0,05). Частоты встречаемости ОНП rs4986790 гена TLR4 статистически значимо отличаются от аналогичных показателей исследуемой группы как для популяции EUR (p = 0,032), так и для субпопуляции CEU (p = 0,047). Частоты аллелей полиморфизмов rs1800795 (IL6) и rs1800896 (IL10) для здоровой популяции Московского региона отличны от подгруппы CEU (p = 0,030 и 0,012 соответственно). Частота ОНП rs2295119 (HLA-DPA2) статистически значимо отличается от популяции EUR (p = 0,034).
Заключение. Проведенный в работе анализ по сравнению распределения частот ОНП для условно здорового населения с аналогичными показателями, представленными в базах данных международного проекта Ensembl, подтверждает необходимость формирования отечественной информационной системы, содержащей как данные о встречаемости аллелей и генотипов ОНП среди условно здорового населения, так и в подгруппах с различными патологическими состояниями.
Ключевые слова
Полный текст
Введение
Особенностями современного мира являются свобода перемещения людей и усиливающееся смешивание популяций, что, по мнению специалистов, ведет к уменьшению генетического разнообразия в масштабах человеческой популяции. Так, L.C. Dunn и соавт. [1] высказали мнение, что сохранение современных тенденций в течение 2000 лет (примерно 75 поколений) может привести к формированию генетически единого населения Земли. Вместе с тем в настоящее время отмечается столь значительное генетическое разнообразие населения мира, что при проведении эпидемиологических исследований необходимо учитывать расовую, этническую и даже субэтническую принадлежность изучаемой популяции. На сегодняшний день исследование как исторически-эволюционных, так и современных аспектов развития человека, его взаимодействия с природной средой является одним из приоритетов мировой науки. Важным направлением является поиск генетических детерминант, значимых в отношении определения особенностей персонифицированного подхода при оказании медицинской помощи пациентам с различными патологиями, особенно аутоиммунной и инфекционной природы. Полиэтиологичность многих заболеваний человека, сложность патогенетических механизмов и множественность вариантов течения (от острых форм с реконвалесценцией и бессимптомного течения до фульминантной формы, а также тяжелых хронических форм со злокачественным течением и др.), непредсказуемость исходов, различная восприимчивость к возбудителям инфекционных заболеваний привели к формированию точки зрения о влиянии генетических факторов человека на формирование патологических процессов.
Так, в Постановлении Правительства РФ от 01.12.2004 № 715 «Об утверждении перечня социально значимых заболеваний и перечня заболеваний, представляющих опасность для окружающих» выделены значимые заболевания вирусной этиологии: туберкулез, вирусные гепатиты B и C, ВИЧ и инфекции, передаваемые половым путем. В отношении течения и исходов заболеваний, обусловленных данными инфекционными агентами, проводятся исследования по выявлению специфических молекулярно-генетических маркеров, которые характеризуются универсальностью в отношении как заболеваний аутоиммунной, так и инфекционной природы, что в значимой мере отражает актуальность подобного рода исследований.
Дизайн исследований, направленных на оценку связи какого-либо генетического фактора с изучаемым признаком (болезнью), в обязательном порядке предполагает сравнение соотношения генотипов или аллельной пропорции в исследуемой группе с данными контрольной группы. Главным требованием к контрольной группе является ее полное соответствие этнической структуре населения на территории выполнения работы. Как правило, контрольная группа формируется из лиц, представляющих индикаторные группы условно здорового населения (доноры крови и др.) с отсутствием изучаемого признака (болезни). Для оценки релевантности отобранной группы необходимо проведение первичной оценки распределения частот аллелей и генотипов среди условно здорового населения в сравнении с уже имеющимися данными, принятыми в качестве эталона.
В Российской Федерации, в соответствии со статистическими данными, по состоянию на 2022 г. проживает 146,9 млн человек. Население характеризуется чрезвычайным этническим разнообразием, представленным 180 народностями, проживающими на территории страны. С учетом столь высокого историко-географического, а также социокультурного разнообразия населения невозможно представить единообразие распределения генотипов среди всего населения, что подтверждается множеством работ по этногенетике, одним из родоначальников которой является отечественный исследователь Ю.Г. Рычков. В изданной под его редакцией монографии «Генофонд населения России и сопредельных стран» уделено пристальное внимание ряду белковых систем организма человека, их полиморфизму и на данном примере констатировано наличие существенных различий в соотношении выявляемых частот генотипов среди населения разных регионов РФ [2].
Ввиду существенного этнического разнообразия нашей страны, исследователи при проведении этапа определения соотношения генотипов изучаемых полиморфизмов группы сравнения сталкиваются с проблемами, актуализирующими вопрос формирования информационной системы на территории Российской Федерации, включающей данные о распределении частот полиморфизмов генов человека в разных регионах страны.
Цель работы – научное обоснование целесообразности формирования отечественной информационной системы, включающей генетические данные условно здорового населения РФ с учетом его этнического многообразия.
Материалы и методы
Исследование выполнено в лаборатории вирусных гепатитов Центрального НИИ Эпидемиологии Роспотребнадзора. С целью формирования представления о распределении частот аллелей ряда однонуклеотидных полиморфизмов (ОНП) была сформирована группа исследования, состоящая из условно здорового населения г. Москвы. Критериями отбора являлись: возраст старше 18 лет, отсутствие инфекционных заболеваний. В группу исследования были включены медицинские работники ФГАУ «Национальный медицинский исследовательский центр «Лечебно-реабилитационный центр» Минздрава России (n = 283), доноры крови НМИЦ ДГОИ имени Дмитрия Рогачева (n = 427), медицинские работники ГБУЗ ГКБ имени В.П. Демихова (n = 310). С учетом того, что численность выборки повышает ее количественную репрезентативность, общее число участников составило 1020 человек [3]. Группа исследования была сформирована из медицинских работников и доноров крови Москвы с абсолютным преобладанием славянского населения. Существующие миграционные потоки касаются в основном других сфер, таких как строительство, коммунальное хозяйство и др. Однако в области медицины мигранты практически не представлены, ввиду чего отклонение выборки по этническому составу было минимально и не оказывало значимого влияния на получаемые результаты. От всех участников получено добровольное информированное согласие на участие в исследовании. Исследование одобрено Локальным этическим комитетом ЦНИИЭ Роспотребнадзора (Протокол № 114 от 22.04.2021). Все образцы были протестированы при помощи иммуноферментного анализа на отсутствие маркеров инфекционных заболеваний, включающих социально значимые заболевания – вирусные гепатиты B, C, а также гепатиты А, Е, корь, полиомиелит и ветряную оспу. ДНК выделяли из периферической крови при помощи регента «Гемолитик» и набора реагентов «Рибо-ПРЕП» («АмплиСенс», Россия). Для исследования был отобран следующий ряд ОНП генов: TLR4 (rs4986790), MERTK (rs4374383), IL1B (rs1143634, rs1143627), IL1RN (rs4251961, rs419598), IFNL4 (rs12979860, rs8099917), IL6 (rs1800795), IL10 (rs1800896), SERPINA1 (rs28929474), HLADPA2 (rs2295119), TULP1 (rs9380516). Представленные гены кодируют интерлейкины (IL), вовлекаемые в каскады биохимических реакций воспалительного процесса, возникающего при различных патологических состояниях, а также ряд полиморфизмов, активно исследуемых в отношении как заболеваний инфекционной этиологии, так и аутоиммунной природы. Группа исследуемых полиморфизмов взята из проводимых нами ранее исследований по выявлению специфических маркеров, ассоциированных с вирусными гепатитами B и C. Методика определения полиморфизмов основана на детекции аллелей ОНП с использованием конформационно блокированных (LNA) аллель-специфичных зондов, детектируемых по двум или четырем каналам флуоресцентной детекции аналогично методике, использованной в ранее проведенной работе [4]. Верификацию полученных результатов проводили при помощи секвенирования по Сэнгеру. Сравнительную характеристику полученного распределения частот аллелей исследуемых ОНП выполняли с использованием баз данных международного проекта Ensembl [5] и интегрированных в него результатов «1000 Genomes Project». Производили сравнение с данными распределения частот аллельных вариантов для субпопуляций CEU (Utah Residents with Northern and Western European Ancestry), FIN (Finnish in Finland) и популяции EUR (European). Статистическую обработку данных осуществляли с использованием стандартной четырехпольной таблицы и расчетом показателя χ2.
Результаты
Сравнительный анализ распределения частот аллелей ОНП, полученного для изучаемой группы условно здорового населения, и данных, представленных в интернет-ресурсе Ensembl, показал следующие результаты: ОНП rs4374383 (MERTK), rs1143627 (IL1B), rs8099917 и rs12979860 (IL-28), rs28929474 (SERPINA1) не имели достоверно значимых отличий со сравниваемыми группами. Наиболее близкое распределение частот аллелей изучаемых полиморфизмов было зарегистрировано в отношении обобщенной популяции EUR. ОНП rs1143634 (IL1B), rs1800795 (IL6), rs1800896 (IL10), rs4251961(IL-1RN) обладали более высоким сходством с субпопуляцией FIN, в свою очередь частоты полиморфизмов rs419598 (IL1RN), rs9380516 (TULP1) и rs2295119 (HLA-DPA2) наибольшим образом совпадали с частотами аллелей, характерных для подгруппы CEU. При этом следует отметить критические точки, для которых критерий достоверности различий между группами оказались статистически значимы (p < 0,05). Так, частоты встречаемости аллелей ОНП rs4986790 гена TLR4 статистически значимо отличались от данных как для группирующей популяции EUR (p = 0,032), так и для субпопуляции CEU (p = 0,047). Полиморфизмы rs1800795 (IL6) и rs1800896 (IL10) также статистически значимо различались в отношении подгруппы CEU (p = 0,030 и 0,012 соответственно). Также следует отметить, что полиморфизм rs2295119 (HLADPA2) имел статистически значимое частотное расхождение с обобщающей популяцией EUR и оказался близок к появлению такового в отношении субпопуляции FIN. Обобщающие данные представлены в таблице.
Таблица. Сравнительная характеристика распределения частот аллелей полиморфизмов населения Московского региона с населением Европы
Table. Comparative characteristics of the distribution of polymorphism allele frequencies in the population of the Moscow region with the population of Europe
Индивидуальный номер ОНП (rs), ген SNP (rs) ID, gene | Аллель Allele | Условно здоровое население Conditionally healthy population | 1000 GENOMES (EUR) | 1000 GENOMES (CEU) | 1000 GENOMES (FIN) | |||||||
n, абс. n, abs. | частота аллеля allele frequency | n, абс. n, abs. | частота аллеля allele frequency | p | n, абс. n, abs. | частота аллеля allele frequency | p | n, абс n, abs.. | частота аллеля allele frequency | p | ||
rs4986790 TLR4 | A | 871 | 0,92 | 949 | 0,943 | 0,032 | 190 | 0,96 | 0,047 | 175 | 0,884 | 0,114 |
G | 77 | 0,08 | 57 | 0,057 | 8 | 0,04 | 23 | 0,116 | ||||
rs4374383 MERTK | G | 1020 | 0,6 | 627 | 0,623 | 0,261 | 130 | 0,657 | 0,133 | 131 | 0,662 | 0,101 |
A | 676 | 0,4 | 379 | 0,377 | 68 | 0,343 | 67 | 0,338 | ||||
rs1143634 IL1B | G | 1550 | 0,76 | 757 | 0,752 | 0,594 | 152 | 0,768 | 0,841 | 151 | 0,763 | 0,967 |
A | 486 | 0,24 | 249 | 0,248 | 46 | 0,232 | 47 | 0,237 | ||||
rs1143627 IL-1B | A | 1321 | 0,65 | 652 | 0,648 | 0,942 | 128 | 0,646 | 0,622 | 123 | 0,621 | 0,428 |
G | 713 | 0,35 | 354 | 0,352 | 70 | 0,354 | 75 | 0,379 | ||||
rs4251961 IL1RN | T | 1356 | 0,67 | 639 | 0,635 | 0,086 | 123 | 0,621 | 0,197 | 140 | 0,707 | 0,249 |
C | 678 | 0,33 | 367 | 0,365 | 75 | 0,379 | 58 | 0,293 | ||||
rs419598 IL1RN | T | 1380 | 0,7 | 712 | 0,708 | 0,743 | 139 | 0,702 | 0,998 | 138 | 0,697 | 0,885 |
C | 586 | 0,3 | 294 | 0,292 | 59 | 0,298 | 60 | 0,303 | ||||
rs12979860 IFNL4 | C | 309 | 0,67 | 695 | 0,691 | 0,465 | 144 | 0,727 | 0,309 | 145 | 0,732 | 0,246 |
T | 151 | 0,33 | 311 | 0,309 | 54 | 0,273 | 53 | 0,268 | ||||
rs8099917 IFNL4 | T | 264 | 0,82 | 837 | 0,832 | 0,772 | 168 | 0,848 | 0,486 | 172 | 0,869 | 0,186 |
G | 56 | 0,18 | 169 | 0,168 | 30 | 0,152 | 26 | 0,131 | ||||
rs1800795 IL6 | G | 963 | 0,57 | 588 | 0,584 | 0,343 | 96 | 0,485 | 0,030 | 108 | 0,545 | 0,585 |
C | 739 | 0,43 | 418 | 0,416 | 102 | 0,515 | 90 | 0,455 | ||||
rs1800896 IL10 | T | 1166 | 0,57 | 550 | 0,547 | 0,175 | 95 | 0,48 | 0,012 | 119 | 0,601 | 0,442 |
C | 870 | 0,43 | 456 | 0,453 | 103 | 0,52 | 79 | 0,399 | ||||
rs28929474 SERPINA1 | C | 453 | 0,98 | 989 | 0,983 | 0,814 | 192 | 0,97 | 0,203 | 193 | 0,975 | 0,378 |
T | 7 | 0,02 | 17 | 0,017 | 6 | 0,03 | 5 | 0,025 | ||||
rs9380516 TULP1 | C | 1599 | 0,79 | 814 | 0,809 | 0,154 | 163 | 0,823 | 0,231 | 164 | 0,828 | 0,173 |
T | 433 | 0,21 | 192 | 0,191 | 35 | 0,177 | 34 | 0,172 | ||||
rs2295119 HLA-DPA2 | G | 684 | 0,85 | 888 | 0,883 | 0,034 | 175 | 0,884 | 0,207 | 178 | 0,899 | 0,069 |
T | 122 | 0,15 | 118 | 0,117 | 23 | 0,116 | 20 | 0,101 | ||||
Примечание. Жирным шрифтом выделены статистически значимые отличия в сравниваемых группах.
Note. Statistically significant differences are shown in bold
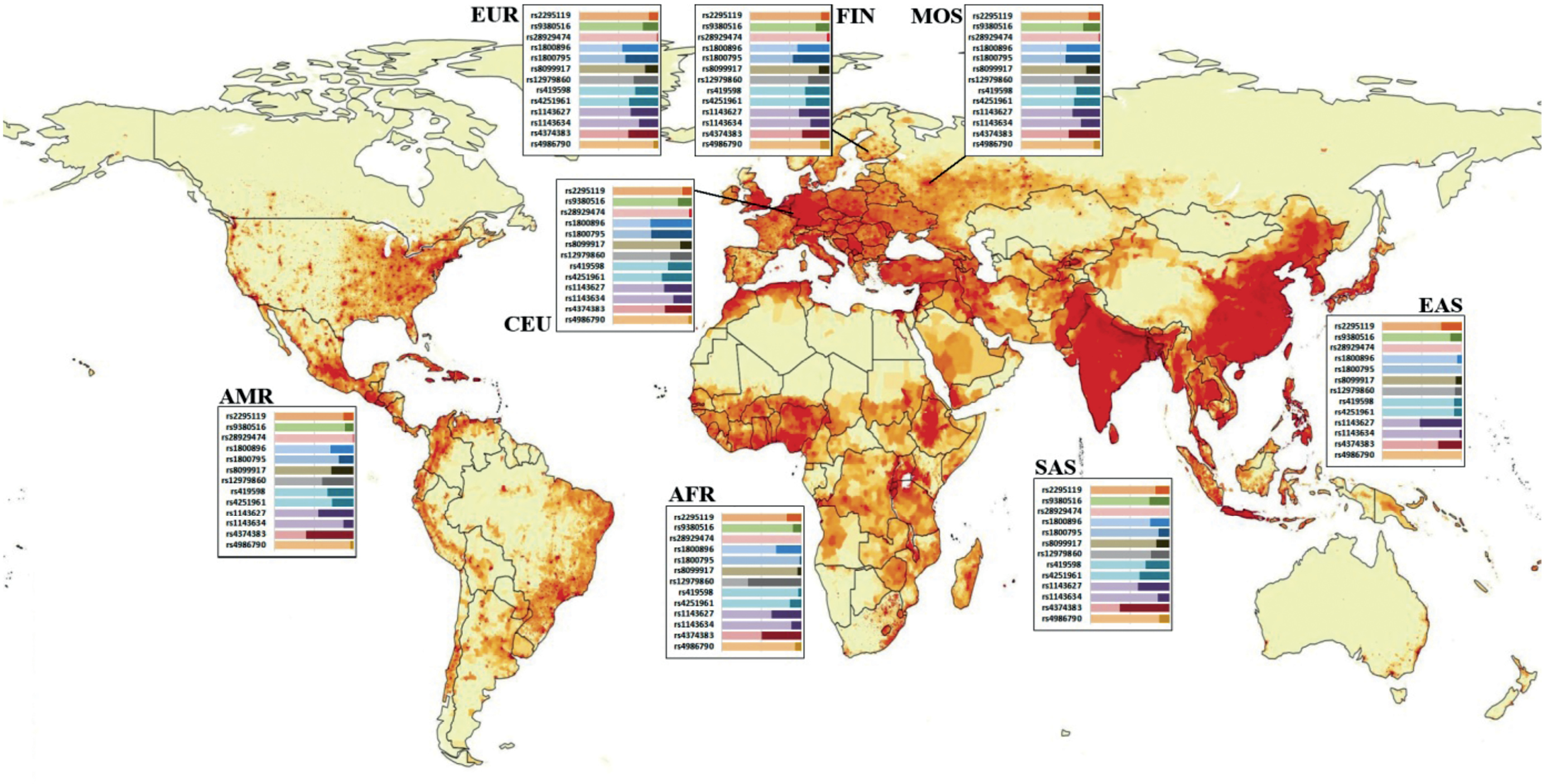
На рисунке показано распределение частот аллелей среди представителей 5 основных популяций мира, двух изучаемых в настоящей работе субпопуляций FIN и CEU, наиболее близких к населению европейской части РФ, и группы MOS, представляющей собственные данные, полученные для условно здорового населения Московского региона.
Рисунок. Соотношение частот аллелей ряда полиморфизмов среди основных популяций мира.
Данные представлены в международных базах данных ресурса Ensembl. MOS – собственные данные, полученные на территории Московского региона. Основа для изображения взята с ресурса https://worldinmaps.com/world/population-and-settlement/population-density/
Figure. The ratio of allele frequencies of a number of polymorphisms among the main populations of the world.
The data are presented in the Ensembl international database. MOS – own data obtained on the territory of the Moscow region. The basis for the image was taken from the resource worldinmaps.com
На рисунке видно, что каждый полиморфизм в той или иной степени имеет разное распределение аллельных вариантов среди основных популяций мира. Особый интерес вызывают статистически значимые различия с субпопуляциями. Альтернативная аллель полиморфизма rs2295119 (HLADPA2) (G/T) определяется в диапазоне от 12 до 26% среди популяций мира, что позволяет ученым в полной мере изучать роль этого генетического варианта в отношении разого рода патологических состояний. Частота встречаемости альтернативной аллели среди участников настоящего исследования для когорты MOS статистически значимо отличалась от аллельного распределения популяции EUR и близка к появлению статистически значимого различия в отношении субпопуляции FIN.
ОНП rs9380516 (TULP1) проявляли максимальную гетерогенность в популяции SAS (25%), однако этот полиморфизм являет собой пример достаточно высокой усредненности распределения частот аллелей. В популяциях AMR и AFR имело место минимальное значение частоты встречаемости альтернативной аллели, составляющее 11%.
ОНП rs1800795 (IL6) отличался широким диапазоном распространенности альтернативной аллели: от 0% в популяции EAS до 52% в популяции CEU. В данном случае необходимо заострить внимание на том, что в соответствии с базами данных по распределению частот, популяция EAS, включающая представителей таких государств, как Китай, Вьетнам и Япония, абсолютно гомогенна по референсному аллелю (G). Однако встречается довольно значительное число работ, посвященных выявлению ассоциативной связи этого полиморфизма с патологиями разной этиологии среди азиатов [6–8]. В научной литературе опубликованы несколько метаанализов, основанных на результатах исследований, в том числе из регионов, население которого не обладает гетерогенностью аллелей по полиморфизму rs1800795 согласно порталу Ensembl [9, 10].
Количественной характеристикой сцепленности наследуемых признаков является коэффициент детерминации R2, значение которого варьирует от 0 до 1. Сцепленность генетических полиморфизмов напрямую зависит от их взаимного расположения на хромосоме, а также ряда иных факторов. Выявление групп сцепления при выполнении исследований по проблеме определения ассоциации ОНП с характеристиками патологического процесса является необходимой составляющей. Вместе с тем в существующих международных базах зафиксированы значительные различия относительно одних и тех же ОНП. В настоящем исследовании использовали несколько пар полиморфизмов, относящихся к одному гену. Так, пара достаточно хорошо изученных полиморфизмов (rs8099917 и rs12979860), относящихся к гену, кодирующему интерферон-λ3 (IFN-λ3), по данным интернет-ресурса LD pair tool [11], основанного на международной базе данных dbSNP, имеет широкий разброс значений коэффициента корреляции R2 – от полного отсутствия взаимосвязи в популяции AFR (R2 = 0,02) до незначительной взаимосвязи аллелей в популяции EUR (R2 = 0,04) и почти 100%-ная корреляция в популяции EAS (R2 = 0,98).
Пара ОНП rs419598 и rs4251961 гена-антагониста рецептора IL-1 (IL1RN) наследуются независимо друг от друга во всех популяциях мира с наивысшими значениями: R2 = 0,24 в популяции SAS и R2 = 0,23 в популяции EUR. Распространенность альтернативной аллели ОНП rs4251961 значительно различается в популяциях. Так, минимальная встречаемость выявлена в популяции EAS и составляет 9%, напротив, в популяциях SAS и EUR наблюдается максимальная гетерогенность аллелей данных локусов со встречаемостью альтернативной аллели 38 и 36% соответственно. В отношении ОНП rs419598 диапазон встречаемости альтернативной аллели также широк и составляет от 3% в популяции AFR и до 33% – в AMR. В европейской популяции (EUR) альтернативная аллель наблюдается у 29% населения.
Полиморфизмы гена IL1B (rs1143627 и rs1143634) наследуются независимо друг от друга. Обобщающий для всех популяций коэффициент R2 составляет 0,03. Альтернативная аллель ОНП rs1143634 выявляется с частотой от 2% в популяции EAS и до 25% в популяции EUR. Распределение частот аллелей полиморфизма rs1143627 также значительно дифференцировано среди населения мира, его нижняя граница составляет 35% популяции в EUR и достигает 52% в популяции EAS.
Пара ОНП rs8099917 и rs12979860 относится к гену, кодирующему IFN-λ4. По данным интернет-ресурса LD pair tool, коэффициент R2 для этой пары ОНП отличается широким разбросом значений: полное отсутствие взаимосвязи между двумя генетическими признаками в популяции AFR (R2 = 0,02), незначительная статистическая взаимосвязь аллелей в случае популяции EUR (R2 = 0,04) и практически 100%-ная корреляция в популяции EAS (R2 = 0,98). Объяснить это явление в настоящий момент не представляется возможным, в связи с чем оно также требует дальнейших углубленных исследований.
Полиморфизм rs28929474 гена SERPINA1 являет собой пример практически 100%-ного генетического единообразия в населении мира. Согласно ресурсу Ensebl, вариативность данного локуса зафиксирована только в отношении популяций EUR и AMR, и на альтернативную аллель приходится всего 2 и 0,4% населения соответственно. При детализации популяции EUR на субпопуляции выявляется достаточно интересная закономерность: процент встречаемости альтернативной аллели в субпопуляции CEU составляет 3%, FIN – 2,5%, GBR – 1,1%, IBS – 1,9% и TCI – 0%, в то время как группа MOS имеет характерные для обобщающей популяции EUR 2%. Данный полиморфный локус характеризуется всего двумя возможными вариантами строения: гетерозиготой CT и гомозиготой по цитозину (CС). Ген SERPINA1 кодирует α-1-антитрипсин – ингибитор протеаз семейства серпинов. Полиморфный локус rs28929474, как правило, рассматривается в комбинации со вторым полиморфизмом гена SERPINA1, а именно rs17580. В настоящее время установлено, что наиболее распространенной причиной возникновения тяжелого дефицита α-1-антитрипсина и сопутствующих патологических состояний, таких как патологии легких, цирроз печени, гепатоцеллюлярная карцинома, васкулит и панникулит, является наличие гомозиготного сочетания указанной пары полиморфизмов, а именно PiZZ-вариант [12].
Обсуждение
С развитием методов молекулярной биологии появились новые возможности по изучению строения генов, а следовательно, и выявлению вариантов строения кодирующих и регуляторных регионов генов человека. Важной исторической вехой является проект «Геном человека», ставший отправной точкой для проведения многочисленных исследований, направленных на изучение роли генов в развитии и течении заболеваний и целого спектра других научных задач в сфере медицины. Также одним из наиболее успешных, масштабных и ранних проектов по генетике человека является программа 1000 геномов (1000 Genomes Progect), завершившаяся в 2000-х гг. [13]. Благодаря этому проекту стал возможным анализ полученных в исследованиях данных на основании референсных последовательностей, представленных в сформированных базах данных. С развитием молекулярных методов исследований и повышением доступности секвенирования появился достаточно обширный ряд ресурсов по генетике человека, животных, насекомых и растений. Такие проекты, как ALPHA, HapMap и др., взаимно дополняют данные о генетическом разнообразии человеческой популяции, но, тем не менее, представленная в этих проектах информация не может в полной мере учесть все генетическое разнообразие населения мира. В настоящее время в международных базах данных представлены 5 основных популяций: африканская (AFR), американская (AMR), восточноазиатская (EAS), европейская (EUR) и южноазиатская (SAS). Каждая из них имеет дополнительное разделение на субпопуляции. Так, в европейской популяции представлены 5 субпопуляций: CEU (Utah Residents with Northern and Western European Ancestry), FIN (Finnish in Finland), GBR (British in England and Scotland), IBS (Iberian populations in Spain) и TSI (Toscani in Italy). Очевидно, что при проведении исследований на территориях, не отображенных в базах данных по генетике человека, например в Российской Федерации, ученые ориентируются на наиболее близкие субпопуляции. В текущем исследовании показано, что ряд ОНП, типированных в когорте населения европейской части Российской Федерации, наибольшим образом схож с субпопуляцией коренных жителей Финляндии (FIN), другие ОНП более близки по частотному распределению к усредненным показателям распределения для обобщенной популяции EUR. Такая ситуация несколько ограничивает применение имеющихся международных баз данных в исследованиях по изучению ассоциации ОНП с разного рода патологическими состояниями. Результаты исследований ряда отечественных научных групп [14] не представляется возможным объединить в единый информационный ресурс, агрегирующий данные так называемого «базового» распределении частот аллелей и генотипов ОНП среди населения РФ. При этом, с учетом современного уровня развития науки, создание такого рода ресурса является актуальной задачей.
Достоверность проводимых медико-биологических исследований – чрезвычайно важное условие при поиске генетических детерминант, влияющих на разные стороны патологического процесса: от его формирования, вариантов течения, осложнений и до исходов как инфекционных, так и соматических заболеваний. Вместе с тем в научных публикациях, посвященных этой проблеме, можно встретить противоречивые сведения, что обусловлено отсутствием релевантного референса. Сравнение распределения частот полиморфизмов, полученных в исследовании, с международными базами данных дополнительно осложняется малыми выборками, представленными по отдельным субпопуляциям. К примеру, в отношении ОНП rs1800795 (IL6) для субпопуляций CEU и FIN интернет-ресурс Ensembl имеет данные о распределении частот аллелей для 198 человек и генотипов на выборке, включающей 99 участников, что критически мало для сравнительной характеристики [15]. Анализ научной литературы по этому профилю показал, что значительная часть исследований выполнена на малых выборках как групп пациентов с изучаемым признаком, так и групп сравнения, которые представлены, как правило, численностью, не превышающей 150 человек [16–18]. В итоге указанная численность (150 человек) не может обеспечить достаточную точность для большого класса исследований. N. Fox и соавт. [19] разработали своего рода справочную таблицу с указанием величины допускаемой ошибки и установлением необходимой численности выборки для получения заданной вероятности ошибки. Согласно предложенным критериям, при условии погрешности выборки, составляющей 5%, рекомендуемая численность групп должна составлять от 350 человек. Очевидно, что соблюдение требований к репрезентативности исследуемых и контрольных групп – необходимое условие выполнения научных работ по данной проблематике. Вместе с тем представляется чрезвычайно важным актуализировать проблему отсутствия в Российской Федерации собственной информационной системы, сформированной с учетом расового и этнического многообразия населения.
В настоящей работе приведены весьма показательные примеры существенной генетической неоднородности населения, даже в пределах весьма ограниченной территории, что при исследованиях в областях как клинической, так и профилактической медицины предопределяет необходимость учета того, что авторы назвали «генетическим портретом населения». Многие современные медико-биологические исследования направлены на развитие персонализированного подхода к пациенту в медицине и, как следствие, выявление генетических маркеров, указывающих на риски развития того и иного патологического состояния. Однако результаты подобных исследований также могут оказаться востребованными в качестве параметров мониторинга в системе эпидемиологического надзора за инфекционными заболеваниями. При создании математических моделей, прогнозирующих уровень заболеваемости, смертность, частоту осложнений и другие параметры мониторинга, характеризующие эпидемический процесс, необходимо учитывать максимально возможное количество факторов, в том числе и генетическую детерминированность населения к перечисленным факторам. Однако такие расчеты возможны только при постоянном выявлении новых генетических детерминант и мониторинге распространенности частот аллелей маркерных генов. Вместе с тем в настоящее время для разработки математических моделей в РФ совершенно недостаточно данных о распространенности аллелей маркерных генов человека, что требует активизации и увеличения масштабов научных исследований по данной проблематике.
Учитывая приведенные в текущей работе различия в распределении частот аллелей полиморфизмов генов человека, получение достоверно значимых результатов генетически-статистических исследований крайне затруднительно. Проводимые исследования на территории РФ, в соответствии с требованиями к отбору групп исследования, в том числе и группе сравнения, в конечном итоге могут быть незначимы в силу отсутствия подтверждения соответствия группы сравнения среднему показателю среди условно здорового населения по исследуемому признаку. Стоит отметить, что отобранная когорта в качестве группы сравнения может соответствовать частотам распределения аллелей, представленным в международных базах данных [20]. Однако увеличение выборки указывает на общепопуляционное несоответствие распределения частот аллелей полиморфизмов, что может свидетельствовать о случайном характере соответствия группы сравнения референсным данным. Заболевания инфекционной природы, например вирусные гепатиты, иммунодефицит, обусловленный ВИЧ и т.д., пристально изучаются научным сообществом. Различные исходы заболевания напрямую связаны с генетическими детерминантами, обусловливающими реакцию иммунной системы человека на возбудителя. Поиск специфичных генетических маркеров, предсказывающих исход, реакцию организма на применяемое лечение, требует отбора групп с наличием изучаемого признака (группа исследования) и с отсутствием такового (группа сравнения). Несоответствие группы сравнения общепопуляционным данным может приводить к ложноположительным ассоциациям с состояниями, обусловленными вирусными агентами.
Заключение
Существующие выборки данных, несмотря на широкую географию их поступления, охватывающую практически всю планету, тем не менее являются фрагментарными, поскольку описывают характеристики локальных популяций. Свою роль играет и малое число участников исследований, составляющих эти популяции, что в конечном итоге не позволяет сформировать полноценное представление о распространенности вариантов генов, а также использовать такие данные для математического моделирования влияния ОНП на развитие эпидемических процессов в масштабах отдельной популяции. Для получения статистически значимых результатов целесообразным представляется составление общенациональной информационной системы, содержащей сведения о генетическом портрете населения регионов РФ, который будет общедоступным для научно-исследовательских организаций как для ее пополнения путем внесения новых данных, так и для использования в конкретных прикладных математических моделях.
Проведенный в настоящей работе анализ по сравнению распределения частот ОНП для условно здорового населения с базами данных международного проекта Ensembl подтверждает необходимость формирования собственной информационной системы, содержащей как данные о встречаемости аллелей и генотипов ОНП среди условно здорового населения, так и в подгруппах с разными патологическими состояниями. Выявлены статистические различия распределения частот ряда полиморфизмов в исследуемой группе MOS в сравнении с референсными показателями международных баз данных, неточность установленного распределения частот аллелей среди крупных популяций, показанных на примере полиморфизма rs1800795 гена IL6 и публикаций из Китая, в которых описаны многочисленные примеры несоответствия референсным значениям. Отсутствие полноценной информации по большинству регионов Российской Федерации указывает на необходимость развития отечественной базы данных, характеризующую генетическое разнообразие населения страны. Получение референсных данных, сформированных с учетом расового и этнического многообразия населения РФ, обеспечит достоверность результатов исследований по выявлению специфических маркеров, влияющих на развитие патологических состояний человека.
Об авторах
Наталья Викторовна Власенко
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Автор, ответственный за переписку.
Email: nvzuz@mail.ru
ORCID iD: 0000-0002-2388-1483
научный сотрудник лаборатории вирусных гепатитов
Россия, 111123, МоскваМихаил Дамирович Чанышев
ФБУН «Центральный НИИ эпидемиологии» Роспотребнадзора
Email: chanish@mail.ru
ORCID iD: 0000-0002-6943-2915
научный сотрудник лаборатории геномных исследований
Россия, 111123, МоскваДмитрий Васильевич Дубоделов
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: gradient27@mail.ru
ORCID iD: 0000-0003-3093-5731
кандидат медицинских наук, старший научный сотрудник лаборатории вирусных гепатитов
Россия, 111123, МоскваАртем Алексеевич Серков
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: toms8191@mail.ru
ORCID iD: 0009-0006-4086-8324
лаборант-исследователь лаборатории вирусных гепатитов
Россия, 111123, МоскваГалина Геннадьевна Солопова
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России
Email: galina.solopova@fnkc.ru
ORCID iD: 0000-0002-1680-7269
кандидат медицинских наук, заведующая отделением инфекционного контроля
Россия, 117997, МоскваАнастасия Владимировна Сацук
ФГБУ «Национальный медицинский исследовательский центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» Минздрава России
Email: vnpoemp@yandex.ru
ORCID iD: 0000-0003-3293-2008
кандидат медицинских наук, врач-эпидемиолог
Россия, 117997, МоскваАртем Владимирович Сницарь
ГБУЗ «Городская клиническая больница имени В.П. Демихова Департамента здравоохранения города Москвы»
Email: snitsarav@yandex.ru
ORCID iD: 0000-0001-6053-4651
заместитель главного врача по медицинской части
Россия, 109263, МоскваТатьяна Анатольевна Семененко
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи» Минздрава России
Email: semenenko@gamaleya.org
ORCID iD: 0000-0002-6686-9011
доктор медицинских наук, профессор, руководитель отдела эпидемиологии
Россия, 123098, МоскваСтанислав Николаевич Кузин
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: drkuzin@list.ru
ORCID iD: 0000-0002-0616-9777
доктор медицинских наук, профессор, заведующий лабораторией вирусных гепатитов
Россия, 111123, МоскваВасилий Геннадиевич Акимкин
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: crie@pcr.ru
ORCID iD: 0000-0003-4228-9044
доктор медицинских наук, профессор, академик РАН, директор
Россия, 111123, МоскваСписок литературы
- Kuper L., ed. Race, Science and Society. Paris: The Unesco Press; 1975.
- Рычков Ю.Г., ред. Генофонд и геногеография народонаселения. Том 1. Генофонд населения России и сопредельных стран. СПб.: Наука; 2000.
- Лихванцев В.В., Ядгаров М.Я., Берикашвили Л.Б., Каданцева К.К., Кузовлев А.Н. Определение объема выборки. Анестезиология и реаниматология. 2020; (6): 7786. https://doi.org/10.17116/anaesthesiology202006177
- Дрибноходова О.П., Корчагин В.И., Миронов К.О., Дунаева Е.А., Титков А.В., Аксельрод Э.В. и др. Сравнительный анализ частот аллельных вариантов rs1801133 и rs1801131 гена MTHFR в выборке пациентов, перенесших ишемический инсульт, и у здорового населения в Московском регионе. Журнал неврологии и психиатрии имени С.С. Корсакова. 2019; 119(3-2): 18–23. https://doi.org/10.17116/jnevro201911903218 https://elibrary.ru/mfftvn
- Ensembl genome browser 110. Available at: https://www.ensembl.org/index.html
- Yin Y.W., Sun Q.Q., Zhang B.B., Hu A.M., Wang Q., Liu H.L., et al. The lack of association between interleukin-6 gene -174 G/C polymorphism and the risk of type 1 diabetes mellitus: a meta-analysis of 18,152 subjects. Gene. 2013; 515(2): 461–5. https://doi.org/10.1016/j.gene.2012.11.062
- Xia J., Sun R.L. Association between interleukin-6 rs1800795 polymorphism and the decreased risk of type 2 diabetes mellitus: an updated meta-analysis. Int. J. Clin. Exp. Med. 2019; 12(1): 86–97.
- Zhang X., Ma L., Peng F., Wu Y., Chen Y., Yu L., et al. The endothelial dysfunction in patients with type 2 diabetes mellitus is associated with IL-6 gene promoter polymorphism in Chinese population. Endocrine. 2011;40(1):124–9. https://doi.org/10.1007/s12020-011-9442-9
- Yang Y., Xiao J., Tang L., Wang B., Sun X., Xu Z., et al. Effects of IL-6 polymorphisms on individual susceptibility to allergic diseases: a systematic review and meta-analysis. Front. Genet. 2022; 13: 822091. https://doi.org/10.3389/fgene.2022.822091
- Cheng Z., Zhang C., Mi Y. IL-6 gene rs1800795 polymorphism and diabetes mellitus: a comprehensive analysis involving 42,150 participants from a meta-analysis. Diabetol. Metab. Syndr. 2022; 14(1): 95. https://doi.org/10.1186/s13098-022-00851-8
- National Institutes of Health. LDlink. Available at: https://ldlink.nci.nih.gov/
- Диагностика и лечение легочной патологии при дефиците альфа-1-антитрипсина: доклад Европейского респираторного общества. Пульмонология. 2018; 28(3): 273–95. https://doi.org/10.18093/0869-0189-2018-28-3-273-295
- Risch N.J. Searching for genetic determinants in the new millennium. Nature. 2000; 405(6788): 847–56. https://doi.org/10.1038/35015718
- Воевода М.И. Полиморфизм и связь с факторами риска некоторых генов предрасположенности к сердечно-сосудистым заболеваниям в этнических группах Сибири (молекулярно-эпидемиологические и эволюционно-генетические аспекты). Атеросклероз. 2009; 5(1): 3–27. https://elibrary.ru/nxqejt
- Ensembl genome browser 110. rs1800795 SNP – Explore this variant – Homo_sapiens. Available at: https://www.ensembl.org/Homo_sapiens/Variation/Explore?r=7:22726526-22727526;v=rs1800795;vdb=variation;vf=729516845
- Зотова И.И., Капустин С.И., Грицаев С.В., Минеева Н.В., Кробинец И.И., Сидорова Ж.Ю. и др. Аллельный полиморфизм гена GPIIB как фактор, ассоциированный с вероятностью развития иммунной тромбоцитопении и тяжестью геморрагического синдрома. Онкогематология. 2018; 13(2): 93–9. https://doi.org/10.17650/1818-8346-2018-13-2-93-99 https://elibrary.ru/uuawru
- Елькина А.Ю., Акимова научный сотрудник , Шварц Ю.Г., Мартынович Т.В., Федотов Э.А. Показатели регуляции сосудистого тонуса и полиморфизм генов, ассоциированный с кардиоваскулярным риском, у молодых, относительно здоровых лиц. Кардиоваскулярная терапия и профилактика. 2019; 18(2): 45–50. https://doi.org/10.15829/1728-8800-2019-2-45-50 https://elibrary.ru/zclfjj
- Белокриницкая Т.Е., Фролова Н.И., Страмбовская Н.Н. Генетический полиморфизм, ассоциированный с риском развития нарушений обмена гомоцистеина, у здоровых коренных жительниц Забайкальского края: этнические и репродуктивные аспекты. Бюллетень Восточно-Сибирского научного центра Сибирского отделения Российской академии медицинских наук. 2013; (5): 13–6. https://elibrary.ru/rtuewh
- Fox N., Hunn A., Mathers N. Sampling and sample size calculation. In: The NIHR RDS for the East Midlands. Yorkshire and the Humber; 2009
- Власенко Н.В., Чурилова научный сотрудник , Лоскутова Т.А., Миронов К.О., Есьман А.С., Дунаева Е.А. и др. Оценка эпидемиологической значимости молекулярно-генетических факторов в отношении напряженности поствакцинального иммунитета против гепатита B. Журнал микробиологии, эпидемиологии и иммунобиологии. 2022; 99(2): 150–59. https://doi.org/10.36233/0372-9311-246 https://elibrary.ru/mtosqh
Дополнительные файлы