Устойчивость к противовирусным препаратам у вирусов человека из подсемейства Betaherpesvirinae
- Авторы: Демин М.В.1, Тихомиров Д.С.1, Туполева Т.А.1, Филатов Ф.П.2,3
-
Учреждения:
- ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
- ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова» Минобрнауки России
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Минздрава России
- Выпуск: Том 67, № 5 (2022)
- Страницы: 385-394
- Раздел: ОБЗОРЫ
- URL: https://virusjour.crie.ru/jour/article/view/642
- DOI: https://doi.org/10.36233/0507-4088-136
- ID: 642
Цитировать
Полный текст
Аннотация
В обзоре представлена информация о механизмах возникновения устойчивости к противовирусным препаратам у вирусов человека из подсемейства Betaherpesvirinae. Даны сведения о принципах работы противовирусных препаратов и их характеристика. Описана частота появления вирусной устойчивости у различных групп пациентов и показаны сведения о возможных последствиях возникновения устойчивости к противовирусным препаратам. Дана информация о генах вируса, в которых происходят мутации, приводящие к вирусной устойчивости, и список таких мутаций, описанных на данный момент. Обсуждается значение исследования мутаций, приводящих к устойчивости вируса к противовирусным препаратам, для медицинской практики.
Полный текст
Введение
Betaherpesvirinae, или β-герпесвирусы, – это подсемейство вирусов, которое входит в семейство герпесвирусов Herpesviridae. Отличительной особенностью представителей этого подсемейства, инфицирующих человека, являются их относительно медленная репликация и частое отсутствие клинических проявлений после инфицирования [1]. Подсемейство включает пять родов, но только вирусы из родов Cytomegalovirus (вирус герпеса человека 5-го типа, или цитомегаловирус (ЦМВ)) и Roseolovirus (вирус герпеса человека типа 6A, вирус герпеса человека типа 6B (ВГЧ-6), вирус герпеса человека 7-го типа (ВГЧ-7)) являются антропонозами.
Как и другие представители семейства герпесвирусов, ЦМВ, ВГЧ-6 и ВГЧ-7 после инфицирования чаще всего находятся в организме заражённого человека в латентном состоянии, но сохраняют способность к реактивации в случае ослабления иммунологического контроля. Активная репликация ЦМВ может быть причиной инфекционного мононуклеоза, а у иммуннокомпрометированных пациентов (инфицированные вирусом иммунодефицита человека (ВИЧ), реципиенты органов и гемопоэтических стволовых клеток (ГСК)) могут наблюдаться серьёзные вирусные инвазии отдельных органов и целых систем организма [1]. Согласно данным литературы, ВГЧ-6 и ВГЧ-7 ответственны за развитие внезапной экзантемы у детей, которую часто называют розеолой. Как в случае с ЦМВ, активная инфекция ВГЧ-6 вызывает серьёзные осложнения у иммуннокомпрометированных пациентов (энцефалит, гепатит, пневмония) [2].
β-герпесвирусы у реципиентов стволовых гемопоэтических клеток
Реципиенты органов или ГСК представляют собой особую группу пациентов, которые уязвимы для инфекционных осложнений, и активная репликация герпесвирусов может быть их причиной [3]. Трансплантацию ГСК, как правило, применяют в качестве этапа лечения у пациентов с опухолевыми заболеваниями системы крови – гемобластозами. В качестве трансплантата могут выступать как собственные кроветворные клетки, собранные у пациента на фоне ремиссии заболевания, так и аллогенные, источником которых является донор, частично или полностью совместимый по системе лейкоцитарных антигенов I типа (HLA-I). В первом случае не возникает иммунологической несовместимости, что способствует более быстрому выходу из аплазии после проведения процедуры. В случае применения аллогенных клеток возможно множество негативных последствий, таких как первичное неприживление, несостоятельность либо гипофункция трансплантата, отсроченное восстановление кроветворения, а в более позднем периоде развитие реакции «трансплантат против хозяина» (РТПХ), возникновение многочисленных инфекционных осложнений в посттрансплантационном периоде. На вероятность развития этих осложнений влияет множество факторов, среди которых можно выделить совместимость донора и реципиента, интенсивность режима кондиционирования перед трансплантацией, степень эрадикации кроветворения реципиента и развитие герпесвирусных инфекций, в том числе вызванных β-герпесвирусами [4]. Важным аспектом также является серостатус пациента и донора. Наибольшую опасность представляет трансплантация ГСК серопозитивного донора серонегативному реципиенту [5]. В этом случае вероятность первичного инфицирования реципиента близка к 100%, а появление симптомов вирусного поражения при отсутствии своевременной противовирусной терапии повышается до 80%. Такая ситуация описана как для ЦМВ [6], так и для ВГЧ-6 [7]. При этом, согласно данным литературы, активация ВГЧ-7 наблюдается заметно реже и не превышает 40% случаев [8]. Развитие инфекций, вызванных этими вирусами, увеличивает тяжесть течения основного гематологического заболевания, а у реципиентов стволовых кроветворных клеток повышает вероятность как развития острой и хронической РТПХ, так и отторжения трансплантата и летального исхода.
Наиболее благоприятной считается трансплантация ГСК от серонегативного донора серонегативному реципиенту, однако, учитывая крайне широкую распространённость этих вирусов, вероятность подбора такой пары «донор – реципиент» часто не представляется возможной. Поэтому проведение профилактики и в случае возникновения клинических проявлений инфекции лечения препаратами прямого противовирусного действия является крайне актуальным.
Профилактическая противовирусная терапия проводится в раннем посттрансплантационном периоде в момент наибольшей клеточной деплеции, когда вероятность возникновения любых инфекционных осложнений, в том числе и вирусной природы, максимальна. В более отдалённом периоде такая терапия чаще не проводится, поскольку используемые для этого препараты обладают достаточно выраженным токсическим и миелосупрессивным действием. Однако вероятность развития инфекции в этот период времени сохраняется, несмотря на восстановление показателей периферической крови на фоне донорского кроветворения [9].
Противовирусные препараты, блокирующие репликацию вирусной ДНК
Подход к противовирусной терапии включает в себя применение лекарственных средств, напрямую или опосредованно подавляющих вирусную репродукцию, чаще всего путём блокировки процесса репликации вирусного генома. На сегодняшний день известно несколько препаратов, способных подавить размножение β-герпесвирусов. В первую очередь это вещества, влияющие на работу вирусной ДНК-полимеразы [10], такие как ацикловир, ганцикловир и их пролекарства с большей биодоступностью – валацикловир и валганцикловир. Данные лекарственные средства являются аналогами нуклеозидов [11] и зарегистрированы для клинического применения на территории Российской Федерации. Как в России, так и во всём мире лечение инфекций, вызываемых ЦМВ, ВГЧ-6 и ВГЧ-7, проводится в большинстве случаев с помощью ганцикловира и валганцикловира [12]. По сравнению с α-герпесвирусами (вирусами простого герпеса 1-го и 2-го типа и вирусом варицелла-зостер), сродство вирусных ферментов β-герпесвирусов (ЦМВ, ВГЧ-6 и ВГЧ-7) с ацикловиром и другими тимидинкиназозависимыми противогерпетическими агентами выражено в меньшей степени [12], на чём и основан подход к терапии. Согласно существующим рекомендациям, профилактика ЦМВ-инфекции производится ганцикловиром и валганцикловиром, в то время как рекомендаций для проведения профилактики инфекций, вызванных ВГЧ-6 и ВГЧ-7, на данный момент не существует [13].
Кроме этих лекарств, в мировой практике также используют другой нуклеотидный аналог – цидофовир и аналог пирофосфата – фоскарнет [14]. Их использование в первую очередь обусловлено возможным развитием устойчивости у ЦМВ и ВГЧ-6 к действию ганцикловира и валганцикловира [15]. Эти препараты не получили столь широкого распространения, как ганцикловир, что связано с явно выраженной нефротоксичностью. На территории РФ эти препараты не зарегистрированы для клинического применения. В мировой практике цидофовир и фоскарнет рекомендовано назначать при тяжёлых жизнеугрожающих герпесвирусных инфекциях, а также в случаях формирования доказанной устойчивости к ацикловиру и ганцикловиру [16].
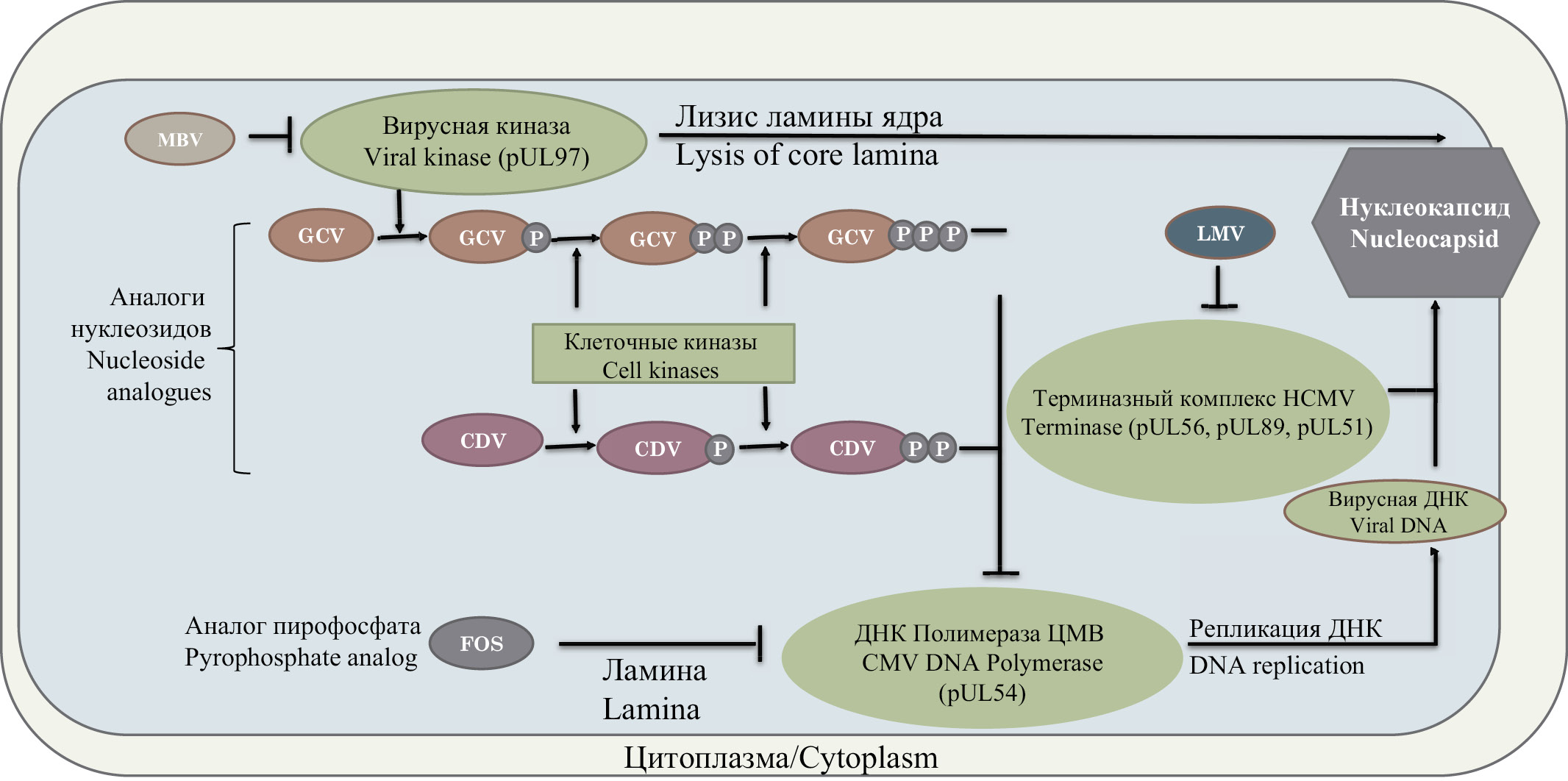
Ограниченное число препаратов с прямым противовирусным действием определяет необходимость поиска лекарств с альтернативным принципом действия. Среди них следует отметить летермовир и марибавир. Механизм их действия отличается от ранее упомянутых препаратов, поскольку их непосредственной мишенью не является вирусная ДНК-полимераза. Летермовир блокирует действие продукта гена ЦМВ UL56, который представляет собой субъединицу терминазного комплекса [17]. Данный комплекс ферментов участвует в упаковке ДНК вируса в капсид и обеспечивает правильное формирование новых вирионов [18]. Терминазный комплекс не имеет аналогов в человеческой клетке, что теоретически делает применение этого препарата безопасным [19]. Летермовир был одобрен для профилактики ЦМВ-инфекции в некоторых странах [20]. Тем не менее масштабных исследований эффективности этого препарата не проводилось, что не позволяет выработать единые стандарты для его использования.
Марибавир в данный момент одобрен для использования в США [21]. Действие препарата основано на подавлении активности продукта гена ЦМВ UL97 [22], который представляет собой серин-треониновую протеинкиназу (фосфотрансферазу), фосфорилирующую человеческие и вирусные белки, участвующие в жизненном цикле вируса. Показано, что марибавир конкурирует с аденозинтрифосфатом (АТФ) за сайты связывания в вирусной фосфотрансферазе [23]. Данная вирусная киназа также принимает участие в перемещении вновь синтезированных незрелых вирусных частиц в цитоплазму через ламину ядра [24]. В экспериментах in vitro в культуре клеток марибавир подавляет репликацию ЦМВ примерно в 10 раз эффективнее, чем ганцикловир.
Поскольку марибавир подавляет активность вирусной фосфотрансферазы, его действие снижает эффективность ганцикловира, который фосфорилируется преимущественно этим ферментом [25]. Таким образом, одновременное назначение этих препаратов противопоказано. Совместное действие марибавира с другими препаратами (фоскарнет, цидофовир, летермовир), напротив, оказывает синергический эффект [26].
Ещё одним важным свойством марибавира является отсутствие у него выраженного миелосупрессивного действия, что повышает привлекательность применения этого препарата у реципиентов ГСК. Принципы действия описанных препаратов представлены на рисунке. Мишенью марибавира выступает вирусная фосфотрансфераза, мишенью ганцикловира, цифовира и фоскарнета – вирусная ДНК-полимераза, а мишенью летермовира является вирусный терминазный комплекс.
Рисунок. Принципы действия противовирусных препаратов: MBV – марибавир, GCV – ганцикловир, CDV – цидофовир, FOS – фоскарнет, LMV – летермовир.
Устойчивость цитомегаловируса к действию противовирусных препаратов
Частота возникновения мутаций в ДНК цитомегаловируса
В многочисленных клинических исследованиях у пациентов с ЦМВ-ретинитом показана актуальность возникновения устойчивых вирусных штаммов и описана частота их появления [27]. Одно из таких исследований, проведённое в институте Джонса Хопкинса, показало, что устойчивые штаммы выявляются в 3% случаев при первичном обследовании пациентов с ЦМВ-поражениями органов зрения. Среди пациентов, находящихся под наблюдением один год и получающих противовирусную терапию ганцикловиром, частота выявления таких штаммов достигает уже 27% [27]. Схожие данные были опубликованы для других препаратов – фоскарнета и цидофовира [28]. Показано, что у 12% ЦМВ-положительных реципиентов алло-ГСК обнаружен мутантный вирусный штамм [29].
В литературе одним из основных факторов риска появления мутаций в ДНК ЦМВ называют длительное использование противовирусных препаратов в субоптимальных дозах [30]. К дополнительным факторам риска развития лекарственной устойчивости ЦМВ относят: использование трансплантатов после Т-клеточной деплеции [31] и РТПХ [32], которые способствуют развитию оппортунистических инфекций. В этих случаях у пациентов нарушено нормальное функционирование иммунных клеток, что может способствовать неконтролируемой репликации вируса и отбору наиболее приспособленного мутантного штамма, а это, в свою очередь, ведёт к возникновению лекарственной устойчивости вируса.
Механизм возникновения устойчивости к противовирусным препаратам у цитомегаловируса
Когда речь идёт об устойчивости вирусов герпетической группы к действию противовирусных препаратов, возможна потеря способности того или иного лекарственного средства эффективно ингибировать вирусную репликацию. При этом подавление процесса репродукции вируса может быть реализовано через различные механизмы: нарушение синтеза вирусной ДНК de novo, нарушение транспорта и созревания компонентов вирионов внутри клетки и пр. Учитывая, что лекарственные противогерпетические препараты первого ряда, используемые в настоящее время, являются ингибиторами ДНК-полимеразы, то наиболее часто на практике наблюдается устойчивость, связанная с мутациями, приводящими к неспособности того или иного препарата ингибировать репликацию вирусного генома. Устойчивость ЦМВ к действию ганцикловира обусловлена возникновением мутаций в гене вирусной фосфотрансферазы ЦМВ UL97, которая отвечает за первый этап фосфорилирования ганцикловира, что обеспечивает вирусную специфичность самого препарата [33]. В основном мутации, потенциально приводящие к устойчивости процесса вирусной репликации к действию препаратов, локализуются в кодонах 460, 520 и 590–607 этого гена, причём относительно небольшое число мутаций отвечает за более чем 80% случаев доказанной устойчивости к ганцикловиру [34]. Предполагается, что мутационный процесс в данной локализации приводит к изменению специфичности вирусной фосфотрансферазы к субстрату (ганцикловиру), при этом не затрагивая другие её функции. Были обнаружены мутации и в других кодонах, но они встречаются крайне редко, хоть и приводят к эффективной устойчивости к ганцикловиру.
Зарегистрированные для клинического применения в РФ ганцикловир и цидофовир после внутриклеточных превращений с образованием ганцикловиртрифосфата и цидофовирдифосфата, а также фоскарнет ингибируют вирусную ДНК-полимеразу, которая является продуктом вирусного гена UL54. Мутации в гене UL54 могут приводить к нечувствительности работы полимеразы к этим веществам. Нередко наблюдается феномен кросс-резистентности к двум и даже одновременно к трём препаратам [35]. Данные литературы свидетельствуют, что мутации в гене UL54 обычно возникают после длительного применения противовирусных средств на фоне уже возникших мутаций в гене UL97 [25], что способствует отбору вирусных штаммов, нечувствительных к препаратам. Кодоны, в которых возникают мутации, группируются главным образом в экзонуклеазном (кодоны 395–545) и каталитическом (кодоны 809–987) доменах фермента. Мутации, приводящие к устойчивости к фоскарнету (аналогу пирофосфата), располагаются в каталитических сайтах вирусной ДНК-полимеразы [36]. У большинства штаммов с кросс-резистентностью к ганцикловиру и цидофовиру мутации идентифицируются в экзонуклеазном домене вирусной ДНК-полимеразы. Механизм устойчивости в данном случае объясняется изменением в структуре экзонуклеазного домена полимеразы. Это изменение приводит к снижению чувствительности этого домена к аналогу нуклеозида (ганцикловиртрифосфата или цидофовирдифосфата). При включении в растущую цепь ДНК такого аналога (положение N + 1) нарушается структура остова ДНК в позициях N + 1 и N + 2. Вирусная ДНК-полимераза стремится устранить напряжение, но её экзонуклеазный домен недостаточно эффективно удаляет встроенный аналог, что ведёт к остановке всего процесса [37]. У штаммов, несущих мутации в экзонуклеазном домене, это напряжение не приводит к остановке синтеза растущей цепи ДНК.
Клинические исследования эффективности препарата марибавир показали, что мутации, возникающие в UL97, могут приводить к устойчивости и к этому препарату [38]. Были зафиксированы случаи кросс-резистентности, когда мутации приводили к единовременной невосприимчивости процесса вирусной репликации и к ганцикловиру, и к марибавиру [39]. Практически все описанные на данный момент мутации, ассоциированные с устойчивостью к марибавиру, находятся недалеко от кодонов 353, 397, 409 и 411, рядом с АТФ-связывающим доменом фермента. Причём участки гена, в которых локализуются эти мутации, не пересекаются с теми участками, где возникают мутации, обеспечивающие вирусу устойчивость к действию ганцикловира.
В работах, посвящённых изучению устойчивости к летермовиру, показано, что регионы возникновения мутаций, отвечающих за устойчивость к действию данного препарата, в основном локализуются в гене UL56. Описаны мутации резистентности, локализующиеся также в генах UL89 и UL51. Все эти гены кодируют ферменты, входящие в комплекс вирусной терминазы. Кодоны, в которых возникают мутации, в случае UL56 ограничиваются положениями 25 и 229–369. Возникающие мутации мало влияют на жизненный цикл вируса, при этом появление сразу трёх мутаций ведёт к заметному повышению устойчивости к летермовиру [40]. Число описанных мутаций в генах UL89 и UL51 мало, как и степень их изученности. В UL89 известны несколько мутаций, расположенных в кодонах 320–360; для UL51 описана мутация в кодоне 91 [19]. Сведения о мутациях, описанных в литературе, показаны в табл. 1 [35].
Таблица 1. Мутации устойчивости и их локализация в геноме цитомегаловируса
Table 1. Resistance mutations and their localization in the cytomegalovirus genome
№ No. | Препарат Drug | Локализация (ген) Localization (gene) | Мутации, ассоциированные с лекарственной резистентностью Mutations associated with drug resistance |
1 | Ганцикловир | UL97 | K359E, K359Q, L405P, M460V, M460I, C518Y, H520Q, A591V, C592G, A594V, A594T, A594E, A594G, A594P, A594S, L595S, L595F, L595W, E596del E596G, E596Y, K599T, L600del, L600del2, C603W, C603R, C603S, C607Y, C607F, I610T, A613V |
2 | Марибавир | UL97 | L337M, V353A, L397R, H411L, T409M, H411Y, H411N |
3 | Ганцикловир + марибавир | UL97 | F342Y, F342S, V356G, D456N, V466G, C480F, C480R P521L, Y617del |
4 | Ганцикловир + цидофовир | UL54 | D301N, E303D, E303G, N408D, N408K, N408S, N410K, F412V, F412C, F412L, F412S, D413E, D413A, D413N, D413Y, K488R, K500N, L501I, T503I, A505V, K513E, K513N, K513R, D515Y, L516R, L516P, L516W, I521T, P522A, P522S, C524del, V526L, C539G, C539R, A543P, L545S, L545W, I726T, I726V, A987G |
5 | Ганцикловир | UL54 | P829S, L957F |
6 | Цидофовир | UL54 | D542E, K805Q |
7 | Фоскарнет | UL54 | N495K, T552N, S585A, F595I, T700A, V715A, V715M, E756D, E756Q, T838A, M844T, V946L |
8 | Фоскарнет + ганцикловир | UL54 | S290R, Q578L, D588N, E756K, L776M, L776, V787A, V787L, L802M, A809V, T821I, M844V, E951D |
9 | Фоскарнет + ганцикловир + цидофовир | UL54 | Q578H, L773V, V787E, V812L, T813S, A834P, G841A G841S, D981del2 |
10 | Летермовир | UL56 | C25F, S229F, V231A, V231L, N232Y, V236A, V236L, V236M, L241P, T244K, L254F, L257I, L257F, K258E, F261L, F261C, Y321C, C325F, C325Y, C325R, C325W, L328V, M329T, A365S, N368D, R369M, R369G, R369S, R369T, N320H, D344E, T350M, M359I, P91S |
Примечание. Жирным выделены наиболее частые мутации.
Note. The most common mutations are highlighted in bold.
Детекция мутаций в геноме цитомегаловируса
Устойчивость к противовирусным препаратам может быть выявлена разными способами, в частности с помощью генотипических методов или определения концентрации противовирусного агента, необходимого для ингибирования репликации вируса in vitro. Для определения устойчивости репликации ЦМВ к действию противовирусных препаратов в культуре клеток можно использовать такие методы, как флуоресцентная микроскопия [41] и анализ сортировки клеток с активацией флуоресценции [42], обнаружение ДНК путём гибридизации [43].
Поиск мутаций, ассоциированных с устойчивостью к действию противовирусных препаратов, целесообразно проводить при повышении у пациента вирусной нагрузки на фоне длительной неэффективной противовирусной терапии [44]. Для поиска мутаций могут применяться различные лабораторные методы, среди которых наибольшее значение имеют полимеразная цепная реакция (ПЦР) и секвенирование. Для эффективного проведения последнего рекомендуется использовать образцы вирусной ДНК, выделенной из клинического материала инфицированного пациента с высокой вирусной нагрузкой – более 1000 копий геном-эквивалента или МЕ на 1 мл, если образец представлен биологической жидкостью, либо на 105 ядросодержащих клеток, если образец представлен цельной кровью или другим клеточным материалом. При исследовании образцов с более низкой концентрацией вирусной ДНК существует риск неудачи при проведении секвенирования [45]. Процесс репликации и, соответственно, мутагенеза ЦМВ может происходить не только в крови, но и в других тканях организма благодаря пантропности вируса. Это, в свою очередь, означает, что формирование лекарственной устойчивости в разных локусах может отличаться [46]. Поиск литературных данных об исследованиях, посвящённых чувствительности вирусных штаммов, изолированных из различных локусов, к действию противовирусных препаратов, не увенчался успехом. Однако это не исключает возможности такой селекции штаммов внутри одного организма.
По данным литературы, для диагностики мутаций устойчивости чаще всего проводится секвенирование по Сенгеру. На первом этапе с помощью ПЦР клонируют участок гена, где расположено превалирующее число ранее описанных мутаций. Чаще всего исследуются кодоны UL97 440–670, UL54 300–1000 и UL56 229–369. После этого проводится секвенирование по Сенгеру. Преимущество этого распространённого метода заключается в возможности его стандартизации и невысокой стоимости. Основным его недостатком является невозможность идентификации мутантных субпопуляций вируса, составляющих менее 20% от общего пула. На данный момент разработаны методы поиска мутаций с помощью секвенирования нового поколения (Next Generation Sequencing – NGS), но высокая стоимость и отсутствие стандартизации пока не позволяют говорить о возможности повсеместного использования данного метода.
Для тестирования образцов на наличие конкретных мутаций может быть использован метод ПЦР. Поскольку за 80% случаев неэффективности этиотропной химиотерапии, наблюдаемой в клинике, отвечает ограниченный перечень описанных мутаций, создание стандартных ПЦР-тестов для их детекции обладает высоким потенциалом для практики.
Устойчивость к противовирусным препаратам у вируса герпеса человека типа 6B
Значение, частота и факторы риска возникновения мутаций в ДНК вируса герпеса человека типа 6B
У реципиентов органов и тканей активная инфекция ВГЧ-6 клинически может проявляться довольно разнообразно: лихорадкой и (или) сыпью, реже поражением ЦНС в виде энцефалита, поражением печени, органов дыхания, угнетением костномозгового кроветворения [47]. Также описаны случаи синергизма ВГЧ-6 и ЦМВ. Согласно данным некоторых авторов, активная репликация ВГЧ-6 может увеличивать скорость реактивации ЦМВ и усугублять тяжесть течения ЦМВ-болезни путём прямого взаимодействия и (или) модуляции иммунного ответа хозяина [48]. Хотя исследования in vitro подтверждают потенциальную устойчивость ВГЧ-6 к противовирусным препаратам, в нескольких случаях описано появление лекарственно-устойчивых изолятов в клинической практике. Например, устойчивый к ганцикловиру ВГЧ-6 мутант был выделен от пациента со СПИДом, который получал длительную терапию по поводу активной ЦМВ-инфекции [15]. Также описан случай обнаружения резистентного к ганцикловиру изолята ВГЧ-6 у реципиента ГСК. Пациент скончался, а выделенный изолят оказался в 100 раз устойчивее к ганцикловиру, чем дикий тип, что, в свою очередь, могло повлиять на исход [49]. K. Baldwin и соавт. описали случай развития энцефалита у реципиента печени, вызванного изолятом ВГЧ-6, устойчивым к ганцикловиру, но чувствительным к фоскарнету [50]. Тем не менее, в отличие от ЦМВ, крупных исследований, позволяющих составить картину о частоте встречаемости устойчивых мутантов ВГЧ-6, особенно у реципиентов ГСК, не проводилось. В связи с этим сбор данных, способных показать частоту и степень опасности возникновений мутаций в геноме ВГЧ-6, ассоциированных с устойчивостью к действию противовирусных препаратов, представляется крайне актуальной задачей. Для ВГЧ-7 практически не описаны случаи возникновения устойчивости, однако значение этого события для реципиентов алло-ГСК и других иммуннокомпрометированных пациентов не оценено.
Механизм возникновения устойчивости к действию противовирусных препаратов у вируса герпеса человека типа 6B
На данный момент объём информации касательно устойчивости ВГЧ-6 к действию противовирусных препаратов намного меньше, чем для ЦМВ. Однако мутации, приводящие к такой резистентности, уже описаны. Нечувствительность репликации ВГЧ-6 к ганцикловиру часто опосредована мутациями в вирусных генах U69 и (или) U38, являющихся аналогами генов ЦМВ UL97 и UL54 и кодирующих соответственно вирусную фосфотрансферазу и вирусную полимеразу. Например, мутация M318V, расположенная в поддомене VIb фосфотрансферазы U69, была идентифицирована в клиническом образце крови, взятом от ВИЧ-положительного пациента [15] с ВГЧ-6 инфекцией. Две (L201I и L213I) и три (P462S, A565V и A975V) мутации были обнаружены соответственно в генах U69 и U38 в геноме вируса, выделенного от реципиента ГСК [49]. Мутация Y479H в гене U69 была обнаружена в изоляте, выделенном из крови реципиента трансплантата почки, получавшего ганцикловир для подавления активной ЦМВ-инфекции [51]. Некоторые мутации у ВГЧ-6 были открыты путём экстраполяции аналогичных мутаций в геноме ЦМВ ввиду сходства генов, например, в гене U38 – мутации A591D, C592G, L595S, A606D и C607Y [52]. Предполагается, что мутации в генах ВГЧ-6 приводят к тем же последствиям, что и в случае с ЦМВ: изменение сайтов связывания с лекарственными аналогами нуклеозидов и пирофосфатом, что в конечном счёте приводит к снижению эффективности препаратов. Известные мутации устойчивости ВГЧ-6 представлены в табл. 2.
Таблица 2. Мутации устойчивости и их локализация в геноме вируса герпеса человека типа 6B
Table 2. Resistance mutations and their localization in the genome of human herpesvirus type 6B
№ No. | Препарат Drug | Локализация (ген) Localization (gene) | Мутации, ассоциированные с лекарственной резистентностью Mutations associated with drug resistance |
1 | Ганцикловир | U69 | L201I, L213I, M318V, A447D, C448G, L450S, A462D, P462S, C463Y |
2 | Фоскарнет | U38 | F292S, T435R, H507Y, C525S |
3 | Ганцикловир | U38 | A565V, A591D, C592G, L595S, A606D, C607Y, A961V, A975V |
4 | Ганцикловир + фоскарнет + цидофовир | U38 | R798I |
Детекция мутаций в геноме вируса герпеса человека типа 6B
Как и в случае с ЦМВ, для оценки чувствительности репликации ВГЧ-6 к действию противовирусных препаратов можно использовать множество методов. Но предпочтительным остаётся метод секвенирования по Сенгеру. Преимущество в данном случае заключается в том, что генотипическое тестирование путём секвенирования ДНК-продуктов ПЦР, амплифицированных из U69 (обычно кодонов 122–564) и (или) гена U38 (обычно кодоны 1–998), может быть проведено непосредственно на базе ДНК, выделенной из клинического образца [51]. Так же как и для ЦМВ, применение в лабораторной практике других методов на сегодняшний день представляется нецелесообразным: NGS является дорогостоящим методом, в то время как ПЦР можно проводить, только заранее определив, какую мутацию следует искать. Согласно данным литературы, для обнаружения устойчивости ВГЧ-6 к противовирусным препаратам чаще всего используют образцы периферической крови.
Заключение
Суммируя вышеизложенное, можно заключить, что возникновение мутаций в геномах β-герпесвирусов, снижающих эффективность проводимых терапевтических мероприятий, не является редким событием в клинической практике. При этом если для ЦМВ был собран довольно большой массив данных, позволяющий составить представление о частоте возникновения и локализации мутаций устойчивости, то для ВГЧ-6 и ВГЧ-7 данные ограничены. Эта проблематика представляется крайне актуальной, учитывая распространённость ВГЧ-6 и наличие описанных случаев активной инфекции, вызванной устойчивым вирусом, закончившихся летальных исходом. Актуальным вопросом, наряду с поиском, идентификацией и описанием мутаций устойчивости для обозначенных вирусов, является разработка методик быстрой и эффективной диагностики подобных мутаций (например, на основе ПЦР). Применение подобных методик может способствовать оперативному получению дополнительной информации для корректировки и повышения эффективности тактики лечения.
Участие авторов: Все авторы внесли равный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили финальную версию до публикации.
Финансирование. Исследование выполнено за счёт государственного бюджета.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Об авторах
Михаил Валерьевич Демин
ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
Автор, ответственный за переписку.
Email: memindisha@gmail.com
ORCID iD: 0000-0002-7579-3442
биолог
Россия, 125167, г. МоскваДмитрий Сергеевич Тихомиров
ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
Email: tihomirovgnc@bk.ru
ORCID iD: 0000-0002-2553-6579
КБН, заведующий лабораторией вирусологии
Россия, 125167, г. МоскваТатьяна Алексеевна Туполева
ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России
Email: ttupoleva@mail.ru
ORCID iD: 0000-0003-4668-9379
ДМН, заведующий отделом вирусологии
Россия, 125167, г. МоскваФеликс Петрович Филатов
ФГБНУ «Научно-исследовательский институт вакцин и сывороток имени И.И. Мечникова» Минобрнауки России; ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Минздрава России
Email: ffelix001@gmail.com
ORCID iD: 0000-0002-2385-9251
ДБН
Россия, 105064, г. Москва; 123098, г. МоскваСписок литературы
- Umene K. Herpesviruses. Fukuoka Igaku Zasshi. 2001; 92(11): 361–4. (in Japanese)
- Piret J., Boivin G. Antiviral drug resistance in herpesviruses other than cytomegalovirus. Rev. Med. Virol. 2014; 24(3):186–218. https://doi.org/10.1002/rmv.1787
- Ramanan P., Razonable R.R. Cytomegalovirus infections in solid organ transplantation: A review. Infect. Chemother. 2013; 45(3): 260–71. https://doi.org/10.3947/ic.2013.45.3.260
- Панкратова О.С., Чухловин А.Б., Зубаровская Л.С., Афанасьев Б.В. Частота выявления вирусов группы герпеса и риск типичных осложнений при аллогенной трансплантации гемопоэтических стволовых клеток. Ученые записки СПбГМУ им. акад. И.П. Павлова. 2010; 17(1): 56–60.
- Kotton C.N. Management of cytomegalovirus infection in solid organ transplantation. Nat. Rev. Nephrol. 2010; 6(12): 711–21. https://doi.org/10.1038/nrneph.2010.141
- Takenaka K., Nishida T., Asano-Mori Y., Oshima K., Ohashi K., Mori T., et al. Cytomegalovirus reactivation after allogeneic hematopoietic stem cell transplantation is associated with a reduced risk of relapse in patients with acute myeloid leukemia who survived to day 100 after transplantation: The Japan society for hematopoietic C. Biol. Blood Marrow Transplant. 2015; 21(11): 2008–16. https://doi.org/10.1016/j.bbmt.2015.07.019
- Rossi C., Delforge M.L., Jacobs F., Wissing M., Pradier O., Remmelink M., et al. Fatal primary infection due to human herpesvirus 6 variant A in a renal transplant recipient. Transplantation. 2001; 71(2): 288–92. https://doi.org/10.1097/00007890-200101270-00021
- Kidd M., Clark D., Sabin C., Andrew D., Hassan-Walker A., Sweny P., et al. Association of human herpesvirus 7 and cytomegalovirus co-infection with cytomegalovirus disease and increased rejection. Transplantation. 2000; 69(11): 2400–4. https://doi.org/10.1097/00007890-200006150-00032
- Britt W. Manifestations of human cytomegalovirus infection: Proposed mechanisms of acute and chronic disease. Curr. Top. Microbiol. Immunol. 2008; 325: 417–70. https://doi.org/10.1007/978-3-540-77349-8_23
- Cameron C.E., Raney K.D., Götte M. Viral Genome Replication. Boston: Springer; 2009.
- Chen S.J., Wang S.C., Chen Y.C. Antiviral agents as therapeutic strategies against cytomegalovirus infections. Viruses. 2019; 12(1): 21. https://doi.org/10.3390/v12010021
- Орлова С.В., Стома И.О., Шмелева Н.П., Сивец Н.В. Современное состояние проблемы герпесвирусных инфекций 6-го и 7-го типов с разными клиническими формами, возможности лечения. Инфекционные болезни: новости, мнения, обучение. 2021; 10(2): 78–86. https://doi.org/10.33029/2305-3496-2021-10-1-78-86
- Ward K.N., Hill J.A., Hubacek P., De La Camara R., Crocchiolo R., Einsele H., et al. Guidelines from the 2017 European Conference on Infections in Leukaemia for management of HHV-6 infection in patients with hematologic malignancies and after hematopoietic stem cell transplantation. Haematologica. 2019; 104(11): 2155–63. https://doi.org/10.3324/haematol.2019.223073
- Krishna B.A., Wills M.R., Sinclair J.H. Advances in the treatment of cytomegalovirus. Br. Med. Bull. 2019; 131(1): 5–17. https://doi.org/10.1093/bmb/ldz031
- Manichanh C., Olivier-Aubron C., Lagarde J.P., Aubin J.T., Bossi P., Gautheret-Dejean A., et al. Selection of the same mutation in the U69 protein kinase gene of human herpesvirus-6 after prolonged exposure to ganciclovir in vitro and in vivo. J. Gen. Virol. 2001; 82(Pt. 11): 2767–76. https://doi.org/10.1099/0022-1317-82-11-2767
- Ward K.N., Clark D.A. Roseoloviruses: human herpesviruses 6A, 6B and 7. In: Principles and Practice of Clinical Virology. Chichester: Wiley-Blackwell; 2009: 223–44.
- Goldner T., Hewlett G., Ettischer N., Ruebsamen-Schaeff H., Zimmermann H., Lischka P. The novel anticytomegalovirus compound AIC246 (letermovir) inhibits human cytomegalovirus replication through a specific antiviral mechanism that involves the viral terminase. J. Virol. 2011; 85(20): 10884–93. https://doi.org/10.1128/jvi.05265-11
- Neuber S., Wagner K., Goldner T., Lischka P., Steinbrueck L., Messerle M., et al. Mutual interplay between the human cytomegalovirus terminase subunits pUL51, pUL56, and pUL89 promotes terminase complex formation. J. Virol. 2017; 91(12): e02384-16. https://doi.org/10.1128/jvi.02384-16
- Piret J., Boivin G. Clinical development of letermovir and maribavir: Overview of human cytomegalovirus drug resistance. Antiviral. Res. 2019; 163: 91–105. https://doi.org/10.1016/j.antiviral.2019.01.011
- Lin A., Maloy M., Su Y., Bhatt V., DeRespiris L., Griffin M., et al. Letermovir for primary and secondary cytomegalovirus prevention in allogeneic hematopoietic cell transplant recipients: Real-world experience. Transpl. Infect. Dis. 2019; 21(6): 1–6. https://doi.org/10.1111/tid.13187
- Avery R.K., Alain S., Alexander B.D., Blumberg E.A., Chemaly R.F., Cordonnier C., et al. Maribavir for refractory cytomegalovirus infections with or without resistance post-transplant: results from a phase 3 randomized clinical trial. Clin. Infect. Dis. 2022; 75(4): 690–701. https://doi.org/10.1093/cid/ciab988
- Williams S.L., Hartline C.B., Kushner N.L., Harden E.A., Bidanset D.J., Drach J.C., et al. In vitro activities of benzimidazole D- and L-ribonucleosides against herpesviruses. Antimicrob. Agents Chemother. 2003; 47(7): 2186–92. https://doi.org/10.1128/aac.47.7.2186-2192.2003
- Shannon-Lowe C.D., Emery V.C. The effects of maribavir on the autophosphorylation of ganciclovir resistant mutants of the cytomegalovirus {UL}97 protein. Herpesviridae. 2010; 1(1): 4. https://doi.org/10.1186/2042-4280-1-4
- Sharma M., Bender B.J., Kamil J.P., Lye M.F., Pesola J.M., Reim N.I., et al. Human cytomegalovirus UL97 phosphorylates the viral nuclear egress complex. J. Virol. 2015; 89(1): 523–34. https://doi.org/10.1128/jvi.02426-14
- Chou S., Marousek G.I., Van Wechel L.C., Li S., Weinberg A. Growth and drug resistance phenotypes resulting from cytomegalovirus DNA polymerase region III mutations observed in clinical specimens. Antimicrob. Agents Chemother. 2007; 51(11): 4160–2. https://doi.org/10.1128/aac.00736-07
- O’Brien M.S., Markovich K.C., Selleseth D., DeVita A.V., Sethna P., Gentry B.G. In vitro evaluation of current and novel antivirals in combination against human cytomegalovirus. Antiviral. Res. 2018; 158: 255–63. https://doi.org/10.1016/j.antiviral.2018.08.015
- Chou S.W. Cytomegalovirus drug resistance and clinical implications. Transpl. Infect. Dis. 2001; 3(Suppl. 2): 20–4. https://doi.org/10.1034/j.1399-3062.2001.00004.x
- Jabs D.A., Enger C., Dunn J.P., Forman M., Hubbard L. Cytomegalovirus retinitis and viral resistance: 3. Culture results. Am. J. Ophthalmol. 1998; 126(4): 543–9. https://doi.org/10.1016/s0002-9394(98)00134-2
- Yu U., Wang X., Zhang X., Wang C., Yang C., Zhou X., et al. Cytomegalovirus infection and the implications of drug-resistant mutations in pediatric allogeneic hematopoietic stem cell transplant recipients: a retrospective study from a tertiary hospital in China. Infect. Dis. Ther. 2021; 10(3): 1309–22. https://doi.org/10.1007/s40121-021-00452-4
- Chou S. Approach to drug-resistant cytomegalovirus in transplant recipients. Curr. Opin. Infect. Dis. 2015; 28(4): 293–9. https://doi.org/10.1097/qco.0000000000000170
- Eckle T., Lang P., Prix L., Jahn G., Klingebiel T., Handgretinger R., et al. Rapid development of ganciclovir-resistant cytomegalovirus infection in children after allogeneic stem cell transplantation in the early phase of immune cell recovery. Bone Marrow Transplant. 2002; 30(7): 433–9. https://doi.org/10.1038/sj.bmt.1703666
- Wolf D.G., Yaniv I., Honigman A., Kassis I., Schonfeld T., Ashkenazi S. Early emergence of ganciclovir-resistant human cytomegalovirus strains in children with primary combined immunodeficiency. J. Infect. Dis. 1998; 178(2): 535–8. https://doi.org/10.1086/517468
- Littler E., Stuart A., Chee M. Human cytomegalovirus UL97 open reading frame encodes a protein that phosphorylates the antiviral nucleoside analogue ganciclovir. Nature. 1992; 358(6382): 160–2. https://doi.org/10.1038/358160a0
- Kleiboeker S., Nutt J., Schindel B., Dannehl J., Hester J. Cytomegalovirus antiviral resistance: Characterization of results from clinical specimens. Transpl. Infect. Dis. 2014; 16(4): 561–7. https://doi.org/10.1111/tid.12241
- Chou S. Advances in the genotypic diagnosis of cytomegalovirus antiviral drug resistance. Antiviral. Res. 2020; 176: 104711. https://doi.org/10.1016/j.antiviral.2020.104711
- Campos A.B., Ribeiro J., Pinho Vaz C., Campilho F., Branca R., Campos A., et al. Genotypic resistance of cytomegalovirus to antivirals in hematopoietic stem cell transplant recipients from Portugal: A retrospective study. Antiviral. Res. 2017; 138: 86–92. https://doi.org/10.1016/j.antiviral.2016.10.016
- Chen H., Beardsley G.P., Coen D.M. Mechanism of ganciclovir-induced chain termination revealed by resistant viral polymerase mutants with reduced exonuclease activity. Proc. Natl Acad. Sci. USA. 2014; 111(49): 17462–7. https://doi.org/10.1073/pnas.1405981111
- Chou S., Marousek G.I. Accelerated evolution of maribavir resistance in a cytomegalovirus exonuclease domain II mutant. J. Virol. 2008; 82(1): 246–53. https://doi.org/10.1128/jvi.01787-07
- Houldcroft C.J., Bryant J.M., Depledge D.P., Margetts B.K., Simmonds J., Nicolaou S., et al. Detection of low frequency multi-drug resistance and novel putative maribavir resistance in immunocompromised pediatric patients with cytomegalovirus. Front. Microbiol. 2016; 7: 1317. https://doi.org/10.3389/fmicb.2016.01317
- Chou S., Satterwhite L.E., Ercolani R.J. New locus of drug resistance in the human cytomegalovirus UL56 gene revealed by in vitro exposure to letermovir and ganciclovir. Antimicrob. Agents Chemother. 2018; 62(9): e00922-18. https://doi.org/10.1128/aac.00922-18
- Agut H., Collandre H., Aubin J.T., Guétard D., Favier V., Ingrand D., et al. In vitro sensitivity of human herpesvirus-6 to antiviral drugs. Res. Virol. 1989; 140(3): 219–28. https://doi.org/10.1016/s0923-2516(89)80099-8
- Manichanh C., Grenot P., Gautheret-Dejean A., Debré P., Huraux J.M., Agut H. Susceptibility of human herpesvirus 6 to antiviral compounds by flow cytometry analysis. Cytometry. 2000; 40(2): 135–40. https://doi.org/10.1002/(sici)1097-0320(20000601)40:2%3C135::aid-cyto7%3E3.0.co;2-h
- De Clercq E., Naesens L., De Bolle L., Schols D., Zhang Y., Neyts J. Antiviral agents active against human. Rev. Med. Virol. 2001; 11(6): 381–95. https://doi.org/10.1002/rmv.336
- Kotton C.N., Kumar D., Caliendo A.M., Huprikar S., Chou S., Danziger-Isakov L., et al. The third international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation. 2018; 102(6): 900–31. https://doi.org/10.1097/tp.0000000000002191
- Sahoo M.K., Lefterova M.I., Yamamoto F., Waggoner J.J., Chou S., Holmes S.P., et al. Detection of cytomegalovirus drug resistance mutations by next-Generation sequencing. J. Clin. Microbiol. 2013; 51(11): 3700–10. https://doi.org/10.1128/jcm.01605-13
- Andrei G., Van Loon E., Lerut E., Victoor J., Meijers B., Bammens B., et al. Persistent primary cytomegalovirus infection in a kidney transplant recipient: Multi-drug resistant and compartmentalized infection leading to graft loss. Antiviral. Res. 2019; 168: 203–9. https://doi.org/10.1016/j.antiviral.2019.06.004
- De Bolle L., Naesens L., De Clercq E. Update on human herpesvirus 6 biology, clinical features, and therapy. Clin. Microbiol. Rev. 2005; 18(1): 217–45. https://doi.org/10.1128/cmr.18.1.217-245.2005
- Humar A., Malkan G., Moussa G., Greig P., Levy G., Mazzulli T. Human herpesvirus-6 is associated with cytomegalovirus reactivation in liver transplant recipients. J. Infect. Dis. 2000; 181(4): 1450–3. https://doi.org/10.1086/315391
- Isegawa Y., Hara J., Amo K., Osugi Y., Takemoto M., Yamanishi K., et al. Human herpesvirus 6 ganciclovir-resistant strain with amino acid substitutions associated with the death of an allogeneic stem cell transplant recipient. J. Clin. Virol. 2009; 44(1): 15–9. https://doi.org/10.1016/j.jcv.2008.09.002
- Baldwin K. Ganciclovir-resistant Human herpesvirus-6 encephalitis in a liver transplant patient: A case report. J. Neurovirol. 2011; 17(2): 193–5. https://doi.org/10.1007/s13365-011-0019-4
- Bounaadja L., Piret J., Goyette N., Boivin G. Analysis of HHV-6 mutations in solid organ transplant recipients at the onset of cytomegalovirus disease and following treatment with intravenous ganciclovir or oral valganciclovir. J. Clin. Virol. 2013; 58(1): 279–82. https://doi.org/10.1016/j.jcv.2013.06.024
- Safronetz D., Petric M., Tellier R., Parvez B., Tipples G.A. Mapping ganciclovir resistance in the human herpesvirus-6 U69 protein kinase. J. Med. Virol. 2003; 71(3): 434–9. https://doi.org/10.1002/jmv.10510
Дополнительные файлы