Сравнительная характеристика завозных случаев классической и геморрагической форм лихорадки денге в 2009–2019 гг.
- Авторы: Сайфуллин М.А.1,2, Зверева Н.Н.1, Карань Л.С.3, Григорьева Я.Е.3, Акиншина Ю.А.2,4, Ларичев В.Ф.2, Шамшева О.В.1, Базарова М.В.5, Сметанина С.В.5
-
Учреждения:
- ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- ФБУН ЦНИИ Эпидемиологии Роспотребнадзора
- ЗАО «ЭКОЛаб»
- ГБУЗ «Инфекционная клиническая больница № 1 Департамента здравоохранения г. Москвы»
- Выпуск: Том 67, № 4 (2022)
- Страницы: 322-330
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/634
- DOI: https://doi.org/10.36233/0507-4088-126
- ID: 634
Цитировать
Аннотация
Введение. В России в качестве статистической системы учёта заболеваний законодательно утверждена Международная классификация болезней 10-го пересмотра (МКБ-10), предусматривающая выделение двух форм лихорадки денге – классической и геморрагической (ГЛД). В открытых источниках официальных статистических данных о соотношении форм заболевания не публикуется. Недостаточность сведений о реальном соотношении форм лихорадки денге затрудняет возможность объективной оценки факторов, обусловливающих тяжесть этого заболевания.
Цель – оценка клинико-эпидемиологических особенностей классической и геморрагической лихорадки денге у больных, госпитализированных в 2009–2019 гг. в Инфекционную клиническую больницу № 1 г. Москвы.
Материалы и методы. Проведено ретроспективное когортное исследование: проанализирована база данных госпитализированных больных, 391 медицинская карта пациентов с диагнозом «лихорадка денге». Оценивались половые, возрастные характеристики, география поездок с учётом предшествующих визитов пациентов в эндемичные регионы, серотип вируса денге. Для определения первичной и повторной инфекции проведён анализ показателей IgG к вирусу денге на 1–5-е сутки заболевания. Для сравнения показателей рассчитывали 95% доверительные интервалы для долей, медианы и интерквартильный размах. Значимость различий между независимыми выборками для оценки качественных характеристик осуществляли при помощи критериев χ2, отношения шансов, для оценки количественных характеристик – критерия Манна–Уитни. Различия считали статистически значимыми при р ≤ 0,05.
Результаты. Доля больных лихорадкой денге составила 14,9% от всех госпитализированных с лихорадочными заболеваниями, развившимися после международных поездок. ГЛД диагностирована у 15,7% больных лихорадкой денге. Значимо чаще ГЛД развивалась у женщин, а также у лиц после повторного посещения эндемичных регионов. Но ГЛД также была диагностирована у 10,9% лиц, впервые посещавших тропические страны. Мы не установили значимых различий развития ГЛД в зависимости от возраста и серотипа вируса денге. У ряда пациентов, ранее не выезжавших в эндемичные регионы, были обнаружены IgG к вирусу денге, что может свидетельствовать о предшествующем инфицировании родственными флавивирусами.
Заключение. Установлено, что в наиболее посещаемых россиянами регионах имеет место циркуляция всех серотипов вируса денге с ежегодной сменой преобладающего серотипа.
Ключевые слова
Полный текст
Введение
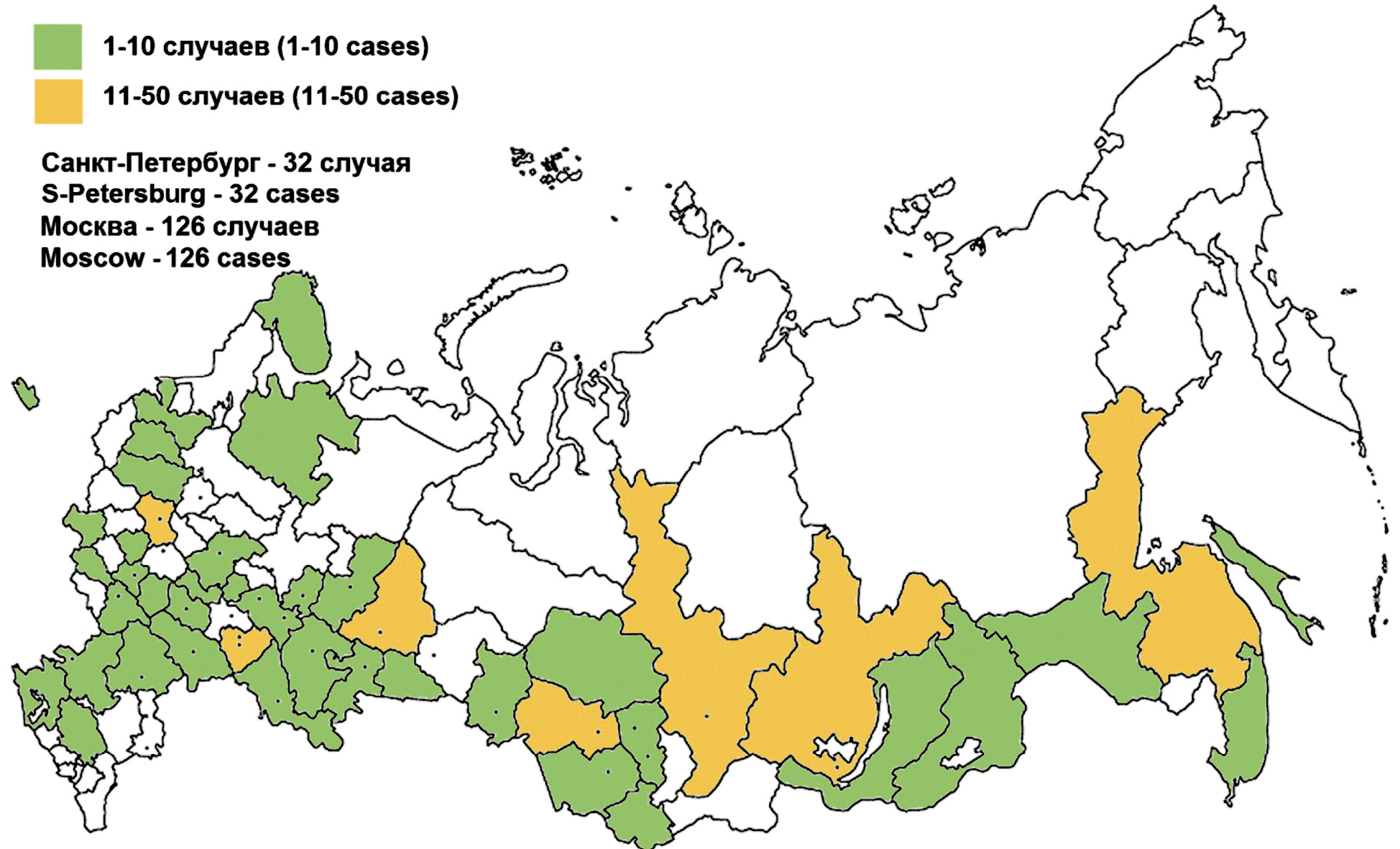
Первый завозной случай лихорадки денге (ЛД) в Российской Федерации был зарегистрирован в 2002 г. [1]. Единичные импортированные случаи были верифицированы в последующие 10 лет. После введения в 2012 г. официальной регистрации ЛД за 9 лет было установлено 1618 случаев заболевания. В 2019 г. 415 случаев ЛД наблюдались в 48 из 85 субъектов Российской Федерации, из них 126 (30,4%) в Москве [2] (рис. 1).
Рис. 1. Заболеваемость лихорадкой денге в субъектах Российской Федерации в 2019 г. (по данным Роспотребнадзора).
В России в качестве статистической системы учёта заболеваний законодательно утверждена1 Международная классификация болезней 10-го пересмотра (МКБ-10), предусматривающая выделение двух форм ЛД – классической (КЛД, А90) и геморрагической (ГЛД, А91). В открытых источниках официальных статистических данных о соотношении форм заболевания не публикуется. Информация о случаях ГЛД в России, в том числе о двух летальных в Москве и Новосибирске, представлена в научных публикациях [3–7]. Недостаточность сведений о реальном соотношении форм ЛД затрудняет возможность объективной оценки факторов, обусловливающих тяжесть этой инфекции. При оказании медицинской помощи больным ЛД рекомендованный Всемирной организацией здравоохранения (ВОЗ) стандартный турникет-тест [5, 7] используется не всегда или же он заменяется на нестандартизированные провокационные пробы [7, 8].
Развитие ГЛД обычно связывают с антителозависимым усилением инфекции (АЗУИ), согласно концепции С. Холстеда развивающимся при вторичной гетерологичной инфекции денге или первичной инфекции у людей, пассивно получивших специфические антитела, в том числе у младенцев, родившихся от серопозитивных матерей [9, 10]. Описанные в литературе случаи повторного заражения гомологичным вирусом денге [11] не выглядят убедительными и требуют дальнейших исследований. Положение о развитии ГЛД при повторном заражении заложено и в клинических рекомендациях «Лихорадка денге у взрослых», опубликованных в 2014 г. [12]. Помимо этого, в настоящее время рассматриваются и другие факторы развития ГЛД: отдельные серотипы DENV [13–15], пол, раса, генетические особенности человека [16–18]. Таким образом, в основе тяжёлых форм заболевания могут лежать различные причины, возможно, приводящие к высокой виремии, высвобождению воспалительных цитокинов, поражению эндотелия, что может определять тяжесть и прогноз заболевания [10, 19, 20].
Цель нашей работы заключалась в оценке клинико-эпидемиологических особенностей КЛД и ГЛД у больных, госпитализированных в 2009–2019 гг. в Инфекционную клиническую больницу № 1 (ИКБ № 1) г. Москвы.
Материалы и методы
Дизайн исследования: ретроспективное когортное исследование.
Материалы: База данных пациентов (создана авторами на платформе MS Access). Медицинские карты пациентов, госпитализированных в ИКБ № 1 с 2009 по 2019 г.
Критерии включения: Медицинские карты пациентов, госпитализированных в ИКБ № 1 с развитием заболевания в течение 21 дня после выезда за границу России. Из этой группы были отобраны карты пациентов с лабораторно подтверждённым диагнозом ЛД. Исследование проводилось при информированном согласии пациентов2. Протокол исследования одобрен Этическим комитетом НИИ вирусологии им. Д.И. Ивановского Минздрава России (протокол №1 заседания от 20.03.2014).
Методы специфической диагностики: Антитела класса М к вирусу денге выявляли при помощи зарегистрированного в России набора реагентов для дифференциального определения IgM-антител к вирусам Зика, денге, Западного Нила и чикунгунья в сыворотке крови человека методом иммуноферментного анализа (ИФА) «ИФА-IgM Зика, денге, ЗН, Чик». Тест-система позволяет выявлять группоспецифические антитела ко всем четырём серотипам вируса денге. Специфические IgG к вирусу денге выявляли с использованием экспериментального набора ИФА-IgG лаборатории биологии и индикации арбовирусов Национальный исследовательский центр эпидемиологии и микробиологии (НИЦЭМ) имени почетного академика Н.Ф. Гамалеи.
Выявление рибонуклеиновой кислоты вируса денге и определение типа вируса проводили с использованием экспериментальных и впоследствии зарегистрированных наборов реагентов «АмплиСенс Dengue virus-FL» и «АмплиСенс Dengue virus type-Fl» (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва).
Диагноз ГЛД устанавливался на основании критериев ВОЗ 1997 г. [20]. При этом учитывались возраст больных, пол, посещение эндемичных по ЛД регионов, контакты с комарами, наличие специфических IgG в первые 5 дней от начала заболевания, результаты генотипирования вируса денге.
Статистическую обработку проводили с помощью программ MS Excel и IBM SPSS Statistics 23.0. Рассчитывали 95% доверительные интервалы (ДИ) для долей на основе bootstrap. Оценку распределения данных делали при помощи критериев Шапиро–Уилка и Колмогорова–Смирнова. Для непараметрических показателей рассчитывались медиана и интерквартильный размах. Проверку гипотезы о значимости различий между независимыми выборками осуществляли при помощи критериев χ2, отношение шансов (OR) применяли для оценки качественных характеристик, U-критерий Манна–Уитни, Краскела–Уоллиса – для оценки количественных характеристик. Различия считали статистически значимыми при р ≤ 0,05.
Результаты
Общая характеристика больных
За период 2009–2019 гг. в ИКБ № 1 было отобрано 2632 медицинские карты пациентов с лихорадочными заболеваниями, развившимися в течение 21 дня после посещения зарубежных стран. У 391 из них (14,9%) был установлен диагноз ЛД, в том числе КЛД у 330 (84,3%), ГЛД I–II степени у 57 (14,6%), ГЛД III–IV степени у 4 (1,1%). Среди больных ЛД было 208 (53,2%) женщин.
В течение последних 10 лет отмечалась ежегодная стабильная регистрация по 20–40 завозных случаев ЛД, однако в 2019 г. произошёл значительный рост числа больных, что, вероятно, связанно с повышением заболеваемости в ряде стран Юго-Восточной Азии, а также увеличением на 18,9% числа выездов россиян в зарубежные страны в сравнении с прошлыми годами3. В различные годы наблюдения соотношение числа случаев ГЛД и КЛД составляло от 0 до 33,3%, ГЛД выявлена у 15,7% от общего числа больных (рис. 2).
Рис. 2. Число случаев лихорадки денге, диагностированных в Инфекционной клинической больнице № 1 г. Москвы в 2009–2019 гг.
Возраст пациентов составил от 1 до 65 лет с медианой 30 лет [26; 38], среди них было 16 (4,1%) детей в возрасте 1–18 лет, из них ГЛД установлена у одной девочки 9 лет. Медиана возраста у больных КЛД составила 30 лет [26; 37], больных ГЛД – 31 год [26; 38]. (pU > 0,05). ГЛД диагностирована у одного ребенка. В связи с малым количеством наблюдений в детской группе статистический анализ различий частоты ГЛД между детьми и взрослыми не проводился.
Среди больных ГЛД отмечалось значительное преобладание женщин – 43 (70,5%; 95% ДИ 58,7–81,4), тогда как в группе КЛД женщин было 165 (50%; 95% ДИ 43,8–54,5), pχ2 = 0,003, OR = 2,45 (95% ДИ 1,4–4,4).
Больные ЛД поступали в стационар в течение всего года, значительно чаще в январе (15,3%), реже – в октябре (3,8%).
113 (28,4%) больных были госпитализированы на 1–3-и сутки от начала заболевания, 215 (55%) – на 4–6-е, 52 (13,3%) – на 7–9-е и 11 (2,8%) – на 10-е сутки и более от момента появления первых симптомов заболевания.
Ассоциация случаев заражения с посещением эндемичных регионов
Нами установлена причинная связь заболевания с поездками в 23 тропические страны: 373 (95,4%) были связаны с посещением Юго-Восточной и Южной Азии, в том числе Таиланда – 223 (57%), Индонезии – 68 (17,4%), Вьетнама – 36 (9,2%), Мальдивской Республики – 15 (3,8%), Индии – 13 (3,3%). В странах Западного полушария инфицировались 12 (3,1%) человек, в том числе 7 – в Доминиканской Республике, 6 (1,5%) – в странах Африки.
Укусы комаров во время поездок отмечали 277 (70,8%) больных, 60 (15,3%) отрицали контакты с любыми насекомыми, 54 (13,8%) отмечали наличие комаров, но не были уверены в нанесённых ими укусах.
Длительность пребывания в эндемичном регионе, установленная в 360 случаях, варьировала от 3 дней до 2 лет: у 86 (23,8%) – от 3 до 10 дней, у 234 (65%) – 11–20 дней, у 26 (7,2%) – 21–30 дней, и 14 (3,9%) пациентов сообщили о более длительном или постоянном проживании, медиана продолжительности пребывания в эндемичном районе составила 15 дней [11; 16].
Среди общего числа больных 382 (97,6%) имели российское гражданство, 155 (39,6%) посетили тропические регионы впервые, 161 (41,1%) выезжали повторно, в том числе это были граждане Индии (2), Вьетнама (4), Анголы, Перу, Таиланда (по одному). Указание на ранее перенесённую ЛД было у двоих граждан Вьетнама. У 75 (19,2%) пациентов не было анамнестических сведений о поездках, достаточных для оценки.
После первичного посещения эндемичного региона ГЛД развилась у 18 пациентов из 173 (10,9%), при повторном посещении – у 35 из 161 (22,3%), pχ = 0,007, OR = 2,34 (95% ДИ 1,26–4,8) (табл. 1).
Таблица 1. Частота развития классической и геморрагической форм лихорадки денге в зависимости от кратности посещения эндемичных регионов
Table 1. The frequency of development of DF and DHF depending on the frequency of visits to endemic regions
Диагноз Diagnosis | Количество (%; 95% ДИ) Visit count (%; 95% CI) | |
Первичное посещение First visit | Повторное посещение Return visit | |
Классическая Dengue fever (DF) | 138 (89,1%; 84,3–93,7) | 126 (77,6%; 71,3–83,6) |
Геморрагическая Dengue Hemorrhagic fever (DHF) | 17 (10,9%; 6,3–15,7) | 35 (22,4%; 16,4–28,7) |
Максимальный инкубационный период заболевания составил 14–15 суток (определялся сроками появления первых симптомов после возвращения в Россию), минимальные и средние сроки инкубации в связи с отсутствием установленной связи между укусами комаров и сроками начала заболевания определить не удалось.
Показатели специфических IgM- и IgG-антител у больных лихорадкой денге
Методами ИФА IgM и ИФА IgG с четырёхвалентным антигеном вируса денге были обследованы 26 сывороток, взятых на 2–5-е сутки от начала заболевания (у 22 от пациентов с КЛД, у 4 – с ГЛД). Во всех пробах были обнаружены IgM в диагностических титрах, 1 : 100 – 1 : 6400. IgG выявлялись у 9 человек (34,6%): 3 больных ГЛД и 6 (27,3%) – КЛД. У 5 из них (3 – ГЛД, 2 – КЛД) в анамнезе отсутствовали данные о предыдущих выездах в эндемичные регионы (табл. 2). Из 17 IgG-негативных пациентов ГЛД развилась у одной женщины, ранее посещавшей эндемичные регионы.
Таблица 2. Значение фактора наличия специфических IgG-антител в ранний период заболевания (2–5 суток)
Table 2. The value of the factor of the presence of specific IgG antibodies in the early period of the disease (2–5 days)
Пол, возраст Gender, Age | Повторное посещение эндемичного региона Return visit in endemic region | Форма заболевания Diagnosis | День болезни Diseases day | Обратная величина титра Reciprocal value of the titer | |
IgG | IgM | ||||
Ж (F), 36 | Да (Yes) | КЛД (DF) | 2 | 1600 | 200 |
М (M), 41 | Да (Yes) | КЛД (DF) | 3 | 100 | 100 |
Ж (F), 29 | Нет (No) | ГЛД (DHF) | 4 | 100 | 100 |
Ж (F), 26 | Нет (No) | КЛД (DF) | 5 | 200 | 100 |
Ж (F), 20 | Нет (No) | КЛД (DF) | 5 | 3200 | 100 |
Ж (F), 27 | Нет (No) | ГЛД (DHF) | 5 | 200 | 800 |
М (M), 31 | Да (Yes) | КЛД (DF) | 5 | 12 800 | 800 |
Ж (F), 23 | Нет (No) | ГЛД (DHF) | 5 | 100 | 1600 |
М (M), 30 | Да (Yes) | КЛД (DF) | 5 | 100 | 6400 |
Зависимость формы заболевания от серотипа вируса
В результате обследования плазмы крови 246 пациентов методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) у 244 был установлен серотип вируса: DENV-1 – 121 (49,5%), DENV-2 – 77 (31,5%), DENV-3 – 30 (12,3%), DENV-4 – 15 (6,1%); у одного пациента была обнаружена коинфекция DENV-1 и DENV-2. У двух пациентов, госпитализированных на 4-е (ГЛД) и 8-е (КЛД) сутки заболевания, результат ПЦР-исследования был отрицательным. В различные годы соотношение вариантов значительно варьировало с преобладанием DENV-1 или DENV-2.
Каждый из серотипов вируса денге вызывал обе формы заболевания, однако в соотношении его форм имелись различия: наибольшая доля ГЛД приходилась на DENV-3 (табл. 3), статистически значимых различий зависимости долей ГЛД при различных серотипах вируса нами не установлено (pkw = 0,1). Этиологического значения вирусов денге в развитии первичных и вторичных случаев ЛД также не установлено.
Таблица 3. Соотношение случаев классической и геморрагической денге при инфицировании различными серотипами
Table 3. The ratio of cases of DF and DHF infected of different DENV serotypes (count, percent, 95%CI)
Диагноз Diagnosis | Количество случаев (%, 95% ДИ) Case count (%, 95% CI) | |||
DENV-1 | DENV-2 | DENV-3 | DENV-4 | |
Классическая Dengue fever (DF) | 19 (15,6%; 9,7–21,9) | 10 (12,1%; 5,5–20,6) | 9 (30,0%; 14,8–48,1 | 1 (6,7%; 0–22,7) |
Геморрагическая Hemorrhagic Dengue fever (DHF) | 103 (84,4%; 78,1–90,3) | 68 (87,9%; 79,4–89,5) | 21 (70%; 51,9–85,2) | 14 (93,3%; 77,3–100) |
Соотношение форм заболевания после возвращения из гиперэндемичных районов Юго-Восточной Азии
ГЛД была диагностирована после посещения 9 стран, при этом 31 случай (51%) после поездки в Таиланд, 12 (19,6%) – в Индонезию, 7 (11,5%) – во Вьетнам, 5 (8,2%) – в Мальдивскую Республику. Единичные завозы были из Индии, Мьянмы, Перу, Доминиканской Республики. Таком образом, 96,7% ГЛД были зарегистрированы после посещения стран Южной и Юго-Восточной Азии. Доля ГЛД в странах с 10 заболевшими и более составляла от 13,9% (95% ДИ 9,5–18,9) в Таиланде до 19,4% (95% ДИ 7,5–33,3) во Вьетнаме. ГЛД, помимо прочего, была диагностирована у двух граждан Вьетнама, ранее перенесших ЛД. Статистически значимых различий в соотношении форм заболевания между странами с количеством заболевших более 10 человек мы не установили (pχ2 = 0,221).
Этиологическое значение серотипа DENV-1 было установлено в 49,5% случаев, вместе с тем в различных гиперэндемичных странах его доля колебалась от 33,3 до 68,0%, при этом во всех странах с 10 и более госпитализированными пациентами выявлялись все 4 серотипа в различных соотношениях (рис. 3).
Рис. 3. Соотношение серотипов вируса денге у больных, прибывших из Таиланда, Индонезии и Вьетнама.
Многолетние наблюдения за госпитализированными пациентами, вернувшимися из Таиланда, показали, что доминирующее значение серотипов из одного и того же региона носило непостоянный характер: значительное преобладание циркуляции DENV-1 наблюдалось в 2013 и 2019 гг., в 2014 г.– DENV-3, в 2018 г. – DENV-2 (рис. 4).
Рис. 4. Соотношение серотипов вируса денге у пациентов, инфицированных в Таиланде в 2013–2019 гг.
Обсуждение
До возникновения пандемии COVID-19 в России отмечалась стойкая тенденция к росту числа верифицированных завозных случаев ЛД. За 10 лет наблюдений количество случаев этой инфекции увеличилось от единичных до превышающих показатели ряда эндемичных для России природно- очаговых инфекций. Данная тенденция была связана с возрастанием международного туризма, а также внедрением в практику методов специфической диагностики. Завозной характер случаев ЛД, в отличие от эндемичных регионов, предопределяет такие особенности этой инфекции в России, как сезонность, возрастной состав заболевших, значительно меньшую долю детей, сравнительную редкость случаев неблагоприятного течения болезни (два летальных случая за всё время наблюдений). Известно, что первичное заражение одним из четырёх вирусов денге приводит, как правило, к развитию классической формы заболевания. Однако мы наблюдали летальный случай после первого посещения эндемичного по ЛД региона [2].
По нашим данным, повторное посещение эндемичного региона является фактором повышенного риска развития ГЛД, в большинстве случаев характеризующейся снижением количества тромбоцитов, положительным турникет-тестом и (или) самостоятельно прекращающимися лёгкими спонтанными кровотечениями. В пользу патогенетического значения антителозависимого усиления инфекции при ГЛД свидетельствует большая частота обнаружения IgG у пациентов на ранних сроках заболевания. Для статистически обоснованных выводов по этому вопросу требуется проведение дополнительных исследований. Тем не менее отсутствие IgG у одного пациента с ГЛД в начальном периоде болезни может свидетельствовать о первичной инфекции. Наличие группоспецифических IgG на ранних сроках заболевания у не выезжавших в эндемичные регионы может быть связано с предшествующим инфицированием родственными флавивирусами (Западного Нила, клещевого энцефалита и др.) или вакцинацией против клещевого энцефалита.
Нами не установлена зависимость формы заболевания от конкретного серотипа DENV, но продемонстрирована циркуляция всех четырех серотипов в гиперэндемичных, наиболее популярных среди российских туристов странах. Кроме того, установлено, что в регионах, эндемичных по ЛД, происходит постоянное изменение соотношения активности циркуляции различных вирусов денге, что не исключает возможности повторного заражения гетерологичным вирусом при повторном посещении той же географической территории. Поэтому перед последующими поездками реконвалесценты денге в обязательном порядке должны быть уведомлены о возможных рисках, необходимых превентивных мерах профилактики и немедленном обращении за медицинской помощью при любом лихорадочном заболевании, развившемся во время или в течение двух недель после поездки в эндемичные регионы.
Выводы
Установлено, что женщины в большей степени подвержены риску заболевания геморрагической формой ЛД, что соответствует результатам предшествующих исследований.
Повторное посещение эндемичных регионов повышает риск развития ГЛД, однако данная форма заболевания может наблюдаться и у лиц после первичного посещения эндемичных тропических стран.
Обнаружение гетерологичных IgG в ранние сроки заболевания у лиц, не посещавших эндемичные по ЛД регионы, вероятно, может быть результатом ранее предшествующего инфицирования родственными вирусами или вакцинацией.
Ограничения исследования
В связи с тем, что исследование было ретроспективным и мы проводили работу с документированными данными, сроки забора клинического материала у госпитализированных пациентов не были достаточно стандартизированы. У небольшой части пациентов из-за поздних сроков обращения и госпитализации в исследованиях было ограничено количество биологического материала, полученного в первые сутки заболевания.
1Приказ Министерства здравоохранения РФ от 27 мая 1997 г. № 170 «О переходе органов и учреждений здравоохранения Российской Федерации на Международную статистическую классификацию болезней и проблем, связанных со здоровьем, X пересмотра».
2Стандартная форма согласия на малоинвазивные манипуляции, забор биологического материала и обработку персональных данных оформлялась при госпитализации пациента.
Об авторах
Мухаммад Абдулфаритович Сайфуллин
ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России; ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0003-1058-3193
Россия, 117997, г. Москва; 125367, г. Москва
Надежда Н. Зверева
ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0003-2699-0439
Россия, 117997, г. Москва
Людмила С. Карань
ФБУН ЦНИИ Эпидемиологии Роспотребнадзора
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0002-5927-460X
Россия, 111123, г. Москва
Яна Е. Григорьева
ФБУН ЦНИИ Эпидемиологии Роспотребнадзора
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0001-9016-9923
Россия, 111123, г. Москва
Юлия А. Акиншина
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России; ЗАО «ЭКОЛаб»
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0002-9223-3455
Россия, 125367, г. Москва; 142530, Московская обл., г. Электрогорск
Виктор Ф. Ларичев
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0001-8262-5650
Россия, 125367, г. Москва
Ольга В. Шамшева
ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0002-6033-6695
Россия, 117997, г. Москва
Марина В. Базарова
ГБУЗ «Инфекционная клиническая больница № 1 Департамента здравоохранения г. Москвы»
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0001-7322-7896
Россия, 125310, г. Москва
Светлана В. Сметанина
ГБУЗ «Инфекционная клиническая больница № 1 Департамента здравоохранения г. Москвы»
Email: dr_saifullin@mail.ru
ORCID iD: 0000-0003-3763-697X
Россия, 125310, г. Москва
Список литературы
- Ларичев В.Ф., Сайфуллин М.А., Акиншина Ю.А., Хуторецкая Н.В., Бутенко А.М. Завозные случаи арбовирусных инфекций в Российской Федерации. Эпидемиология и инфекционные болезни. 2012; (1): 35–8.
- Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 году». М.; 2021.
- Сайфуллин М.А., Келли Е.И., Базарова М.В., Ларичев В.Ф., Карань Л.С., Акиншина Ю.А. и др. Случай лихорадки денге с летальным исходом. Эпидемиология и инфекционные болезни. 2015; 20(2): 49–51.
- Дьячков А.Г., Лиознов Д.А., Дорошкевич В.В. Случай геморрагической лихорадки, вызванный вирусом денге. Журнал инфектологии. 2013; 5(3): 71–3. https://doi.org/10.22625/2072-6732-2013-5-3-71-73
- Сафонов А.Д. Случай завоза геморрагической лихорадки денге в Омск. Эпидемиология и инфекционные болезни. 2012; (1): 49–51.
- Надеев А.П., Мальцева Ю.Г., Шишкина Е.Ю., Поротникова Е.В., Хохлова Н.И. Лихорадка денге с летальным исходом. Архив патологии. 2020; 82(1): 52–5. https://doi.org/10.17116/patol20208201152
- Нечаев В.В., Яровая И.И., Каченя Г.В., Догужиева Е.В., Бунтовская С.С., Егорихина А.Д. и др. Клинико-эпидемиологическая характеристика завозной тропической лихорадки денге. Журнал инфектологии. 2021; 13(1): 78–85. https://doi.org/10.22625/2072-6732-2021-13-1-78-85
- Хохлова Н.И., Краснова Е.И., Позднякова Л.Л. Клиническая и лабораторная диагностика лихорадки денге у туристов. Журнал инфектологии. 2015; 7(1): 65–9. https://doi.org/10.22625/2072-6732-2015-7-1-65-69
- ВОЗ. Информационный бюллетень. Денге и тяжелая денге. Available at: https://www.who.int/ru/news-room/fact-sheets/detail/dengue-and-severe-dengue
- Halstead S. Recent advances in understanding dengue. F1000Res. 2019; 8: F1000 Faculty Rev-1279. https://doi.org/10.12688/f1000research.19197.1
- Waggoner J.J., Balmaseda A., Gresh L., Sahoo M.K., Montoya M., Wang E., et al. Homotypic dengue virus reinfections in Nicaraguan children. J. Infect. Dis. 2016; 214(7): 986–93. https://doi.org/10.1093/infdis/jiw099
- Лихорадка денге у взрослых. Клинические рекомендации. Утверждены решением Пленума правления Национального научного общества инфекционистов 30 октября 2014 года. Available at: https://nnoi.ru/uploads/files/protokoly/Lih_Denge_adult.pdf
- Holmes E.C., Twiddy S.S. The origin, emergence and evolutionary genetics of dengue virus. Infect. Genet. Evol. 2003; 3(1): 19–28. https://doi.org/10.1016/s1567-1348(03)00004-2
- Simmons C.P., Farrar J.J., Nguyen V.C., Wills B. Dengue. N. Engl. J. Med. 2012; 366(15): 1423–32. https://doi.org/10.1056/NEJMra1110265
- Huy N.T., Van Giang T., Thuy D.H., Kikuchi M., Hien T.T., Zamora J., et al. Factors associated with dengue shock syndrome: a systematic review and meta-analysis. PLoS Negl. Trop. Dis. 2013; 7(9): 2412. https://doi.org/10.1371/journal.pntd.0002412
- Николаева Л.И., Ларичев В.Ф., Сайфуллин М.А., Дедова А.В., Гришечкин А.Е., Васильев А.В. и др. Анализ возможного влияния генетических факторов пациентов на течение инфекции, вызванной вирусом лихорадки денге. Инфекционные болезни: Новости. Мнения. Обучение. 2022; 11(1): 8–14. https://doi.org/10.33029/2305-3496-2022-11-1-8-14
- Bhatt P., Sabeena S.P., Varma M., Arunkumar G. Current understanding of the pathogenesis of Dengue virus infection. Curr. Microbiol. 2021; 78(1): 17–32. https://doi.org/10.1007/s00284-020-02284-w
- Xavier-Carvalho C., Cardoso C.C., de Souza Kehdy F., Pacheco A.G., Moraes M.O. Host genetics and dengue fever. Infect. Genet. Evol. 2017; 56: 99–110. https://doi.org/10.1016/j.meegid.2017.11.009
- WHO. Dengue haemorrhagic fever: diagnosis, treatment, prevention and control. Geneva; 1997.
- Harapan H., Michie A., Sasmono R.T., Imrie A. Dengue: a minireview. Viruses. 2020; 12(8): 829. https://doi.org/10.3390/v12080829
Дополнительные файлы