Антитела против VP3 echovirus 30 (Picornaviridae: Enterovirus: Enterovirus betacoxsackie) нейтрализуют вирус in vitro
- Авторы: Новиков Д.В.1,2, Мелентьев Д.А.1,2, Талаев В.Ю.1, Новикова Н.А.1, Мохонова Е.В.1, Кашников А.Ю.1, Заиченко И.Е.1, Светлова М.В.1, Куркова Е.В.1, Бабайкина О.Н.1, Лапин В.А.1,2, Цыганова М.И.1, Зайцев Д.Е.1,2, Новиков В.В.1,2
-
Учреждения:
- ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
- ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»
- Выпуск: Том 70, № 5 (2025)
- Страницы: 477-486
- Раздел: В ПОМОЩЬ ВИРУСОЛОГУ
- URL: https://virusjour.crie.ru/jour/article/view/16802
- DOI: https://doi.org/10.36233/0507-4088-347
- EDN: https://elibrary.ru/thqkln
- ID: 16802
Цитировать
Полный текст
Аннотация
Введение. Широкая распространенность энтеровируса echovirus 30 (E30) и случаи тяжелого течения инфекции указывают на необходимость разработки средств иммунопрофилактики. В структуре поверхностного белка VP3 ряда энтеровирусов найдены эпитопы для нейтрализующих антител и Т-клеточного ответа. Однако иммуногенные свойства VP3 E30 не изучены.
Целью настоящей работы явилась характеристика иммуногенности капсидного белка VP3 E30 и изучение вируснейтрализующих свойств антител против VP3 Е30.
Материалы и методы. Рекомбинантный VP3Е30 и химерный белок SN-VP3E30, состоящий из S-региона VP1 норовируса и полноразмерного VP3 Е30, экспрессировали в Escherichia coli. SN-VP3E30 использовали для формирования вирусоподобных частиц (ВпЧ). Действие SN-VP3E30 на дендритные клетки (ДК) человека оценивали методом проточной цитофлуометрии по изменению экспрессии HLA-DR, CCR7, CD80, CD83 и CD86. Для исследования иммуногенных свойств SN-VP3E30 иммунизировали мышей линии BALB/c и морскую свинку. Титры антител и их авидность определяли методом иммуноферментного анализа. Взаимодействие антител против VP3 с вирусом Е30 изучали с помощью иммуноэлектронной микроскопии. Способность нейтрализовать вирус исследовали в культуре клеток эмбриональной рабдомиосаркомы (RD).
Результаты. Рекомбинантный VP3Е30 вызывал неполное созревание ДК человека, характеризующееся отсутствием стимуляции экспрессии хемокинового рецептора CCR7. Включение VP3 в состав химерных ВпЧ приводило к полному созреванию ДК и сильному гуморальному иммунному ответу у лабораторных животных. Антитела против VP3 характеризовались высокой авидностью, способностью вызывать агломерацию вирусных частиц in vitro и нейтрализовать вирус Е30 в культуре клеток RD.
Заключение. Полученные результаты свидетельствуют о том, что VP3 может быть использован в качестве антигена в составе субъединичной вакцины против энтеровируса Е30.
Ключевые слова
Полный текст
Введение
Echovirus 30 (E30), являющийся одним из представителей вида Enterovirus betacoxsackie (Enterovirus B), широко распространен по всему миру и представляет серьезную проблему для здравоохранения [1]. Вирус Е30 является нейротропным, инфицирование может проявляться в форме менингита реже менингоэнцефалита, энцефалита или системного заболевания. Наиболее часто E30 детектируется при вирусном менингите у детей и у лиц с ослабленным иммунитетом [2]. У инфицированных пациентов отмечаются сильные приступы мигрени, высокая температура, светобоязнь и другие клинические проявления. Обследование детей с вызванным E30 менингитом показало, что инфицирование ассоциируется с нарушениями регионарного кровотока, вероятно связанными с цереброваскулярным воспалением [3]. Энтеровирус Е30 является частой причиной вспышек и подъемов заболеваемости менингитом. В Европе в 2015–2018 гг. Е30 составил 14,5% всех подтвержденных случаев энтеровирусной инфекции [4]. Имеются сообщения о том, что Е30 генетически разнообразен. Филогенетический анализ на основе нуклеотидных последовательностей гена капсидного белка VP1 показал существование 8 монофилетических групп или линий вируса [5]. Таким образом, широкая распространенность и случаи тяжелого течения болезни указывают на необходимость разработки средств иммунопрофилактики E30-инфекции.
Вирус Е30, как и другие энтеровирусы, имеет мелкие безоболочечные вирионы, поверхность капсида которых образована тремя белками – VP1, VP2 и VP3. Взаимодействие этих белков между собой приводит к образованию участка связывания вируса с рецептором клетки. Наиболее исследованным у энтеровирусов является белок VP1, в котором обнаружено множество линейных эпитопов для нейтрализующих вирус антител. Это определяет выбор большинства исследователей в пользу VP1 для создания вакцин против энтеровирусов [6]. Свойства других поверхностных белков Е30 изучены недостаточно. На примере полиовируса было показано, что VP3 проявлял более выраженную способность к проникновению в головной мозг через гематоэнцефалический барьер по сравнению с VP1 [7]. Установлено, что VP3 Enterovirus D68 играет ключевую роль в подавлении врожденного иммунитета хозяина, блокируя синтез интерферонов I типа [8]. В структуре VP3 некоторых энтеровирусов найдены эпитопы для нейтрализующих антител [9–11] и Т-клеточного ответа [12]. Это указывает на возможность использования белка VP3 энтеровирусов в качестве антигена для разработки вакцин или терапевтической мишени. Однако иммуногенные свойства VP3 E30 не изучены.
Цель исследования – характеристика иммуногенных свойств VP3 E30.
Материалы и методы
В работе использовали нуклеотидную последовательность VP3 Echovirus 30 isolate NSW-V46-2008-ECHO30 (GenBank № MF678335.1). Для успешной экспрессии в Escherichia coli проводили оптимизацию кодонов с использованием информации, представленной в базе данных Codon usage database (http://www.kazusa.or.jp/codon/). ДНК синтезировали в ООО «Люмипроб РУС» (Россия). Рекомбинантный VP3E30 получали, как описано ранее [13]. Для повышения иммуногенности VP3 Е30 объединяли в одну молекулу с последовательностью, кодирующей S и шарнирный регионы VP1 норовируса (SN-VP3E30), как описано ранее [14]. Белок SN-VP3E30 экспрессировали в E. coli Rosetta 2 (DE3) (Novagen, США) и очищали с использованием IMAC Sepharose 6 Fast Flow (GE Healthcare, Швеция) в денатурирующих условиях. Для формирования вирусоподобных частиц (ВпЧ) проводили диализ против 1000 объемов буферного раствора, содержащего 50 мМ трис-HCl, 150 мМ NaCl, 20% сахарозы, pH 7,5. Для удаления эндотоксинов применяли Detoxi-Gel (Pierce) в соответствии с рекомендациями производителя и стерилизовали фильтрованием с диаметром пор 0,45 мкм.
Получение антисывороток. Самок 25 мышей линии BALB/c (возраст 8 нед, масса 18–20 г) дважды иммунизировали внутрибрюшинно с интервалом 2 нед. Для иммунизации 1-й группы (10 мышей) использовали 500 мкл раствора, содержащего 10 мкг белка SN-VP3E30, 50 мМ трис-HСl рН 7,5, 150 мМ NaCl и 20% глюкозы; 2-ю группу (10 мышей) иммунизировали 500 мкл раствора, содержащего 10 мкг белка SN-VP3E30, 100 мкг Al(OH)3 («ИмБио», Россия), 50 мМ трис-HСl рН 7,5, 150 мМ NaCl и 20% глюкозы. Контрольную группу (5 мышей) иммунизировали введением 500 мкл буферного раствора (50 мМ трис-HСl рН 7,5, 150 мМ NaCl и 20% глюкозы). Через 21 сут после второй иммунизации у мышей забирали кровь, готовили сыворотку крови и хранили при −70 °С.
Самку морской свинки (Cavia porcellus) (возраст 9 мес, масса 700 г) иммунизировали подкожно дважды с интервалом 2 нед. Для каждой иммунизации использовали 1 мл раствора, содержащего 500 мкг белка SN-VP3E30, 5 мг Al(OH)3, 50 мМ трис-HСl рН 7,5, 150 мМ NaCl и 20% глюкозы. Через 21 сут после второй иммунизации у животного забирали кровь, готовили сыворотку крови и хранили при −70 °С. Для получения фракции иммуноглобулинов класса G из сыворотки крови использовали метод высаливания сульфатом аммония.
Иммуноферментный анализ. Обнаружение антител против VP3 E30 и определение индекса авидности антител проводили, как описано ранее [13], с небольшими изменениями. Для обнаружения антител в сыворотке крови мыши использовали конъюгированные с пероксидазой хрена антитела козы к суммарным иммуноглобулинам мыши (ИМТЕК, Россия) и антитела против мышиных иммуноглобулинов класса M (IgM) (Elabscience, Китай). Для выявления антител против VP3 E30 у морской свинки применяли белок А, меченный пероксидазой хрена (ФГУН НИИЭМ им. Пастера, Россия).
Электронная микроскопия. Для получения микрофотографий ВпЧ использовали трансмиссионную электронную микроскопию. На медную сетку, покрытую парлодиевой пленкой-подложкой, наносили 5 мкл раствора белка в концентрации 100 мкг/мл, инкубировали в течение 5 мин, отмывали водой от несвязавшихся компонентов и окрашивали водным раствором 2% уранилацетата (рН 4,5) в течение 20 с. Образцы анализировали с помощью просвечивающего электронного микроскопа НТ7700 (Hitachi, Япония).
При оценке способности антител против SN-VP3E30 взаимодействовать с вирионами Е30 в качестве источника энтеровируса использовали фекалии двух больных, в которых методом полимеразной цепной реакции с обратной транскрипцией были обнаружены Е30 с генотипом еС2 (Е30-еС2 1194/24) и h (Е30-h 2671/17). Готовили 10% суспензию фекалий в физиологическом растворе, центрифугировали при 5000 об/мин в течение 10 мин, супернатант последовательно фильтровали через мембранные фильтры с размером пор 0,45 и 0,22 мкм. К 20 мкл вирусной суспензии добавляли 20 мкл иммуноглобулинов, выделенных из сыворотки крови морской свинки, иммунизированной SN-VP3E30, методом высаливания. В качестве отрицательного контроля использовали иммуноглобулины морской свинки, иммунизированной полученным ранее VP1 норовируса [15]. Смесь инкубировали в течение 30 мин при 37 °С, затем в течение 12 ч при 4 °С. После инкубации препараты центрифугировали в течение 30 мин при 14 000 об/мин. Полученные осадки разводили в 20 мкл воды и наносили на сетку для электронной микроскопии, контрастировали в водном растворе 2% фосфорно-вольфрамовой кислоты и визуализировали с помощью электронного микроскопа, как описано выше.
Действие на дендритные клетки (ДК). ДК получали, как описано ранее [16]. Моноциты выделяли из мононуклеарных клеток крови взрослых здоровых доноров с помощью 2-часовой адгезии на 48-луночных планшетах (Costar, США). Неприлипшие клетки отмывали, оставшиеся клетки инкубировали в среде RPMI-1640 (Gibco, Великобритания), содержащей 10% эмбриональной телячьей сыворотки (РАА, Австрия). На 1-е и 3-и сутки в культуры вносили по 20 нг/мл интерлейкина (IL)-4 и 100 нг/мл гранулоцитарно-макрофагального колониестимулирующего фактора (Sci.store.ru, Россия). На 7-е сутки полученные незрелые ДК (нДК) переводили в свежую питательную среду и культивировали с добавлением 10 мкг/мл полипептида VP3Е30 или SN-VP3E30 в течение 48 ч. Негативными контролями являлись ДК без добавления рекомбинантных белков (нДК) и ДК, инкубированные с контрольным раствором (КР) – лизатом бактерий, трансфицированных pET22b, который прошел все этапы очистки, аналогично VP3Е30 и SN-VP3E30. Положительным контролем являлись зрелые ДК (зДК), инкубированные в течение 48 ч в присутствии 25 нг/мл IL-6 (Sci.store.ru, Россия), 25 нг/мл IL-1β, 50 нг/мл фактора некроза опухоли-α (TNF-α) (R&D, США) и 1 мкг/мл простагландина E2 (Sigma, США). После инкубации ДК собирали, окрашивали флуоресцентно-мечеными моноклональными антителами к HLA-DR («Сорбент», Россия), CCR7, CD80 (BioLegend, США), CD83 (Elabscience, КНР) и CD86 (eBioscience, США) и анализировали на проточном цитофлуориметре FacsCalibur (ВD Biosciences, США). ДК гейтировали по профилю прямого и бокового светорассеивания и оценивали долю клеток, несущих мембранные молекулы, а также геометрическую среднюю интенсивности флуоресценции (GMFI) как показатель среднего количества молекул на одной клетке.
Реакцию нейтрализации проводили, как детально описано ранее [17]. На клетках эмбриональной рабдомиосаркомы (RD) («Биолот», Россия) определяли 50% цитопатическое действие (ЦПД50) для штаммов Е30 с генотипом eC2 (изолят 2045/23) и генотипом h (изолят 2700/16), ранее выделенных от больных энтеровирусным менингитом и хранящихся в рабочей коллекции ФБУН ННИИЭМ им. академика И.Н. Блохиной Роспотребнадзора. ЦПД регистрировали на 4-е сутки визуально и колориметрическим методом восстановления тетразолия (МТТ) (3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромид) [18]. Далее для исследования нейтрализующих свойств антител сыворотку крови иммунизированных лабораторных животных прогревали в течение 30 мин при 56 °С. Для последовательных разведений использовали полную питательную среду, содержащую 100 ЦПД50 Е30. Смесь инкубировали в течение 1 ч при 37 °С и переносили в 96-луночный планшет, содержащий не менее 95% монослоя клеток RD. Для каждого вируса использовали по три сыворотки крови мышей и сыворотку морской свинки, иммунизированные SN-VP3E30. Исследование проводили в двух повторах. В контрольные лунки вносили питательную среду без вируса. Клетки инкубировали в течение 96 ч при 37 °С и 5% СО2. При использовании МТТ нейтрализующий титр определяли по последнему разведению сыворотки крови, в котором средний показатель оптической плотности при длине волны 570 нм (ОП) был равен или превышал разницу между ОП в лунках с незараженными клетками и ОП в лунках с клетками, зараженными 100 ЦПД50 Е30, разделенную на 2.
Статистическую обработку данных проводили с использованием программы GraphPad Prism 8 (GraphPad Software, США). При сравнении нескольких зависимых выборок использовали тест Фридмана и при неравенстве выборок группы сравнивали парным знаковым ранговым тестом Вилкоксона.
Результаты
Ранее сообщалось, что отдельные пептиды поверхностных белков enterovirus-А71 обладали слабой иммуногенностью даже при использовании адъюванта [19]. В связи с этим для повышения иммуногенности нами был получен химерный белок SN-VP3E30, состоящий из S-части VP1 норовируса и VP3 E30 (рис. 1 а), с молекулярной массой 51 кДа. Такой белок способен формировать округлые вирусоподобные структуры, диаметр которых варьировал приблизительно от 20 до 50 нм (рис. 1 б).
Рис. 1. Белок SN-VP3E30 формирует вирусоподобные частицы (ВпЧ). а – электрофоретическая подвижность очищенного SN-VP3E30 (1) в сравнении с PageRuler Plus Prestained Protein Ladder (Thermo Scientific) (2); б – электронная микрофотография ВпЧ, образованных белком SN-VP3E30 (увеличение 12 000).
Fig. 1. The SN-VP3E30 protein forms virus-like particles (VLPs). a – electrophoretic mobility of purified SN-VP3E30 (1) compared to PageRuler Plus Prestained Protein Ladder (Thermo Scientific) (2); b – electron micrograph of VLP formed by e SN-VP3E30 (12,000× magnification).
На первом этапе исследования иммуногенных свойств оценивали действие рекомбинантных VP3Е30 и SN-VP3E30 на ДК. С этой целью незрелые моноцитарные ДК человека инкубировали с исследуемыми белками, а затем оценивали их фенотип. Действие VP3 на ДК выражалось в небольшом приросте доли CD83+- и CD86+-клеток и увеличении GMFI CD80+-клеток относительно отрицательных контролей (рис. 2). Инкубация ДК с SN-VP3E30 вызывала увеличение доли CD86+-клеток и рост их GMFI, что говорит об увеличении количества копий этой костимулирующей молекулы на клетке. Также SN-VP3E30 индуцировал увеличение экспрессии CD80, которое проявлялось в росте интенсивности флуоресценции окрашенных ДК и оказывал воздействие на CD83 и CCR7, которое регистрировалось как увеличение доли клеток, несущих эти маркеры. Следует отметить, что экспрессия всех перечисленных выше молекул, индуцированная VP3 или SN-VP3E30, заметно уступала уровню экспрессии этих молекул на зДК положительного контроля, созревание которых было индуцировано смесью медиаторов воспаления.
Рис. 2. Экспрессия молекул HLA-DR, CD80, CD83, CD86 и CCR7 на дендритных клетках (ДК) после инкубации с VP3 или SN-VP3E30. а – интенсивность флуоресценции (GMFI); б – процент клеток, несущих маркер (гистограммы Тьюки). Тип клеток, их стимуляторов и анализируемые маркеры – под гистограммами. Различия с нДК обозначены: † – р < 0,05, †† – р<0,005; различия с ДК, инкубированными с КР, обозначены: * – р < 0,05, ** – р < 0,005 (в парном знаковом ранговом тесте Вилкоксона).
Fig. 2. Expression of HLA-DR, CD80, CD83, CD86, and CCR7 molecules on dendritic cells (DCs) after incubation with VP3 or SN-VP3E30. a – the fluorescence intensity (GMFI); b – the percentage of cells bearing the marker (Tukey histograms). The cell type, their stimulators, and analyzed markers are shown below the histograms. Differences from unstimulated DCs are indicated: † – p < 0.05, †† – p < 0.005; differences from DCs incubated with negative control are indicated: * – p < 0.05, ** – p < 0.005 (paired Wilcoxon signed rank test).
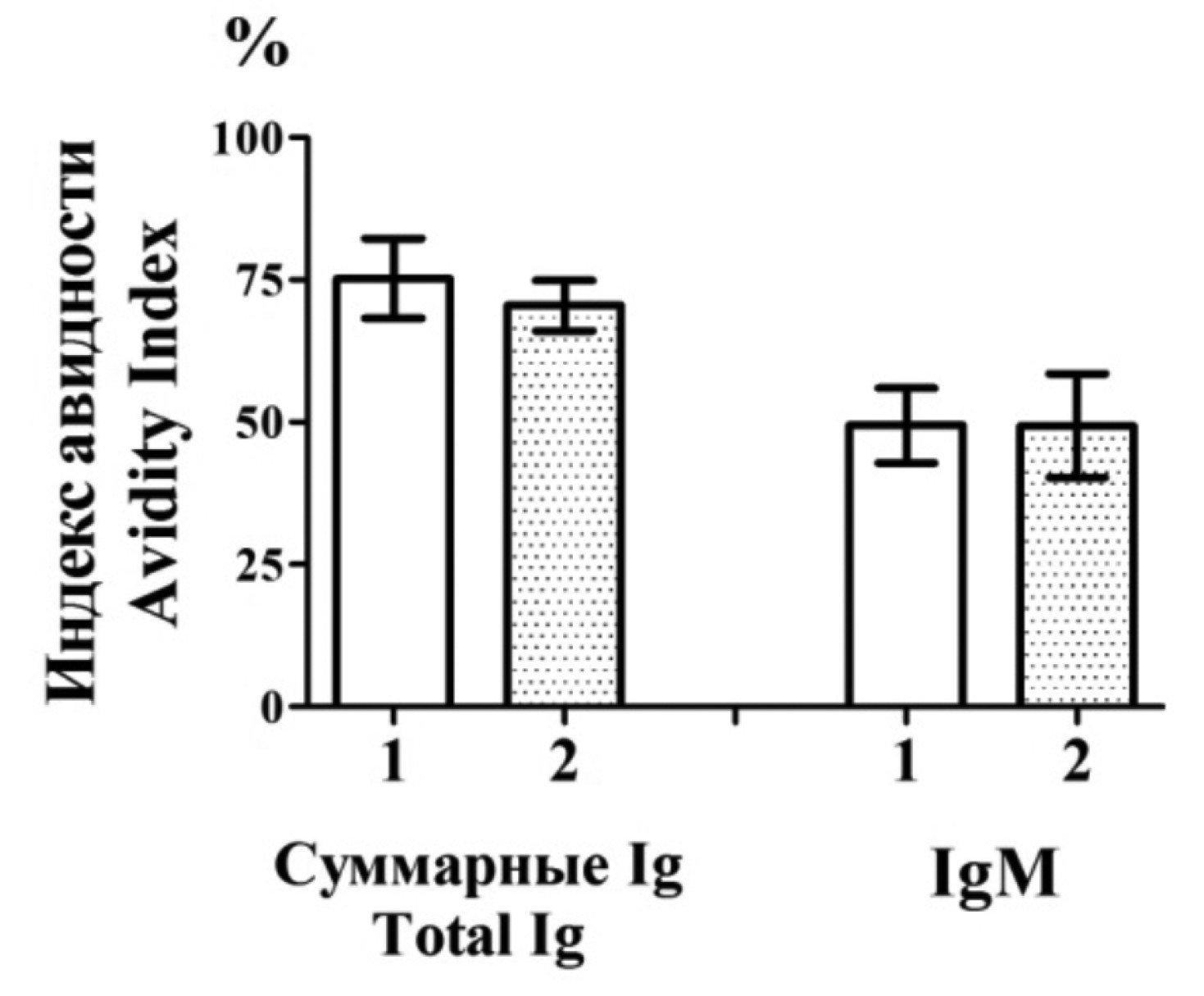
Иммунизация мышей белком SN-VP3E30 показала, что средний титр суммарных антител против VP3 составил приблизительно 1/35 000, а при использовании адъюванта – 1/115 000. Титры анти-VP3 IgM также были высокими и в среднем составляли 1/6600 и 1/8800 при иммунизации совместно с адъювантом (рис. 3 a). Антитела обладали относительно высокими индексами авидности, в среднем 75% для суммарных антител и 49% для IgM. Использование адъюванта не приводило к значимым изменениям индекса авидности антител против VP3 (рис. 3 б).
Рис. 3. Характеристика антител к VP3E30 после иммунизации мышей химерным белком SN-VP3E30. а – титры антител; б – индекс авидности антител. 1 – иммунизация без адъюванта (n = 10), 2 – иммунизации с адъювантом (n = 10).
Fig. 3. Characteristics of antibodies to VP3E30 after mice immunization by the chimeric protein SN-VP3E30. a – antibody titers; b – antibody avidity index. 1 – immunization without adjuvant (n = 10), 2 – immunization with adjuvant (n = 10).
При исследовании взаимодействия антител против VP3 c вирионами Е30 показано, что добавление иммуноглобулинов морской свинки, иммунизированной SN-VP3E30, к выделенным из фекалий препаратам Е30 разных генотипов приводило к образованию вирусных агломератов (рис. 4 б, в). В реакции нейтрализации было установлено, что при разведении в 20–40 раз содержащие анти-VP3 сыворотки крови мышей и морской свинки нейтрализовали 100 ЦПД50 Е30 обоих генотипов.
Рис. 4. Иммуноэлектронные микрофотографии Е30 (увеличение 12 000). а – препарат после взаимодействия с антителами против VP1 норовируса; б – агрегаты Е30-еС2 1194/24 после взаимодействия с антителами против VP3E30; в – агрегаты Е30-h 2671/17 после взаимодействия с антителами против VP3E30.
Fig. 4. Immunoelectron micrographs of E30 (12,000× magnification). a – preparation with antibodies against norovirus VP1; b – Е30-еС2 1194/24 aggregates after interaction with antibodies against VP3E30; с – Е30-h 2671/17 aggregates after interaction with antibodies against VP3E30.
Обсуждение
Энтеровирус Е30 является широко распространенным патогеном, который занимает ведущее место среди представителей вида Enterovirus betacoxsackie, обладающих нейротропностью. Повсеместная распространенность и тяжесть вызываемого заболевания определяют необходимость разработки Е30-вакцины, в том числе на основе поверхностных белков капсида вируса. Поверхностные белки вириона энтеровирусов не гликозилируются, поэтому исследуемые в настоящей работе белки были получены в E. coli. VP3E30 представляет собой рекомбинантный аналог полноразмерного VР3 Е30. Молекула SN-VP3E30 является химерой, в которой S-домен белка VP1 норовируса GII.4 слит в одну молекулу с VР3 Е30. Такое слияние позволяло получать ВпЧ, у которых на поверхности представлен VР3 Е30. Электронная микроскопия показала, что SN-VP3E30 формирует ВпЧ разного размера (рис. 2 б). Это наблюдение согласуется с ранее опубликованными данными, в которых показано, что рекомбинантный VP1 норовируса с генотипом GII.4 образует по крайней мере три типа ВпЧ с диаметром ~ 52, 45 и 26 нм [20].
Поскольку ДК являются важным звеном развития приобретенного иммунитета и необходимы для первой фазы инициации фолликулярных Т-хелперов, которые, в свою очередь, способствуют выработке В-клетками долгоживущих высокоаффинных антител [21], нами было проведено сравнение воздействия VР3E30 и SN-VP3E30 на фенотип ДК. Установлено, что инкубация ДК с VP3 вызывала слабые изменения фенотипа ДК (небольшой прирост доли CD83+- и CD86+-клеток и увеличение экспрессии CD80+) и не стимулировала экспрессию CCR7 на поверхности ДК (рис. 2). CCR7 является основным хемокиновым рецептором, который направляет миграцию ДК из периферических тканей в лимфатические узлы, а при его отсутствии активация фолликулярных Т-хелперов нарушается [22]. Возможно, это наблюдение объясняет описанную ранее слабую иммуногенность отдельных пептидов поверхностных белков энтеровирусов [19]. SN-VP3E30 вызывал увеличение экспрессии костимулирующих молекул CD80 и CD86, маркера зрелости CD83 и хемокинового рецептора CCR7 на поверхности ДК, что вероятно связано со способностью SN-VP3E30 формировать ВпЧ. Однако по сравнению с положительным контролем увеличение экспрессии исследуемых маркеров было умеренным, что отражало созревание не всех ДК человека.
Для дальнейших экспериментов по иммунизации лабораторных животных мы использовали только SN-VP3E30. У мышей, иммунизированных SN-VP3E30, детектировались высокие титры и индексы авидности как суммарных антител, так и IgM-антител против VP3 Е30 (рис. 3). Сравнение иммуногенности SN-VP3E30 с иммуногенностью аналогичного химерного белка SN-VP1E30, содержащего VP1 Е30, иммунизация которым происходила по аналогичной схеме [17], показало, что титры и индексы авидности антител против VP3 были выше, чем у антител против VP1 Е30. Это свидетельствует о более скором процессе созревания антител против VP3. Иммуноглобулины морской свинки, иммунизированной SN-VP3E30, вызывали образование агломератов двух наиболее распространенных в России генотипов вирусов Е30, выделенных из клинического материала. Этот результат свидетельствует о способности антител против VP3 связываться с диким вирусом. Кроме того, сывороточные антитела против VP3, полученные при иммунизации мышей и морской свинки, были способны нейтрализовать генетически различающиеся штаммы Е30 в культуре клеток. Сходные результаты были получены для других энтеровирусов. При исследовании поликлональных сывороток человека моноклональные антитела против одного генотипа могут блокировать заражение клеток в культуре с другими генотипами и серотипами энтеровирусов [23, 24].
Заключение
Таким образом, VP3 Е30 вызывал неполное созревание ДК, характеризующееся отсутствием стимуляции экспрессии хемокинового рецептора CCR7. Включение VP3 в состав химерных ВпЧ приводило к созреванию ДК и сильному гуморальному иммунному ответу у лабораторных животных. Антитела против VP3 Е30 характеризовались высокой авидностью и способностью связывать и нейтрализовать вирусы двух наиболее распространенных на территории России генотипов Е30. Полученные результаты свидетельствуют, что VP3 в составе SN-VP3E30 в перспективе может быть включен в состав комбинированной вакцины для профилактики энтеровирусных инфекций.
Об авторах
Дмитрий Викторович Новиков
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор); ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»
Email: novikov.dv75@mail.ru
ORCID iD: 0000-0001-7049-6935
канд. биол. наук, доцент, ведущий научный сотрудник лаборатории иммунохимии
Россия, 603950, Нижний Новгород; 603950, Нижний НовгородДмитрий Александрович Мелентьев
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор); ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»
Email: dim-melente@yandex.ru
ORCID iD: 0000-0002-2441-6874
младший научный сотрудник лаборатории иммунохимии
Россия, 603950, Нижний Новгород; 603950, Нижний НовгородВладимир Юрьевич Талаев
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: talaev@inbox.ru
ORCID iD: 0000-0003-1993-0622
д-р. мед. наук, профессор, ведущий научный сотрудник-заведующий лабораторией клеточной иммунологии
Россия, 603950, Нижний НовгородНадежда Алексеевна Новикова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: novikova_na@mail.ru
ORCID iD: 0000-0002-3710-6648
д-р. биол. наук, профессор, ведущий научный сотрудник, заведующая лабораторией молекулярной эпидемиологии вирусных инфекций
Россия, 603950, Нижний НовгородЕкатерина Валерьевна Мохонова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: ekaterinamohonova@yandex.ru
ORCID iD: 0000-0002-9742-7646
научный сотрудник лаборатории иммунохимии
Россия, 603950, Нижний НовгородАлександр Юрьевич Кашников
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: mevirfc@mail.ru
ORCID iD: 0000-0003-1033-7347
научный сотрудник лаборатории молекулярной эпидемиологии вирусных инфекций
Россия, 603950, Нижний НовгородИрина Евгеньевна Заиченко
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: imm.irina@mail.ru
ORCID iD: 0000-0001-5063-3111
канд. биол. наук, ведущий научный сотрудник лаборатории клеточной иммунологии
Россия, 603950, Нижний НовгородМария Владимировна Светлова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: marya.talaeva@yandex.ru
ORCID iD: 0000-0003-4097-6780
канд. биол. наук, старший научный сотрудник лаборатории клеточной иммунологии
Россия, 603950, Нижний НовгородЕлена Викторовна Куркова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: el2v@mail.ru
ORCID iD: 0000-0003-1801-9693
канд. биол. наук, старший научный сотрудник лаборатории клеточной иммунологии
Россия, 603950, Нижний НовгородОльга Николаевна Бабайкина
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: olga_babaykina@inbox.ru
ORCID iD: 0000-0003-4527-6134
канд. мед. наук, старший научный сотрудник лаборатории клеточной иммунологии
Россия, 603950, Нижний НовгородВладислав Александрович Лапин
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор); ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»
Email: fridens.95@yandex.ru
ORCID iD: 0000-0002-5905-5722
младший научный сотрудник лаборатории иммунохимии
Россия, 603950, Нижний Новгород; 603950, Нижний НовгородМария Игоревна Цыганова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: maria_che@mail.ru
ORCID iD: 0000-0002-2811-6844
канд. биол. наук, ведущий научный сотрудник лаборатории иммунохимии
Россия, 603950, Нижний НовгородДмитрий Евгеньевич Зайцев
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор); ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»
Email: mitya.zaitseff@yandex.ru
ORCID iD: 0000-0002-7663-6924
младший научный сотрудник лаборатории иммунохимии
Россия, 603950, Нижний Новгород; 603950, Нижний НовгородВиктор Владимирович Новиков
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор); ФГАОУ ВО «Нижегородский государственный университет им. Н.И. Лобачевского»
Автор, ответственный за переписку.
Email: mbre@mail.ru
ORCID iD: 0000-0002-2449-7213
д-р. биол. наук, профессор, ведущий научный сотрудник, заведующий лабораторией иммунохимии
Россия, 603950, Нижний Новгород; 603950, Нижний НовгородСписок литературы
- Brouwer L., Moreni G., Wolthers K.C., Pajkrt D. World-wide prevalence and genotype distribution of enteroviruses. Viruses. 2021; 13(3): 434–49. https://doi.org/10.3390/v13030434
- Chuang Y., Huang Y. Enteroviral infection in neonates. J. Microbiol. Immunol. Infect. 2019; 52(6): 851–7. https://doi.org/10.1016/j.jmii.2019.08.018
- Nishikawa M., Matsubara T., Yoshitomi T., Ichiyama T., Hayashi T., Furukawa S. Abnormalities of brain perfusion in echovirus type 30 meningitis. J. Neurol. Sci. 2000; 179(S 1-2): 122–6. https://doi.org/10.1016/s0022-510x(00)00398-1
- Broberg E.K., Simone B., Jansa J. Upsurge in echovirus 30 detections in five EU/EEA countries, April to September, 2018. Euro Surveill. 2018; 23(44): 1800537. https://doi.org/10.2807/1560-7917.ES.2018.23.44.1800537
- Lema C., Torres C., Van der Sanden S., Cisterna D., Freire M.C., Gómez R.M. Global phylodynamics of Echovirus 30 revealed differential behavior among viral lineages. Virology. 2019; 531: 79–92. https://doi.org/10.1016/j.virol.2019.02.012
- Новиков Д.В., Мелентьев Д.А. Энтеровирусные (Picornaviridae: Enterovirus) (неполио) вакцины. Вопросы вирусологии. 2022; 67(3): 185–92. https://doi.org/10.36233/0507-4088-111 https://elibrary.ru/fwqjow
- Mizutani T., Ishizaka A. Poliovirus capsid protein VP3 can penetrate vascular endothelial cells. FEBS Lett. 2024; 598(15): 1909–18. https://doi.org/10.1002/1873-3468.14974
- Kang J., Huang M., Li J., Zhang K., Zhu C., Liu S., et al. Enterovirus D68 VP3 targets the interferon regulatory factor 7 to inhibit type I interferon response. Microbiol. Spectr. 2023; 11(3): e0413822. https://doi.org/10.1128/spectrum.04138-22
- Kiener T.K., Jia Q., Meng T., Chow V.T.K., Kwang J. A novel universal neutralizing monoclonal antibody against enterovirus 71 that targets the highly conserved “knob” region of VP3 protein. PLoS Negl. Trop. Dis. 2014; 8(5): e2895. https://doi.org/10.1371/journal.pntd.0002895
- Jia Q., Ng Q., Chin W., Meng T., Chow V.T.K., Wang C., et al. Effective in vivo therapeutic IgG antibody against VP3 of enterovirus 71 with receptor-competing activity. Sci. Rep. 2017; 7: 46402. https://doi.org/10.1038/srep46402
- Huang K.A. Structural basis for neutralization of enterovirus. Curr. Opin. Virol. 2021; 51: 199–206. https://doi.org/10.1016/j.coviro.2021.10.006
- Marttila J., Hyoty H., Vilja P., Harkonen T., Alho A., Roivainen M., et al. T cell epitopes in coxsackievirus B4 structural proteins concentrate in regions conserved between enteroviruses. Virology. 2002; 293(2): 217–24. https://doi.org/10.1006/viro.2001.1259
- Мелентьев Д.А., Новиков Д.В., Лапин В.А., Мохонова Е.В., Цыганова М.И., Манакова Э.А. и др. Антитела к поверхностным белкам echovirus 30 (Enterovirus, Picornaviridae) в крови жителей Нижегородской области. Инфекция и иммунитет. 2024; 14(6): 1179–86. https://doi.org/10.15789/2220-7619-BAC-16103 https://elibrary.ru/exbfif
- Новиков Д.В., Мелентьев Д.А., Мохонов В.В., Кашников А.Ю., Новикова Н.А., Лапин В.А. и др. Получение вирусоподобных частиц норовируса (Caliciviridae: Norovirus), содержащих белок VP1 энтеровируса Echovirus 30 (Picornaviridae: Enterovirus: Enterovirus B). Вопросы вирусологии. 2021; 66(5): 383–9. https://doi.org/10.36233/0507-4088-79.
- Лапин В.А., Новиков Д.В., Мохонова Е.В., Мелентьев Д.А., Цыганова М.И., Зайцев Д.Е. и др. Получение рекомбинантного белка VP1 норовируса и его антигенные и иммуногенные свойства. Журнал микробиологии, эпидемиологии и иммунобиологии. 2024; 101(5): 661–7. https://doi.org/10.36233/0372-9311-552 https://elibrary.ru/ubmktf
- Talayev V., Zaichenko I., Svetlova M., Matveichev A., Babaykina O., Voronina E., et al. Low-dose influenza vaccine Grippol Quadrivalent with adjuvant Polyoxidonium induces a T helper-2 mediated humoral immune response and increases NK cell activity. Vaccine. 2020; 38(42): 6645–55. https://doi.org/10.1016/j.vaccine.2020.07.053
- Мелентьев Д.А., Новиков Д.В., Мохонова Е.В., Новикова Н.А., Кашников А.Ю., Селиванова С.Г. и др. Иммунологические свойства химерного белка, содержащего основной капсидный белок echovirus 30 (Picornaviridae: Enterovirus: Enterovirus betacoxsackie). Вопросы вирусологии. 2025; 70(2): 189–98. https://doi.org/10.36233/0507-4088-311 https://elibrary.ru/peagdt
- Riss T.L., Moravec R.A., Niles A.L., Duellman S., Benink H.A., Worzella T.J., et al. Cell viability assays. In: Markossian S., Grossman A., Baskir H., Arkin M., Auld D., Austin C., et al. Assay Guidance Manual. Bethesda (MD): Eli Lilly & Company and the National Center for Advancing Translational Sciences; 2004.
- Anasir M.I., Poh C.L. Advances in antigenic peptide-based vaccine and neutralizing antibodies against viruses causing hand, foot, and mouth disease. Int. J. Mol. Sci. 2019; 20(6): 1256. https://doi.org/10.3390/ijms20061256
- Devant J.M., Hofhaus G., Bhella D., Hansman G.S. Heterologous expression of human norovirus GII.4 VP1 leads to assembly of T=4 virus-like particles. Antiviral Res. 2019; 168: 175–82. https://doi.org/10.1016/j.antiviral.2019.05.010
- Luo W., Yin Q. B cell response to vaccination. Immunol. Invest. 2021; 50(7): 780–801. https://doi.org/10.1080/08820139.2021.1903033
- Krishnaswamy J.K., Gowthaman U., Zhang B., Mattsson J., Szeponik L., Liu D., et al. Migratory CD11b+ conventional dendritic cells induce T follicular helper cell-dependent antibody responses. Sci. Immunol. 2017; 2(18): eaam9169. https://doi.org/10.1126/sciimmunol.aam9169
- Mao Q., Cheng T., Zhu F., Li J., Wang Y., Li Y., et al. The cross-neutralizing activity of enterovirus 71 subgenotype C4 vaccines in healthy Chinese infants and children. PLoS One. 2013; 8(11): e79599. https://doi.org/10.1371/journal.pone.0079599
- Rosenfeld A.B., Shen E.Q.L., Melendez M., Mishra N., Lipkin W.I., Racaniello V.R. Cross-reactive antibody responses against nonpoliovirus enteroviruses. mBio. 2022; 13(1): e0366021. https://doi.org/10.1128/mbio.03660-21
Дополнительные файлы