Рекомбинантный VP1 норовируса генотипа GII.4 (Caliciviridae: Norovirus) способен индуцировать выработку перекрестно-реагирующих антител
- Авторы: Лапин В.А.1, Новиков Д.В.1, Кашников А.Ю.1, Епифанова Н.В.1, Новикова Н.А.1, Мохонова Е.В.1, Мелентьев Д.А.1, Цыганова М.И.1, Зайцев Д.Е.1, Новиков В.В.1
-
Учреждения:
- ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
- Выпуск: Том 70, № 3 (2025)
- Страницы: 282-290
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16753
- DOI: https://doi.org/10.36233/0507-4088-316
- EDN: https://elibrary.ru/HHCKYL
- ID: 16753
Цитировать
Аннотация
Введение. Норовирусы (НВ) являются одной из основных причин острого гастроэнтерита. В настоящее время отсутствует лицензированная вакцина против норовирусной инфекции. Разрабатываемые вакцины основаны на капсидном белке VP1, способном к формированию вирусоподобных частиц.
Целью настоящей работы стала характеристика иммуногенных свойств рекомбинантного VP1 НВ и оценка перекрестной реактивности антител против него с различными геновариантами НВ.
Материалы и методы. В сыворотке крови животных, иммунизированных полученным авторами рекомбинантным белком VP1, c помощью иммуноферментного анализа определяли титры и авидность суммарных антител и антител класса М (IgM) против VP1 HB. Способность полученных антител взаимодействовать с НВ разных генотипов оценивали с помощью иммуноэлектронной микроскопии.
Результаты. Рекомбинантный белок VP1 индуцировал образование у животных антител в высоких титрах. Суммарные антитела против VP1 имели высокую авидность, достигающую 100%, что предполагает наличие у них вируснейтрализующей активности. Антитела класса IgM обладали низкой авидностью. Методом иммуноэлектронной микроскопиии показано, что IgG-антитела против VP1 генотипа GII.4 взаимодействуют с НВ генотипа GII.7 и GII.17.
Заключение. Полученный рекомбинантный белок индуцирует выраженный иммунный ответ с формированием высокоавидных поликлональных перекрестно-реагирующих антител, что позволяет рассматривать его как антигенный компонент прототипа кандидатной вакцины против НВ человека.
Ключевые слова
Полный текст
Введение
Норовирусы (НВ) являются второй по значимости причиной острого гастроэнтерита, уступая только ротавирусу. В странах, где проводится массовая вакцинация против ротавирусной инфекции, наблюдается увеличение доли НВ в этиологической структуре острых кишечных инфекций на фоне снижения заболеваемости ротавирусным гастроэнтеритом. В результате норовирусная инфекция постепенно занимает лидирующую позицию [1]. Вирус обладает высокой контагиозностью, инфицирующая доза составляет 18–2800 вирусных частиц [2]. Ежегодно в мире регистрируется около 700 млн случаев инфицирования НВ и более 200 тыс. смертельных исходов. Лицензированной вакцины для профилактики норовирусной инфекции до настоящего времени не существуют ни в одной стране мира [3]. Всемирная организация здравоохранения включила в 2024 г. норовирусную инфекцию в список приоритетных инфекций, против которых необходима в ближайшее время разработка вакцины [4].
НВ относится к группе безоболочечных вирусов, входящих в семейство Caliciviridae, род Norovirus. Геном вируса представляет собой одноцепочечную РНК позитивной полярности, которая кодирует неструктурные белки (ORF1), основной структурный белок VP1 (ORF2) и минорный белок капсида VP2 (ORF3). Капсид вируса имеет икосаэдрическую симметрию и состоит из 180 копий белка VP1, которые дополняются одной или двумя копиями минорного белка VP2 [5].
Выделено 10 геногрупп НВ и несколько десятков генотипов, различающихся по аминокислотным последовательностям белка VP1. Для человека патогенны представители 5 геногрупп (GI, GII, GIV, GVIII и GIX). Наиболее распространенным и клинически значимым является НВ генотипа GII.4, ответственный в мире в последние три десятилетия за 70–80% вспышек норовирусной инфекции [6].
VP1 НВ способен образовывать вирусоподобные частицы (ВпЧ), морфологически не отличающиеся от природного вируса, но не содержащие нуклеиновую кислоту. Это позволяет использовать такие ВпЧ в качестве безопасных компонентов вакцины. VP1 состоит из двух доменов – S и P. Домен S (от англ. shell – оболочка) отвечает за самосборку капсида и расположен внутри вирусной частицы. Домен Р (от англ. рrotruding – выступающий) расположен на поверхности, дополнительно стабилизирует структуру вириона и представлен двумя субдоменами – P1 и P2, которые несут антигенные сайты, и отвечает за связывание вируса со структурами организма хозяина (антигены групп крови человека HBGA). Наряду с полноразмерным VP1, составляющие его домены также способны образовывать ВпЧ разного размера [7–9].
Разрабатывается несколько вариантов вакцин для профилактики норовирусной инфекции человека. Большинство из них основаны на использовании VP1 и образуемых этим белком или его Р-доменом ВпЧ, которые повышают иммунный ответ на VP1 [10]. Однако в понимании естественного иммунитета к НВ человека остается много пробелов, что затрудняет разработку вакцин. Способность вызывать иммунитет к широкому спектру часто циркулирующих генотипов и защищать от будущих появляющихся штаммов определяет эффективность вакцины. В то же время остается малоизученной возможность перекрестного иммунитета к различным геногруппам или генотипам внутри одной геногруппы НВ [11].
Ранее нами был получен рекомбинантный VP1 НВ генотипа GII.4, циркулирующего на территории Центральной части России. Показано, что он формирует ВпЧ, и кратко описаны его свойства [12].
Целью настоящей работы стала характеристика иммуногенных свойств рекомбинантного VP1 НВ и оценка перекрестной реактивности антител (АТ) против него с различными геновариантами НВ.
Материалы и методы
Экспрессию, очистку и ренатурацию рекомбинантного VP1 НВ генотипа GII.4 осуществляли согласно описанным ранее методам [12]. Для иммунизации использовали самок мышей линии BALB/c возрастом 8 нед и массой 16–18 г. Животных содержали в условиях вивария в соответствии с межгосударственными стандартами ГОСТ 33216-2014 и ГОСТ 33215-2014. Биоматериал для исследования брали у мышей с соблюдением принципов гуманности, изложенных в директивах Европейского сообщества (86/609/ЕС). Исследования проводили согласно биоэтическим и этическим принципам, установленным Хельсинкской декларацией (принята в июне 1964 г. и пересмотрена в октябре 2013 г.).
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Сonsensus Author Guideline for Animal Use (IAVES, 23.07.2010). Протокол исследования одобрен решением Локального этического комитета ННИИЭМ им. акад. И.Н. Блохиной (№ 4 от 25.11.2021).
Животные были разделены на 3 группы по 10 особей: 1-я группа получала внутрибрюшинно 0,5 мл физиологического раствора; 2-я группа – 10 мкг VP1 в 0,5 мл физиологического раствора; 3-я группа – 10 мкг VP1 в 0,5 мл физиологического раствора с добавлением 100 мкг гидроокиси алюминия. Животных иммунизировали дважды с интервалом 2 нед. Через 3 нед после второй иммунизации забирали кровь и получали сыворотку крови. Определение АТ к VP1 НВ в сыворотке крови иммунизированных мышей проводили с помощью твердофазного иммуноферментного анализа. VP1 сорбировали в лунки планшетов в концентрации 1 мкг/мл в течение 18 ч при температуре 4 °C. Планшеты трижды отмывали в фосфатно-солевом буфере, содержащем 0,1% Твин-20 (ФСБ-Т). 1 мкл сыворотки крови разводили ФСБ-Т, содержащим 10% осветленного лизата клеток Escherichia сoli Rosetta 2 (DE3) с шагом 2 и вносили в лунки планшетов в объеме 100 мкл с последующей инкубацией в течение 1 ч при 37 °С. Затем лунки планшетов отмывали ФСБ-Т и вносили по 100 мкл раствора конъюгированных с пероксидазой корня хрена кроличьих АТ против суммарной фракции иммуноглобулинов мыши (ИМТЕК, Россия) или против иммуноглобулинов класса M (IgM) (Elabscience, Китай), инкубировали 1 ч при 37 °С и отмывали ФСБ-Т. Реакцию визуализировали добавлением 100 мкл раствора 0,04% тетраметилбензидина, содержащего 0,002 перекиси водорода при рН 5,0. Оставляли планшет на 10 мин в темном месте. Во все лунки добавляли по 50 мкл 1N H2SO4 и измеряли оптическую плотность (ОП) в двухволновом режиме, при основной длине волны 450 нм и при референсной длине волны 620 нм в микропланшетном ридере Infinite M200 Pro (TECAN, Австрия) с программным обеспечением Magellan 7.2 (TECAN, Австрия). В качестве отрицательного контроля использовали сыворотку крови мышей, получавших внутрибрюшинно физиологический раствор в объеме 0,5 мл. Все тесты выполняли в трех повторах. За положительную реакцию принимали значение ОП, превышающее среднее значение отрицательного контроля, умноженное на 3.
Для определения авидности АТ образцы сыворотки крови тестировали в дублях иммуноферментным методом с описанными ниже модификациями. Перед добавлением конъюгата в одну из двух лунок каждого из образцов вносили 100 мкл раствора 8М мочевины в ФСБ-Т, инкубировали в течение 3 мин, отмывали 5 раз и проводили анализ, как описано выше. Индекс авидности рассчитывали как отношение величины ОП в лунках с 8М мочевиной к величине ОП в лунках без мочевины, полученных для одной сыворотки крови, выраженное в процентах.
Для проведения иммуноэлектронной микроскопии получали АТ морских свинок к VP1 НВ. Подкожно иммунизировали морскую свинку дважды с интервалом 2 нед. Вводили по 500 мкг рекомбинантного VP1 НВ в смеси с 5 мг гидроокиси алюминия. Через 21 сут после повторной иммунизации производили забор крови и выделяли суммарную фракцию иммуноглобулинов путем высаливания 33% сульфатом аммония с последующим диализом осадка против дистиллированной воды; 50 мкл выделенных АТ сорбировали в течение 60 мин на медные сеточки для электронной микроскопии (ЭМ), покрытые парлодиевой подложкой. Сеточки отмывали дистиллированной водой и помещали на капли копрофильтратов, содержащих НВ генотипов GII.4, GII.7, GII.17, GI.3 или echovirus 30 в качестве отрицательного контроля. Инкубировали в течение 60 мин при 37 °С, окрашивали водным раствором 2% уранилацетата (рН 4,5) и анализировали на наличие вирусных частиц с помощью микроскопа HT7700 (Hitachi, Япония). В работе использовали хранящиеся в исследовательской коллекции Нижегородского НИИЭМ им. академика И.Н. Блохиной копрофильтраты с подтвержденным методами электронной микроскопии и полимеразной цепной реакции с обратной транскрипцией наличием вирусов.
Статистическая обработка данных выполнена с помощью программного обеспечения Prism (GraphPad Software) и Microsoft Excel. Различия считали статистически достоверными при р ≤ 0,05.
Результаты
У всех иммунизированных животных в сыворотке крови присутствовали АТ против белка VP1 НВ в разных титрах. У мышей, которым вводили физиологический раствор, АТ против VP1 не обнаруживались. Титры IgM на 21-е сутки после двукратной иммунизации мышей рекомбинантным VP1 колебались от 1 : 256 до 1 : 1024. Средний арифметический титр составил 1 : 474 (рис. 1). У мышей, иммунизированных VP1 в смеси с гидроокисью алюминия, титр АТ был в 2 раза выше, однако различия не были статистически значимы.
Рис. 1. Титры IgM-антител у мышей, иммунизированных рекомбинантным VP1 в отсутствие (а) и в присутствии (б) гидроокиси алюминия.
* – статистически значимые различия (p < 0,05).
Fig. 1. IgM antibody titers in mice immunized with recombinant VP1 protein in the absence (a) and presence (b) of aluminium hydroxide.
* – statistically significant differences (p < 0.05).
Еще более высокие титры АТ были получены при анализе их суммарной фракции. Как видно из рис. 2, средний титр суммарных АТ составил 1 : 1869. При этом в отдельных образцах значения титра достигали 1 : 8000. Иммунизация животных рекомбинантным белком с добавлением адъюванта еще более повышала титры АТ. В этом случае они колебались у животных от 1 : 512 до 1 : 32 768. Средний арифметический титр составил 1 : 13158. Характеризующие напряженность популяционного иммунитета средние геометрические титры составили соответственно 1 : 1024 и 1 : 9410.
Рис. 2. Титры суммарных антител у мышей, иммунизированных рекомбинантным VP1 в отсутствие (а) и в присутствии (б) гидроокиси алюминия.
* – статистически значимые различия (p < 0,05).
Fig. 2. Titers of total antibodies in mice immunized with recombinant VP1 protein in the absence (a) and presence (b) of aluminium hydroxide.
* – statistically significant differences (p < 0.05).
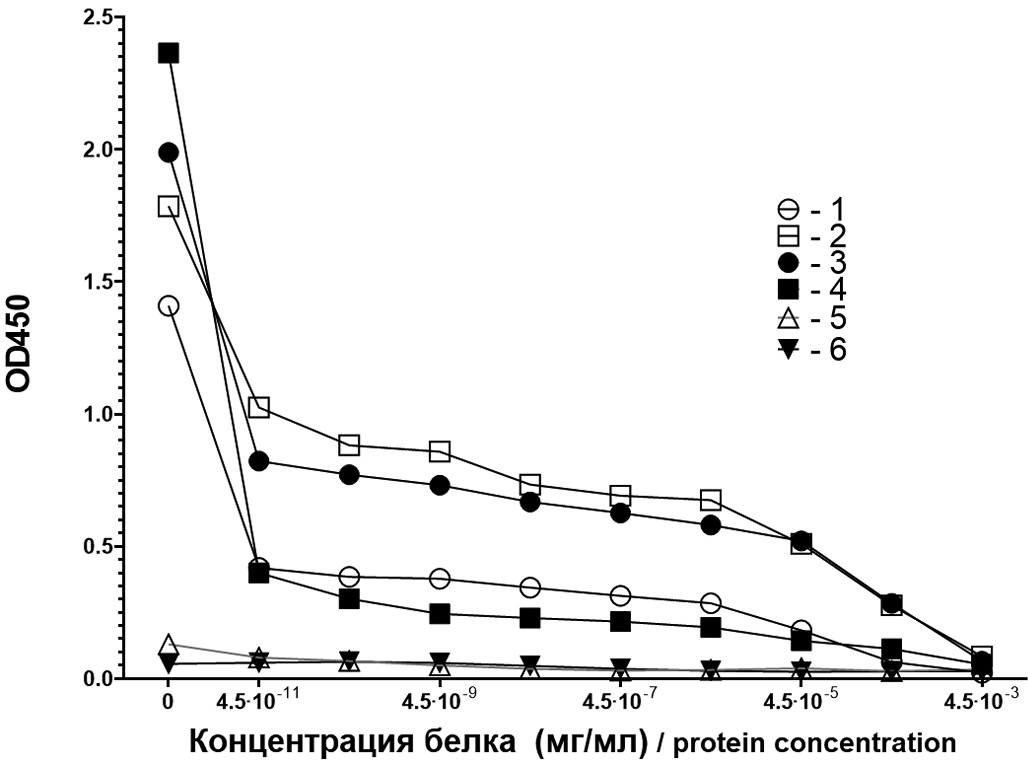
Была проведена оценка специфичности как суммарных АТ против рекомбинантного VP1, так и АТ класса IgM. В конкурентной реакции, когда АТ против VP1 преинкубировали с рекомбинантным VP1 в повышающихся концентрациях, было показано, что мышиные АТ нейтрализуются рекомбинантным белком на 95% при концентрации белка, превышающей 4,5 × 10−4 мг/мл (рис. 3). Кривые нейтрализации суммарных АТ и IgM, наработанных мышами после иммунизации в отсутствие и в присутствии использованного адъюванта, представлены на рис. 3.
Рис. 3. Нейтрализация рекомбинантным VP1 мышиных суммарных антител (АТ) и АТ класса IgM.
1 – суммарные АТ после иммунизации без адъюванта; 2 – то же с адъювантом; 3 – IgM-АТ после иммунизации без адъюванта; 4 – то же с адъювантом; 5 – суммарные АТ неиммунизированных мышей; 6 – IgM-АТ неиммунизированных мышей.
Fig. 3. Neutralization of mouse total antibodies (AB) and IgM AB by recombinant VP1 protein.
1 – total AB after immunization without adjuvant; 2 – same with adjuvant; 3 – IgM AB after immunization without adjuvant; 4 – same with adjuvant; 5 – total AB of unimmunized mice; 6 – IgM-AB of unimmunized mice.
При определении авидности АТ против VP1 показано, что суммарные АТ против VP1, полученные после иммунизации мышей без адъюванта, имели индекс авидности, равный 55,22%. Применение адъюванта приводило к повышению индекса авидности АТ до 83,99%. Близкий к 100% индекс авидности свидетельствует о высокой вероятности продукции животными вируснейтрализующих АТ. IgM-АТ против VP1 имели намного меньший индекс авидности, составивший 9,08% у мышей, иммунизированных VP1 с адъювантом. Индекс авидности IgM АТ после иммунизации рекомбинантным VP1 без адъюванта составил 8,11%.
Возможность перекрестных взаимодействий сывороточных АТ против VP1 с НВ разных генотипов изучали с помощью твердофазной иммуноэлектронной микроскопии. Использовали вирусы, выделенные из фекалий больных норовирусным гастроэнтеритом и энтеровирусным менингитом, собранные на территории Российской Федерации. Сеточки для ЭМ сенсибилизировали АТ против VP1 HB генотипа GII.4 и тестировали на взаимодействие c НВ других генотипов. ЭМ показала наличие вирусных частиц диаметром 40–50 нм при нанесении копрофильтратов, содержащих HB генотипов GII.4, GII.7, GII.17, но не GI.3, на сеточки, покрытые иммуноглобулинами (рис. 5). В качестве контроля специфичности связывания использовали копрофильтрат, содержащий Echovirus 30, в котором с использованием сеточек, покрытых иммуноглобулинами против VP1 НВ, вирусных частиц обнаружено не было. Полученные результаты указывают на связывание сывороточных поликлональных IgG против VP1 генотипа GII.4 с НВ генотипов GII.7, GII.17, но не с НВ генотипа GI.3, т.е. НВ геногруппы GI.
Рис. 4. Сравнение индексов авидности суммарных АТ (1 – иммунизация только VP1, 2 – VP1 совместно с адъювантом) и АТ класса IgM (3 – иммунизация только VP1, 4 – VP1 совместно с адъювантом).
Fig. 4. Comparison of avidity indices of total antibodies (1 – immunization with VP1 alone, 2 – VP1 together with adjuvant) and IgM class antibodies (3 – immunization with VP1 alone, 4 – VP1 together with adjuvant).
Рис. 5. Электронные микрофотографии норовирусных частиц, взаимодействующих с антителами против VP1 норовируса.
а – норовирус (НВ) генотипа GII.4; б – НВ генотипа GII.17; в – HB генотипа GII.7; г – GI.3; д – Echovirus 30.
Fig. 5. Electron micrographs of norovirus particles interacting with antibodies against norovirus VP1 protein.
a – norovirus (NoV) genotype GII.4; b – NoV genotype GII.17. c – NoV genotype GII.7; d – GI.3; e – Echovirus 30.
Обсуждение
Белок VP1 НВ содержит ряд антигенных детерминант (эпитопов), которые определяют его иммуногенные свойства. Домен S образован N-концевыми остатками от 1 до 225 аминокислоты. Остатки от 50 до 225 сворачиваются в 8-цепочечную антипараллельную β-структуру, характерную для капсидных белков многих вирусов. Полипептидная цепь, начинающаяся от 225-й аминокислоты, образует субдомены P1 и P2. С помощью моноклональных АТ в N-концевой части домена S VP1 HB геногруппы II обнаружен достаточно консервативный участок, построенный из 60 аминокислот и содержащий В-клеточные антигенные детерминанты [13, 14]. Также было описано и охарактеризовано несколько перекрестно-реактивных АТ, нацеленных на консервативную область домена P [15–20]. Среди них обнаружены АТ, реагирующие как с линейными, так и конформационными эпитопами [16]. Показано, что к части выявленных эпитопов могут образовываться нейтрализующие АТ, что важно для реализации антивирусного В-клеточного ответа [21, 22]. Идентифицировано 5 антигенных участков, построенных из вариабельных В-клеточных эпитопов и локализованных в структуре P2 субдомена на его внешней поверхности [23]. Эта область P2 субдомена характеризуется высокой частотой мутаций, что, вероятно, является результатом селективного давления со стороны иммунитета хозяина и содержит эпитопы, индуцирующие образование нейтрализующих АТ [24].
В наших исследованиях с применением анализа in silico в составе VP1 HB генотипа GII.4 Sydney [P16], циркулирующего на территории России и воспроизведенного нами в виде рекомбинантного белка, идентифицирован ряд возможных Т-клеточных эпитопов, презентируемых молекулами HLA I и II классов, т.е. способных активировать как цитотоксический ответ Т-клеток, так и Т-хелперный ответ. Моделирование структуры и ее анализ позволили обнаружить также 2 линейных и 47 конформационных В-клеточных эпитопов VP1 при отсутствии его аллергенности [25].
Наличие указанных эпитопов обеспечивает формирование В-клеточного ответ, которое и было зарегистрировано в нашем исследовании. Суммарные АТ, вырабатываемые в высоких титрах в ответ на иммунизацию рекомбинантным VP1, обладали высокой авидностью, что с высокой вероятностью предполагает их вируснейтрализующие свойства. Использование адъюванта приближало индекс авидности к 100%. Заметим, что высокая иммуногенность обусловлена также способностью VP1 формировать ВпЧ, что продемонстрировано нами ранее [12]. Ожидаемыми оказались менее высокие по сравнению с суммарными АТ титры и авидность IgM АТ, образующихся при иммунизации животных рекомбинантным VP1. Вероятно, это связано с относительно короткими сроками иммунизации животных и, как следствие, недостаточной зрелостью выработанного иммунного ответа.
Для исследования перекрестных взаимодействий АТ против VP1 НВ в основном используются суррогатные модели, основанные на взаимодействии АТ с ВпЧ, сформированными VP1 разных генотипов НВ. В недавних исследованиях было показано, что моноклональные IgM были способны связывать ВпЧ, относящиеся к геногруппам GI (GI.1, GI.2, GI.3) и GII (GII.3, GII.4, GII.6, GII.13 или GII.17). Перекрестная реактивность моноклональных IgА регистрировалась только между генотипами внутри геногруппы GII. Моноклональные IgG обладали перекрестной реактивностью с ВпЧ, полученными из VP1 разных генотипов GII и одного генотипа GI.3 [26, 27].
Нами для исследования перекрестной реактивности АТ против VP1 GII.4 был применен оригинальный подход, основанный на использовании для имунноэлектронной микроскопии, выделенных от больных норовирусным гастроэнтеритом. Полученные результаты подтверждают перекрестную реактивность IgG АТ против VP1 GII.4 с другими генотипами. Однако остается неясной их нейтрализующая активность. Ранее при исследовании иммунного ответа на иммунизацию ВпЧ НВ было показано, что в сыворотке крови человека присутствуют как перекрестно реактивные, но не нейтрализующие АТ, так и более узко реактивные нейтрализующие АТ [28].
Заключение
Таким образом, полученный нами рекомбинантный VP1, образующий ВпЧ и индуцирующий выраженный иммунный ответ с формированием высокоавидных поликлональных перекрестно-реагирующих АТ, можно рассматривать как антигенный компонент прототипа кандидатной вакцины против НВ человека наиболее распространенной геногруппы GII.
Об авторах
Владислав Александрович Лапин
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Автор, ответственный за переписку.
Email: fridens.95@yandex.ru
ORCID iD: 0000-0002-5905-5722
младший научный сотрудник лаборатории иммунохимии
Россия, 603950, г. Нижний НовгородДмитрий Викторович Новиков
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: novikov.dv75@mail.ru
ORCID iD: 0000-0001-7049-6935
канд. биол. наук, доцент, ведущий научный сотрудник лаборатории иммунохимии
Россия, 603950, г. Нижний НовгородАлександр Юрьевич Кашников
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: mevirfc@mail.ru
ORCID iD: 0000-0003-1033-7347
научный сотрудник лаборатории молекулярной эпидемиологии вирусных инфекций
Россия, 603950, г. Нижний НовгородНаталия Владимировна Епифанова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: epifanovanv@mail.ru
ORCID iD: 0000-0001-7679-8029
канд. биол. наук, ведущий научный сотрудник лаборатории молекулярной эпидемиологии вирусных инфекций
Россия, 603950, г. Нижний НовгородНадежда Алексеевна Новикова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: novikova_na@mail.ru
ORCID iD: 0000-0002-3710-6648
д-р биол. наук, профессор, ведущий научный сотрудник, заведующая лабораторией молекулярной эпидемиологии вирусных инфекций
Россия, 603950, г. Нижний НовгородЕкатерина Валерьевна Мохонова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: ekaterinamohonova@yandex.ru
ORCID iD: 0000-0002-9742-7646
научный сотрудник лаборатории иммунохимии
Россия, 603950, г. Нижний НовгородДмитрий Александрович Мелентьев
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: dim-melente@yandex.ru
ORCID iD: 0000-0002-2441-6874
младший научный сотрудник лаборатории иммунохимии
Россия, 603950, г. Нижний НовгородМария Игоревна Цыганова
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: maria_che@mail.ru
ORCID iD: 0000-0002-2811-6844
канд. биол. наук, ведущий научный сотрудник лаборатории иммунохимии
Россия, 603950, г. Нижний НовгородДмитрий Евгеньевич Зайцев
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: mitya.zaitseff@yandex.ru
ORCID iD: 0000-0002-7663-6924
старший лаборант лаборатории иммунохимии
Россия, 603950, г. Нижний НовгородВиктор Владимирович Новиков
ФБУН «Нижегородский НИИ эпидемиологии и микробиологии им. академика И.Н. Блохиной» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: mbre@mail.ru
ORCID iD: 0000-0002-2449-7213
д-р биол. наук, профессор, ведущий научный сотрудник, заведующий лабораторией иммунохимии
Россия, 603950, г. Нижний НовгородСписок литературы
- Сергевнин В.И. Современные тенденции в многолетней динамике заболеваемости острыми кишечными инфекциями бактериальной и вирусной этиологии. Эпидемиология и вакцинопрофилактика. 2020; 19(4): 14–9. https://doi.org/10.31631/2073-3046-2020-19-4-14-19 https://elibrary.ru/zejihk
- Hall A.J., Wikswo M.E., Pringle K. Vital signs: foodborne norovirus outbreaks – United States, 2009–2012. MMWR Morb. Mortal Wkly Rep. 2014; 63(22): 491–5.
- Netzler N.E., Enosi Tuipulotu D., White P.A. Norovirus antivirals: Where are we now? Med. Res. Rev. 2019; 39(3): 860–86. https://doi.org/10.1002/med.21545
- Hasso-Agopsowicz M., Hwang A., Hollm-Delgado M.G., Umbelino-Walker I., Karron R.A., Rao R., et al. Identifying WHO global priority endemic pathogens for vaccine research and development using multi-criteria decision analysis. EBioMedicine. 2024; 110: 105424. https://doi.org/10.1016/j.ebiom.2024.105424
- Prasad B.V., Hardy M.E., Dokland T., Bella J., Rossmann M.G., Estes M.K. X-ray crystallographic structure of the Norwalk virus capsid. Science. 1999; 286(5438): 287–90. https://doi.org/10.1126/science.286.5438.287
- Chhabra P., de Graaf M., Parra G.I., Chan M.C., Green K., Martella V., et al. Updated classification of norovirus genogroups and genotypes. J. Gen. Virol. 2019; 100(10): 1393–406. https://doi.org/10.1099/jgv.0.001318
- Tan M., Jiang X. The p domain of norovirus capsid protein forms a subviral particle that binds to histo-blood group antigen receptors. J Virol. 2005; 79(22): 14017–30. https://doi.org/10.1128/JVI.79.22.14017-14030.2005
- Bertolotti-Ciarlet A., White L.J., Chen R., Prasad B.V., Estes M.K. Structural requirements for the assembly of Norwalk virus-like particles. J. Virol. 2002; 76(8): 4044–55. https://doi.org/10.1128/JVI.76.8.4044-4055.2002
- Fang H., Tan M., Xia M., Wang L., Jiang X. Norovirus P particle efficiently elicits innate, humoral and cellular immunity. PLoS One. 2013; 8(5): e63269. https://doi.org/10.1371/journal.pone.0063269
- Mohsen M.O., Gomes A.C., Vogel M., Bachmann M.F. Interaction of viral capsid-derived virus-like particles with the innate immune system. Vaccines (Basel). 2018; 6(3): 37. https://doi.org/10.3390/vaccines6030037
- Cates J.E., Vinjé J., Parashar U., Hall A.J. Recent advances in human norovirus research and implications for candidate vaccines. Expert. Rev. Vaccines. 2020; 19(6): 539–48. https://doi.org/10.1080/14760584.2020.1777860
- Лапин В.А., Новиков Д.В., Мохонова Е.В., Мелентьев Д.А., Цыганова М.И., Новиков В.В. и др. Получение рекомбинантного белка VP1 норовируса и его антигенные и иммуногенные свойства. Журнал микробиологии, эпидемиологии и иммунобиологии. 2024; 101(5): 661–7. https://doi.org/10.36233/0372-9311-552 https://elibrary.ru/ubmktf
- Parra G.I., Azure J., Fischer R., Bok K., Sandoval-Jaime C., Sosnovtsev S.V., et al. Identification of a broadly cross-reactive epitope in the inner shell of the norovirus capsid. PLoS One. 2013; 8(6): e67592. https://doi.org/10.1371/journal.pone.0067592
- Li X., Zhou R., Tian X., Li H., Zhou Z. Characterization of a cross-reactive monoclonal antibody against Norovirus genogroups I, II, III and V. Virus Res. 2010; 151(2): 142–7. https://doi.org/10.1016/j.virusres.2010.04.005
- Parra G.I., Abente E.J., Sandoval-Jaime C., Sosnovtsev S.V., Bok K., Green K.Y. Multiple antigenic sites are involved in blocking the interaction of GII.4 Norovirus capsid with ABH histo-blood group antigens. J. Virol. 2012; 86(13): 7414–26. https://doi.org/10.1128/JVI.06729-11
- Parker T.D., Kitamoto N., Tanaka T., Hutson A.M., Estes M.K. Identification of Genogroup I and Genogroup II broadly reactive epitopes on the norovirus capsid. J. Virol. 2005; 79(11): 7402–9. https://doi.org/10.1128/JVI.79.11.7402-7409.2005
- Shiota T., Okame M., Takanashi S., Khamrin P., Takagi M., Satou K., et al. Characterization of a broadly reactive monoclonal antibody against norovirus genogroups I and II: recognition of a novel conformational epitope. J. Virol. 2007; 81(21): 12298–306. https://doi.org/10.1128/JVI.01196-07
- Li X., Zhou R., Wang Y., Sheng H., Tian X., Li H., et al. Identification and characterization of a native epitope common to norovirus strains GII/4, GII/7 and GII/8. Virus Res. 2009; 140(1-2): 188–93. https://doi.org/10.1016/j.virusres.2009.01.015
- Yoda T., Terano Y., Suzuki Y., Yamazaki K., Oishi I., Utagawa E., et al. Characterization of monoclonal antibodies generated against Norwalk virus GII capsid protein expressed in Escherichia coli. Microbiol. Immunol. 2000; 44(11): 905–14. https://doi.org/10.1111/j.1348-0421.2000.tb02579.x
- Almanza H., Cubillos C., Angulo I., Mateos F., Castón J.R., van der Poel W.H., et al. Self-assembly of the recombinant capsid protein of a swine norovirus into virus-like particles and evaluation of monoclonal antibodies cross-reactive with a human strain from genogroup II. J. Clin. Microbiol. 2008; 46(12): 3971–9. https://doi.org/10.1128/jcm.01204-08
- Lindesmith L.C., McDaniel J.R., Changela A., Verardi R., Kerr S.A., Costantini V., et al. Sera antibody repertoire analyses reveal mechanisms of broad and pandemic strain neutralizing responses after human norovirus vaccination. Immunity. 2019; 50(6): 1530–41. https://doi.org/10.1016/j.immuni.2019.05.007
- Hansman G.S., Taylor D.W., McLellan J.S., Smith T.J., Georgiev I., Tame J.R., et al. Structural basis for broad detection of genogroup II noroviruses by a monoclonal antibody that binds to a site occluded in the viral particle. J. Virol. 2012; 86(7): 3635–46. https://doi.org/10.1128/JVI.06868-11
- Ford-Siltz L.A., Tohma K., Parra G.I. Understanding the relationship between norovirus diversity and immunity. Gut Microbes. 2021; 13(1): 1–13. https://doi.org/10.1080/19490976.2021.1900994
- Winder N., Gohar S., Muthana M. Norovirus: An overview of virology and preventative measures. Viruses. 2022; 14(12): 2811. https://doi.org/10.3390/v14122811
- Zharova A.M.D., Talayev V.Yu., Perenkov A.D., Zaichenko I.Ye., Svetlova M.V., Babaykina O.N., et al. In silico analysis of the antigenic properties of norovirus GII.4 Sydney [P16] VP1 protein. Opera Med. Physiol. 2023; 10(3): 140–51. https://doi.org/10.24412/2500-2295-2023-3-140-151
- Alvarado G., Salmen W., Ettayebi K., Hu L., Sankaran B., Estes M.K., et al. Broadly cross-reactive human antibodies that inhibit genogroup I and II noroviruses. Nat. Commun. 2021; 12(1): 4320. https://doi.org/10.1038/s41467-021-24649-w
- Park J., Lindesmith L.C., Olia A.S., Costantini V.P., Brewer-Jensen P.D., Mallory M.L., et al. Broadly neutralizing antibodies targeting pandemic GII.4 variants or seven GII genotypes of human norovirus. Sci. Transl. Med. 2025; 17(788): eads8214. https://doi.org/10.1126/scitranslmed.ads8214
- Lindesmith L.C., McDaniel J.R., Changela A., Verardi R., Kerr S.A., Costantini V., et al. Sera antibody repertoire analyses reveal mechanisms of broad and pandemic strain neutralizing responses after human norovirus vaccination. Immunity. 2019; 50(6): 1530–41.e8. https://doi.org/10.1016/j.immuni.2019.05.007
Дополнительные файлы