Выявление генов человека, потенциально участвующих в патогенезе вирусного гепатита С, на основе мультисетевого биоинформатического анализа
- Авторы: Ануфриева Е.В.1, Останкова Ю.В.1, Давыденко В.С.1, Щемелев А.Н.1, Тотолян А.А.1
-
Учреждения:
- ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» Роспотребнадзора
- Выпуск: Том 70, № 3 (2025)
- Страницы: 267-281
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16747
- DOI: https://doi.org/10.36233/0507-4088-314
- EDN: https://elibrary.ru/KFJUSV
- ID: 16747
Цитировать
Аннотация
Цель. Поиск генов человека, потенциально участвующих в патогенезе гепатита С (ГС), методом мультисетевого биоинформатического анализа связей белков, задействованных на стадиях прикрепления и проникновения вируса гепатита С (ВГС) в клетку.
Материалы и методы. Для анализа генетических и белок-белковых сетей использовали ряд веб-приложений, алгоритмы и базы данных которых дополняют друг друга. В качестве базовых генов использовали гены CD81, CLDN1, LDLR, OCLN, SCARB1, продукты которых участвуют во взаимодействии с вирусными гликопротеинами Е1 и Е2 на стадии прикрепления и проникновения ВГС в клетку. Проведен анализ данных, включающий двухэтапное балльное ранжирование выявленных генов-кандидатов по их взаимодействию с базовыми генами и присутствию в результатах сетевого анализа разных веб-ресурсов.
Результаты. При использовании трех веб-ресурсов были первично выявлены гены-кандидаты: HumanNet – 100 генов-кандидатов, GeneMania – 20, STRING – 98. По результатам пересечения трех веб-ресурсов, общее число генов-кандидатов, связанных с базовыми генами, составило 170. Общее число генов с рангом выше 4 баллов составило 35. Гены-кандидаты были сгруппированы в функциональные наборы: клеточные барьеры и межклеточные контакты (17 генов, 48,6%); липидный обмен и липопротеины (9 генов, 25,7%); иммунный ответ и взаимодействие с вирусом (5 генов, 14,3%); сигнальные пути, протеолиз и цитоскелет (4 гена, 11,4%). Выявлены следующие гены-кандидаты, потенциально участвующие в патогенезе ГС: APOA1, CLDN3, APOE, LIPC, LRPAP1, CSNK1E, APOB, CD19, CLDN6, CLDN9, ESAM, F11R, IFITM1, LDLRAP1, PCSK9, TJP1, CD9, CLDN11, CLDN17, CLDN2, CLDN5, IGSF8, MMP2, PDZK1, ADAM10, APOA2, C3, CLDN12, DAB1, GJB1, ITGB1, MYLIP, NEDD4L, PTGFRN.
Заключение. В дальнейшем детальное изучение функциональных особенностей и полиморфных вариантов выявленных генов с применением биоинформатических и лабораторных методов может существенно расширить современные представления о вовлеченности генов человека в развитие ГС и открыть новые мишени для разработки лекарственных препаратов и терапевтических стратегий.
Ключевые слова
Полный текст
Введение
По данным Всемирной организации здравоохранения, 50 млн человек в мире больны хроническим вирусным гепатитом С (ХГС), почти 400 тыс. человек ежегодно умирают от гепатита С (ГС), в основном из-за цирроза печени и гепатоцеллюлярной карциномы (ГЦК)1 [1].
Генетическая гетерогенность, характерная для вируса гепатита С (ВГС), является основной причиной быстрой адаптации вирусной популяции в организме хозяина к различным факторам отбора. Следствием вышесказанного становится то, что в 20% острого ГС наблюдается спонтанная элиминация вируса с полным восстановлением гомеостаза организма, тогда как у 80% больных отмечается прогрессирование патологического процесса с формированием хронической формы заболевания, при этом у 30% больных хроническое течение болезни осложняется циррозом печени, у 5% ‒ ГЦК [2]. Однако объяснить это только генетическим разнообразием вируса невозможно, т.к. нередки случаи, когда развитие заболевания отличалось у лиц, инфицированных одними и теми же изолятами вируса, например, при вспышках и/или авариях, а также переливании контаминированной крови. Гетерогенность клинических проявлений обусловлена, по всей видимости, комплексным взаимодействием как факторов ВГС, так и индивидуальных характеристик организма хозяина. При этом определяющую роль играют генетически детерминированные механизмы, обеспечивающие фенотипическую вариабельность ответа на вирусную инфекцию. Для ряда генов хозяина описаны мутации и полиморфные варианты, влияющие на проникновение ВГС и/или развитие заболевания [3, 4]. Существенной проблемой исследований, направленных на изучение взаимодействия патогена и хозяина, является высокая степень индивидуальной генетической вариабельности организма хозяина, включающая полиморфные варианты генов и спектр мутационных событий, потенциально ассоциированных с патогенезом вирусного ГС. Проведение всестороннего экспериментального анализа генома человека с целью выявления корреляций между генетическими маркерами хозяина и особенностями инфекционного процесса представляет собой методологическую задачу, решение которой в рамках существующих возможностей лабораторной диагностики крайне затруднено. Решением этой задачи может стать предварительное выявление с помощью методов in silico генов, потенциально способных участвовать в патогенезе ГС. При этом системность подхода должна быть обусловлена привязкой биоинформатических исследований к жизненному циклу вируса.
Проникновение ВГС в клетку во многом зависит от взаимодействия липопротеинов хозяина и гликопротеинов вирусной оболочки Е1 и Е2 с факторами, экспрессируемыми на поверхности гепатоцитов. За последние два десятилетия исследователи выявили множество факторов человека, участвующих в процессах, ведущих от прикрепления вируса к гепатоциту до рецептор-опосредованного эндоцитоза вирусной частицы и эндосомального слияния [5, 6]. Вирус прикрепляется к поверхностным протеогликанам, липидным рецепторам LDLR/VLDLR, сапрофитному рецептору SR-BI (scavenger receptor class B member 1, продукт гена SCARB1) и CD81. После латеральной транслокации вирионов к зоне плотных контактов для проникновения необходимы белки, формирующие эту зону, клаудин-1 (CLDN1) и окклюдин (OCLN). Клатрин-опосредованный эндоцитоз поглощает частицы ВГС, которые сливаются с эндосомальными мембранами после снижения pH [5]. Таким образом, проникновение ВГС является многоступенчатым процессом, требующим как минимум четырех вышеупомянутых факторов входа: сапрофитного рецептора SR-BI, тетраспанина CD81, белков CLDN1 и OCLN [7]. Вместо рецептора SR-BI, вирус также может использовать для прикрепления рецептор липопротеинов низкой плотности (LDLR) [8].
В связи с вышесказанным, гены, кодирующие белки, для которых известна связь с проникновением вируса в клетку, могут в дальнейшем рассматриваться в качестве основы для поисков генов-кандидатов патогенеза ГС с помощью биоинформатических методов анализа.
Цель работы ‒ поиск генов человека, потенциально участвующих в патогенезе ВГС-инфекции, методом мультисетевого биоинформатического анализа связей белков, задействованных на стадиях прикрепления и проникновения вируса в клетку.
Материалы и методы
В качестве основы для настоящего исследования использовали группу генов, продукты которых, согласно данным литературы, участвуют во взаимодействии с вирусными гликопротеинами Е1 и Е2 на стадии проникновения ВГС в клетку: CD81, CLDN1, LDLR, OCLN, SCARB1. Указанные гены вводили как базовые для анализа.
В настоящем исследовании для оценки генетических и белок-белковых взаимодействий использовали ряд веб-ресурсов, алгоритмы и базы данных которых обеспечивают взаимодополняющий подход [9]:
- HumanNetv3 (https://www.inetbio.org/humannet/pcs.php) ‒ веб-платформа, предназначенная для поиска и анализа генов-кандидатов, ассоциированных с заболеваниями. Этот инструмент ориентирован на изучение генома и протеома человека, что делает его особенно полезным для исследований, связанных с болезнями человека.
- Инструмент STRING (https://string-db.org), предназначенный для поиска и анализа взаимодействий генов и белков, основан на интеграции данных из различных источников.
- GeneMANIA (https://genemania.org) ‒ инструмент, который позволяет не только использовать встроенные базы данных, но и добавлять пользовательские сети взаимодействий, что делает анализ более гибким и специфичным.
В рамках настоящего исследования для всех вышеуказанных программ были установлены параметры оценки, описанные ранее [9].
Балльное ранжирование
Для объективного анализа функциональной значимости генов-кандидатов была разработана ранговая система оценки, построенная на балльном ранжировании, по аналогии с системой ранжирования, предложенной ранее [9, 10]. Предложенная методика состоит из двух этапов.
На первом этапе проводили стандартизированную оценку связи генов-кандидатов с базовыми генами по единым параметрам в рамках каждого используемого веб-ресурса. Генам-кандидатам присваивали по одному баллу за каждое выявленное взаимодействие с любым из трех базовых генов: CD81, CLDN1 или OCLN. Поскольку при проникновении ВГС в клетку гены SCARB1 и LDLR взаимозаменяемы, то за связь с одним из них также присваивали 1 балл. Таким образом, наивысшее число балов, которое может быть присвоено гену-кандидату, равно 4, при условии, что данный ген имеет связи с всеми четырьмя основными молекулами проникновения ВГС (CD81, CLDN1, OCLN, SCARB1/LDLR).
На втором этапе оценивали частоту обнаружения генов-кандидатов в сетях взаимодействий, построенных независимыми веб-ресурсами, что позволяло определить степень их функциональной значимости при использовании разных алгоритмов. Если ген-кандидат был обнаружен с использованием всех трех веб-ресурсов, то ему присуждали 3 балла, если только в двух веб-ресурсах – 2 балла. За присутствие только в одном веб-ресурсе баллы не начислялись.
Согласно формуле «Баллы_HumanNet + Баллы_STRING + Баллы_GeneMania + Баллы_пересечение_в_веб-ресурсах», минимальный проходной балл равен 4. Таким образом, для каждого анализируемого гена-кандидата были установлены минимальные критерии значимости взаимодействий с базовыми генами, подтвержденные данными, как минимум, двух независимых веб-ресурсов.
Этическое утверждение. Протокол исследования одобрен решением локального этического комитета ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» (Протокол № 152 от 22 сентября 2022 г.).
Результаты
Анализ с использованием HumanNetv3
Общее количество потенциальных генов-кандидатов на основе белок-белковых взаимодействий составило 648 генов. Поскольку для последующего функционального анализа HumanNetv3 рассматривает первую сотню кандидатов, для дальнейшей работы были отобраны гены с прогнозом AUROC до уровня ложноположительных результатов в 1% (рис. 1). При этом были исключены ложноположительные кандидаты, а также проведено ранжирование выбранных генов по оценке связей между ними и участвующими в патогенезе ГС базовыми генами CD81, CLDN1, LDLR, OCLN, SCARB1. Пороговое значение (оценка связей), используемое для выявления наиболее вероятных генов-кандидатов, отражающее близость с другими генами по правилу взвешенных соседей, составило 2,6471. Выбранные гены были ранжированы по пороговому значению от 2,6471 до 8,4774.
Рис. 1. AUROC-прогноз генов-кандидатов патогенеза гепатита С до уровня ложноположительных результатов в 1%.
Fig. 1. AUROC prediction of the candidate genes involved in the pathogenesis of HCV infection to the level of false positive results of 1%.
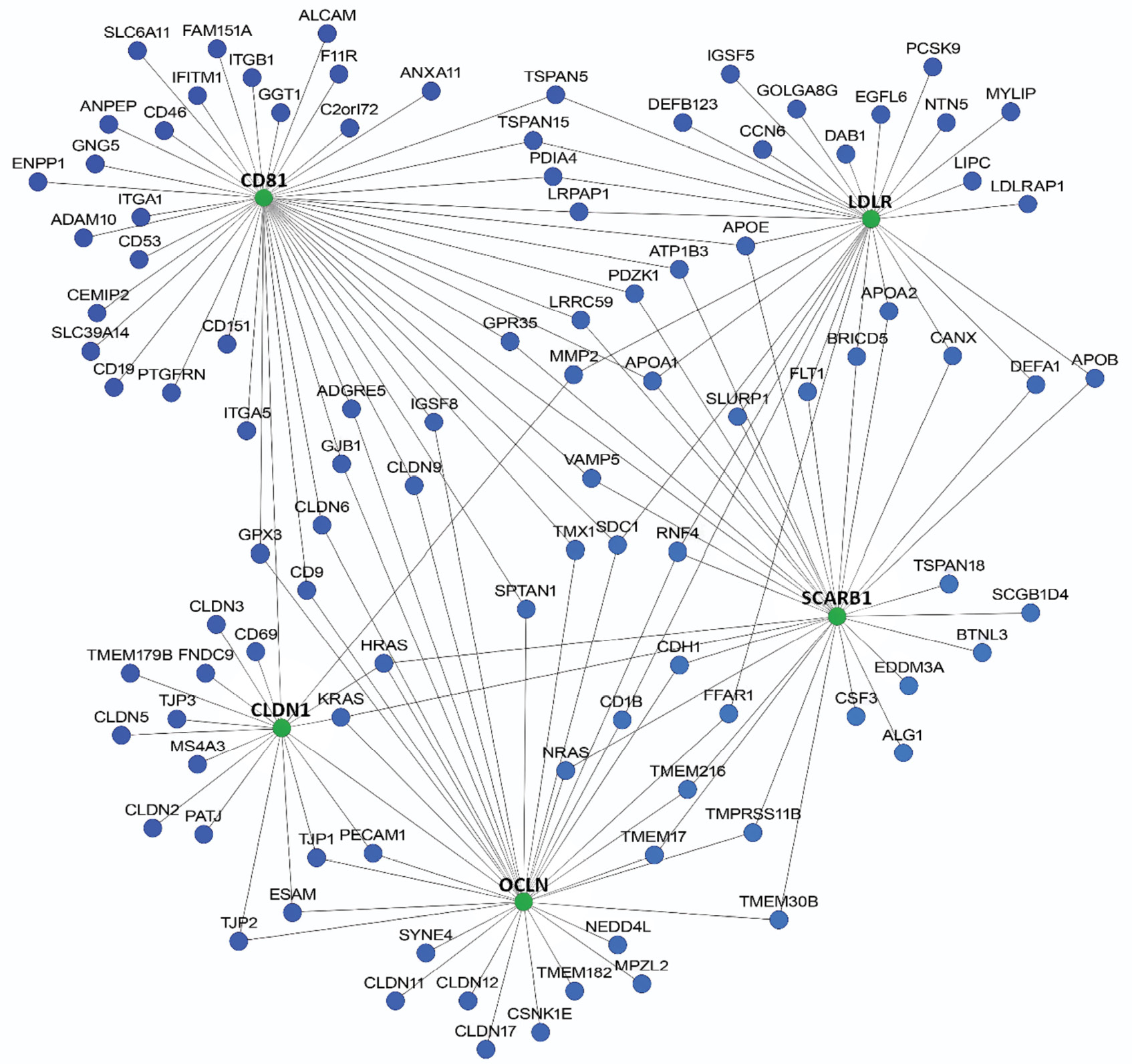
Сеть белок-белковых взаимодействий потенциальных генов-кандидатов представлена на рис. 2.
Рис. 2. Потенциальные гены-кандидаты, участвующие в инфицировании и/или развитии гепатита С (HumanNetv3, пороговая оценка > 2,6471).
Fig. 2. Potential candidate genes involved in the infection and/or development of the HCV infection (HumanNetv3, threshold score > 2.6471).
Большинство выявленных генов-кандидатов участвуют в метаболизме липидов, иммунном ответе, поддержании межклеточных контактов, а также связаны с передачей клеточных сигналов и противовирусной защитой.
Анализ с использованием STRING
Алгоритм STRING определяет гены-кандидаты, анализируя белок-белковые взаимодействия, поэтому дальнейшая характеристика этих генов и базовых генов в рамках данного ресурса охватывает физические взаимодействия и связи их белковых продуктов.
При анализе взаимодействий генов-кандидатов с базовыми генами уровень достоверности связей варьировал от 0,400 до 0,998.
В результате анализа было выявлено 103 гена-кандидата, при этом общее количество связей между генами составило 1343. Среднее число связей на один ген равнялось 24,9, а коэффициент кластеризации достиг 0,908. Важно отметить, что количество обнаруженных связей значительно превышало ожидаемое значение для данного набора генов, которое составило бы 142 (рис. 3).
Рис. 3. Сеть белок-белковых взаимодействий на основании веб-ресурса STRING.
Голубым цветом выделены связи, построенные на основании баз данных, розовым – на основании экспериментальных данных.
Fig. 3. Protein-protein interaction network based on the web resource STRING.
Connections built based on databases are indicated in blue, while those based on experimental data are shown in pink.
Основная часть генов-кандидатов относится к семействам аполипопротеинов, белков плотных контактов и иммунных регуляторов, с дополнительным вкладом в эндоцитоз и передачу сигналов. При анализе генетических и белок-белковых сетей было проведено отсечение связей между выявленными генами. В результате потенциально значимыми, согласно STRING, оказались 98 генов.
Анализ с использованием GeneMANIA
В результате анализа было выявлено 100 потенциальных генов-кандидатов, взаимодействующих с факторами входа ВГС в клетку и потенциально участвующих в патогенезе ГС. Уровень достоверности связей варьировал от 0,00038 до 1. Широкий диапазон уровней связан с тем, что данный веб-ресурс включает в анализ не только человеческие гены, но и их гомологи разных видов. На рис. 4 представлены белок-белковые взаимодействия продуктов генов-кандидатов и базовых генов.
Рис. 4. Комплексная сеть белок-белковых взаимодействий на основании веб-ресурса GeneMania.
Базовые гены помечены штриховкой. Размер шариков отражает количество связей указанного белка/гена на основании всех взаимодействий. Красным цветом отмечены физические связи, зеленым – генетические связи, фиолетовым – коэкспрессия, голубым – участие в биологических путях, оранжевым – предсказанные взаимодействия.
Fig. 4. Comprehensive protein-protein interaction network based on the web resource GeneMania.
Basic genes are marked with shading.
The size of the nodes reflects the number of connections of the specified protein/gene based on all interactions. Physical associations are indicated in red, genetic associations are indicated in green, co-expression is indicated in purple, participation in biological pathways is indicated in blue, predicted interactions are indicated in orange.
При оценке структуры комплексной сети белок-белковых взаимодействий было установлено, что большинство связей (77,64%) основаны на физических взаимодействиях между продуктами генов-кандидатов и базовых генов. На втором месте по значимости находятся связи, обусловленные коэкспрессией (8,01%). Остальные типы взаимодействий включают связи: предсказанные алгоритмом (5,37%), генетические взаимодействия (2,87%) и участие в общих биологических путях (1,88%). Из дальнейшего анализа были исключены гены-кандидаты, связи которых с другими генами основаны только совместной локализации и с общими белковыми доменами, т.к. эти критерии не обеспечивают достаточной информации для оценки функциональной значимости взаимодействий. Такие связи составили 4,23% от общего числа.
Большинство представленных генов-кандидатов связаны с транспортом липидов, иммунным ответом и межклеточной адгезией. При анализе генетической и белок-белковых сетей было проведено отсечение дублирующих связей и связей между выявленными генами. В результате потенциально значимыми, согласно GeneMania, оказались 20 генов.
Балльное ранжирование
Согласно полученным результатам оценки с использованием трех веб-ресурсов, были выявлены гены-кандидаты: HumanNet – 100 генов-кандидатов, STRING – 98, GeneMania – 20. Комплексный анализ данных позволил выявить 170 генов-кандидатов, для которых показана ассоциация с базовыми генами. В таблице представлены наиболее значимые гены-кандидаты, достигшие порогового значения (суммарный балл ≥ 4) по результатам комплексной оценки взаимодействий.
Таблица. Ранговый подсчет вклада связей в каждом веб-ресурсе для генов-кандидатов, потенциально участвующих в патогенезе ВГС-инфекции
Table. Rank count for connection contributions in each web resource for candidate genes potentially involved in the pathogenesis of HCV infection
Гены-кандидаты Candidate genes | Баллы (Score) | Итого Total | |||
HumanNet | STRING | GeneMANIA | Пересечение в веб-ресурсах Common in web resources | ||
TJP2 | 2 | 1 | 4 | 3 | 10 |
APOA1 | 2 | 1 | 3 | 3 | 9 |
CLDN3 | 1 | 2 | 3 | 3 | 9 |
APOE | 2 | 1 | 2 | 3 | 8 |
LIPC | 1 | 1 | 3 | 3 | 8 |
LRPAP1 | 2 | 1 | 2 | 3 | 8 |
CSNK1E | 1 | 1 | 2 | 3 | 7 |
APOB | 1 | 1 | 1 | 3 | 6 |
CD19 | 1 | 1 | 1 | 3 | 6 |
CLDN6 | 2 | 2 | 0 | 2 | 6 |
CLDN9 | 2 | 2 | 0 | 2 | 6 |
ESAM | 2 | 2 | 0 | 2 | 6 |
F11R | 1 | 0 | 3 | 2 | 6 |
IFITM1 | 1 | 1 | 1 | 3 | 6 |
LDLRAP1 | 1 | 1 | 1 | 3 | 6 |
PCSK9 | 1 | 1 | 1 | 3 | 6 |
TJP1 | 2 | 2 | 0 | 2 | 6 |
CD9 | 2 | 1 | 0 | 2 | 5 |
CLDN11 | 1 | 2 | 0 | 2 | 5 |
CLDN17 | 1 | 2 | 0 | 2 | 5 |
CLDN2 | 1 | 2 | 0 | 2 | 5 |
CLDN5 | 1 | 2 | 0 | 2 | 5 |
IGSF8 | 2 | 1 | 0 | 2 | 5 |
MMP2 | 2 | 1 | 0 | 2 | 5 |
PDZK1 | 2 | 1 | 0 | 2 | 5 |
ADAM10 | 1 | 1 | 0 | 2 | 4 |
APOA2 | 1 | 1 | 0 | 2 | 4 |
C3 | 0 | 1 | 1 | 2 | 4 |
CLDN12 | 1 | 1 | 0 | 2 | 4 |
DAB1 | 1 | 1 | 0 | 2 | 4 |
GJB1 | 1 | 1 | 0 | 2 | 4 |
ITGB1 | 1 | 1 | 0 | 2 | 4 |
MYLIP | 1 | 1 | 0 | 2 | 4 |
NEDD4L | 1 | 1 | 0 | 2 | 4 |
PTGFRN | 1 | 1 | 0 | 2 | 4 |
Общее количество генов-кандидатов с рангом 4 и выше составило 35. Выявленные гены-кандидаты были сгруппированы в функциональные наборы: клеточные барьеры и межклеточные контакты (17 генов, 48,6%); липидный обмен и липопротеины (9 генов, 25,7%); иммунный ответ и взаимодействие с вирусом (5 генов, 14,3%); сигнальные пути, протеолиз и цитоскелет (4 гена, 11,4%).
Обсуждение
В рамках настоящего исследования был проведен комплексный биоинформатический анализ для выявления генов-кандидатов, потенциально связанных с проникновением ВГС в клетку хозяина посредством взаимодействия с генами CD81, CLDN1, OCLN, SCARB1/LDLR. Кроме основных факторов входа ВГС в клетку, описано множество кофакторов участвующих в прикреплении вируса, с последующим слиянием с клеткой хозяина. Как правило, это гены, которые экспрессируются практически во всех тканях и органах [11].
Выявленные в настоящем исследовании гены-кандидаты можно разделить на четыре группы с учетом известных биологических функций и участия в процессах, связанных с вирусной инфекцией, иммунным ответом, клеточными барьерами и метаболизмом:
1) гены, обеспечивающие проникновение ВГС в клетку;
2) гены, участвующие в сборке вирионов ВГС;
3) гены, участвующие в иммунном ответе и хронизации ГС;
4) гены, участвующие в регуляции сигнальных путей.
1. Гены, обеспечивающие проникновение вируса гепатита С в клетку
Первая группа генов, объединяющая белки клеточных барьеров и межклеточных контактов, играет ключевую роль в поддержании структуры и функции эпителиальных и эндотелиальных барьеров, которые являются важными для проникновения и распространения ВГС в организме. В группу вошли следующие гены (в скобках указаны соответствующие баллы ранжирования): TJP2 (10), CLDN3 (9), TJP1 (6), CLDN6 (6), CLDN9 (6), F11R (6), ESAM (6), CLDN2 (5), CLDN5 (5), CLDN11 (5), CLDN17 (5), MMP2 (5), IGSF8 (5), PDZK1 (5), CLDN12 (4), GJB1 (4), DAB1 (4).
Гены плотных контактов кодируют белки, формирующие специализированные межклеточные соединения, которые регулируют межклеточный транспорт и поддерживают полярность клеток [12]. В инфекции ГС эти белки играют ключевую роль, т.к. вирус использует их для проникновения в гепатоциты. Клаудины (CLDN) – семейство трансмембранных белков, формирующих плотные контакты, которые контролируют транспорт ионов и молекул между клетками. Члены семейства клаудинов высококонсервативны, особенно в первой внеклеточной петле (EL1), которая, важна для взаимодействия с ВГС [13].
Известно, что CLDN6 и CLDN9 экспрессируются в печени, основном органе репликации ВГС, а также в периферических мононуклеарных клетках крови, дополнительном месте репликации вируса. Клаудины CLDN6 и CLDN9 способны обеспечить проникновение вируса в клетки, особенно в условиях отсутствия или подавления основного корецептора CLDN1, в отличие от CLDN2, CLDN3, CLDN4, CLDN7, CLDN11, CLDN12, CLDN15, CLDN17 и CLDN23 [14]. Однако клаудины, как и ключевые компоненты плотных контактов (TJ), играют важную роль в инициации и развитии ГЦК. Нарушение регуляции экспрессии клаудинов приводит к потере межклеточной адгезии и аберрантной клеточной сигнализации, которые тесно связаны с инвазией раковых клеток, миграцией и эпителиально-мезенхимальным переходом. Белки CLDN1, CLDN3, CLDN4, CLDN5, CLDN6, CLDN7, CLDN9, CLDN10, CLDN11, CLDN14 и CLDN17 аномально экспрессируются в ГЦК, что стимулирует прогрессирование заболевания [15] и косвенно указывает на участие в патогенезе ГС. Гены TJP1 и TJP2 (zonula occludens proteins) кодируют белки, связывающие компоненты плотных контактов с цитоскелетом, обеспечивают структурную стабильность барьера и участвуют в регуляции клеточной полярности. Данные белки участвуют на самых ранних стадиях проникновения ВГС в клетку [13, 16].
Ген PDZK1 кодирует адаптерный белок, регулирующий локализацию и функцию белков плотных контактов, включая регуляцию транспортеров и рецепторов в печени. SR-BI является основным рецептором липопротеинов высокой плотности в печени, где его экспрессия в первую очередь контролируется на посттранскрипционном уровне путем взаимодействия с каркасным белком PDZK1. Стабильное подавление экспрессии PDZK1 с помощью микроРНК в клетках гепатомы человека значительно снижает их восприимчивость к инфекции ГС. Результаты проводимого исследования указывают на косвенное участие PDZK1 в проникновении ВГС в клетку, за счет взаимодействия с рецептором SR-BI и модуляции его функциональной активности как вирусного корецептора [17].
ESAM и F11R (JAM-A) – молекулы адгезии, регулирующие межклеточные контакты и миграцию иммунных клеток, что важно для воспалительного ответа при инфекции. Было обнаружено, что ген ESAM является одним из регуляторов дифференциации звездчатых клеток печени в миофибробласты [18]. Таким образом, при хроническом воспалении печени, вызванном ВГС, изменение экспрессии ESAM может способствовать развитию фиброза и нарушению сосудистой функции. Белок F11R локализован в плотных контактах между эндотелиальными и эпителиальными клетками, где регулирует межклеточную адгезию и барьерную функцию, что влияет на проницаемость сосудов и миграцию иммунных клеток в ткани, включая печень [19]. Показано, что F11R играет ключевую роль в регуляции лейкоцитарной инфильтрации при воспалении печени и фиброгенезе [20], что свидетельствует о важной роли F11R в поддержании сосудистой целостности и контроле воспаления при хроническом повреждении печени, включая ВГС-инфекцию.
Ген MMP2 кодирует матриксную металлопротеиназу (ММР) 2. При ХГС патологическое накопление внеклеточного матрикса является основной характеристикой фиброза печени. ММР играют решающую роль в ремоделировании внеклеточного матрикса, что позволяет рассматривать MMP2 как потенциальный маркер воспаления печени. Было показано значительное повышение уровня MMP2 у пациентов с ХГС по сравнению с контрольной группой [21]. Другое исследование показало, что избыточный синтез MMP2 способствует воспалению и фиброзу печени при инфекции ГС [22].
Ген DAB1 кодирует сигнальный адаптер рилина, участвующий в клеточной миграции и развитии, особенно в нейрональной дифференцировке. Рилин ‒ это секретируемый внеклеточный гликопротеин, который играет важную роль в развитии мозга. В нескольких исследованиях была описана экспрессия рилина в звездчатых клетках печени человека [23]. Экспрессия рилина значительно коррелирует со стадиями фиброза печени и потенциально может вносить вклад в фиброгенез у пациентов с ХГС [24].
Данные прямой роли гена IGSF8 в инфекции ГС ограничены, однако IGSF8 известен как иммуноглобулиноподобный белок, участвующий в клеточной адгезии и иммунной коммуникации. Этот белок взаимодействует с тетраспанинами CD81 и CD9 и может регулировать их роль в определенных клеточных функциях, включая миграцию клеток, что может иметь значение и для вирусных инфекций [25].
Коннексин (Cx32), кодируемый геном GJB1, формирует каналы для межклеточной коммуникации и играет важную роль в регуляции роста и дифференцировки клеток печени, а также в контроле раковых стволовых клеток печени. Было показано, что Cx32 регулирует расширение популяции стволовых клеток печени и влияет на прогрессирование ГЦК через сигнальный путь PI3K/Akt [26].
ВГС инфицирует гепатоциты, которые образуют плотные клеточные контакты, регулируемые белками, описанными выше. Нарушение структуры плотных контактов или изменение экспрессии CLDN и TJP может способствовать проникновению вируса в клетки и распространению инфекции. Кроме того, изменения в адгезивных молекулах и ремоделирующих ферментах (например, MMP2) влияют на воспаление и фиброз печени, характерные для ХГС. Таким образом, эта группа генов обеспечивает структурную и функциональную основу клеточных барьеров, которые ВГС использует и модифицирует для успешной репликации и персистенции в организме.
2. Гены, участвующие в сборке вирионов вируса гепатита С
В группу вошли гены (в скобках указаны соответствующие баллы ранжирования), кодирующие ферменты, рецепторы и регуляторы метаболизма липидов, а также аполипопротеины: APOA1 (9), APOE (8), LIPC (8), LRPAP1 (8), APOB (6), PCSK9 (6), LDLRAP1 (6), APOA2 (4), MYLIP (4).
Вторая функциональная группа включает гены, связанные с липидным обменом и метаболизмом липопротеинов. Эти гены играют важную роль в формировании липовирусных частиц ВГС, а также в регуляции липидного обмена, что существенно влияет на жизненный цикл вируса и патогенез инфекции. Частицы ВГС секретируются как липовирочастицы. Эти гибридные частицы обогащены триглицеридами и эфирами холестерина и состоят из структурных белков и человеческих аполипопротеинов, включая ApoB (продукт гена APOB), ApoE (продукт гена APOE), ApoA-I (продукт гена APOA1), ApoA-II (продукт гена APOA2) и ApoC-I [27]. Белок ApoE, по-видимому, имеет двойную функцию для ВГС. Во-первых, как неотъемлемая часть частиц ВГС, ApoE способствует проникновению вируса в гепатоцит, опосредуя высокоаффинные взаимодействия с молекулами клеточной поверхности, такими как рецепторы LDLR и SR-BI [28]. Во-вторых, ApoE необходим для производства инфекционных частиц ВГС [29].
Другой ген-кандидат, PCSK9, кодирующий протеинконвертазу субтилизин/кексин типа 9, демонстрирует противовирусный эффект на ВГС в клетках и подавляет уровень экспрессии мышиного печеночного CD81 in vivo. Поэтому предполагается, что активность PCSK9 может модулировать инфекционность ВГС у людей [30]. Также PCSK9 контролирует количество LDLR на поверхности клеток, что влияет на метаболизм липидов [31], и потенциально может быть связан с патогенезом ГС.
Ген LIPC (липаза печени), кодирующий фермент, гидролизующий триглицериды и фосфолипиды в липопротеинах, влияет на метаболизм липидов и косвенно на вирусную инфекцию. Было показано, что липаза влияет на ход жизненного цикла ВГС, снижая уровни внутриклеточных триглицеридов, от которых, зависит жизненный цикл вируса [32].
Несмотря на то что прямые доказательства участия генов LDLRAP1, LRPAP1 и MYLIP в процессе проникновения ВГС в клетку в настоящее время отсутствуют, их функциональная связь с регуляцией активности рецептора LDLR позволяет предположить потенциальное косвенное влияние на механизмы вирусной инфекции.
Адаптерный белок LDLRAP1 (LDL receptor adaptor protein 1) опосредует интернализацию LDL-рецепторов [33], что может влиять на внутренний транспорт вирусных частиц. Белок MYLIP, напротив, регулирует деградацию LDL-рецепторов, тем самым влияя на уровень холестерина и, возможно, на вирусный жизненный цикл [34]. Поскольку LDLR рассматривается как один из основных факторов проникновения ВГС, можно предположить, что изменения экспрессии или активности LDLRAP1 и MYLIP могут модулировать доступность LDLR на клеточной поверхности, тем самым опосредованно влияя на эффективность вирусной инфекции. Ген LRPAP1 кодирует белок, который взаимодействует с рецепторами липопротеинов и участвует в их правильном фолдинге и локализации. В контексте вирусных инфекций, включая ГС, последние исследования показывают, что LRPAP1 может играть роль в подавлении врожденного иммунного ответа. Секретируемый LRPAP1 связывается с рецептором IFNAR1 и способствует его деградации, что ослабляет интерферон-индуцированный антивирусный ответ. Это способствует усилению инфекции различных вирусов ‒ как РНК, так и ДНК-содержащих, включая вирус гепатита В [35].
3. Гены, участвующие в иммунном ответе и хронизации гепатита С
В эту группу вошли гены (в скобках указаны соответствующие баллы ранжирования), связанные с иммунным ответом и взаимодействием с ВГС: CD19 (6), IFITM1 (6), CD9 (5), C3 (4), PTGFRN (4).
Эти гены играют ключевую роль в формировании противовирусного иммунитета и механизмах персистенции ВГС в организме человека, участвуют в распознавании вируса, активации иммунных клеток, опсонизации и подавлении вирусной репликации Их функциональные особенности во многом определяют исход инфекции – спонтанное выздоровление или хронизацию процесса [36].
Ген IFITM1, кодируюший белок, индуцируемый интерферонами (IFN), который ограничивает проникновение вирусов в клетки, включая ВГС, за счет изменения структуры мембраны, значительно ограничивает проникновение ВГС в гепатоциты, нарушая последовательные взаимодействия между вирусом и основными корецепторами хозяина, в частности CD81 и OCLN. Кроме того, IFITM1 оказывает противовирусное действие против ряда вирусов, включая ВГС на ранних стадиях инфекции [37].
Белок C3 (бета-1-C-глобулин) – компонент системы комплемента, участвует в опсонизации вирусных частиц и активации воспалительного ответа, играет ключевую роль как в классическом, так и в альтернативном путях активации комплемента. Эта система является важной частью врожденного и адаптивного иммунитета, обеспечивая элиминацию патогенов [38, 39]. Многочисленные исследования подтверждают участие системы комплемента в патогенезе широкого спектра печеночных патологий, включая вирусные гепатиты, процессы повреждения и регенерации гепатоцитов, фиброгенез, алкоголь-ассоциированное поражение печени и ишемические/реперфузионные повреждения [38]. Особый интерес представляют данные последних исследований, демонстрирующие статистически значимое снижение концентрации комплемента C3 у пациентов с ХГС, циррозом и внепеченочными проявлениями [39].
Тетраспанин D19 является маркером В-клеток, играет ключевую роль в активации и дифференцировке В-лимфоцитов, что может быть важно для выработки антител против ВГС. Ген CD9 кодирует тетраспанин, участвующий в формировании мембранных микродоменов и влияющий на клеточную адгезию, миграцию, и может участвовать в процессе вирусного проникновения и передачи. В настоящее время нет прямых исследований, которые показывали бы связь генов CD9 и CD19 с течением инфекции ГС. Однако известно, что ВГС способен поражать В-лимфоциты, которые экспрессируют CD19, а также другие клетки крови. Инфекция ГС может вызывать В-клеточные лимфопролиферативные заболевания, что указывает на возможное взаимодействие вируса с В-клетками, экспрессирующими CD19. При ХГС преимущественная ассоциация ВГС с В-клетками опосредована системой комплемента, в основном через рецептор комплемента 2 (CD21), в сочетании с комплексом CD19 и CD81 [40]. Белок CD81 связывается с другими тетраспанинами, в особенности с CD9. Этот комплекс влияет на индукцию IFN-α (член семейства интерферонов I типа) клетками, инфицированными ВГС [41].
В настоящее время ген PTGFRN, кодирующий белок, который регулирует рецептор простагландина F2α, плохо описан. Предполагается, что он связан с метастазированием при некоторых типах рака [42]. Однако его роль в патогенезе ВГС пока не описана.
4. Гены, участвующие в регуляции сигнальных путей
Последняя группа генов (в скобках указаны соответствующие баллы ранжирования) связана с регуляцией сигнальных путей, протеолизом и цитоскелетными процессами, которые играют важную роль в клеточной адгезии, миграции, внутриклеточной передаче сигналов и потенциально в взаимодействии с ВГС: CSNK1E (7), ADAM10 (4), ITGB1 (4), NEDD4L (4).
Белок ITGB1 (Integrin beta-1) является компонентом интегриновых рецепторов, обеспечивает клеточную адгезию к внеклеточному матриксу и участвует в передаче сигналов, влияющих на миграцию и выживание клеток, а также на взаимодействие с вирусом. ITGB1 взаимодействует с CD81 и действует как кофактор входа во время проникновения ВГС. Также этот белок участвует в создании функционального комплекса для регулирования организации мембраны и подвижности рецепторов [5].
Ген ADAM10 кодирует металлопротеиназу, основная функция которой – протеолиз различных клеточных белков, включая рецепторы и молекулы адгезии, что влияет на клеточную миграцию и может способствовать вирусному проникновению. ADAM10 ассоциируются с CD81, SR-BI и действуют как кофактор входа [43].
Ген NEDD4L кодирует E3-убиквитин-лигазу (NEDD4), регулирующую деградацию белков, которые участвуют в клеточной сигнализации и гомеостазе, что может влиять на вирусный жизненный цикл и иммунный ответ. Несмотря на то что нет данных, подтверждающих участие NEDD4 в патогенезе ГС, он известен как значимый в фиброзировании печени у самок мышей [44] и хорошо описан в качестве необходимого белка для репликации некоторых РНК-вирусов. Например, NEDD4 взаимодействует с богатыми пролином мотивами в вирусных доменах позднего почкования вируса Эбола, вируса бешенства и ВИЧ [45]. Кроме того, NEDD4 положительно регулирует противовирусный врожденный иммунитет, способствует продукции интерферонов I типа и провоспалительных цитокинов, некоторые из которых, как известно, участвуют в развитии воспаления печени [46].
Ген CSNK1E (Casein kinase 1 epsilon) кодирует серин/треонин-протеинкиназу, участвующую в регуляции клеточных циклов, циркадных ритмов и сигнальных путей, которые могут влиять на репликацию вируса и клеточный ответ на инфекцию. Известно, что CSNK1E участвует в контроле циркадных ритмов через фосфорилирование белков PER и CRY [47]. Нарушение циркадных ритмов может влиять на метаболизм гепатоцитов, создавая благоприятную среду для репликации ВГС. Также CSNK1E влияет на липидный обмен и развитие стеатоза печени [48], который часто сопутствует ХГС, ускоряя фиброгенез [49]. Таким образом, хотя нет данных, свидетельствующих о влиянии серин/треонин-протеинкиназы на течение инфекции ГС, она может принимать участие в патогенезе заболевания и иммунном ответе посредством вышеописанных механизмов.
Таким образом, гены 4-й группы регулируют ключевые клеточные процессы, которые ВГС использует для успешного проникновения, репликации и уклонения от иммунного ответа. Например, ADAM10 может способствовать расщеплению рецепторов, необходимых для входа вируса, а ITGB1 участвует в организации клеточного цитоскелета и миграции, что важно для распространения инфекции. CSNK1E и NEDD4L влияют на внутриклеточные сигнальные пути и протеолиз, регулируя стабильность и активность белков, участвующих в антивирусной защите и клеточном цикле.
Использование комплексного биоинформатического анализа позволило выявить гены-кандидаты, потенциально участвующие в инфицировании и прогрессировании ГС. Несмотря на то что методы in silico сыграли ключевую роль в предварительном отборе, приоритетной задачей настоящего исследования являлось обнаружение генов, критически важных для изучаемых биологических процессов. Особый интерес представляют гены-кандидаты, чей вклад в патогенез ГС ранее не был описан. Предположительно, продукты этих генов могут участвовать в инфекционном процессе опосредованно, что открывает новые направления для изучения механизмов заражения. Полученные результаты подчеркивают важность включения выявленных генов в исследования патогенеза ГС.
В качестве следующего этапа исследования представляется необходимым проведение комплексного биоинформатического анализа 35 выявленных генов, включающего оценку экспрессии, локализации продуктов выявленных генов на клеточном уровне, а также характеристику их функциональных взаимодействий и биологических путей. Такой подход позволит определить ключевые молекулярные детерминанты, модулирующие инфекционный процесс и патогенез. Также несомненный научный интерес представляет анализ патогенетической значимости полиморфных вариантов выявленных генов-кандидатов. В перспективе такие исследования будут способствовать установлению новых генетических факторов, влияющих на восприимчивость к ВГС, выявлению новых маркеров прогрессирования заболевания и расширению представления о фундаментальных механизмах инфекции ГС. Заключительным этапом должна стать экспериментальная валидация функциональной роли выявленных генов-кандидатов в патогенезе ГС.
Заключение
В настоящем исследовании с использованием комплексного биоинформатического анализа и последующего ранжирования были выявлены 35 генов-кандидатов, связанных с белками, задействованными на стадиях прикрепления и проникновения вируса в клетку, и потенциально участвующих в патогенезе инфекции. Роль большинства выявленных генов в качестве корецепторов для ВГС уже известна, особый интерес представляют гены, продукты которых ранее не рассматривались как связанные с инфицированием ВГС. Полученные результаты свидетельствуют об их потенциальном вкладе в процессы вирусного проникновения и хронизации ГС. Детальное изучение функциональных особенностей и полиморфных вариантов выявленных генов с применением биоинформатических и экспериментальных методов может существенно расширить современные представления о генетических механизмах взаимодействия вируса и организма-хозяина и открыть новые перспективы для разработки терапевтических стратегий.
1 World Health Organization. Hepatitis C. Key facts. Hepatitis C (who.int). Доступно по: https://www.who.int/news-room/fact-sheets/detail/hepatitis-c
Об авторах
Екатерина Владимировна Ануфриева
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» Роспотребнадзора
Автор, ответственный за переписку.
Email: kate.an21@yandex.ru
ORCID iD: 0009-0002-1882-529X
младший научный сотрудник лаборатории иммунологии и вирусологии ВИЧ-инфекции, аспирант
Россия, Санкт-ПетербургЮлия Владимировна Останкова
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» Роспотребнадзора
Email: shenna1@yandex.ru
ORCID iD: 0000-0003-2270-8897
канд. биол. наук, старший научный сотрудник лаборатории молекулярной иммунологии, заведующая лабораторией иммунологии и вирусологии ВИЧ-инфекции
Россия, Санкт-ПетербургВладимир Сергеевич Давыденко
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» Роспотребнадзора
Email: vladimir_david@mail.ru
ORCID iD: 0000-0003-0078-9681
младший научный сотрудник лаборатории иммунологии и вирусологии ВИЧ-инфекции
Россия, Санкт-ПетербургАлександр Николаевич Щемелев
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» Роспотребнадзора
Email: tvildorm@gmail.com
ORCID iD: 0000-0002-3139-3674
канд. биол. наук, младший научный сотрудник лаборатории иммунологии и вирусологии ВИЧ-инфекции, аспирант
Россия, Санкт-ПетербургАрег Артемович Тотолян
ФБУН «Санкт-Петербургский НИИ эпидемиологии и микробиологии имени Пастера» Роспотребнадзора
Email: totolian@pasteurorg.ru
ORCID iD: 0000-0003-4571-8799
академик РАН, д-р. мед. наук, профессор, заведующий лабораторией молекулярной иммунологии, директор, заведующий кафедрой иммунологии Первого Санкт-Петербургского медицинского университета имени академика И.П. Павлова
Россия, Санкт-ПетербургСписок литературы
- Valutite D., Ostankova Y., Semenov A., Lyalina L., Totolian A. Distribution of primary resistance mutations in Saint Petersburg in patients with chronic hepatitis C. Diagnostics (Basel). 2022; 12(5): 1054. https://doi.org/10.3390/diagnostics12051054
- Guss D., Sherigar J., Rosen P., Mohanty S.R. Diagnosis and management of hepatitis C Infection in primary care settings. J. Gen. Intern. Med. 2018; 33(4): 551–7. https://doi.org/10.1007/s11606-017-4280-y
- Stanislovaitiene D., Lesauskaite V., Zaliuniene D., Smalinskiene A., Gustiene O., Zaliaduonyte-Peksiene D., et al. SCARB1 single nucleotide polymorphism (rs5888) is associated with serum lipid profile and myocardial infarction in an age- and gender-dependent manner. Lipids Health Dis. 2013; 12: 24. https://doi.org/10.1186/1476-511X-12-24
- Itakura J., Nagayama K., Enomoto N., Sakamoto N., Tazawa J., Izumi N., et al. CD81 nucleotide mutation in hepatocellular carcinoma and lack of CD81 polymorphism in patients at stages of hepatitis C virus infection. J. Med. Virol. 2001; 63(1): 22–8.
- Gerold G., Moeller R., Pietschmann T. Hepatitis C virus entry: protein interactions and fusion determinants governing productive hepatocyte invasion. Cold Spring Harb. Perspect. Med. 2020; 10(2): a036830. https://doi.org/10.1101/cshperspect.a036830
- Zeisel M.B., Felmlee D.J., Baumert T.F. Hepatitis C virus entry. Curr. Top. Microbiol. Immunol. 2013; 369: 87–112. https://doi.org/10.1007/978-3-642-27340-7_4
- Carriquí-Madroñal B., Sheldon J., Duven M., Stegmann C., Cirksena K., Wyler E., et al. The matrix metalloproteinase ADAM10 supports hepatitis C virus entry and cell-to-cell spread via its sheddase activity. PLoS Pathog. 2023; 19(11): e1011759. https://doi.org/10.1371/journal.ppat.1011759
- Yamamoto S., Fukuhara T., Ono C., Uemura K., Kawachi Y., Shiokawa M., et al. Lipoprotein receptors redundantly participate in entry of hepatitis C virus. PLoS Pathog. 2016; 12(5): e1005610. https://doi.org/10.1371/journal.ppat.1005610
- Давыденко В.С., Останкова Ю.В., Щемелев А.Н., Ануфриева Е.В., Кушнарева В.В., Тотолян А.А. Выявление генов человека, взаимодействующих с рецепторами прикрепления ВИЧ и потенциально участвующих в патогенезе заболевания, на основе мультисетевого биоинформатического анализа. ВИЧ-инфекция и иммуносупрессии. 2024; 16(4): 28–44. https://doi.org/10.22328/2077-9828-2024-16-4-28-44
- Davydenko V.S., Ostankova Y.V., Schemelev A.N., Anufrieva E.V., Kushnareva V.V., Totolian A.A. Bioinformatically analyzed relationships between specific human genes associated with HIV attachment. Russian Journal of Infection and Immunity. 2024; 14(6): 1153–68. https://doi.org/10.15789/2220-7619-BAR-17830
- Colpitts C.C., Tsai P.L., Zeisel M.B. Hepatitis C virus entry: an intriguingly complex and highly regulated process. Int. J. Mol. Sci. 2020; 21(6): 2091. https://doi.org/10.3390/ijms21062091
- Gumbiner B.M. Breaking through the tight junction barrier. J. Cell. Biol. 1993; 123(6 Pt. 2): 1631–3. https://doi.org/10.1083/jcb.123.6.1631
- Mailly L., Baumert T.F. Hepatitis C virus infection and tight junction proteins: The ties that bind. Biochim. Biophys. Acta Biomembr. 2020; 1862(7): 183296. https://doi.org/10.1016/j.bbamem.2020.183296
- Zheng A., Yuan F., Li Y., Zhu F., Hou P., Li J., et al. Claudin-6 and claudin-9 function as additional coreceptors for hepatitis C virus. J. Virol. 2007; 81(22): 12465–71. https://doi.org/10.1128/JVI.01457-07
- Wang W., Zhou Y., Li W., Quan C., Li Y. Claudins and hepatocellular carcinoma. Biomed. Pharmacother. 2024; 171: 116109. https://doi.org/10.1016/j.biopha.2023.116109
- Park J.H., Park S., Yang J.S., Kwon O.S., Kim S., Jang S.K. Discovery of cellular proteins required for the early steps of HCV infection using integrative genomics. PLoS One. 2013; 8(4): e60333. https://doi.org/10.1371/journal.pone.0060333
- Eyre N.S., Drummer H.E., Beard M.R. The SR-BI partner PDZK1 facilitates hepatitis C virus entry. PLoS Pathog. 2010; 6(10): e1001130. https://doi.org/10.1371/journal.ppat.1001130
- Li X., Wang Q., Ai L., Cheng K. Unraveling the activation process and core driver genes of HSCs during cirrhosis by single-cell transcriptome. Exp. Biol. Med. (Maywood). 2023; 248(16): 1414–24. https://doi.org/10.1177/15353702231191109
- Rosager A.M., Sørensen M.D., Dahlrot R.H., Boldt H.B., Hansen S., Lathia J.D., et al. Expression and prognostic value of JAM-A in gliomas. J. Neurooncol. 2017; 135(1): 107–17. https://doi.org/10.1007/s11060-017-2555-0
- Brozat J.F., Brandt E.F., Stark M., Fischer P., Wirtz T.H., Flaßhove A., et al. JAM-A is a multifaceted regulator in hepatic fibrogenesis, supporting LSEC integrity and stellate cell quiescence. Liver Int. 2022; 42(5): 1185–203. https://doi.org/10.1111/liv.15187
- Abdel-Latif M.S. Plasma levels of matrix metalloproteinase (MMP)-2, MMP-9 and tumor necrosis factor-α in chronic hepatitis C virus patients. Open Microbiol. J. 2015; 9: 136–40. https://doi.org/10.2174/1874285801509010136
- Neuman M.G., Schmilovitz-Weiss H., Hilzenrat N., Bourliere M., Marcellin P., Trepo C., et al. Markers of inflammation and fibrosis in alcoholic hepatitis and viral hepatitis C. Int. J. Hepatol. 2012; 2012: 231210. https://doi.org/10.1155/2012/231210
- Samama B., Boehm N. Reelin immunoreactivity in lymphatics and liver during development and adult life. Anat. Rec. A Discov. Mol. Cell. Evol. Biol. 2005; 285(1): 595–9. https://doi.org/10.1002/ar.a.20202
- Carotti S., Perrone G., Amato M., Vespasiani Gentilucci U., Righi D., Francesconi M., et al. Reelin expression in human liver of patients with chronic hepatitis C infection. Eur. J. Histochem. 2017; 61(1): 2745. https://doi.org/10.4081/ejh.2017.2745
- Fan Y., Pionneau C., Cocozza F., Boëlle P.Y., Chardonnet S., Charrin S., et al. Differential proteomics argues against a general role for CD9, CD81 or CD63 in the sorting of proteins into extracellular vesicles. J. Extracell. Vesicles. 2023; 12(8): e12352. https://doi.org/10.1002/jev2.12352
- Li H., Wang B., Qi B., Jiang G., Qin M., Yu M. Connexin32 regulates expansion of liver cancer stem cells via the PI3K/Akt signaling pathway. Oncol. Rep. 2022; 48(3): 166. https://doi.org/10.3892/or.2022.8381
- Lee J.Y., Acosta E.G., Stoeck I.K., Long G., Hiet M.S., Mueller B., et al. Apolipoprotein E likely contributes to a maturation step of infectious hepatitis C virus particles and interacts with viral envelope glycoproteins. J. Virol. 2014; 88(21): 12422–37. https://doi.org/10.1128/JVI.01660-14
- Zeisel M.B., Felmlee D.J., Baumert T.F. Hepatitis C virus entry. Curr. Top. Microbiol. Immunol. 2013; 369: 87–112. https://doi.org/10.1007/978-3-642-27340-7_4
- Jiang J., Luo G. Apolipoprotein E but not B is required for the formation of infectious hepatitis C virus particles. J. Virol. 2009; 83(24): 12680–91. https://doi.org/10.1128/JVI.01476-09
- Labonté P., Begley S., Guévin C., Asselin M.C., Nassoury N., Mayer G., et al. PCSK9 impedes hepatitis C virus infection in vitro and modulates liver CD81 expression. Hepatology. 2009; 50(1): 17–24. https://doi.org/10.1002/hep.22911
- Маляревская О.В., Намитоков А.М., Кручинова С.В., Космачева Е.Д. Ингибиторы PCSK9: роль в снижении сердечно-сосудистой заболеваемости. Южно-Российский журнал терапевтической практики. 2022; 3(2): 32–40. https://doi.org/10.21886/2712-8156-2022-3-2-32-40
- Desrochers G.F., Filip R., Bastianelli M., Stern T., Pezacki J.P. microRNA-27b regulates hepatic lipase enzyme LIPC and reduces triglyceride degradation during hepatitis C virus infection. J. Biol. Chem. 2022; 298(6): 101983. https://doi.org/10.1016/j.jbc.2022.101983
- Hubacek J.A., Hyatt T. ARH missense polymorphisms and plasma cholesterol levels. Clin. Chem. Lab. Med. 2004; 42(9): 989–90. https://doi.org/10.1515/CCLM.2004.200
- Lindholm D., Bornhauser B.C., Korhonen L. Mylip makes an Idol turn into regulation of LDL receptor. Cell. Mol. Life Sci. 2009; 66(21): 3399–402. https://doi.org/10.1007/s00018-009-0127-y
- Останкова Ю.В., Серикова Е.Н., Ануфриева Е.В., Басина В.В., Машков И.А., Ширшова Н.Ю. и др. Прогностическая оценка развития гепатоцеллюлярной карциномы на основе определения полиморфизма гена человека IFNAR-1 и/или его экспрессии. Клиническая лабораторная диагностика. 2024; 69(7): 349–57. https://doi.org/10.51620/0869-2084-2024-69-7-349-357 https://elibrary.ru/lcckcx
- Rehermann B. Hepatitis C virus versus innate and adaptive immune responses: a tale of coevolution and coexistence. J. Clin. Invest. 2009; 119(7): 1745–54. https://doi.org/10.1172/JCI39133
- Narayana S.K., Helbig K.J., McCartney E.M., Eyre N.S., Bull R.A., Eltahla A., et al. The interferon-induced transmembrane proteins, IFITM1, IFITM2, and IFITM3 inhibit hepatitis C virus entry. J. Biol. Chem. 2015; 290(43): 25946–59. https://doi.org/10.1074/jbc.M115.657346
- Mazumdar B., Kim H., Meyer K., Bose S.K., Di Bisceglie A.M., Ray R.B., et al. Hepatitis C virus proteins inhibit C3 complement production. J. Virol. 2012; 86(4): 2221–8. https://doi.org/10.1128/JVI.06577-11
- Assem N.M., Mohammed A.I., Barry H.M.A., El Sayed I.E.T., Elmadbouh I. Serum cystatin C is an early renal dysfunction biomarker in patients with hepatitis C virus. Egypt Liver J. 2022; 12(1): 67. https://doi.org/10.1186/s43066-022-00231-x
- Wang R.Y., Bare P., De Giorgi V., Matsuura K., Salam K.A., Grandinetti T., et al. Preferential association of hepatitis C virus with CD19+ B cells is mediated by complement system. Hepatology. 2016; 64(6): 1900–10. https://doi.org/10.1002/hep.28842
- Zhang S., Kodys K., Babcock G.J., Szabo G. CD81/CD9 tetraspanins aid plasmacytoid dendritic cells in recognition of hepatitis C virus-infected cells and induction of interferon-alpha. Hepatology. 2013; 58(3): 940–9. https://doi.org/10.1002/hep.25827
- Marquez J., Dong J., Hayashi J., Serrero G. Prostaglandin F2 receptor negative regulator (PTGFRN) expression correlates with a metastatic-like phenotype in epidermoid carcinoma, pediatric medulloblastoma, and mesothelioma. J. Cell. Biochem. 2024; 125(8): e30616. https://doi.org/10.1002/jcb.30616
- Carriquí-Madroñal B., Sheldon J., Duven M., Stegmann C., Cirksena K., Wyler E., et al. The matrix metalloproteinase ADAM10 supports hepatitis C virus entry and cell-to-cell spread via its sheddase activity. PLoS Pathog. 2023; 19(11): e1011759. https://doi.org/10.1371/journal.ppat.1011759
- Chen C., Bi Y., Chen B., He S. Nedd4L signaling contributes to carbon tetrachloride-induced liver fibrosis in female mice and is associated with enteric dysbacteriosis. Gastroenterol. Rep. (Oxf.). 2025; 13: goaf022. https://doi.org/10.1093/gastro/goaf022
- Chesarino N.M., McMichael T.M., Yount J.S. E3 ubiquitin ligase NEDD4 promotes influenza virus infection by decreasing levels of the antiviral protein IFITM3. PLoS Pathog. 2015; 11(8): e1005095. https://doi.org/10.1371/journal.ppat.1005095
- Gao P., Ma X., Yuan M., Yi Y., Liu G., Wen M., et al. E3 ligase Nedd4l promotes antiviral innate immunity by catalyzing K29-linked cysteine ubiquitination of TRAF3. Nat. Commun. 2021; 12(1): 1194. https://doi.org/10.1038/s41467-021-21456-1
- Zhou L., Fitzpatrick K., Olker C., Vitaterna M.H., Turek F.W. Casein kinase 1 epsilon and circadian misalignment impact affective behaviours in mice. Eur J Neurosci. 2022; 55(9-10): 2939-2954. https://doi.org/10.1111/ejn.15456
- Leya M., Jeong H., Yang D., Ton Nu Bao T.H., Pandeya P.R., Oh S.I., et al. Hepatocyte-specific casein kinase 1 epsilon ablation ameliorates metabolic dysfunction-associated steatohepatitis by up-regulating tumor necrosis factor receptor-associated factor 3 in mice. Am. J. Pathol. 2024; 194(11): 2106–27. https://doi.org/10.1016/j.ajpath.2024.08.003
- Harrison S.A. Steatosis and chronic hepatitis C infection: mechanisms and significance. Clin. Gastroenterol. Hepatol. 2005; 3(10 Suppl. 2): S92–6. https://doi.org/10.1016/s1542-3565(05)00706-8
Дополнительные файлы