Анализ генетических полиморфизмов и мутаций лекарственной устойчивости в области NS5 генома ВГС (Flasuviricetes: Amarillovirales: Flaviviridae: Hepacivirus C) в образцах, полученных от ВИЧ-инфицированных лиц без опыта терапии в Алтайском крае в 2022–2023 гг.
- Авторы: Лаповок И.А.1, Сыркина А.В.1, Кириченко А.А.1, Шлыкова А.В.1, Лукьяненко Н.В.2, Сафьянова Т.В.2, Сафронова А.Е.2, Шевченко В.В.2,3, Киреев Д.Е.1
-
Учреждения:
- ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
- ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
- КГБУЗ «Алтайский краевой центр по профилактике и борьбе со СПИДом и инфекционными заболеваниями»
- Выпуск: Том 70, № 3 (2025)
- Страницы: 224-233
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16722
- DOI: https://doi.org/10.36233/0507-4088-298
- EDN: https://elibrary.ru/NZBCOE
- ID: 16722
Цитировать
Аннотация
Введение. Алтайский край в течение последних лет относится к региону, неблагополучному по инфекциям, вызванным вирусами иммунодефицита человека (ВИЧ) и гепатита С (ВГС). Наибольшую опасность представляет коинфекция ВИЧ-1 и ВГС. Существует необходимость оценки генетических вариантов ВГС и их лекарственной устойчивости (ЛУ) к препаратам прямого противовирусного действия (ПППД) у пациентов с коинфекцией ВИЧ-1 и ВГС.
Цель исследования. Определение генетического варианта ВГС и генетических особенностей вируса, связанных с его чувствительностью к ингибиторам NS5A и NS5B, в образцах, полученных от жителей Алтайского края без опыта терапии, с недавно выявленными ВИЧ-инфекцией и коинфекцией ВГС.
Материалы и методы. Коллекцию образцов плазмы крови, собранную в 2022–2023 гг. (n = 286) от ВИЧ-инфицированных лиц, подвергали анализу на наличие маркеров ВГС. Определяли концентрацию РНК ВГС в образцах, получали нуклеотидные последовательности (сиквенсы) фрагментов NS5A и NS5B и Core (для образцов ВГС 2k/1b), определяли субтип и проводили анализ ЛУ и полиморфных позиций.
Результаты. Антитела к ВГС были выявлены в 94/286 (32,86%) образцах, для 52 образцов были получены сиквенсы. К субтипам 3a, 1b, рекомбинантной форме 2k/1b и субтипу 1a относились 28 (53,85%), 17 (32,69%), 5 (9,62%) и один (1,92%) образец. Еще один образец содержал микс-инфекцию ВГС 1b + 3a. Чаще всего сниженная чувствительность и полная устойчивость выявлялись к ингибитору NS5A даклатасвиру: у 5,66 и 9,43% ВГС соответственно. Кроме того, в сиквенсах был выявлен ряд полиморфизмов.
Заключение. Полученные результаты могут косвенно свидетельствовать об увеличении доли ВГС субтипа 3a в эпидемии гепатита C в Алтайском крае, т.к. касаются лишь пациентов с недавно выявленной ВИЧ-инфекцией и коинфекцией ВГС. Данные о выявленных мутациях и генетических полиморфизмах должны быть учтены при назначении специфической терапии пациентам.
Ключевые слова
Полный текст
Введение
К началу 2020-х гг. хроническая форма инфекции, вызванной вирусом гепатита С (ВГС), в мире была выявлена более чем у 70 млн человек, причем у порядка 15 млн человек – на территории Европы [1]. По данным Всемирной организации здравоохранения (ВОЗ), в 2022 г. от последствий инфекции ВГС в мире умерли приблизительно 242 тыс. человек1.
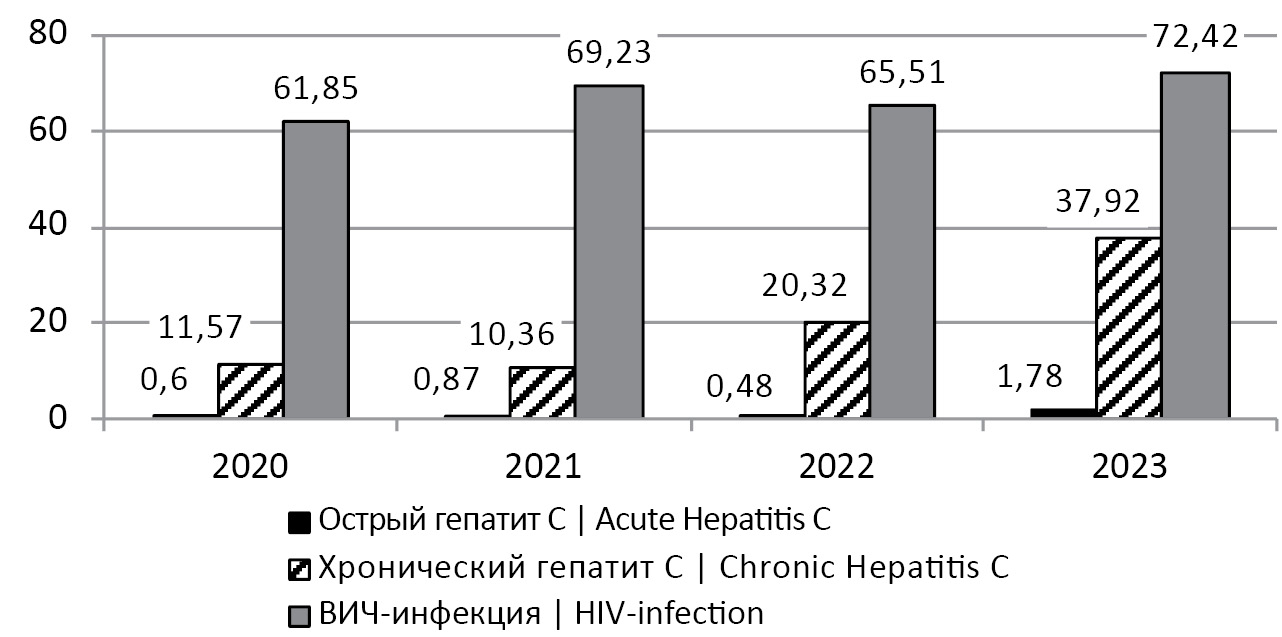
Проблема распространения таких инфекций, как ВГС и вирус иммунодефицита человека (ВИЧ-1), остро стоит как России в целом, так и в отдельных регионах страны. Алтайский край в течение последних лет относится к региону, неблагополучному по ВИЧ-инфекции. Так, заболеваемость ВИЧ-инфекцией в период 2020–2023 гг. не опускалась ниже 61 случая на 100 тыс. населения, достигнув в 2023 г. рекордного показателя в 72,42 на 100 тыс. населения (рис. 1)2,3,4,5. При этом более 65% лиц с ВИЧ-инфекцией, выявленных в Алтайском крае с 1990 по 2023 г., были старше 30 лет, т.е. относились к социально и экономически активному населению6.
Рис. 1. Заболеваемость (на 100 тыс. населения) острым, хроническим гепатитом C и ВИЧ-инфекцией в Алтайском крае в 2020–2023 гг.
Fig. 1. Incidence (per 100 thousand population) of acute, chronic hepatitis C and HIV infection in Altai Krai in 2020–2023.
Установленное незначительное снижение заболеваемости гепатитом С и ВИЧ-инфекцией в Алтайском крае в 2021–2022 гг., вероятно, связано с эпидемией COVID-19, при которой режим самоизоляции не позволял эффективно выявлять новые случаи инфекции ВИЧ-1 и ВГС. В Европе в целом в 2020–2021 гг. отмечалось снижение заболеваемости ВГС-инфекцией: с 6,6 случая на 100 тыс. населения в 2019 г. до 4,7 на 100 тыс. населения к 2021 г. Однако уже в 2022 г. этот показатель возрос до 6,5 на 100 тыс. населения [1]. Так, и в Алтайском крае был зарегистрирован рост заболеваемости острым (ОГС) и хроническим гепатитом С (ХГС) в 2023 г.: до 1,78 и 37,92 на 100 тыс. населения соответственно (рис. 1)2–5.
Сложность коинфекции ВИЧ-1 и ВГС (ВИЧ-1/ВГС) обусловлена тем, что обе инфекции могут усиливать течение друг друга. Излечение ВИЧ-инфекции, кроме отдельных уникальных случаев, невозможно, что требует пожизненной терапии. В случае ВГС-инфекции имеют место случаи полного излечения ОГС, частота которого достигает, по одним данным, 18–34% [2], по другим – 15–45% [3]. В остальных случаях развивается хроническая инфекция, способная привести к циррозу печени, гепатоцеллюлярной карциноме (ГЦК) и печеночной недостаточности, что особенно опасно на фоне приема антиретровирусной терапии (АРТ) против ВИЧ-1 [3, 4]. В результате у пациентов с ВИЧ-1/ВГС-коинфекцией, по сравнению с моноинфекцией ВГС, более чем в 5 раз чаще развиваются тяжелые заболевания печени [5]. У пациентов с коинфекцией в 2 раза выше риск развития цирроза печени [6], по сравнению с больными с моноинфекцией ВГС. Наконец, у пациентов с коинфекцией чаще, чем у пациентов только с ВИЧ-инфекцией, развивается хроническая болезнь почек (почти на 50%) и острая почечная недостаточность (почти на 64%) [7]. Как результат, смертность при коинфекции ВГС/ВИЧ-1 выше, чем при моноинфекции [3, 5].
В настоящее время зарегистрировано 8 генотипов и более 100 субтипов ВГС [8], однако число известных субтипов вируса постоянно растет. Наиболее часто в России фиксируется инфекция ВГС субтипов 1b, 1a и 3a [4]. При этом доминирующим вариантом является субтип 1b. На его долю в России в 2016 г. приходилось около 55% случаев ВГС-инфекции [9]. На 1 ноября 2024 г. 46,1 и 36,2% всех нуклеотидных последовательностей генома ВГС из России (n = 1593), загруженных в международную базу данных института Лос-Аламос, США (https://hcv.lanl.gov/), относились к субтипам 1b и 3a соответственно.
Распределение генотипов ВГС в России неоднородно. Так, в исследовании 2022 г., посвященном анализу ВГС в 35 регионах России, было показано, что в стране в целом на долю генотипа 1 ВГС приходится 53,6% инфекций, а на генотип 3 – 35,4%. В то же время на Дальнем Востоке страны 60 и 39% случаев ВГС-инфекции было вызвано вирусом генотипов 1 и 3 соответственно; в Центральном федеральном округе соотношение этих субтипов составило 58%/35%, в Северо-Западном федеральном округе – 52%/41%, в Южном федеральном округе – 53%/38%, в Северо-Кавказском федеральном округе – 58%/34%, в Приволжском федеральном округе – 59%/35%, а в Уральском федеральном округе – 57%/35%. В Сибирском федеральном округе, куда входит исследуемый Алтайский край, на инфекцию ВГС с генотипом 1 и 3 приходится 50 и 43% случаев соответственно [10].
Кроме описанных генотипов ВГС, на территории страны циркулирует также рекомбинантная форма 2k/1b, впервые описанная в 2002 г. в Санкт-Петербурге. Вероятно, он появился в СССР в период 1923–1956 гг. Точка рекомбинации между 2k и 1b находится в регионе NS2 генома вируса, таким образом, все структурные гены 2k/1b относятся к субтипу 2k, а неструктурные – к 1b [11, 12].
В 2016 г. была разработана программа ВОЗ по ликвидации ВГС в мире к 2030 г. В соответствии с ней должны быть предприняты мероприятия, сокращающие число случаев заболевания ВГС на 90%, а смертности – на 65%. При этом доля выявленных лиц с ВГС-инфекцией должна достичь 90%, а доля вылеченных – 80%7 [1, 3].
Схема терапии, включающая пегилированный интерферон (peg-IFN) и рибавирин, на протяжении многих лет была стандартом лечения пациентов с ХГС [4]. Однако с 2011 г. для лечения ВГС-инфекции стали применять препараты прямого противовирусного действия (ПППД), направленные на ингибирование вирусных неструктурных белков NS3/4A (белок сочетает функции протеазы и геликазы), NS5A (многофункциональный белок, участвующий в вирусной репликации и сборке) и NS5B (РНК-зависимая РНК-полимераза) [2–4]. Применение ПППД позволило достичь устойчивого вирусологического успеха более чем в 90% случаев терапии ХГС, одновременно сокращая длительность лечения до 12 нед [3, 9, 13].
Несмотря на то что в клиническую практику внедрены пангенотипические ПППД, универсальные для всех вариантов ВГС, доминирующих в мире [8], определение генотипа вируса остается актуальной задачей. Генотип ВГС определяет как течение инфекции, так и стратегию терапии ВГС-инфекции. Так, субтип 1b менее чувствителен к препаратам на основе интерферона, в связи с чем для терапии ВГС 1b рекомендовано применение препаратов ПППД [9]. Более того, лишь 50% случаев применения peg-IFN-α и рибавирина для лечения ВГС генотипов 1 и 4 приводило к устойчивому вирусологическому успеху, в то время как побочные эффекты такой терапии отмечались как минимум у 10% пациентов. ВГС субтипа 3a чувствителен к терапии интерфероном, а вирус субтипа 1a быстрее вырабатывает лекарственную устойчивость (ЛУ) к ПППД по сравнению с ВГС субтипа 1b [3].
До введения в широкую практику ПППД отдельной проблемой оставалась терапия ВГС-инфекции, вызванной генетическим вариантом 2k/1b. При неверном генотипировании его как вируса генотипа 2 для лечения пациента могла быть назначена терапия на основе peg-IFN и рибавирина, чувствительность к которым у 2k/1b снижена, как и у вируса субтипа 1b [11]. Несмотря на то что в настоящее время рекомендации по лечению ВГС не включают эту схему, существует необходимость в адекватной дифференциации 2k/1b от других вирусных вариантов при исследовании генетического разнообразия и эпидемиологии ВГС.
Широкое применение ПППД неотвратимо приводит к проблеме ЛУ, в том числе передаваемой устойчивости, т.е. резистентности вируса у пациентов без опыта терапии. Исследование 2022 г. в Северо-Кавказском федеральном округе показало, что 5/42 (12%) пациентов без опыта терапии имели ВГС с мутациями как минимум к одному ПППД [4]. При этом разные генотипы ВГС, как правило, различаются по частоте встречаемости тех или иных мутаций ЛУ.
Наиболее значимой с клинической точки зрения является ЛУ к ингибиторам белка NS5A, поскольку он является мишенью препаратов первой линии терапии [9]. Хорошо известны нуклеотидные замены как минимум в 12 положениях NS5A, связанные с устойчивостью к ингибиторам этого белка [2]. При этом наиболее важными и часто встречаемыми в мире являются замены в позициях 28, 30, 31 и 93 [14]. Справедливо это и для России. Исследование 2018 г. показало, что среди вариантов ВГС субтипа 1b, циркулирующих в Москве в 2008–2014 гг., с частотой более 22% встречается ЛУ к ингибиторам NS5A, причем наиболее часто выявлялись замены R30Q, L31M и Y93H в белке NS5A [9]. Присутствие комбинаций замен L31F + Y93H или Y93H + A62S/T + A30K может быть прогностическим признаком неэффективности терапии даклатасвиром у ВГС 3-го генотипа [13, 14]. А присутствие комбинации S98G + Y93H в NS5A способно двукратно увеличить устойчивость вируса 3-го генотипа к даклатасвиру по сравнению с ВГС, содержащим только Y93H [15]. Между тем неуспех терапии ингибиторами NS5A был отмечен и у пациентов с инфекцией ВГС и сочетанием мутации S98G с заменами A30K либо A62T [4, 15].
Прекрасно себя зарекомендовало комбинированное применение ингибиторов NS5A совместно с ингибиторами NS5B. Например, одновременное применение ингибиторов NS5A даклатасвира или велпатасвира совместно с ингибитором NS5B софосбувиром внесено в Программу по контролю гепатита C в Пакистане, государстве, занимающем 2-е место по степени пораженности населения ВГС [13].
Известны 24 мутации устойчивости ВГС к ингибиторам NS5B [2]. Анализ фрагмента NS5B ВГС от российских пациентов из Северо-Западного федерального округа с недавно выявленной ВИЧ-инфекцией в 2020 г. показал, что среди образцов ВГС субтипа 3a редко выявляли замену D310N (неблагоприятный маркер прогрессирования ВГС-инфекции к патологии печени), а среди почти 30% вирусов субтипа 1b обнаруживали замену C316N, связанную с устойчивостью низкого уровня к тегобувиру [3]. Замена E237G способна снизить чувствительность к различным ПППД – ингибиторам NS5B [4].
Кроме того, описан ряд полиморфизмов NS5B, чье присутствие не исследуется при оценке ЛУ, но которые потенциально способны оказать влияние на эффективность терапии. Полиморфизмом генетического варианта называют замену в позиции генома (в сравнении с референтной последовательностью), распространенную более чем в 1% образцов этого варианта. Сочетание полиморфизмов D148N + I363V, A150V + I363V и T227S + S183P NS5B способно снизить чувствительность вируса субтипа 3a к рибавирину в 1,3–1,6 раза [16], а замена A150V у ВГС генотипа 3 – снизить чувствительность к интерферону-α более чем в 12 раз [17].
Цель исследования – анализ фрагментов генома ВГС, кодирующих белки NS5A и NS5B, в образцах, полученных от жителей Алтайского края без опыта терапии, с недавно выявленными ВИЧ-инфекцией и коинфекцией ВГС, для определения генетического варианта ВГС и генетических особенностей вируса, связанных с его чувствительностью к ингибиторам NS5A и NS5B.
Материалы и методы
В 2022–2023 гг. на базе Алтайского краевого центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями (Центр СПИД) в рамках рутинного анализа ВИЧ-1 и ВГС-инфекции была собрана коллекция образцов плазмы крови пациентов Центра СПИД с недавно выявленной ВИЧ-инфекцией без опыта специфической противовирусной терапии.
Исследование было одобрено ЛЭК ЦНИИ Эпидемиологии (протокол № 93 от 18.06.2019).
Факт наличия антител к ВГС, устанавливали методом иммуноферментного анализа с помощью тест-системы «Бест анти-ВГС» («Вектор Бест», Новосибирск, РФ).
Концентрацию РНК (вирусную нагрузку, ВН) ВГС в образцах плазмы крови определяли с помощью набора реагентов «АмплиСенс HCV-Монитор-FL» (ФБУН ЦНИИЭ, Москва, РФ).
Последующую экстракцию РНК, амплификацию и секвенирование фрагментов NS5A (с 1-й по 117-ю аминокислоту) и NS5B (c 148-й по 556-ю аминокислоту) проводили с помощью набора реагентов «АмплиСенс HСV-Resist-Seq» (ФБУН ЦНИИЭ, Москва, РФ) и генетического анализатора Applied Biosystems 3500 (LifeTechnologies, США).
Для полученных нуклеотидных последовательностей проводили определение генетического варианта ВГС и ЛУ с помощью онлайн-приложения HCVBlast информационного ресурса института Лос-Аламос (США) [18] и онлайн-приложения geno2pheno[HCV] информационного портала некоммерческого научного общества «Генофор» [19]. Интерпретацию степени ЛУ выполняли с помощью онлайн-приложения geno2pheno[HCV]: вирус устойчив (в случае присутствия хорошо охарактеризованной мутации, связанной с ЛУ) и сниженная чувствительность (в случае присутствия мутации, предполагаемо связанной с резистентностью, но для которой собрано недостаточно доказательств клинического исхода) [19].
Для образцов, отнесенных на основании анализа NS5A- и NS5B-фрагментов к рекомбинантной форме ВГС 2k/1b, осуществляли дополнительное секвенирование фрагмента Core генома ВГС (c 8-й по 191-ю аминокислоту) с помощью внутрилабораторной методики и секвенирования по Сэнгеру [20], а затем – анализ нуклеотидных последовательностей Core с помощью HCVBlast [18].
Анализ нуклеотидных последовательностей на предмет наличия полиморфизмов проводили в программе MEGA 6.0 [21]. Анализу подвергали нуклеотидные позиции NS5A и NS5B, описанные в литературе [2, 4, 9, 13–17, 22].
Результаты
Было собрано 286 образцов плазмы крови от ВИЧ-инфицированных лиц – 139 (48,60%) мужчин и 147 (51,40%) женщин. Основным путем инфицирования ВИЧ-1 для пациентов был половой 247 (86,36%), для 39 (13,64%) – потребление инъекционных наркотиков (ПИН). Чаще к уязвимой группе ПИН относились лица мужского пола – 31/39 (79,49%) человек, при том среди лиц с половым путем инфицирования мужчины составляли лишь 46,96% (116/247). Средняя длительность инфекции от момента постановки диагноза до забора образца на исследование составило 15 сут (95% доверительный интервал (ДИ) 12,42–18,76).
В общей сложности у 94/286 (32,86%) человек была выявлена ВГС-инфекция. Среди 94 пациентов с ВИЧ-1/ВГС-коинфекцией 57 (60,64%) были мужчинами. Средний возраст пациентов составил 41 год (95% ДИ 39,23–42,70). Наиболее часто коинфекцию выявляли у мужчин в возрастной группе 35–44 года и у женщин в возрастной категории 55–64 года. В общей сложности 34/94 (36,17%) пациент с коинфекцией относился к уязвимой группе ПИН, в то время как с моноинфекцией ВИЧ-1 – лишь 5/192 (2,60%) пациента.
ВН ВГС < 150 МЕ/мл имели 34/94 (36,17%) образцов от пациентов с коинфекцией, что не позволяло провести их дальнейший генетический анализ. Средний показатель ВН в оставшихся 60 образцах составил 6,96 Log (95% ДИ 6,75–7,11) МЕ/мл. Для 52/60 (86,67%) образцов с ВН ВГС > 150 МЕ/мл удалось получить нуклеотидные последовательности фрагментов NS5A и NS5B генома ВГС.
Анализ генотипа на основе полимеразной цепной реакции (ПЦР) в реальном времени и последующий анализ с помощью HCVBlast и geno2pheno[HCV] позволил установить, что в 28/52 (53,85%) образцах был выявлен ВГС, который относился к субтипу 3a, в 17 (32,69%) образцах – к субтипу 1b, в 5 (9,62%) – к рекомбинатной форме 2k/1b, в одном образце – к субтипу 1a. В образце, полученном от пациентки 25 лет из Барнаула с путем инфицирования ПИН и длительностью ВИЧ-инфекции около 6 мес, были выявлены ВГС типов 1a и 3a, что свидетельствует об инфицировании сразу двумя вариантами ВГС.
Рекомбинантная природа всех 5 образцов с ВГС 2k/1b была подтверждена анализом фрагмента Core. Интересно было то, что все 5 образцов 2k/1b по NS5B были отнесены программой geno2pheno[HCV] к ВГС субтипа 1b, в то время как аналогичный анализ NS5A и анализ обоих фрагментов в HCVBlast позволил безошибочно выявить вариант 2k/1b.
Поскольку один образец имел микс-инфекцию двумя вариантами ВГС, дальнейшему анализу подвергались 53 генома вируса. Результат анализа ЛУ к ингибиторам NS5A и NS5B с помощью приложения geno2pheno[HCV] представлен на рис. 2. Препараты омбитасвир (ингибитор NS5A) и дасабувир (ингибитор NS5B) не рекомендованы для терапии инфекции, вызванной ВГС субтипа 3a. Таким образом, оценку ЛУ к этим препаратам проводили для 24 геномов не 3a-субтипов.
Рис. 2. Результат анализа лекарственной устойчивости к ингибиторам NS5A и NS5B всех нуклеотидных последовательностей ВГС (n = 53) и не 3a-субтипов (n = 24).
Fig. 2. Result of drug resistance analysis to NS5A and NS5B inhibitors of all HCV nucleotide sequences (n = 53) and non-3a subtypes (n = 24).
Результат анализа мутаций ЛУ, полиморфизмов и нетипичных мутаций в критически важных для ЛУ положениях исследованных геномных фрагментов приведен в таблице.
Таблица. Результат анализа нуклеотидных последовательностей ВГС (n = 53) на наличие мутаций ЛУ и важных полиморфизмов
Table. Results of HCV nucleotide sequence (n = 53) analysis for the presence of DR mutations and significant polymorphisms
Замена Substitution | Субтип 3a Subtype 3a, абс./abs. (%) (n = 29) | Субтип 1b Subtype 1b, абс./abs. (%) (n = 17) | 2k/1b, абс./abs. (%) (n = 5) | Субтип 1a Subtype 1a, абс./abs. (%) (n = 2) | Препарат, на который влияет замена The drug affected by substitution |
Фрагмент NS5A (aa. 1–117), абс. (%) NS5A fragment (aa. 1–117), abs. (%) | |||||
M28V | – | – | – | 1 (50) | Велпатасвир, омбитасвир Velpatasvir, ombitasvir |
R30Q | – | 1 (5,88) | 1 (20) | – | Даклатасвир, омбитасвир Daclatasvir, ombitasvir |
R30H | – | 1 (5,88) | – | – | Даклатасвир Daclatasvir |
A30K | 3 (10,35) | – | – | – | Элбасвир, ледипасвир, пибрентасвир, велпатасвир, даклатасвир Elbasvir, ledipasvir, pibrentasvir, velpatasvir, daclatasvir |
A62L | 1 (3,45) | – | – | – | Даклатасвир Daclatasvir |
A30S/T | 2 (6,90) | – | – | – | |
L31M | – | 1 (5,88) | – | – | |
A62S | 22 (75,86) | – | – | – | |
A62T | 3 (10,35) | – | – | – | |
A62V | 2 (6,90) | – | – | – | |
A92V | – | – | 1 (20) | – | |
Y93H | – | – | – | – | |
S98G | 6 (20,70) | – | – | – | |
P587S | – | 1 (5,88) | – | – | |
Фрагмент NS5B (aa. 148–556), абс. (%) NS5B fragment (aa. 148–556), abs. (%) | |||||
L159F | – | 7 (41,18) | – | – | Софосбувир Sofosbuvir |
S556G | – | 3 (17,65) | – | – | Дасабувир, софосбувир Dasabuvir, sofosbuvir |
C316N | – | 9 (52,94) | – | – | Тегобувир Tegobuvir |
S368A | – | 1 (5,88) | – | – | |
N444D | – | – | – | 2 (100) | |
C451H/T/Y | – | 4 (23,53) | – | – | |
S556A | – | 1 (5,88) | – | – | |
D148N | – | – | – | – | |
A150V | 7 (24,14) | – | – | – | |
S183P | – | 17 (100) | 5 (100) | 2 (100) | |
T227S | – | – | – | – | |
E237G | – | – | – | – | |
D310N | 24 (82,76) | – | – | – | |
I363V | – | – | – | – | |
Чаще всего сниженная чувствительность и полная устойчивость выявлялись к ингибитору NS5A даклатасвиру: в 5,66 и 9,43% вирусах соответственно. Это было связано с мутациями R30Q/H и L31M у 3 вирусов субтипа 1b и одного 2k/1b, а также заменой A30K и A62L у 3 и одного вирусов субтипа 3a соответственно. Упомянутая замена A30K обуславливала устойчивость к элбасвиру и ледипасвиру, равно как и замена L31M, выявленная у одного вируса субтипа 1b. Стоит также отметить высокий уровень полиморфизма в 62-м положении у вирусов субтипа 3a: 22 (75,86%) образца содержали замену A62S, еще 5 – A62T/V, и лишь один – связанную с ЛУ к даклатасвиру A62L.
Упомянутые выше два образца (субтипа 1b и 2k/1b) с заменой R30Q и устойчивостью к даклатасвиру были устойчивы и к омбитасвиру. А вирус субтипа 1a из образца с микс-инфекцией двумя вариантами ВГС имел сниженную чувствительность к велпатасвиру и омбитасвиру из-за мутации M28V. При этом у вируса субтипа 3a от той же пациентки не было выявлено никакой устойчивости.
Также 6 (20,69%) вирусов субтипа 3a содержали замену S98G. Однако ни в одном образце не была выявлена связанная с ней мутация Y93H.
Во фрагменте NS5B мутации ЛУ были выявлены лишь среди вирусов субтипа 1b: мутации L159F и S556G, ассоциированные с ЛУ к софосбувиру, содержали 7 (41,18%) и 3 (17,65%) образцов соответственно. Еще 9 (52,94%) вирусов субтипа 1b содержали мутацию ЛУ к тегобувиру C316N.
В 24 (82,76%) вирусах субтипа 3a был выявлен полиморфизм D310N, а замена A150V присутствовала у 7 (24,14%) вирусов этого генетического варианта.
Что касается сочетаний полиморфизмов в позициях 148, 183, 227 и 363, влияющих на чувствительность ВГС субтипа 3a к рибавирину, то был выявлен лишь полиморфизм S183P у всех вирусов субтипа 1b, 2k/1b и 1a. Но ни один образец субтипа 3a не содержал эту замену.
Наконец, в исследуемых нуклеотидных последовательностях NS5B были обнаружены полиморфизмы, не связанные с ЛУ, но в позициях, критичных для устойчивости вируса к дасабувиру. Всего 4 (23,53%) вируса субтипа 1b содержали полиморфизмы C451H/T/Y, и ни один не содержал мутацию ЛУ в этом положении C451S. Один образец 1b имел замену S368A вместо S368T, а еще один – замену S556A вместо S556G/N/R. Оба образца субтипа 1a имели замену N444D вместо N444K [22].
Обсуждение
В обследованной группе пациентов с ВИЧ-инфекцией лишь чуть более 32% были инфицированы ВГС. Вероятно, это связано с тем, что ВИЧ-1/ВГС-коинфекция чаще отмечается у ПИН: если у лиц, практикующих рискованное сексуальное поведение, распространенность ВГС составляет 10–14%, то среди ПИН этот показатель увеличен до 85–90% [5]. Поскольку лишь 13,64% пациентов в исследовании относились к ПИН, не удивительно, что менее 1/3 из них имели ВИЧ-1/ВГС-коинфекцию. Между тем доля ПИН среди пациентов с ВИЧ-1/ВГС-коинфекцией была значительно больше, чем у пациентов только с ВИЧ-1: 36,17% против 2,60%.
Гендерный и возрастной показатели обследованной группы пациентов с выявленной ВИЧ-1/ВГС-коинфекцией были близки таковым по ВГС в Европе. Так, в европейских странах на одну женщину с ВГС приходится 1,6–1,9 случая среди лиц мужеского пола, а средний возраст инфицированных составляет около 46 лет [1]. В настоящем исследовании соотношение женщин и мужчин с коинфекцией составляло 1 : 1,54, а средний возраст пациентов составил 41 год.
Нами было выявлено доминирование ВГС субтипа 3a в исследованной коллекции образцов. Полученный результат отличается от данных исследований, показывающих распределение генотипов ВГС как в России в целом, так и в Сибирском федеральном округе [9, 10], что может расцениваться как отличительная особенность эпидемии ВГС среди ВИЧ-инфицированных лиц в Алтайском крае. Факт доминирования в Алтайском крае ВГС субтипа 3a вызывает тревогу в связи с тем, что по сравнению с другими генотипами инфекция генотипом 3 приводит к более быстрому развитию фиброза и высокой степени стеатоза печени, а также к повышенному риску развития ГЦК [13]. Более того, среди всех генотипов генотип 3 наиболее часто демонстрирует устойчивость к ПППД [15].
Проблема субтипирования ВГС имеет большое значение не только для эпидемиологии возбудителя, но и для прогнозирования течения инфекции и выбора эффективной терапии. Для установления рекомбинантной формы 2k/1b, циркулирующей на территории России, необходимо провести генотипирование региона левее NS2 (например, Core) и правее NS2 (NS3, NS5A или NS5B). В последние годы происходит введение в широкую практику схем терапии, не включающих препараты на основе интерферона, а также включающих пангенотипические ПППД. В России широко применяются не только схемы, включающие софосбувир и даклатасвир, но и схемы 2-й линии терапии, содержащие такие препараты, как элбасвир, ледипасвир, омбитасвир, велпатасвир [23]. В связи с этим необходимость в анализе нуклеотидной последовательности региона Core снижается. Это приводит к усложнению дифференциальной диагностики формы 2k/1b от субтипа 1b, т.к. для образцов ВГС зачастую доступна лишь нуклеотидная последовательность правее NS2. Наши результаты субтипирования фрагментов NS5A и NS5B говорят о том, что для установления 2k/1b вполне достаточно использования анализа фрагмента NS5A в программе geno2pheno[HCV] и/или NS5A или NS5B в программе HCVBlast. При этом для анализа подходят фрагменты, получаемые в рамках проведения теста на ЛУ ВГС к ПППД.
У выявленного в настоящем исследовании случая инфицирования двумя вариантами ВГС есть логичное объяснение – основным путем инфицирования ВГС в мире и в Европе на текущий момент является ПИН [1, 5, 8]. Пациентка, у которой была выявлена данная микс-инфекция ВГС, относится к уязвимой группе ПИН. Одновременная инфекция несколькими вариантами вируса является еще одной серьезной причиной генетической вариабельности ВГС, поскольку создает основу для формирования рекомбинантных форм вируса [12]. В описываемом случае имело место одновременное присутствие субтипа 1a со сниженной чувствительностью к омбитасвиру и субтипа 3a, требующего особого подхода к терапии. Потенциально такая коинфекция может привести к формированию рекомбинанта со сниженной чувствительностью к отдельным схемам терапии.
Обнаруженная высокая частота встречаемости (в 52,94% образцов) замены C316N в образцах субтипа 1b согласуется с ранее опубликованными данными о широкой распространенности этой замены среди циркулирующего в России варианта 1b [3]. Эта замена связана с устойчивостью низкого уровня к тегобувиру у ВГС субтипа 1b. При этом мы не выявили более хорошо известную мутацию ЛУ C316Y, связанную с устойчивостью к ингибиторам NS5B у субтипов 1a и 1b [3, 22].
Более чем в 82% вирусов субтипа 3a мы выявили замену D310N, связанную с прогрессированием патологии печени при ВГС. Ранее эта замена выявлялась лишь в 30% вирусов субтипа 3a, циркулирующих в России [3]. Увеличение ее распространенности среди этого генетического варианта вызывает определенную тревогу. При этом более 24% вирусов субтипа 3a содержали замену A150V, связанную с существенной устойчивостью вируса к интерферону-α [17]. Таким образом, циркулирующий среди ВИЧ-инфицированных лиц в Алтайском крае вариант ВГС субтипа 3a может не только привести к тяжелому поражению печени, но и быть устойчивым к терапии на основе интерферона.
Между тем в настоящем исследовании не выявили ни одного описанного в литературе [16] сочетания полиморфизмов NS5B у субтипа 3a, способного незначительно повлиять на эффективность терапии рибавирином, но обнаружили у вирусов 1b и 1a ряд полиморфизмов, не связанных с ЛУ, но в критических нуклеотидных позициях.
Заключение
Таким образом, полученные результаты в целом свидетельствуют о доминировании в среде недавно выявленных ВИЧ-инфицированных лиц в Алтайском крае ВГС субтипа 3a и косвенно ‒ об увеличении доли этого генетического варианта в эпидемии гепатита C в исследуемом регионе страны. Данные о выявленных мутациях и генетических полиморфизмах должны быть учтены при назначении специфической терапии пациентам.
1 ВОЗ. Гепатит C. Доступно по: https://www.who.int/ru/news-room/fact-sheets/detail/hepatitis-c
2 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2020 году». М.; 2021.
3 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2021 году». М.; 2022.
4 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2022 году». М.; 2023.
5 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2023 году». М.; 2024.
6 Алтайский краевой центр по профилактике и борьбе со СПИДом и инфекционными заболеваниями. Доступно по: https://altaids22.ru
7 WHO. Global health sector strategy on viral hepatitis, 2016–2021: towards ending viral hepatitis; 2016. Доступно по: http://apps.who.int/iris/bitstream/10665/246177/1/WHO-HIV-2016.06-eng.pdf
Об авторах
Илья Андреевич Лаповок
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Автор, ответственный за переписку.
Email: i_lapovok@mail.ru
ORCID iD: 0000-0002-6328-1415
канд. биол. наук, старший научный сотрудник лаборатории диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, 111123, г. МоскваАрина Викторовна Сыркина
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Email: syrkina@cmd.su
ORCID iD: 0009-0003-2733-6663
младший научный сотрудник лаборатории диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, 111123, г. МоскваАлина Алексеевна Кириченко
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Email: kirichenko@cmd.su
ORCID iD: 0000-0002-7116-0138
канд. мед. наук, старший научный сотрудник лаборатории диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, 111123, г. МоскваАнастасия Вениаминовна Шлыкова
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Email: murzakova_a.v@mail.ru
ORCID iD: 0000-0002-1390-8021
научный сотрудник лаборатории диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, 111123, г. МоскваНаталья Валентиновна Лукьяненко
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Email: natvalluk@mail.ru
ORCID iD: 0000-0002-0003-5145
д-р мед. наук, профессор кафедры эпидемиологии, микробиологии и вирусологии
Россия, 656038, г. БарнаулТатьяна Викторовна Сафьянова
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Email: tvsafyanova@yandex.ru
ORCID iD: 0000-0003-3293-4265
д-р мед. наук, профессор, заведующая кафедрой эпидемиологии, микробиологии и вирусологии
Россия, 656038, г. БарнаулАрина Евгеньевна Сафронова
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России
Email: safariev00@mail.ru
ORCID iD: 0009-0009-7350-6073
ординатор кафедры эпидемиологии, микробиологии и вирусологии
Россия, 656038, г. БарнаулВалерий Владимирович Шевченко
ФГБОУ ВО «Алтайский государственный медицинский университет» Минздрава России; КГБУЗ «Алтайский краевой центр по профилактике и борьбе со СПИДом и инфекционными заболеваниями»
Email: infecgepatit@yandex.ru
ORCID iD: 0000-0001-6282-5495
канд. мед. наук, главный внештатный инфекционист Главного управления Алтайского края по здравоохранению и фармацевтической деятельности, доцент кафедры эпидемиологии, микробиологии и вирусологии
Россия, 656038, г. Барнаул; 656010, г. БарнаулДмитрий Евгеньевич Киреев
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
Email: dmitkireev@yandex.ru
ORCID iD: 0000-0002-7896-2379
канд. биол. наук, заведующий лабораторией диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, 111123, г. МоскваСписок литературы
- Simão M., Gonçalves C. Hepatitis C virus infection in Europe. Pathogens. 2024; 13(10): 841. https://doi.org/10.3390/pathogens13100841
- Martinez M.A., Franco S. Therapy implications of hepatitis C virus genetic diversity. Viruses. 2021; 13(1): 41. https://doi.org/10.3390/v13010041
- Останкова Ю.В., Валутите Д.Э., Зуева Е.Б., Серикова Е.Н., Щемелев А.Н., Boumbaly S. и др. Первичные мутации лекарственной устойчивости вируса гепатита C у пациентов с впервые выявленной ВИЧ-инфекцией. Проблемы особо опасных инфекций. 2020; (3): 97–105. https://elibrary.ru/laroef
- Valutite D., Ostankova Y., Semenov A., Lyalina L., Totolian A. Distribution of primary resistance mutations in Saint Petersburg in patients with chronic hepatitis C. Diagnostics. 2022; 12(5): 1054. https://doi.org/10.3390/diagnostics12051054
- Sulkowski M.S. Viral hepatitis and HIV coinfection. J. Hepatol. 2008; 48(2): 353–67. https://doi.org/10.1016/j.jhep.2007.11.009
- Thein H.H., Yi Q., Dore G.J., Krahn M.D. Natural history of hepatitis C virus infection in HIV-infected individuals and the impact of HIV in the era of highly active antiretroviral therapy: a meta-analysis. AIDS. 2008; 22(15): 1979–91. https://doi.org/10.1097/QAD.0b013e32830e6d51
- Wyatt C.M., Malvestutto C., Coca S.G., Klotman P.E., Parikh C.R. The impact of hepatitis C virus coinfection on HIV-related kidney disease: a systematic review and meta-analysis. AIDS. 2008; 22(14): 1799–807. https://doi.org/10.1097/QAD.0b013e32830e0152
- Vo-Quang E., Pawlotsky J.M. «Unusual» HCV genotype subtypes: origin, distribution, sensitivity to direct-acting antiviral drugs and behaviour on antiviral treatment and retreatment. Gut. 2024; 73(9): 1570–82. https://doi.org/10.1136/gutjnl-2024-332177
- Кичатова В.С., Карлсен А.А., Исаева О.В., Солонин С.А., Малинникова Е.Ю., Кюрегян К.К. и др. Лекарственно-резистентные варианты ВГС субтипа 1b, циркулирующие на территории Российской Федерации: анализ аминокислотных мутаций в белках NS5A и core. Журнал инфектологии. 2018; 10(4): 30–6. https://elibrary.ru/vvmeki
- Pimenov N., Kostyushev D., Komarova S., Fomicheva A., Urtikov A., Belaia O., et al. Epidemiology and genotype distribution of hepatitis C virus in Russia. Pathogens. 2022; 11(12): 1482. https://doi.org/10.3390/pathogens11121482
- Акимов И.А., Тимофеев Д.И., Мавзютов А.Р., Иванов М.К. Выявление циркулирующей рекомбинантной формы RF1_2k/1b вируса гепатита С в сыворотке крови пациентов методом ОТ-ПЦР в режиме реального времени. Клиническая лабораторная диагностика. 2021; 66(2): 122–8. https://elibrary.ru/vvobzb
- Kalinina O., Norder H., Mukomolov S., Magnius L.O. A natural intergenotypic recombinant of hepatitis C virus identified in St. Petersburg. J. Virol. 2002; 76(8): 4034–43. https://doi.org/10.1128/jvi.76.8.4034-4043.2002
- Mushtaq S., Hashmi A.H., Khan A., Asad Raza Kazmi S.M., Manzoor S. Emergence and persistence of resistance-associated substitutions in HCV GT3 patients failing direct-acting antivirals. Front. Pharmacol. 2022; 13: 894460. https://doi.org/10.3389/fphar.2022.894460
- Wang C., Valera L., Jia L., Kirk M.J., Gao M., Fridell R.A. In vitro activity of daclatasvir on hepatitis C virus genotype 3 NS5A. Antimicrob. Agents. Chemother. 2013; 57(1): 611–3. https://doi.org/10.1128/AAC.01874-12
- Fernandes Campos G.R., Ward J., Chen S., Bittar C., Rodrigues J.P.V., de Lourdes Candolo Martinelli A., et al. A novel substitution in NS5A enhances the resistance of hepatitis C virus genotype 3 to daclatasvir. J. Gen. Virol. 2021; 102(1): jgv001496. https://doi.org/10.1099/jgv.0.001496
- Mejer N., Fahnøe U., Galli A., Ramirez S., Weiland O., Benfield T., et al. Mutations identified in the hepatitis C virus (HCV) polymerase of patients with chronic HCV treated with ribavirin cause resistance and affect viral replication fidelity. Antimicrob. Agents Chemother. 2020; 64(12): e01417–20. https://doi.org/10.1128/AAC.01417-20
- Lee W.Y.J., Jones M., Wing P.A.C., Rajagopal S., Foster G.R. The A150V polymorphism of genotype 3 hepatitis C virus polymerase inhibits interferon alfa by suppressing protein kinase R activation. Cell. Mol. Gastroenterol. Hepatol. 2021; 11(4): 1163–75. https://doi.org/10.1016/j.jcmgh.2020.11.012
- Los Alamos HCV database. Available at: https://hcv.lanl.gov
- Kalaghatgi P., Sikorski A.M., Knops E., Rupp D., Sierra S., Heger E., et al. Geno2pheno [HCV] – a web-based interpretation system to support hepatitis C treatment decisions in the era of direct-acting antiviral agents. PLoS One. 2016; 11(5): e0155869. https://doi.org/10.1371/journal.pone.0155869
- Kichatova V.S., Kyuregyan K.K., Soboleva N.V., Karlsen A.A., Isaeva O.V., Isaguliants M.G., et al. Frequency of interferon-resistance conferring substitutions in amino acid positions 70 and 91 of core protein of the Russian HCV 1b isolates analyzed in the T-cell epitopic context. J. Immunol. Res. 2018; 2018: 7685371. https://doi.org/10.1155/2018/7685371
- Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Mol. Biol. Evol. 2013; 30(12): 2725–9. https://doi.org/10.1093/molbev/mst197
- Kati W., Koev G., Irvin M., Beyer J., Liu Y., Krishnan P., et al. In vitro activity and resistance profile of dasabuvir, a nonnucleoside hepatitis C virus polymerase inhibitor. Antimicrob. Agents Chemother. 2015; 59(3): 1505–11. https://doi.org/10.1128/AAC.04619-14
- Валутите Д.Э., Семенов А.В., Останкова Ю.В., Козлов К.В., Борисов А.Г., Назаров В.Д. и др. Выявление мутаций лекарственной устойчивости вируса гепатита С у пациентов с неэффективной терапией препаратами прямого противовирусного действия. Журнал микробиологии, эпидемиологии и иммунобиологии. 2021; 98(1): 18–27. https://elibrary.ru/aksnkx
Дополнительные файлы