Скрытый гепатит B: распространенность и клиническая значимость. Роль в возникновении патологии печени и сочетанных вирусных инфекций
- Авторы: Кущ А.А.1
-
Учреждения:
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи» Минздрава России
- Выпуск: Том 70, № 4 (2025)
- Страницы: 299-316
- Раздел: ОБЗОРЫ
- URL: https://virusjour.crie.ru/jour/article/view/16714
- DOI: https://doi.org/10.36233/0507-4088-291
- EDN: https://elibrary.ru/gmsjsl
- ID: 16714
Цитировать
Аннотация
В обзоре рассмотрены вопросы, связанные со скрытым гепатитом В (СГВ), который возникает на поздней стадии хронического гепатита В (ХГВ) после клиренса HBsAg. В клинической практике СГВ обнаруживают по отсутствию HBsAg и по присутствию антител к HBcAg в сыворотке крови и часто называют «прошедшим» или «перенесенным» гепатитом В. Однако ДНК вируса гепатита В (ВГВ) остается в клетках печени, плохо выявляется рутинными методами диагностики и не может быть удалена с помощью имеющих методов терапии. Данные о распространенности СГВ различаются, в то же время СГВ регистрируют во всех регионах мира, значительно чаще – в регионах с высокой распространенностью ВГВ. Получены данные об ассоциации СГВ с фиброзом, циррозом печени и гепатоклеточной карциномой (ГКК), свидетельствующие о повышенном риске неблагоприятного исхода ХГВ у пациентов с СГВ. СГВ ассоциируется не только с ГКК, но также со злокачественными опухолями других органов. Установлено, что СГВ связан с повышенным риском реактивации ВГВ у пациентов с коинфекциями другими вирусами, а также у онкологических больных, лечение которых включает иммуносупрессивную терапию. Реактивация ВГВ приводит к тяжелым последствиям и в отсутствие лечения – к смерти пациентов. Можно заключить, что для достижения цели, поставленной ВОЗ, по искоренению вирусного гепатита к 2030 г. необходимо решить проблему СГВ. Для этого следует создать новые, более чувствительные и информативные диагностические тесты, эффективные методы элиминации ДНК ВГВ, а также более глубоко изучить механизмы развития СГВ.
Полный текст
Введение
Вирус гепатита В (ВГВ) может вызывать острые и хронические заболевания печени, которые представляют потенциальную угрозу для жизни. По данным Всемирной организации здравоохранения (ВОЗ), опубликованным в 2024 г., 254 млн человек хронически инфицированы ВГВ, ежегодно отмечается 1,2 млн новых случаев инфицирования и 1,1 млн смертей, в основном от цирроза печени и первичного рака печени1, и эти показатели к 2030 г. могут увеличиться [1]. Против гепатита В более четырех десятилетий применяется безопасная и эффективная вакцина, однако концентрация противовирусных антител после вакцинации постепенно снижается до уровня ниже протективного, часть людей не отвечает на вакцинацию, что способствует появлению новых случаев заражения ВГВ и хронизации инфекции. Для выяснения причин этого явления необходимо более глубокое изучение вируса, его жизненного цикла и развития вызываемых им заболеваний.
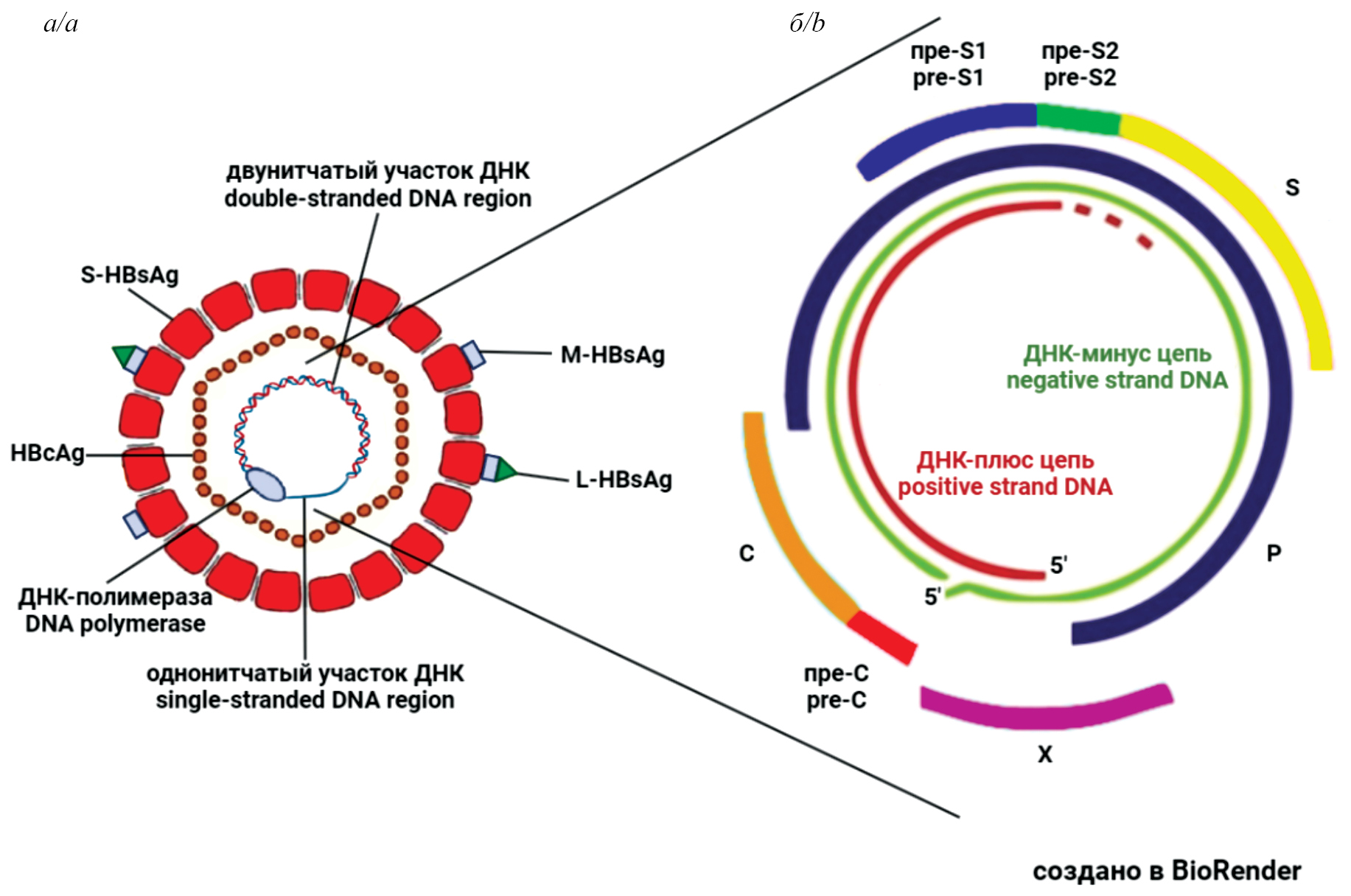
Вирион ВГВ (частица Дейна) состоит из липидной оболочки, содержащей большой (L), средний (M) и малый (S) поверхностные белки, представляющие поверхностный антиген ВГВ – HBsAg. Внутри вириона расположен нуклеокапсид, состоящий из 120 димеров основного белка С (core) – HBc (HBcAg), содержащий вирусную ДНК и ковалентно прикрепленную полимеразу (P) ВГВ (рис. 1 а) [2, 3]. Кроме того, геном ВГВ кодирует неструктурный регуляторный белок Х, который обнаруживают как в ядре, так и в цитоплазме инфицированных клеток [4, 5]. Геном ВГВ (около 3,2 кб) представлен частично двухцепочечной кольцевой расслабленной (релаксированной) ДНК, содержит четыре частично перекрывающиеся открытые рамки считывания (ORF): PreS1/PreS2/S, PreC/C, P и X, которые являются матрицами для образования четырех белков ВГВ – S, С, Р и Х (рис. 1 б).
Рис. 1. Схематическое изображение структуры вируса гепатита В.
а – частица Дейна – вирион ВГВ; б – вирусный геном.
Fig. 1. Schematic representation of the hepatitis B virus structure.
a – the Dane particle – the HBV virion; b – the viral genome.
Жизненный цикл ВГВ схематично представлен на рис. 2. Вирус, проникший в организм, достигает печени и прикрепляется к мембране гепатоцита, для чего преS1-домен взаимодействует с гепаран сульфатом – неспецифическим рецептором на поверхности гепатоцитов. Затем вирус с высокой аффинностью связывается с клеточным рецептором для ВГВ – NTCP (sodium taurocholate cotransporting polypeptide) [6]. Недавно было показано, что в проникновении вириона ВГВ в клетку важную роль играет также рецептор эпидермального фактора роста [7]. После интернализации путем эндоцитоза вируc теряет оболочку (uncoating) и частицы нуклеокапсида (core), содержащие релаксированную кольцевую ДНК (rcДНК) и вирусную полимеразу, транспортируются в ядро. В нуклеоплазме клеточные ферменты репарируют rcДНК и конвертируют ее в ковалентно замкнутую кольцевую ДНК (кзкДНК). кзкДНК ассоциируется с гистонами и негистоновыми белками с образованием мини-хромосомы [8]. кзкДНК транскрибируется клеточной РНК-полимеразой II с образованием набора вирусных матричных РНК, включая прегеномную РНК (pgРНК). Вирусные транскрипты затем транспортируются в цитоплазму и транслируются в 7 белков ВГВ: е-антиген (HBeAg), core (HBc), полимеразу (Pol), 3 поверхностных белка (большой – L-HBs, средний – M-HBs, малый – S-HBs), а также белок Х (HBx). Core-белки олигомеризуются вокруг вирусной полимеразы и pgРНК, и в результате реакции инкапсидации формируется капсид. В капсиде с участием Pol происходит обратная транскрипция pgРНК в rcДНК, вначале синтезируется комплементарная отрицательная одноцепочечная ДНК, затем – вторая положительная нить ДНК. Зрелые капсиды, содержащие rcДНК, затем транспортируются в эндоплазматический ретикулум (ЭПР), где приобретают поверхностные белки. Сформированные таким образом вирионы выходят из инфицированной клетки путем экзоцитоза и могут заражать новые клетки. Некоторые из капсидов, содержащих rcДНК, могут траспортироваться обратно в ядро для поддержания пула кзкДНК (рис. 2) [9, 10].
Рис. 2. Схематическое представление жизненного цикла вируса гепатита В в инфицированной клетке.
Пояснения в тексте.
Fig. 2. Schematic diagram of the hepatitis B virus life cycle in an infected cell.
Explanations in the text.
Наряду с образованием и поддержанием в ядре эписомальной кзкДНК, необходимой для репликации вируса, уже на ранней стадии инфекции часто происходит интеграция ДНК ВГВ в геном хозяина [11, 12]. Интегрированный геном не способен к репликации, в то же время часть генов находятся в активном состоянии и накапливаются данные о роли интегрированной ДНК в развитии рака печени [13, 14].
Перинатальная инфекция ВГВ является серьезным заболеванием, при этом у 90% инфицированных младенцев острая инфекция переходит в хроническую форму [15]. Острая инфекция ВГВ у взрослых пациентов в большинстве случаев характеризуется спонтанным разрешением [16], при котором из периферической крови (ПК) исчезает HBsAg, снижается концентрация вирусной ДНК, отсутствуют серологические, биохимические и клинические признаки гепатита. В таких случаях говорят о «перенесенной» инфекции.
T.I. Michalak и соавт. впервые показали, что после выздоровления от острого гепатита В в сыворотке крови и мононуклеарных клетках ПК может длительно (до 70 мес) выявляться ДНК ВГВ. Авторы заключили, что исчезновение HBsAg из сыворотки крови, выработка анти-HBs-антител и даже нормализация функции печени могут не отражать полного выздоровления от инфекции, вызванной ВГВ [17]. Это заключение было подтверждено многочисленными дальнейшими исследованиями, которые показали, что современные методы лечения гепатита В не обеспечивают полную эрадикацию вируса [18, 19]. Это связано с особенностями жизненного цикла вируса и динамикой инфекционного процесса.
Сразу после заражения ВГВ ДНК вируса и HBsAg могут не определяться в сыворотке/плазме крови, но передаваться реципиентам. Пример описан в работе [20], авторы которой обследовали двух доноров крови и не обнаружили ни HBsAg, ни ДНК ВГВ. Однако у реципиентов крови от этих доноров выявили ВГВ. У обоих доноров впоследствии появился HBsAg и развился острый гепатит. По данным других авторов [21], период «диагностического окна» может составлять от 19 до 35 сут. В подтверждение авторы привели данные о том, что через 35 сут после получения материала от донора в нем не определились ни HBsAg, ни ДНК ВГВ, однако у реципиента развилась инфекция ВГВ штаммом вируса, идентичным штамму, который был детектирован позже у донора. Сходные данные приводят И.Ф. Голубева и соавт., которые заключили, что HBsAg в большинстве случаев обнаруживается в инкубационном периоде через 3–5 нед от момента инфицирования [22]. Считается, что в «периоде окна» – до того, как ДНК ВГВ появится в крови, наиболее сложно определить инфекцию.
Скрытый период, не обнаруживаемый рутинным тестированием, может возникнуть как на ранней стадии, так и на более поздней стадии инфекции (рис. 3).
Рис. 3. Изменения уровней серологических маркеров гепатита В в динамике ВГВ-инфекции.
Пояснения в тексте.
Fig. 3. Changes in the levels of hepatitis B serological markers in the dynamics of HBV infection.
Explanations in the text.
HВsAg – ранний серологический маркер ВГВ-инфекции, уровень которого значительно повышается при вступлении в активную фазу, характеризующуюся также высоким уровнем репликации ДНК ВГВ, синтезом и появлением в плазме крови HBсAg и HBеAg (рис. 3). Обнаружение HВsAg в крови через 6 мес и более после заражения означает переход инфекции в хроническую стадию, при которой происходит сероконверсия с появлением в крови противовирусных антител: анти-HBs, анти-HBc, анти-HBe [23]. Хронический гепатит В (ХГВ) может длиться годами.
С появлением методов детекции ДНК ВГВ (в 1980-х гг.) накопились данные, показавшие, что HBsAg-отрицательные [HBsAg(−)] гепатиты встречаются как в эндемичных регионах, где ХГВ регистрируют с высокой частотой (> 8%), так и в регионах с относительно низким уровнем ХГВ (< 2%) [24]. Хронические гепатиты у пациентов с HBsAg(−), но с ДНК ВГВ(+) стали называть скрытыми, или оккультными (occult).
К 2017 г. многочисленные данные по HBsAg(−)-гепатитам привели Европейскую ассоциацию по изучению печени (EASL) к пересмотру классификации хронических гепатитов, которая ранее включала 4 стадии инфекции. Стадии/фазы ХГВ стали обозначать следующим образом: I – HBeAg-положительная хроническая инфекция, II – HBeAg-положительный хронический гепатит, III – HBeAg-отрицательная хроническая инфекция, IV – HBeAg-отрицательный хронический гепатит, V – HBsAg-отрицательная фаза [25]. Во время фазы V HBsAg не определяется в ПК, но вирусный геном остается в клетках печени и может реплицироваться на низком уровне либо находиться в виде интегрированной ДНК ВГВ в хромосомах человека. Это состояние определяется как оккультный гепатит В [25, 26].
В Руководстве EASL дано определение скрытого (occult) гепатита В (СГВ) по следующим параметрам [24]: отрицательный HBsAg в сыворотке крови; присутствие антител к core-антигену ВГВ (анти-HBc); нормальные показатели аланинаминотрансферазы; присутствие или отсутствие ДНК ВГВ в сыворотке крови, но обязательное присутствие кзкДНК ВГВ, способной к репликации, в печени пациентов. В случаях, когда HBsAg присутствует, но не определяется с помощью доступных коммерческих тестов, например, из-за мутаций в гене S, ХГВ не может быть отнесен к V форме ХГВ – СГВ [27].
В конце декабря 2024 г. Минздрав России одобрил обновленные Клинические рекомендации по хроническому вирусному гепатиту В, разработанные Национальной ассоциацией специалистов по инфекционным болезням имени академика В.И. Покровского и Российским обществом по изучению печени. Классификация ХГВ по фазам инфекционного процесса совпадает с той, которая приведена выше [24]. Пятая фаза инфекции обозначена как «HBsAg-негативная фаза (скрытая HBV-инфекция)»[2].
Цель обзора - обобщить имеющиеся данные о СГВ, обратить внимание на значимость СКВ и реактивации вируса при заболеваниях печени и других органов, обозначить проблемы, требующие дальнейшего изучения, а также указать на перспективы их решения.
Распространенность скрытого гепатита В
Оценка распространенности СГВ значительно варьирует в работах разных авторов и, как отмечается, зависит от распространенности вируса в разных регионах мира. Определение СГВ проводят среди разных групп населения, в том числе в общей популяции, среди практических здоровых людей, среди пациентов с ХГВ и другими заболеваниями печени, а также в группах повышенного риска по реактивации ВГВ и неблагоприятному исходу заболевания. В таблице представлены данные, полученные при изучении двух популяций в разных странах и регионах мира: общей популяции, а также популяции доноров – наиболее часто и тщательно обследуемой популяции. Приведены результаты отдельных исследований, а также данные метаанализа СГВ.
Таблица. Распространенность скрытого гепатита В в общей популяции и в популяции доноров крови среди населения в разных регионах и странах мира
Table. Prevalence of occult hepatitis B in the general population and in the blood donor population in different regions and countries of the world
Регион/Страна Region/Country | Обследованный контингент Surveyed contingent | Распространенность СГВ1 (%) Prevalence of OBI1 (%) | Тест на ДНК ВГВ, предел определения HBV DNA test, detection limit | Ссылка Reference | |
Китай China | Общая популяция General population | 6/52 (11,5) | Гнездовая ПЦР Nested PCR | [28] | |
Доноры крови Blood donors | 31/44 256 (0,070) | Гнездовая ПЦР, ≤ 6 МЕ/мл Nested PCR, ≤ 6 IU/ml | [29] | ||
Западная Европа и Северная Америка Western Europe and North America | Общая популяция General population | 92/329 (28)2 | ПЦР, разные тесты и пределы определения в разных странах: 1,69–154 МЕ/мл PCR, various tests and detection limits in different countries: 1.69–154 IU/ml | [30] | |
34 страны4 34 countries4 | Общая популяция General population | 1159/3 667 171 (0,82) | [31] | ||
25 стран5 25 countries 5 | Доноры3 Donors3 | > 10 000 000 (0,05) | [32] | ||
Вьетнам Vietnam | Общая популяция General population | 7/58 (12) | Гнездовая ПЦР, ≤ 10 МЕ/мл Nested PCR, ≤ 10 IU/ml | [33] | |
Доноры крови Blood donors | 2/623 (0,3) | Гнездовая ПЦР, 30–40 копий/мл Nested PCR, 30–40 copies/ml | [34] | ||
Африка Africa | Гамбия Gambia | Общая популяция General population | 31/330 (9,4) | Гнездовая ПЦР, < 5 МЕ/мл Nested PCR, < 5 IU/ml | [35] |
Камерун Cameroon | Доноры крови Blood donors | 11/240 (4,5) | ПЦРрв, 25 МЕ/мл qPCR, 25 IU/mL | [36] | |
6 стран Африки6 6 African countries6 | Общая популяция General population | > 1 000 000 (13,3) (0–35,6) | ПЦР, разные тесты и пределы определения в разных странах PCR, different tests and detection limits in different countries | [31] | |
Разные регионы Африки Various regions of Africa | Доноры крови3 Blood donors3 | (3,18)7 | ПЦР, разные тесты и пределы определения в разных странах PCR, different tests and detection limits in different countries | [37] | |
Россия Russia | Общая популяция General population | 0/544 (0) | ПЦРрв, 100 МЕ/мл qPCR, 100 IU/mL | [38] | |
Доноры крови Blood donors | 76/2788 (2,85) | Гнездовой ПЦРрв Nest PCR | [39] | ||
Доноры крови Blood donors | 7/2492 (0,28) | ПЦР, 100 копий/мл PCR, 100 copies/ml | [40] | ||
Примечание. 1 – отсутствие HBsAg, присутствие анти-HBc и ДНК ВГВ в сыворотке/плазме крови; 2 – образцы биопсии печени; 3 – метаанализ данных; 4 – страны Европы, Африки, Северной и Южной Америки, Азии; 5 – страны Европы, Азии, Африки, Северной и Южной Америки, Океании; 6 – Ботсвана, Буркина-Фасо, Египет, Нигерия, Южная Африка, Уганда; 7 – в 86 публикациях представлены результаты обследования 4 074 603 доноров крови, количество доноров с СГВ изучено в 14 публикациях, общее количество доноров с СГВ указано только в процентах. ПЦР – полимеразная цепная реакция; ПЦРрв – количественная ПЦР в реальном времени.
Note. 1 – absence of HBsAg, presence of anti-HBc and HBV DNA in serum/plasma; 2 – liver biopsy samples; 3 – meta-analysis of data; 4 – countries of Europe, Africa, North and South America, Asia; 5 – countries of Europe, Asia, Africa, North and South America, Oceania; 6 – Botswana, Burkina Faso, Egypt, Nigeria, South Africa, Uganda; 7 – 86 publications present the results of a survey of 4074,603 blood donors, the number of donors with OBI was studied in 14 publications, the total number of donors with OBI is indicated only as a percentage. qPCR – quantitative real-time PCR.
Данные, представленные в таблице, показали, что распространенность СГВ в общей популяции при изучении сывороток крови значительно варьирует: от 0% (среди 540 здоровых жителей России в г. Москве) и 0,82% (среди более 3 млн обследованных людей в 34 странах мира) до 11,5% в Китае, 12% во Вьетнаме и 9,4–13,3% в странах Африки. Эти данные подтверждают связь распространенности СГВ с уровнем эндемичности ВГВ. Самая высокая распространенность ВГВ наблюдается в Азиатско-Тихоокеанском и Африканском регионах, где проживает более ½ населения Земного шара. По данным ВОЗ, в 2022 г. на эти регионы приходилось не менее 63% новых случаев инфицирования ВГВ во всем мире и приблизительно 1,08 млн смертей3. Это отражается на высокой распространенности СГВ: например, в Китае, по оценке R. Xia (2022), проживают 21 млн человек с СГВ [41]. Следует особо отметить, что при изучении образцов печени СГВ определяется значительно чаще, чем в сыворотках крови. Так, в результате изучения образцов печени в Западной Европе и Северной Америке СГВ выявили в общей популяции в 28% случаев, тогда как при анализе сывороток крови из 34 стран – в 34 раза реже – в 0,82% случаев (таблица). Принципиально сходные данные получены Y.R. Im и соавт. (2022) в результате метаанализа: распространенность маркеров СГВ в 140 518 289 образцах сыворотки или плазмы крови составила в среднем 0,09%, а в 2598 образцах печени – 34,8% [42]. По оценке авторов [43], данные об определении ДНК ВГВ в печени представлены лишь в 10% от всех опубликованных работ по СГВ. Можно предположить, что распространенность СГВ значительно шире, чем известно в настоящее время на основании анализа только сыворотки или плазмы крови.
Сравнительный анализ данных таблицы показал, что среди доноров крови практически во всех регионах и странах мира частота определения СГВ была значительно ниже, чем в общей популяции (от 2–4 до 100 раз и более), однако и в этой популяции наблюдалась значительная вариабельность данных. По данным метаанализа G.R. Takuissu и соавт. (2022), распространенность СГВ среди доноров крови варьировала от 0,7% (в Европе) до 16,7% (в Юго-Восточной Азии с высокой эндемичностью ВГВ) и в целом составила 6,2% [44]. Эксперты признают, что переливание крови от доноров с СГВ создает риск передачи ВГВ, остаточный риск передачи оценивается в 3–14% [45]. Для предотвращения передачи вируса рекомендуют проводить скрининг доноров крови с использованием высокочувствительных серологических и молекулярных тестов [32].
Следует отметить, что имеющиеся в настоящее время данные не позволяют судить о глобальной распространенности СГВ в общей популяции, поскольку размер обследованных групп относительно невелик, особенно для больших стран. Кроме того, в исследованиях используют тесты с разной чувствительностью, стандарты пока не введены, что затрудняет сравнительную оценку полученных результатов.
Наибольшее количество работ посвящено анализу популяций высокого риска развития гепатита В. К ним относятся: пациенты с ХГВ и другими заболеваниями печени; пациенты, находящиеся на гемодиализе; онкологические больные; пациенты, коинфицированные ВГВ и другими вирусами, а также лица со сниженным иммунитетом. Результаты анализа СГВ в группах высокого риска обобщены в нескольких работах последних лет. Анализ СГВ в западных странах с относительно низким уровнем ХГВ показал очень большую вариабельность данных: у пациентов с криптогенным циррозом или прогрессирующим фиброзом печени распространенность СГВ колебалась от 4 до 38%; среди ВИЧ-инфицированных пациентов – от 0 до 45%; у пациентов на гемодиализе – от 0 до 54%; у пациентов, коинфицированных ВГС, – около 52%, и даже среди доноров крови, которые представляют группу низкого риска, распространенность СГВ составляла от 0 до 22,7% [46].
Оценка встречаемости СГВ в 34 странах и регионах показала [31], что распространенность СГВ значительно отличается в группах повышенного риска от таковой в общей популяции. Так, в общей популяции метаанализ определил частоту встречаемости СГВ в среднем в 0,82%, тогда как среди пациентов с заболеваниями печени – в 13,99%, среди людей с ВИЧ-инфекцией – в 16,26%, среди пациентов на гемодиализе – в 4,25%. Y.R. Im и соавт. (2022) сравнивали распространенность СГВ в странах с различной эндемичностью ВГВ. Метаанализ показал, что в странах с низким уровнем эндемичности в популяции доноров крови распространенность СГВ составила в среднем 0,06%, в странах с высокой эндемичностью – 0,98% [42]. Оценка распространенности СГВ в группах высокого риска, проведенная этими авторами, выявила более высокие значения: в странах с низким уровнем эндемичности она составила 5,5%, в странах с высоким уровнем эндемичности – 12,0% [42].
Метаанализ СГВ в группах высокого риска в Египте показал высокую частоту встречаемости СГВ: если в общей популяции она составляла от 1,26 до 4,16% [47], то у пациентов, находящихся на гемодиализе, – 17%, у пациентов с множественными трансфузиями – 41%, у пациентов с хроническим гепатитом С – 15%, у пациентов с раком печени – 31% и у пациентов с циррозом печени – 13% [48]. Среди пациентов, инфицированных ВИЧ, в разных регионах Африки СГВ определили в среднем в 11,2% случаев [49]. Отметим, что в Мексике СГВ встречался среди ВИЧ-инфицированных пациентов гораздо чаще – у 18/50 (36%) [50], чем в среднем среди доноров крови – в 6,4% случаев [51].
В России, так же как и в других странах, распространенность СГВ была неодинаковой в разных группах населения. Например, среди 544 здоровых жителей Москвы СГВ не определили ни у одного человека (таблица), тогда как среди гематологических больных эти же авторы обнаружили СГВ у 5 из 129 (3,9%) пациентов [38]. Значительно чаще – в 7/35 (20%) случаях, выявили СГВ у пациентов с заболеваниями желудочно-кишечного тракта [52]. Оценка распространенности СГВ среди доноров крови одними авторами показала присутствие маркеров СГВ у 76/2788 доноров (2,85%) [39]; тогда как другие авторы определяли СГВ среди доноров крови в 10 раз реже – в 7/2492 (0,28%) случаев [40]. В то же время среди лиц, принимающих психоактивные вещества (ПАВ), эти же авторы обнаруживали СГВ почти в 18 раз чаще – в 3/62 (4,94%) случаев.
Важные данные были получены на основании 76 исследований СГВ в когортах лиц, вакцинированных против гепатита В. СГВ был определен у 1–37% полностью вакцинированных лиц, в том числе у детей, родившихся от вакцинированных матерей [53]. Это означает что, несмотря на значительный успех всеобщей программы вакцинации против ВГВ, нельзя исключить реактивацию вируса при СГВ, и для исчезновения вируса и СГВ в человеческой популяции необходимо внедрять в клиническую практику более эффективные вакцины против ВГВ.
Суммируя данные, приведенные выше, можно констатировать значительную вариабельность результатов по распространенности СГВ. Эти расхождения могут объясняться целым рядом обстоятельств, среди которых:
- небольшие размеры выборки во многих, если не в большинстве работ; обследование населения из стран и географических регионов с различной эндемичностью по гепатиту В;
- анализ гетерогенных популяций, различающихся по полу, возрасту и степени риска развития неблагоприятного течения гепатита В;
- обследование пациентов с различными заболеваниями печени и на разных стадиях патологического процесса, в том числе с криптогенным циррозом и прогрессирующим фиброзом печени;
- присутствие других заболеваний, в том числе парентеральных вирусных инфекций ВГС- и ВИЧ-этиологии;
- использование методик и тест-систем с разной чувствительностью и специфичностью определения HBsAg и ДНК ВГВ в печени и/или в сыворотке крови, что не исключает получения ложноположительных и ложноотрицательных результатов;
- различная природа биологического материала: сыворотка/плазма крови, клетки крови (PBMC), биоптаты печени, парафиновые срезы печени;
- использование неодинакового (часто – недостаточно полного) набора маркеров при определении СГВ.
Клиническая значимость скрытого гепатита В
Мнения исследователей относительно клинической значимости СГВ неоднозначны. Отсутствие HBsAg в сыворотке/плазме крови у больных ХГВ нередко рассматривается как завершение заболевания, в том числе после лечения [54–56].
В то же время во многих работах приводятся данные о негативном влиянии СГВ на клиническое состояние пациентов с ХГВ и об ассоциации СГВ с неблагоприятными исходами ХГВ [57, 58]. Отмечают, что люди со скрытой ВГВ-инфекцией могут заражать других людей и что эта форма инфекции может быть связана с серьезными осложнениями, такими как цирроз печени и гепатоклеточная карцинома (ГКК) [59].
Скрытый гепатит В при фиброзе и циррозе печени
У пациентов с СГВ, как правило, подавлена репликация ВГВ и определяется низкая вирусная нагрузка, обычно менее 200 международных единиц (МЕ) в 1 мл плазмы/сыворотки крови [47]. Тем не менее обследование пациентов с ХГВ показало, что присутствие ДНК ВГВ при отсутствии HBsAg может ассоциироваться с тяжелым течением гепатита В, развитием фиброза и цирроза печени. Так, при обследовании 83 пациентов с СГВ у 52 (62,6%) был обнаружен фиброз печени [60]. X. Tang и соавт. (2023) [61] обследовали 1772 пациентов с фиброзом печени и определили, что у 148 из них (8,4%) имелся СГВ. Сравнительный анализ показал, что у пациентов с СГВ уровни всех показателей фиброза (гиалуроновой кислоты (HA), ламинина, проколлагенового пептида III типа (PCIII), коллагена IV типа (CIV) и индекса патологической гистологической активности (HAI)) были значительно выше, чем у 1624 пациентов с фиброзом, но без СГВ (p < 0,05). Кроме того, ДНК ВГВ значительно чаще обнаруживалась в клетках биопсии печени методом гибридизации in situ у пациентов с СГВ, чем у пациентов без СГВ (80,6% против 37,5%). Авторы заключили, что СГВ ассоциируется с тяжелой формой фиброза печени.
Обследование пациентов показывает, что по крайней мере у 10% людей этиология хронических заболеваний печени остается неустановленной [62]. В таких случаях заболевания печени, в том числе цирроз, называют «криптогенными» [63]. Описаны попытки определить присутствие СГВ у пациентов с криптогенными хроническими заболеваниями печени. В Иране определили СГВ у 2/104 (1,9%) пациентов с криптогенным хроническим гепатитом [64]. Отметим, что для анализа ДНК ВГВ использовали вариант метода полимеразной цепной реакции (ПЦР) с низкой чувствительностью – 150 × 103 копий/мл. Другие авторы из Ирана обнаружили СГВ у 11 из 29 (38%) пациентов с криптогенным циррозом печени. ДНК ВГВ определяли методами ПЦР в реальном времени и гнездовой ПЦР, концентрация ДНК у пациентов с СГВ варьировала от 22 до 7138 копий/мл [65]. Еще в одной работе из Ирана у 7 из 50 (14%) пациентов с криптогенным циррозом печени в сыворотке крови выявили ДНК ВГВ и значительно повышенный уровень трансаминаз. В контрольной группе ни у одного из 80 здоровых волонтеров ДНК ВГВ в сыворотке не обнаружили. Использовали гнездовую ПЦР с чувствительностью обнаружения ДНК ВГВ в сыворотке крови 19 МЕ/мл [66]. Одним из возможных объяснений значительной вариабельности результатов из одной по эндемичности страны может быть разный состав групп пациентов, а также разные по чувствительности методы определения вирусной ДНК.
Анализ причин цирроза печени у 111 пациентов [67] показал присутствие у 66 пациентов в сыворотке крови маркеров гепатита В – HBsAg и анти-HBc, у 18 пациентов серологические маркеры вирусных гепатитов не обнаружили и обозначили их как больных с криптогенным циррозом. Изучение ДНК ВГВ показало ее присутствие в сыворотке крови у 7/18 (38,9%) пациентов, что позволило установить диагноз у этих больных. Для установления причин цирроза печени у 68 пациентов, перенесших трансплантацию печени, анализировали замороженные образцы печени, и у 3 (4,4%) пациентов определили СГВ, при этом у 2/3 пациентов с циррозом предварительно причина заболевания не была установлена [68]. Позже эти же авторы изучали образцы биопсии печени от 104 HBsAg-негативных пациентов с различными заболеваниями печени неустановленной этиологии и у 7/104 пациентов (6,7%) определили ДНК ВГВ. Авторы заключили, что для установления диагноза при криптогенных заболеваниях печени необходимо использовать тесты, позволяющие определять низкие концентрации вирусной ДНК, характерные для СГВ [69].
Цирроз печени приблизительно в 42% случаев коррелирует с ВГВ-инфекцией [42] и является наиболее важным фактором, способствующим развитию рака печени [70]. Согласно данным крупномасштабных ретроспективных исследований, у пациентов с циррозом, несмотря на клиренс HBsAg, риск развития ГКК в 2–10 раз выше, чем у пациентов без цирроза [71–74]. Это показывает, что цирроз печени, ассоциированный со СГВ, может быть предраковым состоянием [75].
Скрытый гепатит В и гепатокарцинома
ГКК являлась одним из 6 наиболее распространенных видов рака и 3-й по значимости причиной смертности от рака во всем мире в 2020 г. [76]. В Китае первичный рак печени является 5-м по распространенности видом рака и занимает 2-е место по уровню смертности [77].
Как уже упоминалось в разделе «Введение», интеграция ДНК ВГВ часто происходит на ранней стадии инфекции, но может происходить и на более поздних этапах, в том числе у пациентов с клиренсом HBsAg [11]. Интегрированные последовательности ВГВ, обнаруженные в большинстве (70–90%) ГКК, связанных с ХГВ [78], могут вызывать инсерционный мутагенез и геномные перестройки, однако регуляторные механизмы этих процессов пока недостаточно изучены [79, 80].
Представляют интерес данные о развитии ГКК у пациентов с СГВ. Китайские исследователи отметили спонтанный клиренс HBsAg у 55 из 1355 пациентов с ХГВ. За 23 мес наблюдения у 18/55 (32,7%) развились серьезные осложнения, в том числе у 11 (20%) – ГКК. Авторы заключили, что отсутствие HBsAg не исключает риск развития ГКК [81]. В другой работе определили сероклиренс HBsAg у 298 пациентов с ХГВ, и у всех была обнаружена ДНК ВГВ в печени. В сыворотке крови ДНК ВГВ была выявлена у 13,4% в течение 1 года, у 6,1% – через 5–10 лет и у 3,7% пациентов – более чем через 10 лет после исчезновения HBsAg; у 7 пациентов (2,4%) наблюдали развитие ГКК. Определили, что риск развития фиброза печени и ГКК был выше у пациентов c CГВ в возрасте старше 50 лет (p = 0,004) [82]. T.C. Yip и соавт. (2017) [83] наблюдали сероклиренс HBsAg у 4568 пациентов после лечения аналогами нуклеозидов или интерфероном. Через 1–5 лет у 54 пациентов (1,2%) диагностировали ГКК. Результаты исследования показали, что после исчезновения HBsAg риск развития ГКК выше у женщин старше 50 лет и у мужчин в любом возрасте.
Длительная терапия, подавляющая активность ДНК ВГВ, может снизить частоту возникновения ГКК и смертность, однако полное излечение ХГВ в настоящее время практически невозможно, поскольку на сегодняшний день нет способов надежно элиминировать интегрированную вирусную ДНК из генома человека [84, 85]. В этой связи в Руководстве Американской ассоциации по изучению заболеваний печени (AASLD) и EASL используется термин «функциональное излечение», которое определяется как устойчивое отсутствие HBsAg и количество ДНК ВГВ в сыворотке крови ниже предела количественного определения через 24 нед после начала лечения [86]. Сходное определение – «функциональный ответ» на лечение, приведено в клинических рекомендациях, утвержденных в России в 2024 г.2
В то же время опубликованы данные, которые показывают, что после лечения пациентов с ХГВ и подавления активности вируса риск ГКК остается. Следует отметить, что частота развития ГКК у пациентов после сероклиренса HBsAg в сообщениях разных авторов сильно различается и составляет от 0 до 20% [85, 87, 88].
Во многих работах последних лет указывается, что у пациентов с СГВ наблюдается повышенный риск ГКК [89, 90]. Результаты исследования D.K.H. Wong и соавт. показали, что большинство (69%) HBsAg-негативных пациентов с ГКК имели СГВ, из них у 29 пациентов выявили кзкДНК в клетках печени и у 43 пациентов – ДНК ВГВ, интегрированную в ДНК гепатоцитов вблизи онкогенов [90]. В другой работе у 90/251 (35,8%) пациентов с СГВ диагностировали ГКК и очаговое поражение печени [91]. Важно, что среди пациентов с криптогенной ГКК у 73% определили СГВ, причем ДНК ВГВ чаще обнаруживали в тканях, прилегающих к опухоли [92].
Можно заключить, что при отсутствии HBsAg и определении ДНК ВГВ сохраняется риск развития ГКК, и это требует наблюдения пациентов с СГВ для раннего выявления опухоли. Кроме того, исследователи отмечают, что изучение СГВ при заболеваниях печени имеет решающее значение для достижения цели ВОЗ по искоренению вирусного гепатита к 2030 г. [56].
Накапливаются данные о роли СГВ не только в опухолях печени, но также в злокачественных опухолях других органов [93]. В одной из работ у 4 из 5 пациентов с раком поджелудочной железы, в сыворотках крови которых HBsAg отсутствовал, но присутствовали анти-HBc, в опухолевой ткани выявили экспрессию гена Х ВГВ. У 3 пациентов в клетках поджелудочной железы определили кзкДНК ВГВ, у одного – интегрированную ДНК ВГВ [94]. Авторы полагают, что основой канцерогенеза могли послужить фрагменты интегрированной вирусной ДНК и экспрессия HBx.
Указывают на связь ВГВ c высоким риском развития В-клеточных лимфом, особенно в странах, где ВГВ является эндемичным [95]. Обследование пациентов с ВГВ и В-клеточной лимфомой показало, что химиотерапия и иммунотерапия ритуксимабом излечивают 60–65% пациентов, однако пациенты, которые не отвечают на терапию, имеют неблагоприятный прогноз [96, 97]. Метаанализ работ из разных регионов мира показал, что вероятность развития неходжкинских лимфом у ВГВ-инфицированных людей в 2–3 раза выше, чем у неинфицированных [98, 99].
Это означает, что пациентов со злокачественными лимфопролиферативными заболеваниями, в том числе c лимфомами, следует обследовать на присутствие маркеров ВГВ-инфекции до начала терапии, а также проводить мониторинг реактивации ВГВ, часто наблюдаемой в результате комплексной терапии лимфом.
Реактивация вируса гепатита B при сочетанных инфекциях и в ходе иммуносупрессивной терапии
Реактивация ВГВ происходит в большинстве случаев у лиц c ХГВ или СГВ при снижении иммунитета, которое наблюдается: 1) в пожилом возрасте (старше 60 лет), причем чаще у мужчин, и c тяжелыми последствиями гепатита (цирроз); 2) у пациентов, коинфицированных другими патогенами; 3) у пациентов с онкологическими и другими заболеваниями, получающих иммуносупрессивную терапию. Ниже рассмотрены работы, которые подтверждают эти наблюдения.
Коинфекция ВГВ и вируса гепатита С (ВГС). По данным Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), в 2013–2016 гг. в 29 случаях регистрировали реактивацию ВГВ у пациентов с гепатитом С, получавших препараты прямого противовирусного действия (ПППД). Один пациент скончался, другому потребовалась пересадка печени [100]. Позже у пациентов с СГВ, инфицированных ВГС, реактивацию ВГВ после лечения ПППД выявляли в среднем в 3% случаев [101]. Сходные данные получены в другой работе [102]: через 3 мес после лечения гепатита С софосбувиром и даклатасвиром у 4/140 пациентов (2,8%) наблюдали реактивацию ВГВ. Значительно чаще – у 81/111 (73%) пациентов с гепатитом С и СГВ – регистрировали реактивацию ВГВ после лечения ледипасвиром и софосбувиром. Клинические проявления гепатита наблюдали у 10 из 111 (9%) пациентов [103]. Реактивацию ВГВ наблюдали у пациентки с СГВ, получавшей ибрутиниб [104]. После лечения гепатита С ПППД реактивация ВГВ чаще происходила у пациентов с текущей коинфекцией ВГВ – у 10/29 (34,5%) пациентов, но также, хотя и значительно реже, у пациентов с прошедшей ВГВ-инфекцией (СГВ) – у 3/228 (1,3%) [105]. Напротив, S. Meschi и соавт. [106] сообщили о том, что среди 137 пациентов с коинфекцией ВГВ/ВГС реактивация ВГВ возникла у 10% пациентов с активным гепатитом В и у 90% – с перенесенной (СГВ) инфекцией. Авторы использовали высокочувствительные тесты и считают, что для анализа риска реактивации ВГВ необходимо определять не только HBsAg, но и ДНК ВГВ. С этим не согласны Q. Maqsood и соавт. (2023), которые показали, что для прогнозирования реактивации ВГВ такие маркеры, как ДНК ВГВ и прегеномная РНК ВГВ, не эффективны, а в качестве биомаркера реактивации ВГВ может быть использован только титр HBsAg [107]. Все авторы считают, что риск реактивации ВГВ при коинфекции с ВГС высок, и это объясняется тем, что ВГС ингибирует репликацию ВГВ, тогда как подавление ВГС в результате лечения ПППД может приводить к реактивации ВГВ [106, 108]. Эти предположения соответствуют действующим рекомендациям, согласно которым все пациенты с ВГС, которым планируется лечение ПППД, должны пройти скрининг на HBsAg и ДНК ВГВ [109].
Новая коронавирусная инфекция. COVID-19 был признан еще одной причиной реактивации ВГВ, поскольку его лечение включает введение высоких доз кортикостероидов и/или некоторых иммуносупрессивных препаратов. Так, при обследовании пациентов с тяжелым COVID-19 и маркерами СГВ, которые получали иммуносупрессивный препарат тоцилизумаб, у 2/23 пациентов (9,7%) обнаружили реактивацию ВГВ. Авторы сделали вывод, что в таких случаях следует проводить профилактику энтекавиром [110]. С этими результатами согласуются данные о реактивации ВГВ у 4/23 (17,4%) пациентов с COVID-19, получавших иммунодепрессанты: у 1/8 (12,5%) HBsAg-позитивных пациентов и у 3/15 (20%) с СГВ [111]. Авторы рекомендуют у всех пациентов с COVID-19, получающих иммуносупрессивную терапию, тестировать 3 маркера ВГВ-инфекции – HBsAg, анти-HBs, анти-HBc, и по показаниям проводить профилактику реактивации ВГВ.
ВИЧ-инфекция. Реактивации ВГВ при СГВ способствует снижение иммунитета при ВИЧ-инфекции. Обобщение результатов 50 исследований показало, что глобальная распространенность СГВ у детей и подростков составила 7,5%, тогда как среди ВИЧ-инфицированных оказалась в 3 раза больше – 24,2% [112]. Реактивацию ВГВ наблюдали в большой группе ВИЧ-инфицированных женщин до проведения антиретровирусной терапии. У 8/400 (2%) пациенток обнаружили СГВ. Результаты исследования показали, что у ВИЧ-инфицированных пациенток с СГВ чаще развивалась иммуносупрессия (количество CD4-клеток < 200 клеток/мм3) и наблюдался более высокий уровень РНК ВИЧ [113].
Онкологические заболевания. Группой высокого риска по реактивации ВГВ являются онкологические больные. Согласно имеющимся данным, у онкологических больных с ХГВ частота реактивации ВГВ вследствие противоопухолевой терапии может составлять от 30 до 80% в зависимости от используемых препаратов, режима химиотерапии и серологического статуса пациента [114]. Реактивация ВГВ может привести к тяжелому гепатиту, печеночной недостаточности или смерти [115]. Ранее сообщалось, что риск реактивации прошедшего гепатита В у пациентов с лимфомой, получавших химиотерапию, составляет 11% [116]. Недавно проведенный метаанализ, включающий 328 онкологических больных с СГВ, находившихся на химиотерапии, показал, что у 3% из них (10 случаев) произошла реактивация ВГВ. Имеются исследования, сообщающие о том, что анти-ВГВ-профилактика до начала противоопухолевой терапии может значительно снизить реактивацию ВГВ у больных с онкологическими заболеваниями [117]. Авторы указали на важность скрининга всех пациентов перед химиотерапией опухолей на наличие не только HBsAg, но и анти-HBc, и отметили, что центры по контролю и профилактике заболеваний и AASLD также рекомендовали проводить тестирование на маркеры ВГВ лиц, получающих иммуносупрессивную терапию.
Было установлено [118], что риск реактивации ВГВ зависит от конкретного иммуносупрессивного препарата и от того, был ли у пациента текущий ХГВ (HBsAg+) или перенесенный СГВ (HBsAg−, анти-HBc+, ДНК ВГВ+). Так, у пациентов с ХГВ самый высокий риск реактивации (> 10%) был связан с приемом анти-CD20-препаратов после трансплантации гемопоэтических стволовых клеток (ГСК), тогда как у пациентов с СГВ – с приемом ингибиторов янус-киназы (JAK). Известны также многочисленные иммуносупрессивные препараты, которые представляют умеренный (1–10%) и низкий риск (< 1%) реактивации ВГВ у пациентов с опухолями. Было установлено, что частота реактивации ВГВ у онкологических больных с ХГВ в анамнезе после химиотерапии составляет в среднем 25% (4–68%). У большинства (65%) этих пациентов наблюдалось прогрессирование заболевания, что требовало проведения трансплантации печени, а в противном случае приводило к смерти [119]. Эксперты рекомендуют всем пациентам с положительным HBsAg до начала иммуносупрессивной терапии проводить профилактику гепатита В. Что касается пациентов с СГВ, то риск реактивации сильно варьирует, зависит от применения различных иммуносупрессивных препаратов, поэтому рекомендуют назначать специфическую профилактику гепатита В в каждом конкретном случае. Отмечают, что у пациентов без HBsAg, но с анти-НВс, которые находились на иммуносупрессивной терапии без профилактики, реактивация ВГВ может достигать более 10% [120, 121].
В реактивации ВГВ ключевую роль играют иммунные механизмы. Нарушения иммунных реакций хозяина против инфицированных клеток, а также нарушения в передачи сигналов системы интерферона позволяют вирусу обходить иммунную защиту хозяина и способствуют реактивации. Одно из приоритетных направлений борьбы с реактивацией ВГВ состоит в выборе противовирусных препаратов в каждом конкретном случае. Показано, что на предотвращение реактивации ВГВ может существенно повлиять внедрение персонализированной медицины – подходов к лечению, ориентированных на конкретного пациента [122]. Авторы подчеркивают важность комплексного лечения реактивации вируса гепатита В, сочетающего методы иммуномодуляции с противовирусным лечением.
Заключение
СГВ привлекает все большее внимание специалистов разного профиля, о чем свидетельствует растущее количество работ, посвященных этой проблеме. Показана связь СГВ с такими серьезными последствиями ХГВ, как цирроз печени и ГКК, а также со злокачественными опухолями других органов. Анализ маркеров СГВ позволяет установить диагноз в случаях криптогенных заболеваний печени. Установлено, что СГВ является фактором риска реактивации ВГВ, особенно при снижении иммунитета. Реактивация вируса приводит к более тяжелому течению гепатита и к неблагоприятному исходу заболевания. К группе высокого риска относятся пациенты с СГВ, коинфицированные другими вирусами: ВГС, SARS-CoV-2, ВИЧ. Высокий риск реактивации ВГВ установлен у онкологических больных с СГВ, проходящих курс химиотерапии. Показана возможность реактивации ВГВ у пациентов после гемотрансфузии от доноров крови с СГВ, а также передача ВГВ реципиентам органов при пересадках органов от доноров трансплантата с СГВ.
Для решения проблемы СГВ необходимо принять ряд мер. К ним относится масштабное обследование общей популяции населения, а также групп повышенного риска реактивации вируса и развития гепатита В. В связи с низкими концентрациями ДНК ВГВ в сыворотке/плазме крови, а также невозможностью в большинстве случаев получения образцов печени, необходимо усовершенствовать диагностику СГВ путем повышения чувствительности тестов, используемых в клинической практике. Рассматривается перспективность использования новых маркеров ВГВ: РНК ВГВ и HBcrAg (Hepatitis B core-related antigen). HBcrAg – новый суррогатный биомаркер, уровень которого коррелирует с уровнем кзкДНК ВГВ и позволяет судить о присутствии и уровне ДНК ВГВ в печени без использования инвазивных процедур. Отсутствие способов воздействия на кзкДНК ВГВ в настоящее время не позволяет удалить вирус из организма. Для подавления активности или разрушения кзкДНК разрабатываются подходы на основе низкомолекулярных ингибиторов и технологии редактирования генома CRISPR/Cas. Решение вопросов СГВ будет способствовать достижению цели, поставленной ВОЗ, – ликвидации вирусных гепатитов к 2030 г.
1 WHO. Hepatitis B; 2024. Доступно по: https://who.int/news-room/fact-sheets/detail/hepatitis-b
2 Рубрикатор клинических рекомендаций. Доступно по: https://cr.minzdrav.gov.ru
3 WHO. Global Hepatitis Report 2024. Action for access in low- and middle-income countries; 2024. Доступно по: https://who.int/publications/b/68511
Об авторах
Алла Александровна Кущ
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: vitallku@mail.ru
ORCID iD: 0000-0002-3396-5533
д-р биол. наук, профессор, ведущий научный сотрудник
Россия, 123098, г. МоскваСписок литературы
- Ou T.Y., Huy L.D., Mayne J., Shih C.L., Mai Xuan H., Thi Hong Nguyen N., et al. Global mortality of chronic liver diseases attributable to Hepatitis B virus and Hepatitis C virus infections from 1990 to 2019 and projections to 2030. J. Infect. Public Health. 2024; 17(7): 102443. https://doi.org/10.1016/j.jiph.2024.04.027.
- Tsukuda S., Watashi K. Hepatitis B virus biology and life cycle. Antiviral Res. 2020; 182: 104925. https://doi.org/10.1016/j.antiviral.2020.104925
- Mouzannar K., Schauer A., Liang T.J. The post-transcriptional regulatory element of hepatitis B virus: from discovery to therapy. Viruses. 2024; 16(4): 528. https://doi.org/10.3390/v16040528
- Панасюк Я.В., Власенко Н.В., Чурилова Н.С., Клушкина В.В., Дубоделов Д.В., Кудрявцева Е.Н. и др. Современные представления о роли гена Х вируса гепатита В (Hepadnaviridae: Orthohepadnavirus: Hepatitis B virus) в патогенезе инфекции, вызванной вирусом гепатита B. Вопросы вирусологии. 2022; 67(1): 7–17. https://doi.org/10.36233/0507-4088-84 https://elibrary.ru/tvufhi
- Li D., Hamadalnil Y., Tu T. Hepatitis B viral protein HBx: Roles in viral replication and hepatocarcinogenesis. Viruses. 2024; 16(9): 1361. https://doi.org/10.3390/v16091361.
- Asami J., Park J.H., Nomura Y., Kobayashi C., Mifune J., Ishimoto N., et al. Structural basis of hepatitis B virus receptor binding. Nat. Struct. Mol. Biol. 2024; 31(3): 447–54. https://doi.org/10.1038/s41594-023-01191-5
- Iwamoto M., Saso W., Sugiyama R., Ishii K., Ohki M., Nagamori S., et al. Epidermal growth factor receptor is a host-entry cofactor triggering hepatitis B virus internalization. Proc. Natl Acad. Sci. USA. 2019; 116(17): 8487–92. https://doi.org/10.1073/pnas.1811064116
- Gómez-Moreno A., Ploss A. Mechanisms of hepatitis B virus cccDNA and minichromosome formation and HBV gene transcription. Viruses. 2024; 16(4): 609. https://doi.org/10.3390/v16040609
- Gopalakrishna H., Ghany M.G. Perspective on emerging therapies to achieve functional cure of chronic hepatitis B. Curr. Hepatol. Rep. 2024; 23(2): 241–52. https://doi.org/10.1007/s11901-024-00652-9
- Sinha P., Thio C.L., Balagopal A. Intracellular host restriction of hepatitis B virus replication. Viruses. 2024; 16(5): 764. https://doi.org/10.3390/v16050764
- Yu X., Gong Q., Yu D., Chen Y., Jing Y., Zoulim F., et al. Spatial transcriptomics reveals a low extent of transcriptionally active hepatitis B virus integration in patients with HBsAg loss. Gut. 2024; 73(5): 797–809. https://doi.org/10.1136/gutjnl-2023-330577
- Zoulim F., Chen P.J., Dandri M., Kennedy P.T., Seeger C. Hepatitis B virus DNA integration: Implications for diagnostics, therapy, and outcome. J. Hepatol. 2024; 81(6): 1087–99. https://doi.org/10.1016/j.jhep.2024.06.037
- Yeh S.H., Li C.L., Lin Y.Y., Ho M.C., Wang Y.C., Tseng S.T., et al. Hepatitis B virus DNA integration drives carcinogenesis and provides a new biomarker for HBV-related HCC. Cell. Mol. Gastroenterol. Hepatol. 2023; 15(4): 921–9. https://doi.org/10.1016/j.jcmgh.2023.01.001
- Gu Z., Jiang Q., Abulaiti A., Chen X., Li M., Gao N., et al. Hepatitis B virus enhancer 1 activates preS1 and preS2 promoters of integrated HBV DNA impairing HBsAg secretion. JHEP Rep. 2024; 6(9): 101144. https://doi.org/10.1016/j.jhepr.2024.101144
- Maiorella R., Rodriguez V.A. Hepatitis B vaccine refusal in the newborn period. Pediatr. Ann. 2021; 50(8): e343–7. https://doi.org/10.3928/19382359-20210712-01
- Rajbhandari R., Chung R.T. Treatment of hepatitis B: A concise review. Clin. Transl. Gastroenterol. 2016; 7(9): e190. https://doi.org/10.1038/ctg.2016.46
- Michalak T.I., Pasquinelli C., Guilhot S., Chisari F.V. Hepatitis B virus persistence after recovery from acute viral hepatitis. J. Clin. Invest. 1994; 93(1): 230–9. https://doi.org/10.1172/JCI116950
- Hirode G., Choi H.S.J., Chen C.H., Su T.H., Seto W.K., Van Hees S., et al. Off-therapy response after nucleos(t)ide analogue withdrawal in patients with chronic hepatitis B: An international, multicenter, multiethnic cohort (RETRACT-B Study). Gastroenterology. 2022; 162(3): 757–71.e4. https://doi.org/10.1053/j.gastro.2021.11.002.
- Di Dato F., Iorio R. Expanding indications for chronic hepatitis B treatment: Is it really desirable to treat everyone? World J. Gastroenterol. 2024; 30(17): 2294–7. https://doi.org/10.3748/wjg.v30.i17.2294
- Gerlich W.H., Bremer C., Saniewski M., Schüttler C.G., Wend U.C., Willems W.R., et al. Occult hepatitis B virus infection: detection and significance. Dig. Dis. 2010; 28(1): 116–25. https://doi.org/10.1159/000282074
- Kleinman S.H., Busch M.P. Assessing the impact of HBV NAT on window period reduction and residual risk. J. Clin. Virol. 2006; 36(Suppl. 1): S23–9. https://doi.org/10.1016/s1386-6532(06)80005-3
- Голубева И.Ф., Шальнова Е.Е., Бочкова Г.Б. Инфекционные риски и обеспечение безопасности донорской крови и ее компонентов. Лабораторная диагностика инфекционных заболеваний. 2019; (1): 6–21.
- Heim K., Sagar, Sogukpinar Ö., Llewellyn-Lacey S., Price D.A., Emmerich F., et al. Attenuated effector T cells are linked to control of chronic HBV infection. Nat. Immunol. 2024; 25(9): 1650–62. https://doi.org/10.1038/s41590-024-01928-4
- European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J. Hepatol. 2017; 67(2): 370–98. https://doi.org/10.1016/j.jhep.2017.03.021
- Budzinska M.A., Shackel N.A., Urban S., Tu T. Cellular genomic sites of hepatitis B virus DNA integration. Genes (Basel). 2018; 9(7): 365. https://doi.org/10.3390/genes9070365
- Raimondo G., Locarnini S., Pollicino T., Levrero M., Zoulim F., Lok A.S., et al. Update of the statements on biology and clinical impact of occult hepatitis B virus infection. J. Hepatol. 2019; 71(2): 397–408. https://doi.org/10.1016/j.jhep.2019.03.034
- Wang C., Xue R., Wang X., Xiao L., Xian J. High-sensitivity HBV DNA test for the diagnosis of occult HBV infection: commonly used but not reliable. Front. Cell. Infect. Microbiol. 2023; 13: 1186877. https://doi.org/10.3389/fcimb.2023.1186877
- Fang Z.L., Zhuang H., Wang X.Y., Ge X.M., Harrison T.J. Hepatitis B virus genotypes, phylogeny and occult infection in a region with a high incidence of hepatocellular carcinoma in China. World J. Gastroenterol. 2004; 10(22): 3264–8. https://doi.org/10.3748/wjg.v10.i22.3264
- Mo Y., Jin F., Li D., Zou W., Zhong J., Tong Z., et al. Prevalence and molecular characteristics of occult hepatitis B virus infection among blood donors in Huzhou City, eastern China. Gene. 2024; 927: 148718. https://doi.org/10.1016/j.gene.2024.148718
- Pisaturo M., Onorato L., Russo A., Chiodini P., Coppola N. An estimation of the prevalence of occult HBV infection in Western Europe and in Northern America: A meta-analysis. J. Viral Hepat. 2020; 27(4): 415–27. https://doi.org/10.1111/jvh.13248
- Ji D.Z., Pang X.Y., Shen D.T., Liu S.N., Goyal H., Xu H.G. Global prevalence of occult hepatitis B: A systematic review and meta-analysis. J. Viral Hepat. 2022; 29(5): 317–29. https://doi.org/10.1111/jvh.13660
- Fu M.X., Faddy H.M., Candotti D., Groves J., Saa P., Styles C., et al. International review of blood donation screening for anti-HBc and occult hepatitis B virus infection. Transfusion. 2024; 64(11): 2144–56. https://doi.org/10.1111/trf.18018
- Серикова Е.Н., Семенов А.В., Останкова Ю.В., Тотолян А.А. Метод выявления вируса гепатита В в плазме крови при низкой вирусной нагрузке с использованием ПЦР в режиме реального времени. Клиническая лабораторная диагностика. 2021; 65(1): 59–64. https://doi.org/10.18821/0869-2084-2021-66-1-59-64 https://elibrary.ru/fagbfm
- Tung T.T., Schmid J., Nghia V.X., Cao L.C., Linh L.T.K, Rungsung I., et al. Low risk of occult hepatitis B infection among Vietnamese blood donors. Pathogens. 2022; 11(12): 1524. https://doi.org/10.3390/pathogens11121524
- Ndow G., Cessay A., Cohen D., Shimakawa Y., Gore M.L., Tamba S., et al. Prevalence and clinical significance of occult hepatitis B infection in the Gambia, West Africa. J. Infect. Dis. 2022; 226(5): 862–70. https://doi.org/10.1093/infdis/jiab327
- Mbencho M.N., Hafza N., Cao L.C., Mingo V.N., Achidi E.A., Ghogomu S.M., et al. Incidence of Occult Hepatitis B Infection (OBI) and hepatitis B genotype characterization among blood donors in Cameroon. PLoS One. 2024; 19(10): e0312126. https://doi.org/10.1371/journal.pone.0312126.
- Simpore A., Bazie B.V.E.J.T., Yooda P.A., Zoure A.A., Sawadogo S., Sawadogo A.G., et al. Seroprevalence of viral hepatitis B and occult hepatitis B among blood donors in Africa: a systematic review and meta-analysis. Rev. Med. Virol. 2024; 34(6): e70006. https://doi.org/10.1002/rmv.70006
- Семененко Т.А., Ярош Л.В., Баженов А.И., Никитина Г.Ю., Клейменов Д.А., Эльгорт Д.А. и др. Эпидемиологическая оценка распространенности «скрытых» форм и HBSAG-мутантов вируса гепатита В у гематологических больных. Эпидемиология и вакцинопрофилактика. 2012; (6): 9–14. https://elibrary.ru/pukkft
- Останкова Ю.В., Серикова Е.Н., Ширшова Н.Ю., Кусевицкая М.Б., Горская О.А., Басина В.В. и др. Распространенность скрытой формы хронического гепатита В у доноров крови в Санкт-Петербурге. Инфекция и иммунитет. 2023; 13(6): 1129–40. https://doi.org/10.15789/2220-7619-POO-14480 https://elibrary.ru/xhpybw
- Ганина А.А., Кюрегян К.К., Исаева О.В., Дмитриев П.Н., Марданлы С.Г., Михайлов М.И. Частота выявления «скрытого» гепатита В среди лиц с наркотической зависимостью и доноров крови. Наркология. 2008; 7(9): 70–4. https://elibrary.ru/kaybtf
- Xia R., Peng J., He J., Jiang P., Yuan C., Liu X., et al. The serious challenge of occult hepatitis B virus infection-related hepatocellular carcinoma in China. Front. Microbiol. 2022; 13: 840825. https://doi.org/10.3389/fmicb.2022.840825
- Im Y.R., Jagdish R., Leith D., Kim J.U., Yoshida K., Majid A., et al. Prevalence of occult hepatitis B virus infection in adults: a systematic review and meta-analysis. Lancet Gastroenterol. Hepatol. 2022; 7(10): 932–42. https://doi.org/10.1016/S2468-1253(22)00201-1.
- Bucio-Ortiz L., Enriquez-Navarro K., Maldonado-Rodríguez A., Torres-Flores J.M., Cevallos A.M., Salcedo M., et al. Occult hepatitis B virus infection in hepatic diseases and its significance for the WHO’s elimination plan of viral hepatitis. Pathogens. 2024; 13(8): 662. https://doi.org/10.3390/pathogens13080662
- Takuissu G.R., Kenmoe S., Amougou Atsama M., Atenguena Okobalemba E., Mbaga D.S., Ebogo-Belobo J.T., et al. Global epidemiology of occult hepatitis B virus infections in blood donors, a systematic review and meta-analysis. PLoS One. 2022; 17(8): e0272920. https://doi.org/10.1371/journal.pone.0272920
- Candotti D., Boizeau L., Laperche S. Occult hepatitis B infection and transfusion-transmission risk. Transfus. Clin. Biol. 2017; 24(3): 189–95. https://doi.org/10.1016/j.tracli.2017.06.014
- Pisaturo M., Onorato L., Russo A., Coppola N. Prevalence of occult HBV infection in Western countries. J. Med. Virol. 2020; 92(12): 2917–29. https://doi.org/10.1002/jmv.25867
- Elbahrawy A., Alaboudy A., El Moghazy W., Elwassief A., Alashker A., Abdallah A.M. Occult hepatitis B virus infection in Egypt. World J. Hepatol. 2015; 7(12): 1671–8. https://doi.org/10.4254/wjh.v7.i12.1671
- Azzam A., Khaled H., El-Kayal E.S., Gad F.A., Omar S. Prevalence of occult hepatitis B virus infection in Egypt: a systematic review with meta-analysis. J. Egypt. Public Health Assoc. 2023; 98(1): 13. https://doi.org/10.1186/s42506-023-00138-4
- Kajogoo V.D., Swai S.S., Gurung S. Prevalence of occult hepatitis B among HIV-positive individuals in Africa: A systematic review and meta-analysis. SAGE Open Med. 2022; 10: 20503121211072748. https://doi.org/10.1177/20503121211072748
- Enriquez-Navarro K., Maldonado-Rodriguez A., Rojas-Montes O., Torres-Ibarra R., Bucio-Ortiz L., De la Cruz M.A., et al. Identification of mutations in the S gene of hepatitis B virus in HIV positive Mexican patients with occult hepatitis B virus infection. Ann. Hepatol. 2020; 19(5): 507–15. https://doi.org/10.1016/j.aohep.2020.06.002
- García-Montalvo B.M., Ventura-Zapata L.P. Molecular and serological characterization of occult hepatitis B infection in blood donors from Mexico. Ann. Hepatol. 2011; 10(2): 133–41.
- Морозов И.А., Ильченко Л.Ю., Громова Н.И., Федоров И.Г., Гордейчук И.В., Княженцева А.К. и др. Проблемы скрытой инфекции, вызванной вирусом гепатита В. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2012; 22(4): 58–65. https://elibrary.ru/piwdpl
- Delghandi S., Raoufinia R., Shahtahmasbi S., Meshkat Z., Gouklani H., Gholoobi A. An overview of occult hepatitis B infection (OBI) with emphasis on HBV vaccination. Heliyon. 2024; 10(17): e37097. https://doi.org/10.1016/j.heliyon.2024.e37097
- Yip T.C., Wong G.L., Wong V.W., Tse Y.K., Lui G.C., Lam K.L., et al. Durability of hepatitis B surface antigen seroclearance in untreated and nucleos(t)ide analogue-treated patients. J. Hepatol. 2017; 68(1): 63–72. https://doi.org/10.1016/j.jhep.2017.09.018
- Liu W.J., Wu W.J., Lin C.L., Liu C.J., Huang Y.W., Hu J.T., et al. Impact of age at HBsAg seroclearance on hepatic outcomes and life expectancy in men with chronic HBV infection based on multi-state modeling of the natural history. J. Gastroenterol. 2025; 60(1): 107–17. https://doi.org/10.1007/s00535-024-02162-3
- Leowattana W., Leowattana P., Leowattana T. Quantitative hepatitis B core antibody and quantitative hepatitis B surface antigen: Novel viral biomarkers for chronic hepatitis B management. World J. Hepatol. 2024; 16(4): 550–65. https://doi.org/10.4254/wjh.v16.i4.550
- El Jamaly H., Eslick G.D., Weltman M. Meta-analysis: hepatitis B reactivation in patients receiving biological therapy. Aliment. Pharmacol. Ther. 2022; 56(7): 1104–8. https://doi.org/10.1111/apt.17155
- Morrone A., Fiorilli V., Cinti L., Roberto P., Ferri A.L., Visentini M., et al. Surface antigen serocleared hepatitis B virus infection increases the risk of mixed cryoglobulinemia vasculitis in male patients with chronic hepatitis C. Front. Immunol. 2024; 15: 1411146. https://doi.org/10.3389/fimmu.2024.1411146
- Saravanan S., Shankar E.M., Vignesh R., Ganesh P.S., Sankar S., Velu V., et al. Occult hepatitis B virus infection and current perspectives on global WHO 2030 eradication. J. Viral Hepat. 2024; 31(7): 423–31. https://doi.org/10.1111/jvh.13928
- Peng J., Yao X., Yuan C., Liu X., Xia R., He J., et al. The investigation of hepatitis B vaccine immune responses in occult hepatitis B virus-infected patients. Front Immunol. 2022; 13: 903685. https://doi.org/10.3389/fimmu.2022.903685
- Tang X., Yang L., Zhang P., Wang C., Luo S., Liu B., et al. Occult hepatitis B virus infection and liver fibrosis in Chinese patients. J. Infect. Dis. 2023; 228(10): 1375–84. https://doi.org/10.1093/infdis/jiad140
- Yurlov K.I., Masalova O.V., Kisteneva L.B., Khlopova I.N., Samokhvalov E.I., Malinovskaya V.V. et al. Human herpesviruses increase the severity of hepatitis. Biology (Basel). 2021; 10(6): 483. https://doi.org/10.3390/biology10060483
- Berasain C., Betés M., Panizo A., Ruiz J., Herrero J.I., Civeira M.P., et al. Pathological and virological findings in patients with persistent hypertransaminasaemia of unknown aetiology. Gut. 2000; 47(3): 429–35. https://doi.org/10.1136/gut.47.3.429
- Kaviani M.J., Behbahani B., Mosallaii M.J., Sari-Aslani F., Taghavi S.A. Occult hepatitis B virus infection and cryptogenic chronic hepatitis in an area with intermediate prevalence of HBV infection. World J. Gastroenterol. 2006; 12(31): 5048–50. https://doi.org/10.3748/wjg.v12.i31.5048
- Anvari F.A., Alavian S.M., Norouzi M., Mahabadi M., Jazayeri S.M. Prevalence and molecular analysis of occult hepatitis B virus infection isolated in a sample of cryptogenic cirrhosis patients in Iran. Oman Med. J. 2014; 29(2): 92–6. https://doi.org/10.5001/omj.2014.23
- Hashemi S.J., Hajiani E., Masjedizadeh A., Makvandi M., Shayesteh A.A., Alavinejad S.P., et al. Occult hepatitis B infection in patients with cryptogenic liver cirrhosis in southwest of Iran. Jundishapur J. Microbiol. 2015; 8(3): e16873. https://doi.org/10.5812/jjm.16873
- Agarwal N., Naik S., Aggarwal R., Singh H., Somani S.K., Kini D., et al. Occult hepatitis B virus infection as a cause of cirrhosis of liver in a region with intermediate endemicity. Indian J. Gastroenterol. 2003; 22(4): 127–31.
- Ferrari T.C., Xavier M.A., Vidigal P.V., Amaral N.S., Diniz P.A., Resende A.P., et al. Occult hepatitis B virus infection in liver transplant patients in a Brazilian referral center. Braz. J. Med. Biol. Res. 2014; 47(11): 990–4. https://doi.org/10.1590/1414-431X20143782
- Faria A.C., Correa B.H.M., Faria L.C., Vidigal P.V.T., Xavier M.A.P., Ferrari T.C.A. Occult hepatitis B virus infection in patients with chronic liver disease of different etiology in a Brazilian referral center: comparison of two different hepatitis B virus deoxyribonucleic acid amplification protocols: a cross-sectional study. Sao Paulo Med. J. 2022; 141(3): e2022147. https://doi.org/10.1590/1516-3180.2022.0147.R1.12072022
- Daher D., Seif El Dahan K., Cano A., Gonzales M., Ransom C., Jaurez E., et al. Hepatocellular carcinoma surveillance patterns and outcomes in patients with cirrhosis. Clin. Gastroenterol. Hepatol. 2024; 22(2): 295–304.e2. https://doi.org/10.1016/j.cgh.2023.08.003
- Kim G.A., Lee H.C., Kim M.J., Ha Y., Park E.J., An J., et al. Incidence of hepatocellular carcinoma after HBsAg seroclearance in chronic hepatitis B patients: a need for surveillance. J. Hepatol. 2015; 62(5): 1092–9. https://doi.org/10.1016/j.jhep.2014.11.031
- Yip T.C., Wong G.L., Chan H.L., Tse Y.K., Lam K.L., Lui G.C., et al. HBsAg seroclearance further reduces hepatocellular carcinoma risk after complete viral suppression with nucleos(t)ide analogues. J. Hepatol. 2019; 70(3): 361–70. https://doi.org/10.1016/j.jhep.2018.10.014
- Yang H., Bae S.H., Nam H., Lee H.L., Lee S.W., Yoo S.H., et al. A risk prediction model for hepatocellular carcinoma after hepatitis B surface antigen seroclearance. J. Hepatol. 2022; 77(3): 632–41. https://doi.org/10.1016/j.jhep.2022.03.032
- Yip T.C., Wong V.W., Lai M.S., Lai J.C., Hui V.W., Liang L.Y., et al. Risk of hepatic decompensation but not hepatocellular carcinoma decreases over time in patients with hepatitis B surface antigen loss. J. Hepatol. 2023; 78(3): 524–33. https://doi.org/10.1016/j.jhep.2022.11.020
- Varghese N., Majeed A., Nyalakonda S., Boortalary T., Halegoua-DeMarzio D., Hann H.W. Review of related factors for persistent risk of hepatitis B virus-associated hepatocellular carcinoma. Cancers (Basel). 2024; 16(4): 777. https://doi.org/10.3390/cancers16040777
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., et al. Global Cancer Statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J. Clin. 2021; 71(3): 209–49. https://doi.org/10.3322/caac.21660
- Zhou M., Wang H., Zeng X., Yin P., Zhu J., Chen W., et al. Mortality, morbidity, and risk factors in China and its provinces, 1990–2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2019; 394(10204): 1145–58. https://doi.org/10.1016/S0140-6736(19)30427-1
- Péneau C., Imbeaud S., La Bella T., Hirsch T.Z., Caruso S., Calderaro J., et al. Hepatitis B virus integrations promote local and distant oncogenic driver alterations in hepatocellular carcinoma. Gut. 2022; 71(3): 616–26. https://doi.org/10.1136/gutjnl-2020-323153
- Dias J.D., Sarica N., Cournac A., Koszul R., Neuveut C. Crosstalk between hepatitis B virus and the 3d genome structure. Viruses. 2022; 14(2): 445. https://doi.org/10.3390/v14020445
- Zhang M., Chen H., Liu H., Tang H. The impact of integrated hepatitis B virus DNA on oncogenesis and antiviral therapy. Biomark. Res. 2024; 12(1): 84. https://doi.org/10.1186/s40364-024-00611-y
- Huo T.I., Wu J.C., Lee P.C., Chau G.Y., Lui W.Y., Tsay S.H., et al. Sero-clearance of hepatitis B surface antigen in chronic carriers does not necessarily imply a good prognosis. Hepatology. 1998; 28(1): 231–6. https://doi.org/10.1002/hep.510280130
- Yuen M.F., Wong D.K., Fung J., Ip P., But D., Hung I., et al. HBsAg seroclearance in chronic hepatitis B in Asian patients: replicative level and risk of hepatocellular carcinoma. Gastroenterology. 2008; 135(4): 1192–9. https://doi.org/10.1053/j.gastro.2008.07.008
- Yip T.C., Chan H.L., Wong V.W., Tse Y.K., Lam K.L., Wong G.L. Impact of age and gender on risk of hepatocellular carcinoma after hepatitis B surface antigen seroclearance. J. Hepatol. 2017; 67(5): 902–8. https://doi.org/10.1016/j.jhep.2017.06.019
- Ji M., Hu K. Recent advances in the study of hepatitis B virus covalently closed circular DNA. Virol. Sin. 2017; 32(6): 454–64. https://doi.org/10.1007/s12250-017-4009-4
- Kaur S.P., Talat A., Karimi-Sari H., Grees A., Chen H.W., Lau D.T.Y., et al. Hepatocellular carcinoma in hepatitis B virus-infected patients and the role of hepatitis B surface antigen (HBsAg). J Clin Med. 2022; 11(4): 1126. https://doi.org/10.3390/jcm11041126.
- Ghany M.G., Buti M., Lampertico P., Lee H.M.; 2022 AASLD-EASL HBV-HDV Treatment Endpoints Conference Faculty. Guidance on treatment endpoints and study design for clinical trials aiming to achieve cure in chronic hepatitis B and D: Report from the 2022 AASLD-EASL HBV-HDV Treatment Endpoints Conference. J. Hepatol. 2023; 79(5): 1254–69. https://doi.org/10.1016/j.jhep.2023.06.002
- Gounder P.P., Bulkow L.R., Snowball M., Negus S., Spradling P.R., Simons B.C., et al. Nested case-control study: hepatocellular carcinoma risk after hepatitis B surface antigen seroclearance. Aliment. Pharmacol. Ther. 2016; 43(11): 1197–207. https://doi.org/10.1111/apt.13621
- Kuang X.J., Jia R.R., Huo R.R., Yu J.J., Wang J.J., Xiang B.D., et al. Systematic review of risk factors of hepatocellular carcinoma after hepatitis B surface antigen seroclearance. J. Viral Hepat. 2018; 25(9): 1026–37. https://doi.org/10.1111/jvh.12905
- Mak L.Y., Wong D.K., Pollicino T., Raimondo G., Hollinger F.B., Yuen M.F. Occult hepatitis B infection and hepatocellular carcinoma: Epidemiology, virology, hepatocarcinogenesis and clinical significance. J. Hepatol. 2020; 73(4): 952–64. https://doi.org/10.1016/j.jhep.2020.05.042
- Wong D.K., Cheng S.C.Y., Mak L.L., To E.W., Lo R.C., Cheung T.T., et al. Among patients with undetectable hepatitis B surface antigen and hepatocellular carcinoma, a high proportion has integration of HBV DNA into hepatocyte DNA and no cirrhosis. Clin. Gastroenterol. Hepatol. 2020; 18(2): 449–56. https://doi.org/10.1016/j.cgh.2019.06.029
- Huang Y., Li W., Hu H.T., Ruan S.M., Xian M.F., Xie X.Y., et al. Contrast-enhanced US diagnostic algorithm of hepatocellular carcinoma in patients with occult hepatitis B. Abdom. Radiol. (NY). 2022; 47(2): 608–17. https://doi.org/10.1007/s00261-021-03343-x
- Wong D.K., Huang F.Y., Lai C.L., Poon R.T., Seto W.K., Fung J., et al. Occult hepatitis B infection and HBV replicative activity in patients with cryptogenic cause of hepatocellular carcinoma. Hepatology. 2011; 54(3): 829–36. https://doi.org/10.1002/hep.24551
- Morozov S., Batskikh S. Commentary: Hepatitis B virus infection: an insight into the clinical connection and molecular interaction between hepatitis B virus and host extrahepatic cancer risk. Front Immunol. 2023; 14: 1200405. https://doi.org/10.3389/fimmu.2023.1200405
- Batskikh S., Morozov S., Dorofeev A., Borunova Z., Kostyushev D., Brezgin S., et al. Previous hepatitis B viral infection-an underestimated cause of pancreatic cancer. World J. Gastroenterol. 2022; 28(33): 4812–22. https://doi.org/10.3748/wjg.v28.i33.4812
- Rosenberg M., Poluch M., Thomas C., Sindaco P., Khoo A., Porcu P. Hepatitis B virus and B-cell lymphoma: evidence, unmet need, clinical impact, and opportunities. Front. Oncol. 2023; 13: 1275800. https://doi.org/10.3389/fonc.2023.1275800
- Dunleavy K. Double-hit lymphoma: optimizing therapy. Hematology Am. Soc. Hematol. Educ. Program. 2021; 2021(1): 157–63. https://doi.org/10.1182/hematology.2021000247
- Barraclough A., Hawkes E., Sehn L.H., Smith S.M. Diffuse large B-cell lymphoma. Hematol. Oncol. 2024; 42(6): e3202. https://doi.org/10.1002/hon.3202
- Li M., Gan Y., Fan C., Yuan H., Zhang X., Shen Y., et al. Hepatitis B virus and risk of non-Hodgkin lymphoma: an updated meta-analysis of 58 studies. J. Viral. Hepat. 2018; 25(8): 894–903. https://doi.org/10.1111/jvh.12892
- Spradling P.R., Xing J., Zhong Y., Rupp L.B., Moorman A.C., Lu M., et al. Incidence of malignancies among patients with chronic hepatitis B in US Health Care Organizations, 2006–2018. J. Infect. Dis. 2022; 226(5): 896–900. https://doi.org/10.1093/infdis/jiac011
- Bersoff-Matcha S.J., Cao K., Jason M., Ajao A., Jones S.C., Meyer T., et al. Hepatitis B virus reactivation associated with direct-acting antiviral therapy for chronic hepatitis C virus: a review of cases reported to the U.S. Food and Drug Administration Adverse Event Reporting System. Ann. Intern. Med. 2017; 166(11): 792–8. Doi: https://doi.org/10.7326/m17-0377
- Pisaturo M., Macera M., Alessio L., Calò F., Coppola N. Hepatitis B virus (HBV) reactivation following pharmacological eradication of hepatitis C virus (HCV). Viruses. 2019; 11(9): 850. https://doi.org/10.3390/v11090850
- Osman H.A., Ghweil A.A., Sabry A.M., Mahdy R.E., Khodeary A. Management of patients with hepatitis B virus reactivation post-DAA treatment of chronic hepatitis C virus infection In HCV-HBV coinfected patients with pretreatment HBeAg seroconversion and early degree of hepatic fibrosis. Infect. Drug Resist. 2019; 12: 3067–73. https://doi.org/10.2147/IDR.S215974
- Liu C.J., Sheen I.S., Chen C.Y., Chuang W.L., Wang H.Y., Tseng K.C., et al. Ledipasvir/Sofosbuvir for patients coinfected with chronic hepatitis C and hepatitis B in Taiwan: follow-up at 108 weeks posttreatment. Clin. Infect. Dis. 2022; 75(3): 453–9. https://doi.org/10.1093/cid/ciab971
- Lam L.K., Chan T.S.Y., Hwang Y.Y., Mak L.Y., Seto W.K., Kwong Y.L., et al. Hepatitis B virus reactivation in seronegative occult hepatitis B patient receiving ibrutinib therapy. Virol. J. 2023; 20(1): 168. https://doi.org/10.1186/s12985-023-02140-w
- Toka B., Köksal A.Ş., Dertli R., Şirin G., Fidan S., Ülger Y., et al. Hepatitis B reactivation in patients treated with direct-acting antivirals for hepatitis C. Dig. Dis. 2022; 40(5): 635–43. https://doi.org/10.1159/000521298
- Meschi S., Mizzoni K., Leoni B.D., Galli C., Garbuglia A.R., Belladonna S., et al. Occult HBV infection in patients infected by HIV or HCV: Comparison between HBV-DNA and two assays for HBsAg. Viruses. 2024; 16(3): 412. https://doi.org/10.3390/v16030412
- Maqsood Q., Sumrin A., Iqbal M., Younas S., Hussain N., Mahnoor M., et al. Hepatitis C virus/hepatitis B virus coinfection: Current prospectives. Antivir. Ther. 2023; 28(4): 13596535231189643. https://doi.org/10.1177/13596535231189643
- Colombatto P., Palmisano E., Ricco G., Cavallone D., Oliveri F., Coco B., et al. Different kinetics of HBV-DNA and HBsAg in HCV coinfected patients during DAAs therapy. J. Clin. Med. 2022; 11(5): 1406. https://doi.org/10.3390/jcm11051406
- Conners E.E., Panagiotakopoulos L., Hofmeister M.G., Spradling P.R., Hagan L.M., Harris A.M., et al. Screening and testing for hepatitis B virus infection: CDC recommendations – United States, 2023. MMWR Recomm. Rep. 2023; 72(1): 1–25. https://doi.org/10.15585/mmwr.rr7201a1
- Rodríguez-Tajes S., Miralpeix A., Costa J., López-Suñé E., Laguno M., Pocurull A., et al. Low risk of hepatitis B reactivation in patients with severe COVID-19 who receive immunosuppressive therapy. J. Viral Hepat. 2021; 28(1): 89–94. https://doi.org/10.1111/jvh.13410
- Mihai N., Olariu M.C., Ganea O.A., Adamescu A.I., Molagic V., Aramă Ș.S., et al. Risk of hepatitis B virus reactivation in COVID-19 patients receiving immunosuppressive treatment: a prospective study. J. Clin. Med. 2024; 13(20): 6032. https://doi.org/10.3390/jcm13206032
- Wu J., He J., Xu H. Global prevalence of occult HBV infection in children and adolescents: A systematic review and meta-analysis. Ann. Hepatol. 2024; 29(1): 101158. https://doi.org/10.1016/j.aohep.2023.101158
- Tsui J.I., French A.L., Seaberg E.C., Augenbraun M., Nowicki M., Peters M., et al. Prevalence and long-term effects of occult hepatitis B virus infection in HIV-infected women. Clin. Infect. Dis. 2007; 45(6): 736–40. https://doi.org/10.1086/520989
- Hwang J.P., Vierling J.M., Zelenetz A.D., Lackey S.C., Loomba R. Hepatitis B virus management to prevent reactivation after chemotherapy: a review. Support Care Cancer. 2012; 20(11): 2999–3008. https://doi.org/10.1007/s00520-012-1576-7
- Shouval D., Shibolet O. Immunosuppression and HBV reactivation. Semin. Liver Dis. 2013; 33(2): 167–77. https://doi.org/10.1055/s-0033-1345722
- Chen K.L., Chen J., Rao H.L., Guo Y., Huang H.Q., Zhang L., et al. Hepatitis B virus reactivation and hepatitis in diffuse large B-cell lymphoma patients with resolved hepatitis B receiving rituximab-containing chemotherapy: risk factors and survival. Chin. J. Cancer. 2015; 34(5): 225–34. https://doi.org/10.1186/s40880-015-0015-9
- Mezzacappa C., Lim J.K. Management of HBV reactivation: challenges and opportunities. Clin. Liver Dis. (Hoboken). 2024; 23(1): e0143. https://doi.org/10.1097/CLD.0000000000000143
- Anvari S., Tsoi K. Hepatitis B virus reactivation with immunosuppression: a hidden threat? J. Clin. Med. 2024; 13(2): 393. https://doi.org/10.3390/jcm13020393
- Zhu Y., Li H., Wang X., Zheng X., Huang Y., Chen J., et al. Hepatitis B virus reactivation increased the risk of developing hepatic failure and mortality in cirrhosis with acute exacerbation. Front. Microbiol. 2022; 13: 910549. https://doi.org/10.3389/fmicb.2022.910549
- Papatheodoridis G.V., Lekakis V., Voulgaris T., Lampertico P., Berg T., Chan H.L.Y., et al. Hepatitis B virus reactivation associated with new classes of immunosuppressants and immunomodulators: A systematic review, meta-analysis, and expert opinion. J. Hepatol. 2022; 77(6): 1670–89. https://doi.org/10.1016/j.jhep.2022.07.003
- Savaliya B.P., Shekouhi R., Mubarak F., Manaise H.K., Jimenez P.B., Kowkabany G., et al. Risk of hepatitis B virus reactivation in cancer patients undergoing treatment with tyrosine kinase-inhibitors. World J. Gastroenterol. 2024; 30(24): 3052–8. https://doi.org/10.3748/wjg.v30.i24.3052
- Ma H., Yan Q.Z., Ma J.R., Li D.F., Yang J.L. Overview of the immunological mechanisms in hepatitis B virus reactivation: Implications for disease progression and management strategies. World J. Gastroenterol. 2024; 30(10): 1295–312. https://doi.org/10.3748/wjg.v30.i10.1295
Дополнительные файлы