Оценка профилактического эффекта нокдауна клеточных генов NXF1, PRPS1 и NAA10 при гриппозной инфекции на модели in vitro
- Авторы: Пашков Е.А.1,2, Шиквин Д.А.3, Пашков Г.А.1,2, Нагиева Ф.Г.1, Богданова Е.А.2, Быков А.С.2, Пашков Е.П.2, Свитич О.А.1,2, Зверев В.В.1,2
-
Учреждения:
- ФГБУН «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» Минздрава России
- ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
- ФГБОУ ВО «МИРЭА – Российский технологический университет»
- Выпуск: Том 70, № 1 (2025)
- Страницы: 66-77
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16712
- DOI: https://doi.org/10.36233/0507-4088-289
- EDN: https://elibrary.ru/oqonmm
- ID: 16712
Цитировать
Аннотация
Введение. Грипп – острое респираторное вирусное инфекционное заболевание, индуцируемое одноименными вирусами. Существующие на сегодняшний день профилактические и терапевтические подходы имеют важное противоэпидемическое значение, однако имеется ряд проблем, таких как быстрое возникновение резистентных штаммов, отсутствие формирования перекрестного иммунитета и эффективность вакцин. Одним из подходов в создании противогриппозных средств является использование механизма РНК-интерференции и малых интерферирующих РНК (миРНК), комплементарных к матричной РНК мишени вирусных и клеточных генов.
Цель – оценка профилактического противогриппозного эффекта миРНК, направленных к клеточным генам NXF1, PRPS1 и NAA10, на модели in vitro.
Материалы и методы. Исследовали антигенные варианты вируса гриппа типа А: A/California/7/09 (H1N1), А/WSN/33 (H1N1) и A/Brisbane/59/07 (H1N1); клеточные культуры A549 и MDCK. Исследование выполняли посредством молекулярно-генетических (трансфекции, выделение нуклеиновых кислот, полимеразная цепная реакция с обратной транскрипцией в реальном времени) и вирусологических методов (заражение клеточных культур, титрование по визуальному цитопатическому действию, оценка вирусного титра посредством метода Рамакришнана).
Результаты. Показано, что миРНК, таргетированные к клеточным генам NXF1, PRPS1 и NAA10 при профилактическом применении в клеточной культуре в концентрации 0,25 мкг на лунку, при инфицировании штаммами вируса гриппа A/California/7/09 (H1N1), А/WSN/33 (H1N1) и A/Brisbane/59/07 (H1N1) при множественности инфекции 0,01, снижают вирусную репликацию до уровня 220 ТЦД50 на 1 мл клеточной среды, тогда как в контрольных необработанных клетках вирусный урожай составил ~106 ТЦД50 на 1 мл среды.
Выводы. Снижение экспрессии указанных генов NXF1, PRPS1 и NAA10 приводит к нарушению жизненного цикла и активности вирусов гриппа. Подобный подход может быть потенциально исследован и использован для близко- и дальнородственных представителей иных семейств вирусов.
Ключевые слова
Полный текст
Введение
Грипп – острое респираторное вирусное инфекционное заболевание, индуцируемое одноименными вирусами, относящимися к семейству Orthomyxoviridae. Согласно информационному бюллетеню CDC (Centers for Disease Control and Prevention, США), с 2020 г. и по настоящее время в мире регистрируется постоянный рост числа случаев гриппозной инфекции1. Ежегодное нарастание случаев инфицирования вирусами гриппа типа А среди человеческой популяции вызывает обеспокоенность, связанную с возможностью возникновения новой пандемии гриппозной инфекции [1].
Течение гриппа варьирует от острой преходящей лихорадки до тяжелого заболевания, осложнения которого могут вызывать дисфункцию сердечно-сосудистой, дыхательной, иммунной, мочеполовой и центральной нервной систем, а также провоцировать развитие вторичных грибковых либо бактериальных инфекций [2‒8]. Имеющиеся на сегодняшний день профилактические и терапевтические подходы имеют важное противоэпидемическое значение, однако также существует и ряд проблем, таких как быстрое возникновение резистентных штаммов, отсутствие формирования перекрестного иммунитета и эффективность вакцин, колеблющаяся на уровне от 70 до 90% у пациентов в возрасте моложе 65 лет и от 30 до 40% у пациентов, чей возраст 65 лет и старше [9]. Наряду с этим состав противогриппозных вакцин должен ежегодно обновляться в соответствии с прогнозируемой циркуляцией тех или иных антигенных вирусных вариантов [10, 11].
На сегодняшний день для терапии гриппозной инфекции FDA (U.S. Food and Drug Administration, США) рекомендованы четыре препарата: Xofluza (Балоксавира марбоксил) Rapivab (Перамивир), Relenza (Занамивир) и Tamiflu (Осельтамивир), классифицируемые в зависимости от ингибирующего гриппозную репродукцию механизма [12, 13]. Механизм действия препарата Xofluza заключается в ингибировании активности вирусной РНК-полимеразы, а остальных – в ингибировании нейраминидазы вируса гриппа [13]. Появление «эмергентных» лекарственно-устойчивых штаммов обуславливает необходимость разработки инновационных подходов в создании новых противогриппозных препаратов с выраженным противовирусным эффектом, улучшенной переносимостью и сниженной токсичностью до начала пандемии.
Подводя итог вышесказанному, можно отметить, что высокую актуальность для обеспечения безопасности населения имеет вопрос разработки дешевых, эффективных и безопасных противогриппозных средств профилактики и терапии.
РНК-интерференция – это эволюционно сложившийся механизм регуляции генной экспрессии и поддержания иммунного гомеостаза эукариот. Регуляция экспрессии генов в данном случае проявляется в качестве временного сайленсинга активности целевого гена. Сущность РНК-интерференции заключается в подавлении экспрессии целевой матричной РНК (мРНК) или гена с помощью молекулы малой интерферирующей РНК (миРНК). Механизм РНК-интерференции заключается в том, что чужеродная экзогенная двухцепочечная РНК расщепляется белком-эндонуклеазой Dicer на короткие фрагменты длиной от 21 до 25 пар нуклеотидов (миРНК), которые в цитоплазме связываются с белковым комплексом RISC (RNA-induced silencing complex), после чего происходит деградация целевой мРНК и блокировка трансляции [14, 15]. В настоящее время проходят лабораторные и клинические испытания терапевтические препараты, проявляющие противовирусную активность в отношении вирусного гепатита С (SPC3649), вирусного гепатита В (NucB1000), геморрагической лихорадки Эбола (TKM-Ebola), а также ряда других вирусных инфекций [16, 17]. Имеется доказанный противовирусный эффект от применения миРНК в отношении возбудителей вирусных инфекций животных, таких как вирусная болезнь Марека, ящур, трансмиссивный гастроэнтерит свиней, вирусная лихорадка о’ньонг-ньонг [18‒21]. Разработка и использование новых противовирусных композиций миРНК, наряду с уже существующими, позволит эффективнее ограничить распространение вирусных патогенов в человеческой популяции [22].
Одним из подходов в создании противогриппозных средств является использование специфических миРНК, комплементарных к мРНК мишени клеточных генов. Данный метод опосредован тем, что вирус гриппа имеет склонность к высокой мутационной изменчивости [23]. Исходя из этого, в данном случае целесообразнее влиять на экспрессию клеточных генов, чьи белковые продукты способствуют репродукции вируса гриппа в клетке, ввиду того что риск образования альтернативного вирусного репродуктивного пути низок [24]. Для проведения подобной оценки нами были выбраны следующие клеточные гены-мишени: NXF1, PRPS1 и NAA10. Ген NAA10 кодирует экспрессию белка NαA (N-концевая ацетилтрансфераза), который необходим для осуществления пострансляционной модификации белков, в том числе и вирусных. Ацетилирование белков вируса гриппа приводит к повышению вирусной вирулентности [22]. Ген PRPS1 кодирует экспрессию белка PRPS1, катализирующего фосфорибозилирование рибозы-5-фосфата до 5-фосфорибозил-1-пирофосфата. Это необходимо для биосинтеза пуриновых оснований, в частности аденина, входящего в состав вирусной РНК (вРНК) [25]. Ген NXF1 также кодирует экспрессию одноименного белка, участвует в процессе экспорта молекул из нуклеоплазмы в цитоплазму. Вирусный белок NS1 способен связываться с осью TAP/NXF1, что будет способствовать экспорту вирусной мРНК из ядра [26].
Подходы, направленные на профилактику вирусной инокуляции и связанные с подавлением клеточных генов, экспрессирующих белки, критически важные для вирусной репродукции, представляют особый интерес. Исходя из вышесказанного, целью настоящей работы являлось миРНК-опосредованное подавление активности генов NXF1, PRPS1 и NAA10 для оценки последующего профилактического и вирусингибирующего эффекта миРНК.
Материалы и методы
Малые интерферирующие РНК. Анализ нуклеотидных последовательностей для последующего выбора миРНК осуществляли с использованием программ Geneious (Geneious, США) и siDirect 2.1 (University of Tokyo, Япония). Посредством Geneious выполняли выравнивание транскриптов мРНК целевых генов и затем через программу siDirect 2.1 проводили подбор миРНК. Синтез миРНК производили на базе НПО «Синтол» (Москва, Россия).
Вирусы. Антигенные варианты вируса гриппа А: A/California/7/09 (H1N1), А/WSN/33 (H1N1) и A/Brisbane/59/07 (H1N1) были полученные из коллекции вирусов ФГБНУ НИИ вакцин и сывороток им. И.И. Мечникова. Используемая множественность заражения в работе (мн.з.) составила 0,01.
Определение вирусного титра. Вирусную активность оценивали по максимальному разведению вируссодержащей жидкости, при котором определялась конечная точка визуального проявления цитопатического действия (ЦПД) в культуре клеток А549 [27]. Значения вирусного титра даны в ТЦД50/мл (тканевых цитотоксических доз/мл).
Клеточные линии. Использовали клеточную линию MDCK, представляющую собой эпителий почечных канальцев собаки (Институт Пастера, Франция), а также клеточную линию A549 ‒ карциномные альвеолярно-базальные эпителиальные клетки человека (коллекция ATCC-CCL-185, США). Подробные условия культивирования используемых клеточных линий представлены в нашем раннем исследовании [28].
Метилтетразолиевый тест (МТТ-тест). Цитотоксический эффект миРНК оценивали с помощью колориметрического МТТ-теста. Подробные условия проведения МТТ-теста также представлены в нашем раннем исследовании [28]. По аналогии с работой M. Estrin и соавт., порог выживаемости трансфицированных клеток составлял 70% от выживаемости отрицательного контроля [29].
Трансфекция миРНК в клеточную культуру. Трансфекцию миРНК проводили на 24-луночных планшетах в клеточную линию А549 по достижении 70% клеточного монослоя (S лунки – 2 см2, посевная концентрация клеток на лунку 2,5 × 105. Количество вещества миРНК составило 0,25 мкг на лунку2). На начальном этапе выполняли смешивание реагента Geneject40 («Молекта», Россия)2 и Opti-MEM (Thermo Fisher Scientific, США), которые затем добавляли к смеси миРНК и Opti-MEM. Полученный комплекс инкубировали в течение 15 мин при температуре 25 °C. За время инкубации проводилась промывка клеток раствором Хенкса («ПанЭко», Россия) и бессывороточной средой Opti-MEM.. В качестве неспецифического контроля была использована миРНК L2, направленная к гену светляковой люциферазы, которая была разработана и апробирована ранее к.б.н. Файзулоевым Е.Б. для исключения неспецифического действия других миРНК, а также для оценки их эффективности [30].
Инокуляция трансфицированных вирусом гриппа клеток. Через 4 ч с момента трансфекции удаляли поддерживающую среду из лунок с трансфицированными клетками и инокулировали по 0,5 мл вируссодержащей жидкости с мн.з. 0,01, после чего вновь помещали клетки в CO2-инкубатор.
Выделение нуклеиновых кислот. Выделение общей РНК из лизата клеток выполняли с использованием набора «Рибосорб» («Амплисенс», Россия) в соответствии со служебным протоколом. Полученная РНК хранилась при температуре −70 °С.
Реакция обратной транскрипции. Обратную транскрипцию (ОТ) выполняли с использованием коммерческого набора реагентов ОТ-1 («Синтол», Россия) согласно протоколу производителя. Реакционную ОТ-смесь с внесенной в нее выделенной РНК инкубировали в термостате «Термит» («ДНК-Технология», Россия) при температурно-временно́м режиме 37 °С в течение 60 мин и 95 °С в течение 5 мин.
Полимеразная цепная реакция (ПЦР). Оценку динамики концентрации вРНК выполняли с помощью ПЦР в реальном времени (ПЦР-РВ) с набором праймеров, специфичных для гена М [31]. Использовали набор реагентов для проведения ПЦР в присутствии красителя EVA Green и референтного красителя ROX («Синтол»). Реакцию ПЦР-РВ проводили в амплификаторе «ДТ-96» («ДНК-технология», Россия) при следующих настройках: 95 °С ‒ 5 мин (1 цикл); 62 °С ‒ 40 с, 95 °С ‒ 15 с (40 циклов).
Оценка изменения экспрессии генов. Для анализа данных, полученных в ходе количественной ПЦР-РВ, и оценки изменения экспрессии целевых генов использовали метод Пфаффля [32].
Этическое утверждение. Исследование было одобрено этическим комитетом ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет) (протокол № 04-21 от 18.02.2021).
Статистическая обработка данных. Оценку достоверности итоговых результатов проводили с использованием статистического непараметрического критерия суммы рангов Вилкоксона, а также с использованием программного обеспечения Microsoft Excel 2013 (Microsoft, США) [33]. Разницу считали достоверной при уровне статистической значимости p ≤ 0,05.
Результаты
Определение значений цитотоксического действия миРНК
На 1-е сутки с момента заражения приемлемый уровень выживаемости отмечался при использовании всех миРНК, однако на 2-е сутки выживаемость была выше в клетках, обработанных миРНК: NXF1.1, PRPS1.2 и NAA10.1, и составила 77,0 ± 3,0, 86,0 ± 1,5 и 72,0 ± 4,0% соответственно. Следует отметить, что к 3-м суткам с момента трансфекции указанных комплексов наблюдалось выраженное повышение жизнеспособности клеток, превышающее данный показатель относительно иных миРНК. Полученные результаты представлены в табл. 1.
Таблица 1. Процент жизнеспособных клеток по отношению к контролю после трансфекции миРНК
Table 1. Percent of viable cells relative to control after siRNA transfection
миРНК siRNA | 1-е сутки 1st day | 2-е сутки 2nd day | 3-и сутки 3rd day |
NXF1.1 | 77,0 ± 3,0 | 67,0 ± 1,0 | 71,0 ± 2,0 |
NXF1.2 | 73,0 ± 2,0 | 60,0 ± 4,0 | 67,0 ± 7,0 |
PRPS1.1 | 101,0 | 65,0 ± 8,0 | 71,0 ± 6,0 |
PRPS1.2 | 86,0 ± 1,5 | 67,0 ± 2,0 | 79,0 ± 3,0 |
NAA10.1 | 72,0 ± 4,0 | 70,0 ± 3,0 | 83,0 ± 4,0 |
NAA10.2 | 116,0 ± 8,0 | 65,0 ± 3,0 | 81,0 ± 1,0 |
siL2 | 83,0 ± 2,0 | 86,0 ± 4,0 | 92,0 ± 3,0 |
K− (нетрансф.) K− (non-transfected) | 100 | 100 | 100 |
Примечание. За 100% принята оценка выживаемости необработанных клеток (отриц. контроль). Пороговое значение выживаемости установлено на уровне 70%. Жирным шрифтом выделены наименования комплексов и наименее токсичные значения снижения жизнеспособности клеток.
Note. The survival rate of untreated cells (negative control) was taken as 100%. The threshold value of survival was set at 70%. Names of complexes and the least toxic values based on cell viability reduction are marked in bold font.
Определение таргетного эффекта используемых миРНК
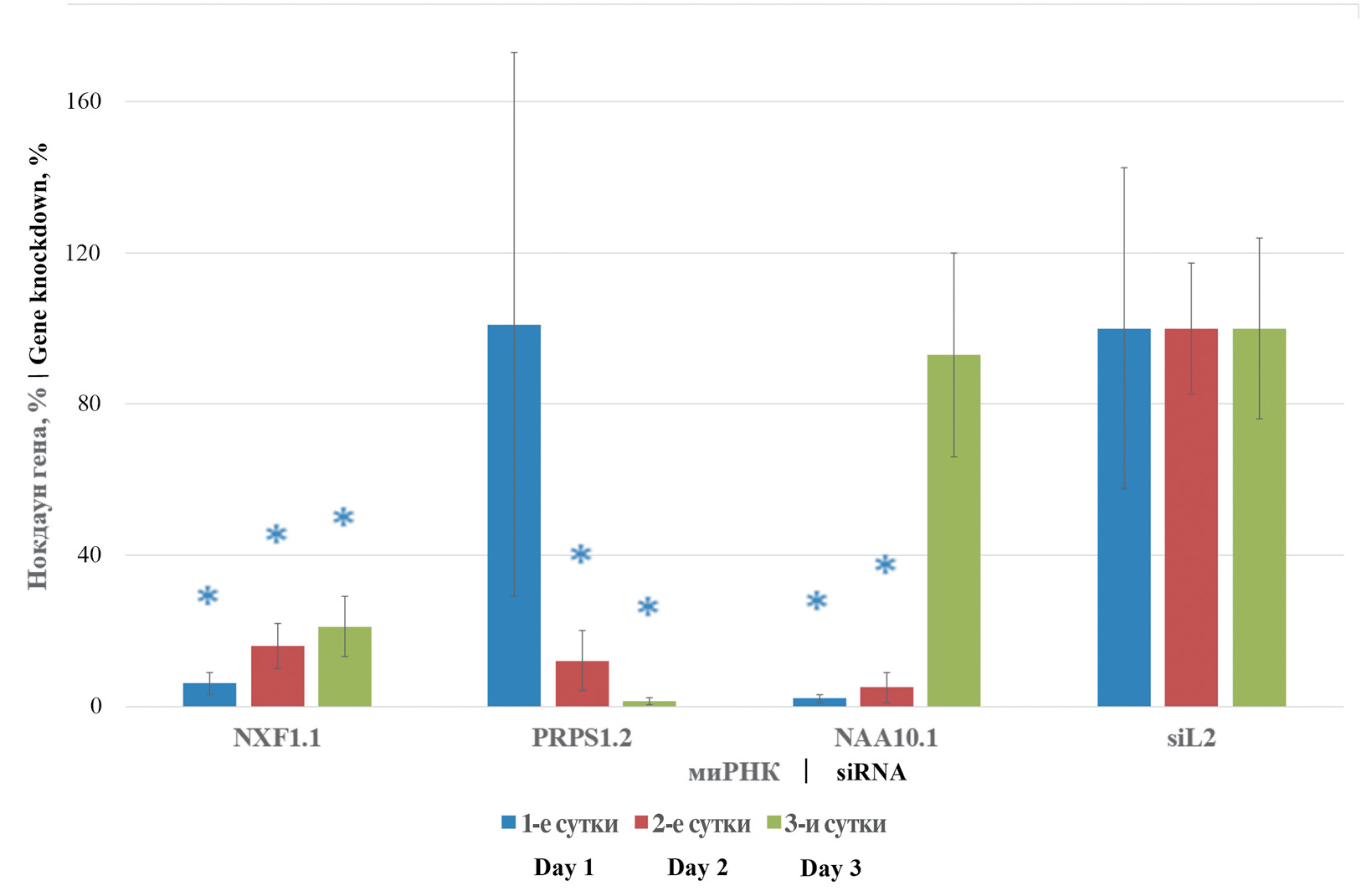
Для дальнейшей работы были отобраны миРНК NXF1.1, PRPS1.2 и NAA10.1. Оценку их целевого действия проводили в течение 3 сут на клеточной культуре А549. Установлено, что трансфекция миРНК NXF1.1 вызывает достоверное снижение количества транскрипционных продуктов одноименного гена до уровня в 6,0, 16,0 и 21,0% в 1, 2-е и 3-и сутки соответственно, по сравнению со значениями, полученными при анализе клеток, трансфицированных неспецифической миРНК siL2. Схожий результат был получен при использовании миРНК NAA10.1, где достоверный уровень продуктов транскрипции целевого гена в течение 2 сут с момента транскрипции составлял 2,0 и 5,0% в 1-е и 2-е сутки соответственно относительно значений группы неспецифического контроля. На 3-и сутки с момента трансфекции процентный уровень транскриптов гена NAA10 достигал схожих значений с клетками, обработанными siL2. миРНК PRPS1.2 индуцировала достоверное снижение процентного уровня экспрессии целевого гена на 2-е и 3-и сутки до 12,0 и 1,3% соответственно. Наряду с низким токсическим эффектом, неотъемлемым условием применения миРНК является подавление экспрессии целевого гена в течение необходимого промежутка времени. На данном этапе исследования было выявлено, что при использовании указанных миРНК отмечается стабильное снижение уровня транскриптов указанных генов. Результаты представлены на рис. 1.
Рис. 1. Изменение транскриптов генов NXF1, PRPS1 и NAA10 в динамике.
На оси абсцисс представлены миРНК и их одноименные целевые клеточные гены; на оси ординат ‒ процент изменения уровня транскрипта. Данные критерия Пфаффля представлены в процентах. * ‒ р ≤ 0,05.
Fig. 1. Dynamic changes in NXF1, PRPS1 and NAA10 gene transcripts.
siRNA and their target cellular genes of the same name are shown on the X-axis; % change in transcript level is shown on the Y-axis. Pfaffl test data are presented in %. * ‒ p ≤ 0.05.
Проведенная оценка выживаемости клеток и уровня динамики транскриптов целевых генов дает понять, что используемые миРНК не вызывают чрезмерного цитоцидного эффекта на исследуемой клеточной линии. Полученные результаты позволяют использовать миРНК NXF1.1, PRPS1.2 и NAA10.1 для дальнейшей оценки профилактического эффекта в отношении разных генетических вариантов вируса гриппа А.
Оценка противовирусного эффекта используемых миРНК
При оценке противовирусного эффекта используемых миРНК на 1-е сутки с момента трансфекции было установлено, что липофекция миРНК NXF1.1 приводит к снижению вирусного титра штаммов A/California/7/09 (H1N1), A/Brisbane/59/07 (H1N1) и A/WSN/1933 (H1N1) на 3,5, 2,3 и 1,6 lg ТЦД50/мл соответственно относительно уровня вирусного титра в клетках, обработанных неспецифической миРНК. Количество вРНК при использовании данной миРНК снижалось в 1088,0, 11,2 и 33,4 раза соответственно по сравнению с группой неспецифического контроля. На 2-е сутки использования миРНК NXF1.1 показатель вирусной активности для указанной миРНК снижался на 3,2, 3,2 и 3,0 lg ТЦД50/мл, а количество вРНК – в 633,4, 6,4 и 25,2 раза соответственно указанным штаммам относительно неспецифической контрольной группы. Далее, на 3-и сутки, показатель вирусного титра снижался на 2,2 и 2,0 lg ТЦД50/мл в клетках, зараженных штаммами A/Brisbane/59/07 и A/WSN/1933 (H1N1), а вРНК – в 8,3 и 30,2 раза соответственно.
Трансфекция миРНК PRPS1.2 приводила к снижению вирусной репродукции штаммов A/California/7/09 (H1N1), A/Brisbane/59/07 (H1N1) и A/WSN/1933 (H1N1) на 1-е сутки на 2,3, 2,1 и 2,1 lg ТЦД50/мл, а вРНК – в 2917,0, 10,8 и 33,4 раза соответственно. На 2-е сутки с момента трансфекции уровень вирусного титра снижался на 3,2, 0,7 и 1,2 lg ТЦД50/мл, а количество вРНК – в 5059,4, 25,2 и 17,4 раза соответственно. Спустя 72 ч с момента трансфекции уровень вирусной активности был снижен на 2,2, 1,4 и 2,0 lg ТЦД50/мл соответственно.
Использование миРНК NAA10.1 на 1-е сутки с момента трансфекции индуцировало снижение вирусного титра штаммов A/California/7/09 (H1N1), A/Brisbane/59/07 (H1N1) и A/WSN/1933 (H1N1) на 1,6, 2,1 и 2,3 lg ТЦД50/мл соответственно по отношению к группе неспецифического контроля. Уровень вРНК в данном случае снижался в 141,3, 12,1, 16,6 раза соответственно. На 2-е сутки с момента трансфекции показатель вирусного титра снизился на 1,2 и 2,3 lg ТЦД50/мл соответственно в культурах клеток, зараженных штаммами A/Brisbane/59/07 (H1N1) и A/WSN/1933 (H1N1), а количество вРНК – в 455,1, 18,6 и 29,2 раза соответственно для штаммов A/California/7/09 (H1N1), A/Brisbane/59/07 (H1N1) и A/WSN/1933 (H1N1). На 3-и сутки после липофекции NAA10.1 уровень вРНК снизился в 141,3, 6,1 и 27,0 раза соответственно. Полученные данные представлены на рис. 2 и в табл. 2.
Рис. 2. Противовирусный эффект миРНК, специфичных к клеточным генам NXF1, PRPS1 и NAA10.
а ‒ A/California/7/09 (H1N1); б ‒ A/Brisbane/59/07 (H1N1); в ‒ A/WSN/1933 (H1N1). По оси абсцисс ‒ миРНК и их одноименные целевые клеточные гены; по оси ординат ‒ показатель вирусного титра lg ТЦД50/мл относительно вирусного и неспецифического контроля. * ‒ р < 0,05 относительно неспецифического контроля siL2.
Fig. 2. Antiviral effect of siRNAs specific to the NXF1, PRPS1 and NAA10 cell genes.
а ‒ A/California/7/09 (H1N1); b ‒ A/Brisbane/59/07 (H1N1); c ‒ A/WSN/1933 (H1N1); on the X-axis ‒ siRNA and their target cellular genes of the same name; on the Y-axis ‒ the viral titer log10 TCID50/mL relative to the viral and nonspecific control). * ‒ p < 0.05 relative to the nonspecific control siL2.
Таблица 2. Влияние противовирусного эффекта миРНК, направленных к генам NXF1, PRPS1 и NAA10, на динамику количества вРНК вируса гриппа A/California/7/09 (H1N1), A/Brisbane/59/07 и A/WSN/1933 (H1N1)
Table 2. Antiviral effect of siRNAs directed to the NXF1, PRPS1 and NAA10 genes on the dynamics of the amount of vRNA of the influenza virus A/California/7/09 (H1N1), A/Brisbane/59/07 and A/WSN/1933 (H1N1)
Ген Gene | миРНК siRNA | Показатель снижения вРНК вируса гриппа А (кратность по отношению к siL2) при мн.з. 0,01 Influenza A virus vRNA reduction rate (multiplicity relative to siL2) at 0.01 MOI | ||
1-е сутки 1st day | 2-е сутки 2nd day | 3-и сутки 3rd day | ||
A/California/7/09 (H1N1) | ||||
NXF1 | NXF1.1 | 1088,0 | 633,4 | 423,9 |
PRPS1 | PRPS1.2 | 2917,1 | 5059,4 | 1771,1 |
NAA10 | NAA10.1 | 8,6 | 455,1 | 141,3 |
siL2 | 21 012 866 | 19 581 834 721 | 24 581 834 721 | |
A/Brisbane/59/07 | ||||
NXF1 | NXF1.1 | 11,2 | 6,4 | 8,3 |
PRPS1 | PRPS1.2 | 10,8 | 25,2 | 15,5 |
NAA10 | NAA10.1 | 12,1 | 18,6 | 6,1 |
siL2 | 195 184 | 1 837 130 | 23 156 335 | |
A/WSN/1933 (H1N1) | ||||
NXF1 | NXF1.1 | 33,4 | 33,6 | 30,2 |
PRPS1 | PRPS1.2 | 10,4 | 17,4 | 40,3 |
NAA10 | NAA10.1 | 16,6 | 29,2 | 27,0 |
siL2 | 371 038 | 2 647 184 | 41 839 472 | |
Примечание. Расчет результатов проводился относительно клеток с неспецифической миРНК L2. Данные для неспецифического контроля siL2 даны в значении количество единиц вРНК/мл. Жирным шрифтом выделены значения, для которых р < 0,05.
Note. The results were calculated relative to cells with nonspecific siRNA L2. Data for the nonspecific siL2 control are given as the number of vRNA units/mL. Values for which p < 0.05 are shown in bold.
Обсуждение
С момента своего открытия механизм РНК-интерференции сразу стал использоваться как один из инструментов, позволяющих регулировать вирусную репродукцию на моделях in vitro и in vivo. Более того, классическим подходом при проектировании средств, базируемых на механизме РНК-интерференции, являлось использование участков вирусного генома в качестве мишеней, что отражено в одной из ранних работ Q. Ge и соавт. В этом исследовании авторы заражали мышей вирусом гриппа A/PR/8/34 (H1N1) и интраназально инокулировали миРНК к вирусному гену NP, что вызывало снижение репродукции в 60 раз [34]. Результаты исследования H.Y. Sui и соавт. показывают, что при использовании миРНК, направленных к консервативной последовательности гена, экспрессирующего вирусный белок М2, наблюдается ингибирование репродукции высоковирулентного A/Hong Kong/486/97 (H5N1) в 3 раза [35]. В работе J. Piasecka и соавт. был рассмотрен противовирусный эффект при миРНК-опосредованном ингибировании образования белка NP вирусов гриппа A/California/04/2009 (H1N1) и A/PR/8/34 (H1N1), во время которого отмечалось снижение вирусной репродукции до 85% по сравнению с контрольной группой [36].
В то же время вирусы гриппа А имеют высокую склонность к мутационной изменчивости в результате замен, делеций, инсерций участков нуклеотидных последовательностей либо реассортаций, что приводит к появлению лекарственной резистентности [23]. Исходя из этого, разработка новых профилактических и терапевтических подходов с использованием миРНК, таргетированных к клеточным мишеням, обладает рядом преимуществ: подобные средства способны обладать как профилактическим, так и терапевтическим потенциалом; возможно осуществить дизайн и синтез препарата на основе миРНК в течение нескольких часов; препараты миРНК можно применять в комплексе с иными противовирусными препаратами для синергии их эффекта; миРНК, таргетированные к клеточным генам, транскрибирующим белковые продукты, ключевые для процесса вирусной репродукции, могут быть направлены по отношению к разным таксономическим группам вирусов [24]. Исходя их этих критериев, важно вести поиск клеточных генов-мишеней, нокдаун которых будет приводить к подавлению репродукции вирусов близко- или дальнородственных таксономических групп. В настоящем исследовании оценивали противовирусный эффект профилактической трансфекции миРНК, нацеленных на клеточные гены NXF1, PRPS1 и NAA10. Результаты исследования свидетельствуют о том, что процессы ядерного импорта и экспорта, фосфорибозилирование рибозы-5-фосфата до 5-фосфорибозил-1-пирофосфата, а также посттрансляционная модификация белков могут играть важную роль в репродукции вируса гриппа [37‒39]. Ингибирование трансляции рассматриваемых генов приводит к снижению вирусной репродукции по результатам использования таких методов, как титрование по ЦПД и ОТ-ПЦР. Было показано, что наряду со снижением показателя вирусного титра, начиная с момента липофекции исследуемых миРНК, отмечалось и снижение количества вРНК в течение 3 сут. Наиболее эффективное снижение вирусной репродукции наблюдалось при подавлении гена NXF1 в 1-е сутки с момента трансфекции всех специфически ингибирующих миРНК: снижение вирусного титра на 2,0‒3,2 lg ТЦД50/мл и количества вРНК в 11,2‒1088,0 раза. Временное нарушение репродукции вируса гриппа в результате миРНК-опосредованной блокировки ядерного импорта и экспорта в результате сайленсинга гена NXF1 приводило к более выраженному противовирусному эффекту, по сравнению с иными исследуемыми в настоящем исследовании клеточными генами. Подобный результат может быть опосредован тем, что в ходе своей репродукции вирусы гриппа осуществляют часть репликативного цикла в нуклеоплазме, транслоцируясь через ядерно-поровый комплекс в мембране ядра, а рибозилирование и посттрансляционная модификация белков могут осуществляться иными путями [40‒42].
Параллельно с этим, в ряде исследований отмечается значимость гена/белка NXF1 в репродуктивном цикле иных вирусов. Так, в работе M. Mei и соавт. отмечается ключевое значение NXF1 в ядерном экспорте мРНК для SARS-CoV-2, однако структурно-управляемый мутагенез кислотного участка (D33, E36, E37 и E41) на поверхности N-концевого домена Nsp1, опосредующего взаимодействие с NXF1, приводил к блокировке ядерного экспорта [43]. Схожий дефект связывания NS1 вируса гриппа А с осью NXF1•NXT1 приводит к высвобождению мРНК, кодирующих экспрессию ряда иммунных факторов, из ядра, и как следствие, к снижению вирусной активности, что представлено в работе K. Zhang и соавт. [44]. Не менее важной представляется роль NXF1 в жизненном цикле вируса Эбола, показанная в исследовании L. Wendt и соавт., где авторы проводили реакцию коиммунопреципитации и двойного иммунофлуоресцентного анализа с целью охарактеризовать взаимодействие NXF1 с вирусными белками и вРНК. Было выявлено, что вирусный белок NP взаимодействует с РНК-связывающим доменом NXF1 и конкурирует с РНК за это взаимодействие. Также в работе использовалась минигеномная система, при которой наблюдался нокдаун гена NXF1. На фоне того, что уровни мРНК в клетках с дисфункцией NXF1 были сопоставимы с контрольными клетками, авторы предположили, что NXF1 важен для ядерного экспорта мРНК к рибосомам для эффективной трансляции мРНК [45]. Несплайсированная РНК ВИЧ-1 используется для последующей трансляции вирусных белков, однако перед этим она должна быть транслоцирована из нуклеоплазмы в цитоплазму. В работе J. Chen и соавт. с использованием гибридизации in situ было установлено, что для ядерного экспорта, используемого ВИЧ-1, задействуется NXF1 [46].
Наряду с транскрипцией и трансляцией, транслокация мРНК через ядерный поровый комплекс (NPC), структурным компонентом которого является NXF1, представляется важным регуляторным этапом экспрессии генов ряда вирусных семейств [47]. Основываясь на результатах, полученных в исследовании, а также рассмотренных выше литературных источников, можно сделать вывод, что белковый продукт экспрессии гена NXF1 играет важную роль в репродукции вирусов, относящихся к разным таксономическим группам. Помимо гена NXF1, иные гены, образующие NPC, также являются мишенями, сайленсинг которых способен приводить к снижению вирусной репродукции. Так, в нашем раннем исследовании была показана взаимосвязь между снижением вирусной активности гриппа А и ингибированием экспрессии генов Nup98 и Nup205, также кодирующих образование белков-нуклеопоринов NPC [48]. Исходя из этого, миРНК-опосредованное нарушение функциональной активности некоторых компонентов NPC может рассматриваться как один из перспективных вариантов разработки противовирусных препаратов, направленных на широкий спектр вирусных инфекций.
Полученные в ходе исследования результаты ясно демонстрируют, что профилактическая схема использования миРНК снижает последующую вирусную репродукцию. Имеющиеся данные согласуются с концепцией того, что профилактическая блокировка факторов клетки-хозяина, важных для вирусной репродукции, посредством миРНК, способно нарушать инфекционный процесс [49]. В тот же момент важно понимать, что подобная схема введения нуждается в точном выборе времени введения профилактического препарата. Ввиду этого, необходимо также проводить исследования, целью которых будет оптимизация и подбор оптимальных условий и времени для введения профилактического препарата.
Заключение
Полученные данные подтверждают, что гены, кодирующие экспрессию белков, образующих ядерно-поровый комплекс, являются перспективными мишенями для перспективных противовирусных миРНК, «нокдаун» их экспрессии приводит к снижению репродукции вирусов гриппа, а создание противовирусных препаратов на основе РНК-интерференции представляет из себя перспективный вектор направления разработки противогриппозных препаратов на основе механизма РНК-интерференции.
1 Centers for Disease Control and Prevention. Past reported global human cases with highly pathogenic avian influenza A(H5N1) (HPAI H5N1) by country, 1997–2024. https://www.cdc.gov/bird-flu/php/avian-flu-summary/chart-epi-curve-ah5n1.html
2 http://molecta.ru/wordpress/transfection
Об авторах
Евгений Алексеевич Пашков
ФГБУН «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» Минздрава России; ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Автор, ответственный за переписку.
Email: pashckov.j@yandex.ru
ORCID iD: 0000-0002-5682-4581
канд. мед. наук, ассистент кафедры микробиологии, вирусологии и иммунологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); младший научный сотрудник лаборатории прикладной вирусологии ФГБНУ НИИВС им. И.И. Мечникова
Россия, 105064, г. Москва; 119991, г. МоскваДмитрий Андреевич Шиквин
ФГБОУ ВО «МИРЭА – Российский технологический университет»
Email: carrypool@gmail.com
ORCID iD: 0009-0005-9874-2081
студент кафедры биотехнологии и промышленной фармации института тонких химических технологий им. М.В. Ломоносова
Россия, 119454, г. МоскваГеоргий Алексеевич Пашков
ФГБУН «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» Минздрава России; ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: georgp2004@mail.ru
ORCID iD: 0000-0003-0392-9969
студент клинического института детского здоровья им. Н.Ф. Филатова
Россия, 105064, г. Москва; 119991, г. МоскваФирая Галиевна Нагиева
ФГБУН «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» Минздрава России
Email: fgn42@yandex.ru
ORCID iD: 0000-0001-8204-4899
д-р мед. наук, доцент, заведующая лабораторией гибридных клеточных культур
Россия, 105064, г. МоскваЕкатерина Александровна Богданова
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: bogdekaterin@yandex.ru
ORCID iD: 0000-0002-5620-1843
канд. мед. наук, доцент кафедры микробиологии, вирусологии и иммунологии
Россия, 119991, г. МоскваАнатолий Сергеевич Быков
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: drbykov@bk.ru
ORCID iD: 0000-0002-8099-6201
д-р мед. наук, профессор кафедры микробиологии, вирусологии и иммунологии
Россия, 119991, г. МоскваЕвгений Петрович Пашков
ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: 9153183256@mail.ru
ORCID iD: 0000-0002-4963-5053
д-р мед. наук, профессор кафедры микробиологии, вирусологии и иммунологии
Россия, 119991, г. МоскваОксана Анатольевна Свитич
ФГБУН «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» Минздрава России; ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: svitichoa@yandex.ru
ORCID iD: 0000-0003-1757-8389
чл.-корр. РАН, д-р мед. наук, директор ФГБНУ НИИВС им И.И. Мечникова, заведующая лабораторией молекулярной иммунологии ФГБНУ НИИВС им. И.И. Мечникова, профессор кафедры микробиологии, вирусологии и иммунологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Россия, 105064, г. Москва; 119991, г. МоскваВиталий Васильевич Зверев
ФГБУН «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова» Минздрава России; ФГАОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Email: vitalyzverev@outlook.com
ORCID iD: 0000-0002-0017-1892
академик РАН, д-р биол. наук, научный руководитель ФГБНУ НИИВС им. И.И. Мечникова, профессор, заведующий кафедрой микробиологии, вирусологии и иммунологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет)
Россия, 105064, г. Москва; 119991, г. МоскваСписок литературы
- Purcell R., Giles M.L., Crawford N.W., Buttery J. Systematic review of avian influenza virus infection and outcomes during pregnancy. Emerg. Infect. Dis. 2025; 31(1): 50–6. https://doi.org/10.3201/eid3101.241343
- Bin N.R., Prescott S.L., Horio N., Wang Y., Chiu I.M., Liberles S.D. An airway-to-brain sensory pathway mediates influenza-induced sickness. Nature. 2023; 615(7953): 660–7. https://doi.org/10.1038/s41586-023-05796-0
- Kenney A.D., Aron S.L., Gilbert C., Kumar N., Chen P., Eddy A., et al. Influenza virus replication in cardiomyocytes drives heart dysfunction and fibrosis. Sci. Adv. 2022; 8(19): eabm5371. https://doi.org/10.1126/sciadv.abm5371
- Conrad A., Valour F., Vanhems P. Burden of influenza in the elderly: a narrative review. Curr. Opin. Infect. Dis. 2023; 36(4): 296–302. https://doi.org/10.1097/QCO.0000000000000931
- Watanabe T. Renal complications of seasonal and pandemic influenza A virus infections. Eur. J. Pediatr. 2013; 172(1): 15–22. https://doi.org/10.1007/s00431-012-1854-x
- van de Veerdonk F.L., Wauters J., Verweij P.E. Invasive aspergillus tracheobronchitis emerging as a highly lethal complication of severe influenza. Am. J. Respir. Crit. Care Med. 2020; 202(5): 646–8. https://doi.org/10.1164/rccm.202005-1883ED
- Feys S., Cardinali-Benigni M., Lauwers H.M., Jacobs C., Stevaert A., Gonçalves S.M., et al. Profiling bacteria in the lungs of patients with severe influenza versus COVID-19 with or without aspergillosis. Am. J. Respir. Crit. Care Med. 2024; 210(10): 1230–42. https://doi.org/10.1164/rccm.202401-0145OC
- Białka S., Zieliński M., Latos M., Skurzyńska M., Żak M., Palaczyński P., et al. Severe bacterial superinfection of influenza pneumonia in immunocompetent young patients: case reports. J. Clin. Med. 2024; 13(19): 5665. https://doi.org/10.3390/jcm13195665
- Pleguezuelos O., James E., Fernandez A., Lopes V., Rosas L.A., Cervantes-Medina A., et al. Efficacy of FLU-v, a broad-spectrum influenza vaccine, in a randomized phase IIb human influenza challenge study. NPJ Vaccines. 2020; 5(1): 22. https://doi.org/10.1038/s41541-020-0174-9
- Isakova-Sivak I., Rudenko L. Next-generation influenza vaccines based on mRNA technology. Lancet Infect. Dis. 2025; 25(1): 2–3. https://doi.org/10.1016/S1473-3099(24)00562-0
- Hodgson D., Sánchez-Ovando S., Carolan L., Liu Y., Hadiprodjo A.J., Fox A., et al. Quantifying the impact of pre-vaccination titre and vaccination history on influenza vaccine immunogenicity. Vaccine. 2025; 44: 126579. https://doi.org/10.1016/j.vaccine.2024.126579
- Gaitonde D.Y., Moore F.C., Morgan M.K. Influenza: diagnosis and treatment. Am. Fam. Physician. 2019; 100(12): 751–8.
- Li Y., Huo S., Yin Z., Tian Z., Huang F., Liu P., et al. The current state of research on influenza antiviral drug development: drugs in clinical trial and licensed drugs. mBio. 2023; 14(5): e0127323. https://doi.org/10.1128/mbio.01273-23
- Wang J., Li Y. Current advances in antiviral RNA interference in mammals. FEBS J. 2024; 291(2): 208–16. https://doi.org/10.1111/febs.16728
- Traber G.M., Yu A.M. RNAi-based therapeutics and novel RNA bioengineering technologies. J. Pharmacol. Exp. Ther. 2023; 384(1): 133–54. https://doi.org/10.1124/jpet.122.001234
- Qureshi A., Tantray V.G., Kirmani A.R., Ahangar A.G. A review on current status of antiviral siRNA. Rev. Med. Virol. 2018; 28(4): e1976. https://doi.org/10.1002/rmv.1976
- Chokwassanasakulkit T., Oti V.B., Idris A., McMillan N.A. SiRNAs as antiviral drugs – Current status, therapeutic potential and challenges. Antiviral. Res. 2024; 232: 106024. https://doi.org/10.1016/j.antiviral.2024.106024
- Wang L., Dai X., Song H., Yuan P., Yang Z., Dong W., et al. Inhibition of porcine transmissible gastroenteritis virus infection in porcine kidney cells using short hairpin RNAs targeting the membrane gene. Virus Genes. 2017; 53(2): 226–32. https://doi.org/10.1007/s11262-016-1409-8
- Lambeth L.S., Zhao Y., Smith L.P., Kgosana L., Nair V. Targeting Marek’s disease virus by RNA interference delivered from a herpesvirus vaccine. Vaccine. 2009; 27(2): 298–306. https://doi.org/10.1016/j.vaccine.2008.10.023
- Chen W., Liu M., Jiao Y., Yan W., Wei X., Chen J., et al. Adenovirus-mediated RNA interference against foot-and-mouth disease virus infection both in vitro and in vivo. J. Virol. 2006; 80(7): 3559–66. https://doi.org/10.1128/JVI.80.7.3559-3566.2006
- Keene K.M., Foy B.D., Sanchez-Vargas I., Beaty B.J., Blair C.D., Olson K.E. RNA interference acts as a natural antiviral response to O’nyong-nyong virus (Alphavirus; Togaviridae) infection of Anopheles gambiae. Proc. Natl. Acad. Sci. USA. 2004; 101(49): 17240–5. https://doi.org/10.1073/pnas.0406983101
- Ahmed F., Kleffmann T., Husain M. Acetylation, methylation and allysine modification profile of viral and host proteins during influenza A virus infection. Viruses. 2021; 13(7): 1415. https://doi.org/10.3390/v13071415
- Izumi H. Conformational variability prediction of influenza virus hemagglutinins with amino acid mutations using supersecondary structure code. Methods. Mol. Biol. 2025; 2870: 63–78. https://doi.org/10.1007/978-1-0716-4213-9_5
- Lesch M., Luckner M., Meyer M., Weege F., Gravenstein I., Raftery M., et al. RNAi-based small molecule repositioning reveals clinically approved urea-based kinase inhibitors as broadly active antivirals. PLoS Pathog. 2019; 15(3): e1007601. https://doi.org/101371/journal.ppat.1007601
- Li X., Berg N.K., Mills T., Zhang K., Eltzschig H.K., Yuan X. Adenosine at the interphase of hypoxia and inflammation in lung injury. Front. Immunol. 2021; 11: 604944. https://doi.org/10.3389/fimmu.2020.604944
- Read E.K., Digard P. Individual influenza A virus mRNAs show differential dependence on cellular NXF1/TAP for their nuclear export. J. Gen. Virol. 2010; 91(Pt. 5): 1290–301. https://doi.org/10.1099/vir.0.018564-0
- Ramakrishnan M.A. Determination of 50% endpoint titer using a simple formula. World J. Virol. 2016; 5(2): 85–6. https://doi.org/10.5501/wjv.v5.i2.85
- Пашков Е.А., Самойликов Р.В., Пряников Г.А., Быков А.С., Пашков Е.П., Поддубиков А.В. и др. Иммуномодулирующий эффект комплексов миРНК in vitro при гриппозной инфекции. Российский иммунологический журнал. 2023; 26(4): 457–62. https://doi.org/10.46235/1028-7221-13984-IVI httpss://elibrary.ru/byxobk
- Estrin M.A., Hussein I.T.M., Puryear W.B., Kuan A.C., Artim S.C., Runstadler J.A. Host-directed combinatorial RNAi improves inhibition of diverse strains of influenza A virus in human respiratory epithelial cells. PLoS One. 2018; 13(5): e0197246. https://doi.org/10.1371/journal.pone.0197246
- Файзулоев Е.Б. Изучение противовирусной активности антисмысловых РНК и рибозимов в отношении инфекции, вызываемой вирусом алеутской болезни норок: Автореф. диcс. ... канд. биол. наук. М.; 2002.
- Lee H.K., Loh T.P., Lee C.K., Tang J.W., Chiu L., Koay E.S. A universal influenza A and B duplex real-time RT-PCR assay. J. Med. Virol. 2012; 84(10): 1646–51. https://doi.org/10.1002/jmv.23375
- Bustin S.A., Benes V., Nolan T., Pfaffl M.W. Quantitative real-time RT-PCR – a perspective. J. Mol. Endocrinol. 2005; 34(3): 597–601. https://doi.org/10.1677/jme.1.01755
- Howard C.W., Zou G., Morrow S.A., Fridman S., Racosta J.M. Wilcoxon-Mann-Whitney odds ratio: A statistical measure for ordinal outcomes such as EDSS. Mult. Scler. Relat. Disord. 2022; 59: 103516. https://doi.org/10.1016/j.msard.2022.103516
- Ge Q., Filip L., Bai A., Nguyen T., Eisen H.N., Chen J. Inhibition of influenza virus production in virus-infected mice by RNA interference. Proc. Natl. Acad. Sci. USA. 2004; 101(23): 8676–81. https://doi.org/10.1073/pnas.0402486101
- Sui H.Y., Zhao G.Y., Huang J.D., Jin D.Y., Yuen K.Y., Zheng B.J. Small interfering RNA targeting M2 gene induces effective and long-term inhibition of influenza A virus replication. PLoS One. 2009; 4(5): 5671. https://doi.org/10.1371/journal.pone.0005671
- Piasecka J., Lenartowicz E., Soszynska-Jozwiak M., Szutkowska B., Kierzek R., Kierzek E. RNA secondary structure motifs of the influenza A virus as targets for siRNA-mediated RNA interference. Mol. Ther. Nucleic. Acids. 2020; 19: 627–42. https://doi.org/10.1016/j/omtn.2019.12.018
- Zhou Y., Liu Y., Gupta S., Paramo M.I., Hou Y., Mao C., et al. A comprehensive SARS-CoV-2-human protein-protein interactome reveals COVID-19 pathobiology and potential host therapeutic targets. Nat. Biotechnol. 2023; 41(1): 128–39. https://doi.org/10.1038/s41587-022-01474-0
- Hu J., Zhang L., Liu X. Role of post-translational modifications in influenza A virus life cycle and host innate immune response. Front. Microbiol. 2020; 11: 517461. https://doi.org/10.3389/fmicb.2020.517461
- Zhang K., Cagatay T., Xie D., Angelos A.E., Cornelius S., Aksenova V., et al. Cellular NS1-BP protein interacts with the mRNA export receptor NXF1 to mediate nuclear export of influenza virus M mRNAs. J. Biol. Chem. 2024; 300(11): 107871. https://doi.org/10.1016/j.jbc.2024.107871
- Esparza M., Bhat P., Fontoura B.M. Viral-host interactions during splicing and nuclear export of influenza virus mRNAs. Curr. Opin. Virol. 2022; 55: 101254. https://doi.org/10.1016/j.coviro.2022.101254
- Dawson A.R., Wilson G.M., Coon J.J., Mehle A. Post-Translation Regulation of Influenza Virus Replication. Annu. Rev. Virol. 2020; 7(1): 167–87. https://doi.org/10.1146/annurev-virology-010320-070410
- Husain M. Influenza A virus and acetylation: the picture is becoming clearer. Viruses. 2024; 16(1): 131. https://doi.org/10.3390/v16010131
- Mei M., Cupic A., Miorin L., Ye C., Cagatay T., Zhang K., et al. Inhibition of mRNA nuclear export promotes SARS-CoV-2 pathogenesis. Proc. Natl. Acad. Sci. USA. 2024; 121(22): e2314166121. https://doi.org/10.1073/pnas.2314166121
- Zhang K., Xie Y., Muñoz-Moreno R., Wang J., Zhang L., Esparza M., et al. Structural basis for influenza virus NS1 protein block of mRNA nuclear export. Nat. Microbiol. 2019; 4(10): 1671–9. https://doi.org/10.1038/s41564-019-0482-x
- Wendt L., Brandt J., Bodmer B.S., Reiche S., Schmidt M.L., Traeger S., et al. The Ebola virus nucleoprotein recruits the nuclear RNA export factor NXF1 into inclusion bodies to facilitate viral protein expression. Cells. 2020; 9(1): 187. https://doi.org/10.3390/cells9010187
- Chen J., Umunnakwe C., Sun D.Q., Nikolaitchik O.A., Pathak V.K., Berkhout B., et al. Impact of nuclear export pathway on cytoplasmic HIV-1 RNA transport mechanism and distribution. mBio. 2020; 11(6): e01578–20. https://doi.org/10.1128/mBio.01578-20
- Guo J., Zhu Y., Ma X., Shang G., Liu B., Zhang K. Virus infection and mRNA nuclear export. Int. J. Mol. Sci. 2023; 24(16): 12593. https://doi.org/10.3390/ijms241612593
- Пак А.В., Пашков Е.А., Абрамова Н.Д., Поддубиков А.В., Нагиева Ф.Г., Богданова Е.А. и др. Действие противовирусных миРНК на выработку цитокинов in vitro. Тонкие химические технологии. 2022; 17(5): 384–93. httpss://doi.org/10.32362/2410-6593-2022-17-5-384-393 httpss://elibrary.ru/meflst
- Banerjee A., Mukherjee S., Maji B.K. Manipulation of genes could inhibit SARS-CoV-2 infection that causes COVID-19 pandemics. Exp. Biol. Med. (Maywood). 2021; 246(14): 1643–9. https://doi.org/10.1177/15353702211008106
Дополнительные файлы