Суммарные антитела и нейтрализующая способность сывороток реконвалесцентов по отношению к трем разным штаммам SARS-CoV-2
- Авторы: Пальянова Н.В.1, Адаменко Л.С.1, Курская О.Г.1, Сароян Т.А.1, Соломатина М.В.1, Соболев И.А.1, Шестопалов А.М.1
-
Учреждения:
- ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
- Выпуск: Том 70, № 1 (2025)
- Страницы: 78-86
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16711
- DOI: https://doi.org/10.36233/0507-4088-290
- EDN: https://elibrary.ru/qcllgf
- ID: 16711
Цитировать
Аннотация
Цель исследования. Оценить уровень гуморального иммунитета реконвалесцентов против SARS-CoV-2.
Материалы и методы. В исследовании участвовали 259 человек в возрасте от 18 лет до 81 года, отобранных случайным образом в ФГБНУ «ФИЦ ФТМ» и в ФГБУН «Институт неорганической химии им. А.В. Николаева» СО РАН. У участников определяли количество антител методом иммуноферментного анализа. Титры нейтрализующих антител выявляли с помощью реакции микронейтрализации с использованием 3 штаммов SARS-CoV-2. NGS-секвенирование проводили с использованием платформы Illumina MiSeq, филогенетический анализ ‒ с помощью ресурса NextClade.
Результаты. Среднее количество антител у реконвалесцентов составило 133,42 ± 7,20 BAU/мл. Количество антител не зависело от пола и возраста пациентов, а также от времени, прошедшего после перенесенного COVID-19. Изучаемые штаммы SARS-CoV-2 были отсеквенированы и задепонированы в международную базу данных GISAID, проведен генетический анализ: EPI_ISL_19424272 филогенетически относится к кладе В1.1, EPI_ISL_19424271 относится к кладе B.1.1.397, EPI_ISL_19424270 относится к варианту Дельта B.1.617.2.122. Не было выявлено достоверных различий в нейтрализующей способности сывороток реконвалесцентов (переболевших за 2‒3 мес до исследования) для первых двух вариантов SARS-CoV-2 (циркулировавших на момент болезни участников исследования) и она была значительно снижена для варианта, относящегося к кладе Дельта, появившегося в новосибирском регионе позже (1/2 сывороток не показала нейтрализацию).
Выводы. Нейтрализующая способность сывороток реконвалесцентов имеет наибольшую активность в отношении тех вариантов вируса, которым переболел пациент, в то время как против нового варианта она оказывается сниженной или отсутствует. Циркуляция SARS-CoV-2 продолжается, и иммунитет, выработанный к первоначальным вариантам вируса, может оказаться недостаточно эффективным против вновь возникающих штаммов вследствие появления у вируса мутаций, позволяющих избегать выработанных ранее антител.
Ключевые слова
Полный текст
Введение
В декабре 2019 г. в Китае началась вспышка заболеваемости новой коронавирусной инфекцией (COVID-19), которая в марте 2020 г. была признана Всемирной организацией здравоохранения (ВОЗ) пандемией. В России заболеваемость начала расти с марта 2020 г., однако первая волна оказалась небольшой по сравнению с последующими волнами. К концу 2020 г. в Новосибирской области (население 2,8 млн человек), по официальным данным, переболело 27 885 человек1. Инфекция, вызванная вирусом SARS-CoV-2, может протекать скрыто (бессимптомное течение) [1] либо вызывать широкий спектр симптомов COVID-19: от лихорадки, астении или миалгии до пневмонии, в наиболее тяжелых случаях развивается острый респираторный дистресс-синдром [2]. Диагностика COVID-19 основана на выявлении РНК SARS-CoV-2 с использованием полимеразной цепной реакции в реальном времени (ОТ-ПЦР). В начале пандемии в Новосибирской области тестированию подвергались все пациенты с симптомами ОРВИ, путешественники и лица из групп риска [3], однако бессимптомное течение оставалось скрытым как для пациента, так и для официальной статистики. Одним из способов установить истинное количество перенесших новую коронавирусную инфекцию является выявление антител к SARS-CoV-2 методом иммуноферментного анализа (ИФА). К началу 2021 г. особенно актуальным стало измерение уровня специфических антител с целью принятия решения о вакцинации и контроля эффективности вакцин. Вакцинация на тот период еще только началась, и к концу декабря 2020 г. были вакцинированы всего 1280 жителей региона2.
Первоначально уровень защитных антител измеряли с помощью различных тест-систем от разных производителей и с разным уровнем надежности. Позже для количественных и качественных показателей были введены способы перерасчета в международных единицах BAU (binding antibody units) в соответствии со стандартами ВОЗ (WHO, NIBSC code 20/136). В настоящей работе использовали как качественный тест на антитела, так и количественный, рассчитанный в BAU/мл.
Наличие антител к SARS-CoV-2 само по себе еще не является основанием считать пациента или группу лиц защищенными от повторного заражения [4]. Необходимо убедиться в нейтрализующей способности этих антител и, как следствие, уровне защиты от инфицирования. Кроме того, уровень нейтрализации может оказаться различным для разных вариантов вируса.
Материалы и методы
Характеристика выборки
В исследовании участвовали 259 человек. Исследуемые были набраны случайным образом в ФГБНУ «ФИЦ ФТМ» и в ФГБУН «Институт неорганической химии им. А.В. Николаева» СО РАН. Все участники исследования были старше 18 лет и подписали информированные согласия на участие в проводимом исследовании. Проведение исследования было одобрено Комитетом по биомедицинской этике при ФИЦ ФТМ (протокол № 8 от 11.03.2020). Анкету участника согласились заполнить 77 человек. В анкету вошел вопрос о возрасте и дате выявления в мазках РНК SARS-CoV-2. К моменту начала исследования 63 респондента указали в анкете, что уже перенесли COVID-19 в разное время и 14 респондентов такую информацию не предоставили. К моменту окончания исследования никто из участников не был вакцинирован и не сообщал о повторном заболевании, однако нельзя утверждать, что в группе не было повторных заболеваний с бессимптомным течением, т.к. регулярного ПЦР-тестирования на наличие РНК SARS-CoV-2 не проводилось. Возраст респондентов, сообщивших свои данные, варьировал от 18 лет до 81 года с медианным значением 55 лет. Среди обследованных были 40% мужчин и 60% женщин.
Поскольку не все участники исследования сдавали кровь одинаковое количество раз, а также время от перенесенного COVID-19 до начала исследования отличалось, было сформировано несколько групп:
- группа лиц, которым проводили качественный анализ на антитела к SARS-CoV-2 (259 участника);
- группа лиц, которым проводили количественный анализ на антитела к SARS-CoV-2 (94 участника);
- группы лиц (7 групп), перенесших COVID-19 соответственно за 1, 2, 3, 4, 5, 6 и 7–9 мес до начала исследования (6, 23, 37, 38, 34, 17, 8 участников соответственно);
- группа динамического наблюдения за уровнем антител: перенесшие COVID-19 за 3 мес до начала исследования и сдавшие кровь 1 раз в месяц 4 мес подряд (8 участников);
- группа респондентов, указавших в анкете, что не болели COVID-19 (14 участников);
- группа нейтрализации: лица, у которых сыворотку крови проверяли не только на количество антител, но и на нейтрализующую способность по отношению к SARS-CoV-2 (30 участников).
Анализ сывороточных антител к SARS-CoV-2
Взятие крови осуществляли в условиях процедурного кабинета клиники ФГБНУ «ФИЦ ФТМ» 1 раз в месяц. Качественный анализ содержания антител к SARS-CoV-2 проводили ежемесячно с ноября 2020 г. по ноябрь 2021 г. с использованием наборов реагентов «SARS-CoV-2-IgG-ИФА-БЕСТ» («Вектор-Бест», Россия). Каждый участник мог сдать кровь один или несколько раз. Всего за указанный период было проанализировано 596 образцов от 259 человек.
Для образцов сывороток, отобранных в январе, феврале, марте и апреле 2021 г. и предварительно охарактеризованных как серопозитивные к SARS-CoV-2 при помощи качественного теста на суммарные антитела, было проведено количественное измерение общего сывороточного IgM и IgG к SARS-CoV-2 методом ИФА с использованием наборов реагентов «SARS-CoV-2-AT суммарные-ИФА-БЕСТ» («Вектор-Бест», Россия): всего 209 образцов от 94 человек.
Несмотря на появление международного стандарта, разные производители тест-систем указывают разные пороговые значения для определения положительного, отрицательного или сомнительного результата анализа. Так, в работе [5] образцы с уровнем менее 25,6 BAU/мл были отнесены к отрицательным, от 25,7 до 35,1 считались пограничными, с уровнем более 35,2 BAU/мл считались положительными, в то время как в тест-системе «Вектор-Бест» производитель рекомендует руководствоваться следующей градацией.
Градация для тест-системы «Вектор-Бест» (по данным производителя):
- от 0 до 10 ВАU/мл ‒ результат отрицательный, антитела отсутствуют;
- 11‒79 BAU/мл ‒ вируснейтрализующий эффект низкий (принятие решения о вакцинации);
- 80‒149,9 BAU/мл ‒ вируснейтрализующий эффект действует только в 50% случаев (контроль в динамике);
- более 150 BAU/мл ‒ вируснейтрализующая активность ярко выражена в 100% случаев (достаточный уровень для защиты, вакцинация не требуется);
- 500 и выше ‒ выработан максимальный уровень антител (вакцинация не требуется)
В настоящей работе ориентировались на градацию производителя набора «Вектор-Бест».
Получение и характеристики штаммов SARS-CoV-2 для нейтрализации
Были получены (изолированы) 3 разных штамма SARS-CoV-2 для нейтрализации сыворотками реконвалесцентов (табл. 1). Выбор вариантов соответствовал 3 первым волнам пандемии в Новосибирской области. Для данных штаммов SARS-CoV-2 было проведено секвенирование полных геномов и с помощью NextClade установлена их принадлежность к филогенетическим кладам3. Секвенирование было выполнено с использованием платформы Illumina MiSeq и соответствующих наборов реагентов (Illumina, США). Предварительно для последующего секвенирования была выполнена обратная транскрипция и амплификация геномов. При подготовке геномных библиотек для секвенирования SARS-CoV-2 использовали сет праймеров ARTIC v34. Сборку полногеномных нуклеотидных последовательностей осуществляли с помощью программного обеспечения bowtie. Сиквенсы SARS-CoV-2 депонировали в международную базу данных GISAID с именами (идентификаторами) EPI_ISL_19424270, EPI_ISL_19424271, EPI_ISL_19424272.
Таблица 1. Штаммы SARS-CoV-2, использованные для проверки нейтрализующей способности сывороток
Table 1. SARS-CoV-2 strains used to test the neutralizing ability of sera
Название Name | EPI_ISL_19424272 | EPI_ISL_19424271 | EPI_ISL_19424270 |
Клада Clade | B.1.1 | B.1.1.397 | B.1.617.2.122 |
Референсный вариант Reference variant | Ухань Wuhan | Ухань Wuhan | Дельта Delta |
Циркулировал в СФО Circulated in the Siberian Federal District | С начала пандемии до мая 2021 г. From the beginning of the pandemic until May 2021 | Январь 2021 г. – май 2021 г. January 2021 – May 2021 | Июнь 2021 г. – январь 2022 г. June 2021 – January 2022 |
Условное обозначение в статье Conventional designation in the article | Ухань 1 Wuhan 1 | Ухань 2 Wuhan 2 | Дельта Delta |
В предыдущей работе мы установили, какие варианты SARS-CoV-2 были распространены в Сибирском федеральном округе (СФО) в разные периоды пандемии [6], что позволило определить периоды циркуляции в Новосибирской области вариантов, генетически схожих со штаммами, полученным в настоящей работе (табл. 1).
Поскольку варианты вируса, относящиеся к кладе Дельта, появились в Новосибирской области только летом 2021 г., контактов пациентов с ними на момент сбора сывороток не было.
Нейтрализующая способность сывороток против трех вариантов SARS-CoV-2
Для анализа нейтрализующей способности были выбраны случайным образом 29 пациентов, имеющих антитела к SARS-CoV-2, и один участник, не болевший и не имеющий антител. У всех пациентов анализировали сыворотку, полученную в январе, феврале или марте.
Исследование сывороток крови в реакции нейтрализации (РН) проводили микрометодом в культуре клеток Vеrо, выращенной на 96-луночных планшетах фирмы TPP (Швейцария). Реакцию нейтрализации ставили с постоянной для каждого штамма дозой препарата ‒ 100 ТЦД50/мл. Сыворотки крови пациентов предварительно прогревали на водяной бане при температуре 56 °С в течение 30 мин, затем готовили 8 последовательных двукратных разведений, начиная с сыворотки без разведения. Для разведения сывороток использовали ФСБ (фосфатно-солевой буфер). В работе была приготовлена смесь разведений сыворотки и рабочего разведения вируса в равных объемах. Смесь инкубировали 1 ч при комнатной температуре, затем добавляли в лунки 96-луночного планшета с монослоем культуры клеток Vero и инкубировали в течение 4 сут при температуре 37 °C, 5% CO2. Результаты титрования учитывали визуально путем микроскопического исследования клеточного монослоя на наличие цитопатического действия (ЦПД) на 4-е сутки после заражения. Титром сыворотки считали обратное значение ее последнего разведения, в котором признаков ЦПД не регистрировали. В РН были поставлены следующие контроли: контроль клеток (КК) ‒ лунки, не инфицированные вирусом; отрицательный контроль сыворотки (К−) ‒ сыворотка в разведении 1/10; контроль вируса (КВ) ‒ лунки, инфицированные вирусом в двукратном разведении; контроль рабочей концентрации вируса ‒ готовили два последовательных 10-кратных разведения рабочей концентрации вируса (кв/10, кв/100). Значения контрольных показателей учитывали следующим образом: КК ‒ неповрежденный клеточный монослой, К−, КВ и кв/10 ‒ полная дегенерация клеточного монослоя, кв/100 ‒ ½ инфицированных лунок имеет признаки ЦПД.
Статистический анализ
Статистический анализ выполняли с помощью программного обеспечения Statistica 10.0. Достоверность различий между группами оценивали с использованием критерия χ2 и t-критерия Стьюдента. Доверительные интервалы для относительных величин рассчитывали при помощи онлайн-калькулятора EPITOOLS5.
Результаты
Качественный анализ на антитела к SARS-CoV-2
За ноябрь и декабрь 2020 г. было протестировано 69 образцов, из них 32 оказались положительными (33,3%; ДИ 95% 24,7–43,2%). За 10 мес 2021 г. было протестировано 537 образцов сыворотки, из них 434 оказались положительными (80,8%; ДИ 95% 77,3–83,9%). В течение всего периода наблюдения за 259 участниками исследования у 195 были выявлены антитела к SARS-CoV-2 (75,3%; ДИ 95% 69,7–80,2%).
Количественный анализ на антитела к SARS-CoV-2
В течение 4 мес (январь, февраль, март и апрель 2021 г.) для сывороток, предварительно показавших наличие антител при качественном анализе (всего 209 образцов от 94 человек), был проведен количественный анализ антител к SARS-CoV-2. Среди всех исследованных образцов крови минимальное количество суммарных антител к SARS-CoV-2 составляло 14 BAU/мл, максимальное ‒ 190 BAU/мл, среднее ‒ 133,42 ± 7,2 BAU/мл, медиана ‒ 157,5 BAU/мл. Поскольку от момента заболевания до начала исследования для каждого пациента прошло разное количество времени, участников, имеющих сходное время от перенесенного заболевания, объединили в 7 групп: 1, 2 3, 4, 5, 6, 7‒9 мес от заболевания. Число пациентов в каждой группе составляло: 6, 23, 37, 38, 34, 17, 8 человек соответственно (рис. 1).
Рис. 1. Динамика количества антител.
Среднее количество суммарных антител через 1, 2, 3, 4, 5, 6, 7–9 мес после перенесенного COVID-19, количественный метод, BAU/мл (N = 6, 23, 37, 38, 34, 17, 8).
Fig. 1. Dynamics of the number of antibodies.
Average number of total antibodies 1, 2, 3, 4, 5, 6, 7–9 months after COVID-19, quantitative method, BAU/мл (N = 6, 23, 37, 38, 34, 17, 8).
Количество антител не зависело от пола и возраста пациентов, а также от времени, прошедшего после перенесенного COVID-19 (рис. 1). Разброс значений в 1-й группе оказался достаточно большим, а число участников ‒ малым, получить уровень достоверности отличий этой группы от остальных не представлялось возможным. В среднем уровень антител сохранялся не менее 6 мес.
Не болевшие COVID-19 участники исследования
В группу контроля должны были войти не болевшие COVID-19 участники исследования. При измерении уровня антител в этой группе выяснилось, что только один человек из 14, отметивших, что не болели COVID-19, на самом деле не имел антител к SARS-CoV-2. Остальные имели положительный результат как при качественном, так и при количественном анализе, если руководствоваться таблицей производителя тест-системы (более 11 BAU/мл). Возможно, эти лица перенесли заболевание бессимптомно. Интересно, что, несмотря на бессимптомное течение, мы не можем утверждать, что у этой когорты иммунный ответ был менее выраженным, чем у переболевших с симптомами. Разброс уровня антител в этой группе был достаточно большим (рис. 2). Некоторые участники этой группы сдавали кровь несколько раз, что позволило рассчитать среднее количество антител за 4 мес наблюдения. Для остальных показан результат одного измерения.
Рис. 2. Уровень суммарный IgM и IgG к SARS-CoV-2 у 14 участников исследования, не болевших COVID-19 (по данным анкетирования), BAU/мл.
При возможности (более 3 измерений уровня антител) были рассчитаны средние значения и погрешности измерений. Участник № 1 имел отрицательный результат, у остальных участников исследования ‒ положительный результат.
Fig. 2. The level of total IgM and IgG antibodies to SARS-CoV-2 in 14 study participants who did not have COVID-19 (according to the questionnaire), BAU/mL.
Mean values and measurement errors were calculated when possible (more than three antibody concentration measurements). Participant No. 1 had a negative result, the rest of the study participants had a positive result.
Динамическое наблюдение за уровнем антител в течение 4 мес
Отследить динамику уровня антител за 4 мес удалось у 8 участников. Для корректного сравнения динамику наблюдали у самой многочисленной группы – переболевших за 3 мес до начала исследования и сдававших кровь каждый месяц на протяжении 4 мес. В этой группе наблюдалось три сценария: постепенное падение уровня антител, нарастание уровня антител и волнообразное поведение уровня антител. Разница между минимальным и максимальным уровнями антител в среднем достигала 28 ± 7,7 BOE/мл (рис. 3). Различие сценариев объясняется различной ситуацией, в которой могли находиться участники исследования. Так, падение уровня антител – естественный процесс, хотя и не слишком заметный на таком коротком промежутке времени. При повторном инфицировании происходит подъем количества антител, даже при бессимптомном протекании инфекции.
Рис. 3. Изменение количества антител в течение 4 мес.
Динамическое наблюдение за уровнем антител в течение 4 мес в группе лиц, переболевших COVID-19 за 3 мес до начала исследования, BAU/мл.
Fig. 3. Change in the concentration of antibodies over 4 months.
Dynamic changes in antibody levels within 4 months in the group that had COVID-19 3 months before the start of the study, BAU/mL.
Анализ динамики уровня антител для участников, которым проводили забор крови не менее 2 раз, выявил закономерность: уровень антител у одного человека хотя и мог колебаться, но оставался относительно стабильным (стандартное отклонение 16,6 ± 3,5) на протяжении исследования. По-видимому, уровень антител является для каждого человека индивидуальным и меняется в небольших пределах при отсутствии дополнительного влияния (вакцинация, заболевание).
Нейтрализующая активность антител
Для нейтрализации были выбраны 3 штамма вируса и протестированы на сыворотках крови, отобранных в январе, феврале и марте 2021 г. При сопоставлении времени циркуляции на территории СФО [6] и времени отбора сывороток крови выяснилось, что образцы, отобранные в начале 2021 г., были получены от лиц, которые могли иметь контакт с первыми двумя вариантами вируса, но не с третьим.
Все 30 сывороток крови были протестированы против 3 штаммов SARS-CoV-2. Для участника, не имевшего антител к SARS-CoV-2, нейтрализующей способности у сыворотки также не обнаружили ни для одного штамма (табл. 2).
Таблица 2. Нейтрализующая способность сывороток и количество антител к SARS-CoV-2 у 30 участников исследования
Table 2. Neutralizing ability of sera and the concentration of antibodies to SARS-CoV-2 in 30 study participants
№ | Месяцев от болезни Months from illness | Возраст Age | Январь January 2021 | Февраль February 2021 | Март March 2021 | Апрель April 2021 | Ухань 1 Wuhan 1 | Ухань 2 Wuhan 2 | Дельта Delta |
1 | 0 | 37 | 164,3 | 164,3 | 185,9 | 157,5 | 1 : 32 | 1 : 16 | 1 : 16 |
2 | 1 | 49 | 160,6 | 181,9 | 181,9 | 161 | 1 : 2 | 1 : 64 | 0 |
3 | 1 | 58 | ‒ | ‒ | 185,9 | 157,5 | 1 : 4 | 1 : 16 | 1 : 2 |
4 | 2 | 29 | 25,6 | 18,3 | ‒ | 21 | 1 : 8 | 1 : 4 | 1 : 8 |
5 | 2 | 41 | 171,6 | 167,9 | 190 | 164,5 | 1 : 4 | 1 : 32 | 0 |
6 | 2 | 25 | ‒ | 24,3 | 24,25 | ‒ | 1 : 4 | 1 : 8 | 0 |
7 | 2 | 80 | 167,9 | 185,9 | 190 | 161 | 1 : 64 | 1 : 32 | 0 |
8 | 2 | 47 | 43,8 | 36 | 32,3 | 21 | 1 : 4 | 1 : 4 | 1 : 2 |
9 | 2 | 68 | ‒ | 181,9 | 177,8 | 154 | 1 : 8 | 1 : 32 | 0 |
10 | 2 | 54 | 25,6 | ‒ | 20,2 | 21 | 1 : 4 | 1 : 8 | 0 |
11 | 2 | 64 | 171,6 | 185,9 | 185,9 | 157,5 | 1 : 128 | 1 : 128 | 1 : 64 |
12 | 3 | 64 | 175,2 | 185,9 | 185,9 | ‒ | 1 : 64 | 1 : 128 | 1 : 64 |
13 | 3 | 57 | 146 | 137,4 | 137,4 | 125 | 1 : 32 | 1 : 8 | 1 : 4 |
14 | 3 | 67 | 157 | 157 | 165,7 | 148,2 | 1 : 64 | 1 : 8 | 0 |
15 | 3 | 32 | 105,9 | 93 | 93 | ‒ | 1 : 32 | 0 | 0 |
16 | 3 | 49 | 69,4 | 55 | 44,5 | 35 | 1 : 32 | 1 : 8 | 0 |
17 | 3 | 35 | 157 | 157 | 170 | ‒ | 1 : 32 | 1 : 8 | 1 : 4 |
18 | 3 | 64 | 146 | 113,2 | 93 | 108,5 | 1 : 8 | 1 : 16 | 0 |
19 | 3 | 78 | 164,3 | 165,7 | 157,6 | 154 | 1 : 32 | 1 : 1,1 | 0 |
20 | 3 | 71 | 171,6 | 167,9 | 173,8 | 150,5 | 1 : 16 | 1 : 32 | 0 |
21 | 3 | 50 | ‒ | ‒ | 84,9 | ‒ | 1 : 16 | 1 : 8 | 1 : 8 |
22 | 3 | 59 | ‒ | 167,9 | 181,9 | 157,5 | ‒ | 1 : 32 | 0 |
23 | 3 | 63 | 167,9 | 173,8 | 157,6 | ‒ | 1 : 8 | 1 : 16 | 1 : 4 |
24 | 3 | 62 | 171,6 | 181,9 | 190 | ‒ | 1 : 64 | 1 : 128 | 1 : 64 |
25 | 3 | 66 | 164,3 | 160,6 | 177,8 | 154 | 1 : 16 | 1 : 32 | 1 : 16 |
26 | 3 | 65 | 167,9 | 160,6 | ‒ | 157,5 | 1 : 32 | 0 | 1 : 16 |
27 | 3 | 66 | 160,6 | 164,4 | 173,8 | 150,5 | 1 : 8 | 1 : 32 | 0 |
28 | Не болел Hadn’t COVID-19 | 36 | 0,0 | 4,0 | 4,0 | 0,0 | 0 | 0 | 0 |
29 | Нет данных No data | 57 | ‒ | ‒ | 121,25 | ‒ | 1 : 2 | 1 : 2 | 0 |
30 | Нет данных No data | 31 | 105,9 | 84,9 | 72,8 | 73,5 | 1 : 16 | 1 : 4 | 1 : 8 |
Примечание. «–» – отсутствуют данные; «0» – отсутствует нейтрализация.
Note. «–» – no data; «0» – no neutralization.
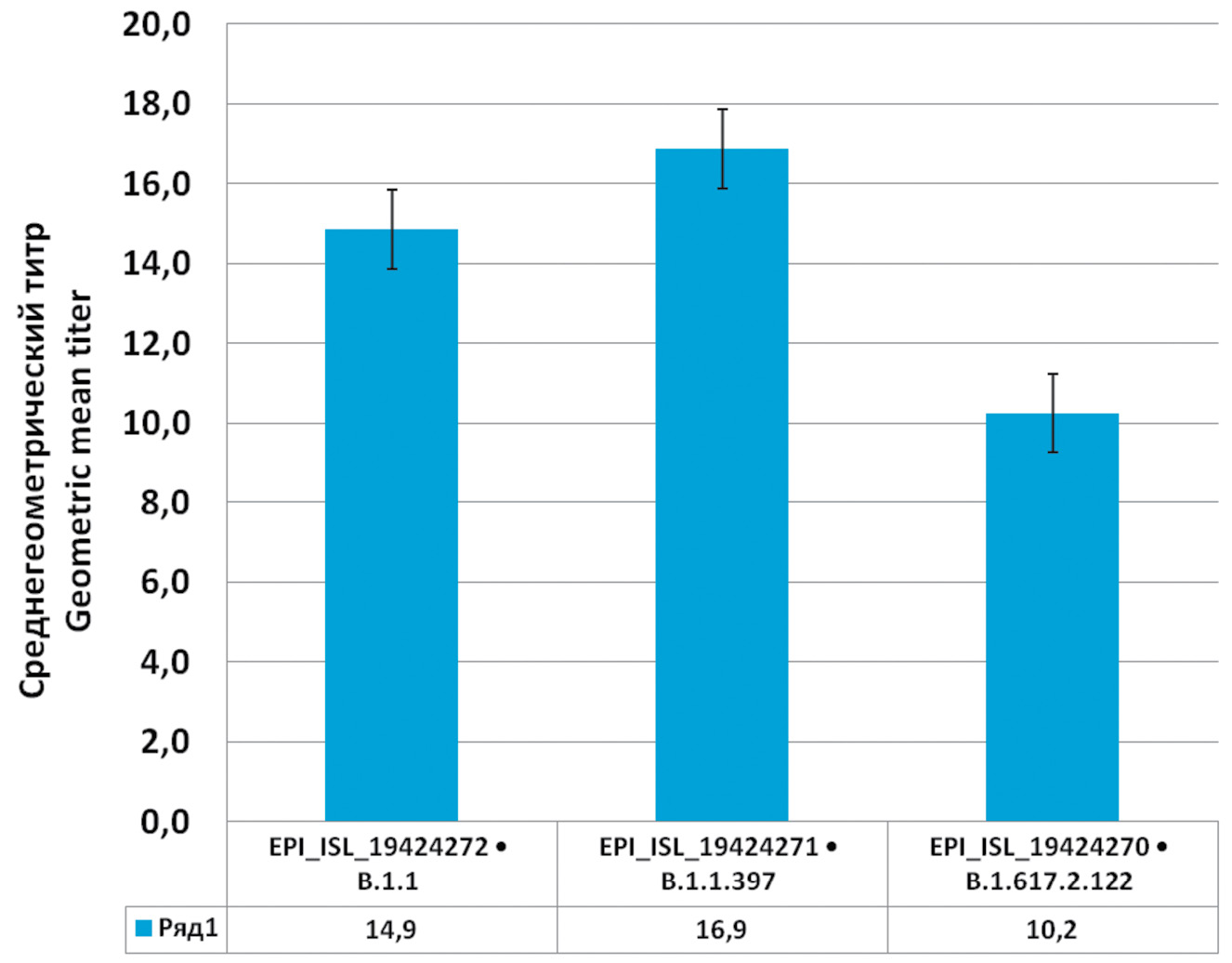
Против штамма EPI_ISL_19424272 (Ухань 1) не показала нейтрализацию одна сыворотка из 29 серопозитивных, против EPI_ISL_19424271 (Ухань 2) – 3 сыворотки, против EPI_ISL_19424270 (Дельта) – ½ сывороток не показала нейтрализацию. Для остальных был рассчитан среднегеометрический титр (рис. 4).
Рис. 4. Нейтрализующая способность сывороток реконвалесцентов против 3 штаммов SARS-CoV-2: EPI_ISL_19424272 (Ухань 1), EPI_ISL_19424271 (Ухань 2) и EPI_ISL_19424270 (Дельта).
Fig. 4. Neutralizing ability of convalescent serum against three strains of SARS-CoV-2: EPI_ISL_19424272 (Wuhan 1), EPI_ISL_19424271 (Wuhan 2) и EPI_ISL_19424270 (Delta).
Как мы видим, нейтрализующая способность сывороток реконвалесцентов имеет наибольшую активность в отношении тех вариантов вируса, которыми переболел пациент, в то время как против нового варианта она оказывается сниженной или отсутствует вовсе. Также выяснилось, что уровень нейтрализации не зависит от количества антител и от того, переболел человек с симптомами или без. Группа пациентов, сыворотки которых не показали нейтрализацию, не отличалась от остальных участников исследования. Количество антител к SARS-CoV-2, тяжесть течения болезни и время, прошедшее после болезни, не влияли на уровень нейтрализации. Таким образом, количество антител не может служить надежным критерием защищенности человека от заболевания, т.к. эти антитела могли быть выработаны против более раннего варианта вируса.
Обсуждение
Механизмы развития иммунной реакции на SARS-CoV-2 еще до конца не изучены. Неясно, формируется или нет у переболевших стойкий иммунитет. Принятие решение о вакцинации должно основываться не только на данных об эпидемиологической ситуации, но и на состоянии иммунитета прививающегося [7]. В настоящей работе изучали антительный компонент гуморального иммунитета реконвалесцентов. Полученные результаты согласуются с данными работы [5], где средний уровень антител составил 129,67 BAU/мл на 3-м месяце после инфицирования SARS-CoV-2. Мы также рассмотрели динамику изменения количества антител в течение 4 мес после перенесенного 3 мес назад COVID-19 и обнаружили, что хотя уровень антител значительно различается между пациентами, изменения для каждого пациента варьируются не так сильно. У большого числа пациентов, инфицированных SARS-CoV-2, симптомы отсутствовали [1, 8], что не позволяет достаточно полно оценить заболеваемость и возможности распространения этой инфекции. Мы не обнаружили корреляции между бессимптомным течением заболевания и уровнем антител. Работы по нейтрализующей способности сывороток достаточно редки, т.к. необходимо использовать живой вирус. В основном в исследованиях представлены данные по формированию поствакцинального иммунитета [9]. В нашем случае все участники исследования не были вакцинированы, а варианты вируса были подобраны так, чтобы была возможность сравнить нейтрализацию циркулировавшего на момент сбора сывороток варианта и варианта Дельта, с которым участники исследования не встречались. Поскольку корреляции между количеством антител и титром нейтрализации обнаружено не было, не представляется возможным говорить о защитном гуморальном иммунитете, опираясь только на данные о количестве антител.
Заключение
При постоянно видоизменяющихся вариантах вируса SARS-CoV-2, информации о количестве заболевших и об уровне антител у пациента может оказаться недостаточно для принятия решения о вакцинации, т.к. новые варианты вируса могут эффективно избегать выработанного ранее иммунитета. Кроме того, иммунитет, выработанный против ранних вакцинных штаммов, может оказаться недостаточным для защиты от последующих вариантов SARS-CoV-2, как это уже происходит с вирусом гриппа.
1 Yandex DataLens. Коронавирус: дашборд. Доступно по адресу: https://datalens.yandex/7o7is1q6ikh23?tab=X1&state=512ef5d71481
2 Правительство Новосибирской области. Вакцинация против коронавируса продолжается в Новосибирской области. Доступно по адресу: https://www.nso.ru/news/44654
3 Nextclade. Доступно по адресу: https://clades.nextstrain.org/
4 hCoV-2019/nCoV-2019 Version 3 Amplicon Set. Доступно по адресу: https://artic.network/resources/ncov/ncov-amplicon-v3.pdf
5 Epitools – Calculate confidence limits for a sample proportion. Доступно по адресу: https://epitools.ausvet.com.au/ciproportion
Об авторах
Наталья Валерьевна Пальянова
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Автор, ответственный за переписку.
Email: natalia.palyanova@gmail.com
ORCID iD: 0000-0002-1783-5798
SPIN-код: 4975-4485
Scopus Author ID: 55983936800
ResearcherId: KAM-6786-2024
младший научный сотрудник
Россия, 630117, г. НовосибирскЛюбовь Сергеевна Адаменко
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: aminisib@yandex.ru
ORCID iD: 0000-0001-6412-3622
младший научный сотрудник
Россия, 630117, г. НовосибирскОльга Григорьевна Курская
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: kurskaya_og@mail.ru
ORCID iD: 0000-0002-1931-2026
канд. мед. наук, руководитель лаборатории респираторных вирусных инфекций, старший научный сотрудник
Россия, 630117, г. НовосибирскТереза Араевна Сароян
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: 111.st.13@rambler.ru
ORCID iD: 0000-0001-8071-5425
младший научный сотрудник
Россия, 630117, г. НовосибирскМария Владимировна Соломатина
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: solomatina.mariyav@yandex.com
ORCID iD: 0000-0003-0736-0271
канд. биол. наук, старший научный сотрудник
Россия, 630117, г. НовосибирскИван Андреевич Соболев
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: sobolev.riov@yandex.ru
ORCID iD: 0000-0002-4561-6517
канд. биол. наук, старший научный сотрудник, заведующий лабораторией геномики и эволюции вирусов
Россия, 630117, г. НовосибирскАлександр Михайлович Шестопалов
ФГБНУ «Федеральный исследовательский центр фундаментальной и трансляционной медицины»
Email: shestopalov2@mail.ru
ORCID iD: 0000-0002-9734-0620
-р биол. наук, профессор, заслуженный деятель науки РФ, директор НИИ Вирусологии ФГБНУ «ФИЦ ФТМ»
Россия, 630117, г. НовосибирскСписок литературы
- Балахонов С.В., Дубровина В.И., Чеснокова М.В., Войткова В.В., Пятидесятникова А.Б., Брюхова Д.Д. и др. Изучение гуморального иммунного ответа при лёгкой и бессимптомной формах проявления COVID-19. Acta Biomedica Scientifica. 2020; 5(5): 26–30. https://doi.org/10.29413/ABS.2020-5.5.3 https://elibrary.ru/mvlnmh
- Machhi J., Herskovitz J., Senan A.M., Dutta D., Nath B., Oleynikov M.D., et al. The natural history, pathobiology, and clinical manifestations of SARS-CoV-2 infections. J. Neuroimmune Pharmacol. 2020; 15(3): 359–86. https://doi.org/10.1007/s11481-020-09944-5
- Palyanova N., Sobolev I., Alekseev A., Glushenko A., Kazachkova E., Markhaev A., et al. Genomic and epidemiological features of COVID-19 in the Novosibirsk region during the beginning of the pandemic. Viruses. 2022; 14(9): 2036. https://doi.org/10.3390/v14092036
- Новикова Е.А., Петрова А.Г., Москалева Е.В., Ваняркина А.С., Рычкова Л.В. Ретроспектива международных серологических исследований по формированию и динамике гуморального иммунного ответа к SARS-CoV-2: от 2020 к 2021. Acta Biomedica Scientifica. 2021; 6(2): 47–57. https://doi.org/10.29413/ABS.2021-6.2.5 https://elibrary.ru/sbnnav
- Oktay Gültekin E., Gültekin O., Coskun A., Aksak T. Antibody response three months after SARS-CoV-2 infection. J. Med. Virol. 2022; 94(10): 4712–8. https://doi.org/10.1002/jmv.27909
- Palyanova N.V., Sobolev I.A., Palyanov A.Y., Kurskaya O.G., Komissarov A.B., Danilenko D.M. et al. The development of the SARS-CoV-2 epidemic in different regions of Siberia in the 2020–2022 Period. Viruses. 2023; 15(10): 2014. https://doi.org/10.3390/v15102014
- Tukhvatulin A.I., Dolzhikova I.V., Shcheblyakov D.V., Zubkova O.V., Dzharullaeva A.S., Kovyrshina A.V., et al. An open, non-randomised, phase 1/2 trial on the safety, tolerability, and immunogenicity of single-dose vaccine “Sputnik Light” for prevention of coronavirus infection in healthy adults. Lancet Reg. Health Eur. 2021; 11: 100241. https://doi.org/10.1016/j.lanepe.2021.100241
- Евсеева Г.П., Лазарева М.А., Власова М.А., Наговицына Е.Б., Супрун С.В., Телепнёва Р.С. и др. Оценка уровня иммунной прослойки к SARS-CoV-2 у детей в условиях новой коронавирусной инфекции COVID-19. Бюллетень физиологии и патологии дыхания. 2023; (88): 59–68. https://doi.org/10.36604/1998-5029-2023-88-59-68 https://elibrary.ru/lhyxot
- Wang K., Long Q.X., Deng H.J., Hu J., Gao Q.Z., Zhang G.J., et al. Longitudinal dynamics of the neutralizing antibody response to SARS-CoV-2 infection. Clin. Infect. Dis. 2021; 73(3): e531–9. https://doi.org/10.1093/cid/ciaa1143
Дополнительные файлы