Оценка возможности определения количественного содержания гемагглютинина в готовой лекарственной форме инактивированных вакцин для профилактики гриппа, содержащих адъювант
- Авторы: Бутырский А.Ю.1, Морозова Е.Н.1, Саркисян К.А.1
-
Учреждения:
- ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России
- Выпуск: Том 70, № 1 (2025)
- Страницы: 57-65
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16708
- DOI: https://doi.org/10.36233/0507-4088-286
- EDN: https://elibrary.ru/itvlmz
- ID: 16708
Цитировать
Аннотация
Введение. Основным показателем качества, обеспечивающим эффективность вакцин для профилактики гриппа, является специфическая активность. Определение показателя в гриппозной вакцине, содержащей адъювант Совидон, проводят в полуфабрикате – тривакцине до добавления адъюванта. Настоящий подход имеет ряд недостатков. Важное значение для выпуска в гражданский оборот лекарственного препарата, соответствующего требованиям нормативной документации, имеет оценка статистической управляемости производственного процесса по результатам контроля показателя «специфическая активность».
Цель работы – оценка сопоставимости результатов количественного определения гемагглютинина в полуфабрикате вакцины для профилактики гриппа и в готовой лекарственной форме; анализ результатов контроля показателя качества «специфическая активность» для оценки статистической управляемости производственного процесса.
Материалы и методы. Для исследования методом одиночной радиальной иммунодиффузии использовали полуфабрикат вакцины для профилактики гриппа (тривакцина до добавления адъюванта Совидон) и соответствующие серии готовой лекарственной формы. Расчет содержания гемагглютинина проводили при помощи программного обеспечения SIAMS Photolab. Для построения контрольных карт Шухарта (Х-карты) в программе Microsoft Excel применяли паспортные данные предприятия – производителя лекарственного препарата.
Результаты. Статистический анализ показал, что результаты количественного определения гемагглютинина в полуфабрикате вакцины и готовой форме лекарственного препарата достоверно не отличаются (при уровне значимости р < 0,05). Анализ контрольных карт Шухарта показал наличие критериев, свидетельствующих о тенденциях к выходу производственного процесса из состояния статистической управляемости.
Заключение. Показана принципиальная возможность и обоснована целесообразность определения количественного содержания гемагглютинина в готовой лекарственной форме вакцины, содержащей адъювант Совидон. Выявленные тренды при анализе контрольных карт Шухарта являются основанием для установления причины выхода производственного процесса из состояния статистической управляемости и анализа рисков выпуска в гражданский оборот серий вакцины, не соответствующих установленным требованиям.
Полный текст
Введение
Грипп до настоящего времени остается инфекционным заболеванием, представляющим особую значимость для практического здравоохранения. По данным Роспотребнадзора, заболеваемость гриппом за период 2017–2021 гг. варьировала в диапазоне от 14,96 (2021 г.) до 37,31 (2019 г.) случая на 100 тыс. населения, а в последние 2 года регистрировался резкий ее подъем: 60,8 и 166,94 случая на 100 тыс. населения в 2022–2023 гг. соответственно [1]. Экономический ущерб в Российской Федерации в 2023 г. от гриппа составил 9 813 451,4 тыс. рублей1. В первую очередь эпидемиологическая и социальная значимость гриппа определяется высокой контагиозностью инфекции, широкой восприимчивостью населения к возбудителю инфекции, значительной частотой осложнений у пациентов из самых уязвимых слоев (дети в возрасте до 14 лет, пациенты старше 65 лет, беременные женщины, пациенты с легочными и сердечно-сосудистыми хроническими заболеваниями). В этой связи важнейшим мероприятием, показавшим высокую эффективность для управления гриппозной инфекцией, является ежегодная всероссийская прививочная кампания против гриппа. Установлено, что вакцинация в случае совпадения вакцинных и циркулирующих штаммов вируса гриппа на 90% снижает заболеваемость гриппом, на 56% – других ОРВИ, на 48% – число госпитализаций, связанных с осложнениями после перенесенного заболевания [2]. С учетом рекомендаций Всемирной организации здравоохранения охват прививками против гриппа в группах риска должен быть не менее 75%; охват прививками против гриппа населения в целом по стране и по субъектам Российской Федерации в отдельности – не менее 45%2. За последние 5 лет количество привитых ежегодно колебалось в пределах 69 122 430–85 898 810 (абс. значения). Обращает на себя внимание подъем заболеваемости в последние 2 года, несмотря на то что охват населения прививками не снижался по сравнению с 2021 г., когда регистрировался минимальный уровень заболеваемости за десятилетие. В этих условиях пристального внимания требует выпуск в гражданский оборот гриппозных вакцин, соответствующих всем показателям качества. Основным показателем качества, обеспечивающим профилактическую эффективность гриппозных вакцин, является специфическая активность. Данный показатель характеризуется количественным содержанием гемагглютининов подтипов и типов вируса гриппа, актуальных на текущий эпидемический сезон и входящих в состав вакцины. Помимо общепринятой классификации гриппозных вакцин, в зависимости от типа производства (цельновирионные, расщепленные, субъединичные вакцины) отечественные вакцины можно классифицировать по составу вспомогательных веществ: содержащие адъювант и не содержащие адъювант.
В состав адъювантных вакцин для профилактики гриппа, зарегистрированных на сегодняшний день в Российской Федерации, входит один из двух возможных адъювантов: азоксимера бромид или Совидон.
В соответствии с требованиями Государственной фармакопеи Российской Федерации3, для контроля показателя качества «специфическая активность» вакцин для профилактики гриппа используется метод одиночной радиальной иммунодиффузии (ОРИД), предложенный J.M. Wood и соавт. и внедренный в 1978 г. в рутинную практику контроля вакцин [3, 4]. Важным условием, обеспечивающим правильность получения достоверных результатов испытания, является образование на пластине колец преципитации в лунках с испытуемым образцом, сопоставимых по характеристикам (четкость границ, диаметр колец) с кольцами преципитации в лунках со стандартным образцом. В зависимости от состава гриппозной вакцины адъювант, входящий в ее состав, может изменять вид колец преципитации, что в свою очередь может влиять на правильность измерения диаметра зон преципитации. Например, при определении количества гемагглютинина в готовой вакцине, содержащей адъювант азоксимера бромид, образуемые кольца преципитации характеризуются размытым контуром, сливающимся с внутренним фоном, что не позволяет корректно установить границы считывания и получить достоверные результаты испытания. Следует отметить, что производителем показана возможность контроля показателя в готовом препарате, однако предложенный метод предусматривает особые условия отмывки пластин с агарозой и увеличивает время испытания на несколько суток.
В 2012 г. была зарегистрирована отечественная вакцина для профилактики гриппа, содержащая адъювант Совидон [5]. В соответствии с действующей нормативной документацией на препарат выпускающий контроль качества по показателю «специфическая активность» проводят на образцах полуфабриката (субъединичной тривакцины до добавления адъюванта). Существенным недостатком использования полуфабриката в качестве объекта испытания является короткий срок годности (от 3 до 6 мес), что ограничивает его применение для изучения стабильности вакцин для профилактики гриппа на протяжении срока годности готовой лекарственной формы или при расследовании рекламаций с мест применения. Количество гемагглютинина в готовой лекарственной форме определяют расчетным методом: путем умножения значения, полученного при определении в полуфабрикате, на определенный коэффициент, зависящий от объема добавляемого адъюванта. Однако данный подход не учитывает вероятность нарушений в производственном процессе на этапе добавления адъюванта и последующих стадиях, которые могут влиять на фактическое содержание гемагглютинина в готовом препарате. В этой связи предпочтительным является проведение испытания по показателю «специфическая активность» на образцах готовой лекарственной формы [6].
В последние годы все большее признание получает идеология «фармацевтическая система качества» (ФСК), представленная впервые на Международной конференции по гармонизации требований к регистрации лекарственных средств для медицинского применения (ICH) в Брюсселе. На сегодняшний день выделяют 4 основных элемента ФСК: 1) мониторинг процессов и качества продукции; 2) система корректирующих и предупреждающих действий; 3) управление изменениями; 4) анализ со стороны руководства [7]. Одним из наглядных инструментов оценки качества выпускаемых в гражданский оборот вакцин для профилактики гриппа является оценка статистической управляемости производственного процесса путем построения и анализа контрольных карт Шухарта. Известно, что производственный процесс находится на приемлемом и стабильном уровне, позволяющем обеспечить соответствие качества продукции регламентированным требованиям, если его изменчивость обусловлена случайными причинами, действующими постоянно и трудно поддающимися обнаружению. Своевременное выявление отклонений от установленных контрольных границ позволяет незамедлительно провести анализ производственных рисков и предотвратить выпуск некачественной вакцины [8, 9].
Цель настоящей работы – оценить сопоставимость результатов количественного определения гемагглютинина в полуфабрикате вакцины и в готовой лекарственной форме, провести анализ результатов контроля показателя качества «специфическая активность» по паспортным данным для оценки статистической управляемости производственного процесса с помощью контрольных карт Шухарта.
Материалы и методы
В качестве объектов исследования использовали 31 серию полуфабрикатов (тривакцины до добавления адъюванта Совидон) и соответствующих им серий готовой лекарственной формы вакцины для профилактики гриппа, содержащей адъювант Совидон. В качестве стандартных образцов (антигенов) использовали стандартные образцы, предусмотренные нормативной документацией на испытуемую вакцину, охарактеризованные по количественному содержанию гемагглютинина соответствующих штаммов вируса гриппа: подтипа A/Victoria/4897/2022 (IVR-238) (H1N1), подтипа A/Thailand/8/2022 (H3N2) IVR-237, типа B/Austria/1359417/2021 (BVR-26) (Victoria lineage). В качестве стандартных образцов (сывороток) использовали стандартные сыворотки, содержащие антитела к гемагглютинину вируса гриппа подтипов А(H1N1), А(H3N2) и типа В, гомологичные стандартным антигенам.
Испытания проводили методом ОРИД в соответствии с методикой, изложенной в нормативной документации на лекарственный препарат. Основные этапы методики включали в себя: 1) приготовление пластин с 1,5% агарозой, содержащей соответствующую стандартную сыворотку; 2) смешивание испытуемых образцов с детергентом и инкубацию не менее 30 мин при комнатной температуре; 3) приготовление разведений испытуемых образцов с буферным раствором в соотношении 1 : 0, 3 : 1, 1 : 1, 1 : 3; 4) внесение разведений испытуемых образцов в объеме 20 мкл в лунки пластины с агарозой; 5) инкубацию пластин не менее 18 ч во влажной камере при температуре 20 ± 5 °С; 6) окрашивание пластин с последующей отмывкой от излишков красителя до проявления линий преципитаций; 7) учет результатов при помощи программного обеспечения SIAMS Photolab.
Статистическую обработку результатов исследования проводили с использованием программного обеспечения StatPlus (version 7). Нормальность распределения оценивали по критерию Шапиро–Уилка, для оценки равенства дисперсий в сравниваемых группах использовали тест Левена. Статистическую значимость различий в группах с нормальным распределением данных определяли по критерию Стьюдента (t-тест для двух независимых выборок) при уровне значимости р < 0,05; в группах с ненормальным распределением данных – по критерию Манна–Уитни при уровне значимости р < 0,05.
Построение контрольных карт Шухарта проводили в программе Microsoft Excel, одна точка на графике соответствует количественному содержанию гемагглютинина в одной серии лекарственного препарата по данным предприятия-производителя. Для расчета верхней (UCL) и нижней (LCL) контрольных границ, значений стандартного отклонения процесса (σ) руководствовались общепринятыми требованиями4.
Требования ГОСТ Р ИСО 7870-2-2015 предусматривают использование 8 критериев для оценки статистической управляемости производственного процесса:
- критерий 1 – одна точка вне зоны А;
- критерий 2 – 9 точек подряд в зоне С или по одну сторону от центральной линии;
- критерий 3 – 6 возрастающих или убывающих точек подряд;
- критерий 4 – 14 попеременно возрастающих и убывающих точек;
- критерий 5 – 2 из 3 последовательных точек в зоне А;
- критерий 6 – 4 из 5 последовательных точек в зоне В или вне ее;
- критерий 7 – 15 последовательных точек в зоне С, выше или ниже центральной линии;
- критерий 8 – 8 последовательных точек по обеим сторонам центральной линии и ни одной в зоне С.
Критерии 1, 2, 3, 7 расценивали как критические, 4, 5, 6, 8 – как предупреждающие.
Результаты
При учете результатов обращали внимание на визуальные характеристики колец преципитации, образовавшихся вокруг лунок с внесенными образцами. Основными критериями приемлемости результатов на этапе визуального анализа являлись: сопоставимость колец преципитации, полученных при внесении в лунки пластин образцов тривакцины (эталон сравнения) и образцов лекарственного препарата; соответствие интенсивности колец преципитации для испытуемых образцов интенсивности колец преципитации для стандартных образцов (антигенов); отсутствие двойных колец преципитации во всех лунках пластины. В качества эталона сравнения использовали кольца преципитации, образующиеся при взаимодействии стандартной сыворотки с антигеном, содержащимся в тривакцине и стандартном антигене. Особое внимание уделяли интенсивности колец и четкости их границ.
В случае соблюдения вышеуказанных критериев проводили построение графиков зависимости квадратов диаметров колец преципитации от разведений испытуемого образца/стандартного образца (антигена) и расчет количественного содержания гемагглютинина в образцах при помощи специализированного программного обеспечения. Графики представляют собой прямые линии, построенные методом наименьших квадратов. На данном этапе учитывали критерии приемлемости результатов испытания: отсутствие пересечения графиков, построенных для стандартного образца и испытуемого образца; расстояние между начальными точками графиков (разведение 1 : 3) – не более 3 мм2. Для пересчета в готовом лекарственном препарате полученное содержание гемагглютинина в тривакцине умножали на 0,9 (коэффициент, представляющий собой частное, полученное от деления объема серии тривакцины до добавления адъюванта (мл) на объем серии вакцины после добавления адъюванта).
Полученные данные оценивали на нормальность распределения при помощи критерия Шапиро–Уилка (табл. 1). Если уровень значимости (р) > 0,05, то распределение относили к нормальному.
Таблица 1. Оценка нормальности распределения значений, характеризующих содержание гемагглютининов вируса гриппа в испытуемых образцах
Table 1. Evaluation for normality of distribution of hemagglutinin content in test samples
№ группы Group No. | Объект испытания Test sample | Вакцинный штамм Vaccine strain | Среднее значение Mean value | Критерий Шапиро–Уилка (W) Shapiro–Wilk criterion (W) | р | Характер распределения Normality of distribution |
1 | Тривакцина Trivaccine | A/Victoria (H1N1) | 5,205 (n = 31) | 0,948 | 0,141 | Нормальный Normal |
2 | Лекарственный препарат Drug | A/Victoria (H1N1) | 5,186 (n = 31) | 0,961 | 0,312 | Нормальный Normal |
3 | Тривакцина Trivaccine | A/Thailand (H3N2) | 5,539 (n = 31) | 0,902 | 0,008 | Ненормальный Abnormal |
4 | Лекарственный препарат Drug | A/Thailand (H3N2) | 5,542 (n = 31) | 0,927 | 0,037 | Ненормальный Abnormal |
5 | Тривакцина Trivaccine | B/Austria | 11,185 (n = 30) | 0,962 | 0,345 | Нормальный Normal |
6 | Лекарственный препарат Drug | B/Austria | 11,160 (n = 30) | 0,958 | 0,268 | Нормальный Normal |
Для изучения возможности определения количественного содержания гемагглютинина в образцах готовой лекарственной формы вакцины для профилактики гриппа была проведена статистическая оценка достоверности различий в попарно сравниваемых группах (тривакцина/лекарственный препарат). Результаты представлены в табл. 2, 3. Выводы о достоверности различий делали по уровню значимости: если р > 0,05, то различия в сравниваемых группах отсутствуют.
Таблица 2. Оценка достоверности различий содержания гемагглютинина в сериях тривакцины и лекарственного препарата для штаммов вирусов гриппа A/Victoria (H1N1), B/Austria с использованием критерия Стьюдента
Table 2. The evaluation of hemagglutinin content in test samples (strain A/Victoria (H1N1), strain B/Austria) by t-test (Student test)
№ групп Group No. | Среднее (тривакцина) Mean (trivaccine) | Среднее (лекарственный препарат) Mean (final lot) | Критерий Стьюдента (t) Student test (t) | р | Вывод о достоверности различий Conclusion on the reliability of differences |
1, 2 | 5,205 | 5,186 | 0,189 | 0,851 | Отсутствуют None |
5, 6 | 11,185 | 11,160 | 0,108 | 0,914 | Отсутствуют None |
Таблица 3. Оценка достоверности различий содержания гемагглютинина в сериях тривакцины и лекарственного препарата для штамма вируса гриппа A/Thailand (H3N2) с использованием критерия Манна–Уитни
Table 3. The evaluation of hemagglutinin content in test samples (strain A/Thailand (H3N2)) by Mann–Whitney U test
№ группы Group No. | Сумма рангов (тривакцина) Rank total (trivaccine) | Сумма рангов (лекарственный препарат) Rank total (final lot) | Критерий Манна–Уитни (U) Mann–Whitney U test (U) | р | Вывод о достоверности различий Conclusion on the reliability of differences |
3, 4 | 1010,5 | 942,5 | 446,5 | 0,632 | Отсутствуют None |
Результаты статистического анализа экспериментальных данных показали, что в 2 случаях попарно сравниваемые группы (группы 1 и 2, 5 и 6) имели нормальный характер распределения и в 1 случае (группы 3 и 4) – ненормальный характер, что обусловило разный выбор статистических критериев для оценки различий между 2 независимыми выборками: критерий Стьюдента для нормального распределения и критерий Манна–Уитни для ненормального распределения. Проведенный анализ продемонстрировал, что во всех случаях статистически достоверные различия во всех попарно сравниваемых группах отсутствуют.
Результаты анализа статистической управляемости процесс производства вакцины для профилактики гриппа представлены на рис. 1–3.
Рис. 1. Контрольная карта оценки стабильности производственного процесса вакцины для профилактики гриппа по результатам определения количественного содержания гемагглютинина вируса гриппа подтипа A(H1N1) в сериях вакцины.
Описание в тексте.
Fig. 1. The Control chart for evaluation of stability of the influenza vaccine production (the content of influenza virus strain A(H1N1) hemagglutinin in final lots of the vaccine).
Description in the text.
Рис. 2. Контрольная карта оценки стабильности производственного процесса вакцины для профилактики гриппа по результатам определения количественного содержания гемагглютинина вируса гриппа подтипа A(H3N2) в сериях вакцины.
Описание в тексте.
Fig. 2. The Control chart for evaluation of stability of the influenza vaccine production (the content of influenza virus strain A(H3N2) hemagglutinin in final lots of the vaccine).
Description in the text.
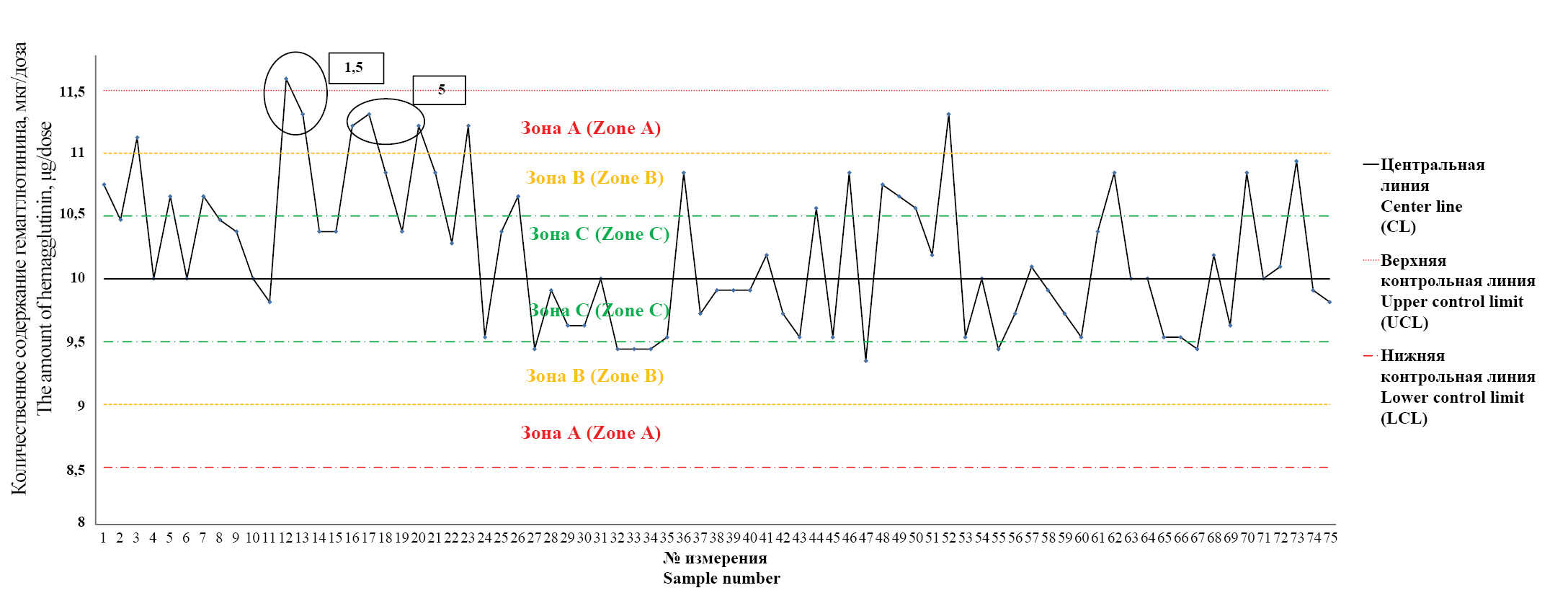
Рис. 3. Контрольная карта оценки стабильности производственного процесса вакцины для профилактики гриппа по результатам определения количественного содержания гемагглютинина вируса гриппа типа В в сериях вакцины.
Описание в тексте.
Fig. 3. The Control chart for evaluation of stability of the influenza vaccine production (the content of influenza virus strain B hemagglutinin in final lots of the vaccine).
Description in the text.
На оси Y каждого графика приведены значения содержания гемагглютинина в микрограммах на 1 дозу препарата (мкг/доза), на оси Х – количество измерений. Для анализа полученных данных на каждом графике проведены центральная линия (CL), соответствующая среднему значению полученных измерений, и по 3 дополнительные линии с каждой стороны от центральной линии, соответствующие рассчитанным значениям ±1σ, ±2σ, ±3σ (UCL – верхняя контрольная линия, LCL – нижняя контрольная линия). Зоны, ограниченные центральной линией и линиями ±1σ, ±2σ, ±3σ, на графике обозначены «зона С», «зона В», «зона А» соответственно. В случае обнаружения признаков, соответствующих критериям из раздела «Материалы и методы», номер критерия указывали на графике.
Во всех измерениях специфическая активность серий вакцины для профилактики гриппа соответствовала требованиям нормативной документации: для подтипов А (H1N1) и A (H3N2) – от 4,0 до 6,0 мкг/доза, для типа В – от 9,0 до 13,0 мкг/доза.
Из рис. 1 видно, что критерии, сигнализирующие о действии специальных (внешних) причин, не свойственных производственному процессу, отсутствуют. Однако обращает на себя внимание тот факт, что в 3 случаях (измерения 11, 28, 37) выявляется тенденция к формированию критерия 5, в 1 случае (измерения 59–64) – критерия 3 и в 1 случае (измерение 64) – критерия 1. В последнем случае измерение 64 достигает значения (5,6 мкг на дозу), установленного для верхней контрольной границы, не выходя при этом за пределы зоны А.
На рис. 2 критерии, сигнализирующие о действии специальных (внешних) причин, также отсутствуют. Однако в 2 случаях (измерения18, 28) прослеживается тенденция к формированию критичного критерия 1: измерения достигают значения (5,9), установленного для верхней контрольной границы, при этом не выходя за пределы зоны А, но приближаясь вплотную к верхней границе нормативного содержания гемагглютинина в вакцине (6,0 мкг гемагглютинина на дозу).
Из рис. 3 видно, что в 1 случае установлен критерий 1 (измерение 12), в 2 случаях – критерий 5 (измерения 16, 17), наблюдается тенденция к формированию критерия 3 (измерения 7–11).
Обсуждение
При планировании испытания рассматривалась гипотеза о том, что адъювант Совидон, содержащийся в вакцине, может изменять стандартный вид колец преципитации, ухудшать качество отмывки пластин от красителя, снижать контрастность колец преципитации по отношению к агарозному гелю и, как следствие, приводить к некорректному измерению квадратов диметров и, соответственно, получению недостоверных результатов.
При учете результатов испытания в качества эталона сравнения использовали кольца преципитации, образующиеся при взаимодействии стандартной сыворотки с антигеном, содержащимся в тривакцине и стандартном антигене. Особое внимание уделяли интенсивности колец и четкости их границ.
Сравнительный анализ визуальных характеристик колец преципитации показал, что кольца, образуемые вакциной с адъювантом, не отличались от колец эталонов сравнения. Дополнительная обработка пластин путем погружения в буферный раствор и отмывки неспецифических компонентов не требовалась. Было показано, что критерии приемлемости на этапе визуальной оценки результатов соблюдались для каждого объекта исследования независимо от вакцинного штамма вируса гриппа, входящего в состав вакцины, и содержания адъюванта в готовом препарате (от 0,8 до 1,2 мг/мл).
При проведении расчетов в программе SIAMS Photolab анализировали графики линейной зависимости квадратов диаметров колец преципитации от разведений образцов вакцины с адъювантом. Для всех наблюдений было установлено, что диаметр колец преципитации уменьшался в ряду разведений вакцины: 1 : 0–3 : 1–1 : 1–1 : 3, при этом коэффициент детерминации (R2) колебался в диапазоне 0,900–0,998. Было установлено, что критерии приемлемости для графиков также соблюдались во всех случаях: графики, построенные для испытуемых образцов и стандартных антигенов, не пересекались, начальные точки графиков отстояли друг от друга в пределах 3 мм2.
Показано, что адъювант Совидон не влияет на достоверность определения количественного содержания гемагглютинина в готовой лекарственной форме методом ОРИД. Таким образом, изменение объекта испытаний при проведении исследований по подтверждению соответствия выпускаемых в гражданский оборот гриппозных вакцин с адъювантом позволит проводить контроль показателя «специфическая активность» путем прямого измерения количества гемагглютинина, а не расчетным способом. Данный факт приобретает особое значение, т.к. контроль готовой лекарственной формы позволяет обнаружить несоответствие по показателю «специфическая активность» в случае воздействия негативных внешних факторов на лекарственный препарат с момента выпуска препарата предприятием-производителем и до момента его поступления в испытательную лабораторию. Кроме того, расширяются возможности по исследованию стабильности лекарственного препарата, срок годности (12 мес) которого превышает срок годности полуфабриката (3 мес), и изучению качества вакцины в случае расследования рекламаций с мест применения гриппозной вакцины.
Анализ построенных контрольных карт позволяет сделать вывод о наличии специальных причин, влияющих на производственный процесс. Обращает на себя внимание контрольная карта, представленная на рис. 3. Выявленный критерий 1 относится к критическому типу и может сигнализировать о необходимости воздействия на сам производственный процесс. Серьезность ситуации подчеркивает тот факт, что в непосредственной близости от обнаруженного критерия регистрируется критерий 5 и прослеживается тенденция к выходу за пределы контрольной верхней границы для двух точек на графике (измерения 20, 23). В последующем наблюдается возвращение производственного процесса в состояние статистической управляемости, но уже измерение 52 приближается к верхней контрольной границе. В сложившейся ситуации можно говорить о высокой вероятности снижения степени стабильности производственного процесса вакцины для профилактики гриппа.
На контрольной карте, представленной на рис. 1, сформированные критерии нестабильности производственного процесса отсутствуют, однако регистрируется выход 5 измерений в зону А, при этом одна из точек достигла верхней контрольной границы, не выходя за ее пределы. Представленная на рисунке ситуация может свидетельствовать о повышении риска выхода производственного процесса из состояния статистического управления.
Оценка данных, приведенных на рис. 2, показывает появление критерия 5 дважды. Хотя указанный критерий относится к типу предупреждающих критериев, не требующих воздействия на производственный процесс, на контрольной карте зафиксированы 2 случая достижения верхней контрольной границы и 2 случая выхода измерений в зону А. Следует отметить, что измерения достигают верхней контрольной точки в непосредственной близости от первого критерия 5 (точки 6–14).
В целом можно выделить 2 подхода в случае регистрации критериев нестабильности производственного процесса в зависимости от типа обнаруженных критериев. Получение результата, выходящего за пределы контрольной границы (зоны А), указывает на то, что производственный процесс может быть неконтролируемым. Контрольная карта в этом случае сигнализирует о том, что может присутствовать специальная причина изменчивости и следует каким-либо образом воздействовать на процесс, например, возможны: проведение анализа данных для определения источников специальной причины в целях устранения и сокращения влияния этой причины в будущем; регулирование производственного процесса; остановка производственного процесса и проведение корректирующих действий [10].
Если результаты измерений находятся вне пределов предупреждающих границ (±2σ), но внутри контрольных границ, то, несмотря на то что никаких воздействий на процесс не требуется, целесообразно обратить внимание на выявление наличия или отсутствия специальной причины.
Заключение
Показана принципиальная возможность и обоснована целесообразность определения количественного содержания гемагглютинина в готовой лекарственной форме вакцины для профилактики гриппа, содержащей адъювант Совидон.
Выявленные тренды при анализе контрольных карт Шухарта являются основанием для установления причины выхода производственного процесса вакцины для профилактики гриппа из состояния статистической управляемости и анализа рисков выпуска в гражданский оборот серий вакцины, не соответствующих установленным требованиям.
1 Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2023 году». М.; 2024..
2 СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней».
3 «ФС.3.3.1.0028.20. Фармакопейная статья. Вакцина гриппозная инактивированная» (утв. и введена в действие Приказом Минздрава России от 28.07.2020 № 751).
4 «ГОСТ Р ИСО 7870-2-2015. Национальный стандарт Российской Федерации. Статистические методы. Контрольные карты. Часть 2. Контрольные карты Шухарта».
Об авторах
Алексей Юрьевич Бутырский
ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России
Автор, ответственный за переписку.
Email: butirskiy@expmed.ru
ORCID iD: 0000-0002-0352-522X
главный эксперт лаборатории вирусных вакцин
Россия, 127051, г. МоскваЕлена Николаевна Морозова
ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России
Email: Morozovaen@expmed.ru
ORCID iD: 0009-0005-0478-1558
эксперт 2-й категории лаборатории вирусных вакцин
Россия, 127051, г. МоскваКаринэ Арташесовна Саркисян
ФГБУ «Научный центр экспертизы средств медицинского применения» Минздрава России
Email: Sarkisyan@expmed.ru
ORCID iD: 0000-0003-0445-7086
канд. мед. наук, начальник лаборатории вирусных вакцин
Россия, 127051, г. МоскваСписок литературы
- Никифоров В.В., Полибин Р.В., Суранова Т.Г., Полежаева Н.А. Грипп вчера, сегодня и завтра. Итоги мониторинга иммунизации и заболеваемости в эпидемические сезоны 2019–2020, 2020–2021, 2021–2022, 2022–2023 годов. Эпидемиология и инфекционные болезни. 2023; 28(6): 373–86. https://doi.org/10.17816/EID607411 https://elibrary.ru/milthb
- Ерофеева М.К., Стукова М.А., Шахланская Е.В., Бузицкая Ж.В., Максакова В.Л., Крайнова Т.И. и др. Оценка профилактической эффективности гриппозных вакцин. Эпидемиология и вакцинопрофилактика. 2021; 20(5): 52–60. https://doi.org/10.31631/2073-3046-2021-20-5-52-60-52-60 https://elibrary.ru/zcbuzk
- Wood J.M., Schild G.C., Newman R.W., Seagroatt V. An improved single-radial-immunodiffusion technique for the assay of influenza haemagglutinin antigen: application for potency determinations of inactivated whole virus and subunit vaccines. J. Biol. Stand. 1977; 5(3): 237–47. https://doi.org/10.1016/s0092-1157(77)80008-5
- Wood J.M., Weir J.P. Standardisation of inactivated influenza vaccines – learning from history. Influenza Other Respir. Viruses. 2018; 12(2): 195–201. https://doi.org/10.1111/irv.12543
- Никифорова А.Н., Исакова-Сивак И.Н., Ерофеева М.К., Фельдблюм И.В., Руденко Л.Г. Результаты изучения безопасности иммуногенности отечественной субъединичной адъювантной вакцины Совигрипп у добровольцев 18-60 лет. Эпидемиология и вакцинопрофилактика. 2014; (2): 72–8. https://elibrary.ru/sbeunx
- Minor P.D. Assaying the potency of influenza vaccines. Vaccines (Basel). 2015; 3(1): 90–104. https://doi.org/10.3390/vaccines3010090
- Хохлов А.Л., Пятигорская Н.В., ред. Промышленная фармация. Путь создания продукта. М.: Российская академия наук; 2019.
- Демидова П.В., Мефед К.М., Давыдов Д.С., Саркисян К.А., Мовсесянц А.А., Меркулов В.А. Оценка стабильности показателей качества отечественной вакцины против гриппа, предназначенной для иммунизации населения в течение эпидемического сезона 2017-2018 гг. БИОпрепараты. Профилактика, диагностика, лечение. 2018; 18(2): 121–32. https://doi.org/10.30895/2221-996X-2018-18-2-121-132 https://elibrary.ru/xqrelj
- Алексеева И.А., Перелыгина О.В., Колышкина Е.Д. Оценка стабильности производства коклюшного, дифтерийного и столбнячного компонентов АКДС-вакцины с помощью контрольных карт Шухарта. БИОпрепараты. Профилактика, диагностика, лечение. 2021; 21(4): 256–65. https://doi.org/10.30895/2221-996X-2021-21-4-256-265 https://elibrary.ru/vnsstr
- Уилер Д., Чамберс Д. Статистическое управление процессами: Оптимизация бизнеса с использованием контрольных карт Шухарта. М.: Альпина Бизнес Букс; 2024.
Дополнительные файлы