Доклинические исследования безопасности интраназальной вакцины на основе вирусоподобных частиц для профилактики COVID-19
- Авторы: Чернорыж Я.Ю.1, Кондратьева В.М.1, Малкова А.П.2, Савочкина Т.Е.1, Елисеева О.В.1, Латышев О.Е.1, Якунин Д.Ю.1, Зайкова О.Н.1, Слуднякова Е.С.1, Гребенникова Т.В.1
-
Учреждения:
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- Институт медико-АНО «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ»)
- Выпуск: Том 70, № 1 (2025)
- Страницы: 35-46
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16701
- DOI: https://doi.org/10.36233/0507-4088-278
- EDN: https://elibrary.ru/fzgyxe
- ID: 16701
Цитировать
Аннотация
Введение. Масштабная и продолжительная пандемия новой коронавирусной инфекции (COVID-19) показала необходимость эффективной вакцинации. Наряду с иммуногенностью, безопасность является критически важным вопросом для вакцин, поскольку общественное доверие может способствовать успеху или провалу программ иммунизации. В рамках доклинических исследований мы оценили безопасность вакцины на основе вирусоподобных частиц (Virus-like particles, VLP) на мышах и крысах.
Цель ‒ оценить токсичность (острую и субхроническую) и местную переносимость четырехвалентной вакцины против COVID-19 на основе VLP для интраназального введения в соответствии с правилами надлежащей лабораторной практики.
Материалы и методы. Материалом для исследования являлись половозрелые аутбредные мыши (30 самцов и 30 самок), половозрелые аутбредные крысы (45 самцов и 45 самок). Проводили оценку следующих показателей: физиологических, морфометрических и гистологических; общий и биохимический анализ крови и клинический анализ мочи.
Результаты. Не было зарегистрировано ни гибели, ни клинической картины интоксикации при исследовании на мышах острой токсичности, все показатели были в пределах физиологической нормы. При исследовании на крысах субхронической токсичности не отмечалось изменений в общем состоянии, поведении, не было гибели животных. Структура внутренних органов, показатели клинических и биохимических анализов крови, гемостаза и анализа мочи достоверно не различались между группами и не выходили за пределы нормы. При визуальной оценке, цитологическом и гистологическом анализе места введения вакцины не было выявлено местно-раздражающего действия.
Заключение. Четырехвалентная VLP-вакцина для профилактики COVID-19 безопасна, о чем свидетельствуют полученные результаты доклинических исследований, интраназальное введение не оказывает негативного влияния на функцию различных органов, уровень клеточных и биохимических биомаркеров в крови и моче мышей и крыс. В месте введения не было выявлено местно-раздражающего действия при визуальной оценке, цитологическом и гистологическом анализе.
Ключевые слова
Полный текст
Введение
Пандемия новой коронавирусной инфекции (COVID-19) привела к необходимости введения Всемирной организацией здравоохранения (ВОЗ) режима чрезвычайной ситуации в области здравоохранения, который не отменяли более 3 лет. Несмотря на успехи глобальных мер по борьбе с распространением пандемии COVID-19, коронавирусная инфекция все еще может представлять угрозу. Это связано с постоянным появлением новых вариантов вируса SARS-CoV-2, которые возникают при накоплении мутаций в естественном процессе репликаций вируса. Для вируса SARS-CoV-2 характерна эволюция с примерной скоростью 0,0011 замены на участок в год, что соответствует примерно одной замене каждые 11 сут. В конце 2020 г. ВОЗ предложила классифицикацию новых штаммов SARS-CoV-2: 1) варианты, представляющие интерес (VOIs), ‒ штаммы, у которых мутации привели к потенциальному увеличению тяжести заболевания вследствие снижения восприимчивости к лечению и снижения нейтрализации антителами и/или трансмиссивности из-за изменений в связывании вируса с рецепторами; 2) варианты, вызывающие озабоченность (VOCs), ‒ штаммы с высокой трансмиссивностью, большей тяжестью заболевания и низким ответом на лечение и вакцинацию из-за отсутствия нейтрализации вырабатываемыми антителами [1]. Исследования, направленные на поиск эффективного специфического лечения коронавирусной инфекции, не дали результатов, в лечении применяются противовирусные препараты, нацеленные на широкий спектр вирусов, включая коронавирусы, и иммуномодуляторы. Поэтому в настоящее время единственной защитой и профилактикой распространения коронавирусной инфекции является вакцинация.
Острая необходимость в вакцинации для борьбы с пандемией COVID-19 привела к разнообразию используемых платформ вакцин против COVID-19, которые представлены цельновирусными инактивированными вакцинами, белковыми субъединичными вакцинами, векторными вакцинами, вакцинами на основе ДНК и/или мРНК, и каждая имеет свои преимущества. Главный недостаток – это то, что у большинства вакцин в основе лежит формирование иммунитета только на поверхностный спайковый гликопротеин S (spike) SARS-CoV-2. Постоянные и быстрые мутации могут приводить к потере эпитопов в S-белке у новых штаммов и, следовательно, к прогнозируемому снижению нейтрализации вакциноиндуцированными антителами. Поэтому в основе подходов к разработке и оптимизации вакцин обязательно должно быть прогнозирование влияния новых VOCs, чтобы не допустить избегания или подавления иммунных ответов человека постоянно эволюционирующим вирусом.
Технология создания вакцин на основе вирусоподобных частиц (Virus-like particles, VLP) – современный и перспективный подход к созданию иммуногенных, эффективных и безопасных вакцин. VLP представляют собой самособирающиеся структурные вирусные белки, которые не содержат вирусного генома. VLP-вакцины имеют существенное преимущество по сравнению с субъединичными вакцинами, они презентуют белковые эпитопы как нативный вирус, что позволяет существенно усиливать иммунный ответ. Клинические исследования проходят 7 вакцин на основе VLP против COVID-19: LYB001 (Yantai Patronus Biotech Co Ltd), Covifenz (Medicago), NVX-CoV2373 (Novavax), VBI-2902a (VBI Vaccines Inc.), ABNCoV2 (Radboud University), RBD SARS-CoV-2 HBsAg VLP vaccine (Serum Institute of India + Accelagen Pty + SpyBiotech), SARS-CoV-2 VLP Vaccine (The Scientific and Technological Research Council of Turkey), а 19 проходят доклинические исследования1. Для большинства вакцин, в том числе одобренных и проходящих доклинические исследования VLP-вакцин, характерно парентеральное введение (внутримышечное или подкожное), для которого требуется соблюдение правил асептики и специально обученный персонал. Для повышения иммуногенности они применяются совместно с адъювантами различной природы, и перечисленные выше вакцины не исключение. Интраназальная иммунизация продемонстрировала многообещающую способность стимулировать секреторный иммунитет слизистых оболочек наряду с формированием гуморального и клеточного иммунного ответа, а также ряд дополнительных преимуществ, главное из которых – это простота введения и дозирования по сравнению с инъекционными формами. Защита дыхательных путей, входных ворот для вируса SARS-CoV-2, путем активации местного иммунитета слизистых оболочек является одним из главных преимуществ интраназального способа введения вакцин. По сравнению с инъекционными формами интраназальная вакцина удобна для дозирования, для проведения иммунизаций назальной вакциной не требуется специально обученный персонал, а значит, исключается нехватка специалистов, что немаловажно в случае возникновения эпидемии и/или пандемии. Кроме того, неинвазивный метод вакцинации более привлекателен для людей, а особенно для лиц с трипанофобией, что значительно расширяет круг пациентов, согласных на иммунизацию.
Четырехвалентная интраназальная VLP-вакцина против COVID-19 представляет собой смесь из 4 структурных белков SARS-CoV-2 (S, M, N, E), синтезированных в бакуловирусной системе экспрессии, очищенных и гомогенизированных. VLP имитируют вирион SARS-CoV-2, при этом не содержат нуклеиновых кислот, а следовательно, не размножаются в организме. Главным иммуногенным белком является S-белок SARS-CoV-2, при этом в составе вакцины используются VLP, содержащие S-белок с консенсусными мутациями клайдов 19А, Alpha, Delta и Omicron. Таким образом, после иммунизации в организме будут синтезироваться антитела к штаммам данных клайдов [2, 3].
Материалы и методы
Вакцина. Состав: комплекс рекомбинантных VLP, содержащих на поверхности S-белок, клайдов 19А, Alpha, Delta, Omicron SARS-CoV-2, синтезированных в бакуловирусной системе экспрессии – 80‒160 мкг; калия дигидрофосфат – 0,63 мг; динатрия гидрофосфат – 0,65 мг; натрия хлорид – 3,84 мг; калия хлорид – 0,09 мг; кальция хлорид – 0,02 мг; трис(гидроксиметил)аминометан-HCl – 0,03 мг; тиомерсал – 4,00 мкг; вода для инъекций – до 0,5 мл.
Животные. Использованы половозрелые аутбредные мыши массой 25–35 г (30 самок (♀) и 30 самцов (♂)), половозрелые аутбредные крысы массой 300–400 г (45♀ и 45♂). Мышей содержали по 10 особей, крыс – по 5 особей в клетках из поликарбоната с приспособлениями для корма, воды и стальных держателей этикеток. Были сформированы следующие группы: «физ. р-р» – животные, которым вводили физиологический раствор (NaCl 0,9%); «адьювант на основе сквалена» – группа животных, которым интраназально вводили адъювант; «VLP» – группа мышей, которым вводили интраназально вакцину 200 мг антигена в дозе препарата; «VLP 80 мкг» – группа крыс, которым вводили интраназальную вакцину 80 мкг антигена в дозе; «VLP 160 мкг» – группа крыс, которым вводили интраназально вакцину 160 мкг антигена в дозе. Все манипуляции с животными осуществляли в соответствии с правилами Европейской конвенции по защите позвоночных животных, используемых для экспериментов и в других научных целях ETS No. 123 (Страсбург, 1986), и Директивой 2010/63/EU Европейского Парламента и Совета Европейского союза по охране животных, используемых в научных целях. Дизайн и концепция исследования были сформированы с учетом требований Министерства здравоохранения РФ и концепции гуманного использования животных в экспериментах – «Концепция трех R»2 3[4–14].
Выбор доз препарата и способ введения. Мышам интраназально дробно вводили вакцину (25 мкл с интервалом 1,5 ч) с концентрацией 200 мг антигена в дозе для исследования острой токсичности, эта дозировка более чем в 2000 раз превышает дозу для человека. Крысам при исследовании субхронической токсичности VLP-вакцины вводили интраназально одну прививочную (80 мкг антигена в дозе) и удвоенную дозу для человека (160 мкг антигена в дозе). Так же как и мышам, из-за отсутствия возможности однократного интраназального введения исследуемых доз препарата, введение проводилось дробно (интервал 3 ч).
Наблюдение за животными. При исследовании острой токсичности на мышах наблюдение за животными осуществляли в течение 2 нед, а в день вакцинации – ежечасно. При исследовании хронической токсичности на крысах через 24 ч после последнего введения вакцины из каждой группы были выведены 10 животных, а за оставшимися крысами наблюдали 2 нед. Мышей и крыс подвергали эвтаназии с полным предварительным обследованием аналогично крысам, выведенным из исследуемых групп через 24 ч после последнего введения вакцины. Токсическое действие оценивали по таким критериям, как: гибель животных (сроки и количество при наличии таковых); мониторинг дыхательных показателей (диспноэ и/или тахипноэ, цианоз, ринорея); мониторинг двигательной активности (гипер-/гипокинезия, гиперсомния, атаксия, потеря чувствительности, каталепсия, прострация, тремор, фасцикуляции конвульсии); рефлексы; глазные признаки; гиперсаливация; полиурия; мониторинг сердечно-сосудистых показателей (бради-, тахикардия, аритмия); мониторинг показателей работы желудочно-кишечного тракта (диспепсия, рвота, изменения стула); пилолейомиома; алопеция; аналгезия; мышечный тонус; потребление корма и воды; зоосоциальное поведение.
Регистрация массы тела. Взвешивание проводили на весах АСОМ РС-100W-5 (АСОМ, Южная Корея).
Измерение температуры. Термометрию проводили ректально электронным медицинским термометром B.Well WT-03 (B.Well, Великобритания).
Потребление воды и корма. Учет проводили до начала исследования и далее с периодичностю 1 раз в 14 сут. Потребление воды определяли по разнице объема воды в бутылочках для питья до установки в клетку и через 24 ч. Аналогично определяли потребление корма – по разнице в массе до раздачи и через сутки.
Поведенческие реакции в тесте «Открытое поле». Наблюдение за поведением животного проводили в течение 10 мин в специальной установке, представляющей собой расчерченную на квадраты круглую площадку диаметром 90 см с высотой стенок 50 см с освещением красной лампой 40 Вт, которая размещалась на расстоянии 2 м. Регистрация исследуемых параметров проводилась визуально. Учитывали время на адаптацию, горизонтальную и вертикальную активность по количеству пересеченных квадратов по горизонтали и вертикали соответственно, количество актов дефекации и уринаций, а также груминг (умывание).
Показания сердечно-сосудистой деятельности, такие как частота сердечных сокращений и электрокардиографическая активность, регистрировали при помощи компьютерного электрокардиографа «Поли-Спектр-8/В» специализированного для ветеринарии (ООО «Нейрософт», Россия).
Анализ крови. Общий анализ крови выполняли на гематологическом анализаторе Mindray BC-2800-vet (Mindray, Китай) в соответствии с инструкцией производителя. Для этого в пробирки с антикоагулянтом ЭДТА «Юнивет» отбирали из хвостовой вены кровь. Оценивали количество красных и белых клеток крови (эритроцитов и лейкоцитов-моноцитов, лимфоцитов и гранулоцитов). При исследовании крови на гемостаз определяли следующие показатели: время свертывания крови, активированное частичное тромбопластиновое время (АЧТВ) и фибриноген. Забор крови производили также из хвостовой вены, но в пробирки с 3,8% раствором цитрата натрия. Анализ осуществляли на анализаторе показателей гемостаза АПГ-02-П (ООО «ЭМКО», Россия) в соответствии с инструкцией производителя с использованием наборов реагентов компании «Ренам».
Биохимический анализ крови проводили на фотометре «Стат факс 4500+» (Awareness Technology Inc., США) с применением стандартных наборов реагентов компаний «Юнимед» и «Ольвекс Диагностикум» в соответствии с инструкцией производителя. Отбор крови осуществляли в пробирки с гранулами для отделения сыворотки. Определяли следующие показатели: общий белок (биуретовый метод), аспартат- и аланинаминотрансферазу и щелочную фосфатазу (кинетический метод), креатинин (кинетический метод, основанный на реакции Яффе), мочевину (УФ-кинетический метод), альбумин и натрий (колориметрический метод), калий (турбидиметрический метод без депротеинизации), билирубин общий (по реакции диазотирования билирубина диазосульфаниловой кислотой), глюкозу (глюкозооксидазный метод), холестерин и триглицериды (ферментативный метод).
Анализ мочи проводили с помощью полосок «ДекаФан ЛАУРА» на экспресс-анализаторе мочи LAURA Smart (Erba Lachema s.r.o., Чехия). Определяли удельный вес мочи, уровень pH и содержание эритроцитов, лейкоцитов, белка, глюкозы, кетонов, билирубина, уробилиногена и нитритов.
Терминальные процедуры. Некропсия проводилась сразу после гибели животных по полной патологоанатомической схеме. При изучении острой токсичности эвтаназию проводили ингаляцией двуокиси углерода (CO2), а при изучении субхронической токсичности проводили методом декапитации с предварительной анестезией.
Макроскопическое исследование. Визуально оценивали исследуемые органы, такие как: головной мозг, сердце, аорта, гортань, трахея, легкие, подчелюстная слюнная железа, щитовидная железа, тимус, лимфатические узлы, пищевод, желудок, поджелудочная железа, тонкий и толстый кишечник, печень и желчный пузырь, селезенка, почки, надпочечники, мочевой пузырь, семенники/яичники, матка, влагалище.
Микроскопическое исследование проводили на световом микроскопе Leica DM1000 (Leica Microsystems CSC GmbH, Германия) для анализа цитогистоархитектоники места введения (носовые ходы).
Морфометрический анализ. Органы взвешивали на весах DL-63 («ДЭМКОМ», Россия). Парные органы взвешивали вместе. Относительную массу органов (головной мозг, тимус, сердце, легкие, почки, надпочечники, печень, селезенка, семенники/яичники) определяли по соотношению массы исследуемого органа к массе тела животного.
Гистологическое исследование. Готовили срезы (3–4 нм) исследуемых образцов органов и тканей на микротоме RMD-4000 (MT Point, Россия) после предварительной фиксации в 15% растворе формалина, а также обезвоживания, обезжиривания и парафинизации на гистопроцессоре TLP-144 (MT Point, Россия). После фиксации полученных срезов на предметном стекле проводили депарафинизацию в ксилоле и батарее спиртов для дальнейшего окрашивания гематоксилином и эозином. Затем окрашенные образцы исследовали на световом микроскопе Leica DM1000 (Leica Microsystems CSC GmbH, Германия).
Статистический анализ. Критерий сравнения выбирали исходя из параметров нормальности распределения выборок. Достоверность различий полученных значений измеряемых показателей между контрольными и опытными группами выполняли с помощью параметрических и непараметрических методов. (t-критерия Стьюдента и U-критерий Манна–Уитни соответственно). Достоверным считали различие при p < 0,05.
Авторы подтверждают соблюдение институциональных и национальных стандартов по использованию лабораторных животных в соответствии с Consensus author guidelines for animal use (IAVES 23.07.2010). Протокол исследования одобрен биоэтической комиссией АНО «ИМБИИТ» (Протокол № 4/2022 от 16.05.2022).
Результаты
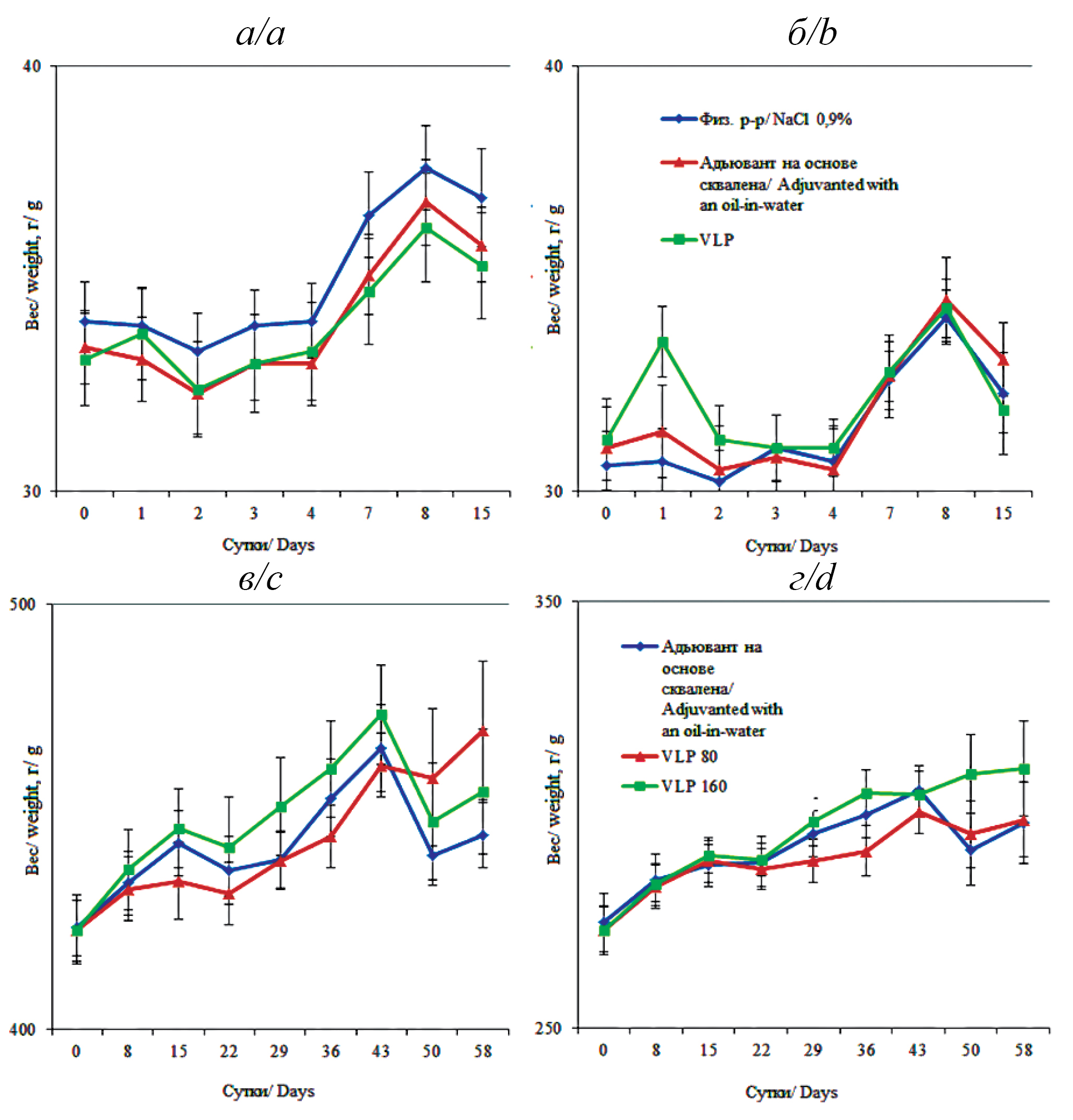
Исследование острой токсичности на мышах показало, что на протяжении всего исследования у животных не было установлено клинической картины интоксикации, гибели не зарегистрировано. Во время иммунизации животные вели себя спокойно, чихания или заглатывания препарата не наблюдалось. При последних введениях как вакцины, так и носителя у мышей наблюдались покраснение и припухлость зеркальца носа, которые проходили в течение суток. После введения вакцины, а также в остальное время наблюдений при визуальном осмотре всех животных исследуемых групп не было выявлено отклонений от нормы и различий между группами. Мыши выглядели здоровыми. Зоосоциальное поведение мышей контрольных и опытных групп не отличалось. Внешний вид, состояние шерсти, мышечный тонус и дыхание были без особенностей. Частота мочеиспускания, цвет мочи, желудочно-кишечные показатели, рефлексы соответствовали физиологической норме [15, 16]. Независимо от пола или исследуемой группы не было зарегистрировано достоверной разницы в потреблении корма и воды, прибавка в весе статистически значимо не различалась между контрольной («физ. р-р.») и опытными группами («адьювант на основе сквалена» и «VLP») на протяжении всего эксперимента (р > 0,05). Результаты представлены на рисунке а и б.
Рисунок. Средние значения массы самцов (а) и самок (б) мышей в исследуемых группах до исследования – 0-е сутки, на 1, 2, 3, 4, 7, 8 и 15-е сутки после введения вакцины, г (m ± SEM). Средние значения массы самцов (в) и самок (г) крыс в исследуемых группах до исследования – 0-е сутки, на 8, 15, 22, 29, 36, 43, 50 и 58-е сутки после введения вакцины, г (m ± SEM).
По вертикали – масса животных, г; по горизонтали – продолжительность эксперимента, сутки.
Figure. Average weights of male (a) and female (b) mice in the study groups before the study – day 0, on days 1, 2, 3, 4, 7, 8 and 15 after vaccine administration, g (m ± SEM). Average weights of male (c) and female (d) rats in the study groups before the study – day 0, on days 8, 15, 22, 29, 36, 43, 50 and 58 after vaccine administration, g (m ± SEM).
Vertical axis – animal weight, g; horizontal axis – experiment duration, days.
Для патоморфологической оценки органов проводили некропсию с извлечением органов. Не было установлено влияния вакцины на состояние внутренних органов мышей при макроскопическом исследовании. Достоверных как внутригрупповых, так и межгрупповых различий не обнаружено. Расположение внутренних органов было физиологически правильным, естественные отверстия без особенностей, свободной жидкости не обнаружено. Также не было обнаружено отрицательного влияния вакцины на анатомию и вес органов. Полученные результаты относительной массы внутренних органов представлены в табл. 1.
Таблица 1. Относительная масса внутренних органов самцов и самок мышей, % (m ± SEM)
Table 1. Relative mass of internal organs of mice, % (m ± SEM)
Орган Organ | Группа Group | |||||
Физ. р-р NaCl 0.9% | Адьювант на основе сквалена Adjuvanted with an oil-in-water | VLP | ||||
♀, n = 10 | ♂, n = 10 | ♀, n = 10 | ♂, n = 10 | ♀, n = 10 | ♂, n = 10 | |
Головной мозг Brain | 1,2 ± 0,06 | 1,1 ± 0,06 | 1,3 ± 0,05 | 1,0 ± 0,04 | 1,3 ± 0,09 | 1,1 ± 0,08 |
Тимус Thymus | 0,2 ± 0,03 | 0,1 ± 0,01 | 0,2 ± 0,01 | 0,2 ± 0,02 | 0,2 ± 0,02 | 0,2 ± 0,01 |
Сердце Heart | 0,4 ± 0,01 | 0,4 ± 0,01 | 0,4 ± 0,02 | 0,4 ± 0,01 | 0,4 ± 0,01 | 0,4 ± 0,02 |
Легкие Lungs | 0,8 ± 0,11 | 0,7 ± 0,07 | 0,7 ± 0,06 | 0,9 ± 0,11 | 0,9 ± 0,11 | 0,7 ± 0,12 |
Почки Kidneys | 1,1 ± 0,04 | 1,2 ± 0,04 | 1,1 ± 0,04 | 1,3 ± 0,03 | 1,1 ± 0,04 | 1,3 ± 0,06 |
Надпочечники Adrenal glands | 0,04 ± 0,002 | 0,02 ± 0,001 | 0,03 ± 0,002 | 0,02 ± 0,002 | 0,04 ± 0,002 | 0,02 ± 0,001 |
Печень Liver | 3,8 ± 0,13 | 3,6 ± 0,06 | 3,8 ± 0,14 | 3,6 ± 0,07 | 3,6 ± 0,10 | 3,8 ± 0,09 |
Селезенка Spleen | 0,4 ± 0,07 | 0,3 ± 0,02 | 0,4 ± 0,08 | 0,3 ± 0,02 | 0,4 ± 0,07 | 0,4 ± 0,03 |
Тимус/селезенка Thymus/spleen | 0,5 ± 0,12 | 0,5 ± 0,05 | 0,5 ± 0,06 | 0,5 ± 0,05 | 0,5 ± 0,10 | 0,5 ± 0,05 |
Семенники/яичники Testes/Ovaries | 0,1 ± 0,01 | 0,6 ± 0,04 | 0,1 ± 0,01 | 0,7 ± 0,03 | 0,2 ± 0,01 | 0,7 ± 0,05 |
Примечание. Здесь и в табл. 2, 3 данные представлены в виде средних значений по группе со стандартными ошибками среднего (m ± SEM).
Note. Here and in the table. 2, 3 data are presented as group means with standard errors of the mean (m ± SEM).
При исследовании субхронической токсичности на крысах не было зарегистрировано гибели животных. Мониторинг общего состояния и поведения на протяжении всего эксперимента проводился ежедневно. Отклонения не выявлены, тест «Открытое поле» – без особенностей. Реакция на внешние раздражители, ориентация в пространстве, мышечный тонус и координация движений были в пределах физиологических норм. Не было проявлений признаков агрессии. Крысы выглядели здоровыми, шерстяной покров был без особенностей, кожа ‒ без патологических признаков. Живот не был увеличен; видимые слизистые – умеренно влажные, розовые, чистые; зубы – без изменений; уши и глаза ‒ без воспалительных признаков; слезо- и слюноотделение ‒ без нарушений. Дыхание ровное, без особенностей. Количество мочеиспусканий и дефекаций ‒ в соответствии с физиологической нормой. Нос ‒ без выделений. У некоторых животных после трехкратной инстилляции за день как вакцины, так и носителя в носовую полость появились покраснение и припухлость носового зеркальца. Описанные явления исчезали самостоятельно через сутки. Термометрия животных не выявила отклонений за пределы физиологической нормы [15, 16]. Не было обнаружено достоверного влияния интраназального введения VLP-вакцины как в прививочной, так и в двойной прививочной дозировках, на динамику массы тела крыс, что показывает отсутствие негативного влияния VLP-вакцины на этот показатель (рис. в и г).
Средние групповые значения клинического анализа крови представлены в табл. 2. Через сутки после последней иммунизации (43-и сутки) было выявлено достоверное увеличение менее чем в 2 раза количества тромбоцитов у самцов крыс, получавших 160 мкг антигена в дозе препарата (двойная прививочная доза) по сравнению с контрольной группой. Выявленное увеличение количества тромбоцитов носило обратимый характер и не наблюдалось в других опытных группах или при иных сроках проведения клинического анализа крови в течение всего исследования. Через 14 сут не было статистически значимых различий данного показателя между опытными и контрольными группами. При этом не было достоверных различий между группами по остальным исследуемым показателям анализа крови, которые не выходили за границы физиологических норм для крыс [15, 16].
Таблица 2. Показатели клинического анализа крови самцов и самок крыс на 1-е и 14-е сутки после последней вакцинации (43 и 58-е сутки эксперимента соответственно), % (m ± SEM)
Table 2. Clinical blood test parameters of rats on the 1st and 14th days after the last immunization (43th and 58th days of the experiment, respectively), % (m ± SEM)
Показатель Blood count | Сутки Days | Группа Group | |||||
Адьювант на основе сквалена Adjuvanted with an oil-in-water | VLP 80 мкг VLP 80 μg | VLP 160 мкг VLP 160 μg | |||||
♀, n = 15 | ♂, n = 15 | ♀, n = 15 | ♂, n = 15 | ♀, n = 15 | ♂, n = 15 | ||
RBC, 1012/л RBC, 1012/l | 43 | 7,8 ± 0,11 | 7,9 ± 0,37 | 7,7 ± 0,33 | 8,3 ± 0,20 | 7,9 ± 0,30 | 8,3 ± 0,19 |
58 | 8,0 ± 0,26 | 8,7 ± 0,23 | 7,8 ± 0,14 | 8,7 ± 0,27 | 7,6 ± 0,12 | 8,2 ± 0,42 | |
PLT, 109/л PLT, 109/l | 43 | 374,6 ± 28,01 | 355,7 ± 49,87 | 417,2 ± 32,29 | 363,2 ± 28,48 | 517,6 ± 70,96 | 600,4 ± 67,74* |
58 | 347,2 ± 10,84 | 338,0 ± 16,10 | 365,2 ± 7,89 | 369,2 ± 5,15 | 330,0 ± 10,50 | 372,4 ± 7,55 | |
HCT, % | 43 | 43,0 ± 0,69 | 41,6 ± 1,75 | 41,5 ± 1,72 | 43,9 ± 1,00 | 42,9 ± 1,63 | 44,0 ± 1,08 |
58 | 43,3 ± 1,04 | 46,1 ± 1,18 | 42,2 ± 1,06 | 45,0 ± 1,29 | 41,7 ± 0,47 | 43,9 ± 2,02 | |
HGB, г/л HGB, g/l | 43 | 147,3 ± 2,58 | 139,4 ± 6,10 | 141,8 ± 6,04 | 147,1 ± 3,46 | 146,1 ± 5,87 | 144,0 ± 7,91 |
58 | 149,2 ± 3,83 | 160,0 ± 4,45 | 146,7 ± 4,14 | 154,3 ± 5,18 | 144,2 ± 2,06 | 144,7 ± 7,02 | |
WBC, 109/л WBC, 109/l | 43 | 10,9 ± 1,72 | 10,1 ± 0,99 | 9,9 ± 1,11 | 9,0 ± 1,20 | 9,8 ± 1,09 | 11,0 ± 1,54 |
58 | 11,0 ± 1,72 | 17,5 ± 1,60 | 11,0 ± 1,55 | 12,2 ± 2,40 | 15,0 ± 1,19 | 15,7 ± 0,72 | |
LYM, % | 43 | 63,1 ± 1,90 | 64,4 ± 0,95 | 67,7 ± 0,99 | 67,3 ± 1,73 | 65,8 ± 1,93 | 64,9 ± 1,78 |
58 | 64,5 ± 2,32 | 57,3 ± 2,20 | 62,0 ± 1,18 | 53,5 ± 3,24 | 63,8 ± 5,59 | 56,5 ± 5,37 | |
MON, % | 43 | 4,1 ± 0,27 | 3,8 ± 0,16 | 3,7 ± 0,18 | 3,3 ± 0,14 | 4,0 ± 0,35 | 3,7 ± 0,17 |
58 | 4,1 ± 0,86 | 4,0 ± 0,35 | 4,5 ± 0,34 | 3,9 ± 0,22 | 3,8 ± 0,27 | 4,0 ± 0,33 | |
GRAN, % | 43 | 32,8 ± 1,90 | 31,9 ± 0,87 | 28,6 ± 0,88 | 29,4 ± 1,66 | 30,2 ± 1,85 | 31,5 ± 1,67 |
58 | 31,4 ± 2,25 | 38,7 ± 2,34 | 31,7 ± 0,90 | 39,9 ± 3,42 | 28,4 ± 8,36 | 36,5 ± 4,42 | |
Примечание. RBC – эритроциты; PLT – тромбоциты; HCT – гематокрит; HGB – гемоглобин; WBC – лейкоциты; LYM – лимфоциты; MON – моноциты; GRAN – гранулоциты. * – статистически значимое различие в сравнении с контролем по t-критерию Стьюдента (р < 0,05).
Note. RBC – erythrocytes; PLT – platelets; HCT – hematocrit; HGB – hemoglobin; WBC – leukocytes; LYM – lymphocytes; MON – monocytes; GRAN – granulocytes. * – statistically significant difference compared to the control according to Student’s t-test (p < 0.05).
Исследование системы гемостаза по таким показателям коагулограммы, как АЧТВ, время рекальцификации и фибриноген, не выявило достоверных различий между опытными и контрольными группами. Показатели биохимического анализа крови (общий белок, холестерин, триглицериды, билирубин общий, аспартат- и аланинаминотрансфераза, щелочная фосфатаза, мочевина) и анализа мочи (белок, кетоны, удельный вес, рН,) у крыс, получавших интраназальную вакцину на основе VLP в прививочной и двойной прививочной дозе, статистически значимо не отличались от аналогичных показателей у крыс контрольных групп. У самцов и самок крыс не были выявлены признаки интоксикации и патологические отклонения в структуре внутренних органов. Средние значения относительной массы внутренних органов крыс представлены в табл. 3.
Таблица 3. Морфометрический анализ внутренних органов самцов и самок крыс на 1-е и 14-е сутки после последней вакцинации (43 и 58-е сутки эксперимента соответственно), % (m ± SEM)
Table 3. Relative mass of internal organs of rats on the 1st and 14th days after the last immunization (43th and 58th days of the experiment, respectively), % (m ± SEM)
Орган Organ | Сутки Days | Группа Group | |||||
Адьювант на основе сквалена Adjuvanted with an oil-in-water | VLP 80 мкг VLP 80 μg | VLP 160 мкг VLP 160 μg | |||||
♀, n = 15 | ♂, n = 15 | ♀, n = 15 | ♂, n = 15 | ♀, n = 15 | ♂, n = 15 | ||
Головной мозг Brain | 43 | 0,6 ± 0,02 | 0,4 ± 0,01 | 0,6 ± 0,01 | 0,4 ± 0,02 | 0,6 ± 0,02 | 0,4 ± 0,01 |
58 | 0,6 ± 0,03 | 0,4 ± 0,02 | 0,6 ± 0,03 | 0,4 ± 0,01 | 0,6 ± 0,02 | 0,5 ± 0,02 | |
Тимус Thymus | 43 | 0,13 ± 0,01 | 0,1 ± 0,01 | 0,1 ± 0,01 | 0,1 ± 0,01 | 0,1 ± 0,01 | 0,1 ± 0,01 |
58 | 0,10 ± 0,01 | 0,1 ± 0,01 | 0,1 ± 0,01 | 0,1 ± 0,003 | 0,1 ± 0,01 | 0,1 ± 0,01 | |
Сердце Heart | 43 | 0,3 ± 0,01 | 0,3 ± 0,02 | 0,3 ± 0,03 | 0,3 ± 0,01 | 0,3 ± 0,01 | 0,3 ± 0,004 |
58 | 0,3 ± 0,01 | 0,3 ± 0,02 | 0,3 ± 0,01 | 0,3 ± 0,01 | 0,0 ± 0,01 | 0,3 ± 0,02 | |
Легкие Lungs | 43 | 0,6 ± 0,05 | 0,4 ± 0,03 | 0,6 ± 0,05 | 0,5 ± 0,03 | 0,5 ± 0,05 | 0,4 ± 0,03 |
58 | 0,5 ± 0,03 | 0,5 ± 0,04 | 0,5 ± 0,05 | 0,4 ± 0,04 | 0,5 ± 0,03 | 0,6 ± 0,02* | |
Почки Kidneys | 43 | 0,6 ± 0,01 | 0,6 ± 0,02 | 0,6 ± 0,02 | 0,6 ± 0,02 | 0,6 ± 0,01 | 0,5 ± 0,01 |
58 | 0,6 ± 0,02 | 0,6 ± 0,03 | 0,6 ± 0,01 | 0,6 ± 0,01 | 0,6 ± 0,03 | 0,6 ± 0,02 | |
Надпочечники Adrenal glands | 43 | 0,02 ± 0,002 | 0,01 ± 0,001 | 0,02 ± 0,001 | 0,01 ± 0,001 | 0,02 ± 0,001 | 0,01 ± 0,001 |
58 | 0,02 ± 0,003 | 0,01 ± 0,001 | 0,02 ± 0,002 | 0,01 ± 0,001 | 0,02 ± 0,002 | 0,01 ± 0,001 | |
Печень Liver | 43 | 2,4 ± 0,05 | 2,5 ± 0,08 | 2,4 ± 0,06 | 2,4 ± 0,06 | 2,4 ± 0,06 | 2,3 ± 0,04 |
58 | 2,5 ± 0,05 | 2,4 ± 0,10 | 2,5 ± 0,13 | 2,5 ± 0,13 | 2,8 ± 0,13 | 2,3 ± 0,05 | |
Селезенка Spleen | 43 | 0,3 ± 0,01 | 0,2 ± 0,01 | 0,3 ± 0,02 | 0,2 ± 0,01 | 0,2 ± 0,01 | 0,2 ± 0,01 |
58 | 0,3 ± 0,01 | 0,2 ± 0,01 | 0,3 ± 0,01 | 0,2 ± 0,004 | 0,3 ± 0,03* | 0,2 ± 0,02 | |
Семенники/яичники Testes/Ovaries | 43 | 0,04 ± 0,004 | 0,7 ± 0,02 | 0,04 ± 0,002 | 0,7 ± 0,03 | 0,04 ± 0,002 | 0,7 ± 0,02 |
58 | 0,04 ± 0,002 | 0,7 ± 0,03 | 0,04 ± 0,005 | 0,7 ± 0,01 | 0,04 ± 0,001 | 0,8 ± 0,03 | |
Примечание. * ‒ статистически значимое различие в сравнении с контролем по t-критерию Стьюдента (р < 0,05).
Note. * ‒ statistically significant difference compared to the control according to Student’s t-test (p < 0.05).
В опытной группе крыс, которым вводили интраназально VLP-вакцину в двойной прививочной дозировке (160 мкг антигена в дозе), было выявлено увеличение в 1,5 раза относительной массы селезенок у самок и легких у самцов по сравнению с контрольной группой. Несмотря на то что увеличение было статистически значимым, значения не выходили за границы физиологических норм для лабораторных крыс [15, 16].
При визуальной оценке, цитологическом и гистологическом анализе места введения вакцины не было выявлено местно-раздражающего действия.
Обсуждение
Несмотря на ограниченные данные по безопасности вакцин против SARS-CoV-2, их применение в условиях пандемии было необходимо. При этом развитие в последующем нежелательных явлений и тяжелых осложнений у добровольцев неблагоприятно сказывается на доверии населения к вакцинации. Библиометрический анализ 1312 исследований вакцин от COVID-19, проведенный Y. Chen и соавт., показал, что они в первую очередь сосредоточены на клинических испытаниях [17], в то время как доклинические исследования безопасности практически не освещаются.
Ранее было показано, что одобренные к применению вакцины на основе VLP: против вируса папиломы человека (Gardasil, Gardasil9, Cervarix), гепатита В (Sci-B-Vac), гепатита Е (Hecolin) и малярии (Mosquirix), зарекомендовали себя как безопасные, иммуногенные и эффективные [18]. Все эти вакцины вводятся внутримышечно, так же как и 7 VLP-вакцин против COVID-19, которые находятся на разных стадиях клинических исследований1. Разработка вакцин против SARS-CoV-2 с интраназальным способом введения все больше привлекает интерес исследователей разных стран и, несмотря на разнообразие возможных платформ, преимущественно это векторные вакцины [19]. Создание поливалентных вакцин для профилактики COVID-19, эффективных в отношении новых вариантов SARS-CoV-2, по-прежнему является актуальной задачей [20]. Одним из важных этапов разработки вакцин является изучение безопасности, в том числе определение острой и хронической токсичности, поэтому были проведены доклинические исследования безопасности ранее разработанных, полученных и охарактеризованных VLP [21] при интраназальном способе введения.
В соответствии с Руководством по проведению доклинических исследований лекарственных средств под ред. А.Н. Миронова [10], исследования на животных предоставляют наиболее полную информацию о токсических свойствах тестируемой вакцины, которую предполагается применять у человека. Мыши и крысы являются стандартными объектами токсикологических исследований в количестве, достаточном для полной регистрации изучаемых эффектов и статистической обработки полученных данных.
В настоящей работе приведены результаты исследований острой (мыши) и субхронической (крысы) токсичности с оценкой местной переносимости, проведенных на аутбредных животных (для исключения генотипической зависимости) обоего пола, с разбросом по массе тела менее 10% и количестве, достаточном для статистической обработки результатов, но не превышающем этически допустимые количества для формирования опытных и контрольных групп.
При исследовании острой токсичности на мышах вводили однократно интраназально VLP-вакцину с концентрацией 200 мг антигена в дозе препарата, что превышает более чем в 2000 раз прививочную дозу для человека. Исследуемая вакцина оказалась нетоксична, отсутствовали признаки интоксикации и гибель животных, в связи с чем подсчет летальных доз был невозможен. Полученные результаты совпадают с данными, которые были получены другими исследователями [22, 23], они также не смогли провести расчеты летальных доз из-за отсутствия смертности исследуемых животных. Это подтверждает низкую токсичность вакцин на основе VLP.
В доклинических исследованиях субхронической токсичности крысам вводили одну прививочную дозу вакцины, рассчитанную для человека (80 мкг), и удвоенную дозу (160 мкг). Примечательно, что, как и в случае с исследованием на мышах, различий по исследуемым показателям между группами не было. При этом в случае введения двойной прививочной дозы препарата крысам через сутки после последней иммунизации (43-и сутки) у самцов отмечалось проходящее статистически значимое увеличение количества тромбоцитов менее чем в 2 раза, а на 58-е сутки выявлено увеличение почти в 1,5 раза селезенок у самок и легких у самцов, но поскольку эти значения не превышали физиологические нормы для лабораторных крыс [15, 16], то полученные отклонения можно отнести к флуктуационным изменениям, не связанным с вакцинацией. При визуальной оценке, цитологическом и гистологическом анализе места введения вакцины не было выявлено местно-раздражающего действия. Доклинические исследования, представленные Иранскими исследователями, показали, что субъединичная вакцина с гетерологичным методом вакцинации «прайм-буст», когда животным вводили две дозы вакцины внутримышечно, а одну дозу интраназально, не показала никаких изменений в общих клинических наблюдениях; массе тела и потреблении пищи, клинических показателях, гематологическом исследовании, химическом анализе крови и патологическом исследовании жизненно важных органов. Была установлена безопасность вакцины после введения однократной и повторной дозы препарата [23].
Непрерывная оценка безопасности вакцин крайне необходима, а ее результаты следует распространять для укрепления доверия к программам иммунизации для повышения приверженности общества вакцинопрофилактике [24].
Интраназальная иммунизация продемонстрировала многообещающую способность стимулировать секреторный иммунитет слизистых оболочек наряду с индукцией гуморального и клеточного иммунитета, а также имеет дополнительное преимущество простоты введения и дозирования по сравнению с парентеральными формами введения.
Продемонстрированная в настоящем исследовании безопасность при изучении острой и субхронической токсичности четырехвалентной вакцины на основе VLP для профилактики COVID-19 интраназального применения позволяет проводить дальнейшую разработку этого лекарственного препарата в широких доклинических и последующих клинических исследованиях.
Заключение
Представленное исследование острой и субхронической токсичности с оценкой местной переносимости четырехвалентной VLP-вакцины против COVID-19 является частью доклинических исследований безопасности, иммуногенности и эффективности интраназальной вакцины на основе VLP против COVID-19. Концепция и дизайн исследования были сформированы с учетом требований МЗ РФ, стандартов в области доклинического изучения безопасности новых фармакологических средств – системы GLP (Good Laboratory Practice) и руководства по проведению доклинических исследований лекарственных средств под ред. А.Н. Миронова.
Как исследование острой токсичности на аутбредных мышах, так и исследование субхронической токсичности на аутбредных крысах продемонстрировало безопасность четырехвалентной вакцины на основе VLP для профилактики COVID-19. Было показано, что инстилляции в нос (прививочной дозы, двойной прививочной дозы и дозировки антигена, превышающей более чем в 2000 раз прививочную дозу для человека) не оказывают токсического действия на организм лабораторных животных – крыс и мышей. А отмеченные незначительные изменения носили преходящий характер и не выходили за границы физиологической нормы.
1 https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines, дата обращения 05.11.2024
2 Национальный стандарт Российской Федерации (ГОСТ 33044-2014) «Принципы надлежащей лабораторной практики».
3 Национальный стандарт РФ ГОСТ Р 56701-2015 от 01.07.2016 «Лекарственные средства для медицинского применения. Руководство по планированию доклинических исследований безопасности с целью последующего проведения клинических исследований и регистрации лекарственных средств».
Об авторах
Яна Юрьевна Чернорыж
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: revengeful_w@mail.ru
ORCID iD: 0000-0001-9848-8515
SPIN-код: 3576-8760
Scopus Author ID: 57203299151
ResearcherId: AAI-7206-2020
канд. мед. наук, научный сотрудник лаборатории молекулярной диагностики
Россия, 123098, г. МоскваВалерия Михайловна Кондратьева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: 1999valeriak@mail.ru
ORCID iD: 0000-0001-9163-4516
аспирант лаборатории молекулярной диагностики
Россия, 123098, г. МоскваАнастасия Павловна Малкова
Институт медико-АНО «Институт медико-биологических исследований и технологий» (АНО «ИМБИИТ»)
Email: nastena0302@yandex.ru
ORCID iD: 0000-0002-2817-4817
заведующая лабораторией биологических исследований
Россия, 143090, г. Краснознаменск, Московская обл.Татьяна Евгеньевна Савочкина
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: tasavochkina@yandex.ru
ORCID iD: 0000-0003-4366-8476
младший научный сотрудник лаборатории молекулярной диагностики
Россия, 123098, г. МоскваОлеся Васильевна Елисеева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: olesenka80@mail.ru
ORCID iD: 0000-0002-0723-9749
канд. биол. наук, старший научный сотрудник лаборатории молекулярной диагностики
Россия, 123098, г. МоскваОлег Евгеньевич Латышев
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: oleglat80@mail.ru
ORCID iD: 0000-0002-5757-3809
канд. биол. наук, старший научный сотрудник лаборатории молекулярной диагностики
Россия, 123098, г. МоскваДмитрий Юрьевич Якунин
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: yd364@mail.ru
ORCID iD: 0009-0009-4531-5739
аспирант лаборатории молекулярной диагностики
Россия, 123098, г. МоскваОльга Николаевна Зайкова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: zaykova_o_n@mail.ru
ORCID iD: 0000-0003-4708-2069
канд. биол. наук, старший научный сотрудник лаборатории молекулярной диагностики
Россия, 123098, г. МоскваЕкатерина Сергеевна Слуднякова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: ekaterina.ses@mail.ru
ORCID iD: 0009-0000-4925-5205
ведущий инженер по внедрению научных разработок
Россия, 123098, г. МоскваТатьяна Владимировна Гребенникова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: t_grebennikova@mail.ru
ORCID iD: 0000-0002-6141-9361
д-р биол. наук, профессор, чл.-корр. РАН, заместитель директора по научной работе подразделения Института вирусологии им. Д.И. Ивановского, руководитель Испытательного центра
Россия, 123098, г. МоскваСписок литературы
- Fernandes Q., Inchakalody V.P., Merhi M., Mestiri S., Taib N., Moustafa Abo El-Ella D., et al. Emerging COVID-19 variants and their impact on SARS-CoV-2 diagnosis, therapeutics and vaccines. Ann. Med. 2022; 54(1): 524–40. https://doi.org/10.1080/07853890.2022.2031274
- Гребенникова Т.В., Елисеева О.В., Латышев О.Е., Савочкина Т.Е., Цибезов В.В., Черепушкин С.А. и др. Рекомбинантные вирусоподобные частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2. Патент RU 2769224 C1; 2022. https://elibrary.ru/prmwjl
- Гребенникова Т.В., Елисеева О.В., Латышев О.Е., Черепушкин С.А., Цибезов В.В., Лебедева В.В. и др. Вирусоподобные химерные частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2, содержащие белки коронавируса и ротавируса. Патент RU 2779810 C1; 2022.
- Гуськова Т.А., Сюбаев Р.Д. Токсикологические аспекты одновременного использования различных лекарственных средств. Токсикология лекарственных средств. М.: Русский врач; 2003: 116–40.
- Западнюк И.П., Западнюк В.И., Захария Е.А. Лабораторные животные, их разведение и использование в эксперименте. Киев; 1982.
- Международные рекомендации по проведению медико-биологических исследований с использованием животных. Ланимагология. 1993; (1): 29.
- Меньшиков В.В. Лабораторные методы исследования в клинике. М.; 1987.
- Назаренко Г.И., Кишкун А.А. Клиническая оценка результатов лабораторных исследований: Практическое руководство. М.: Медицина; 2007.
- Трахтенберг И.М. Проблемы нормы в токсикологии. М.; 1991.
- Миронов А.Н. ред. Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012.
- Миронов А.Н., Меркулов В.А. Руководство по экспертизе лекарственных средств. Том 3. М.: Полиграф-Плюс; 2014.
- Гарбер Д.С., Барби Р.В., Билицки Д.T., Клейтон Ли.Э., Донован Д.К., Кон Д.Ф. и др. Руководство по содержанию и использованию лабораторных животных. М.: ИРБИС; 2017. https://elibrary.ru/zrjvdj
- WHO. Guidelines on the non-clinical evaluation of vaccine adjuvants and adjuvanted vaccines; 2014. Available at: https://who.int/publications/m/item/nonclinical-evaluation-of-vaccine-adjuvants-and-adjuvanted-vaccines-annex-2-trs-no-987
- Требования Международного комитета по науке по использованию в экспериментальных исследованиях лабораторных животных. Бюллетень ИКЛАС. 1978; (24): 4–5.
- Линева А. Физиологические показатели нормы животных. Справочник. М.: Аквариум ЛТД; 2003.
- Абрашова Т.В., Гущин Я.А., Ковалева М.А., Рыбакова А.В., Селезнева А.И., Соколова А.П. и др. Справочник. Физиологические, биохимические и биометрические показатели нормы экспериментальных животных. СПб.: ЛЕМА; 2013. https://elibrary.ru/ptsruo
- Chen Y., Cheng L., Lian R., Song Z., Tian J. COVID-19 vaccine research focusses on safety, efficacy, immunoinformatics, and vaccine production and delivery: a bibliometric analysis based on VOSviewer. Biosci. Trends. 2021; 15(2): 64–73. https://doi.org/10.5582/bst.2021.01061
- Nooraei S., Bahrulolum H., Hoseini Z.S., Katalani C., Hajizade A., Easton A.J., et al. Virus-like particles: preparation, immunogenicity and their roles as nanovaccines and drug nanocarriers. J. Nanobiotechnology. 2021; 19(1): 59. https://doi.org/10.1186/s12951-021-00806-7.
- Bai Z., Wan D., Lan T., Hong W., Dong H., Wei Y., et al. Nanoplatform based intranasal vaccines: current progress and clinical challenges. ACS Nano. 2024; 18(36): 24650–81. https://doi.org/10.1021/acsnano.3c10797.
- Marks P.W., Gruppuso P.A., Adashi E.Y. Urgent need for next-generation COVID-19 vaccines. JAMA. 2023; 329(1): 19–20. https://doi.org/10.1001/jama.2022.22759
- Латышев О.Е., Зайкова О.Н., Елисеева О.В., Савочкина Т.Е., Чернорыж Я.Ю., Сыроешкин А.В. и др. Разработка, получение и характеристика вирусоподобных частиц SARS-CoV-2 (Coronaviridae: orthocoronavirinae: betacoronavirus: sarbecovirus). Вопросы вирусологии. 2024; 69(2): 175–86. https://doi.org/10.36233/0507-4088-226 https://elibrary.ru/gkxfed
- Banihashemi S.R., Es-Haghi A., Fallah Mehrabadi M.H., Nofeli M., Mokarram A.R., Ranjbar A., et al. Safety and efficacy of combined intramuscular/intranasal RAZI-COV PARS vaccine candidate against SARS-CoV-2: A preclinical study in several animal models. Front. Immunol. 2022; 13: 836745. https://doi.org/10.3389/fimmu.2022.836745
- Vakhrusheva A.V., Kudriavtsev A.V., Kryuchkov N.A., Deev R.V., Frolova M.E., Blagodatskikh K.A., et al. SARS-CoV-2 subunit virus-like vaccine demonstrates high safety profile and protective efficacy: preclinical study. Vaccines (Basel). 2022; 10(8): 1290. https://doi.org/10.3390/vaccines10081290
- Антонова Н.А., Ерицян К.Ю. Систематический обзор эмпирических исследований факторов отказа от вакцинации. Гигиена и санитария. 2018; 97(7): 664–70. https://doi.org/10.18821/0016-9900-2018-97-7-664-670 https://elibrary.ru/uxaexo
Дополнительные файлы