Анализ ассоциации клинического течения гриппа с однонуклеотидным полиморфизмом генов, влияющих на продукцию интерферона-λ3
- Авторы: Николаева Л.И.1, Стучинская М.Д.1, Телепенина К.П.1, Шевченко Н.Г.1, Куприянов В.В.1, Краснослободцев К.Г.1, Мукашева Е.А.1, Трушакова С.В.1, Хлопова И.Н.1, Кружкова И.С.1, Кистенева Л.Б.1, Колобухина Л.В.1, Бурцева Е.И.1
-
Учреждения:
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
- Выпуск: Том 70, № 1 (2025)
- Страницы: 25-34
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16691
- DOI: https://doi.org/10.36233/0507-4088-271
- EDN: https://elibrary.ru/hnrscv
- ID: 16691
Цитировать
Аннотация
Введение. Предрасположенность к разному течению инфекционного процесса во многом связана с полиморфизмом генома человека, особенно генов, кодирующих белки иммунной системы. На ранних этапах гриппозной инфекции существенную роль в ограничении репликации вируса выполняют компоненты врожденного иммунитета – интерфероны I (α/β) и III (λ) типа.
Цель работы – изучить ассоциации однонуклеотидных полиморфизмов (ОНП) генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) с разным течением гриппозной инфекции и выявить генетические маркеры осложненного внебольничной пневмонией гриппа. Отмеченные выше гены влияют на продукцию интерферона-λ3.
Материалы и методы. Исследованы образцы от 456 пациентов с легким (n = 150), среднетяжелым (n = 173) и тяжелым (n = 133) течением гриппа. Вирусную РНК выявляли методами обратной транскрипции и полимеразной цепной реакции (ПЦР). ОНП генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) устанавливали с помощью ПЦР. При анализе ассоциаций ОНП генов использовали программу SNPStats.
Результаты. У пациентов с генотипом С/Т или T/T по гену IFNL4 (rs12979860 C/T) чаще выявляли пневмонию, чем при генотипе С/С (ОШ 2,47 (1,31–4,63); р = 0,0044; q = 0,0059). Наличие одного аллеля Т увеличивало риск развития пневмонии (ОШ 2,02 (1,05–4,02); р = 0,006; q = 0,008). При генотипе Т/Т риск повышался более чем в 2 раза: ОШ 2,14 (1,31–3,48). Анализ ОНП гена IFNL3 (rs8099917 T/G) выявил более слабо выраженную ассоциацию G-аллеля с пневмонией (ОШ 1,86 (1,04–3,31); р = 0,03; q = 0,045).
Заключение. Генетическими маркерами повышенного риска внебольничной пневмонии при гриппе является наличие T-аллеля в гене IFNL4 (rs12979860 C/T) и в меньшей значимости G-аллеля в гене IFNL3 (rs8099917 T/G). Носители этих аллелей имеют повышенный риск развития пневмонии при гриппе, особенно в пожилом возрасте.
Ключевые слова
Полный текст
Введение
Вирусы гриппа А и В ежегодно вызывают эпидемические подъемы заболеваемости людей. Вирусы гриппа А ответственны также за эпизоотии среди птиц и некоторых видов млекопитающих. Ежегодно во всем мире регистрируют около 1 млрд случаев гриппа у людей, из которых 3–5 млн имеют тяжелое течение, количество смертельных исходов колеблется, в зависимости от сезона, от 290 до 650 тыс. случаев1 [1]. В нашей стране ежегодно грипп и другие респираторные вирусные инфекции регистрируются в среднем у 30 млн человек, а ежегодный экономический ущерб составляет около 40 млрд рублей [2].
Наиболее часто грипп осложняется развитием внебольничной пневмонии, которая выявляется у значительной доли госпитализированных больных и может привести к летальному исходу [3]. После окончания эпидемии гриппа в течение 2–3 мес регистрируется дополнительная (отсроченная) смертность от этой инфекции у пациентов групп риска, имеющих в анамнезе заболевания сердца, легких и ряда других органов. Экспертами рассчитано, что смертность после перенесенного гриппа может увеличиваться у лиц с хронической сердечно-сосудистой патологией в 52 раза, а при хронических легочных заболеваниях – в 120 раз [4].
Последняя пандемия гриппа, объявленная Всемирной организацией здравоохранения в 2009 г., была вызвана штаммом A(H1N1)pdm09, в структуре генома которого присутствовали гены свиного, птичьего и сезонного гриппа человека. Пандемия A(H1N1)pdm09 затронула все возрастные группы населения и имела более тяжелые последствия, чем предыдущие. В настоящее время очевидную опасность представляет птичий вирус гриппа типа А, имеющий варианты гемагглютина H5 и Н7 [5]. Зарегистрированы случаи инфицирования людей этими вирусами гриппа после контакта с больными птицами, которые завершились летально в 30–50% случаев. Причинами летальных исходов при инфицировании птичьим вирусом гриппа А(H5N1) считают тропизм вируса к рецепторам тканей разных органов, его более интенсивную репликацию и гипервоспалительный иммунный ответ больных людей [5, 6].
Реакции иммунной системы человека на многие патогены и на гриппозные антигены, в частности, зависят от вариабельности (полиморфизма) генома, что обусловливает определенную предрасположенность к разному течению инфекционного процесса. В ограничении репликации вируса гриппа на ранних этапах инфекции существенную роль выполняют интерфероны (ИФН) I и III типа. Как компоненты врожденного иммунитета, они до формирования адаптивного иммунного ответа запускают продукцию цитокинов, хемокинов, стимулируют привлечение нейтрофилов, моноцитов, NK-клеток к очагу воспаления и индуцируют биосинтез внутриклеточных противовирусных белков.
ИФН III типа были идентифицированы в 2003 г. при анализе новых белков, открытых благодаря проекту «Геном человека», и классифицированы как интерлейкин (IL) 28А, IL-28В и IL-29 [7]. Впоследствии, в 2012 г., эти цитокины были переименованы по рекомендации комитета по номенклатуре при HUGO (Human Genome Organization) в ИФН-λ1 (IL-29), ИФН-λ2 (IL-28А), ИФН-λ3 (IL-28В). Установлено, что ИФН III типа вырабатываются несколько раньше ИФН I типа и обеспечивают защиту эпителия дыхательных путей [8, 9]. Рекомбинантные ИФН III типа могут эффективно ограничивать гриппозную инфекцию у лабораторных мышей [10, 11]. Показана возможность создания лекарственного препарата на основе пегилированной формы ИФН III типа для терапии вирусного респираторного заболевания COVID-19 [12].
Около гена, кодирующего ИФН-λ3, выявлены однонуклеотидные полиморфизмы (ОНП), влияющие на продукцию этого цитокина [13]. Наиболее значимыми для ряда вирусных инфекций являются ОНП, локализованные выше гена IFNL3 (rs8099917 T/G), в интроне гена IFNL4 (rs12979860 С/Т) и в экзоне гена IFNL4 (rs368234815 ΔG/TT) [7]. На содержание в сыворотке крови ИФН-λ3 оказывают влияние ОНП генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 С/Т). С учетом всего вышеизложенного и факта, что вклад ОНП отмеченных выше генов в развитие тяжелого течения гриппа у жителей нашей страны практически не изучен, в настоящем исследовании были выбраны для анализа потенциально возможные ассоциации вариабельных локусов генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) с клиническими вариантами течения гриппозной инфекции.
Основная цель исследования – выявить маркеры тяжелого течения гриппа по вариабельным локусам генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T).
Материалы и методы
Пациенты и группы. Биологический материал (кровь и носоглоточные смывы) был собран в период с октября 2020 г. по май 2024 г. от взрослых больных. Все пациенты имели вирусологически подтвержденный диагноз «грипп». Исследование проводили при добровольном информированном согласии пациентов. Протокол исследования одобрен этическим комитетом ГБУЗ ИКБ № 1 (протокол № 11/А от 16.10.2020 и № 8 от 28.12.2022). В 1-ю группу вошли 150 пациентов, имевших легкое течение гриппа. Возрастной диапазон – 20–84 лет, средний возраст – 44,6 года, соотношение мужчин и женщин: 46,7% к 53,3%. Во 2-ю группу включили 173 пациентов, госпитализированных со среднетяжелым гриппом без внебольничной пневмонии. Возрастной диапазон – 18–89 лет, средний возраст – 41,4 года, соотношение мужчин и женщин: 46,8% к 53,2%. В 3-ю группу включили 133 пациентов, госпитализированных с тяжелым течением гриппозной инфекции и внебольничной пневмонией. Возрастной диапазон – 18–94 лет, средний возраст – 53 года, соотношение мужчин и женщин: 57,1% к 42,9%. Анализируемые группы пациентов были сопоставимы по гендерному составу и по возрастному диапазону (для всех групп р > 0,05). Общее число пациентов составило 456 человек (226 мужчин и 230 женщин), что позволило получить статистические данные с уровнем значимости 0,05 и доверительным интервалом 4,59 [14].
Идентификацию и типирование генома вируса гриппа в носоглоточных смывах проводили методом, сочетающим обратную транскрипцию и полимеразную цепную реакцию (ПЦР), с помощью тест-систем «АмплиСенс Influenza viruses A/B», «АмплиСенс Influenza viruses A/H1-swine-FL», «АмплиСенс Influenza viruses A-тип FL», согласно рекомендациям производителя (ЦНИИЭ Роспотребнадзора, Россия).
Для анализа аллельных вариантов полиморфных зон генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 С/Т) выделяли ДНК из клеток венозной крови, используя набор реагентов «Проба-Рапид-Генетика» («ДНК-технология», Россия). Определение генотипов в полиморфных зонах генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 С/Т) выполняли методом ПЦР, используя набор реагентов «Иммуногенетика IL28B» («ДНК-технология», Россия).
При статистическом анализе использовали пакет программ Statistica v. 10 (StatSoft, США). Для оценки достоверности различий анализируемых параметров в группах пациентов применяли критерий χ2 и точный метод Фишера. Для анализа ассоциации аллельных вариантов полиморфных зон генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 С/Т) в разных группах пациентов использовали программу SNPStats (https://www.snpstats.net/). Группы сравнивали по 5 возможным моделям наследования: кодоминантной, доминантной, рецессивной, сверхдоминантной и лог-аддитивной. Поправку q-значение на множественные сравнения (для оценки вероятности отклонения нулевой гипотезы) рассчитывали, используя калькулятор https://www.sdmproject.com/utilities/?show=FDR. Для оценки значимости различий рассчитывали 95% доверительный интервал (95% ДИ, 95% CI), отношение шансов (ОШ, OR) и информационный критерий Акаике (ИКА, AIC). Различия признавали достоверными при величине p < 0,05.
Результаты
На 1-м этапе исследования было выполнено сравнение генетических показателей по анализируемым генам в группах пациентов, различающихся по клиническому течению гриппозной инфекции. С этой целью данные генотипирования 1-й группы (легкое течение) были сопоставлены с соответствующими показателями 2-й группы (среднетяжелое течение, табл. 1) и с показателями 3-й группы (тяжелое течение, табл. 2).
Таблица 1. Результаты анализа генотипов в полиморфных локусах генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) у пациентов с легким и среднетяжелым течением гриппа
Table 1. Results of genotype analysis in polymorphic loci of IFNL3 (rs8099917 T/G) and IFNL4 (rs12979860 C/T) genes in patients with mild and moderate influenza
Модель aнализа Analysis model | Генотипы Genotypes | 1-я группа (n = 150), абс. (%) 1st group (n = 150), abs. (%) | 2-я группа (n = 173), абс. (%) 2nd group (n = 173), abs. (%) | ОШ (95% ДИ) OR (95% CI) | Значение р p-value | ИКА AIC |
Ген / Gene IFNL4 | ||||||
Кодоминантная Codominant | С/С C/T T/T | 77 (51,3) 58 (38,7) 15 (10,0) | 94 (54,3) 63 (36,4) 16 (9,2) | 1,00 1,12 (0,70–1,79) 1,14 (0,53–2,46) | 0,86 | 451,8 |
Доминантная Dominant | С/С С/Т – T/T | 77 (51,3) 73 (48,7) | 94 (54,3) 79 (45,7) | 1,00 1,13 (0,73–1,75) | 0,59 | 449,8 |
Рецессивная Recessive | C/C – C/T T/T | 135 (90,0) 15 (10,0) | 157 (90,8) 16 (9,2) | 1,00 1,09 (0,52–2,29) | 0,83 | 450,1 |
Сверхдоминантная Overdominant | С/С – Т/Т C/T | 92 (61,3) 58 (38,7) | 110 (63,6) 63 (36,4) | 1,00 1,10 (0,70–1,73) | 0,68 | 450 |
Лог-аддитивная Log-additive | – | – | – | 1,09 (0,78–1,52) | 0,61 | 449,9 |
Ген / Gene IFNL3 | ||||||
Кодоминантная Codominant | T/T T/G G/G | 108 (72,0) 39 (26,0) 3 (2,0) | 123 (71,1) 46 (26,6) 4 (2,3) | 1,00 0,97 (0,59–1,59) 0,85 (0,19–3,90) | 0,97 | 452,1 |
Доминантная Dominant | T/T T/G – G/G | 108 (72,0) 42 (28,0) | 123 (71,1) 50 (28,9) | 1,00 0,96 (0,59–1,55) | 0,86 | 450,1 |
Рецессивная Recessive | T/T – T/G G/G | 147 (98,0) 3 (2,0) | 169 (97,7) 4 (2,3) | 1,00 0,86 (0,19–3,92 | 0,85 | 450,1 |
Сверхдоминантная Overdominant | T/T – G/G T/G | 111 (74,0) 39 (26,0) | 127 (73,4) 46 (26,6) | 1,00 0,97 (0,59–1,59) | 0,9 | 450,1 |
Лог-аддитивная Log-additive | – | – | – | 0,95 (0,62–1,47) | 0,83 | 450,1 |
Таблица 2. Результаты анализа генотипов в полиморфных локусах генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) у пациентов с легким и тяжелым течением гриппа
Table 2. Results of genotype analysis in polymorphic loci of IFNL3 (rs8099917 T/G) and IFNL4 (rs12979860 C/T) genes in patients with mild and severe influenza
Модель aнализа Analysis model | Генотипы Genotyp | 1-я группа (n = 150), абс. (%) 1st group (n = 150), abs. (%) | 3-я группа (n = 133), абс. (%) 3rd group (n = 133), abs. (%) | ОШ (95% ДИ) OR (95% CI) | Значение р p-value | ИКА AIC |
Ген / Gene IFNL4 | ||||||
Кодоминантная Codominant | С/С C/T T/T | 77 (51,3) 58 (38,7) 15 (10,0) | 61 (45,9) 53 (39,9) 19 (14,3) | 1,00 1,15 (0,70–1,90) 1,60 (0,75–3,40) | 0,46 | 395,8 |
Доминантная Dominant | С/С С/Т – T/T | 77 (51,3) 73 (48,7) | 61 (45,9) 72 (54,1) | 1,00 1,25 (0,78–1,99) | 0,36 | 394,5 |
Рецессивная Recessive | C/C – C/T T/T | 135 (90,0) 15 (10,0) | 114 (85,7) 19 (14,3) | 1,00 1,50 (0,73–3,09) | 0,27 | 394,1 |
Сверхдоминантная Overdominant | С/С –Т/Т C/T | 92 (61,3) 58 (38,7) | 80 (60,1) 53 (39,9) | 1,00 1,05 (0,65–1,69) | 0,84 | 395,3 |
Лог-аддитивная Log-additive | – | – | – | 1,23 (0,87–1,73) | 0,23 | 393,9 |
Ген / Gene IFNL3 | ||||||
Кодоминантная Codominant | T/T T/G G/G | 108 (72,0) 39 (26,0) 3 (2,0) | 85 (63,9) 42 (31,6) 6 (4,5) | 1,00 1,37 (0,81–2,30) 2,54 (0,62–10,46) | 0,24 | 393,4 |
Доминантная Dominant | T/T T/G – G/G | 108 (72,0) 42 (28,0) | 85 (63,9) 48 (36,1) | 1,00 1,45 (0,88–2,40) | 0,14 | 393,2 |
Рецессивная Recessive | T/T – T/G G/G | 147 (98,0) 3 (2,0) | 127 (95,5) 6 (4,5) | 1,00 2,31 (0,57–9,45) | 0,23 | 393,8 |
Сверхдоминантная Overdominant | T/T – G/G T/G | 111 (74,0) 39 (26,0) | 91 (68,4) 42 (31,6) | 1,00 1,31 (0,78–2,20) | 0,3 | 394,2 |
Лог-аддитивная Log-additive | – | – | – | 1,44 (0,93–2,23) | 0,099 | 393,6 |
Как следует из данных табл. 1 и 2, значимых различий в частоте встречаемости отдельных генотипов в 3 сравниваемых группах, различающихся по клиническому течению гриппозной инфекции, не выявлено. Однако наблюдалось снижение доли генотипа СС (rs12979860 C/T) в гене IFNL4 и генотипа ТТ (rs8099917 T/G) в гене IFNL3 от 1-й группы к 3-й.
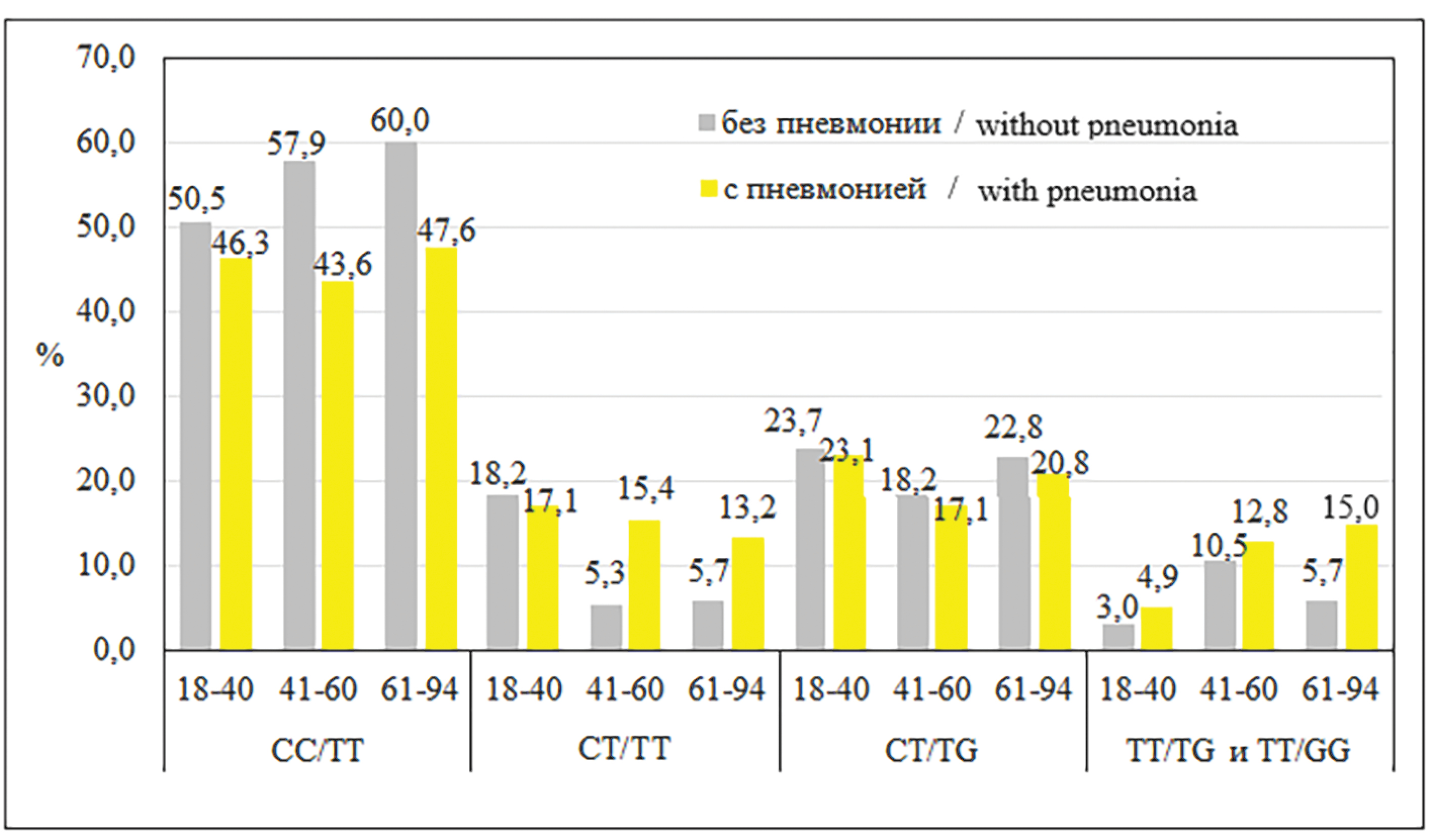
На следующем этапе исследования был выбран другой критерий: «есть пневмония» или «нет пневмонии», и сопоставлены генотипы групп со среднетяжелым и тяжелым течением с учетом этого критерия. Но предварительно было оценено влияние возраста на развитие пневмонии. Для этого были выделены возрастные подгруппы пациентов: 1) 18–40 лет (n = 140), 2) 41–60 лет (n = 78), 3) 61–94 лет (n = 88). На рисунке представлено распределение генотипов в анализируемых локусах генов по всем возрастным подгруппам больных. Визуально заметно, что генотип СС/ТТ чаще выявляется у лиц без пневмонии во всех возрастных подгруппах. Появление Т-аллеля изменило соотношение случаев «есть пневмония – нет пневмонии», генотип СТ/ТТ стал чаще определяться у лиц с пневмонией старше 40 лет. При генотипе СТ/TG частота случаев с пневмонией и без нее была очень близкой. Частоты обнаружения пневмонии при генотипах TT/TG и TT/GG были близкими в сравниваемых возрастных подгруппах.
Рисунок. Распределение генотипов по локусам генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) с учетом возрастных подгрупп.
Проценты рассчитаны на всю группу. Генотип ТТ/ТТ не включен из-за малочисленности.
Figure. Distribution of genotypes by loci of the IFNL3 (rs8099917 T/G) and IFNL4 (rs12979860 C/T) genes, taking into account age subgroups.
The percentages are calculated for the entire group. The TT/TT genotype is not included due to the small number.
Доля пациентов с пневмонией в возрастной подгруппе 18–40 лет составила 29,3% (n = 41), в подгруппе 41–60 лет – 51,3% (n = 40), а в подгруппе 61–94 лет – 60,2% (n = 53). Частота встречаемости пневмонии в подгруппе 18–40 лет была достоверно меньше, чем в подгруппе 41–60 лет (р = 0,0021) и в подгруппе 61–94 лет (р < 0,0001). Учитывая такое различие в обнаружении пневмонии, далее проанализировали ОНП генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) в подгруппе пациентов до 40 лет включительно (n = 140, пневмония у 41) и в объединенных подгруппах пациентов старше 40 лет (n = 166, пневмония у 93). В подгруппе 18–40 лет не обнаружено достоверных различий при анализе ОНП генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) у пациентов с пневмонией относительно участников без пневмонии (данные не приведены). Результаты аналогичного анализа пациентов в возрасте 41 года и старше для объединенных подгрупп представлены в табл. 3.
Таблица 3. Результаты анализа генотипов в полиморфных локусах генов IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 C/T) у пациентов от 41 года и старше
Table 3. Results of genotype analysis in polymorphic loci of IFNL3 (rs8099917 T/G) and IFNL4 (rs12979860 C/T) genes in patients from 41 years old and above
Модель aнализа Analysis model | Генотипы Genotyp | Пациенты без пневмонии (n = 73), абс. (%) Patients without pneumonia (n = 73), abs. (%) | Пациенты с пневмонией (n = 93), абс. (%) Patients with pneumonia (n = 93), abs. (%) | ОШ (95% ДИ) OR (95% CI) | Значение р (q) p-value (q) | ИКА AIC |
Ген / Gene IFNL4 | ||||||
Кодоминантная Codominant | С/С C/T T/T | 46 (63,0) 23 (31,5) 4 (5,5) | 38 (40,9) 39 (41,9) 16 (17,2) | 1,00 2,02 (1,05–4,02) 4,84 (1,49–15,71) | 0,006 (0,008) | 223,5 |
Доминантная Dominant | С/С С/Т – T/T | 46 (63,0) 27 (37,0) | 38 (40,9) 55 (59,1) | 1,00 2,47 (1,31–4,63) | 0,0044 (0,0059) | 223,6 |
Рецессивная Recessive | C/C – C/T T/T | 69 (94,5) 4 (5,5) | 77 (82,8) 16 (17,2) | 1,00 3,58 (1,14–11,24) | 0,017 (0,0227) | 226 |
Сверхдоминантная Overdominant | С/С – Т/Т C/T | 50 (68,5) 23 (31,5) | 54 (58,1) 39 (41,9) | 1,00 1,57 (0,83–2,99) | 0,17 | 229,8 |
Лог-аддитивная Log-additive | – | – | – | 2,14 (1,31–3,48) | 0,0014 (0,0019) | 221,5 |
Ген / Gene IFNL3 | ||||||
Кодоминантная Codominant | T/T T/G G/G | 55 (75,3) 17 (23,3) 1 (1,4) | 58 (62,4) 28 (30,1) 7 (5,5) | 1,00 1,56 (0,77–3,17) | 0,066 | 228,3 |
Доминантная Dominant | T/T T/G – G/G | 55 (75,3) 18 (24,7) | 58 (62,4) 35 (37,6) | 1,00 1,84 (0,94–3,63) | 0,073 | 228,5 |
Рецессивная Recessive | T/T – T/G G/G | 72 (98,6) 1 (1,4) | 86 (92,5) 7 (7,5) | 1,00 5,86 (0,70–48,76 | 0,049 (0,065) | 227,8 |
Сверхдоминантная Overdominant | T/T – G/G T/G | 56 (76,7) 17 (23,3) | 65 (69,9) 28 (30,1) | 1,00 1,42 (0,70–2,86) | 0,32 | 230,0 |
Лог-аддитивная Log-additive | – | – | – | 1,00 1,86 (1,04–3,31) | 0,03 (0,045) | 227,0 |
Из данных табл. 3 следует, что у пациентов с генотипом С/Т или T/T по полиморфному локусу (rs12979860 C/T) гена IFNL4 достоверно чаще развивалась пневмония, чем при генотипе С/С (ОШ 2,47 (1,31–4,63); р = 0,0044; q = 0,0059). Изменения риска развития пневмонии происходило при появлении одного неблагоприятного аллеля Т (ОШ 2,02 (1,05–4,02); р = 0,006; q = 0,008). Лог-аддитивная модель выявила значимую достоверную связь (р = 0,0014; q = 0,0019) и показала, что два неблагоприятных аллеля увеличивали риск развития пневмонии более чем в 2 раза: ОШ 2,14 (1,31–3,48). У аллельных вариантов вариабельного локуса гена IFNL3 (rs8099917 T/G) выявлена слабовыраженная связь G-аллеля с пневмонией (р = 0,03; q = 0,045) в лог-аддитивной модели.
Известно, что инфицирование вирусом гриппа А(H1N1)pdm09 чаще приводит к тяжелому течению гриппа и развитию пневмонии. В этой связи в анализируемых группах и подгруппах было установлено содержание разных штаммов вируса гриппа. В группе со среднетяжелым и тяжелым течением наблюдались легкие различия: вирус гриппа А(H3N2) чаще выявляли в группе со среднетяжелым течением (49,1% против 40,6%), вирус гриппа А(H1N1)pdm09 чаще обнаруживали у пациентов с тяжелым теченим (39,1% против 28,9%), но нигде уровень статистически значимой достоверности не был достигнут (р > 0,05). Вирус гриппа B/Victoria и один случай B/Yamagata (у пациента с пневмонией) были обнаружены с близкой частотой (22,0% против 21,8%). У пациентов старше 41 года частота встречаемости этих трех штаммов вируса также не имела достоверных различий (р = 0,0922 для А(H3N2); р = 0,1295 для А(H1N1)pdm09; р = 0,9771 для вируса гриппа В). Таким образом, штаммы вируса не могли существенно повлиять на развитие пневмонии, что важно для сравниваемых подгрупп пациентов от 41 года и старше. Установлено, что частое развитие пневмонии при инфицировании вирусом А(H1N1)pdm09 свойственно варианту вируса с мутациями, приводящими к аминокислотной замене в рецептор-связывающем сайте гемагглютинина в позиции 222, где вместо остатка аспарагиновой кислоты появляются тирозин или аспарагин [15]. Однако широкого распространнения этот мутантный вариант вируса А(H1N1)pdm09 не получил.
Обсуждение
Ранее, в 2017 г., отечественные исследователи А.А. Курдин и соавт., анализируя те же гены и полиморфизмы у 100 больных гриппом со среднетяжелым и тяжелым течением и у 115 пациентов с легким течением инфекции, показали, что данные группы пациентов достоверно различались по частоте обнаружения генотипа СС (2,5% против 79,1%), СТ (95,0% против 21,7%) и ТТ (6,5% против 0%) [16]. В нашем исследовании участвовали 456 пациентов, но подобных различий не было получено (табл. 1). А.А. Курдин и соавт. не описали метод выявления генетического полиморфизма и характеристику праймеров или наборов. В 2019 г. ученые из Ирана M. Keshavarz и соавт., изучая полиморфизм генов воспалительных цитокинов и гена IFNL3 (rs8099917 Т/G) при 80 случаях тяжелого течения гриппа и 96 случаях гриппоподобных заболеваний в иранской популяции, показали, что частота аллелей T и G в сравниваемых группах достоверных различий не имела [17]. В нашем исследовании число участников было существенно больше, популяция жителей нашей страны имеет иные генетические характеристики. Но главное то, что M. Keshavarz и соавт. сделали неудачный выбор группы сравнения. Она не была контрастной к участникам с тяжелым течением гриппа (оптимально было бы использовать группу с легким течением гриппа либо лиц, редко болеющих гриппом). В исследовании M. Keshavarz и соавт. группа сравнения была сформирована из пациентов с гриппоподобными заболеваниями.
По данным настоящего исследования, тяжелое течение гриппозной инфекции, осложненное внебольничной пневмонией, достоверно реже наблюдалось у пациентов в возрасте 18–40 лет, чем в возрастных группах от 41 года и старше. У лиц старше 60 лет наиболее часто отмечалась внебольничная пневмония. Анализ групп пациентов от 41 года и старще со среднетяжелым и тяжелым течением инфекции показал, что ассоциация с развитием пневмонии наблюдалась по аллельным вариантам гена IFNL4 (rs12979860 C/T) и существенно слабее по вариабельному локусу гена IFNL3 (rs8099917 T/G). Пациенты с генотипом С/С (IFNL4, rs12979860 C/T) достоверно реже заболевали внебольничной пневмонией, чем носители других генотипов. У пациентов с генотипом С/Т достоверно чаще обнаруживали пневмонию, т.е. появление Т-аллеля повышало риск развития пневмонии. Данная закономерность не распространялась на более молодых участников (18–40 лет). Известно, что в молодом возрасте оптимально функционирует врожденный и адаптивный иммунный ответ [18]. Очевидно, поэтому в группе участников от 18 до 40 лет был снижен риск развития пневмонии. У возрастных пациентов показано снижение адаптивного иммунного ответа с сохранением врожденного звена [18]. Вероятно, поэтому нам удалось обнаружить у пациентов старше 40 лет ассоциацию ОНП генов IFNL4 (rs12979860 C/T) и IFNL3 (rs8099917 T/G), влияющих на экспрессию ИФН-λ3, с развитием пневмонии при гриппозной инфекции. По данным представленного исследования, генетическими маркерами повышенного риска развития внебольничной пневмонии при гриппе являются наличие Т-аллеля в вариабельном локусе гена IFNL4 (rs12979860 C/T) и, в меньшей значимости, G-аллеля в полиморфном локусе гена IFNL3 (rs8099917 T/G),
Заключение
Грипп может осложняться развитием внебольничной пневмонии, которая наиболее часто является причиной летального исхода при этой инфекции. В этой связи в настоящем исследовании был выполнен анализ ряда факторов, влияющих на развитие пневмонии при гриппозной инфекции. Одним из таких факторов является возраст. Лица старше 40 лет и особенно старше 60 лет наиболее подвержены гриппу, осложненному пневмонией, что еще раз подчеркивает необходимость ежегодной вакцинации этой группы лиц от гриппа. Главной целью представленного исследования было изучение роли полиморфизма генов врожденного иммунитета IFNL3 (rs8099917 T/G) и IFNL4 (rs12979860 С/Т), влияющих на продукцию ИФН-λ3, в развитии пневмонии при гриппозной инфекции. Было установлено, что из двух проанализированных генов наиболее значимы ОНП гена IFNL4 (rs12979860 С/Т). Показано, что у пациентов старше 41 года с генотипом С/Т или T/T по полиморфному локусу гена IFNL4 (rs12979860 C/T) достоверно чаще развивалась пневмония, чем при генотипе С/С (ОШ 2,47 (1,31–4,63); р = 0,0044; q = 0,0059). Появление одного неблагоприятного аллеля Т увеличивало риск развития пневмонии (ОШ 2,02 (1,05–4,02); р = 0,006; q = 0,008). Два неблагоприятных аллеля увеличивали риск более чем в 2 раза: ОШ 2,14 (1,31–3,48); р = 0,0014; q = 0,0019. У аллельных вариантов вариабельного локуса гена IFNL3 (rs8099917 T/G) выявлена более слабо выраженная связь G-аллеля с пневмонией (ОШ 1,86 (1,04–3,31); р = 0,03; q = 0,045). Таким образом, генетическими маркерами повышенного риска развития внебольничной пневмонии при гриппе являются наличие Т-аллеля в вариабельном локусе гена IFNL4 (rs12979860 C/T) и, в меньшей значимости, G-аллеля в полиморфном локусе гена IFNL3 (rs8099917 T/G). Данное исследование носит поисковый характер и направлено на развитие базы генетических маркеров для персонифицированной предиктивной и профилактической медицины.
1 World Health Organization. WHO launches new global influenza strategy (https://www.who.int/news/item/11-03-2019-who-launches-new-global-influenza-strategy).
Об авторах
Людмила Ивановна Николаева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: l.i.nikolaeva@mail.ru
ORCID iD: 0000-0002-1323-5568
д-р биол. наук, ведущий научный сотрудник, руководитель лаборатории генно-инженерных препаратов
Россия, 123098, г. МоскваМайя Денисовна Стучинская
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: mayastay@mail.ru
ORCID iD: 0000-0001-8544-7482
младший научный сотрудник лаборатории генно-инженерных препаратов
Россия, 123098, г. МоскваКристина Павловна Телепенина
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: telepenina_kristina@mail.ru
ORCID iD: 0009-0003-3380-5104
лаборант-исследователь лаборатории генно-инженерных препаратов
Россия, 123098, г. МоскваНадежда Григорьевна Шевченко
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: dr.nadya@inbox.ru
ORCID iD: 0000-0002-2486-4554
младший научный сотрудник лаборатории генно-инженерных препаратов
Россия, 123098, г. МоскваВиктор Васильевич Куприянов
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: vkoop@mail.ru
ORCID iD: 0000-0002-8602-1974
канд. биол. наук, старший научный сотрудник лаборатории генно-инженерных препаратов
Россия, 123098, г. МоскваКирилл Геннадьевич Краснослободцев
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: kkg_87@mail.ru
ORCID iD: 0000-0003-1745-9128
научный сотрудник лаборатории этиологии и эпидемиологии гриппа
Россия, 123098, г. МоскваЕвгения Андреевна Мукашева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: mukasheva_evgeniya@mail.ru
ORCID iD: 0000-0002-5688-5309
научный сотрудник лаборатории этиологии и эпидемиологии гриппа
Россия, 123098, г. МоскваСветлана Викторовна Трушакова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: s.trushakova@gmail.com
ORCID iD: 0000-0002-9610-3041
канд. биол. наук, научный сотрудник лаборатории этиологии и эпидемиологии гриппа
Россия, 123098, г. МоскваИрина Николаевна Хлопова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: khlopova.ira@yandex.ru
ORCID iD: 0000-0002-7419-590X
канд. мед. наук, ведущий научный сотрудник лаборатории хронических вирусных инфекций
Россия, 123098, г. МоскваИрина Сергеевна Кружкова
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: irina-kru@yandex.ru
ORCID iD: 0000-0002-1983-481X
научный сотрудник лаборатории респираторных вирусных инфекций с апробацией лекарственных средств
Россия, 123098, г. МоскваЛидия Борисовна Кистенева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: lborisovna2007@yandex.ru
ORCID iD: 0000-0001-7336-409X
д-р мед. наук, ведущий научный сотрудник лаборатории хронических вирусных инфекций
Россия, 123098, г. МоскваЛюдмила Васильевна Колобухина
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: lkolobuchina@yandex.ru
ORCID iD: 0000-0001-5775-3343
д-р мед. наук, профессор, главный научный сотрудник лаборатории респираторных вирусных инфекций с апробацией лекарственных средств
Россия, 123098, г. МоскваЕлена Ивановна Бурцева
ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Минздрава России
Email: elena-burtseva@yandex.ru
ORCID iD: 0000-0003-2518-6801
д-р мед. наук, ведущий научные сотрудник, руководитиель лаборатории этиологии и эпидемиологии гриппа
Россия, 123098, г. МоскваСписок литературы
- Iuliano A.D., Roguski K.M., Chang H.H., Muscatello D.J., Palekar R., Tempia S., et al. Estimates of global seasonal influenza-associated respiratory mortality: a modelling study. Lancet. 2018; 391(10127): 1285–300. https://doi.org/10.1016/s0140-6736(17)33293-2
- Острые респираторные вирусные заболевания у взрослых: Клинические рекомендации. Национальное научное общество инфекционистов; 2014. Available at: https://library.mededtech.ru/rest/documents/ORVI_adult/
- Исаков В.А. Клинико-патогенетические аспекты тяжелого гриппа. Аллергология и иммунология. 2002; 3(1): 136–44. https://elibrary.ru/xvrzmd
- Покровский В.И., Семенов Б.Ф. Концепция отсроченной смерти при гриппе и тактика вакцинопрофилактики инфарктов, инсультов и летальных исходов этой инфекции. Российский медицинский журнал. 2003; 11(22): 1266–72. https://elibrary.ru/weoptp
- Shi J., Zeng X., Cui P., Yan C., Chen H. Alarming situation of emerging H5 and H7 avian influenza and effective control strategies. Emerg. Microbes Infect. 2023; 12(1): 2155072. https://doi.org/10.1080/22221751.2022.2155072
- de Jong M.D., Simmons C.P., Thanh T.T., Hien V.M., Smith G.J., Chau T.N., et al. Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia. Nat. Med. 2006; 12(10): 1203–7. https://doi.org/10.1038/nm1477
- Николаева Л.И., Сапронов Г.В., Куприянов В.В. Инфекционные болезни. Роль интерферонов-лямбда в иммунной защите от гриппа. Инфекционные болезни. 2019; 17(1): 86–92. https://doi.org/10.20953/1729-9225-2019-1-86-92 https://elibrary.ru/dcfhfp
- Klinkhammer J., Schnepf D., Ye L., Schwaderlapp M., Gad H.H., Hartmann R., et al. IFN-λ prevents influenza virus spread from the upper airways to the lungs and limits virus transmission. Elife. 2018; 7: e33354. https://doi.org/10.7554/elife.33354
- Fox J.M., Crabtree J.M., Sage L.K., Tompkins S.M., Tripp R.A. Interferon lambda upregulates IDO1 expression in respiratory epithelial cells after influenza virus infection. J. Interferon Cytokine Res. 2015; 35(7): 554–62. https://doi.org/10.1089/jir.2014.0052
- Davidson S., McCabe T.M., Crotta S., Gad H.H., Hessel E.M., Beinke S., et al. IFNλ is a potent anti-influenza therapeutic without the inflammatory side effects of IFNα treatment. EMBO Mol. Med. 2016; 8(9): 1099–112. https://doi.org/10.15252/emmm.201606413
- Kim S., Kim M.J., Kim C.H., Kang J.W., Shin H.K., Kim D.Y., et al. The superiority of IFN-λ as a therapeutic candidate to control acute influenza viral lung infection. Am. J. Respir. Cell Mol. Biol. 2017; 56(2): 202–12. https://doi.org/10.1165/rcmb.2016-0174oc
- Feld J.J., Kandel C., Biondi M.J., Kozak R.A., Zahoor M.A., Lemieux C., et al. Peginterferon lambda for the treatment of outpatients with COVID-19: a phase 2, placebo-controlled randomised trial. Lancet Respir. Med. 2021; 9(5): 498–510. https://doi.org/10.1016/s2213-2600(20)30566-x
- Lazear H.M., Nice T.J., Diamond M.S. Interferon-λ: immune functions at barrier surfaces and beyond. Immunity. 2015; 43(1): 15–28. https://doi.org/10.1016/j.immuni.2015.07.001
- Отдельнова К.А. Определение необходимого числа наблюдений в комплексных социально-гигиенических исследованиях. В кн.: Сборник трудов медицинского института им. Н.И. Пирогова «Комплексные социально-гигиенические исследования и клинико-социальные исследования». М.; 1980.
- Львов Д.К., Бурцева Е.И., Колобухина Л.В., Федякина И.Т., Кириллова Е.С., Трушакова С.В. и др. Вирусологические, эпидемиологические, клинические, молекулярно-генетические особенности эпидемии гриппа 2015–2016 гг.: доминирование вируса гриппа A(H1N1)pdm09 в России и странах Северного полушария. Вопросы вирусологии. 2016; 61(4): 159–65. https://doi.org/10.18821/0507-4088-2016-61-4-159-166
- Курдин А.А., Амбалов Ю.М., Пшеничная Н.Ю. Значение полиморфизмов генов лямбда-интерферонов в патогенезе и клиническом течении гриппа и других острых респираторно-вирусных инфекций. Главный врач Юга России. 2017; (3): 49–50. https://elibrary.ru/yzbirt
- Keshavarz M., Namdari H., Farahmand M., Mehrbod P., Mokhtari-Azad T., Rezaei F. Association of polymorphisms in inflammatory cytokines encoding genes with severe cases of influenza A/H1N1 and B in an Iranian population. Virol. J. 2019; 16(1): 79. https://doi.org/10.1186/s12985-019-1187-8
- Парахонский А.П. Старение иммунной системы. Международный журнал прикладных и фундаментальных исследований. 2011; (6-1): 73–4. https://elibrary.ru/necmtj
Дополнительные файлы