Особенности белка Tat не-А6-вариантов вируса иммунодефицита человека 1-го типа (Retroviridae: Lentivirus: Lentivirus humimdef1), характерных для Российской Федерации
- Авторы: Кузнецова А.И.1, Антонова А.А.1, Лебедев А.В.1, Ожмегова Е.Н.1, Шлыкова А.В.2, Лаповок И.А.2, Галзитская О.В.1,3,4
-
Учреждения:
- Институт вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
- ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
- ФБУН «Институт белка» Российской академии наук
- ФБУН «Институт теоретической и экспериментальной биофизики» Российской академии наук
- Выпуск: Том 69, № 6 (2024)
- Страницы: 524-534
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16690
- DOI: https://doi.org/10.36233/0507-4088-272
- EDN: https://elibrary.ru/xdvhfq
- ID: 16690
Цитировать
Аннотация
Введение. Белок Tat вируса иммунодефицита человека 1-го типа (ВИЧ-1) являет транс-активатором транскрипции вирусного генома, дополнительные функции которого включают способность запускать хронический воспалительный процесс. Естественные аминокислотные замены в белке Tat могут влиять на функциональные свойства белка и на течение ВИЧ-инфекции.
Целью работы является анализ особенностей консенсусных последовательностей белка Tat не-А6-вариантов ВИЧ-1, характерных для Российской Федерации, исследование естественных полиморфизмов белка Tat варианта CRF63_02A6 и вариантов вируса субтипа В, циркулирующих на территории России.
Материалы и методы. Материалом для работы послужили полногеномные нуклеотидные последовательности ВИЧ-1 вариантов CRF63_02A6, CRF03_A6B, а также субтипа В и CRF02_AG, циркулирующих на территории России. Референсная группа была сформирована на основе последовательностей вариантов ВИЧ-1 субтипа В, циркулирующих в разных странах мира. Анализируемые последовательности преимущественно были загруженные из международной базы данных Los Alamos.
Результаты. Консенсусная последовательность CRF63_02A6 содержала наибольшее количество аминокислотных замен (31) и во вторичной структуре не содержала спирали в позициях 30‒33, однако это не привело к изменению предсказанной третичной структуры. Консенсусная последовательность CRF03_A6B содержала стоп-кодон в 87-м положении. Определены полиморфизмы вариантов ВИЧ-1 субтипа В, циркулирующих в нашей стране, и вариантов CRF63_02A6.
Заключение. Получены консенсусные последовательности белка Tat не-А6-вариантов ВИЧ-1, характерных для Российской Федерации, и определены их особенности. Замена R78G, расположенная в функционально значимом мотиве, и функционально значимая замена C31S достоверно чаще встречались у вариантов вируса субтипа В, циркулирующих на территории России, и у вариантов CRF63_02A6 соответственно, чем в референсной группе. Ограничением проведенного исследования являлась небольшая выборка последовательностей.
Полный текст
Введение
Вирус иммунодефицита человека (ВИЧ) относится к роду Lentivirus семейства Retroviridae. На основании генетических особенностей и различий вирусных антигенов ВИЧ классифицируют на 1-й и 2-й типы [1]. Распространение ВИЧ-2 ограничивается западной частью Африки, хотя и были зарегистрированы случаи завоза вируса этого типа в другие части мира. ВИЧ-1 возник примерно в 1920-х гг. на территории современной Демократической Республики Конго и со временем распространился по всему миру [2]. ВИЧ-1 на основе генетических характеристик подразделяют на группы: M, N, O и P. На вирусы группы M приходится большинство случаев заражения ВИЧ-инфекцией в мире. Варианты ВИЧ-1 группы М подразделяются на подтипы: A (суб-субтипы А1‒А8), B, C, D, F (суб-субтипы F1‒F2), G, H, J, K, L. Между подтипами образуются многочисленные рекомбинантные формы [3]. Варианты ВИЧ-1 распространяются по миру крайне неравномерно [2]. На современном этапе распространения ВИЧ-инфекции в России доминирующим генетическим вариантом остается суб-субтип A6 (82,9%), на 2-м месте по частоте встречаемости находится субтип B (7,14%), рекомбинантная форма CRF63_02A6 составляет около 3,59%, частота встречаемости каждой из рекомбинантных форм CRF02_AG и CRF03_AB ‒ около 1% [4]. При этом в целом в Российской Федерации отмечается увеличение частоты встречаемости рекомбинантных форм ВИЧ-1 и их вовлеченности в эпидемический процесс с течением времени [4].
Белок Tat ВИЧ-1 является транс-активатором транскрипции вирусного генома: изменяет активность вирусного промотора и клеточной РНК-полимеразы. Репликация вируса начинается с короткой и прерванной транскрипции, в результате которой образуются короткие вирусные РНК, кодирующие белок Tat и некоторые другие белки вируса. Образовавшиеся транскрипты транспортируются в цитоплазму, где на рибосомах происходит синтез соответствующих белков [5]. Вновь образовавшийся Tat, обладая сигналом ядерной локализации, возвращается обратно в ядро, где вызывает высвобождение позитивного фактора элонгации транскрипции (the positive transcription elongation factor b, P-TEFb) из неактивного комплекса, образованного этим белком с HEXIM1, LARP и 7SK RNA. Затем P-TEFb в комплексе с Tat связывается со специальным TAR-элементом (trans-activation response element) на синтезирующейся вирусной РНК, что приводит к увеличению процессивности РНК-полимеразы и, как следствие, формированию полноразмерных вирусных молекул РНК [5, 6]. Tat также обладает дополнительными как внутриклеточными, так и внеклеточными функциями. Инфицированные клетки высвобождают Tat в межклеточное пространство, откуда он поступает в кровоток. Далее белок Tat может поглощаться как ВИЧ-инфицированными, так и неинфицированными клетками. Латентно ВИЧ-инфицированные клетки могут быть реактивированы белком Tat. Неинфицированные клетки, поглотившие Tat, переходят в состояние активации, что в конечном итоге приводит их к апоптозу. Кроме того, клетки, поглотившие Tat, сами начинают вырабатывать цитокины воспаления. В результате запускается хронический воспалительный процесс, способствующий развитию коморбидных, нейродегенеративных и сердечно-сосудистых заболеваний у ВИЧ-инфицированных пациентов [5, 7, 8].
Tat является небольшим основным белком, который кодируется двумя экзонами и содержит от 86 до 106 аминокислотных остатков (АО), преимущественно 101 АО. Первые 5 доменов кодируются первым экзоном, 6-й домен – вторым экзоном. Первые 3 домена (1-й: 1‒21 АО; 2-й: 22‒37 АО; 3-й: 38‒48 АО) образуют минимальную область, необходимую для транс-активации [6, 8]. Четвертый домен (49‒57 АО) отвечает за связывание с TAR-элементом, за захват белка клетками и вместе с 5-м доменом (58‒72 АО) определяет ядерную локализацию Tat [5, 6]. Шестой домен (73–101 АО), кодируемый вторым экзоном, предположительно, способствует вирусной инфекционности и связыванию с интегринами на клеточной мембране [6]. Активно изучается вопрос влияния аминокислотных замен в белке Tat на его функции [9, 10] и на патогенез ВИЧ-инфекции [6, 11, 12]. Актуальность изучения вариабельности белка Tat также определяется тем, что Tat является перспективной мишенью для разработки антиретровирусных препаратов и создания терапевтических вакцин [13, 14].
Проведенные ранее исследования особенностей белка Tat наиболее широко распространенного в России суб-субтипа А6 определили замены, которые позволяют отличить этот вариант ВИЧ от других генетических вариантов. Так, исследования показали наличие в 4-м функционально значимом домене мутаций, частота встречаемости которых достоверно отличалась у суб-субтипа А6 и наиболее изученного субтипа В, а также определили у суб-субтипа А6 в 6-м домене белка Tat мотив QRD вместо функционально значимого мотива RGD [5, 7].
Целью этого исследования является изучение особенностей белка Tat у не-А6-вариантов ВИЧ-1, характерных для Российской Федерации: анализ особенностей консенсусных последовательностей белка Tat, включая исследование вторичных и третичных структур, сравнение профиля естественных полиморфизмов Tat у вариантов CRF63_02A6 и вариантов вируса субтипа В, циркулирующих на территории России, с вариантами вируса субтипа В, циркулирующими в мире. Полученные данные могут быть использованы при разработке лекарственных препаратов и вакцин, а также внесут вклад в изучение влияния мутаций полиморфизма на функциональные свойства вирусов.
Материалы и методы
Из международной базы данных Los Alamos (www.hiv.lanl.gov/content/index, от 19.04.2024) были выбраны все полногеномные последовательности вариантов CRF63_02A6, CRF03_A6B, а также циркулирующих на территории Российской Федерации вариантов субтипа В и CRF02_AG. При этом в исследование включали одну последовательность от одного пациента. Из выбранных последовательностей были выгружены нуклеотидные последовательности гена tat. В результате были загружены 26 последовательностей CRF63_02A6, 4 последовательности CRF03_A6B, 35 последовательностей, циркулирующих на территории России, вариантов субтипа В, одна последовательность варианта CRF02_AG, полученная от ВИЧ-инфицированного пациента в России.
Дополнительно в исследование были включены две последовательности гена tat варианта CRF02_AG, выгруженные из полногеномных последовательностей вируса, полученных лабораторией ранее от 2 пациентов в рамках выполнения проекта CHAIN 7-й Рамочной программы Европейского сообщества «Единая сеть по изучению лекарственной устойчивости к антиретровирусным препаратам». На забор крови от пациентов было получено разрешение Этического комитета при ФГУН ГНЦ ВБ «Вектор» (Протокол № 1 от 30 марта 2010 г.). Пациенты подписывали информированное согласие на участие в исследовании. Образцы анализировали путем массового параллельного секвенирования с помощью набора «АмплиСенс HIV-Resist-NGS» в соответствии с инструкцией производителя (ФБУН ЦНИИЭ Роспотребнадзора, Россия). Полногеномное секвенирование образцов было выполнено с применением технологии MiSeq и соответствующих наборов MiSeq reagent kits V2 (Illumina, США) путем анализа 4 перекрывающихся специфических фрагментов (общая протяженность анализируемого фрагмента 704–9563 по HXB2).
Субтип вируса определяли на основе анализа полногеномной последовательности в программах Comet (https://comet.lih.lu) и RIP (RIP 3.0 submission form (lanl.gov)). Последовательности были сгруппированы в соответствии с субтипом вируса.
Для формирования референсной группы последовательностей из международной базы данных Los Alamos (www.hiv.lanl.gov/content/index) были выбраны 50 полногеномных последовательностей субтипа В, циркулирующих в разных странах мира: США, странах ЕС, Канаде, Японии, Китае, Южной Корее и Австралии. В исследование также включали одну последовательность от одного пациента. Из всех выбранных последовательностей были выгружены нуклеотидные последовательности гена tat.
После этого был проведен контроль качества нуклеотидных последовательностей, в ходе которого из анализа исключали последовательности, содержавшие: а) замены в стартовом кодоне; б) пропуски нуклеотидов, не кратные 3; в) следующие 2 раза подряд N-вырождения. Последовательности, не прошедшие контроль качества, были удалены из исследования.
Затем нуклеотидные последовательности были переведены в аминокислотные последовательности при помощи программы Sequence Manipulation Suite: Translate (www.bioinformatics.org) и выравнены между собой в каждой группе в программе MEGA v. 10.2.2 (www.megasoftware.net). Далее для каждой группы последовательностей с помощью программного обеспечения Advanced Consensus Maker tool на сайте базы данных Los Alamos (https://www.hiv.lanl.gov/content/sequence/CONSENSUS/AdvCon.html) формировали аминокислотную консенсусную последовательность. Вставки аминокислот при формировании референсной последовательности не учитывали. Референсную консенсусную последовательность (референс) формировали на основе референсной группы последовательностей.
Сравнение консенсусных последовательностей CRF63_02A6, CRF03_A6B и циркулирующих в России вариантов CRF02_AG и субтипа В с референсной консенсусной последовательностью субтипа В и между собой проводилось в программе MEGA v. 10.2.2 (www.megasoftware.net).
Далее на основе анализа консенсусных последовательностей в программе PSIPRED (http://bioinf.cs.ucl.ac.uk/psipred/) предсказывали вторичную структуру консенсусных последовательностей не-А6-вариантов ВИЧ-1, циркулирующих в России. При этом анализировали специфичные изменения вторичной структуры соответствующих вариантов вируса относительно референсной консенсусной последовательности. Вторичную структуру исследовали только для консенсусных последовательностей, которые были сформированы на основе более чем 10 последовательностей.
При помощи программы IsUnstruct предсказывали расположение неструктурированных участков в консенсусных последовательностях [15].
При помощи программы AlphaFold 2 (AlphaFold Protein Structure Database) предсказывали пространственную структуру консенсусных последовательностей [16].
Затем проводили сравнение естественных полиморфизмов вариантов субтипа В, циркулирующих на территории России, и вариантов CRF63_02A6 с вариантами субтипа В, циркулирующими в мире. Для этого первоначально посредством программы MEGA v. 10.2.2 выявляли естественные полиморфизмы всех анализируемых групп относительно референсной консенсусной последовательности – консенсусной последовательности вирусов субтипа В, циркулирующих в мире. При этом под полиморфизмами понимали мутации – единичные замены, встречающиеся в 1% наблюдений и чаще [17]. Далее с применением программного модуля Nonparametric Statistics из пакета Statistica 8.0 (StatSoft Inc., США) попарно сравнивали группу вариантов субтипа В, циркулирующих на территории России, и группу вариантов CRF63_02A6 с группой вариантов субтипа В, циркулирующих в мире: выявляли сайты со статистически достоверными различиями (p < 0,05 при использовании критерия χ2).
Результаты
Анализируемые последовательности
Две полногеномные последовательности ВИЧ-1 CRF02_AG, полученные ранее в ходе выполнения проекта CHAIN, были депонированы в Gene bank с номерами PP816227 и PP816231.
После проведения контроля качества загруженных нуклеотидных последовательностей одна последовательность CRF63_02A6, одна последовательность CRF03_A6B и две последовательности субтипа В из референсной группы, т.е. группы последовательностей вариантов ВИЧ-1 субтипа В, циркулирующих в разных странах мира, были исключены из анализа. Таким образом, в исследование вошли 25 последовательностей CRF63_02A6, 3 последовательности CRF03_A6B, 35 последовательностей, циркулирующих на территории России, вариантов субтипа В, 3 последовательности вируса варианта CRF02_AG, циркулирующих на территории РФ. Референсная группа была сформирована на основе 48 последовательностей. Полученные консенсусные последовательности представлены на рис. 1.
Рис. 1. Множественное выравнивание консенсусных последовательностей полноразмерного белка Tat вариантов субтипа В и вариантов CRF02_AG, циркулирующих в России, и вариантов Crf03_A6B, CRF63_02A6 относительно консенсусной последовательности вариантов субтипа В, циркулирующих в мире (B референс).
Точками обозначены позиции АО, в которых АО в консенсусах соответствовали референсу. Аминокислоты классифицированы на основе полярности радикалов. Неполярные аминокислоты: G (глицин), A (аланин), V (валин), L (лейцин), I (изолейцин), P (пролин) отмечены синим цветом; полярные незаряженные аминокислоты: S (серин), T (треонин), C (цистеин), M (метионин), N (аспарагин), Q (глутамин) – зеленым; ароматические аминокислоты: F (фенилаланин), Y (тирозин), W (триптофан), H (гистидин) – желтым; отрицательно заряженные аминокислоты: D (аспарагиновая кислота) и E (глутаминовая кислота) – оранжевым; положительно заряженные аминокислоты: K (лизин), R (аргинин) – красным [18, 19]. X – АО не определен (серым).
Fig. 1. Multiple alignment of the full-length Tat protein’s consensus sequences of subtype B and CRF02_AG variants circulating in Russia, and variants Crf03_A6B, CRF63_02A6 relative to the consensus sequence of subtype B variants circulating in the world (B reference).
The dots indicate amino acid residues (a.a.r.) positions in which the a.a.r. in the consensus corresponded to the reference. Non-polar amino acids: G (glycine), A (alanine), V (valine), L (leucine), I (isoleucine), P (proline) – are marked in blue; polar uncharged amino acids: S (serine), T (threonine), C (cysteine), M (methionine), N (asparagine), Q (glutamine) – green; aromatic amino acids: F (phenylalanine), Y (Tyrosine), W (tryptophan), H (Histidine) – yellow; polar acidic negatively charged amino acids: D (aspartic acid) and E (glutamic acid) – orange; polar basic positively charged amino acids: K (lysine), R (arginine) – in red [18, 19]. X – a.a.r. is undefined (gray).
Структурный анализ
Первичная структура
Консенсус циркулирующих в России вариантов ВИЧ-1 субтипа В отличался от референсной консенсусной последовательности в 8 позициях, при этом 8 из 8 замен были связаны с изменениями химических свойств. Под изменением химических свойств понимали изменение полярности или заряда аминокислоты в заданной позиции (рис. 1).
Консенсус циркулирующих в России вариантов вируса CRF02_AG отличался от референсной последовательности в 30 позициях, при этом лишь в 8 из 30 позиций замена аминокислоты не была связана с изменением химических свойств.
Консенсус вариантов ВИЧ-1 CRF03_A6B содержал преждевременный стоп-кодон в 87-й позиции, в 6 из 86 аминокислотных позицияй отличался от референсной последовательности, при этом в 3 из 6 позиций замена аминокислоты не была связана с изменением химических свойств.
Консенсус CRF63_02A6 отличался от референсной последовательности в 31 позиции, при этом лишь в 8 из 31 позиции замена аминокислоты не была связана с изменением химических свойств (рис. 1).
Вторичная структура
Вторичную структуру исследовали для консенсусных последовательностей, вариантов ВИЧ-1 субтипа В, циркулирующих на территории России, и вариантов CRF63_02A6. При этом осуществляли их сравнение с референсной последовательностью.
Поскольку консенсусная последовательность вариантов ВИЧ-1 субтипа В, циркулирующих на территории Российской Федерации, в 70-й позиции в равной степени вероятности содержала серин (S) и пролин (P), то при прогнозировании вторичной структуры белка Tat проводили анализ двух вариантов последовательностей: B (Россия)_v1/B(Russia)_v1 и B(Россия)_v2/B(Russia)_v2 соответственно. Результаты анализа структуры исследуемых последовательностей представлены на рис. 2.
Рис. 2. Предсказанные вторичные структуры консенсусных последовательностей: A – B(референс)/B(reference); B – B(Россия)_v1/B(Russia)_v1; C – B(Россия)_v2/B(Russia)_v2; D – CRF63_02A6.
Fig. 2. Predicted secondary structures of consensus sequences: A – B(референс)/B(reference); B – B(Россия)_v1/ B(Russia)_v1; C – B(Россия)_v2/ B(Russia)_v2; D – CRF63_02A6.
Большая часть вторичной структуры белка Tat представляет собой клубок. Наибольшие отличия от референсной последовательности продемонстрировала консенсусная последовательность CRF63_02A6: отсутствие спирали в позициях 30‒33.
Третичная структура
Затем проводили сравнение третичной структуры консенсусной последовательности белка Tat CRF63_02A6 с референсной последовательностью (рис. 3).
Рис. 3. Результаты сравнения третичной структуры консенсусной последовательности белка Tat CRF63_02A6 с референсной последовательностью.
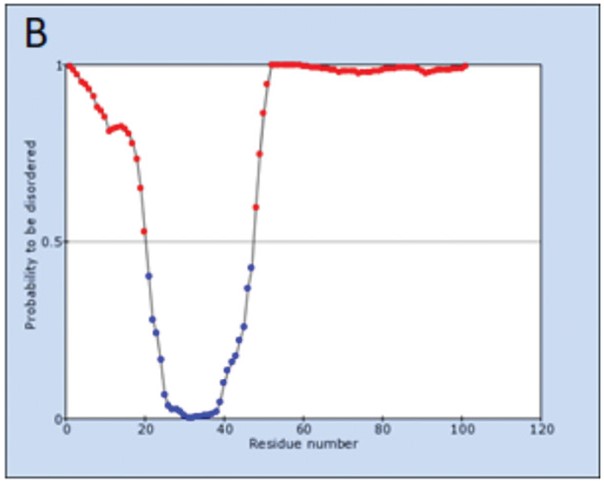
Профиль вероятности для неструктурированных участков консенсусных последовательностей белка Tat, предсказанных программой IsUnstruct: A – консенсусная последовательность вариантов ВИЧ-1 субтипа В, циркулирующих в мире; B – консенсусная последовательность вариантов ВИЧ-1 CRF63_02A6. Пространственная структура, предсказанная с помощью программы AlphaFold 2, для консенсусных последовательностей белка Tat: C – консенсусная последовательность вариантов ВИЧ-1 субтипа В, циркулирующих в мире; D – консенсусная последовательность вариантов ВИЧ-1 CRF63_02A6. Красным цветом выделен профиль последовательности и участки цепи, соответствующие неструктурированным участкам; синим цветом – структурированная область. Пояснение в тексте.
Fig. 3. Results of comparison of the tertiary structure of the consensus sequence of the Tat protein CRF63_02A6 with the reference sequence.
Probability profile for unstructured regions of Tat consensus sequences predicted by IsUnstruct: A – consensus sequence of HIV-1 subtype B variants circulating worldwide; B – consensus sequence of HIV-1 CRF63_02A6 variants. Spatial structure predicted by AlphaFold 2 for Tat consensus sequences: C – consensus sequence of HIV-1 subtype B variants circulating worldwide; D – consensus sequence of HIV-1 CRF63_02A6 variants. The sequence profile corresponding to unstructured regions is marked in red.
Профили вероятности для неструктурированных областей белка Tat как референсной последовательности, так и консенсусной последовательности вариантов CRF63_02A6 содержали только одну структурированную область, соответствующую участку, обогащенному цистеинами, в районе 22‒48 АО, что соотносится с 2-м и 3-м доменом белка Tat (рис. 3). Эта область выделена синим цветом на профиле и на пространственной структуре, предсказанной с помощью AlphaFold 2 (рис. 3).
Сравнение профилей естественных полиморфизмов белка Tat
При сравнении профиля естественных полиморфизмов белка Tat ВИЧ-1 вариантов субтипа В, циркулирующих на территории России, и вариантов вируса CRF63_02A6 с вариантами вируса субтипа В, циркулирующих в мире обнаружено что:
- 1 последовательность из группы вариантов субтипа В, циркулирующих в мире, содержала вставку глутамина между 76 и 77 АО – 76-77insQ;
- 1 последовательность CRF63_02A6 содержала вставку гистидина между 80 и 81 АО – 80-81insH;
- 2 последовательности из группы вариантов субтипа В, циркулирующих в мире, содержали преждевременный стоп-кодон в 87-й позиции и одна последовательность – в 100-й позиции;
- 1 последовательность из группы вариантов субтипа В, циркулирующих на территории России, содержала преждевременный стоп-кодон в 87-й позиции;
- 3 последовательности CRF63_02A6 содержали преждевременный стоп-кодон в 100-й позиции.
Однако обнаруженные вставки и преждевременные стоп-кодоны не имели достоверной разницы в частоте встречаемости между анализируемыми группами.
При сравнении профиля естественных полиморфизмов вариантов вируса субтипа В, циркулирующих на территории России, и вариантов вируса субтипа В, циркулирующих в мире, была определена 21 замена со статистически значимыми различиями в частоте встречаемости, однако после введения поправки по Бонферрони лишь две замены ‒ S68P и R78G ‒ имели достоверную разницу в частоте встречаемости (табл. 1).
Таблица 1. Замены в белке Tat со статистически значимой разницей в частоте встречаемости у вариантов ВИЧ-1 субтипа В, циркулирующих в мире, и у вариантов ВИЧ-1 субтипа В, циркулирующих на территории России (p < 0,05)
Table 1. Substitutions in the Tat protein with a statistically significant difference in the frequency of occurrence between HIV-1 subtype B variants circulating in the world and HIV-1 subtype B variants circulating in Russia (p < 0.05)
Участок Domain | Замена Substitution | B Мир World | B Россия Russia | p | Участок Domain | Замена Substitution | B Мир World | B Россия Russia | p |
n = 48 | n = 35 | n = 48 | n = 35 | ||||||
I | K19Q | 1 | 5 | 0,034 | VI | R78G* | 4 | 13 | 0,0013* |
II | N24A | 0 | 3 | 0,0388 | D80N | 0 | 6 | 0,0029 | |
K29Q | 5 | 0 | 0,0489 | P81Q | 1 | 6 | 0,0148 | ||
III | T40K | 16 | 20 | 0,0307 | n = 46 | n = 34 | |||
IV | Q54R | 0 | 3 | 0,0388 | K89E | 8 | 1 | 0,0432 | |
V | Q60K | 1 | 5 | 0,034 | R93K | 7 | 0 | 0,0173 | |
T64D | 0 | 5 | 0,0069 | R93S | 7 | 13 | 0,0188 | ||
S68P* | 8 | 20 | 0,0001* | D98H | 13 | 17 | 0,0471 | ||
S70P | 11 | 17 | 0,0146 | D98N | 0 | 6 | 0,0031 | ||
VI | P77A | 5 | 0 | 0,0489 | V100D | 2 | 9 | 0,0045 | |
n = 45 | n = 34 | ||||||||
P77T | 0 | 3 | 0,0388 | D101H | 7 | 14 | 0,0107 |
Примечание. * ‒ позиции, достоверные по критерию χ2 с поправкой Бонферрони p < 0,0024. В связи с наличием преждевременных стоп-кодонов в некоторых последовательностях менялось число (n) анализируемых последовательностей в группах, т.к. аминокислоты, находящиеся после стоп-кодона, в анализе не учитывали: с 1 по 87 АО группа вариантов ВИЧ-1 субтипа В, циркулирующих в мире, состояла из 48 последовательностей, группа вариантов субтипа В, циркулирующих на территории России, – из 35 последовательностей; с 88 АО по 100 АО группа вариантов ВИЧ-1 субтипа В, циркулирующих в мире, ‒ из 46 последовательностей, группа вариантов ВИЧ-1 субтипа В, циркулирующих на территории России, – из 34 последовательностей; в 101 АО группа вариантов ВИЧ-1 субтипа В, циркулирующих в мире, ‒ из 45 последовательностей, группа вариантов ВИЧ-1 субтипа В, циркулирующих на территории России, – из 34 последовательностей.
Note. * ‒ significant in the χ2 test with Bonferroni correction p < 0.024. Due to the presence of premature stop codons in some sequences, the number of analyzed sequences in groups changed, since amino acids (a.a.r) located after the stop codon were not taken into account in the analysis: from 1 to 87 a.a.r, the group of HIV-1 subtype B variants circulating in the world contained 48 sequences, the group of HIV-1 subtype B variants circulating in Russia – 35 sequences; from 88 to 100 a.a.r, the group of HIV-1 subtype B variants circulating in the world contained 46 sequences, the group of HIV-1 subtype B variants circulating in Russia – 34 sequences; in 101 a.a.r. the group of HIV-1 subtype B variants circulating in the world contained 45 sequences, the group of HIV-1 subtype B variants circulating in Russia – 34 sequences.
При сравнении профиля естественных полиморфизмов вариантов CRF63_02A6 и вариантов вируса субтипа В, циркулирующих в мире, были определены 54 замены со статистически значимыми различиями в частоте встречаемости. После введения поправки по Бонферрони 31 замена имела достоверную разницу в частоте встречаемости (табл. 2).
Таблица 2. Замены в белке Tat со статистически значимой разницей в частоте встречаемости у вариантов ВИЧ-1 субтипа В, циркулирующих в мире, и у вариантов CRF63_02A6 (p < 0,05)
Table 2. Substitutions in the Tat protein with a statistically significant difference in the frequency of occurrence between HIV-1 subtype B variants circulating in the world and HIV-1 CRF63_02A6 variants (p < 0.05)
Участок Domain | Замена Substitution | B Мир World | CRF63_02A6 | p | Участок Domain | Замена Substitution | B Мир World | CRF63_02A6 | p |
n = 48 | n = 25 | n = 48 | n = 25 | ||||||
I | E2D | 5 | 24 | 0,0000* | V | D61S | 3 | 18 | 0,0000* |
R7N | 7 | 21 | 0,0000* | S62R | 0 | 21 | 0,0000* | ||
K12N | 4 | 20 | 0,0000* | Q63E | 10 | 0 | 0,014 | ||
K19R | 11 | 0 | 0,0094 | T64N | 12 | 1 | 0,0062 | ||
A21P | 12 | 0 | 0,0062 | T64D | 0 | 22 | 0,0000* | ||
II | T23S | 0 | 17 | 0,0000* | V67A | 16 | 0 | 0,0011 | |
N24K | 11 | 1 | 0,0385 | V67D | 1 | 5 | 0,0082 | ||
K28I | 0 | 2 | 0,0469 | V67N | 0 | 19 | 0,0000* | ||
C31S | 1 | 9 | 0,0001* | S68P | 8 | 24 | 0,0000* | ||
C31V | 0 | 2 | 0,0469 | L69V | 0 | 24 | 0,0000* | ||
F32L | 10 | 0 | 0,014 | S70P | 11 | 21 | 0,0000* | ||
F32W | 1 | 25 | 0,0000* | VI | A74L | 0 | 24 | 0,0000* | |
F32Y | 7 | 0 | 0,0446 | S75P | 4 | 25 | 0,0000* | ||
V36L | 2 | 22 | 0,0000* | Q76T | 0 | 22 | 0,0000* | ||
III | I39L | 6 | 25 | 0,0000* | P77T | 0 | 24 | 0,0000* | |
I39T | 12 | 0 | 0,0062 | D80N | 0 | 22 | 0,0000* | ||
T40N | 0 | 21 | 0,0000* | P84Q | 8 | 0 | 0,0305 | ||
G42A | 10 | 0 | 0,014 | K85E | 11 | 25 | 0,0000* | ||
IV | R53G | 1 | 20 | 0,0000* | n = 46 | n = 25 | |||
Q54R | 0 | 22 | 0,0000* | K89E | 8 | 0 | 0,0269 | ||
Q54H | 0 | 3 | 0,0143 | K90E | 1 | 23 | 0,0000* | ||
R57G | 1 | 24 | 0,0000* | E92A | 0 | 22 | 0,0000* | ||
V | A58S | 7 | 0 | 0,0446 | R93S | 7 | 25 | 0,0000* | |
A58T | 9 | 23 | 0,0000* | E94K | 6 | 25 | 0,0000* | ||
P59S | 2 | 21 | 0,0000* | D98H | 13 | 1 | 0,0141 | ||
P59T | 0 | 2 | 0,0469 | P99R | 0 | 3 | 0,0164 | ||
Q60R | 0 | 2 | 0,0469 | V100C | 1 | 14 | 0,0000* | ||
D61G | 7 | 0 | 0,0446 | V100Y | 1 | 4 | 0,0297 |
Примечание. * ‒ позиции достоверные по критерию χ2 с поправкой Бонферрони p < 0,0009. В связи с наличием преждевременных стоп-кодонов в некоторых последовательностях менялось число (n) анализируемых последовательностей в группах, т.к. аминокислоты, находящиеся после стоп-кодона, в анализе не учитывали: с 1 по 87 АО группа вариантов ВИЧ-1 субтипа В, циркулирующих в мире, состояла из 48 последовательностей, группа вариантов CRF63_02A6 – из 25 последовательностей; с 88 АК по 100 АО группа вариантов ВИЧ-1 субтипа В, циркулирующих в мире, – из 46 последовательностей, группа вариантов CRF63_02A6 – из 25 последовательностей.
Note. * ‒ significant in the χ2 test with Bonferroni correction p < 0.0009. Due to the presence of premature stop codons in some sequences, the number of analyzed sequences in groups changed, since amino acid residues (a.a.r.) located after the stop codon were not taken into account in the analysis: from 1 to 87 a.a.r, the group of HIV-1 subtype B variants circulating in the world contained 48 sequences, the group of CRF63_02A6 variants – 25 sequences; from 88 to 100 a.a.r., the group of HIV-1 subtype B variants circulating in the world contained 46 sequences, the group of CRF63_02A6 variants – 25 sequences.
Обсуждение
Одной из основных характеристик ВИЧ-1 является высокая генетическая изменчивость, которая определяет необычайное глобальное генетическое разнообразие вируса [2, 20]. Полиморфизмы отражают естественные различия между генетическими вариантами ВИЧ-1, при этом некоторые из них могут иметь функциональную значимость [11, 12, 21]. Как известно, высокая генетическая изменчивость ВИЧ-1 является результатом действия нескольких факторов, которые включают в себя работу специфического вирусного фермента, обратной транскриптазы, и возникновения эскейп-мутаций в ответ на действие иммунной системы хозяина [9, 22]. Проведенные исследования показали, что белок Tat является мишенью для действия цитотоксического иммунного ответа и был определен ряд CTL-эпитопов в белке Tat (https://www.hiv.lanl.gov/content/immunology/maps/ctl/Tat.html) [9]. Таким образом, мутации в белке Tat могут быть ассоциированы как с субтипом вируса, так и с генетическими особенностями популяции хозяина, в которой циркулирует вирус. Настоящее исследование направлено на изучение особенностей белка Tat у не-А6-вариантов вируса, характерных для Российской Федерации.
Сравнение консенсусных последовательностей показало, что все анализируемые варианты белка Tat отличались от референсной последовательности, при этом каждый из вариантов содержал уникальный профиль замен.
Консенсусная последовательность вариантов ВИЧ-1 субтипа В, циркулирующих на территории России, в 63-м положении содержала замену Q63E, которая, как отмечалось ранее, у вариантов вируса субтипа С способствовала более высокой транскрипционной активации в человеческих CD4 T-клетках [23].
Консенсусные последовательности CRF02_AG и CRF63_02A6 содержали наибольшее количество замен, при этом в 32, 34, 37, 40, 54, 57, 58, 61, 62, 64, 67‒70, 74‒77, 80, 90, 92‒94-й позициях содержали одни и те же замены аминокислот относительно референсной последовательности. Такой результат объясняется тем, что CRF63_02A6 является рекомбинантной формой CRF02_AG и суб-субтипа А6, которая в области гена tat соответствует CRF02_AG (https://www.hiv.lanl.gov/components/sequence/HIV/crfdb/crfs.comp).
В свою очередь, CRF03AB является рекомбинантной формой суб-субтипа А6 и субтипа В, которая в области гена tat соответствует субтипу В (https://www.hiv.lanl.gov/components/sequence/HIV/crfdb/crfs.comp). Консенсусная последовательность CRF03AB в 87-й позиции содержит стоп-кодон, что характерно для некоторых вариантов ВИЧ-1 субтипа В, например для референс-штамма HXB2 (K03455). Укороченная версия белка Tat, содержащая 86 АО, является функциональной, однако некоторые функции, такие как модуляция модификации цитоскелета клетки-хозяина и, возможно, функция обеспечения оптимальной репликации в клетках линии моноцитов-макрофагов, ассоциируют со вторым экзоном [6].
Меньшее число замен относительно референса приходится на фрагмент белка Tat с 1 по 51 АО: консенсус вариантов ВИЧ-1 субтипа В, циркулирующих на территории Российской Федерации, содержал 1 замену, CRF02_AG – 10, CRF03_A6B – 3, CRF63_02A6 – 8. Тогда как во фрагменте белка Tat c 52‒101 АО: консенсус вариантов ВИЧ-1 субтипа В, циркулирующих на территории Российской Федерации, содержал 7 замен, CRF02_AG – 20, CRF03_A6B – 3 и стоп-кодон в 87-м положении, CRF63_02A6 – 23 (рис. 1). Это частично объясняется тем, что первые три домена белка Tat (1‒48 АО) формируют минимальную область, необходимую для транс-активации транскрипции вирусного генома [6, 8]. Также ранее исследователями уже отмечалось, что в целом область, кодируемая вторым экзоном гена tat, является менее консервативной, чем область, кодируемая первым экзоном [10].
В результате сравнения консенсусных последовательностей было показано, что существующие отличия первичной структуры CRF63_02A6 от референсной последовательности, отсутствие элемента спирали в позициях 30‒33 вторичной структуры CRF63_02A6, по предсказаниям, не влияло на пространственную структуру белка: наиболее структурированная область располагалась в районе 2-го и 3-го домена как у CRF63_02A6, так и у референсной последовательности (рис. 3).
При анализе профиля естественных полиморфизмов было показано, что замены S68P и R78G достоверно чаще встречались у вариантов ВИЧ-1 субтипа В, циркулирующих в России, чем в референсной группе (табл. 1). При этом мотив 78RGD80 является лигандом для некоторых интегринов и, в связи с этим, предположительно, замена R78G может влиять на функциональные свойства белка Tat [6].
Список замен со статистически значимой разницей в частоте встречаемости в белке Tat у вариантов ВИЧ-1 субтипа В, циркулирующих в мире, и у вариантов CRF63_02A6 соответствовал списку замен, обозначенному при сравнении консенсусных последовательностей. Дополнительно было показано, что замена C31S достоверно чаще встречалась у вариантов CRF63_02A6. При этом известно, что замена C31S является функционально значимой, ассоциирована со сниженной нейротоксичностью белка Tat [12, 24].
Ограничение исследования. Ограничением проведенного исследования является небольшая выборка последовательностей. Изучение особенностей белка Tat не-А6-вариантов ВИЧ-1, характерных для Российской Федерации, на больших выборках последовательностей является интересным направлением для исследований, которое актуализируется постепенным расширением распространения не-А6-вариантов ВИЧ-1 на территории страны [4]. Также перспективным направлением для возможных исследований в будущем является изучение влияния особенностей белка Tat разных вариантов вируса, характерных для Российской Федерации, на Tat-TAR-взаимодействие.
Заключение
Впервые получены консенсусные последовательности белка Tat не-А6-вариантов ВИЧ-1, характерных для Российской Федерации. Показано, что разные варианты вируса обладают характерными особенностями в первичной структуре белка. Наибольшее количество аминокислотных замен содержала консенсусная последовательность CRF63_02A6, при этом существующие особенности не оказали влияние на профиль вероятности расположения неструктурированных областей белка. Показано, что замена R78G, расположенная в функционально значимом мотиве, достоверно чаще встречалась у вариантов вируса субтипа В, циркулирующих на территории России, чем у вариантов вируса субтипа В, циркулирующих в мире. Определено, что функционально значимая замена C31S, достоверно чаще встречалась у вариантов CRF63_02A6, чем у вариантов вируса субтипа В, циркулирующих в мире. Отмечены перспективные направления для будущих исследований.
Об авторах
Анна Игоревна Кузнецова
Институт вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
Автор, ответственный за переписку.
Email: a-myznikova@list.ru
ORCID iD: 0000-0001-5299-3081
канд. биол. наук, заведующая лабораторией вирусов лейкозов, ведущий научный сотрудник
Россия, 123098, г. МоскваАнастасия Александровна Антонова
Институт вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
Email: aantonova1792@gmail.com
ORCID iD: 0000-0002-9180-9846
канд. биол. наук, научный сотрудник лаборатории вирусов лейкозов
Россия, 123098, г. МоскваАлексей Владимирович Лебедев
Институт вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
Email: lebedevalesha236@gmail.com
ORCID iD: 0000-0001-6787-9345
канд. биол. наук, научный сотрудник лаборатории вирусов лейкозов
Россия, 123098, г. МоскваЕкатерина Никитична Ожмегова
Институт вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России
Email: belokopytova.01@mail.ru
ORCID iD: 0000-0002-3110-0843
канд. биол. наук, научный сотрудник лаборатории вирусов лейкозов
Россия, 123098, г. МоскваАнастасия Вениаминовна Шлыкова
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: murzakova_a.v@mail.ru
ORCID iD: 0000-0002-1390-8021
научный сотрудник лаборатории диагностики и молекулярной эпидемиологии ВИЧ-инфекции
Россия, 111123, г. МоскваИлья Андреевич Лаповок
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
Email: i_lapovok@mail.ru
ORCID iD: 0000-0002-6328-1415
канд. биол. наук, старший научный сотрудник
Россия, 111123, г. МоскваОксана Валериановна Галзитская
Институт вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России; ФБУН «Институт белка» Российской академии наук; ФБУН «Институт теоретической и экспериментальной биофизики» Российской академии наук
Email: ogalzit@vega.protres.ru
ORCID iD: 0000-0002-3962-1520
д-р физ.-мат. наук, заведующая лабораторией биоинформатики, главный научный сотрудник
Россия, 123098, г. Москва; 142290, Московская область, г. Пущино; 142290, Московская область, г. ПущиноСписок литературы
- German Advisory Committee Blood (Arbeitskreis Blut), Subgroup «Assessment of Pathogens Transmissible by Blood». Human Immunodeficiency Virus (HIV). Transfus. Med. Hemother. 2016; 43(3): 203–22. https://doi.org/10.1159/000445852
- Bbosa N., Kaleebu P., Ssemwanga D. HIV subtype diversity worldwide. Curr. Opin. HIV AIDS. 2019; 14(3): 153–60. https://doi.org/10.1097/COH.0000000000000534
- Кузнецова А.И. Роль полиморфизма ВИЧ-1 в патогенезе. ВИЧ-инфекция и иммуносупрессии. 2023; 15(3): 26–37. https://doi.org/10.22328/2077-9828-2023-15-3-26-37 https://elibrary.ru/cwjjai
- Антонова А.А., Кузнецова А.И., Ожмегова Е.Н., Лебедев А.В., Казеннова Е.В., Ким К.В. и др. Генетическое разнообразие ВИЧ-1 на современном этапе эпидемии в Российской Федерации: увеличение распространенности рекомбинантных форм. ВИЧ-инфекция и иммуносупрессии. 2023; 15(3): 61–72. https://doi.org/10.22328/2077-9828-2023-15-3-61-72 https://elibrary.ru/tpwttn
- Кузнецова А.И., Громов К.Б., Киреев Д.Е., Шлыкова А.В., Лопатухин А.Э., Казеннова Е.В. и др. Анализ особенностей белка Tat вируса иммунодефицита человека 1 типа суб-субтипа А6 (Retroviridae: Orthoretrovirinae: Lentivirus: Human immunodeficiency virus-1). Вопросы вирусологии. 2021; 66(6): 452–63. https://doi.org/10.36233/0507-4088-83 https://elibrary.ru/cmzgyc
- Li L., Dahiya S., Kortagere S., Aiamkitsumrit B., Cunningham D., Pirrone V., et al. Impact of Tat genetic variation on HIV-1 disease. Adv. Virol. 2012; 2012: 123605. https://doi.org/10.1155/2012/123605
- Kuznetsova A., Kim K., Tumanov A., Munchak I., Antonova A., Lebedev A., et al. Features of Tat protein in HIV-1 sub-subtype A6 variants circulating in the Moscow Region, Russia. Viruses. 2023; 15(11): 2212. https://doi.org/10.3390/v15112212
- Ajasin D., Eugenin E.A. HIV-1 Tat: Role in bystander toxicity. Front. Cell. Infect. Microbiol. 2020: 10: 61. https://doi.org/10.3389/fcimb.2020.00061
- Kamori D., Ueno T. HIV-1 Tat and viral latency: what we can learn from naturally occurring sequence variations. Front. Microbiol. 2017; 8: 80. https://doi.org/10.3389/fmicb.2017.00080
- Spector C., Mele A.R., Wigdahl B., Nonnemacher M.R. Genetic variation and function of the HIV-1 Tat protein. Med. Microbiol. Immunol. 2019; 208(2): 131–69. https://doi.org/10.1007/s00430- 019-00583-z
- Ranga U., Shankarappa R., Siddappa N.B., Ramakrishna L., Nagendran R., Mahalingam M., et al. Tat protein of human immunodeficiency virus type 1 subtype C strains is a defective chemokine. J. Virol. 2004; 78(5): 2586–90. https://doi.org/10.1128/jvi.78.5.2586-2590.2004
- Ruiz A.P., Ajasin D.O., Ramasamy S., DesMarais V., Eugenin E.A., Prasad V.R. A naturally occurring polymorphism in the HIV-1 Tat basic domain inhibits uptake by bystander cells and leads to reduced neuroinflammation. Sci. Rep. 2019; 9(1): 3308. https://doi.org/10.1038/s41598-019-39531-5
- Jin H., Li D., Lin M.H., Li L., Harrich D. Tat-based therapies as an adjuvant for an HIV-1 functional cure. Viruses. 2020; 12(4): 415. https://doi.org/10.3390/v12040415
- Asamitsu K., Fujinaga K., Okamoto T. HIV Tat/P-TEFb interaction: a potential target for novel anti-HIV therapies. Molecules. 2018; 23(4): 933. https://doi.org/10.3390/molecules23040933
- Lobanov M.Y., Sokolovskiy I.V., Galzitskaya O.V. IsUnstruct: prediction of the residue status to be ordered or disordered in the protein chain by a method based on the Ising model. J. Biomol. Struct. Dyn. 2013; 31(10): 1034–43. https://doi.org/10.1080/07391102.2012.718529
- Jumper J., Evans R., Pritzel A., Green T., Figurnov M., Ronneberger O., et al. Highly accurate protein structure prediction with AlphaFold. Nature. 2021; 596(7873): 583–9. https://doi.org/10.1038/s41586-021-03819-2
- Shafer R.W., Rhee S.Y., Pillay D., Miller V., Sandstrom P., Schapiro J.M., et al. HIV-1 protease and reverse transcriptase mutations for drug resistance surveillance. AIDS. 2007; 21(2): 215–23. https://doi.org/10.1097/QAD.0b013e328011e691
- Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина; 1998.
- Lobanov M.Y., Pereyaslavets L.B., Likhachev I.V., Matkarimov B.T., Galzitskaya O.V. Is there an advantageous arrangement of aromatic residues in proteins? Statistical analysis of aromatic interactions in globular proteins. Comput. Struct. Biotechnol. J. 2021; 19: 5960–8. https://doi.org/10.1016/j.csbj.2021.10.036
- Tee K.K., Thomson M.M., Hemelaar J. Editorial: HIV-1 genetic diversity, volume II. Front. Microbiol. 2022; 13: 1007037. https://doi.org/10.3389/fmicb.2022.1007037
- Бобкова М.Р. Генетическое разнообразие вирусов иммунодефицита человека и антиретровирусная терапия. Терапевтический архив. 2016; 88(11): 103–11. https://doi.org/10.17116/terarkh20168811103-111 https://elibrary.ru/xeaxsb
- Cilento M.E., Kirby K.A., Sarafianos S.G. Avoiding drug resistance in HIV reverse transcriptase. Chem. Rev. 2021; 121(6): 3271–96. https://doi.org/10.1021/acs.chemrev.0c00967
- Gotora P.T., Brown K., Martin D.R., van der Sluis R., Cloete R., Williams M.E. Impact of subtype C-specific amino acid variants on HIV-1 Tat-TAR interaction: insights from molecular modelling and dynamics. Virol. J. 2024; 21(1): 144. https://doi.org/10.1186/s12985-024-02419-6
- Mishra M., Vetrivel S., Siddappa N.B., Ranga U., Seth P. Clade-specific differences in neurotoxicity of human immunodeficiency virus-1 B and C Tat of human neurons: Significance of dicysteine C30C31 motif. Ann. Neurol. 2008; 63(3): 366–76. https://doi.org/10.1002/ana.21292
Дополнительные файлы