Вирус Эпштейна–Барр (Orthoherpesviridae: Lymphocryptovirus) у этносов России: распространенность типов ВЭБ (ВЭБ-1 и ВЭБ-2), варианты гена LMP1 и злокачественные опухоли
- Авторы: Гурцевич В.Э.1, Лубенская А.К.1, Сенюта Н.Б.1, Смирнова К.В.1,2,3
-
Учреждения:
- НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
- ФГАОУ ВО «Российский университет дружбы народов»
- ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
- Выпуск: Том 69, № 1 (2024)
- Страницы: 56-64
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16609
- DOI: https://doi.org/10.36233/0507-4088-214
- EDN: https://elibrary.ru/fibzll
- ID: 16609
Цитировать
Аннотация
Введение. Открытие двух типов вируса Эпштейна–Барр (ВЭБ) ‒ ВЭБ-1 и ВЭБ-2 ‒ стимулировало изучение их распространенности в популяциях и связи со злокачественными опухолями.
Цель исследования. Изучить персистенцию ВЭБ-1 и ВЭБ-2 среди этносов России, проанализировать ПЦР-продукты гена LMP1 в изолятах вируса и оценить вклад типов ВЭБ в заболеваемость злокачественными новообразованиями.
Материалы и методы. Изоляты ВЭБ, амплифицированные из смывов ротовой полости представителей республик Адыгея, Калмыкия, Татарстан и Московской области (МО), изучали методом гнездной ПЦР на принадлежность к ВЭБ-1 и ВЭБ-2. Ампликоны LMP1, полученные с помощью ПЦР в реальном времени из ДНК вирусных изолятов, подвергали классификации и секвенированию на автоматическом секвенаторе ДНК ABI PRISM 3100-Avant (США), а результаты секвенирования анализировали с помощью программ Chromas 230 и Vector NT (Invitrogen, США). Достоверность полученных данных оценивали с помощью статистических пакетов Statistica for Windows 10.0.
Результаты. Показатели распространенности ВЭБ-1 и ВЭБ-2 у представителей четырех этносов сравнивали с уровнями заболеваемости некоторыми опухолями у населения трех республик и МО. Доминирующая персистенция трансформирующего in vitro ВЭБ-1 у представителей Татарстана и МО коррелировала среди населения этих территорий с высокой заболеваемостью раком желудка и лимфомами. Напротив, преобладающее инфицирование не трансформирующим in vitro ВЭБ-2 представителей Адыгеи и обоими типами вируса примерно у одинакового процента представителей Калмыкии коррелировало с более низкой заболеваемостью вышеуказанными опухолями населения этих республик. Различия между показателями заболеваемости указанными новообразованиями в сравниваемых этнических популяциях были статистически недостоверными (р > 0,05). Обнаруженные варианты LMP1 не отражали ни уровень персистенции типов ВЭБ, ни частоту возникновения опухолей.
Заключение. Инфицированность этносов ВЭБ-1 и ВЭБ-2 может существенно различаться под влиянием разных факторов. Преобладание в популяции трансформирующего in vitro ВЭБ-1 не увеличивает заболеваемость опухолями за счет случаев, ассоциированных с доминирующим типом вируса.
Полный текст
Введение
Эпидемиологические данные позволяют предположить, что в мире с вирусом Эпштейна–Барр (ВЭБ) связано возникновение около 200 тыс. опухолей в год [1]. При этом биологическая особенность ВЭБ заключается в его способности индуцировать неоплазии различного клеточного происхождения, в то время как опухоли, вызываемые другими онкогенными вирусами, возникают только в клетках их тканей-мишеней. С другой стороны, известно, что ВЭБ инфицировано более 90% населения планеты, однако его присутствие в организме человека не является обязательным условием возникновения опухоли. Для реализации онкогенных потенций вируса необходимы дополнительные условия: как общие, так и отличающиеся для разных типов опухолей.
В частности, доказано, что риск возникновения эндемичной лимфомы Беркитта в странах Экваториальной Африки связан с высокой нагрузкой ВЭБ-инфекции у детей при рождении в сочетании с заражением малярийным плазмодием, оказывающим мутагенное действие на В-клетки [2]. Кроме того, риску развития рака носоглотки (РНГ) способствуют интенсивное заражение в младенчестве ВЭБ и особенности питания с первых лет жизни ребенка, характерные для культуры Южного Китая, – кормление детей соленой рыбой, богатой преканцерогенами (нитрозаминами) [3]. Нарушение иммунитета, изменяющего баланс между вирусом и хозяином в пользу вируса, также является важной предпосылкой для возникновения обоих типов опухоли.
В возникновении некоторых опухолей, например, РНГ, определенную роль играет и генетический фактор. Случаи так называемого «семейного» рака встречаются примерно в 10% случаев среди населения эндемичных по РНГ южных провинций Китая [4]. Несколько аллельных детерминант чувствительности, наиболее тесно связанных с областью HLA класса I, обнаружены также у больных РНГ вне эндемичных регионов [5].
С открытием двух типов ВЭБ (ВЭБ-1 и ВЭБ-2), различающихся генами, кодирующими ядерные антигены (EBNA-2, 3А, 3В, 3С), и биологическими свойствами, стали проводить исследования, цель которых состояла в выяснении роли каждого типа вируса в ВЭБ-ассоциированном канцерогенезе. Эти исследования базировались на фактах, согласно которым ВЭБ-1, в отличие от ВЭБ-2, способен трансформировать В-лимфоциты in vitro [6], и на результатах экспериментальных исследований, показавших более медленный рост лимфобластоидных клеточных линий, инфицированных ВЭБ-2, по сравнению с ВЭБ-1. Оказалось, однако, что оба типа вируса способны вызывать В-клеточные лимфомы у мышей линии CBH [7].
Отличаются оба типа вируса и по степени распространенности среди разных групп населения. В частности, показано, что население европеоидной расы характеризуется инфицированием преимущественно 1-м типом вируса (~74%), у здоровых лиц азиатского происхождения отмечено еще большее его преобладание (~85%) [8, 9]. Имеются также данные, указывающие на достаточно широкое распространение ВЭБ-2 среди отдельных групп населения, например лиц, бессимптомно инфицированных ВИЧ (50%) [10], больных с прогрессирующей формой ВИЧ-инфекции (62%), больных СПИДом с неходжкинской лимфомой (53%), и даже среди доноров в некоторых штатах Америки (50%) [11]. Однако вопрос о том, являются ли ВЭБ-1 и ВЭБ-2 опухоль-специфическими, остается пока без ответа.
Поиски опухоль-специфических штаммов ВЭБ велись и на базе генетического разнообразия генов латентного мембранного белка 1 (latent membrane protein 1, LMP1) ‒ LMP1, отнесенных по общепризнанной классификации R. Edwards и соавт. к 7 разным вариантам вне зависимости от типа вируса [12]. В частности, было обнаружено, что почти все изоляты ВЭБ китайского происхождения, относящиеся к 1-му типу, содержат делецию 30 п.н. с характерными аминокислотными заменами в его белковом варианте ‒ LMP1 [13]. В популяциях из других географических регионов, таких как Япония, делеция 30 п.н., обнаруживаемая в LMP1, была связана преимущественно с вирусом 2-го типа. [14]. Важно отметить, что большинство молекулярных полиморфизмов, обнаруженных в изолятах ВЭБ от здоровых вирусоносителей, с одинаковой частотой обнаруживались и в вирус-ассоциированных опухолях пациентов из того же географического региона. [15].
Возникает вопрос, могут ли типы ВЭБ и/или варианты LMP1 вируса влиять на заболеваемость определенными формами опухолей или частота последних определяется главным образом генетическими особенностями популяции и/или другими факторами. В связи с этим было бы важно изучить молекулярный профиль, а также опухоль-индуцирующие свойства изолятов ВЭБ среди разных этносов, представляющих генетически различающиеся группы населения и подвергающиеся воздействию различных факторов окружающей среды.
На основании вышеизложенного целью настоящего исследования был анализ распространенности типов ВЭБ и вариантов LMP1 у представителей четырех генетически отличающихся этносов (адыгейцев, калмыков, татар и славян) ‒ жителей разных климатических зон и географических территорий России со своим национальным бытом и культурой. Важно было также выяснить, существует ли корреляция между доминированием одного из типов ВЭБ и вариантов LMP1 и частотой возникновения злокачественных опухолей.
Материалы и методы
Объекты исследования
Изучены смывы полости рта у представителей четырех этносов (адыгейцев, калмыков, татар и славян) ‒ жителей трех республик Российской Федерации и Московской области (МО) соответственно. Подробная характеристика лиц, принявших участие в исследовании, представлена в табл. 1. Все участники были практически здоровыми людьми и представителями вышеуказанных этнических групп не менее чем в трех поколениях. Каждый смыв представлял собой клеточную суспензию, полученную индивидуально после полоскания рта в течение 30 с 15 мл стерильного физиологического раствора. Пробы смывов, собранные в герметично закрытые пластиковые пробирки, хранили при температуре +4 °С не более 2 сут до исследования. Информированное согласие было получено от всех обследованных лиц. Протокол исследования одобрен Этическим комитетом ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России (Протокол № 512 от 10.11.2021).
Таблица 1. Характеристика представителей этносов, участвовавших в исследовании
Table 1. Characteristics of ethnic group representatives involved in the study
Представители этносов Repsentatives of ethnic groups | Религия Religion | Географический регион Geographical region | Число обследованных лиц Number of investigated persons | Гендерное соотношение: М/Ж Gender ratio: M/F | Средний возраст, лет Average age, years |
Адыгейцы Adygeans | Ислам Islam | г. Майкоп, Республика Адыгея Maykop town, Republic of Adygea | 59 | 24/34 | 41,4 |
Калмыки Kalmyks | Буддизм Buddhism | г. Элиста, Республика Калмыкия Elista town, Republic of Kalmykia | 50 | 19/31 | 21,4 |
Татары Tatars | Ислам Islam | г. Казань, Республика Татарстан Kazan city, Republic of Tatarstan | 60 | 15/45 | 21,5 |
Славяне Slavs | Православие Orthodoxy | Московская область, районы Small towns, Moscow region | 40 | 21/19 | 47,5 |
Экстракция ДНК и амплификация гена LMP1
Из собранных после центрифугирования клеток смывов полости рта выделяли тотальную ДНК методом фенол-хлороформной депротеинизации. Наличие и концентрацию ДНК ВЭБ, амплифицированную из образцов тотальной ДНК, анализировали методом полимеразной цепной реакции в реальном времени (ПЦР-РВ), описанным нами ранее [16]. Амплификацию гена LMP1 из вирусной ДНК проводили в два этапа с внешними и внутренними праймерами по ранее принятой нами методике [17]. Каждый ПЦР-продукт очищали на мини-колонке QIAGEN (QIAquick PCR Purification kit, cat. 28104, Германия) согласно инструкции производителя. Для реакции использовали примерно 100–200 нг ПЦР-продукта, а концентрацию ДНК оценивали визуально в агарозном геле. В качестве положительного контроля применяли ДНК, выделенную из линии В95-8, а в качестве отрицательного контроля – воду.
Типирование ВЭБ методом гнездной ПЦР гена EBNA-2
Типирование изолятов ВЭБ на 1-й и 2-й типы (ВЭБ-1 и ВЭБ-2) проводили с помощью гнездной ПЦР, следуя описанному ранее методу [18] с незначительными модификациями. Используемые праймеры продемонстрировали высокую специфичность и отсутствие перекрестной реактивности с геномом человека и другими вирусами или микроорганизмами [19].
Секвенирование ПЦР-продуктов LMP1
Ампликоны LMP1 секвенировали в обоих направлениях. Секвенирование проводили с помощью набора реактивов ABI PRISM BigDye Terminator v. 3.1 (США) с последующим анализом продуктов реакции на автоматическом секвенаторе ДНК ABI PRISM 3100-Avant (США). Обработку данных секвенирования выполняли с помощью программ Chromas 230 и Vector NT (Invitrogene, США).
Классификация LMP1
Нуклеотидные последовательности образцов LMP1, амплифицированные из ВЭБ-изолятов, полученных из смывов полости рта, были транслированы в LMP1-аминокислотные последовательности и подверглись анализу с помощью принятой в литературе классификации R. Edwards и соавт. [12].
Статистический анализ
Количество копий ВЭБ-1 и ВЭБ-2 в смывах полости рта лиц исследуемых групп оценивали с помощью U-теста Манна–Уитни. С помощью точного теста Фишера (Fisher’s exact test) рассчитывали значение р при сравнении числа лиц, инфицированных ВЭБ 1-го или 2-го типов; различия считали статистически значимыми при р ≤ 0,05. Вычисления проводили с помощью статистических пакетов Statistica for Windows 10.0.
Результаты
Типы ВЭБ
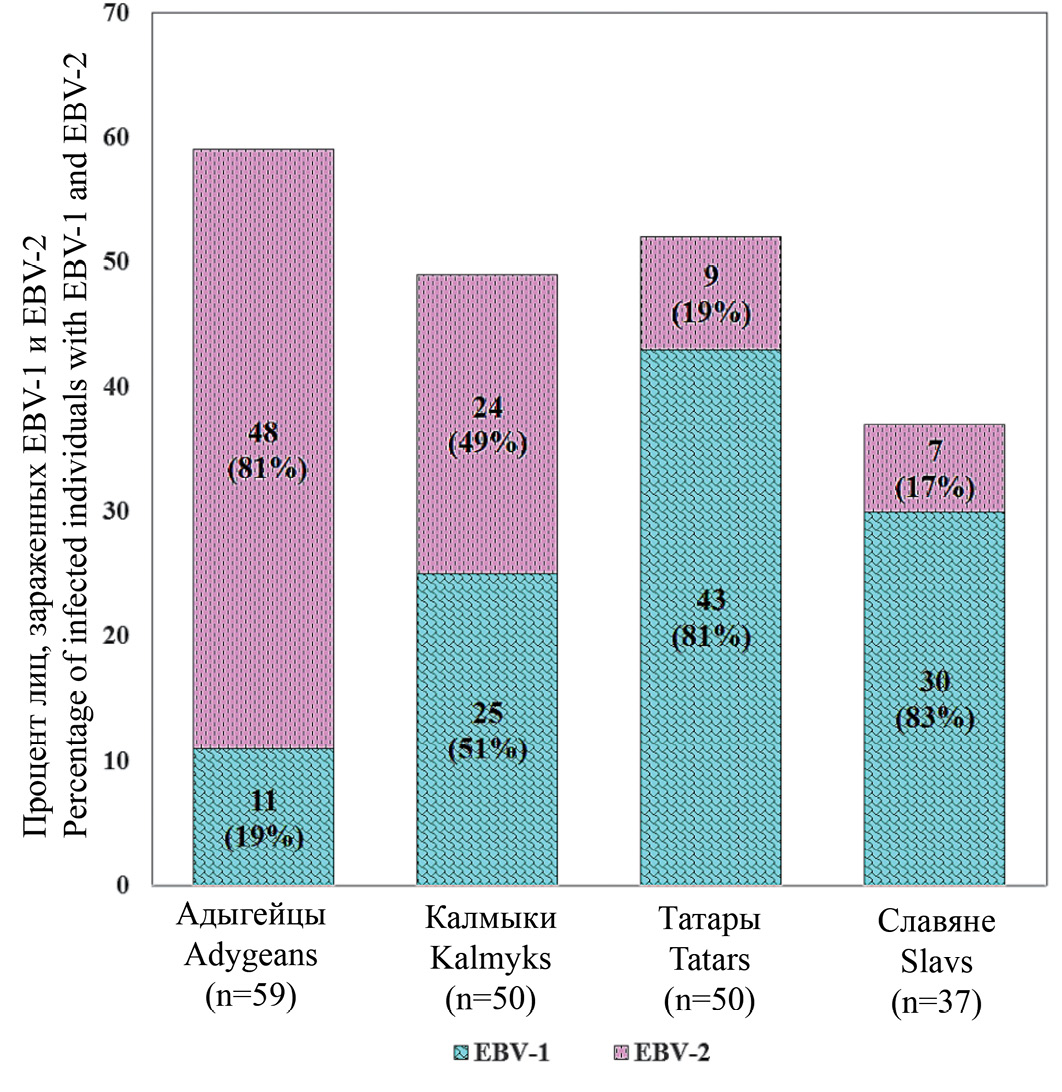
Образцы ВЭБ, амплифицированные из клеточных суспензий смывов полости рта представителей четырех этнических групп, были протестированы на типы вируса ВЭБ ‒ ВЭБ-1 и ВЭБ-2. Полученные результаты свидетельствовали о том, что в группе славян и татар доминирует ВЭБ-1 (81%, 30/37 и 83%, 43/52 соответственно), а в группе адыгейцев ‒ ВЭБ-2 (81%; 48/59) (рис. 1). Представители калмыков были инфицированы обоими типами вируса примерно в равном соотношении (51%, 25/49 с 1-м типом и 49%, 24/49 с 2-м типом). По одному случаю одновременного заражения обоими типами вируса обнаружено в группах калмыков, славян и татар.
Рис. 1. Соотношение ВЭБ-1 и ВЭБ-2 в смывах полости рта представителей четырех этносов: адыгейцев, калмыков, татар и славян.
Fig. 1. The ratio of EBV-1 and EBV-2 in oral lavages of four ethnic groups’ representatives: Adygeans, Kalmyks, Tatars and Slavs.
Полиморфизм образцов гена LMP1 ВЭБ
Нуклеотидные последовательности гена LMP1 были транслированы в аминокислотные со последующим определением варианта для каждого образца LMP1 с помощью классификации R. Edwards и соавт. [12]. Обнаруженные варианты LMP1, а также результаты их секвенирования представлены в табл. 2. Из таблицы следует, что низко трансформирующий in vitro вариант LMP1-95.8 был характерен для 100% вирусных изолятов адыгейцев. Этот вариант LMP1 был также широко представлен среди вирусных изолятов калмыков и славян (75,9 и 82,5% соответственно) и в меньшей степени – среди татар (34,1%). Вариант LMP1-China-1, аналог высоко трансформирующего in vitro китайского варианта LMP1-Cao, был идентифицирован в вирусных изолятах калмыков (17,2%), славян (7,5%) и татар (9,8%). Вариант LMP1-Med− в вирусных изолятах представителей вышеуказанных этносов встречался в 3,4, 2,5 и 14,6% случаев соответственно, а вариант LMP1-NC – только у представителей калмыков (3,4%) и славян (7,5%).
Таблица 2. Полиморфизм LMP1 в изолятах ВЭБ из смывов полости рта представителей четырех этносов
Table 2. LMP1 polymorphism in EBV isolates from oral lavages of four ethnic groups representatives
Этническая группа (количество промываний полости рта) Investigated ethnic groups (number of oral lavages) | Число амплифицированных образцов LMP1 Number of amplified LMP1 samples | Варианты LMP1 по классификации R. Edwards и соавт. [12] LMP1 variants by classification of Edwards et al. [12] | Мутации в CTAR-областях гена LMP1 Mutations in CTAR regions of the LMP1 gene | ||||||
B95.8 | China-1 | Med- | NC | ВК* OC* | CTAR 1 191-232 | CTAR 2 351-386 | CTAR 3 275-330 | ||
Адыгейцы Adygeans (n = 59) | 29/59 (49,2%) | 29/29 (100%) | 0 (0%) | 0 (0%) | 0 (0%) | – | S229T 2/29 (6,9%) | S366T 1/29 (3,4%) | S309T/N 2/29 (6,9%) |
Калмыки Kalmyks (n = 50) | 29/50 (58,0%) | 22/29 (75,9%) | 5/29 (17,2%) | 1/29 (3,4%) | 1/29 (3,4%) | – | S229T 2/29 (6,9%) | S366A/T 6/29 (20,7%) | S309/N; 8/29 (16,9%) Q322E/T 7/29 (24,1%) |
Славяне Slavs (n = 40) | 40/40 (100%) | 33/40 (82,5%) | 3/40 (7,5%) | 1/40 (2,5%) | 3/40 (7,5%) | – | S229T 8/41 (19,5%) | S366A/T 22/41 (53,6%) | S309N; 2/41(4,9%) Q322N/E; 9/41(22,0%) |
Татары Tatars (n = 60) | 41/60 (68,3%) | 14/41 (34,1%) | 4/41 (9,8%) | 6/41 (14,6%) | 0 (0%) | 17/41 (41,5%) | 0 (0%) | S366/T 19/40 (47,5%) L338S 7/40 (17,5%) | S309N; 4/40 (10,0%) Q322N/E/T 7/40 (17,5%) E328Q; 4/12 (30,0%) |
Примечание. *ВК – вне классификации.
Note. *OC – out of classification.
По классификации R. Edwards и соавт. [12] у представителей татар из 41 образца LMP1 его белковые варианты LMP1 были идентифицированы в 24 случаях. Остальные 17 (41,5%) образцов не могли быть интерпретированы с помощью этой классификации, что позволило нам обозначить их в качестве образцов «вне классификации» (ВК). Среди 17 неидентифицированных образцов LMP1 8 образцов характеризовались совокупным содержанием делеций 5 аа в кодонах 312–316 и 382–386, не характерных ни для одного из известных нам вариантов LMP1. Эта группа, принадлежащая этническим татарам и обозначенная нами как LMP1-ТатК (Татарстан-Казань), по-видимому, заслуживает дальнейшего изучения.
Секвенирование всех полученных образцов LMP1 выявило наличие важных ключевых мутаций в С-концевой области транс-активирующих доменов. В частности, в домене CTAR1 образцов LMP1, принадлежащих представителям адыгейцев, калмыков и татар, мутация кодона 229 (S→T) выявлена в 6,9, 6,9 и 19,5% случаев соответственно. В домене CTAR2 образцы LMP1 представителей всех четырех этносов содержали мутации в кодоне 366 (S→A/T) в диапазоне от 3,4 до 53,6% случаев. В домене CTAR3 образцы LMP1, полученные от представителей вышеуказанных этносов, содержали мутацию кодона 309 (S→T/N) с частотой от 4,9 до 16,9% случаев. В этом же домене у представителей калмыков, татар и славян мутация (Q→N/E/T) в кодоне 322 обнаружена в 24,1, 22,0 и 17,5% случаев соответственно, а мутация в кодоне 328 (E→Q) выявлена только у представителей славян в 30% (4/12) случаев. На основании результатов секвенирования образцов LMP1 от представителей адыгейцев, калмыков и татар можно сделать вывод о генетическом родстве штаммов ВЭБ, циркулирующих среди этих этносов. Штаммы ВЭБ славянского происхождения, хотя и характеризуются отсутствием мутаций в домене CTAR1 и повышенным количеством мутаций в доменах CTAR2 и CTAR3, с учетом остальных обнаруженных мутаций могут также считаться генетически близкими к штаммам ВЭБ, циркулирующим у остальных представителей изучаемых этносов.
Типы ВЭБ и злокачественные опухоли
С целью выяснить, влияет ли каждый из типов ВЭБ на заболеваемость злокачественными опухолями, различные показатели распространенности ВЭБ-1 и ВЭБ-2 у представителей адыгейцев, калмыков, татар и славян сравнивали с показателями заболеваемости некоторыми злокачественными новообразованиями среди населения трех национальных республик и МО. Была проанализирована заболеваемость опухолями желудка, полости рта и крови, в которых встречаются соответствующие ВЭБ-ассоциированные новообразования, такие как аденокарцинома желудка, рак миндалин и РНГ, лимфома Ходжкина и неходжкинские лимфомы. Результаты анализа представлены на рис. 2. Согласно стандартизированным показателям (на 100 тыс. населения), заболеваемость опухолями полости рта и глотки среди населения трех республик и МО была низкой и колебалась от 7 до 36 [20]. Заболеваемость раком желудка и лимфомами была значительно выше. Значения этих показателей для республики Татарстан (121 и 95 соответственно) и MО (124 и 103 соответственно) коррелировали с доминированием трансформирующего in vitro типом вируса (ВЭБ-1) у представителей этих регионов. Напротив, более низкие показатели заболеваемости этими же опухолями, раком желудка и лимфомами, наблюдали у населения Республики Адыгея (72 и 81 соответственно), представители которой были инфицированы преимущественно не трансформирующим типом вируса (ВЭБ-2), и населения Республики Калмыкия (63 и 50 соответственно), представители которой были инфицированы обоими типами вируса примерно в равных соотношениях. Статистический анализ, однако, показал, что различия между показателями заболеваемости лимфомами и раком желудка у населения Республики Татарстан и МО, с одной стороны, и республик Адыгея и Калмыкия, с другой, были статистически недостоверными (p > 0,05).
Рис. 2. Показатели заболеваемости опухолями с ВЭБ-ассоциированными случаями среди населения республик Адыгея, Калмыкия, Татарстан и Московской области.
Fig. 2. Incidence rates of malignant neoplasms with EBV-associated cases among the population of the Republics of Adygea, Kalmykia, Tatarstan and the Moscow region.
Обсуждение
Нами изучена распространенность ВЭБ-1 и ВЭБ-2 у представителей четырех этносов, генетически отличающихся и обитающих в разных географических и климатических регионах России. Показано, что соотношение лиц, инфицированных ВЭБ-1 и ВЭБ-2, у представителей каждого этноса различно, что, вероятно, связано с генетическими особенностями этносов, и в первую очередь с разнообразием их типов главного комплекса гистосовместимости (МНС). Вероятно, по этой же причине в европеоидной популяции обнаружено доминирование ВЭБ-1, тогда как население некоторых африканских стран чаще инфицировано 2-м типом вируса [21]. Исключить влияние климата и условия быта на распространение типов вируса внутри различных групп населения, по-видимому, также нельзя.
Попытки обнаружить существование опухоль-специфических штаммов ВЭБ предпринимались многими исследователями, но до сих пор были неудачными. В нашей работе доминирование трансформирующего in vitro типа ВЭБ-1 среди представителей республики Татарстан и МО коррелировало с более высокой заболеваемостью населения этих территориальных образований раком желудка и лимфомами. Напротив, более низкие уровни заболеваемости этими новообразованиями у населения других республик сочетались с преимущественным распространением нетрансформирующего типа ВЭБ-2 у представителей республики Адыгея и обоих типов вируса в равных соотношениях у представителей Республики Калмыкия. Однако различия между показателями заболеваемости этими опухолями у изучаемых этносов оказались статистически недостоверными (р > 0,05). Тем не менее полученные данные представляют интерес и требуют дополнительных исследований. Можно предположить, что для выяснения влияния ВЭБ-инфекции на возникновение злокачественных опухолей важно определить частоту ВЭБ-ассоциированных случаев среди опухолей изучаемой локализации. Установление соотношения опухолей, ассоциированных с трансформирующим и нетрансформирующим типами ВЭБ (ВЭБ-1 и ВЭБ-2), также могло бы внести важный вклад в изучение канцерогенеза, ассоциированного с ВЭБ.
Об авторах
Владимир Эдуардович Гурцевич
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Автор, ответственный за переписку.
Email: gurtsevitch-vlad-88@yandex.ru
ORCID iD: 0000-0003-1840-4364
д-р мед. наук, профессор, главный научный консультант лаборатории вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Россия, 115478, г. МоскваАлександра Кирилловна Лубенская
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Email: lubenskoy.96@mail.ru
ORCID iD: 0000-0003-3953-7449
научный сотрудник, лаборатория вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Россия, 115478, г. Москва,Наталья Борисовна Сенюта
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России
Email: nat.senyuta@yandex.ru
ORCID iD: 0000-0001-8915-8274
канд. мед. наук, научный консультант лаборатории вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
Россия, 115478, г. МоскваКсения Валерьевна Смирнова
НИИ канцерогенеза ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России; ФГАОУ ВО «Российский университет дружбы народов»; ФГАОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И. Пирогова» Минздрава России
Email: skv.lab@yandex.ru
ORCID iD: 0000-0001-6209-977X
канд. биол. наук, заведующая лабораторией вирусного канцерогенеза, НИИ канцерогенеза ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, РУДН, ФГАОУ ВО «РНИМУ им. Н.И. Пирогова» Минздрава России
Россия, 115478, г. Москва; 117198, г. Москва; 117997, г. МоскваСписок литературы
- Shannon-Lowe C., Rickinson A. The global landscape of EBV-associated tumors. Front. Oncol. 2019; 9: 713. https://doi.org/10.3389/fonc.2019.00713
- Graham B.S., Lynch D.T. Burkitt Lymphoma. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023.
- Tsao S.W., Tsang C.M., Lo K.W. Epstein-Barr virus infection and nasopharyngeal carcinoma. Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2017; 372(1732): 20160270. https://doi.org/10.1098/rstb.2016.0270
- Bei J.X., Zuo X.Y., Liu W.S., Guo Y.M., Zeng Y.X. Genetic susceptibility to the endemic form of NPC. Chin. Clin. Oncol. 2016; 5(2): 15. https://doi.org/10.21037/cco.2016.03.11
- Su W.H., Hildesheim A., Chang Y.S. Human leukocyte antigens and Epstein–Barr virus-associated nasopharyngeal carcinoma: old associations offer new clues into the role of immunity in infection-associated cancers. Front. Oncol. 2013; 3: 299. https://doi.org/10.3389/fonc.2013.00299
- Rickinson A.B., Young L.S., Rowe M. Influence of the Epstein-Barr virus nuclear antigen EBNA 2 on the growth phenotype of virus-transformed B cells. J. Virol. 1987; 61(5): 1310–7. https://doi.org/10.1128/jvi.61.5.1310-1317.1987
- Romero-Masters J.C., Huebner S.M., Ohashi M., Bristol J.A., Benner B.E., Barlow E.A., et al. B cells infected with Type 2 Epstein–Barr virus (EBV) have increased NFATc1/NFATc2 activity and enhanced lytic gene expression in comparison to Type 1 EBV infection. PLoS Pathog. 2020; 16(2): e1008365. https://doi.org/10.1371/journal.ppat.1008365
- Correa R.M., Fellner M.D., Alonio L.V., Durand K., Teyssié A.R., Picconi M.A. Epstein–Barr virus (EBV) in healthy carriers: Distribution of genotypes and 30 bp deletion in latent membrane protein-1 (LMP-1) oncogene. J. Med. Virol. 2004; 73(4): 583–8. https://doi.org/10.1002/jmv.20129
- Srivastava G., Wong K.Y., Chiang A.K., Lam K.Y., Tao Q. Coinfection of multiple strains of Epstein–Barr virus in immunocompetent normal individuals: reassessment of the viral carrier state. Blood. 2000; 95(7): 2443–5.
- Van Baarle D., Hovenkamp E., Kersten M.J., Klein M.R., Miedema F., van Oers M.H. Direct Epstein–Barr virus (EBV) typing on peripheral blood mononuclear cells: no association between EBV type 2 infection or superinfection and the development of acquired immunodeficiency syndrome-related non-Hodgkin’s lymphoma. Blood. 1999; 93(11): 3949–55.
- Sixbey J.W., Shirley P., Chesney P.J., Buntin D.M., Resnick L. Detection of a second widespread strain of Epstein–Barr virus. Lancet. 1989; 2(8666): 761–5. https://doi.org/10.1016/s0140-6736(89)90829-5
- Edwards R.H., Seillier-Moiseiwitsch F., Raab-Traub N. Signature amino acid changes in latent membrane protein 1 distinguish Epstein–Barr virus strains. Virology. 1999; 261(1): 79–95. https://doi.org/10.1006/viro.1999.9855
- Cheung S.T., Leung S.F., Lo K.W., Chiu K.W., Tam J.S., Fok T.F., et al. Specific latent membrane protein 1 gene sequences in type 1 and type 2 Epstein-Barr virus from nasopharyngeal carcinoma in Hong Kong. Int. J. Cancer. 1998; 76(3): 399–406. https://doi.org/10.1002/(sici)1097-0215(19980504)76:3<399::aid-ijc18>3.0.co;2-6
- Oshima M., Azuma H., Okuno A. High prevalence of Epstein-Barr virus type A strain with the 30 b.p. deletion of the latent membrane protein-1 gene in a Japanese population. Pediatr. Int. 1999; 41(5): 490–5. https://doi.org/10.1046/j.1442-200x.1999.01122.x
- Khanim F., Yao Q.Y., Niedobitek G., Sihota S., Rickinson A.B., Young L.S. Analysis of Epstein–Barr virus gene polymorphisms in normal donors and in virus-associated tumors from different geographic locations. Blood. 1996; 88(9): 3491–501.
- Смирнова К.В., Сенюта Н.Б., Ботезату И.В., Душенькина Т.Е., Лубенская А.К., Фроловская А.А. и др. Вирус Эпштейна–Барр у этнических татар: инфицированность и сиквенсные варианты онкогена LMP1. Успехи молекулярной онкологии. 2018; 5(3): 65–74. https://doi.org/10.17650/2313-805X-2018-5-3-65-74 https://elibrary.ru/vloxpu
- Hahn P., Novikova E., Scherback L., Janik C., Pavlish O., Arkhipov V., et al. The LMP1 gene isolated from Russian nasopharyngeal carcinoma has no 30-bp deletion. Int. J. Cancer. 2001; 91(6): 815–21. https://doi.org/10.1002/1097-0215(200002)9999:9999<:aid-ijc1122>3.0.co;2-w
- Hassan R., White L.R., Stefanoff C.G., de Oliveira D.E., Felisbino F.E., Klumb C.E., et al. Epstein–Barr virus (EBV) detection and typing by PCR: a contribution to diagnostic screening of EBV-positive Burkitt’s lymphoma. Diagn. Pathol. 2006; 1: 17. https://doi.org/10.1186/1746-1596-1-17
- Salahuddin S., Khan J., Azhar J., B. Whitehurst C., Qadri I., Shackelford J., et al. Prevalence of Epstein–Barr Virus Genotypes in Pakistani Lymphoma Patients. Asian Pac. J. Cancer Prev. 2018; 19(11): 3153–9. https://doi.org/10.31557/APJCP.2018.19.11.3153
- Каприн А.Д., Старинский В.В., Шахзадова А.О., ред. Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). М.; 2021.
- Young L.S., Yao Q.Y., Rooney C.M., Sculley T.B., Moss D.J., Rupani H., et al. New type B isolates of Epstein–Barr virus from Burkitt’s lymphoma and from normal individuals in endemic areas. J. Gen. Virol. 1987; 68(Pt. 11): 2853–62. https://doi.org/10.1099/0022-1317-68-11-2853
Дополнительные файлы