Выявление антител к вирусу гепатита Е у домашних северных оленей (Rangifer tarandus) в Республике Саха (Якутия)
- Авторы: Кичатова В.С.1,2,3, Потемкин И.А.1,2,3, Асади Мобархан Ф.А.1,2, Румянцева Т.Д.4, Семенов С.И.5, Кюрегян К.К.1,2, Михайлов М.И.1,2
-
Учреждения:
- ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора
- ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова»
- ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
- ФГБОУ ВО «Арктический государственный агротехнологический университет»
- ФГАОУ ВО «Северо-Восточный федеральный университет им. М.К. Аммосова»
- Выпуск: Том 68, № 6 (2023)
- Страницы: 549-556
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16590
- DOI: https://doi.org/10.36233/0507-4088-206
- EDN: https://elibrary.ru/ifzfnu
- ID: 16590
Цитировать
Аннотация
Введение. Несмотря на то что домашние и дикие свиньи являются основным резервуаром зоонозных генотипов вируса гепатита E (ВГЕ) в странах умеренного климата, наличие антител к ВГЕ (анти-ВГЕ) у коренного населения приполярных территорий, т.е. за пределами ареала обитания диких и домашних свиней, указывает на наличие альтернативного резервуара вируса. Потенциальным резервуаром ВГЕ в приполярных регионах могут являться северные олени (Rangifer tarandus).
Целью исследования являлось определение распространенности анти-ВГЕ среди домашних северных оленей на территории Республики Саха (Якутия).
Материалы и методы. Образцы сыворотки крови от 497 домашних оленей из Оймяконского (n = 425) и Усть-Янского районов (n = 72) Республики Саха (Якутия) были исследованы на анти-ВГЕ методом иммуноферментного анализа с помощью коммерческого набора реагентов «ДС-ИФА-АНТИ-ВГЕ-G» (ООО «Диагностические системы-Столица», Россия) по протоколу производителя, однако вместо человеческого специфического конъюгата из набора использовали кроличьи поликлональные антитела против IgG оленя, меченные пероксидазой хрена (KPL, США) в разведении 1 : 100 в фосфатно-солевом буфере.
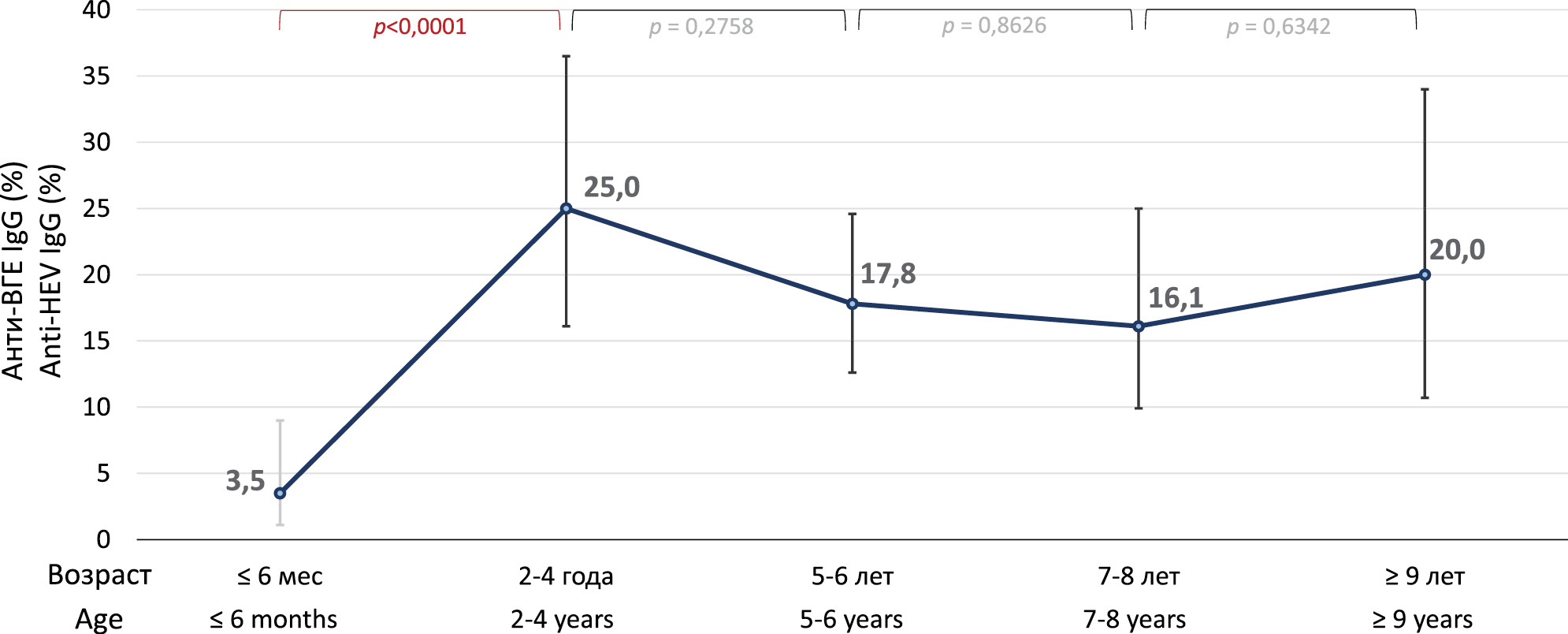
Результаты. В среднем частота выявления анти-ВГЕ в сыворотках северных оленей составила 15,5% (95% ДИ 12,6–19,0%). Частота выявления анти-ВГЕ достоверно увеличивалась с возрастом: с 3,5% (95% ДИ 1,1–9,0%) у оленят в возрасте 3–6 мес до 25,0% (95% ДИ 1,6–36,5%) у оленей в возрасте 2–4 года (р < 0,0001), и начиная с этого возраста выходили на плато, не различаясь достоверно между более старшими возрастными группами (p > 0,05). В целом частота выявления анти-ВГЕ среди оленей в возрасте 2 года и старше составила 19,0% (95% ДИ 15,3–23,4%). Статистически значимые различия по частоте выявления анти-ВГЕ между самками и самцами северных оленей отсутствовали как среди взрослых животных, так и среди оленят.
Заключение. Полученные результаты выявления анти-ВГЕ среди домашних северных оленей в Республике Саха (Якутия) свидетельствуют о широком распространении среди этих животных инфекции, вызываемой ВГЕ или антигенно сходным вирусом. Выявленная динамика накопления антител в популяции северных оленей свидетельствует о том, что инфицирование, по-видимому, происходит в первые 2 года жизни животного.
Ключевые слова
Полный текст
Введение
Вирус гепатита Е (ВГЕ), или Paslahepevirus balayani (семейство Hepeviridae, род Paslahepevirus) в соответствии с номенклатурой ICTV, представляет собой РНК-содержащий вирус, вызывающий острый, а у пациентов с иммуносупресией – хронический гепатит [1]. Кроме того, для этого вируса характерна тропность не только к гепатоцитам, но и к широкому спектру других тканей, что обусловливает часто регистрируемые внепеченочные проявления инфекции, в том числе неврологические [2]. ВГЕ ежегодно вызывает в мире не менее 20 млн случаев заражения, из которых около 3,3 млн сопровождаются развитием симптомов заболевания, с уровнем смертности 0,2–4,0%, и является наиболее распространенной причиной острого вирусного гепатита [3]. Ранее считалось, что эта инфекция актуальна для тропических стран с низким уровнем санитарного благополучия, но в последние годы благодаря повышению осведомленности, увеличению надзора за ВГЕ и охвата диагностикой, стало понятно, что ВГЕ-инфекция широко распространена и в индустриальных странах [4]. Результаты последних исследований показывают, что для России также характерны широкая распространенность ВГЕ и особенности эпидемиологии инфекции, наблюдаемые в индустриальных странах умеренного климата [5].
Эпидемиология и, очевидно, патогенность ВГЕ-инфекции во многом зависят от генотипа ВГЕ. В настоящее время известно 8 генотипов ВГЕ [6]. Генотипы 1 и 2 являются строго антропонозными и вызывают вспышки и спорадические случаи в развивающихся странах [7]. Другие генотипы вируса способны инфицировать разные виды млекопитающих: диких кабанов (генотипы 3, 5 и 6), домашних свиней (генотипы 3 и 4), оленей (генотипы 3 и 4), кроликов (генотип 3ra) и верблюдов (генотипы 7 и 8) [8]. С генотипами 3 и 4 связаны все незавозные (автохтонные) случаи заражения человека ВГЕ в индустриальных странах, при этом домашние свиньи признаны основным источником инфекции. Согласно консолидированному мнению экспертов, ВГЕ занимает 6-е место среди вирусов с высоким риском зоонозной передачи, что подчеркивает его зоонозный потенциал [9]. Кроме собственно ВГЕ, ряд других представителей семейства Hepeviridae, в первую очередь циркулирующий среди крыс Rocahepevirus ratti, также способны вызывать заболевание у человека [10].
Несмотря на то что свиньи, домашние и дикие, являются основным зоонозным резервуаром ВГЕ генотипов 3 и 4 в странах умеренного климата, наличие антител к ВГЕ (анти-ВГЕ) у коренного населения приполярных территорий [11], т.е. за пределами ареала обитания диких и домашних свиней, указывает на наличие альтернативного резервуара вируса. Потенциальным резервуаром ВГЕ в приполярных регионах могут являться северные олени (Rangifer tarandus). Северный олень является главным сельскохозяйственным животным на огромных приполярных территориях и основным источником мяса для населения этих территорий, в том числе для коренного населения Севера. Известно, что помимо свиней, ВГЕ генотипов 3 и 4 выявляются у разных видов европейских и азиатских оленей [12]. Кроме того, у лосей был идентифицирован вирус Paslahepevirus alci, наиболее филогенетически близкий к ВГЕ из всех гепевирусов [13]. Однако, несмотря на несколько сообщений о выявлении анти-ВГЕ у северных оленей [14–16], сам вирус от этого вида животных до сих пор не выделен.
Ранее нами были описаны случаи выявления анти-ВГЕ как у оленеводов, так и у домашних северных оленей на территории Республики Саха (Якутия) [17]. Целью настоящего исследования являлось определение распространенности анти-ВГЕ у северных оленей в Якутии на расширенной выборке, включающей в себя оленей разных возрастов: от оленят моложе одного года до животных старше 10 лет.
Материалы и методы
Всего в летне-осенние периоды 2022–2023 гг. были собраны 497 образцов сыворотки крови от домашних оленей на территориях Оймяконского (n = 425) и Усть-Янского районов (n = 72) Республики Саха (Якутия). В Усть-Янском районе были собраны преимущественно образцы сыворотки крови от оленят в возрасте до 4 мес (n = 60), тогда как в Оймяконском районе – образцы от животных всех возрастных групп: от оленят в возрасте до 6 мес до оленей старше 10 лет. Распределение образцов по регионам исследования и в общей выборке в зависимости от пола и возраста животных приведено в табл. 1. Для 21 образца пол и точный возраст животного не были известны, однако они были получены от животных 2 лет и старше, в связи с чем их учитывали при расчете среднего значения частоты выявления анти-ВГЕ и среднего значения коэффициента позитивности (КП), но исключали из дальнейшего анализа распределения показателей серопозитивности в зависимости от пола и возраста животных.
Таблица 1. Распределение образцов сыворотки крови северных оленей в зависимости от пола и возраста животных
Table 1. Distribution of blood serum samples of reindeer depending on sex and age of animals
Возраст Age | Пол Sex | Оймяконский район Oymyakonsky District | Усть-Янский район Ust-Yansky District | Всего Total |
До 6 мес Les than 6 months | Самки Female | 44 | 28 | 72 |
Самцы Male | 9 | 32 | 41 | |
Всего Total | 53 | 60 | 113 | |
2–4 года 2–4 years | Самки Female | 38 | 6 | 44 |
Самцы Male | 20 | 4 | 24 | |
Всего Total | 58 | 10 | 68 | |
5–6 лет 5–6 years | Самки Female | 139 | 1 | 140 |
Самцы Male | 16 | 1 | 17 | |
Всего Total | 155 | 2 | 157 | |
7–8 лет 7–8 years | Самки Female | 89 | 0 | 89 |
Самцы Male | 4 | 0 | 4 | |
Всего Total | 93 | 0 | 93 | |
Старше 9 лет Over 9 years | Самки Female | 41 | 0 | 41 |
Самцы Male | 4 | 0 | 4 | |
Всего Total | 45 | 0 | 45 | |
Не установлен Undetermined | Не установлен Undetermined | 21 | 0 | 21 |
Сбор образцов крови проводили в рамках планового ветеринарного контроля с соблюдением институциональных и национальных стандартов по этическому обращению с животными. Протокол исследования был одобрен Этическим комитетом ФГАОУ ВО «Северо-Восточный федеральный университет им. М.К. Аммосова» (протокол № 34 от 30.03.2022).
Образцы крови собирали из яремной вены животного в пробирки для крови (BD Vacutainer; BD, Великобритания) с использованием ветеринарной иглы Боброва («МИЗ-Ворсма», Россия) для оленей в возрасте 2 года и старше или иглы инъекционной (KDM, KD-FINE 18G × 1,5”, Германия) для оленят в возрасте до года. Отделение сыворотки проводили путем естественного отстаивания в течение 24 ч при температуре 18–20 °С. Образцы сыворотки крови переносили в стерильные полипропиленовые пробирки и хранили при 2–8 °С не более 2 сут, затем замораживали при температурном режиме от −18 до −20 °С и транспортировали с соблюдением холодовой цепи в лабораторию, где хранили при −70 °С до тестирования.
Анти-ВГЕ класса IgG определяли с помощью коммерческого набора реагентов «ДС-ИФА-АНТИ-ВГЕ-G» (ООО «Диагностические системы-Столица», Россия) по протоколу производителя, однако вместо человеческого специфического конъюгата из набора использовали кроличьи поликлональные антитела против IgG оленя, меченные пероксидазой хрена (KPL, США) в разведении 1 : 100 в фосфатно-солевом буфере. Применявшийся набор основан на рекомбинантном антигене капсидного белка ВГЕ, высококонсервативном у разных генотипов ВГЕ, и имеет чувствительность 1000 мМЕ/мл [18]. Оптическую плотность (ОП) измеряли спектрофотометрически при длине волны 450 нм. ВГЕ-положительные и отрицательные контрольные образцы, поставляемые с набором, использовали в качестве положительного и отрицательного контроля в каждом планшете соответственно. Анти-ВГЕ-реактивную сыворотку крови оленей, полученную в предыдущем исследовании [17], также использовали для мониторинга воспроизводимости результатов между постановками. Образцы со значениями ОП, превышающие пороговое значение (0,20 плюс средняя ОП отрицательных контролей), считали реактивными. Для каждого реактивного образца рассчитывали КП как отношение ОП образца к пороговому значению ОП.
Статистический анализ результатов выполняли с использованием программного обеспечения GraphPad 10.0.2 (https://www.graphpad.com/). Статистическая обработка данных включала: определение средних показателей величин, расчет 95% доверительного интервала (95% ДИ), выявление достоверности различий средних значений показателей в сравниваемых группах с использованием критерия Фишера (для относительных показателей) и непарного критерия Стьюдента (для количественных показателей). Различия оценивались как статистически значимые при p ≤ 0,05.
Результаты
В среднем частота выявления анти-ВГЕ в сыворотке крови северных оленей составила 15,5% (77/497; 95% ДИ 12,6–19,0%). В образцах от оленей из Оймяконского района частота выявления анти-ВГЕ составила 16,5% (70/425; 95% ДИ 13,2–20,3%), а в образцах из Усть-Янского района – 9,7% (7/72; 95% ДИ 4,5–19,0%), при этом различия между районами не были статистически значимы (р = 0,1618). В связи с этим для дальнейшего анализа две выборки были объединены. Результаты выявления анти-ВГЕ в разных возрастных группах оленей приведены на рисунке. Частота выявления анти-ВГЕ достоверно увеличивалась с 3,5% (4/113; 95% ДИ 1,1–9,0%) у оленят в возрасте 3–6 мес до 25,0% (17/68; 95% ДИ 16,1–36,5%) у оленей в возрасте 2–4 года (р < 0,0001), и начиная с этого возраста выходила на плато, не различаясь достоверно между более старшими возрастными группами (p > 0,05). В целом частота выявления анти-ВГЕ среди оленей в возрасте 2 года и старше составила 19,0% (69/363; 95% ДИ 15,3–23,4%), что достоверно превышало аналогичный показатель среди оленят в возрасте не старше 6 мес (р = 0,0002).
Рисунок. Показатели частоты выявления анти-ВГЕ в разных возрастных группах северных оленей.
Figure. Frequency rates of anti-HEV detection in different age groups of reindeer.
Показатели частоты выявления анти-ВГЕ в зависимости от пола животных приведены в табл. 2. Статистически значимые различия по частоте выявления анти-ВГЕ между самками и самцами северных оленей отсутствовали как среди взрослых животных, так и среди оленят.
Таблица 2. Показатели частоты выявления анти-ВГЕ у самцов и самок северных оленей
Table 2. Frequency rates of anti-HEV detection in male and female reindeer
Возрастная группа Age group | Анти-ВГЕ, n реактивных/N обследованных животных (%) Anti-HEV, n reactive/N animals examined (%) | p* | |
самцы males | самки females | ||
Оленята, 4–6 мес Calves, 4–6 months | 2/39 (5,1%) | 2/70 (2,9%) | 0,6202 |
Взрослые олени, 2 года и старше Adult reindeer, 2 years and older | 12/37 (32,4%) | 57/257 (22,2%) | 0,3272 |
Примечание. *Значения р получены при сравнении между двумя группами животных с использованием критерия Фишера.
Note. *p values were obtained when comparing between two groups of reindeer using Fisher’s exact test.
Среднее значение КП реактивных по анти-ВГЕ образцов сыворотки крови северных оленей (±SD) составило 4,03 ± 3,54; 57,1% (44/77) реактивных по анти-ВГЕ образцов имели КП ≥ 2. Средние значения КП реактивных сывороток в зависимости от возраста животных приведены в табл. 3. Статистически значимые различия между показателями средней величины КП в зависимости от возраста животных выявлены не были.
Таблица 3. Средние значения коэффициента позитивности реактивных по анти-ВГЕ сывороток северных оленей в разных возрастных группах животных
Table 3. Mean values of the cut-off index of anti-HEV reactive sera of reindeer in different age groups of animals
Возрастная группа Age group | Среднее значение КП ± SD Average COI value ± SD | p* |
4–6 мес 4–6 months | 3,77 ± 3,23 | |
2–4 года 2–4 years | 3,98 ± 2,85 | 0,8959 |
5–6 лет 5–6 years | 4,41 ± 4,32 | 0,7775 |
7–8 лет 7–8 years | 3,81 ± 3,51 | 0, 9844 |
9 лет и старше 9 years and older | 3,71 ± 2,86 | 0, 9747 |
Все возрастные группы All age groups | 4,03 ± 3,54 | 0,8822 |
Примечание. *Значения р при сравнении с данными для группы оленят с использованием непарного критерия Стьюдента.
Note. *p values when compared to the data for the reindeer calves using unpaired Student’s test.
Обсуждение
Полученные результаты свидетельствуют о широком распространении инфекции, вызываемой ВГЕ или антигенно сходным вирусом, среди поголовья домашних северных оленей в Якутии. Выявление анти-ВГЕ у северных оленей в настоящем исследовании не обязательно свидетельствует о циркуляции среди этих животных именно вируса вида Paslahepevirus balayani, поскольку для капсидных белков разных представителей семейства Hepeviridae продемонстрирована перекрестная антигенная реактивность [19–21]. Именно антитела к капсидному белку ВГЕ являются, как правило, мишенью для серологических тестов, используемых для диагностики гепатита Е, в том числе для тест-системы, применявшейся в настоящем исследовании. Таким образом, реактивность сыворотки крови северных оленей в нашем исследовании может свидетельствовать о наличии антител к ВГЕ или другим ВГЕ-подобным вирусам. Косвенным свидетельством специфичности выявления анти-ВГЕ в нашем исследовании является величина КП, превышающая показатель 1,5, в 71,4% реактивных образцов.
Средняя частота выявления анти-ВГЕ в настоящем исследовании (15,5%) оказалась сходной с долей серопозитивных полуодомашненных северных оленей в Норвегии (15,7%) [16], но значительно выше, чем в Канаде (8,8%) [14]. Сравнение с ранее полученными нами результатами выявления анти-ВГЕ в меньшей выборке северных оленей из Оймяконского и Анабарского районов Якутии (12,0%; 23/191) [17] продемонстрировало отсутствие достоверных различий (p = 0,2783). Как и во всех упомянутых выше исследованиях, доля серопозитивных самцов и самок в настоящем исследовании оказалась сходной. В то же время нами впервые продемонстрировано достоверное увеличение частоты выявления анти-ВГЕ по мере взросления животных – по сравнению с оленятами в возрасте 4–6 мес, распространенность анти-ВГЕ возрастала среди животных, достигших 2 лет, и сохранялась примерно на одном уровне в более старших возрастных группах. В обследованных в Норвегии группах северных оленей анти-ВГЕ несколько чаще встречались среди взрослых животных по сравнению с оленятами, однако эти различия не были статистически значимыми [16], вероятно, из-за небольших размеров выборок в каждом обследованном регионе страны.
Следует отметить, что поиск ВГЕ у северных оленей до настоящего времени не проводили систематически. Несколько исследований, в которых для детекции РНК ВГЕ использовали праймеры, специфичные для Paslahepevirus balayani, дали отрицательный результат [14, 17]. Не были выявлены последовательности гепевирусов и при использовании метагеномного подхода для анализа образцов сыворотки крови и ректальных мазков от диких и домашних северных оленей из Фенноскандии и Якутии [22]. Причинами неудачи при поиске РНК ВГЕ у этих животных могли быть, в случае использования ВГЕ-специфичных праймеров, значительное генетическое различие между ВГЕ северного оленя и известными штаммами вида Paslahepevirus balayani, а также тот факт, что поиск ВГЕ проводили в основном среди взрослых животных. Среди домашних свиней большинство случаев заражения ВГЕ происходит у поросят в возрасте 2–4 мес, поскольку они становятся восприимчивыми к вирусу после исчезновения материнских антител [23]. Аналогичным образом, большинство случаев заражения ВГЕ у северных оленей также может возникать в раннем возрасте, на что указывают полученные нами результаты выявления анти-ВГЕ у животных разного возраста. Выявленная динамика накопления антител в популяции северных оленей свидетельствует о том, что инфицирование, по-видимому, происходит в первые 2 года жизни, после чего у животных сохраняется гуморальный иммунитет. Таким образом, дальнейший поиск последовательностей гепевирусов у северных оленей целесообразно проводить среди молодых животных, с использованием метагеномных методов или более универсальных праймеров, если применяется метод полимеразной цепной реакции.
Заключение
Полученные результаты выявления анти-ВГЕ среди домашних северных оленей в Республике Саха (Якутия) свидетельствует о широком распространении среди этих животных инфекции, вызываемой ВГЕ или антигенно сходным вирусом. Динамика накопления анти-ВГЕ в популяции северных оленей косвенно свидетельствует об особенности эпидемиологии инфекции, похожей на наблюдаемую среди поголовья свиней, – встреча с вирусом происходит, как правило, у молодых животных с последующей сероконверсией и формированием иммунитета. Аналогично ситуации, наблюдаемой в свиноводстве, риск инфицирования для человека, вероятно, является наибольшим при контакте с оленятами, поскольку для них выше вероятность наличия репликации вируса, сопровождаемой виремией и выделением вируса.
Об авторах
Вера Сергеевна Кичатова
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова»; ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Автор, ответственный за переписку.
Email: vera_kichatova@mail.ru
ORCID iD: 0000-0002-7838-6965
канд. мед. наук, старший научный сотрудник лаборатории молекулярной эпидемиологии вирусных гепатитов ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; научный сотрудник лаборатории вирусных гепатитов ФГБНУ НИИВС им. И.И. Мечникова; старший научный сотрудник отдела социально значимых вирусных инфекций ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Россия, 111123, г. Москва; 105064, г. Москва; 125993, г. МоскваИлья Александрович Потемкин
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова»; ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России
Email: axi0ma@mail.ru
ORCID iD: 0000-0001-7559-4219
канд. мед. наук, старший научный сотрудник лаборатории молекулярной эпидемиологии вирусных гепатитов ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; научный сотрудник лаборатории вирусных гепатитов ФГБНУ НИИВС им. И.И. Мечникова; старший научный сотрудник отдела социально значимых вирусных инфекций ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
Россия, 111123, г. Москва; 105064, г. Москва; 125993, г. МоскваФедор Алиевич Асади Мобархан
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова»
Email: 1amfa@bk.ru
ORCID iD: 0000-0002-1838-8037
научный сотрудник лаборатории молекулярной эпидемиологии вирусных гепатитов ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; младший научный сотрудник лаборатории вирусных гепатитов ФГБНУ НИИВС им. И.И. Мечникова, Москва, Россия
Россия, 111123, г. Москва; 105064, г. МоскваТатьяна Дмитриевна Румянцева
ФГБОУ ВО «Арктический государственный агротехнологический университет»
Email: tanya_rum@mail.ru
ORCID iD: 0000-0003-0997-5499
ведущий научный сотрудник Научно-исследовательской части ФГБОУ ВО «Арктический государственный агротехнологический университет», Якутск, Россия
Россия, 677008, г. Якутск, Республика Саха (Якутия)Сергей Иннокентьевич Семенов
ФГАОУ ВО «Северо-Восточный федеральный университет им. М.К. Аммосова»
Email: insemenov@yandex.ru
ORCID iD: 0000-0001-8099-2270
д-р мед. наук, ведущий научный сотрудник НИЦ Медицинского института ФГАОУ ВО СВФУ им. М.К. Аммосова, Якутск, Россия
Россия, 677010, г. Якутск, Республика Саха (Якутия)Карен Каренович Кюрегян
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова»
Email: karen-kyuregyan@yandex.ru
ORCID iD: 0000-0002-3599-117X
д-р биол. наук, профессор РАН, заведующий лабораторией молекулярной эпидемиологии вирусных гепатитов ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; ведущий научный сотрудник лаборатории вирусных гепатитов ФГБНУ НИИВС им. И.И. Мечникова, Москва, Россия
Россия, 111123, г. Москва; 105064, г. МоскваМихаил Иванович Михайлов
ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора; ФГБНУ «Научно-исследовательский институт вакцин и сывороток им. И.И. Мечникова»
Email: michmich2@yandex.ru
ORCID iD: 0000-0002-6636-6801
д-р мед. наук, чл.-корр. РАН, главный научный сотрудник лаборатории молекулярной эпидемиологии вирусных гепатитов ФБУН ЦНИИ Эпидемиологии Роспотребнадзора; заведующий лабораторией вирусных гепатитов ФГБНУ НИИВС им. И.И. Мечникова, Москва, Россия
Россия, 111123, г. Москва; 105064, г. МоскваСписок литературы
- Purdy M.A., Drexler J.F., Meng X.J., Norder H., Okamoto H., Van der Poel W.H.M., et al. ICTV virus taxonomy profile: Hepeviridae 2022. J. Gen. Virol. 2022; 103(9). https://doi.org/10.1099/jgv.0.001778
- Pischke S., Hartl J., Pas S.D., Lohse A.W., Jacobs B.C., Van der Eijk A.A. Hepatitis E virus: Infection beyond the liver? J. Hepatol. 2017; 66(5): 1082–95. https://doi.org/10.1016/j.jhep.2016.11.016.
- WHO. Hepatitis E: Fact Sheet; 2020. Available at: https://www.who.int/news-room/fact-sheets/detail/hepatitis-e
- Kamar N., Izopet J., Pavio N., Aggarwal R., Labrique A., Wedemeyer H., et al. Hepatitis E virus infection. Nat. Rev. Dis. Primers. 2017; 3: 17086. https://doi.org/10.1038/nrdp.2017.86
- Mikhailov M.I., Karlsen A.A., Potemkin I.A., Isaeva O.V., Kichatova V.S., Malinnikova E.Y., et al. Geographic and temporal variability of hepatitis E virus circulation in the Russian Federation. Viruses. 2022; 15(1): 37. https://doi.org/10.3390/v15010037
- Smith D.B., Izopet J., Nicot F., Simmonds P., Jameel S., Meng X.J., et al. Update: proposed reference sequences for subtypes of hepatitis E virus (species Orthohepevirus A). J. Gen. Virol. 2020; 101(7): 692–8. https://doi.org/10.1099/jgv.0.001435
- Nelson K.E., Labrique A.B., Kmush B.L. Epidemiology of genotype 1 and 2 hepatitis E virus infections. Cold Spring Harb. Perspect. Med. 2019; 9(6): a031732. https://doi.org/10.1101/cshperspect.a031732
- Pallerla S.R., Harms D., Johne R., Todt D., Steinmann E., Schemmerer M., et al. Hepatitis E virus infection: circulation, molecular epidemiology, and impact on global health. Pathogens. 2020; 9(10): 856. https://doi.org/10.3390/pathogens9100856
- Grange Z.L., Goldstein T., Johnson C.K., Anthony S., Gilardi K., Daszak P., et al. Ranking the risk of animal-to-human spillover for newly discovered viruses. Proc. Natl Acad. Sci. USA. 2021; 118(15): e2002324118. https://doi.org/10.1073/pnas.2002324118
- Reuter G., Boros Á., Pankovics P. Review of hepatitis E virus in rats: evident risk of species Orthohepevirus C to human zoonotic infection and disease. Viruses. 2020; 12(10): 1148. https://doi.org/10.3390/v12101148
- Minuk G.Y., Sun A., Sun D.F., Uhanova J., Nicolle L.E., Larke B., et al. Serological evidence of hepatitis E virus infection in an indigenous North American population. Can. J. Gastroenterol. 2007; 21(7): 439–42. https://doi.org/10.1155/2007/289059
- Di Profio F., Sarchese V., Palombieri A., Fruci P., Lanave G., Robetto S., et al. Current knowledge of Hepatitis E Virus (HEV) epidemiology in ruminants. Pathogens. 2022; 11(10): 1124. https://doi.org/10.3390/pathogens11101124
- Lin J., Karlsson M., Olofson A.S., Belák S., Malmsten J., Dalin A.M., et al. High prevalence of hepatitis e virus in Swedish moose – a phylogenetic characterization and comparison of the virus from different regions. PLoS One. 2015; 10(4): e0122102. https://doi.org/10.1371/journal.pone.0122102
- Weger S., Elkin B., Lindsay R., Bollinger T., Crichton V., Andonov A. Hepatitis E virus seroprevalence in free-ranging deer in Canada. Transbound. Emerg. Dis. 2017; 64(3): 1008–11. https://doi.org/10.1111/tbed.12462
- Sacristán C., Madslien K., Sacristán I., Klevar S., das Neves C.G. Seroprevalence of hepatitis E virus in moose (Alces alces), reindeer (Rangifer tarandus), red deer (Cervus elaphus), roe deer (Capreolus capreolus), and muskoxen (Ovibos moschatus) from Norway. Viruses. 2021; 13(2): 224. https://doi.org/10.3390/v13020224
- Rinaldo C.H., Nymo I.H., Sánchez Romano J., Breines E.M., Murguzur F.J.A., Tryland M. Serological evidence of hepatitis E virus infection in semi-domesticated Eurasian tundra reindeer (Rangifer tarandus tarandus) in Norway. Pathogens. 2021; 10(12): 1542. https://doi.org/10.3390/pathogens10121542
- Slukinova O.S., Kyuregyan K.K., Karlsen A.A., Potemkin I.A., Kichatova V.S., Semenov S.I., et al. Serological evidence of hepatitis E virus circulation among reindeer and reindeer herders. Vector. Borne Zoonotic Dis. 2021; 21(7): 546–51. https://doi.org/10.1089/vbz.2020.2727
- Kodani M., Kamili N.A., Tejada-Strop A., Poe A., Denniston M.M., Drobeniuc J., et al. Variability in the performance characteristics of IgG anti-HEV assays and its impact on reliability of seroprevalence rates of hepatitis E. J. Med. Virol. 2017; 89(6): 1055–61. https://doi.org/10.1002/jmv.24741
- Haqshenas G., Huang F.F., Fenaux M., Guenette D.K., Pierson F.W., Larsen C.T., et al. The putative capsid protein of the newly identified avian hepatitis E virus shares antigenic epitopes with that of swine and human hepatitis E viruses and chicken big liver and spleen disease virus. J. Gen. Virol. 2002; 83(Pt. 9): 2201–9. https://doi.org/10.1099/0022-1317-83-9-2201
- Zhou X., Kataoka M., Liu Z., Takeda N., Wakita T., Li T.C. Characterization of self-assembled virus-like particles of dromedary camel hepatitis E virus generated by recombinant baculoviruses. Virus Res. 2015; 210: 8–17. https://doi.org/10.1016/j.virusres.2015.06.022
- Kubickova B., Schenk J.A., Ramm F., Markuškienė K., Reetz J., Dremsek P., et al. A broadly cross-reactive monoclonal antibody against hepatitis E virus capsid antigen. Appl. Microbiol. Biotechnol. 2021; 105(12): 4957–73. https://doi.org/10.1007/s00253-021-11342-7
- Sánchez Romano J., Omazic A., Leijon M., Hagström Å., Tryland M., Kantanen J., et al. Screening of Eurasian tundra reindeer for viral sequences by next-generation sequencing. Int. J. Environ. Res. Public Health. 2021; 18(12): 6561. https://doi.org/10.3390/ijerph18126561
- Feng R., Zhao C., Li M., Harrison T.J., Qiao Z., Feng Y., et al. Infection dynamics of hepatitis E virus in naturally infected pigs in a Chinese farrow-to-finish farm. Infect. Genet. Evol. 2011; 11(7): 1727–31. https://doi.org/10.1016/j.meegid.2011.07.009
Дополнительные файлы