Том 67, № 1 (2022)
- Год: 2022
- Дата публикации: 16.03.2022
- Статей: 9
- URL: https://virusjour.crie.ru/jour/issue/view/54
Весь выпуск
ОБЗОРЫ
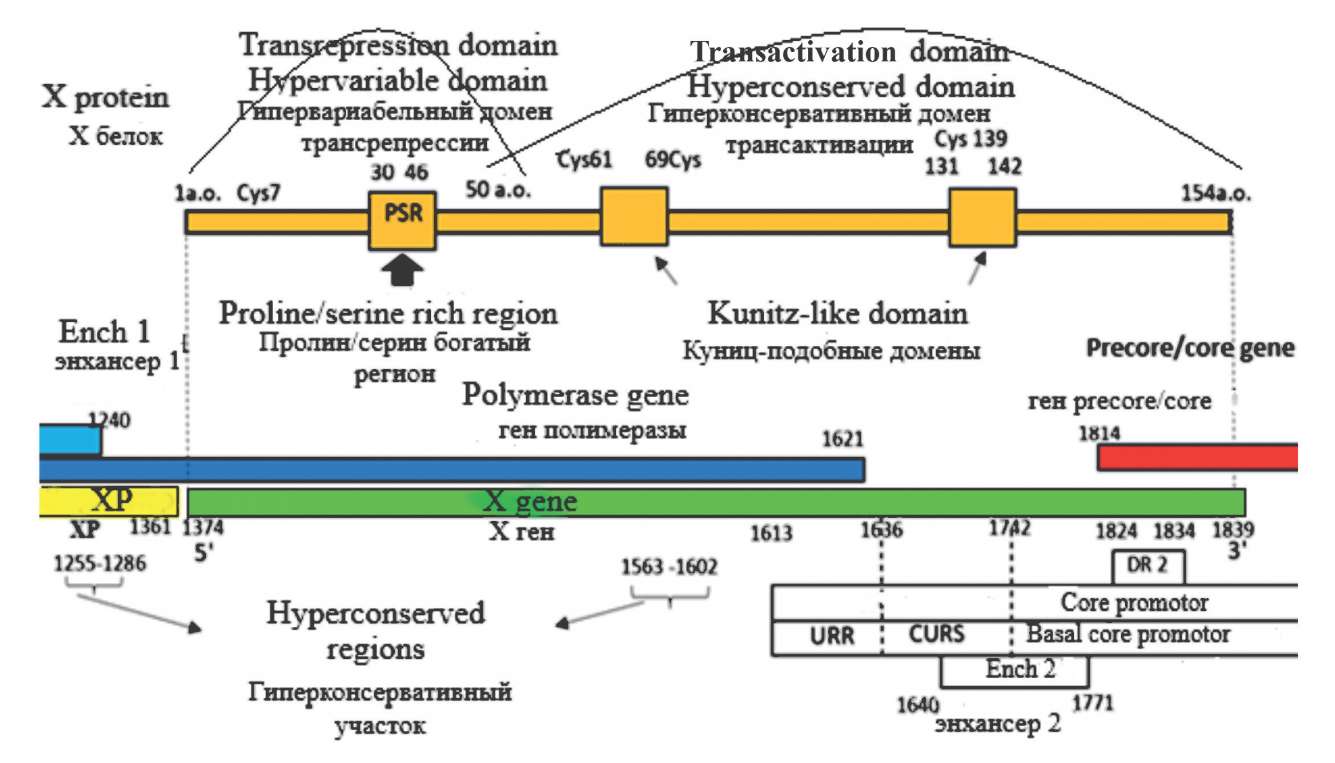
Современные представления о роли гена Х вируса гепатита В (Hepadnaviridae: Orthohepadnavirus: Hepatitis B virus) в патогенезе инфекции, вызванной вирусом гепатита B
Аннотация
В обзоре представлена информация о роли Х гена вируса гепатита В (Hepadnaviridae: Orthohepadnavirus: Hepatitis B virus) (ВГВ) и кодируемого им белка Х в патогенезе вирусного гепатита В (ГB). Рассмотрена эволюция возбудителя от первоосновы до современного варианта гепаднавирусов (Hepadnaviridae) как процесс, начавшийся около 407 млн лет назад и продолжающийся до настоящего времени. Обобщены результаты научных трудов зарубежных исследователей о многообразии воздействия белка X на течение инфекционного процесса и роли этой вирусной структуры в механизмах канцерогенеза. Описаны различия в характере влияния белка на течение заболевания у пациентов различных этнических групп с учётом генотипической принадлежности ВГВ. Обсуждается значение определения генетической вариабельности гена Х как фундаментальной характеристики вируса, имеющей значение для оценки рисков распространения гепатоцеллюлярной карциномы (ГЦК) среди населения Российской Федерации.
 7-17
7-17


Генетический полиморфизм и распространение пестивирусов (Flaviviridae: Pestivirus) крупного рогатого скота в мире и в Российской Федерации
Аннотация
Род Pestivirus семейства Flaviviridae включает 11 видов. Пестивирусы крупного рогатого скота (КРС) являются возбудителями вирусной диареи – болезни слизистых (ВД – БС), широко распространённой среди этих животных, и включают 3 генетически различающиеся вида: пестивирус А (bovine viral diarrhea virus 1, BVDV-1), В (BVDV-2) и H (BVDV-3, HoBiPeV). Число субтипов BVDV-1 составляет 21, BVDV-2 – 4 и BVDV-3 – 4. Наличие полиморфизма вирусов затрудняет диагностику вызываемых ими заболеваний, снижает эффективность вакцинации и контрольных программ.
Для поиска научных статей использовали базы данных PubMed, MedLine, Web of Science, Scopus, eLIBRARY.RU за 2000–2021 гг.
Пестивирус А (BVDV-1) характеризуется повсеместным распространением, но чаще регистрируется в странах Европы. Наибольшее количество его субтипов выявлено у КРС в Италии и Китайской Народной Республике (КНР). Вирус широко распространён в Центральном регионе РФ (субтипы 1а и 1m). На территории Сибири среди аборигенных и импортированных животных циркулируют 11 субтипов BVDV-1: 1а (5%), 1b (35%), 1c (5%), 1d (10%), 1f (20%), 1g, 1i (по 2,5%), 1j, 1k, 1p и 1r (по 5%). Пестивирус В (BVDV-2) более вирулентный, встречается реже, преимущественно в Соединённых Штатах Америки (США), Канаде, Бразилии, Аргентине, Уругвае, некоторых странах Европы: Федеративной Республике Германия (ФРГ), Словакии, Италии и Азии (Южная Корея, Япония и Монголия). В Сибирском регионе выявлены 3 его субтипа: 2a (25%), 2b (10%) и 2с (5%). Пестивирус H (BVDV-3) циркулирует на территории Европы, Азии и Южной Америки. Основным путём заноса для этого возбудителя служат контаминированные биологические препараты. В России BVDV-3 итало-бразильской группы (3a) выявлен в 7 лотах эмбриональной сыворотки.
Установлена роль пестивирусов в возникновении респираторных болезней телят, абортов, системных инфекций и энтеритов как у телят, так и у взрослых животных. Источником инфицирования в подобных случаях является контаминированная живая вакцина.
 18-26
18-26


ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
Сопоставление напряжённости гуморального иммунитета к кори с заболеваемостью в различных возрастных группах из числа медицинских работников г. Москвы
Аннотация
Введение. Изучение напряжённости гуморального иммунитета к вирусу кори (Paramyxoviridae: Morbillivirus) (ВК) до настоящего времени сохраняет свою актуальность в связи с продолжающейся регистрацией эпизодов групповой заболеваемости этой инфекцией (в том числе в медицинских организациях).
Цель исследования – изучение связи напряжённости гуморального иммунитета к кори с заболеваемостью этой инфекцией в различных возрастных группах жителей г. Москвы из числа медицинских работников.
Материал и методы. Простое аналитическое исследование осуществлялось в рамках программы совершенствования работы по профилактике кори в субъектах Российской Федерации с анализом причины роста доли серонегативных лиц и сопоставления результатов серомониторинга с данными повозрастной заболеваемости. На протяжении 2018 г. в 1855 образцах сывороток крови, взятых у ранее привитых против данного заболевания сотрудников крупного больничного комплекса г. Москвы, выполнено определение содержания антител (АТ) класса IgG к ВК. Исследуемые распределены на 11 групп в соответствии с возрастом. Статистический анализ полученных данных проводился с использованием непараметрических критериев.
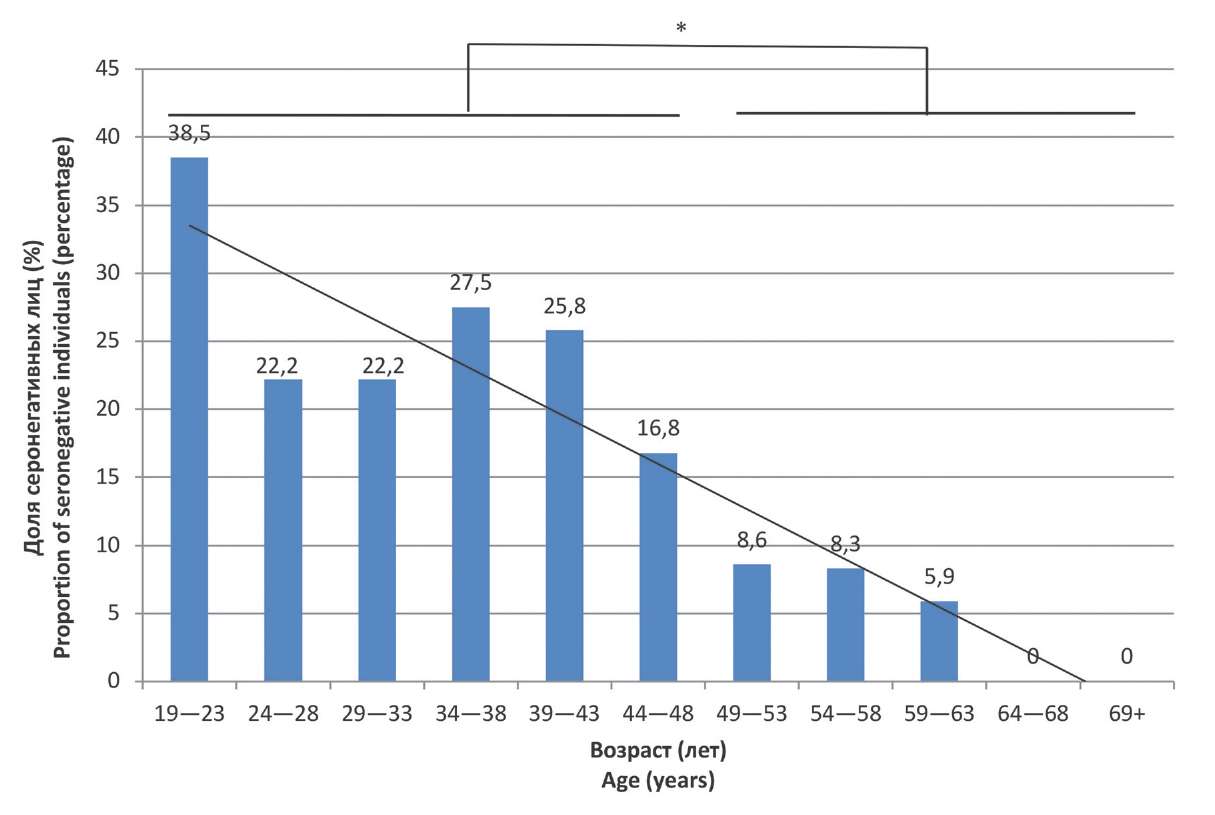
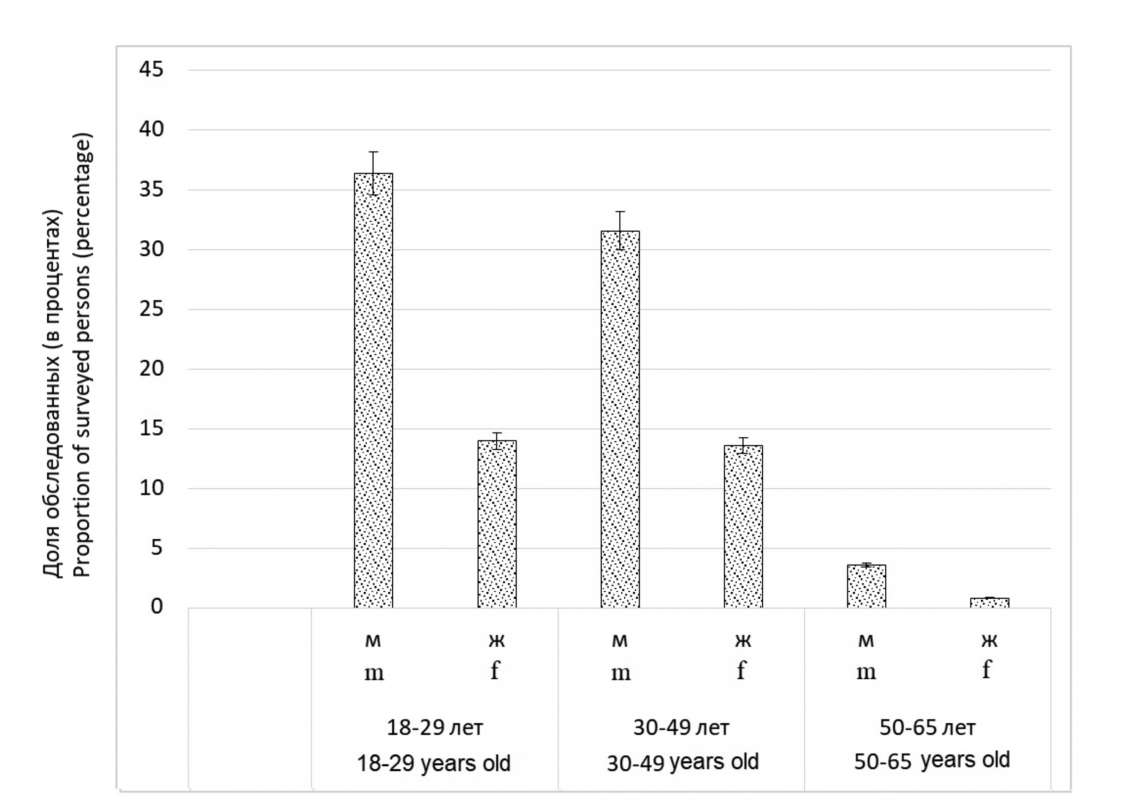
Результаты и обсуждение. Установлено, что по мере увеличения возраста доля серонегативных лиц из числа персонала медицинского учреждения снижалась с 38,5% в группе 19–23 лет до 0% в группе 64 и более лет (64+). Исследуемые в возрасте от 19 до 43 лет оказались наиболее восприимчивыми к коревой инфекции, что подтверждается не только наибольшим количеством серонегативных результатов в данных группах (от 22,2 до 38,5%), но и наивысшим показателем заболеваемости среди них (от 6,93 до 14,03 на 100 тыс. населения). Самая защищённая от кори возрастная группа – лица старше 64 лет, у которых не получено серонегативных результатов на фоне наименьших показателей заболеваемости корью. Это, вероятно, обусловлено тем, что в к указанному возрасту большинство из них перенесли коревую инфекцию и сформировали достаточный иммунный ответ. В то же время более молодые лица, живущие в постэлиминационную эру, имеют только поствакцинальные АТ к ВК, уровень которых при отсутствии бустеризации диким штаммом возбудителя быстро снижается до непротективных значений.
Заключение. У сотрудников медицинских организаций в возрасте до 35 лет представляется целесообразным проводить мониторирование уровня IgG-АТ к ВК. Серонегативным к данному инфекционному агенту показано однократное введение живой коревой вакцины.
 27-36
27-36


Мутации в гене UL97 цитомегаловируса (Herpesvirales: Herpesviridae: Cytomegalovirus: Human betaherpesvirus 5), ассоциированные с устойчивостью к ганцикловиру, у реципиентов аллогенных стволовых гемопоэтических клеток
Аннотация
Введение. Инфекция, вызываемая цитомегаловирусом (Herpesvirales: Herpesviridae: Cytomegalovirus: Human betaherpesvirus 5) (ЦМВ), является серьезной проблемой для пациентов с ослабленной системой иммунной защиты, в число которых входят лица с депрессиями кроветворения. В случае возникновения ЦМВ-ассоциированных осложнений возникает необходимость в проведении противовирусной терапии. Однако в ходе естественного мутационного процесса, особенно при длительном использовании препаратов в субоптимальных дозах, могут возникнуть штаммы ЦМВ, устойчивые к действию противовирусных препаратов (таких, как ганцикловир, валганцикловир). Гипотетически возникновение устойчивости у вируса может являться причиной более агрессивного течения инфекции, неэффективности противовирусной терапии и, как следствие, увеличения количества смертельных исходов. В связи с этим своевременное выявление мутаций, которые потенциально могут привести к устойчивости вируса к противовирусным перпаратам при трансплантации гемопоэтических стволовых клеток (ГСК), а также при трансплантации органов и тканей, может оказаться важным при принятии терапевтического решения. Мы приводим описание трех клинических случаев, для которых проанализирована динамика появления мутантного штамма ЦМВ по гену UL97, коррелирующая с вирусной нагрузкой и клинической картиной.
Цель исследования – определение периода возникновения в гене UL97 фосфотрансферазы ЦМВ мутаций, ассоциированных с устойчивостью к действию противовирусных препаратов, у пациентов с гемобластозами после трансплантации аллогенных стволовых гемопоэтических клеток (алло-ГСК).
Материал и методы. В исследование вошли 48 образцов ДНК ЦМВ, выделенной из периферической крови 3 реципиентов алло-ГСК с ЦМВ-инфекцией, находившихся на лечении в клиниках ФГБУ «Национальный медицинский исследовательский центр гематологии» («НМИЦ гематологии») Минздрава России с онкогематологическими заболеваниями в 2015–2017 гг. Пациенты получили условные коды (ПР, ПД и ФС). У всех исследуемых выявлены мутации, ассоциированные с резистентностью к противовирусной терапии (ПВТ). Для поиска мутаций применялся метод секвенирования по Сэнгеру. Полученные последовательности ДНК подвергались анализу с помощью программного обеспечения Nucleotide BLAST и Genome compiler. Поиск мутаций осуществлялся в программе MRA mutation resistance analyzer. При помощи данного программной среды нуклеотидные последовательности сравнивались с референсной последовательностью UL97 штамма ЦМВ Merlin.
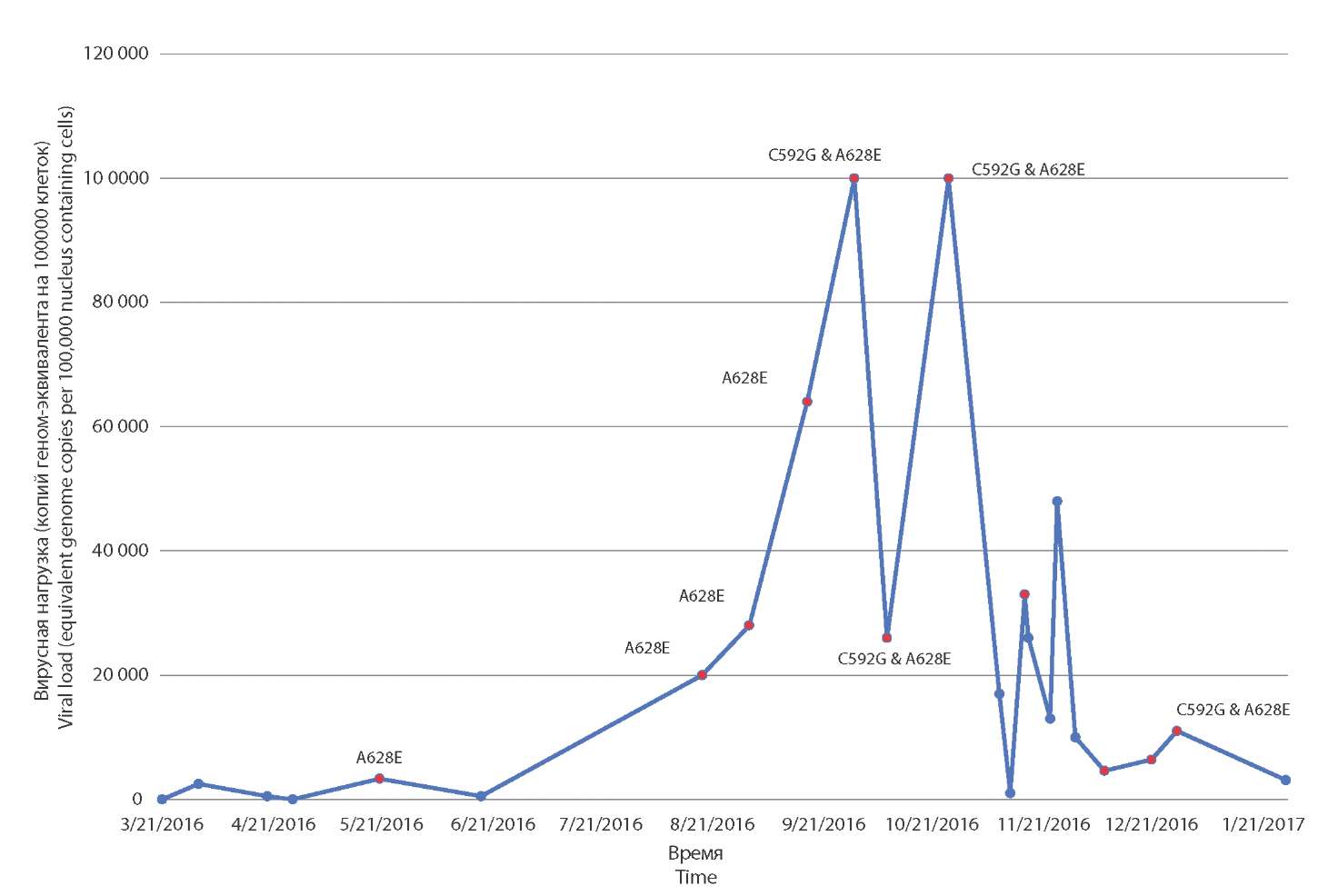
Результаты и обсуждение. Для всех пациентов, у которых обнаружены штаммы вируса, содержащие мутации C592G (ПР), C607F (ПД) и C603W (ФС), определены моменты возникновения мутационных изменений – на 187, 124 и 1184 день после трансплантации соответственно. Показано, что появление мутаций с высоким фактором резистентности сопровождается ростом вирусной нагрузки (ВН), появлением характерной клинической картины и отсутствием адекватного ответа на лечение ганцикловиром и его производными.
Заключение. С использованием полученных результатов предполагается разработка тест-системы на основе полимеразной цепной реакции (рПЦР; random polymerase chain reaction, rPCR) для детекции мутаций в наиболее часто встречающихся кодонах: M460I/V, C592G, A591V, A594T/V, L595F/S, C603W. Учитывая, что данные по распространённости мутационных изменений получены из зарубежных источников, целесообразно проведение аналогичных исследований о частоте встречаемости мутаций в гене UL97 среди популяции РФ с целью повышения качества и точности тест-систем.
 37-47
37-47


Иммуноферментная идентификация escape-мутантов S143L и G145R вируса гепатита B (Hepadnaviridae: Orthohepadnavirus: Hepatitis B virus)
Аннотация
Введение. Достижение цели Всемирной организации здравоохранения по ликвидации вирусного гепатита В к 2030 г. представляется проблематичным, отчасти из-за наличия мутантов ускользания (англ. escape) у возбудителя этого заболевания, вируса гепатита В (ВГВ) (Hepadnaviridae: Orthohepadnavirus: Hepatitis B virus), распространяющихся преимущественно в группах риска. Специфической рутинной диагностики, направленной на идентификацию escape-мутантов, не существует.
Цель исследования – оценка метода серологического портретирования, адаптированного для рутинного выявления escape-мутаций в 143 и 145 аминокислотных остатках (а.о.) поверхностного антигена (HBsAg) ВГВ.
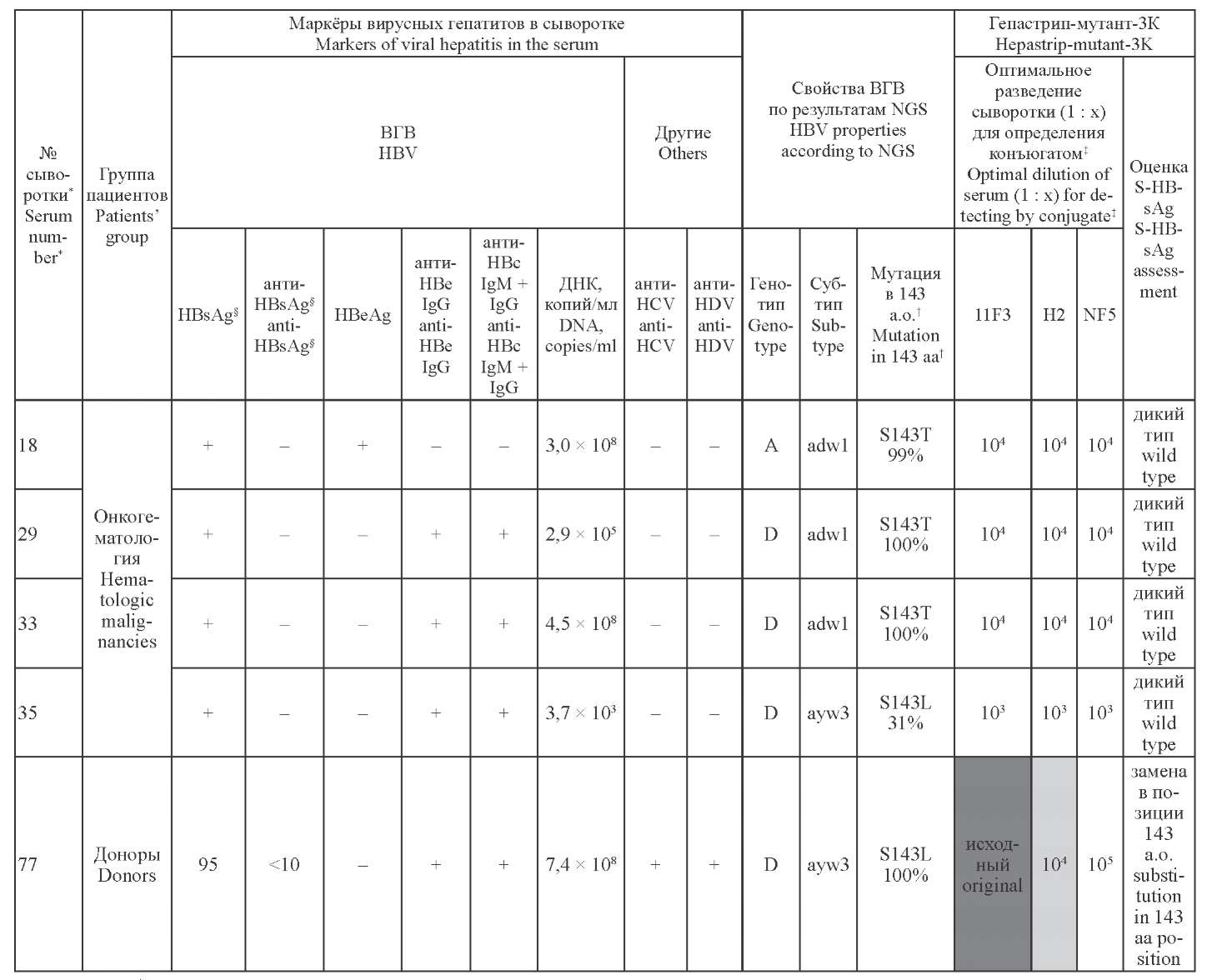
Материал и методы. ДНК ВГВ из 56 образцов HBsAg-положительных сывороток крови, полученных от доноров, хронических носителей HBsAg, а также страдающих злокачественными заболеваниями крови лиц, секвенировали. После выявления мутаций в HBsAg образцы тестировали в иммуноферментной тест-системе «Гепастрип-мутант-3К».
Результаты и обсуждение. Escape-мутации выявлялись преимущественно у больных со злокачественными заболеваниями крови: замены в 143 и 145 а.о. обнаружены в 10,81 и 8,11% случаев соответственно. С помощью иммуноферментного анализа мутация G145R распознана почти во всех случаях. Тест-система специфично распознавала замену S143L в отличие от варианта S143T. Присутствие соседней мутации D144E может предполагаться благодаря ее особому серологическому портрету.
Заключение. Иммуноферментная детекция escape-мутаций S143L, D144E и G145R может применяться для рутинной диагностики, особенно в группах риска. Диагностические параметры тест-системы могут быть уточнены при дополнительных исследованиях. Данная иммуноферментная тест-система и методика применимы для разработки и контроля качества вакцин против escape-мутантов.
 48-58
48-58


Распространенность маркеров вирусного гепатита В среди доноров крови в Гвинейской Республике
Аннотация
Введение. Проблема трансфузионной безопасности в отношении парентеральных вирусных гепатитов до настоящего времени сохраняет свою актуальность. Вирусный гепатит В (ГВ) остается наиболее распространенной вирусной инфекцией, передаваемой при трансфузиологических манипуляциях. Одной из естественных фаз течения хронического вирусного гепатита В (ХГВ) является оккультный гепатит (ОкГВ), характеризующийся недетектируемым уровнем HBsAg (независимо от содержания иных серологических маркеров) при наличии ДНК ВГВ в ткани печени и крайне низким уровнем вирусной нагрузки в крови вплоть до неопределяемого. В Гвинейской Республике, как и в большинстве государств континента, профилактика трансфузионной передачи ВГВ посредством скрининга доноров до сих пор основывается на изолированном серологическом определении HBsAg, в связи с чем ОкГВ сохраняется в качестве потенциальной угрозы для гемотрансфузионной безопасности. Определение ДНК ВГВ служит надёжной профилактической мерой против передачи вируса от доноров с HBsAg-негативным ГВ, особенно в высокоэндемичных регионах. В связи с этим для обоснования рекомендаций по повышению безопасности крови на фоне значительной частоты встречаемости ВГВ на территории Гвинейской Республики проведено настоящее исследование.
Цель работы – оценка распространенности серологических и молекулярно-генетических маркёров вирусного гепатита В (ГВ) у доноров крови в Гвинейской Республике.
Материал и методы. Исследованы 250 образцов крови, полученные от доноров, проживающих на территории г. Конакри (Гвинейская Республика). В пробах определяли наличие серологических (поверхностный антиген – HBsAg; антитела (АТ) к поверхностному (анти-HBs IgG) и ядерному (коровому) (анти-HBc IgG) антигенам) и молекулярно-генетических (ДНК) маркеров этой инфекции.
Результаты и обсуждение. Встречаемость маркеров вирусного ГВ составила 83,2%; HBsAg обнаружен у 16,4% исследуемых. Частота его выявления оказалась более высокой среди мужчин (19,55%) по сравнению с женщинами (8,45%), относительный риск инфицирования вирусом с формированием HBsAg-позитивной хронической формы заболевания у лиц мужского пола также достоверно выше. Значение распространенности ДНК возбудителя в исследуемой группе составило 30,4%; при этом 15,6% приходится на ОкГВ. Показано преобладание данного варианта течения инфекционного процесса у доноров 30–49 лет (24,78%). Среди лиц моложе 30 лет встречаемость ОкГВ оказалась ниже (8,73%), а в возрасте от 50 лет и старше оккультная форма ГВ не выявлена. На основании филогенетического анализа 76 изолятов вируса установлено преобладание в исследованной группе генотипа E (85,53%). Случаи выявления ДНК патогена имели место у HBsAg-негативных доноров крови при наличии АТ анти-HBs IgG (n = 4), а также на фоне одновременного присутствия анти-HBs IgG и анти-HBc IgG (n = 7). При этом показатель вирусной нагрузки превышал 200 МЕ/мл. В ходе секвенирования в каждом образце обнаружены escape-мутации, способствующие ускользанию вируса от диагностики при скринировании на HBsAg.
Заключение. Оценка распространенности маркеров ГВ у доноров крови, определение генотипов и клинически значимых мутаций вариантов вируса необходимы для обеспечения биологической и трансфузионной безопасности при медицинских манипуляциях, контроля и предотвращения распространения данного инфекционного агента.
 59-68
59-68


Выявление SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus: Sarbecovirus) у детей с острой кишечной инфекцией в Нижнем Новгороде за период 2020–2021 гг.
Аннотация
Введение. Новая коронавирусная инфекция COVID-19 является серьёзной проблемой общественного здравоохранения во всем мире. В ряде публикаций показано наличие при этом заболевании помимо респираторных нарушений симптомов со стороны желудочно-кишечного тракта (ЖКТ) (тошноты, рвоты, диареи).
Цель настоящей работы – мониторинг РНК возбудителя COVID-19 – коронавируса SARS-CoV-2 (Coronaviridae: Coronavirinae: Betacoronavirus: Sarbecovirus) у детей, госпитализированных с острой кишечной инфекцией (ОКИ), с последующей молекулярно-генетической характеристикой обнаруженных штаммов.
Материал и методы. Материалом для исследования служили образцы фекалий детей с ОКИ, находившихся на госпитализации в инфекционном стационаре Нижнего Новгорода в период с 01.07.2020 по 31.10.2021 гг. Обнаружение вирусной РНК проводили методом полимеразной цепной реакции в реальном времени (ПЦР-РВ). Определение нуклеотидной последовательности фрагмента гена S-белка осуществляли методом секвенирования по Сэнгеру.
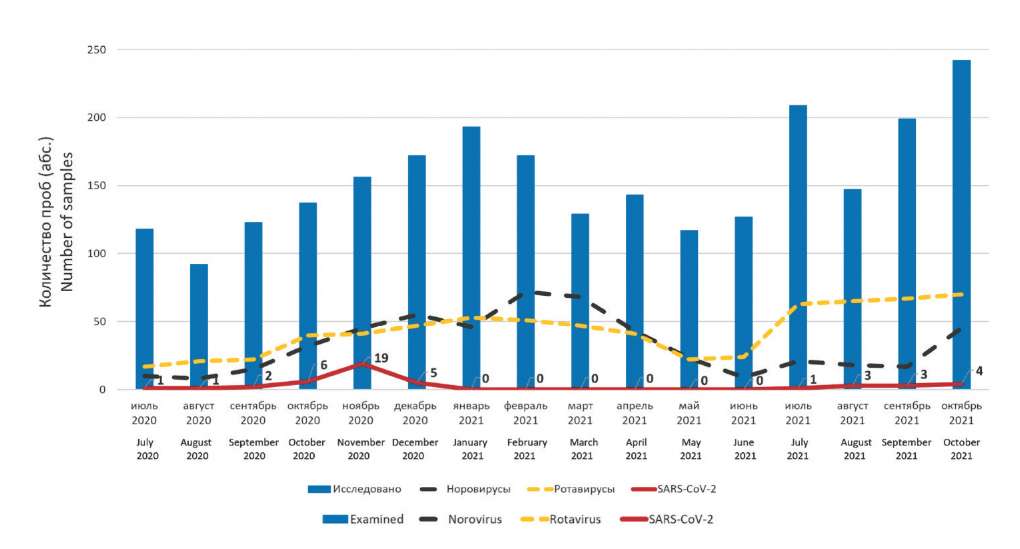
Результаты и обсуждение. При исследовании 2476 образцов фекалий детей с ОКИ, генетический материал SARS-CoV-2 выявлен в 45 образцах. Максимальное количество проб, содержащих РНК вируса SARS-CoV-2, приходилось на ноябрь 2020 г. (частота обнаружения 12,2%). В 20,0% случаев вирусная РНК детектирована в сочетании с рота-, норо- и аденовирусами. Установлены 28 нуклеотидных последовательностей комплементарной ДНК (кДНК) фрагмента гена S-белка. Филогенетический анализ показал принадлежность изучаемых штаммов SARS-CoV-2 к 2 вариантам. При анализе аминокислотной последовательности S-белка у исследованных штаммов показано отсутствие в выборке 2020 г. мутации N501Y, являющейся маркёром вариантов с высоким эпидемическим потенциалом (ВЭП) – вызывающих озабоченность (англ. variants of concern, VOC) согласно определению Всемирной организации здравоохранения (ВОЗ) (линии Alpha B.1.1.7, Beta B.1.351, Gamma P.1). В 2 образцах, изолированных в сентябре 2021 г., идентифицирован вариант линии B.1.617.2 Delta.
Заключение. Обнаружение РНК SARS-CoV-2 в копроматериале детей с ОКИ, свидетельствующее о возможности реализации фекально-орального механизма передачи возбудителя, определяет необходимость оптимизации его мониторинга и разработки алгоритма работы с пациентами, имеющими признаки ОКИ, в условиях пандемии новой коронавирусной инфекции.
 69-76
69-76


Выделение нового штамма М-2020 вируса оспы верблюдов (Poxviridae: Orthopoxvirus: Camelpox virus) в Республике Казахстан и изучение его репродукции на различных биологических системах
Аннотация
Введение. В данной работе представлены результаты выделения вируса оспы верблюдов (ОВ) (Poxviridae: Orthopoxvirus: Camelpox virus, CMLPV) и изучения его репродуктивных свойств на чувствительных биологических системах.
Материал и методы. В исследовании использован эпизоотический штамм М-96 вируса, а также его аттенуированные варианты КМ-40 и КМ-70, полученные путём последовательного пассирования. Выделение возбудителя из суспензии биопсийных образцов осуществляли на культуре клеток и в развивающихся куриных эмбрионах (РКЭ). Все эксперименты проводили с числом повторности, обеспечивающим получение достоверных результатов.
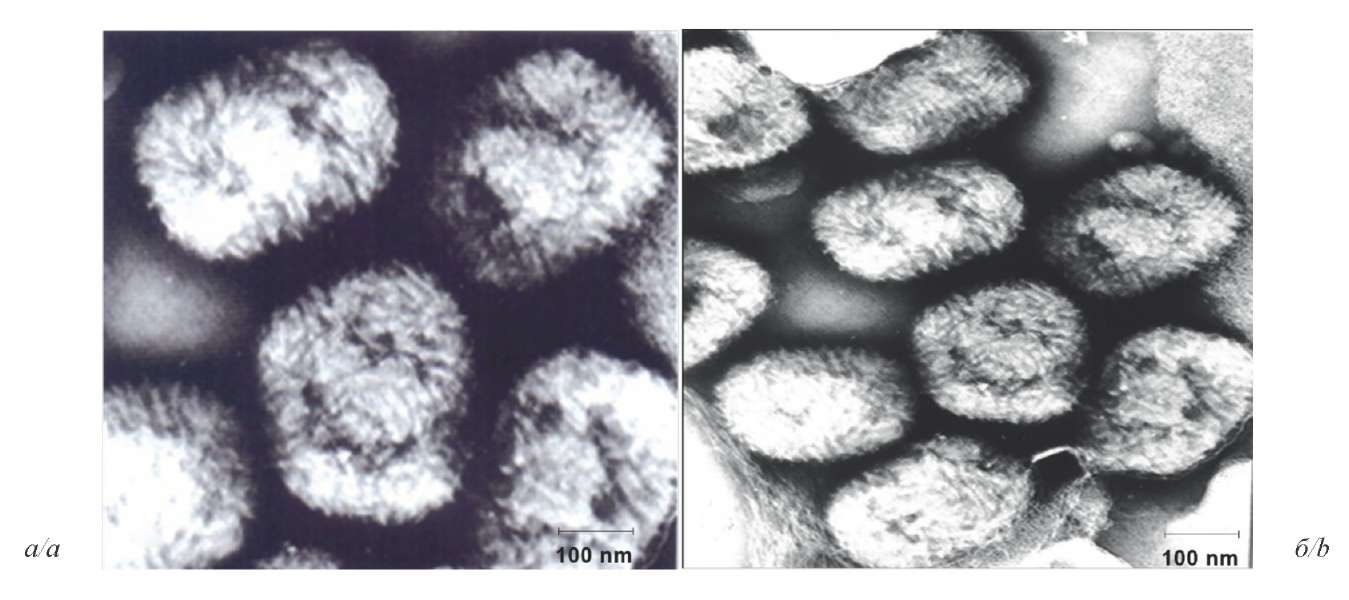
Результаты. В серии экспериментов выделен вирус ОВ из корочек и соскобов с оспенными папулами кожи, полученных во время вспышки заболевания от больных верблюдов (Camelus bactrianus) из различных районов Мангистауской области Республики Казахстан в конце 2019 г. При этом признаки размножения возбудителя на хорион-аллантоисной оболочке (ХАО) отмечались с 3 пассажа. Полученный вирус вызывал формирование на ХАО патологических изменений в виде возвышающихся точечных или сплошных узелков белого цвета, ограниченных от окружающей ткани, с геморрагическими очагами в центре, в размере от 1,0 до 5,0 мм. Определены репродуктивные свойства изолята на чувствительных биологических системах в сравнении с эпизоотическим штаммом М-96 CMLPV, выделенным ранее на территории Казахстана во время вспышки ОВ 1996 г., а также его аттенуированными вариантами. Выделенному вирусу присвоено условное название М-2020.
Обсуждение. При исследовании в обеих чувствительных системах культивирования (клеточной культуре и РКЭ) штаммы М-96 и его аттенуированные варианты КМ-40, КМ-70, использованные в экспериментах в качестве контроля, продемонстрировали высокую инфекционную активность с титром 4,75–6,75 lg ТЦД50/см3, тогда как для исследуемого изолята вируса ОВ М-2020 указанная величина оказалась существенно ниже (3,00-4,75 lg ТЦД50/см3, p > 0,05).
 77-86
77-86


ЮБИЛЕЙНЫЕ ДАТЫ
 87-88
87-88