Современные подходы к конструированию и применению рекомбинантных вирусов
- Авторы: Прохорова П.В.1, Власова Н.Н.1, Южаков А.Г.1, Гулюкин А.М.1
-
Учреждения:
- ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук»
- Выпуск: Том 70, № 5 (2025)
- Страницы: 417-430
- Раздел: ОБЗОРЫ
- URL: https://virusjour.crie.ru/jour/article/view/16774
- DOI: https://doi.org/10.36233/0507-4088-323
- EDN: https://elibrary.ru/cuxdyq
- ID: 16774
Цитировать
Аннотация
В обзоре описан ряд вирусных векторов и рассмотрены различные методы конструирования рекомбинантных вирусов, особое внимание уделено системе гомологичной рекомбинации и CRISPR/Cas9, описана возможность использования разных клонирующих векторов (виды плазмид, BAC). Также в обзоре представлен сравнительный анализ эффективности и безопасности применения вирусных векторов как для создания рекомбинантных вакцин, так и для получения онколитических вирусов, препаратов для генной терапии.
Полный текст
Введение
Вакцинация является экономичным и эффективным способом борьбы с распространением инфекционных заболеваний. Начиная 1796 г. (первая вакцинация, проведенная Э. Дженнером) использовались живые ослабленные, далее инактивированные и впоследствии субъединичные вакцины [1–3]. На начальном этапе создания рекомбинантных вакцин в основном использовали лишь поксвирусные, герпесвирусные и аденовирусные векторы, в настоящее время создано значительное количество рекомбинантных вакцин основе ДНК- и РНК-содержащих рекомбинантных вирусов [4], однако в России на практике используется только вакцина «Гам-КОВИД-Вак».
На настоящий момент к современным модификациям препаратов специфической профилактики относятся вакцины на основе рекомбинантных вирусов, вирусоподобных частиц, а также ДНК- и мРНК-вакцины, что позволяет значительно повысить безопасность и эффективность вакцинации, решить ряд проблем, возникающих при использовании традиционных живых аттенуированных видов вакцин. Также рекомбинантные вирусы используются для создания препаратов для лечения онкологических и генетических заболеваний [1, 3, 5–8].
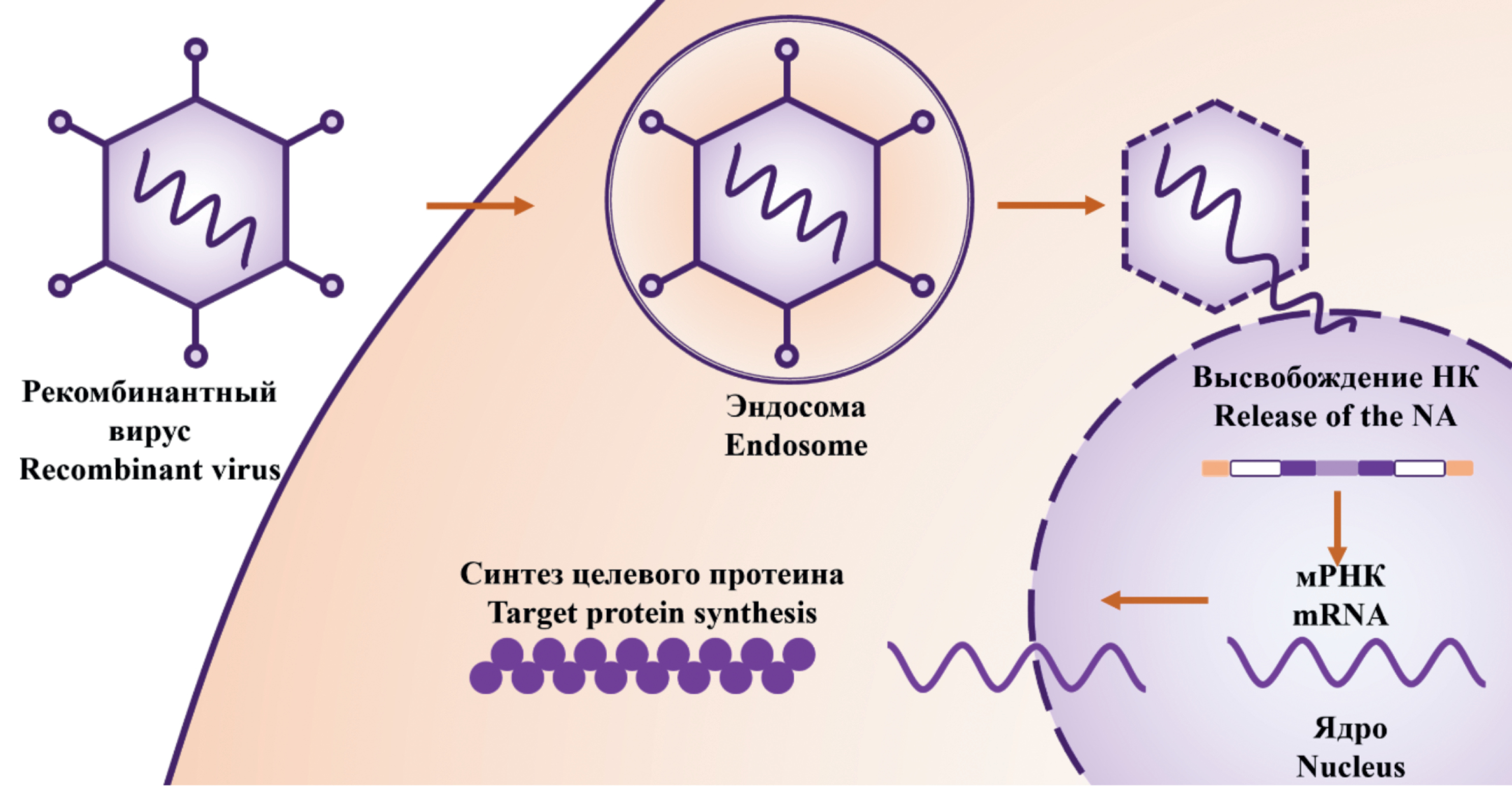
Как правило, рекомбинантные векторные вирусные вакцины разрабатываются на основе использования апатогенного гетерологичного вирусного вектора в качестве продуцента целевых антигенов (рис. 1), поскольку применение гомологичного вируса в качестве вектора предопределяет возможность реверсии его вирулентности при рекомбинации с исходным вирулентным возбудителем [3, 9]. Вакцинные рекомбинантные вирусы содержат модифицированный геном с промотором перед сайтами клонирования для встройки одного или нескольких чужеродных генов, кодирующих целевые протективные антигены [10]. При применении векторных вакцин происходит экспрессия антигена, аналогичная таковой при естественной инфекции, создается возможность доставки целевых антигенов в определенные клетки и ткани [1, 11, 12]. Гетерологичные векторные вакцины разрабатываются на основе двух и более вирусных векторов, кодирующих одни и те же или разные целевые антигены. При двукратной схеме вакцинации формируется более выраженный и длительный иммунный ответ по сравнению с однократной или двукратной вакцинацией одновекторной вакциной [1, 13].
Рис. 1. Синтез целевого протеина рибосомами клетки.
Fig. 1. Synthesis of the target protein by cellular ribosomes.
Максимально высокий уровень безопасности достигается использованием вакцин «одного цикла» или «одного вирусного поколения». Это вакцинные рекомбинантные вирусы, из генома которых удален белок, необходимый для вирусной репликации (как правило, это белок, участвующий в сборке вириона). Параллельно с конструированием рекомбинантного вируса для репликации данного модифицированного агента создается специализированная линия клеток, в которой синтезируется белок, необходимый для вирусной репликации. В результате дефектный рекомбинантный вирус реплицируется в модифицированной культуре клеток и нарабатываются его препаративные количества. Однако в макроорганизме этот вируc при синтезе основных протективных белков теряет возможность к продуктивной инфекции и полноценной сборке вирионов. При введении такого рекомбинантного вируса активируются обе ветви иммунной защиты: гуморальная и клеточная, а его контагиозность и способность к персистенции утрачиваются [14, 15].
Для рекомбинантных вакцин с целью усиления иммунного ответа и увеличения его длительности необходимо использование адъюванта, хотя формирование защиты возможно и без него [1, 3]. При пероральном или интраназальном введении рекомбинантная вирусная вакцина способствует выработке как общего иммунного ответа, так и местной реакции организма в зависимости от способа введения [1, 10].
Методы конструирования рекомбинантных вирусов
Для конструирования рекомбинантных вирусов разработан ряд методов: гомологичная рекомбинация (ГР) [16], транспозон-опосредованный инсерционный мутагенез [17], нуклеазные методы ZFN [18], TALEN [19], а также подходы обратной генетики [20, 21] и др.
Обратная генетика позволяет получить измененный биологически активный вирус путем трансфекции инфицированных вирусным вектором линий клеток плазмидами, которые содержат гены, кодирующие целевые белки. Внося изменения путем введения мутаций в различные целевые гены, можно снижать вирулентность и менять антигенные свойства как самого вектора, так и клонируемых вирусных генов [22].
Как правило, для создания рекомбинантного вируса необходимы вирусный реципиентный вектор и донорный плазмидный (или синтетический) носитель целевого гена. Для вирусных ДНК-векторов подготовительный этап на этом заканчивается. Для генетической модификации РНК-вирусов необходим предварительный этап получения комплементарной ДНК (кДНК) [16]. Однако синтезу полноразмерных кДНК может препятствовать ряд причин, таких как токсичность для бактерий (что решается методом CPEC (Circular polymerase extension reaction), при котором происходит последовательная сборка вектора из ампликонов при полимеразной цепной реакции с обратной транскрипцией), образование шпилек и др. [21]. Дальнейшие процессы получения рекомбинантных РНК-содержащих вирусов также имеют ряд отличий, которые зависят от типа вирусной РНК: геном «+», геном «−», интегрированный геном, сегментированный геном или двухцепочечный геном. Например, для рекомбинантных РНК-содержащих вирусов с геномом «+» необходима эффективная доставка (чаще всего используют лимпосомы) вновь синтезированной РНК в цитоплазму клетки, в то время как для рекомбинантных РНК-содержащих вирусов с геномом «−» требуется вирус-помощник или даже встройка измененной полноразмерной кДНК в крупный ДНК-содержащий вирусный вектор, аналогично тому, как была получена маркированная рекомбинантная вакцина против чумы крупного рогатого скота (КРС) [23].
Относительно ретровирусных рекомбинантов известно, что конечным продуктом полимеразной реакции является двухцепочечный ДНК-провирус, содержащий все вирусные гены и фланкированный 3’- и 5’-LTR (long terminal repeat, длинные концевые повторы). Провирусная ДНК, интеграза (IN), отдельные вирусные и клеточные белки образуют вирусный преинтеграционный комплекс, который импортируется внутрь ядра, а IN катализирует встройку вирусной ДНК в геном клетки [24]. Однако на современном этапе созданы лентивирусные векторы с дефектом интегразы (IDLV), которые уже после однократной иммунизации стимулируют длительный иммунный ответ и обладают высоким уровнем безопасности [25, 26].
Для создания рекомбинантного вируса используется хорошо воспроизводимый метод ГР (рис. 2 а). Для получения рекомбинантного вируса при ГР конструируют плазмидный вектор с фланкирующими целевой ген последовательностями, гомологичными месту встройки в геноме векторного вируса [16]. ДНК плазмидного вектора вводится в инфицированные вирусом клетки или котрансфицируется с геномной ДНК вируса. В трансфицированных клетках происходит обмен последовательностями между плазмидной и вирусной ДНК, содержащими гомологичные участки. Поскольку вирусный вектор должен иметь какой-либо селективный маркер, то рекомбинантные вирусы отбирают клонированием на основе разницы репликации исходного и имеющего маркер рекомбинантного вируса [27].
Рис. 2. Основные методы создания рекомбинантных вирусов. а – гомологичная рекомбинация; б – система CRISPR/Cas9.
Fig. 2. The main methods for creating recombinant viruses. a – homologous recombination; b – CRISPR/Cas9 system.
На настоящий момент наиболее эффективным и универсальным методом редактирования вирусного генома является технология CRISPR/Cas 9 (рис. 2 б) [19, 28]. Она характеризуется высокой корректностью редактирования ДНК-мишеней и низкой активностью расщепления вне мишеней, относительно простым использованием, поэтому система CRISPR/Cas 9 вытеснила предшествующие ей ZFN и TALEN [29, 30]. Технология CRISPR/Cas9 основана на том, что для распознавания целевой последовательности используются не белки (как у ZFN и TALEN), а небольшие молекулы направляющей РНК (нРНК, guide-RNA). Система редактирования генома CRISPR/Cas9 состоит из ДНК-связывающего домена, отвечающего за распознавание и связывание определенной последовательности ДНК, и эффекторного домена, обеспечивающего расщепление ДНК [29]. Редактирование проходит в 2 этапа: расщепления ДНК и последующей репарации [28], которая происходит либо посредством негомологичного соединения концов (non-homologous end joining, NHEJ), либо гомологичного восстановления (homology-directed repair, HDR). Для повышения эффективности и точности вводимых изменений используются методы, подавляющие NHEJ и усиливающие HDR, которые основаны на химической модуляции, синхронизированной экспрессии перекрывающихся гомологичных участков [31]. Преимуществом CRISPR/Cas9 являются легкость и скорость создания нРНК, возможность модификации нескольких целевых генов. Тем не менее CRISPR/Cas9 имеет ограничения, связанные с разницей в скорости расщепления ДНК по сравнению со скоростью репликации вируса, необходимостью повышения эффективности восстановления [28].
Широко востребованные технологии редактирования генома быстро и успешно развиваются. Так, недавно разработанная CRISPR/Cas9-система вытесняется новым методом NICER, основанным на использовании никазы Cas9, создающей лишь одноцепочечные разрывы, которые восстанавливаются без опасности возникновения мутаций, что расширяет возможности для коррекции генетических нарушений, ассоциированных с определенными заболеваниями [32].
Клонирующие векторы
Плазмидные векторы имеют обязательную минимальную структуру, включающую точку начала репликации (ori), селективный маркер устойчивости к антибиотикам и множественный сайт клонирования (MCS) [33]. В качестве векторов переноса используют и другие разновидности плазмид: фосмиды, основанные на бактериальной F-плазмиде; космиды, содержащие ДНК фага лямбда с cos-участком, дрожжевые плазмиды из штаммов Saccharomyces [34], линейные плазмиды Streptomyces и др. [35]. Однако накопление и выделение плазмид из дрожжей является более сложным, трудоемким и дорогостоящим процессом по сравнению с Escherichia coli [36].
BAC (Bacterial artificial chromosome) – низкокопийные векторы с высокой емкостью (до 300 kb) по сравнению с плазмидными векторами (до 10 kb), используется для клонирования больших вирусных геномов [27, 33, 37, 38]. Преимуществами BAC являются высокая точность репликации, отсутствие селективного давления на вирусный геном в E. coli, отсутствие токсического эффекта для бактерий [27].
Наиболее популярным методом получения клонирующих векторов является рестриктазно-лигазный метод, также существует ряд альтернативных технологий: MCS и бактериальная сборка in vivo [39], FastCloning [40], рекомбинационное клонирование GATEWAY [41], SLiCE [42], Golden Gate [43]; независимые от лигирования ELIC [44], SLIC [45], HAC [46], One-step SLIC [47] и In-fusion [48].
Вирусные векторы
Аденовирусы часто используются в качестве вектора, обладают широким тропизмом, высокой эффективностью трансдукции, отсутствием интеграции в геном хозяина [1, 49]. В качестве векторов на основе аденовируса выбирают как способные к репликации варианты, так и с ее дефектом: в зависимости от того, содержат они всю область ранних генов, ответственных за модификацию экспрессии генов хозяина и синтеза вирусного белка, или только ее часть [1, 50, 51]. Для эффективного иммунного ответа выбор аденовирусного вектора основывается на использовании малораспространенных серотипов, чтобы избежать антителозависимой ингибиции его репликации [49]. Аденовирус 5-го типа (Ad5) ранее являлся стандартным выбором в качестве вектора, однако на данный момент его применению препятствует высокая серопревалентность среди людей, которая достигает 90%, поэтому для решения данной проблемы использовались другие, более редкие типы аденовирусов для человека (Ad26, Ad35, Ad11) и аденовирусы животных [1, 52]. Высокая серопревалентность приводит к снижению иммунного ответа, как было продемонстрировано во время испытания вакцины-кандидата STEP против ВИЧ: у вакцинированных наступало повышение восприимчивости к ВИЧ [53]. Для защиты от SARS-CoV-2 созданы в том числе одобренные для массового применения вакцины как на основе Ad5 [54–57], Ad26 [1, 54, 56, 58, 59], так и на их комбинации [54]. Также против лихорадки Эбола были разработаны вакцины с использованием Ad5 [60, 61] и Ad26 [62].
Различные серотипы аденовируса шимпанзе (ChAd) и, в частности, ChAdOx1 (вектор с дефектом репликации) были использованы для создания векторных вакцин-кандидатов против вируса бешенства (RABV), MERS, SARS-CoV-2 и др. [1]. Несмотря на то что вакцину-кандидата ChAdOx1 nCoV-19 признали безопасной, у вакцинированных был обнаружен высокий уровень аутоантител к тромбоцитарному фактору 4 (PF4), что объясняется образованием комплекса PF4 и аденовирусов (в том числе и Ad5, Ad26) [1, 63–65]. Аденовирус шимпанзе был использован в качестве вирусного вектора при разработке вакцин-кандидатов ChAd3-EBO-Z против вируса Эбола [66], ChAdOx1-GnGc против лихорадки долины Рифт [67].
Векторы на основе аденоассоциированных вирусов (AAV) являются популярными для генной терапии и доставки терапевтических антител [11]. Несмотря на распространенный иммунитет к AAV, некоторые вакцины на их основе формируют более высокий и устойчивый иммунный ответ по сравнению с другими типами вакцин [1]. Первым был создан рекомбинант AAV с вирусом простого герпеса 2-го типа [68], а далее разработан rAAV-B11-Fc, экспрессирующий антитела с нейтрализующей активностью против ботулотоксина типа A [69], а также вакцина-кандидат rAAV-COVID-19 [70]. Для генной терапии разработан и одобрен ряд препаратов: Onasemnogene Abeparvovec на основе AAV9 для лечения спинально-мышечной атрофии у детей [5, 6], Valoctocogene Roxaparvovec и Etranacogene Dezaparvovec на основе AAV5 для лечения гемофилии A и B [7, 71], Voretigene neparvovec на основе AAV2 для лечения амавроза Лебера [8]. Однако применение rAAV, особенно в высоких дозах, может быть ограничено из-за реакций иммунной системы, которые приводят к возникновению токсических эффектов. Иммуносупрессия, применяемая для подавления иммунных реакций на AAV-вектор, во многих случаях неэффективна. Причиной возникновения токсических эффектов являются реакции адаптивного иммунитета на антигены капсида AAV, а также чрезмерная активация системы комплемента. К побочным эффектам применения AAV-векторов относится: тромботическая микроангиопатия, нарушение кровообращения печени (молниеносная гепатотоксичность), токсичность в отношении задних корешков спинномозговых нервов, миокардит и аллергическая реакция. На развитие токсических эффектов после введения AAV-вектора влияет: дозировка, серотип AAV, способ введения, индивидуальные особенности пациентов (возраст, наличие определенных заболеваний) [72].
Поксвирусные векторы характеризуются высокой иммуногенностью и способностью вызывать устойчивый и быстро формирующийся иммунный ответ, который может усиливаться при комбинации 2 векторов [1, 73]. Преимуществом поксвирусных векторов является наибольшая (~ 25 т.п.о.) емкость, что позволяет конструировать мультиантигенные вакцины [1, 74]. Чаще других используются ослабленные ортопоксвирусы: MVA и NYVAC. Однако при введении большой дозы (свыше 108 БОЕ) возможны серьезные побочные эффекты. Также недостатком вакцин на основе поксиврусов является возможное снижение иммунногенности у лиц, ранее привитых вакциной против натуральной оспы [75]. На основе MVA были получены рекомбинантные вакцины-кандидаты SARS-CoV ADS-MVA [76], MVA-MERS-S против MERS-CoV [9], на основе вируса оспы канареек создан рекомбинант против цитомегаловирусной инфекции (ALVAC-gB) [77], для конструирования LIVP-hIFNα и LIVP-mIFNα использовали вирус оспы коров, данные рекомбинантные вирусы были разработаны в России, они характеризуются высокой онкоселективностью и онколитической активностью [78]. В РФ в Институте химической биологии и фундаментальной медицины СО РАН В.А. Рихтером и соавт. на основе вируса осповакцины штамма VV-GMCSF-Lact был создан онколитический вирус для борьбы с раком молочной железы, на данный момент проведены клинические испытания I фазы [79, 80]. Для получения VV-GMCSF-Lact использовали родительский штамм LIVP вируса осповакцины, было проведено удаление фрагмента генов тимидинкиназы и ростового фактора, встроены гены индуктора противоопухолевого иммунного ответа цитокина ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор) и однотоксического белка лактаптина [79]. Также в России были проведены сравнительные исследования онколитической активности рекомбинантных штаммов вируса осповакцины LIVP-RFP и MVA-RFP с инактивированным геном тимидинкиназы в отношении солидных опухолей [81].
В качестве вирусного вектора для создания препаратов для генной терапии и лечения онкологических заболеваний используется вирус простого герпеса 1-го типа (HSV-1). HSV-1 обладает большой емкостью, а также проявляет высокую активность относительно деструкции опухолей [82, 83]. Тем не менее существуют проблемы с обеспечением безопасного и высокопродуктивного производства таких препаратов. Преимущественный тропизм белков HSV-1 к поверхностными рецепторам клеток нервной ткани и возможность делеции гена Us3, вызывающего активацию и синтез фасфатидилнозитол-3-киназы, обладающей сигнальной функцией в процессах пролиферации и апоптоза опухолевых клеток, делают HSV-1 эффективным инструментом для лечения опухолей центральной нервной системы. Основным недостатком использования HSV-1 в качестве векторного вируса для генной терапии является токсичность, связанная с особенностями вектора, а также индукция воспаления. Поэтому целью модификации HSV-1 является снижение нейротоксичности и увеличение способности вируса поражать клетки глиомы, а также создание возможности экспрессировать различные трансгены, усиливающие собственный противоопухолевый иммунитет [84]. Противоопухолевые свойства описанных рекомбинантных онколитических герпесвирусов испытаны как in vitro, так и на моделях in vivo. Например, штамм HSV1716 прошел три клинических испытания I фазы [85].
На данный момент существуют уже одобренные Управлением по контролю качества пищевых продуктов и лекарственных средств (FDA, США) препараты: Imlygic для лечения злокачественной меланомы [86], Vyjuvek для терапии дистрофического буллезного эпидермолиза [87].
Из РНК вирусных конструкций, выделяют векторы на основе вируса везикулярного стоматита (VSV), которые обладают высоким уровнем репродукции и характеризуются низкой превалентностью антител у людей [1, 88, 89], широким тропизмом [89], высокой иммуногенностью при однократном введении и пролонгированным иммунным ответом. Их иммуногенность по сравнению с вакцинами на основе RABV с дефектом репликации гораздо выше [10]. К недостаткам VSV-векторов относится: низкая эффективность при повторном введении, слабо выраженный тропизм к раковым клеткам по сравнению с другими онколитическими вирусами [89]. VSV-вектор использовался для уже одобренной вакцины против вируса Эбола (rVSV-ZEBOV) [1, 88]; а также для вакцин-кандидатов для профилактики геморрагической лихорадки Марбург [90], лихорадки Ласса [91] и др.
Вакцины на основе лентивируса с дефектом интегразы (IDLV) стимулируют интенсивный и длительный иммунный ответ после однократной иммунизации, обладают высоким уровнем безопасности [1, 25, 26]. IDLV получены из ВИЧ или вируса иммунодефицита обезьян путем удаления из генома области, отвечающей за репликацию вируса, и мутацией длинных концевых повторов сигнала упаковки и гена интегразы [1, 10]. Однако IDLV характеризуется значительно более низким уровнем экспрессии по сравнению с интегрирующимся лентивирусом [92, 93], а также более низким уровнем риска инсерционного мутагенеза [94]. На основе IDLV созданы рекомбинантные вирусы для повышения эффективности трансдукции дендритных клеток [95], также IDLV использовался для доставки антигенов вируса гриппа H1N1 [96, 97].
Благодаря высокой геномной стабильности в качестве вектора используют вирус парагриппа PIV серотипов 1, 2, 3 и 5, а также B/HPIV3 – химерный вирус парагриппа КРС и человека. Установлено существование возможного расширения тропизма и повышения патогенности при использовании PIV5 [98]. На основе PIV сконструированы вакцины-кандидаты для профилактики парагриппа человека 2-го типа, COVID-19 [99], респираторно-синцитиальной вирусной инфекции [100], лихорадки Эбола [101].
Принято считать, что вакцинный вирус кори MeV штаммов Schwarz и Moraten является безопасным вирусным вектором [10]. MeV позволяет создавать поливалентные рекомбинантные вакцины. Предварительная вакцинация против кори обычно не снижает иммунногенности вакцин с применением MeV в качестве вирусного вектора, также MeV отличается высокой стабильностью [102]. Однако было выявлено, что ранее сформированный иммунитет к кори может влиять на эффективность иммунизации в зависимости от выбранного антигена [103]. На основе MeV были разработаны вакцины-кандидаты для профилактики лихорадки Западного Нила [104], лихорадки Чикунгунья [105], лихорадки Зика [106].
Иногда используют и вирусный вектор на основе вируса болезни Ньюкасла (NDV) с низкой вирулентностью (NDV LaSota, B1), поскольку введение NDV повышает индукцию интерферона, а его белки обладают адъювантными свойствами [10, 107]. Важно учитывать, что человек может быть подвержен NDV, при этом обычно течение заболевания легкое и не вызывает осложнений [108], однако недавно были зафиксированы 2 смертельных случая после заражения людей с иммуносупрессией [109]. Эффективность повторной вакцинации с применением NDV в качестве вектора может снижаться из-за наличия антител к нему, что ограничивает возможность его постоянного использования [4]. На основе NDV были разработаны вакцины-кандидаты против COVID-19 [110], лихорадки Эбола [111].
Характеристика вирусных векторов представлена в таблице.
Таблица. Сравнительная характеристика вирусных векторов [52, 55, 83, 84, 88, 98, 102, 108, 112–116]
Table. Comparative characteristics of viral vectors [52, 55, 83, 84, 88, 98, 102, 108, 112–116]
Семейство, размер генома Family, genome size | Вирусный вектор Viral vector | Емкость вектора Vector capacity | Достоинства Advantages | Недостатки Disadvantages |
ДНК-содержащие вирусы DNA viruses | ||||
Adenoviridae 30–45 т.п.о./kb | Ad5, Ad26, ChAd, ChAdOx1 | 6–15 т.п.о./kb | Широкий тропизм, эффективная трансдукция, отсутствие интеграции в геном хозяина Broad tropism, efficient transduction, lack of integration into the host genome | Риск тромбозов. Ad5: высокий уровень превалентности антител у людей Risk of thrombosis. Ad5: high antibody prevalence in humans |
Parvoviridae 4,7 т.п.о./kb | AAV | 4,5 т.п.о./kb | Высокий и устойчивый иммунный ответ A strong and sustained immune response | Риск тяжелых токсических эффектов Risk of severe toxic effects |
Poxviridae 200–300 т.п.о./kb | MVA, NYVAC, VOV | 25 т.п.о./kb | Высокая иммуногенность, длительный иммунный ответ, большая емкость. High immunogenicity, long-lasting immune response, high capacity | Высокие дозы повышают побочных эффектов, низкая иммуногенность, у привитых осповакциной High doses increase side effects, low immunogenicity in smallpox vaccinees |
Herpesviridae 152 т.п.о./kb | HSV-1 | 15–25 т.п.о./kb | Большая емкость, высокая онколитическая активность High capacity, high oncolytic activity | Обеспечение безопасности на производстве, токсичность вектора Ensuring safety in production, vector toxicity |
РНК-содержащие вирусы RNA viruses | ||||
Rhabdoviridae 11 т.п.о./kb | VSV | До 6 т.п.о. Up to 6 kb | Низкая превалентность антител у людей, высокая иммуногенность Low antibody prevalence in humans, high immunogenicity | Невозможность повторного введения, низкая селективная онколитическая активность Inability to re-administer, low selective oncolytic activity |
Retroviridae 10,7 т.п.о./kb | IDLV | До 10 т.п.о. Up to 10 kb | Высокий уровень безопасности, длительный иммунный ответ, сниженный риск инсерционного мутагенеза High level of safety, long-lasting immune response, reduced risk of insertional mutagenesis | Низкий уровень экспрессии генов Low gene expression level |
Paramyxoviridae 15 т.п.о./kb | PIV1, PIV2, PIV3, PIV5, B/HPIV3 | 1,5–2,5 т.п.о./kb | Высокая геномная стабильность High genomic stability | Возможное расширение тропизма и патогенности Possible expansion of tropism and pathogenicity |
MeV | 5 т.п.о./kb | Стабильность, возможность создания поливалентных вакцин Stability, the possibility of creating polyvalent vaccines | Редко: негативное влияние иммунизации от кори на иммуногенность рекомбинантных вакцин Rarely: the negative impact of measles immunization on the immunogenicity of recombinant vaccines | |
NDV | 4,5 т.п.о./kb | Высокая иммуногенность, адъювантные свойства High immunogenicity, adjuvant properties | Снижение эффективности при повторном введении Decreased effectiveness upon repeated administration | |
Заключение
В современных подходах к иммунизации людей и животных все чаще используют рекомбинантные вирусные вакцины. Применение рекомбинантных вакцин на основе гомологичного реплицирующегося вектора имеет высокий риск восстановления его патогенных свойств [1, 3, 9]. С целью избежать реверсии вирулентности возбудителя, был разработан альтернативный вариант с более высоким уровнем безопасности – вакцины на основе гетерологичных векторов и векторов с дефектом репликации – «одного вирусного поколения» [3].
Создание и применение рекомбинантных вирусов для вакцинопрофилактики, терапии онкологических заболеваний, генной терапии, изучения вирусного генома значимо улучшают арсенал защитных средств в современной медицине, ветеринарии и биологии, в целом. В настоящее время методология получения рекомбинантных вакцин на основе CRISPR/Cas9, гомологичной рекомбинации и т.д., повысили их безопасность и эффективность вакцинации, сделали возможным создание новых методов лечения онкологических и генетических заболеваний, а исследования в данной области остаются одним из ключевых направлений в современной вирусологии.
Однако применение рекомбинантных вирусов в качестве вакцинных препаратов до настоящего времени относится к малоизученным направлениям как в эпидемиологии, так и в эпизоотологии. В ветеринарии создано и успешно применяются большое количество рекомбинантных вакцин, что вполне оправданно, поскольку их использование на животных дает статистически значимый для медицинских исследователей материал при анализе эффективности и безопасности рекомбинантных вакцин. Распространение вирусов в целевой популяции всегда предполагает возможный контакт вирусного вектора с его вирулентным аналогом, создавая предпосылки к частичному или полному восстановлению патогенных свойств. Кроме того, следует учитывать и скорость изменчивости вирусов, которая для РНК-содержащих вирусов составляет приблизительно 10–2–10–4 нуклеотидных замен на сайт в год, а для ДНК-содержащих вирусов – 10–5–10–6 нуклеотидных замен на сайт в год [117, 118]. Следовательно, вопрос о применении рекомбинантных вирус-вакцин должен решаться на основе совместных исследований эпидемиологов, эпизоотологов, вирусологов и молекулярных биологов.
Об авторах
Полина Владимировна Прохорова
ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук»
Автор, ответственный за переписку.
Email: appoliproh@yandex.ru
ORCID iD: 0009-0009-7278-5541
лаборант-исследователь в Рабочей группе (отделу) по выполнению государственного задания в области инфекционной патологии животных
Россия, 109428, МоскваНаталья Никифоровна Власова
ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук»
Email: vlanany@yandex.ru
ORCID iD: 0000-0001-8707-7710
д-р биол. наук, старший научный сотрудник, главный научный сотрудник лаборатории биохимии и молекулярной биологии
Россия, 109428, МоскваАнтон Геннадиевич Южаков
ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук»
Email: anton_oskol@mail.ru
ORCID iD: 0000-0002-0426-9678
канд. биол. наук, заведующий лабораторией биохимии и молекулярной биологии
Россия, 109428, МоскваАлексей Михайлович Гулюкин
ФГБНУ «Федеральный научный центр – Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. К.И. Скрябина и Я.Р. Коваленко Российской академии наук»
Email: admin@viev.ru
ORCID iD: 0000-0003-2160-4770
д-р ветеринар. наук, член-корр. РАН, директор
Россия, 109428, МоскваСписок литературы
- Travieso T., Li J., Mahesh S., Mello J.D.F.R.E., Blasi M. The use of viral vectors in vaccine development. NPJ Vaccines. 2022; 7(1): 75. https://doi.org/10.1038/s41541-022-00503-y
- Jogi H.R., Smaraki N., Rajak K.K., Yadav A.K., Bhatt M., Einstien C., et al. Revolutionizing Veterinary Health with Viral Vector-Based Vaccines. Indian J. Microbiol. 2024; 64(3): 867–78. https://doi.org/10.1007/s12088-024-01341-3
- Brisse M., Vrba S.M., Kirk N., Liang Y., Ly H. Emerging concepts and technologies in vaccine development. Front. Immunol. 2020; 11: 583077. https://doi.org/10.3389/fimmu.2020.583077
- Choi K.S. Newcastle disease virus vectored vaccines as bivalent or antigen delivery vaccines. Clin. Exp. Vaccine Res. 2017; 6(2): 72. https://doi.org/10.7774/cevr.2017.6.2.72
- Mendell J.R., Al-Zaidy S., Shell R., Arnold W.D., Rodino-Klapac L.R., Prior T.W., et al. Single-dose gene-replacement therapy for spinal muscular atrophy. N. Engl. J. Med. 2017; 377(18): 1713–22. https://doi.org/10.1056/NEJMoa1706198
- Ogbonmide T., Rathore R., Rangrej S.B., Hutchinson S., Lewis M., Ojilere S., et al. Gene Therapy for Spinal Muscular Atrophy (SMA): a review of current challenges and safety considerations for onasemnogene abeparvovec (zolgensma). Cureus. 2023; 15(3): e36197. https://doi.org/10.7759/cureus.36197
- Ozelo M.C., Mahlangu J., Pasi K.J., Giermasz A., Leavitt A.D., Laffan M., et al. Valoctocogene roxaparvovec gene therapy for hemophilia A. N. Engl. J. Med. 2022; 386(11): 1013–25. https://doi.org/10.1056/NEJMoa2113708
- Testa F., Bacci G., Falsini B., Iarossi G., Melillo P., Mucciolo D.P., et al. Voretigene neparvovec for inherited retinal dystrophy due to RPE65 mutations: a scoping review of eligibility and treatment challenges from clinical trials to real practice. Eye (Lond.). 2024; 38(13): 2504–15. https://doi.org/10.1038/s41433-024-03065-6
- Link E.K., Tscherne A., Sutter G., Smith E.R., Gurwith M., Chen R.T., et al. A Brighton collaboration standardized template with key considerations for a benefit/risk assessment for a viral vector vaccine based on a non-replicating modified vaccinia virus Ankara viral vector. Vaccine. 2025; 43(Pt. 1): 126521. https://doi.org/10.1016/j.vaccine.2024.126521
- Wang S., Liang B., Wang W., Li L., Feng N., Zhao Y., et al. Viral vectored vaccines: design, development, preventive and therapeutic applications in human diseases. Signal Transduct. Target Ther. 2023; 8(1): 149. https://doi.org/10.1038/s41392-023-01408-5
- Zhan W., Muhuri M., Tai P.W.L., Gao G. Vectored immunotherapeutics for infectious diseases: can rAAVs be the game changers for fighting transmissible pathogens? Front. Immunol. 2021; 12: 673699. https://doi.org/10.3389/fimmu.2021.673699
- Nascimento I.P., Leite L.C.C. Recombinant vaccines and the development of new vaccine strategies. Braz. J. Med. Biol. Res. 2012; 45(12): 1102–11. https://doi.org/10.1590/s0100-879x2012007500142
- Tukhvatulin A.I., Dolzhikova I.V., Dzharullaeva A.S., Grousova D.M., Kovyrshina A.V., Zubkova O.V., et al. Safety and immunogenicity of rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine against SARS-CoV-2 in healthy adolescents: an open-label, non-randomized, multicenter, phase 1/2, dose-escalation study. Front. Immunol. 2023; 14: 1228461. https://doi.org/10.3389/fimmu.2023.1228461
- de Pinho Favaro M.T., Atienza-Garriga J., Martínez-Torró C., Parladé E., Vázquez E., Corchero J.L., et al. Recombinant vaccines in 2022: a perspective from the cell factory. Microb. Cell Fact. 2022; 21(1): 203. https://doi.org/10.1186/s12934-022-01929-8
- Valencia S., Gill R.B., Dowdell K.C., Wang Y., Hornung R., Bowman J.J., et al. Comparison of vaccination with rhesus CMV (RhCMV) soluble gB with a RhCMV replication-defective virus deleted for MHC class I immune evasion genes in a RhCMV challenge model. Vaccine. 2019; 37(2): 333–42. https://doi.org/10.1016/j.vaccine.2018.08.043
- Rasmussen T.B., Risager P.C., Fahnøe U., Friis M.B., Belsham G.J., Höper D., et al. Efficient generation of recombinant RNA viruses using targeted recombination-mediated mutagenesis of bacterial artificial chromosomes containing full-length cDNA. BMC Genomics. 2013; 14: 819. https://doi.org/10.1186/1471-2164-14-819
- Zhan X., Lee M., Xiao J., Liu F. Construction and characterization of murine cytomegaloviruses that contain transposon insertions at open reading frames m09 and M83. J. Virol. 2000; 74(16): 7411–21. https://doi.org/10.1186/1471-2164-14-819
- Urnov F.D., Miller J.C., Lee Y.L., Beausejour C.M., Rock J.M., Augustus S., et al. Highly efficient endogenous human gene correction using designed zinc-finger nucleases. Nature. 2005; 435(7042): 646–51. https://doi.org/10.1038/nature03556
- Sakuma T., Hosoi S., Woltjen K., Suzuki K.I., Kashiwagi K., Wada H., et al. Efficient TALEN construction and evaluation methods for human cell and animal applications. Genes Cells. 2013; 18(4): 315–26. https://doi.org/10.1111/gtc.12037
- Kuo L., Godeke G.J., Raamsman M.J., Masters P.S., Rottier P.J. Retargeting of coronavirus by substitution of the spike glycoprotein ectodomain: crossing the host cell species barrier. J. Virol. 2000; 74(3): 1393–406. https://doi.org/10.1128/jvi.74.3.1393-1406.2000
- Edmonds J., van Grinsven E., Prow N., Bosco-Lauth A., Brault A.C., Bowen R.A., et al. A novel bacterium-free method for generation of flavivirus infectious DNA by circular polymerase extension reaction allows accurate recapitulation of viral heterogeneity. J. Virol. 2013; 87(4): 2367–72. https://doi.org/10.1128/JVI.03162-12
- Sedova E.S., Shcherbinin D.N., Migunov A.I., Smirnov Yu.A., Logunov D.Yu., Shmarov M.M., et al. Recombinant influenza vaccines. Acta Naturae. 2012; 4(4): 17–27.
- Walsh E.P., Baron M.D., Rennie L.F., Monaghan P., Anderson J., Barrett T. Recombinant rinderpest vaccines expressing membrane-anchored proteins as genetic markers: evidence of exclusion of marker protein from the virus envelope. J. Virol. 2000; 74(21): 10165–75. https://doi.org/10.1128/jvi.74.21.10165-10175.2000
- Supotnitskiy M.V. Genotherapeutic vector systems based on viruses. Biopreparats (Biopharmaceuticals). 2011; (3): 15–26.
- Blasi M., Wescott E.C., Baker E.J., Mildenberg B., LaBranche C., Rountree W., et al. Therapeutic vaccination with IDLV-SIV-Gag results in durable viremia control in chronically SHIV-infected macaques. NPJ Vaccines. 2020; 5(1): 36. https://doi.org/10.1038/s41541-020-0186-5
- Blasi M., Negri D., LaBranche C., Alam S.M., Baker E.J., Brunner E.C., et al. IDLV-HIV-1 Env vaccination in non-human primates induces affinity maturation of antigen-specific memory B cells. Commun. Biol. 2018; 1: 134. https://doi.org/10.1038/s42003-018-0131-6
- Wang D., Wang X.W., Peng X.C., Xiang Y., Song S.B., Wang Y.Y., et al. CRISPR/Cas9 genome editing technology significantly accelerated herpes simplex virus research. Cancer Gene Ther. 2018; 25(5-6): 93–105. https://doi.org/10.1038/s41417-018-0016-3
- Chen J.S., Dagdas Y.S., Kleinstiver B.P., Welch M.M., Sousa A.A., Harrington L.B., et al. Enhanced proofreading governs CRISPR-Cas9 targeting accuracy. Nature. 2017; 550(7676): 407–10. https://doi.org/10.1038/nature24268
- Liu M., Rehman S., Tang X., Gu K., Fan Q., Chen D., et al. Methodologies for improving HDR efficiency. Front. Genet. 2018; 9: 691. https://doi.org/10.3389/fgene.2018.00691
- Tomita A., Sasanuma H., Owa T., Nakazawa Y., Shimada M., Fukuoka T., et al. Inducing multiple nicks promotes interhomolog homologous recombination to correct heterozygous mutations in somatic cells. Nat. Commun. 2023; 14(1): 5607. https://doi.org/10.1038/s41467-023-41048-5
- Nora L.C., Westmann C.A., Martins-Santana L., Alves L.F., Monteiro L.M.O., Guazzaroni M.E., et al. The art of vector engineering: towards the construction of next-generation genetic tools. Microb. Biotechnol. 2019; 12(1): 125–47. https://doi.org/10.1111/1751-7915.13318
- Julin D. Plasmid cloning vectors. In: Bell E., ed. Molecular Life Sciences. New York: Springer; 2014. https://doi.org/10.1007/978-1-4614-6436-5_86-1
- Helinski D.R. A brief history of plasmids. EcoSal Plus. 2022; 10(1): eESP00282021. https://doi.org/10.1128/ecosalplus.esp-0028-2021
- Zhou Y., Li C., Ren C., Hu J., Song C., Wang X., et al. One-step assembly of a porcine epidemic diarrhea virus infectious cDNA clone by homologous recombination in yeast: rapid manipulation of viral genome with CRISPR/Cas9 gene-editing technology. Front. Microbiol. 2022; 13: 787739. https://doi.org/10.3389/fmicb.2022.787739
- Dix T.C., Lassota A., Brauer U., Haussmann I.U., Soller M. Gap-repair recombineering for efficient retrieval of large DNA fragments from BAC clones and manipulation of large high-copy number plasmids. BMC Methods. 2024; 1(1): 11. https://doi.org/10.1186/s44330-024-00011-6
- Hao M., Tang J., Ge S., Li T., Xia N. Bacterial-artificial-chromosome-based genome editing methods and the applications in herpesvirus research. Microorganisms. 2023; 11(3): 589. https://doi.org/10.3390/microorganisms11030589.
- Chen F., Li Y.Y., Yu Y.L., Dai J., Huang J.L., Lin J. Simplified plasmid cloning with a universal MCS design and bacterial in vivo assembly. BMC Biotechnol. 2021; 21(1): 24. https://doi.org/10.1186/s12896-021-00679-6
- Li C., Wen A., Shen B., Lu J., Huang Y., Chang Y. FastCloning: a highly simplified, purification-free, sequence- and ligation-independent PCR cloning method. BMC Biotechnol. 2011; 11: 92. https://doi.org/10.1186/1472-6750-11-92
- Walhout A.J., Temple G.F., Brasch M.A., Hartley J.L., Lorson M.A., van den Heuvel S., et al. GATEWAY recombinational cloning: application to the cloning of large numbers of open reading frames or ORFeomes. Methods Enzymol. 2000; 328: 575–92. https://doi.org/10.1016/s0076-6879(00)28419-x
- Motohashi K. A simple and efficient seamless DNA cloning method using SLiCE from Escherichia coli laboratory strains and its application to SLiP site-directed mutagenesis. BMC Biotechnol. 2015; 15: 47. https://doi.org/10.1186/s12896-015-0162-8
- Engler C., Gruetzner R., Kandzia R., Marillonnet S. Golden gate shuffling: a one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS One. 2009; 4(5): e5553. https://doi.org/10.1371/journal.pone.0005553
- Koskela E.V., Frey A.D. Homologous recombinatorial cloning without the creation of single-stranded ends: exonuclease and ligation-independent cloning (ELIC). Mol. Biotechnol. 2015; 57(3): 233–40. https://doi.org/10.1007/s12033-014-9817-2
- Li M.Z., Elledge S.J. Harnessing homologous recombination in vitro to generate recombinant DNA via SLIC. Nat. Methods. 2007; 4(3): 251–6. https://doi.org/10.1038/nmeth1010
- Tan L., Strong E.J., Woods K., West N.P. Homologous alignment cloning: a rapid, flexible and highly efficient general molecular cloning method. PeerJ. 2018; 6: e5146. https://doi.org/10.7717/peerj.5146
- Jeong J.Y., Yim H.S., Ryu J.Y., Lee H.S., Lee J.H., Seen D.S., et al. One-step sequence- and ligation-independent cloning as a rapid and versatile cloning method for functional genomics studies. Appl. Environ. Microbiol. 2012; 78(15): 5440–3. https://doi.org/10.1128/AEM.00844-12
- Zhu B., Cai G., Hall E.O., Freeman G.J. In-fusion assembly: seamless engineering of multidomain fusion proteins, modular vectors, and mutations. Biotechniques. 2007; 43(3): 354–9. https://doi.org/10.2144/000112536
- Zhou D., Zhou X., Bian A., Li H., Chen H., Small J.C., et al. An efficient method of directly cloning chimpanzee adenovirus as a vaccine vector. Nat. Protoc. 2010; 5(11): 1775–85. https://doi.org/10.1038/nprot.2010.134
- Davison A.J., Benkő M., Harrach B. Genetic content and evolution of adenoviruses. J. Gen. Virol. 2003; 84(Pt. 11): 2895–908. https://doi.org/10.1099/vir.0.19497-0
- Davis A.R., Wivel N.A., Palladino J.L., Tao L., Wilson J.M. Construction of adenoviral vectors. Mol. Biotechnol. 2001; 18(1): 63–70. https://doi.org/10.1385/MB:18:1:63
- Elkashif A., Alhashimi M., Sayedahmed E.E., Sambhara S., Mittal S.K. Adenoviral vector-based platforms for developing effective vaccines to combat respiratory viral infections. Clin. Transl. Immunology. 2021; 10(10): e1345. https://doi.org/10.1002/cti2.1345
- Gray G., Buchbinder S., Duerr A. Overview of STEP and Phambili trial results: two phase IIb test-of-concept studies investigating the efficacy of MRK adenovirus type 5 gag/pol/nef subtype B HIV vaccine. Curr. Opin. HIV AIDS. 2010; 5(5): 357–61. https://doi.org/10.1097/COH.0b013e32833d2d2b
- Logunov D.Y., Dolzhikova I.V., Shcheblyakov D.V., Tukhvatulin A.I., Zubkova O.V., Dzharullaeva A.S., et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021; 397(10275): 671–81. https://doi.org/10.1016/S0140-6736(21)00386-X
- Wu S., Huang J., Zhang Z., Wu J., Zhang J., Hu H., et al. Safety, tolerability, and immunogenicity of an aerosolised adenovirus type-5 vector-based COVID-19 vaccine (Ad5-nCoV) in adults: preliminary report of an open-label and randomised phase 1 clinical trial. Lancet Infect. Dis. 2021; 21(12): 1654–64. https://doi.org/10.1016/S1473-3099(21)00396-0
- Zhu F.C., Li Y.H., Guan X.H., Hou L.H., Wang W.J., Li J.X., et al. Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial. Lancet. 2020; 395(10240): 1845–54. https://doi.org/10.1016/S0140-6736(20)31208-3
- Xu J.W., Wang B.S., Gao P., Huang H.T., Wang F.Y., Qiu W., et al. Safety and immunogenicity of heterologous boosting with orally administered aerosolized bivalent adenovirus type-5 vectored COVID-19 vaccine and B.1.1.529 variant adenovirus type-5 vectored COVID-19 vaccine in adults 18 years and older: a randomized, double blinded, parallel controlled trial. Emerg. Microbes. Infect. 2024; 13(1): 2281355. https://doi.org/10.1080/22221751.2023.2281355
- See I., Su J.R., Lale A., Woo E.J., Guh A.Y., Shimabukuro T.T., et al. US case reports of cerebral venous sinus thrombosis with thrombocytopenia after Ad26.COV2.S vaccination, March 2 to April 21, 2021. JAMA. 2021; 325(24): 2448–56. https://doi.org/10.1001/jama.2021.7517
- Sadoff J., Gray G., Vandebosch A., Cárdenas V., Shukarev G., Grinsztejn B., et al. Safety and efficacy of single-dose Ad26.COV2.S vaccine against COVID-19. N. Engl. J. Med. 2021; 384(23): 2187–201. https://doi.org/10.1056/NEJMoa2101544
- Bos R., Rutten L., van der Lubbe J.E.M., Bakkers M.J.G., Hardenberg G., Wegmann F., et al. Ad26 vector-based COVID-19 vaccine encoding a prefusion-stabilized SARS-CoV-2 Spike immunogen induces potent humoral and cellular immune responses. NPJ Vaccines. 2020; 5: 91. https://doi.org/10.1038/s41541-020-00243-x
- Zhu F.C., Hou L.H., Li J.X., Wu S.P., Liu P., Zhang G.R., et al. Safety and immunogenicity of a novel recombinant adenovirus type-5 vector-based Ebola vaccine in healthy adults in China: preliminary report of a randomised, double-blind, placebo-controlled, phase 1 trial. Lancet. 2015; 385(9984): 2272–9. https://doi.org/10.1016/S0140-6736(15)60553-0
- Zhang Z., Zhao Z., Wang Y., Wu S., Wang B., Zhang J., et al. Comparative immunogenicity analysis of intradermal versus intramuscular immunization with a recombinant human adenovirus type 5 vaccine against Ebola virus. Front. Immunol. 2022; 13: 963049. https://doi.org/10.3389/fimmu.2022.963049
- Anywaine Z., Whitworth H., Kaleebu P., Praygod G., Shukarev G., Manno D., et al. Safety and immunogenicity of a 2-dose heterologous vaccination regimen with Ad26.ZEBOV and MVA-BN-Filo Ebola vaccines: 12-month data from a phase 1 randomized clinical trial in Uganda and Tanzania. J. Infect. Dis. 2019; 220(1): 46–56. https://doi.org/10.1016/S1473-3099(21)00128-6
- Schultz N.H., Sørvoll I.H., Michelsen A.E., Munthe L.A., Lund-Johansen F., Ahlen M.T., et al. Thrombosis and thrombocytopenia after ChAdOx1 nCoV-19 vaccination. N. Engl. J. Med. 2021; 384(22): 2124–30. https://doi.org/10.1056/NEJMoa2104882
- Greinacher A., Selleng K., Palankar R., Wesche J., Handtke S., Wolff M., et al. Insights in ChAdOx1 nCoV-19 vaccine-induced immune thrombotic thrombocytopenia. Blood. 2021; 138(22): 2256–68. https://doi.org/10.1182/blood.2021013231
- Baker A.T., Boyd R.J., Sarkar D., Teijeira-Crespo A., Chan C.K., Bates E., et al. ChAdOx1 interacts with CAR and PF4 with implications for thrombosis with thrombocytopenia syndrome. Sci. Adv. 2021; 7(49): eabl8213. https://doi.org/10.1126/sciadv.abl8213
- Ewer K., Rampling T., Venkatraman N., Bowyer G., Wright D., Lambe T., et al. A monovalent chimpanzee adenovirus Ebola vaccine boosted with MVA. N. Engl. J. Med. 2016; 374(17): 1635–46. https://doi.org/10.1056/NEJMoa1411627
- Warimwe G.M., Lorenzo G., Lopez-Gil E., Reyes-Sandoval A., Cottingham M.G., Spencer A.J., et al. Immunogenicity and efficacy of a chimpanzee adenovirus-vectored Rift Valley fever vaccine in mice. Virol. J. 2013; 10: 349. https://doi.org/10.1186/1743-422X-10-349
- Manning W.C., Paliard X., Zhou S., Pat Bland M., Lee A.Y., Hong K., et al. Genetic immunization with adeno-associated virus vectors expressing herpes simplex virus type 2 glycoproteins B and D. J. Virol. 1997; 71(10): 7960–2. https://doi.org/10.1128/JVI.71.10.7960-7962
- Derkaev A.A., Ryabova E.I., Esmagambetov I.B., Shcheblyakov D.V., Godakova S.A., Vinogradova I.D., et al. rAAV expressing recombinant neutralizing antibody for the botulinum neurotoxin type A prophylaxis. Front. Microbiol. 2022; 13: 960937. https://doi.org/10.3389/fmicb.2022.960937
- Liao G., Lau H., Liu Z., Li C., Xu Z., Qi X., et al. Single-dose rAAV5-based vaccine provides long-term protective immunity against SARS-CoV-2 and its variants. Virol. J. 2022; 19(1): 212. https://doi.org/10.1186/s12985-022-01940-w
- Pipe S.W., Leebeek F.W.G., Recht M., Key N.S., Castaman G., Miesbach W., et al. Gene therapy with etranacogene dezaparvovec for hemophilia B. N. Engl. J. Med. 2023; 388(8): 706–18. https://doi.org/10.1056/NEJMoa2211644
- Ertl H.C.J. Immunogenicity and toxicity of AAV gene therapy. Front. Immunol. 2022; 13: 975803. https://doi.org/10.3389/fimmu.2022.975803
- Pantaleo G., Janes H., Karuna S., Grant S., Ouedraogo G.L., Allen M., et al. Safety and immunogenicity of a multivalent HIV vaccine comprising envelope protein with either DNA or NYVAC vectors (HVTN 096): a phase 1b, double-blind, placebo-controlled trial. Lancet HIV. 2019; 6(11): e737–49. https://doi.org/10.1016/S2352-3018(20)30002-3
- Mastrangelo M.J., Eisenlohr L.C., Gomella L., Lattime E.C. Poxvirus vectors: orphaned and underappreciated. J. Clin. Invest. 2000; 105(8): 1031–4. https://doi.org/10.1172/JCI9819
- Draper S.J., Cottingham M.G., Gilbert S.C. Utilizing poxviral vectored vaccines for antibody induction-progress and prospects. Vaccine. 2013; 31(39): 4223–30.
- Ura T., Okuda K., Shimada M. Developments in viral vector-based vaccines. Vaccines. 2014; 2(3): 624–41. https://doi.org/10.1016/j.vaccine.2013.05.091
- Chen Z., Zhang L., Qin C., Ba L., Yi C.E., Zhang F., et al. Recombinant modified vaccinia virus Ankara expressing the spike glycoprotein of severe acute respiratory syndrome coronavirus induces protective neutralizing antibodies primarily targeting the receptor binding region. J. Virol. 2005; 79(5): 2678–88. https://doi.org/10.1128/JVI.79.5.2678-2688.2005
- Gönczöl E., Berensci K., Pincus S., Endresz V., Méric C., Paoletti E., et al. Preclinical evaluation of an ALVAC (canarypox) – human cytomegalovirus glycoprotein B vaccine candidate. Vaccine. 1995; 13(12): 1080–5. https://doi.org/10.1016/0264-410x(95)00048-6
- Naberezhnaya E.R., Soboleva A.V., Vorobyev P.O., Vadekhina V.V., Yusubalieva G.M., Isaeva I.V., et al. Interferon type I-expressing recombinant vaccinia virus as a platform for selective immunotherapy of glioblastoma and melanoma. Bulletin of Russian State Medical University. 2024; (6): 18–26. https://doi.org/10.24075/brsmu.2024.072 https://elibrary.ru/rgazed
- Кулигина Е.В., Рихтер В.А., Власов В.В. Противоопухолевый препарат на основе генно-модифицированного вируса осповакцины VV-GMCSF-LACT. Вестник Российской академии наук. 2023; 93(3): 855–64. https://doi.org/10.31857/S0869587323090098 https://elibrary.ru/ugrbdm
- Open multi-cohort study of the first phase of safety of a drug based on double recombinant vaccinia virus VV-GMCSF-Lact; 2025. Available at: https://clinicaltrials.gov/study/NCT05376527?%20cond=cancer&intr=lactaptin&rank=1
- Шакиба Я., Набережная Е.Р., Кочетков Д.В., Юсубалиева Г.М., Воробьев П.О., Чумаков П.М. и др. Сравнение онколитической активности рекомбинантных штаммов вируса осповакцины LIVP-RFP и MVA-RFP в отношении солидных опухолей. Вестник Российского государственного медицинского университета. 2023; (2): 4–12. https://doi.org/10.24075/vrgmu.2023.010
- Su D., Han L., Shi C., Li Y., Qian S., Feng Z., et al. An updated review of HSV-1 infection-associated diseases and treatment, vaccine development, and vector therapy application. Virulence. 2024; 15(1): 2425744. https://doi.org/10.1080/21505594.2024.2425744
- Ingusci S., Goins W.F., Cohen J.B., Miyagawa Y., Knipe D.M., Glorioso J.C. Next-generation replication-defective HSV vectors for delivery of large DNA payloads. Mol. Ther. 2025; 33(5): 2205–16. https://doi.org/10.1016/j.ymthe.2025.03.055
- Калиберденко В.Б., Арамян Э.Э., Зинченко М.С. Особенности онколитической виротерапии и ее применение для лечения глиобластомы. Клинический разбор в общей медицине. 2024; 5(12): 51–4. https://doi.org/10.47407/kr2024.5.12.00537
- Губанова Н.В., Гайтан А.С., Разумов И.А., Мордвинов В.А., Кривошапкин А.Л., Нетесов С.В. и др. Онколитические вирусы в терапии глиом. Молекулярная биология. 2012; 46(6): 874–86. https://elibrary.ru/pfeyjr
- Senzer N.N., Kaufman H.L., Amatruda T., Nemunaitis M., Reid T., Daniels G., et al. Phase II Clinical trial of a granulocyte-macrophage colony-stimulating factor – encoding, second-generation oncolytic herpesvirus in patients with unresectable metastatic melanoma. JCO. 2009; 27(34): 5763–71. https://doi.org/10.1200/JCO.2009.24.367
- Guide S.V., Gonzalez M.E., Bağcı I.S., Agostini B., Chen H., Feeney G., et al. Trial of Beremagene Geperpavec (B-VEC) for dystrophic epidermolysis bullosa. N. Engl. J. Med. 2022; 387(24): 2211–9. https://doi.org/10.1056/NEJMoa2206663
- Ollmann Saphire E. A vaccine against Ebola Virus. Cell. 2020; 181(1): 6. https://doi.org/10.1016/j.cell.2020.03.011
- Munis A.M., Bentley E.M., Takeuchi Y. A tool with many applications: vesicular stomatitis virus in research and medicine. Expert Opin. Biol. Ther. 2020; 20(10): 1187–201. https://doi.org/10.1080/14712598.2020.1787981
- Mire C.E., Geisbert J.B., Agans K.N., Satterfield B.A., Versteeg K.M., Fritz E.A., et al. Durability of a vesicular stomatitis virus-based Marburg virus vaccine in nonhuman primates. PLoS One. 2014; 9(4): e94355. https://doi.org/10.1371/journal.pone.0094355
- Stein D.R., Warner B.M., Soule G., Tierney K., Frost K.L., Booth S., et al. A recombinant vesicular stomatitis-based Lassa fever vaccine elicits rapid and long-term protection from lethal Lassa virus infection in guinea pigs. NPJ Vaccines. 2019; 4: 8. https://doi.org/10.1038/s41541-019-0104-x
- Hamilton A.M., Foster P.J., Ronald J.A. Evaluating nonintegrating lentiviruses as safe vectors for noninvasive reporter-based molecular imaging of multipotent mesenchymal stem cells. Hum. Gene Ther. 2018; 29(10): 1213–25. https://doi.org/10.1089/hum.2018.111
- Dong W., Kantor B. Lentiviral vectors for delivery of gene-editing systems based on CRISPR/Cas: current state and perspectives. Viruses. 2021; 13(7): 1288. https://doi.org/10.3390/v13071288
- Apolonia L. The old and the new: prospects for non-integrating lentiviral vector technology. Viruses. 2020; 12(10): 1103. https://doi.org/10.3390/v12101103
- Negri D.R.M., Rossi A., Blasi M., Michelini Z., Leone P., Chiantore M.V., et al. Simian immunodeficiency virus-Vpx for improving integrase defective lentiviral vector-based vaccines. Retrovirology. 2012; 9: 69. https://doi.org/10.1186/1742-4690-9-69
- Gallinaro A., Borghi M., Bona R., Grasso F., Calzoletti L., Palladino L., et al. Integrase defective lentiviral vector as a vaccine platform for delivering influenza antigens. Front. Immunol. 2018; 9: 171. https://doi.org/10.3389/fimmu.2018.00171
- Fontana J.M., Christos P.J., Michelini Z., Negri D., Cara A., Salvatore M. Mucosal immunization with integrase-defective lentiviral vectors protects against influenza virus challenge in mice. PLoS One. 2014; 9(5): e97270. https://doi.org/10.1371/journal.pone.0097270
- Chen Z. Parainfluenza virus 5-vectored vaccines against human and animal infectious diseases. Rev. Med. Virol. 2018; 28(2): e1965. https://doi.org/10.1002/rmv.1965
- An D., Li K., Rowe D.K., Diaz M.C.H., Griffin E.F., Beavis A.C., et al. Protection of K18-hACE2 mice and ferrets against SARS-CoV-2 challenge by a single-dose mucosal immunization with a parainfluenza virus 5-based COVID-19 vaccine. Sci. Adv. 2021; 7(27): eabi5246. https://doi.org/10.1016/j.isci.2021.103379
- Liang B., Ngwuta J.O., Herbert R., Swerczek J., Dorward D.W., Amaro-Carambot E., et al. Packaging and prefusion stabilization separately and additively increase the quantity and quality of Respiratory Syncytial Virus (RSV)-neutralizing antibodies induced by an RSV fusion protein expressed by a parainfluenza virus vector. J. Virol. 2016; 90(21): 10022–38. https://doi.org/10.1128/JVI.01196-16
- Lingemann M., Liu X., Surman S., Liang B., Herbert R., Hackenberg A.D., et al. Attenuated human parainfluenza virus type 1 expressing Ebola virus glycoprotein GP administered intranasally is immunogenic in African green monkeys. J. Virol. 2017; 91(10): e02469-16. https://doi.org/10.1128/JVI.02469-16
- Brandler S., Tangy F. Recombinant vector derived from live attenuated measles virus: potential for flavivirus vaccines. Comp. Immunol. Microbiol. Infect. Dis. 2008; 31(2-3): 271–91. https://doi.org/10.1016/j.cimid.2007.07.012
- Ebenig A., Lange M.V., Mühlebach M.D. Versatility of live-attenuated measles viruses as platform technology for recombinant vaccines. NPJ Vaccines. 2022; 7(1): 119. https://doi.org/10.1038/s41541-022-00543-4
- Desprès P., Combredet C., Frenkiel M.P., Lorin C., Brahic M., Tangy F. Live measles vaccine expressing the secreted form of the West Nile virus envelope glycoprotein protects against West Nile virus encephalitis. J. Infect. Dis. 2005; 191(2): 207–14. https://doi.org/10.1086/426824
- Rossi S.L., Comer J.E., Wang E., Azar S.R., Lawrence W.S., Plante J.A., et al. Immunogenicity and efficacy of a measles virus-vectored chikungunya vaccine in nonhuman primates. J. Infect. Dis. 2019; 220(5): 735–42. https://doi.org/10.1093/infdis/jiz202
- Nürnberger C., Bodmer B.S., Fiedler A.H., Gabriel G., Mühlebach M.D. A measles virus-based vaccine candidate mediates protection against Zika virus in an allogeneic mouse pregnancy model. J. Virol. 2019; 93(3): e01485-18. https://doi.org/10.1128/JVI.01485-18
- Fournier P., Arnold A., Wilden H., Schirrmacher V. Newcastle disease virus induces pro-inflammatory conditions and type I interferon for counter-acting Treg activity. Int. J. Oncol. 2012; 40(3): 840–50. https://doi.org/10.3892/ijo.2011.1265
- Kim S.H., Samal S. Newcastle disease virus as a vaccine vector for development of human and veterinary vaccines. Viruses. 2016; 8(7): 183. https://doi.org/10.3390/v8070183
- Kuiken T., Buijs P., Van Run P., Van Amerongen G., Koopmans M., Van Den Hoogen B. Pigeon paramyxovirus type 1 from a fatal human case induces pneumonia in experimentally infected cynomolgus macaques (Macaca fascicularis). Vet. Res. 2017; 48(1): 80. https://doi.org/10.1186/s13567-017-0486-6
- Sun W., Liu Y., Amanat F., González-Domínguez I., McCroskery S., Slamanig S., et al. A Newcastle disease virus expressing a stabilized spike protein of SARS-CoV-2 induces protective immune responses. Nat. Commun. 2021; 12(1): 6197. https://doi.org/10.1038/s41467-021-26499-y
- DiNapoli J.M., Yang L., Samal S.K., Murphy B.R., Collins P.L., Bukreyev A. Respiratory tract immunization of non-human primates with a Newcastle disease virus-vectored vaccine candidate against Ebola virus elicits a neutralizing antibody response. Vaccine. 2010; 29(1): 17–25. https://doi.org/10.1016/j.vaccine.2010.10.024
- Gonçalves M.A. Adeno-associated virus: from defective virus to effective vector. Virol. J. 2005; 2(1): 43. https://doi.org/10.1186/1743-422X-2-43
- Somia N., Verma I.M. Gene therapy: trials and tribulations. Nat. Rev. Genet. 2000; 1(2): 91–9. https://doi.org/10.1038/35038533
- Schubert M., Harmison G.G., Meier E. Primary structure of the vesicular stomatitis virus polymerase (L) gene: evidence for a high frequency of mutations. J. Virol. 1984; 51(2): 505–14. https://doi.org/10.1128/JVI.51.2.505-514.1984
- An H.Y., Kim G.N., Wu K., Kang C.Y. Genetically modified VSVNJ vector is capable of accommodating a large foreign gene insert and allows high level gene expression. Virus Res. 2013; 171(1): 168–77. https://doi.org/10.1016/j.virusres.2012.11.007
- Kalidasan V., Ng W.H., Ishola O.A., Ravichantar N., Tan J.J., Das K.T. A guide in lentiviral vector production for hard-to-transfect cells, using cardiac-derived c-kit expressing cells as a model system. Sci. Rep. 2021; 11(1): 19265. https://doi.org/10.1038/s41598-021-98657-7
- Jenkins G.M., Pagel M., Gould E.A., de A Zanotto P.M., Holmes E.C. Evolution of base composition and codon usage bias in the genus Flavivirus. J. Mol. Evol. 2001; 52: 383. https://doi.org/10.1007/s002390010168
- Duffy S., Shackelton L.A., Holmes E.C. Rates of evolutionary change in viruses: patterns and determinants. Nat. Rev. Genet. 2008; 9: 267. https://doi.org/10.1038/nrg2323
Дополнительные файлы