Ультраструктурная организация и репродукция вирионов в клетках линии Vero (E6) в условиях моноинфицирования вирусом гриппа A/H1N1 pmd09 и коинфицирования в сочетании с SARS-CoV-2 (штаммы Delta и Omicron)
- Авторы: Емцова К.Ф.1, Спиридонова Е.В.1, Омигов В.В.1, Моисеева А.А.1, Даниленко Е.И.1, Таранов О.С.1
-
Учреждения:
- ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
- Выпуск: Том 70, № 3 (2025)
- Страницы: 246-253
- Раздел: ОРИГИНАЛЬНЫЕ ИССЛЕДОВАНИЯ
- URL: https://virusjour.crie.ru/jour/article/view/16738
- DOI: https://doi.org/10.36233/0507-4088-308
- EDN: https://elibrary.ru/HBLZSL
- ID: 16738
Цитировать
Полный текст
Аннотация
Введение. РНК-содержащие вирусы, в особенности вирусы гриппа, представляют высокую эпидемиологическую значимость. Манифестация COVID-19 привела к регистрации случаев коинфекции, патогенез которой в значительной степени неясен. Линия Vero (E6) широко применяется для исследования морфогенеза различных вирусов, включая грипп и коронавирус.
Цель работы – исследование ультраструктуры клеток линии Vero (E6) и репродукции вирусных частиц при моноинфицировании вирусом гриппа А и коинфицирования этого вируса с двумя геновариантами SARS-CoV-2 в динамике через 6, 18 и 24 ч после инокуляции.
Материалы и методы. Для проведения in vitro исследования воздействия вирусной инфекции и анализа динамики изменения количества внутриклеточных вирусных частиц использовали модель клеточной линии Vero (E6). В исследовании задействовали 4 экспериментальные группы: клетки линии Vero (E6), моноинфицированные вирусом гриппа штамма A/H1N1 pmd09 в дозовой нагрузке 0,1 MOI; клетки линии Vero (E6), коинфицированные вирусом гриппа штамма A/H1N1 pmd09 в сочетании со штаммом Delta SARS-CoV-2 в суммарной дозовой нагрузке 0,1 MOI; клетки линии Vero (E6), коинфицированные вирусом гриппа штамма A/H1N1 pmd09 в сочетании со штаммом Omicron SARS-CoV-2 в суммарной дозовой нагрузке 0,1 MOI. В каждой исследуемой группе осуществляли отбор клеток на временны́х точках 6, 18 и 24 ч.
Результаты. Во всех группах спустя 6 ч патологических структур, помимо вируссодержащих транспортных везикул, не выявлено. Через 18 ч была отмечена вакуолизация эндоплазматического ретикулума, в разной степени характерная для всех исследуемых групп. Спустя 24 ч во всех группах ультраструктурные изменения встречались сравнительно чаще относительно этапов 6 и 18 ч и выражались в вакуолизации органелл и/или уплотнении цитоплазмы. Статистический анализ динамики количества вирусных частиц внутри групп показал тенденцию на возрастание этого параметра до стадии 24 ч в группе моноинфицирования. Однако ни одна из групп коинфекции не демонстрировала тенденции на изменение количества вирусных частиц, поскольку статистически значимых различий между стадиями 6, 18 и 24 ч выявлено не было.
Заключение. Полученные результаты позволили выдвинуть предположение о том, что взаимодействие вирусов гриппа A/H1N1 pmd09 и SARS-CoV-2 способствовало общему снижению образования новых вирионов в клетках линии Vero (E6) в обоих случаях коинфицирования.
Ключевые слова
Полный текст
Введение
За последние 15 лет наблюдалось несколько сезонных эпидемий гриппа A/H1N1 и пандемия новой коронавирусной инфекции (COVID-19) [1, 2]. Вспышка коронавирусной инфекции привела к появлению множества геновариантов, среди которых варианты Delta вируса SARS-CoV-2 имели высокую патогенность в разгар пандемии [3]. В свою очередь, варианты Omicron-штамма (в частности, линия XBB.1.5) преобладали и продолжали циркулировать в популяции людей на момент 2024 г. [4]. Манифестация и всемирное распространение инфекции COVID-19 происходили на фоне продолжавшихся сезонных эпидемий гриппа. Столь сложная эпидемиологическая ситуация привела к выявлению клинических случаев коинфицирования этими респираторными вирусами [5].
Случаи коинфекции вируса гриппа A и SARS-CoV-2 выявляются нечасто, что, с одной стороны, может быть связано с недостаточным уровнем эффективности методов диагностики [6]. С другой стороны, это может объясняться потенциальными конкурентными взаимоотношениями между вирусами [7, 8]. Патогенез коинфекции коронавируса SARS-CoV-2 и вируса гриппа A/H1N1 pmd09 в значительной степени неясен. В том числе мало изучены патологические изменения на уровне ультраструктуры, а также особенности репродукции обоих вирусов в условиях коинфицирования. Среди моделей для исследования инфекций коронавируса и гриппа оптимальной с практической точки зрения является клеточная линия Vero (E6). Клетки линии Vero восприимчивы как к коронавирусной инфекции, так и к гриппу, при этом на них были продемонстрированы выраженные цитопатические изменения [9–11]. Применяя метод трансмиссионной электронной микроскопии в совокупности с программным обеспечением, возможно оптимизировать получение данных для последующего анализа.
Цель работы – исследование ультраструктуры клеток линии Vero (E6) и репродукции вирусных частиц при моноинфицировании вирусом гриппа А и коинфицирования этого вируса с двумя геновариантами SARS-CoV-2 в динамике через 6, 18 и 24 ч после инокуляции.
Материалы и методы
Вирусы. В исследовании задействовали один изолят вируса гриппа H1N1 A/California/07/2009 и два изолята коронавируса SARS-CoV-2: hCoV-19/Russia/KHM-SRC-8583/2023 (штамм Omicron, вариант XBB.1.5) и hCoV-19/Russia/Godara-delta-2804/2021 (штамм Delta). Суспензии A/H1N1 pmd09 и Omicron SARS-CoV-2 были переданы сотрудниками отдела «Зоонозных инфекций и гриппа»; штамм Delta SARS-CoV-2 был предоставлен отделом «Коллекции микроорганизмов» ФБУН ГНЦ ВБ «Вектор».
Клеточные культуры. В качестве модели задействовали клеточную линию Vero (E6), любезно предоставленную отделом «Коллекции микроорганизмов» ФБУН ГНЦ ВБ «Вектор». Клеточный монослой наращивали в 6-луночных планшетах на среде DMEM («Аламед», Россия). К среде добавили 10% FBS (Fetal bovinerum, фетальная бычья сыворотка) (HyClone, США), амфотерицин В (0,25 мкг/мл), стрептомицин (100 мкг/мл) и пенициллин (100 МЕ/мл).
Для инициации инфекционного процесса к клеткам добавляли 0,2 мл вируссодержащей среды (в дозовой нагрузке 0,1 MOI). Лунки промывали 2 мл среды DMEM, содержащей антибиотики, затем добавляли среду, содержащую антибиотики и 2% FBS. Клетки инкубировали 2 сут. Передачу материала осуществляли сотрудники отдела «Коллекции микроорганизмов» в соответствии с протоколом биобезопасности – в ходе транспортировки клеточные культуры находились в пробирках, содержащих фиксатор (4% глутаральдегид).
Схема эксперимента. В исследовании задействовали следующие экспериментальные группы:
- Клетки линии Vero (E6), моноинфицированные вирусом гриппа штамма A/H1N1 pmd09 в дозовой нагрузке 0,1 MOI.
- Клетки линии Vero (E6), коинфицированные вирусом гриппа штамма A/H1N1 pmd09 в сочетании со штаммом Delta SARS-CoV-2 в суммарной дозовой нагрузке 0,1 MOI.
- Клетки линии Vero (E6), коинфицированные вирусом гриппа штамма A/H1N1 pmd09 в сочетании со штаммом Omicron SARS-CoV-2 в суммарной дозовой нагрузке 0,1 MOI.
В каждой исследуемой группе осуществляли отбор клеток на временн'ых точках 6, 18 и 24 ч.
Трансмиссионная электронная микроскопия. Ультратонкие срезы контрастировали по Рейнольдсу и исследовали с помощью трансмиссионного электронного микроскопа модели JEM-1400 (JEOL, Япония) при ускоряющем напряжении катода, равном 80 кВ. Получение и анализ изображений выполняли с использованием цифровой камеры Veleta (Olympus, Япония) и программного обеспечения iTEM (Olympus, Япония).
Статистическая обработка. Для анализа полученных количественных данных задействовали программное обеспечение Excel 2019 (Microsoft, США). Проверку экспериментальных выборок на соответствие распределения нормальному осуществляли, применив критерий Колмогорова–Смирнова. Дальнейшее попарное сравнение и расчет p-значений проводили с помощью критерия Манна–Уитни. С учетом поправки Шидака, различия между выборками считали достоверными при условии p < 0,0169. Все значения уровня значимости ниже пороговых отображены на графиках.
Результаты
Моноифицирование вирусом A/H1N1 pmd09 через 6, 18 и 24 ч
На первой временнóй точке (6 ч с момента инокуляции) в части образцов было отмечено присутствие крупных вакуолей в клетках, которые в большинстве случаев являлись следствием вакуолизации профилей эндоплазматического ретикулума (ЭПР) (рис. 1 А). Вирусные частицы были выявлены в состоянии адгезии с плазмолеммой или везикулярной мембраной (рис. 1 Б, В). По прошествии 18 ч наравне с вакуолизацией элементов комплекса Гольджи и ЭПР некоторые клетки имели уплотненную гиалоплазму. Примечательно, что ядра отдельных клеток имели инвагинации ядерных мембран (рис. 1 Г). В отличие от стадии 6 ч, вирусные частицы A/H1N1 pmd09 были выявлены непосредственно в цитоплазме клеток (рис. 1 Д). Образцы клеток, полученных спустя 24 ч, демонстрировали ультраструктурные изменения, схожие с таковыми на стадии 18 ч, – вирусные частицы были локализованы в гиалоплазме, которая, в свою очередь, была заметно высветлена (рис. 1 Е). Кариоплазма части ядер также была светлее относительно гиалоплазмы (рис. 1 Ж), а ядерные мембраны местами образовывали области инвагинации. В целом стадия 24 ч характеризовалась более выраженными внутриклеточными деструктивными изменениями относительно групп 6 и 18 ч.
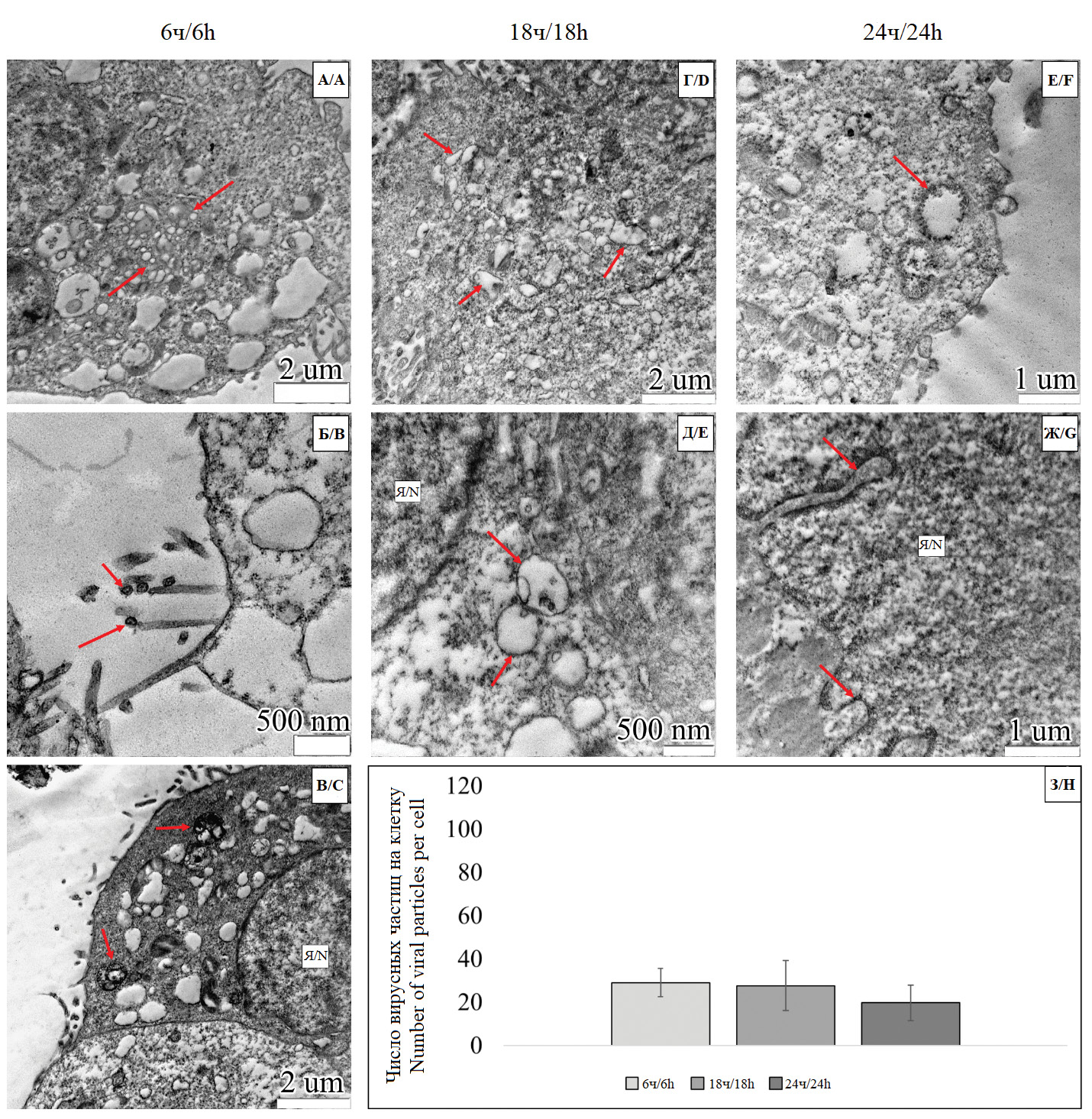
Рис. 1. Динамика ультраструктурных изменений в клетках Vero (E6) при моноинфекции штамма вируса гриппа A/H1N1 pmd09.
Электронограммы А, Б и В соответствуют стадии 6 ч, Г и Д – стадии 18 ч, Е и Ж – стадии 24 ч.
А – участок цитоплазмы клетки с оптически светлыми зонами, представляющими собой профили ЭПР с признаками вакуолизации (стрелки). Масштаб 1 мкм; Б – участок цитоплазмы клетки с вируссодержащими транспортными везикулами (стрелки). Масштаб 500 нм; В – участок цитоплазмы клетки с вакуолизированными полостями ЭПР (стрелки). Множественные вирусные частицы в состоянии адгезии локализованы вдоль плазмолеммы. Масштаб 2 мкм; Г – участок цитоплазмы клетки с везикулами (V) и ядром (N) с признаками инвагинации ядерных мембран (стрелка). Масштаб 1 мкм; Д – участок цитоплазмы клетки, содержащей вирусные частицы A/H1N1 pmd09 (стрелки). Масштаб 500 нм; Е – участок клетки, имеющей резко просветленную гиалоплазму, большое количество мембранных структур и свободные вирусные частицы (стрелки). Масштаб 1 мкм; Ж – фрагмент цитоплазмы клетки с ядром (N). Кариоплазма высветлена относительно гиалоплазмы. Масштаб 1 мкм; З – график типа «Bar-plot», отражающий динамику изменения количества вирусных частиц на клетку на этапах 6, 18 и 24 ч.
Fig. 1. Dynamics of ultrastructural changes in Vero (E6) cells in influenza A/H1N1 pmd09 virus monoinfection.
Electron diffraction patterns А, B, and C correspond to the 6h stage, D and E to the 18h stage, and F and G to the 24h stage.
А – a section of the cell cytoplasm with optically empty zones representing ER cell profiles with focal vacuolization (arrows). Scale bar is 1 μm; B – a section of the cell cytoplasm with virus-containing transport vesicles (arrows). Scale bar is 500 nm; C – a section of the cell cytoplasm with vacuolated ER cavities (arrows). Multiple adherent viral particles are localized along the plasma membrane. Scale bar is 2 μm; D – a section of the cell cytoplasm with vesicles (V) and a nucleus (N) with signs of invagination of the nuclear membranes (arrow). Electron diffraction pattern. Scale bar is 1 μm; E – a section of the cell cytoplasm containing A/H1N1 pmd09 viral particles (arrows). Scale bar is 500 nm; F – a section of a cell with sharply cleared hyaloplasm, a large number of membrane structures and free viral particles (arrows). Scale bar is 1 μm; G – a fragment of the cell cytoplasm with a nucleus (N). The karyoplasm is cleared relative to the hyaloplasm. Scale bar is 1 μm; H – a «Bar-plot» graph reflecting the dynamics of changes in the number of viral particles per cell at stages 6, 18 and 24 h.
При проведении статистического анализа количества вирусных частиц на клетку в группе моноинфекции вируса гриппа A был отмечен рост этого параметра на этапе 18 ч. В свою очередь, количество вирусных частиц на этапе 24 ч было также статистически значимо больше, относительно группы 6 ч (в обоих случаях p = 0,009). При этом группы 18 и 24 ч не имели статистически значимых различий (рис. 1 З).
Коинфицирование вирусами Delta SARS-CoV-2 и A/H1N1 pmd09
После отбора клеток спустя 6 ч были визуализированы структурные изменения, схожие с полученными в группе моноинфекции на аналогичной стадии, – вакуолизация цитоплазмы, обусловленная расширением профилей ЭПР (рис. 2 А). Вирусные частицы были выявлены в межклеточном пространстве и находились в состоянии адгезии с плазмалеммой (рис. 2 Б). Отдельно взятые клетки имели уплотненную цитоплазму, которая содержала везикулы с электронно-плотным мелкозернистым веществом (рис. 2 В). Через 18 ч после инокуляции, подобно предыдущей стадии, у большинства клеток была отмечена вакуолизация профилей синтетического аппарата (рис. 2 Г). Однако, в отличие от предыдущей стадии, в межклеточном пространстве вирусные частицы встречались значительно реже и в основном были локализованы вдоль внутренней стороны везикулярной мембраны (рис. 2 Д). По прошествии 24 ч, подобно стадии 18 ч, вирусные частицы были обнаружены в составе транспортных везикул (рис. 2 Е). У части ядер двойная мембрана образовывала инвагианции (рис. 2 Ж), примечательно, что подобные изменения встречались также в группе моноинфицирования вирусом гриппа А.
Рис. 2. Динамика ультраструктурных изменений в клетках Vero (E6) при коинфекции штамма вируса гриппа A/H1N1 pmd09 и штамма Delta SARS-CoV-2.
Электронограммы А, Б и В соответствуют стадии 6 ч, Г и Д – стадии 18 ч, Е и Ж – стадии 24 ч.
А – участок цитоплазмы клетки, демонстрирующий высокую синтетическую активность: видны множественные просветы аппарата Гольджи и грЭПР (стрелки), местами с признаками вакуолизации. Масштаб 2 мкм; Б – фрагмент мембраны с микроворсинками и вирусными частицами в состоянии адгезии (стрелки). Масштаб 500 нм; В – участки двух соседних клеток. Клетка в верхней половине электронограммы имеет сравнительно более плотную гиалоплазму, в которой локализованы везикулы, содержащие электронно-плотное вещество (стрелка). Я – ядро. Масштаб 2 мкм; Г – участок цитоплазмы клетки с высокой синтетической активностью, выраженной в вакуолизации профилей ЭПР (стрелки). Масштаб 2 мкм; Д – участок гиалоплазмы клетки, с вируссодержащими транспортными везикулами (стрелки) вблизи ядра (N). Масштаб 500 нм; Е – фрагмент цитоплазмы клетки с вирусными частицами, локализованными вдоль внутренней стороны везикулярной мембраны (стрелка). Масштаб 1 мкм; Ж – участок клеточного ядра (N) с признаками инвагинации ядерных мембран (стрелка). Масштаб 1 мкм; З – график типа «Bar-plot», отражающий динамику изменения количества вирусных частиц на клетку на этапах 6, 18 и 24 ч.
Fig. 2. Dynamics of ultrastructural changes in Vero (E6) cells coinfected with the A/H1N1 pmd09 influenza virus and the Delta strain of SARS-CoV-2.
Electron diffraction patterns А, B, and C correspond to the 6-h stage, D and E to the 18-h stage, and F and G to the 24-h stage.
А – a cell region demonstrating high synthetic activity: multiple lumens of the Golgi apparatus and rER (arrows) are visible, with signs of vacuolization in places. Scale bar is 2 μm; B – fragments of the membrane with microvilli and viral particles in the adhesion state (arrows). Scale bar is 500 nm; C – sections of two preserved cells. The cell in the upper part of the electronogram has a comparatively denser hyaloplasm, in which vesicles containing electron-dense substance are localized (arrow). N – nucleus. Scale bar is 2 μm; D – a section of the cell cytoplasm with high synthetic activity, expressed in vacuolization of the ER profiles (arrows). Scale bar is 2 μm; E – a section of the cell hyaloplasm with virus-containing transport vesicles (arrows) near the nucleus (N). Scale bar is 500 nm; F – a fragment of the cell cytoplasm with viral particles localized along the periphery of the vesicular membrane (arrow). Scale bar is 1 μm; G – a section of the cell nucleus (N) with signs of invagination of the nuclear membranes (arrow). Scale bar is 1 μm; H – a «Bar-plot» graph reflecting the dynamics of changes in the number of viral particles per cell at stages 6, 18 and 24 h.
Количество вирусных частиц на клетку оставалось неизменным в течение всех трех сроков (рис. 2 З).
Коинфицирование вирусами Omicron SARS-CoV-2 и A/H1N1 pmd09
Спустя 6 ч в цитоплазме клеток линии Vero (E6) было обнаружено большое количество везикул. Как и в случае предыдущих двух групп, в основном они представляли собой вакуолизированные полости синтетического аппарата клетки (рис. 3 А). Через 18 ч после введения вируссодержащей суспензии в культуральную среду в цитоплазме клеток Vero были обнаружены вирусные частицы, а также везикулы с зернистым содержимым. Часть везикул была локализована вблизи аппарата Гольджи и, в отличие от группы 6 ч, эти везикулы были двухмембранными (рис. 3 Б). Через 24 ч после инокуляции некоторые клетки имели признаки деструкции, выраженные в уплотнении хроматина и цитоплазмы (рис. 3 В). Цитопатические изменения в остальных клетках значительно не отличались от таковых у предыдущей группы и характеризовались вакуолизацией ЭПР и комплекса Гольджи и присутствием в цитоплазме транспортных вируссодержащих везикул.
Рис. 3. Динамика ультраструктурных изменений в клетках Vero (E6) при коинфекции штамма вируса гриппа A/H1N1 pmd09 и штамма Omicron SARS-CoV-2.
Электронограмма А соответствует стадии 6 ч, Б – стадии 18 ч, В – стадии 24 ч.
А – участок цитоплазмы клетки с органоидами в состоянии вакуолизации (стрелки). Масштаб 500 нм; Б – участок гиалоплазмы клетки с профилями комплекса Гольджи (GC), часть которых имеет двойную мембрану (сплошные стрелки), и везикулами вблизи него (V); свободные вирусные частицы локализованы в гиалоплазме (пунктирные стрелки). Масштаб 500 нм; В – клетка в состоянии деструкции, обзорная электронограмма. Гиалоплазма (H) имеет повышенную плотность. Ядро (N) содержит ядрышко (Ns), хроматин уплотнен. Масштаб 1 мкм; Г – график типа «Bar-plot», отражающий динамику изменения количества вирусных частиц на клетку на этапах 6, 18 и 24 ч.
Fig. 3. Dynamics of ultrastructural changes in Vero (E6) cells coinfected with the A/H1N1 pmd09 influenza virus and the Omicron strain of SARS-CoV-2.
Electron diffraction pattern A corresponds to the 6-h stage, B – to the 18-h stage, and C – to the 24-h stage.
А – a section of the cell cytoplasm with organelles in a state of vacuolation (arrows). Scale bar is 500 nm; В – a section of the cell hyaloplasm with profiles of the Golgi complex (GC), some of which have a double membrane (solid arrows) and vesicles near to it (V); free viral particles are localized in the hyaloplasm (dashed arrows). Scale bar is 500 nm; C – a general electronogram of a cell in a state of destruction. The hyaloplasm (H) has an increased density. The nucleus (N) contains a nucleolus (Ns), the chromatin is compacted. Scale bar is 1 μm; D – a «Bar-plot» graph reflecting the dynamics of changes in the number of viral particles per cell at stages 6, 18 and 24 h.
Количество вирусных частиц на клетку на всех этапах исследования статистически значимо не изменялось (рис. 3 Г). Аналогичная динамика также прослеживалась для группы коинфицирования Delta SARS-CoV-2 и A/H1N1 pmd09.
Обсуждение
В соответствии с полученными результатами, для экспериментальных групп была выявлена следующая динамика: с увеличением прошедшего с момента инокуляции времени отмечено повышение разнообразия и усиление выраженности ультраструктурных изменений, таких как присутствие в цитоплазме транспортных вируссодержащих везикул, инвагинации ядерных мембран, вакуолизация полостей синтетического аппарата клеток, резкое изменение плотности цитоплазмы (в сторону уплотнения или, напротив, высветления). Эти цитопатические изменения напрямую связаны со взаимодействием вирусов и клеточных систем, поскольку структурная реорганизация органелл играет критическую роль для обеспечения внутриклеточного транспорта вирусных частиц и создания условий для реализации вирусных репликативных процессов. В совокупности эти процессы способствуют наработке внутриклеточных вирусных частиц, которые впоследствии высвобождаются путем экзоцитоза [12].
На этапе 6 ч характерным для всех исследуемых групп признаком было формирование транспортных вируссодержащих везикул. При этом вирусные частицы были локализованы по периферии плазмолеммы в состоянии адгезии, на стадии инкорпорации в цитоплазму или в составе транспортных везикул. Ранние исследования продемонстрировали схожие результаты [9, 13]. Примечательно, что в образцах группы коинфицирования A/H1N1 pmd09 и штамма Omicron SARS-CoV-2 были обнаружены двухмембранные везикулы – структуры, характерные для жизненного цикла SARS-CoV-2, но не вирусов гриппа [14]. Спустя 18 ч после инокуляции вакуолизация профилей комплекса Гольджи и ЭПР встречалась в образцах всех групп инфицирования и имела разную степень выраженности.
Вируссодержащие транспортные везикулы были отмечены в случаях группы моноинфицирования A/H1N1 pmd09 и группы коинфицирования A/H1N1 pmd09 в сочетании со штаммом Delta коронавируса. Во втором варианте коинфицирования (со штаммом Omicron) вирусные частицы были обнаружены в гиалоплазме клеток. Примечательно, что в образцах группы моноинфицирования A/H1N1 pmd09 у части ядер было отмечено уплотнение хроматина, а ядерные мембраны образовывали инвагинации. Структурные изменения, затрагивающие ядро, могут быть ассоциированы с процессами жизненного цикла вируса гриппа, такими как репликация и транскрипция вирусного генома [13, 15].
На этапе 24 ч, подобно стадии 18 ч, вирусные частицы были локализованы преимущественно в транспортных везикулах, что было характерно для всех экспериментальных групп. На этой стадии структурные цитопатические изменения выявлялись сравнительно чаще, чем в предыдущих временных точках, и имели выраженный характер. Отмечено изменение плотности гиалоплазмы (как в сторону уплотнения, так и в сторону высветления) наравне с вакуолизацией органоидов. Эти наблюдения согласуются с результатами ранних исследований, в которых было показано, что такой временной интервал является достаточным для усиления структурных цитопатических изменений [9]. Также стоит отметить, что признаки инвагинации ядерных мембран на этом этапе встречались не только в образцах клеток, моноинфицированных A/H1N1 pmd09, но и в образцах группы коинфекции A/H1N1 pmd09 и Delta-штамма SARS-CoV-2.
Таким образом, при исследовании на модели клеточной линии Vero (E6) при условии равной вирусной нагрузки, составляющей 0,1 MOI, группы моно- и коинфицирования не имели значительных различий по степени интенсивности цитопатических изменений в клетках. Однако на уровне ультраструктурной организации была обнаружена особенность – инвагинация ядерных мембран, характерная для образцов группы моноинфекции A/H1N1 pmd09 и коинфекции в сочетании с Delta SARS-CoV-2. Примечательно, что этот признак в случае коинфицирования был обнаружен лишь на стадии 24 ч. Выявление специфических для вируса гриппа ультраструктурных изменений на поздней стадии гипотетически, может являться следствием конкуренции с коронавирусом за ресурсы клеточных систем.
Заключение
В работе было выполнено ультраструктурное исследование клеток линии Vero (E6), подверженных моноинфекции вируса гриппа A/H1N1 pmd09 и двум вариантам коинфекции – в сочетании со штаммами Omicron или Delta SARS-CoV-2. Также была исследована динамика внутриклеточных структурных изменений на этапах 6, 18 и 24 ч после инокуляции.
Статистический анализ данных по признаку количества вирусных частиц на клетку позволил установить, статистически значимые различия в группе моноинфицирования вирусом гриппа между стадиями 6 и 18 ч, а также 6 и 24 ч (p = 0,009 в обоих случаях). Таким образом, в группе моноинфицирования прослеживалась динамика на возрастание количества вирусных частиц до стадии 24 ч. Однако ни одна из групп коинфекции не демонстрировала тенденции на изменение количества вирусных частиц, поскольку статистически значимых различий между стадиями 6, 18 и 24 ч выявлено не было.
Такие различия между группами ко- и моноинфекции позволяют выдвинуть предположение о том, что на модели клеточной линии Vero (E6) инфекция вируса гриппа A/H1N1 pmd09 совместно со штаммами коронавируса Delta или Omicron опосредует нарушения в синтетических процессах, которые играют критическую роль для сборки новых вирусных частиц или репликации вирусного генома. Вероятно, это связано с конкуренцией этих вирусов за ресурсы клеточных систем, в особенности синтетический аппарат.
Об авторах
Ксения Федоровна Емцова
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: k.emtsova@g.nsu.ru
ORCID iD: 0009-0003-5165-5357
стажер-исследователь отдела микроскопических исследований
Россия, 630559, Новосибирская область, р.п. КольцовоЕкатерина Викторовна Спиридонова
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: spiridonova_ev@vector.nsc.ru
ORCID iD: 0009-0006-8655-6713
стажер-исследователь отдела микроскопических исследований
Россия, 630559, Новосибирская область, р.п. КольцовоВладимир Вилорьевич Омигов
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Автор, ответственный за переписку.
Email: omigov_vv@vector.nsc.ru
ORCID iD: 0000-0002-2028-6099
канд. мед. наук, ведущий научный сотрудник отдела микроскопических исследований
Россия, 630559, Новосибирская область, р.п. КольцовоАнастасия Алексеевна Моисеева
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: moiseeva_aa@vector.nsc.ru
ORCID iD: 0000-0001-7048-2357
младший научный сотрудник отдела зоонозных инфекций и гриппа
Россия, 630559, Новосибирская область, р.п. КольцовоЕлена Игоревна Даниленко
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: danilenko_ev@vector.nsc.ru
ORCID iD: 0009-0007-8106-7037
младший научный сотрудник отдела зоонозных инфекций и гриппа
Россия, 630559, Новосибирская область, р.п. КольцовоОлег Святославович Таранов
ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор)
Email: taranov@vector.nsc.ru
ORCID iD: 0000-0002-6746-8092
начальник отдела микроскопических исследований
Россия, 630559, Новосибирская область, р.п. КольцовоСписок литературы
- Matrosovich M.N., Gambaryan A.S., Teneberg S., Piskarev V.E., Yamnikova S.S., Lvov D.K., et al. Avian influenza A viruses differ from human viruses by recognition of sialyloligosaccharides and gangliosides and by a higher conservation of the HA receptor-binding site. Virology. 1997; 233(1): 224–34. https://doi.org/10.1006/viro.1997.8580
- Wu D., Wu T., Liu Q., Yang Z. The SARS-CoV-2 outbreak: What we know. Int. J. Infect. Dis. 2020; 94: 44–8. https://doi.org/10.1016/j.ijid.2020.03.004
- Saito A., Irie T., Suzuki R., Maemura T., Nasser H., Uriu K., et al. Enhanced fusogenicity and pathogenicity of SARS-CoV-2 Delta P681R mutation. Nature. 2022; 602(7896): 300–6. https://doi.org/10.1038/s41586-021-04266-9
- Muik A., Quandt J., Lui B.G., Bacher M., Lutz S., Grünenthal M., et al. Immunity against conserved epitopes dominates after two consecutive exposures to SARS-CoV-2 Omicron BA.1. Cell Rep. 2024; 43(8): 114567. https://doi.org/10.1016/j.celrep.2024.114567
- Wu X., Cai Y., Huang X., Yu X., Zhao L., Wang F., et al. Coinfection with SARS-CoV-2 and influenza A virus in patient with pneumonia, China. Emerg. Infect. Dis. 2020; 26(6): 1324–6. https://doi.org/10.3201/eid2606.200299
- Yue H., Zhang M., Xing L., Wang K., Rao X., Liu H., et al. The epidemiology and clinical characteristics of co-infection of SARS-CoV-2 and influenza viruses in patients during COVID-19 outbreak. J. Med. Virol. 2020; 92(11): 2870–3. https://doi.org/10.1002/jmv.26163.
- Rezaee D., Bakhtiari S., Jalilian F.A., Doosti-Irani A., Asadi F.T., Ansari N. Coinfection with severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and influenza virus during the COVID-19 pandemic. Arch. Virol. 2023; 168(2): 53. https://doi.org/10.1007/s00705-022-05628-y
- Nowak M.D., Sordillo E.M., Gitman M.R., Paniz Mondolfi A.E. Coinfection in SARS-CoV-2 infected patients: where are influenza virus and rhinovirus/enterovirus? J. Med. Virol. 2020; 92(10): 1699–700. https://doi.org/10.1002/jmv.25953
- Eymieux S., Rouillé Y., Terrier O., Seron K., Blanchard E., Rosa-Calatrava M., et al. Ultrastructural modifications induced by SARS-CoV-2 in Vero cells: a kinetic analysis of viral factory formation, viral particle morphogenesis and virion release. Cell. Mol. Life Sci. 2021; 78(7): 3565–76. https://doi.org/10.1007/s00018-020-03745-y
- Barreto-Vieira D.F., da Silva M.A.N., Garcia C.C., Miranda M.D., Matos A.D.R., Caetano B.C., et al. Morphology and morphogenesis of SARS-CoV-2 in Vero-E6 cells. Mem. Inst. Oswaldo Cruz. 2021; 116: e200443. https://doi.org/10.1590/0074-02760200443
- Chen P.L., Tzeng T.T., Hu A.Y., Wang L.H., Lee M.S. Development and evaluation of vero cell-derived master donor viruses for influenza pandemic preparedness. Vaccines (Basel). 2020; 8(4):626. https://doi.org/10.3390/vaccines8040626
- Cao Y.C., Deng Q.X., Dai S.X. Remdesivir for severe acute respiratory syndrome coronavirus 2 causing COVID-19: an evaluation of the evidence. Travel Med. Infect. Dis. 2020; 35: 101647. https://doi.org/10.1016/j.tmaid.2020.101647
- Ayari A., Rosa-Calatrava M., Lancel S., Barthelemy J., Pizzorno A., Mayeuf-Louchart A., et al. Influenza infection rewires energy metabolism and induces browning features in adipose cells and tissues. Commun. Biol. 2020; 3(1): 237. https://doi.org/10.1038/s42003-020-0965-6
- Barreto-Vieira D.F., da Silva M.A.N., de Almeida A.L.T., Rasinhas A.D.C., Monteiro M.E., Miranda M.D., et al. SARS-CoV-2: ultrastructural characterization of morphogenesis in an in vitro system. Viruses. 2022; 14(2): 201. https://doi.org/10.3390/v14020201
- Martin A.J., Jans D.A. Antivirals that target the host IMPα/β1-virus interface. Biochem. Soc. Trans. 2021; 49(1): 281–95. https://doi.org/10.1042/bst20200568
Дополнительные файлы